Клинический разбор в общей медицине №2 2024
Konstantin O. Mironov3, Sergey L. Babak4, Anastasia D. Strutynskaya2
1 Central Research Institute of Tuberculosis, Moscow, Russia;
2 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia;
3 Central Research Institute of Epidemiology, Moscow, Russia;
4 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia
strutynskaya@yandex.ru
Abstract
Mycobacteriosis is an infectious disease caused by opportunistic non-tuberculous microbacteria in patients with chronic respiratory pathology and decreased immunological reactivity. The number of patients with this pathology is increasing not only in Russia, but throughout the world. Scientists' attention was drawn to the fact that the isolation of non-tuberculous mycobacteria from patient’s sputum samples does not correlate with the incidence of non-tuberculous mycobacteriosis and the need for its treatment. This may be due to the presence of gene polymorphisms that affect the structure and functional characteristics of innate immune factors. The article presents a rare clinical case of non-tuberculous mycobacteriosis caused by Mycobacterium avium in a 50-year-old woman without severe concomitant diseases and secondary immunodeficiency. The genetic study revealed polymorphic gene alleles, which may predispose this patient for the infection and severe course of this disease.
Keywords: non-tuberculous mycobacteriosis, pulmonary disease, immunodeficiency, gene polymorphisms, innate immunity.
For citation: Makariantz N.N., Karnaushkina M.A., Salamaikina S.A., Mironov K.O., Babak S.L., Strutynskaya A.D. Clinical case of progressive pulmonary mycobacteriosis with potential genetic predisposition in a patient with mild bronchial asthma. Clinical analysis in general medicine. 2024; 5 (2): 72–77 (In Russ.). DOI: 10.47407/kr2023.5.2.00391
Увеличилась продолжительность жизни людей, относящихся к группам риска развития НТМ, таких как пациенты, находящиеся на иммуносупрессивной терапии, люди с тяжелыми хроническими респираторными заболеваниями и пациенты с множественной коморбидной патологией. Совершенствование диагностики НТМ приводит к возрастанию осведомленности медицинского сообщества об этом заболевании, а следовательно – к своевременному назначению необходимых мер профилактики.
Нетуберкулезные микобактерии (НТМБ) – это условно-патогенные кислотоустойчивые микобактерии с сапрофитным типом питания, не относящиеся к Mycobacterium tuberculosis complex [7, 8]. Выделение из образцов мокроты пациента НТМБ не коррелирует с наличием симптомов заболевания и необходимостью проведения лечения [9]. Установление свойств НТМБ и выявление генетических факторов риска у пациентов, способствующих развитию данного инфекционного заболевания, является одним из направлений развития молекулярной диагностики инфекционных заболеваний в настоящее время. Поскольку однонуклеотидные замены в последовательности ДНК человека могут влиять на структуру и функциональные особенности факторов врожденного иммунитета, которые отвечают за реакцию на инвазию НТМБ, изучение данных полиморфизмов могло бы помочь в решении этой проблемы [9–11].
Отдельную сложность представляет собой выбор правильной тактики ведения пациентов с НТМ. Диапазон методов лечения варьирует от динамического наблюдения и использования симптоматической терапии с применением мукорегуляторов, бронходилататоров и дыхательной гимнастики до этиотропной комбинированной антибактериальной терапии и хирургических методов лечения. Решение в каждом конкретном случае должно приниматься индивидуально и основываться на принципе наименьшего вреда, поскольку осложнения от антибактериальной терапии зачастую тяжелее, чем сама болезнь.
Цель – рассмотреть редкий клинический случай развития НТМ, вызванного Mycobacterium avium, у 50-летней женщины без тяжелых сопутствующих заболеваний и вторичного иммунодефицита. Согласно литературным данным женский пол и средний возраст являются факторами риска развития легочных инфекций, вызванных НТМБ [5]. В этом описании клинического случая мы подчеркиваем важность понимания связи даже незначительных предрасполагающих факторов с полиморфизмами генов, участвующих в регуляции врожденного иммунитета.
Пациентка Л., 50 лет, индекс массы тела 31 кг/м2, правильного телосложения, жительница сельской местности, неработающая, в течение нескольких лет страдает бронхиальной астмой легкого течения, постоянной базисной терапии не получает, при возникновении затруднения дыхания использует будесонид/формотерол 160 мкг/4,5 мкг (не чаще 1 раза в неделю). Курение отрицает. Ухудшение самочувствия отметила осенью 2020 г., когда появился кашель с отделением гнойной мокроты, повысилась температура до субфебрильных цифр. На компьютерной томографии органов грудной клетки (КТ ОГК), выполненной в ноябре 2020 г. по месту жительства, обнаружены признаки диссеминированного процесса в легких и участок пневмофиброза и бронхоэктазов в нижней доле правого легкого (рис. 1).
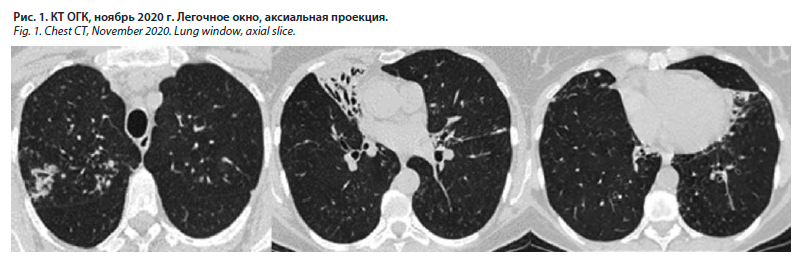
Заподозрен туберкулез, в связи с чем пациентка госпитализирована в отделение дневного стационара противотуберкулезного диспансера по месту жительства, где при исследовании трахеобронхиального аспирата методом полимеразной цепной реакции (ПЦР) обнаружена ДНК НТМБ, что позволило поставить диагноз НТМ легких. Идентификация возбудителя и определение лекарственной чувствительности не проводились. Назначена терапия рифампицином, изониазидом, пиразинамидом и этамбутолом, которую пациентка принимала в течение 6 мес без существенной положительной клинической динамики: сохранялся кашель со слизисто-гнойной мокротой.
Пациентка направлена под наблюдение пульмонолога по месту жительства, рекомендована антибактериальная монотерапия левофлоксацином, который пациентка принимала по своему усмотрению каждый раз, когда усиливался кашель (короткими курсами в течение года). Также проводились ингаляции фенотерол 0,25 мг + ипратропия бромид 0,5 мг/мл в связи с возникновением жалоб на затруднение дыхания и чувство неполного вдоха. На контрольной КТ ОГК от августа 2021 г. (через 8 мес) зарегистрирована отрицательная динамика в виде нарастания очаговых изменений в легких с обеих сторон (рис. 2). Была назначена терапия левофлоксацином, пиразинамидом и этамбутолом, которую пациентка принимала в течение 3 мес без положительной клинической и рентгенологической динамики и затем самостоятельно прекратила.
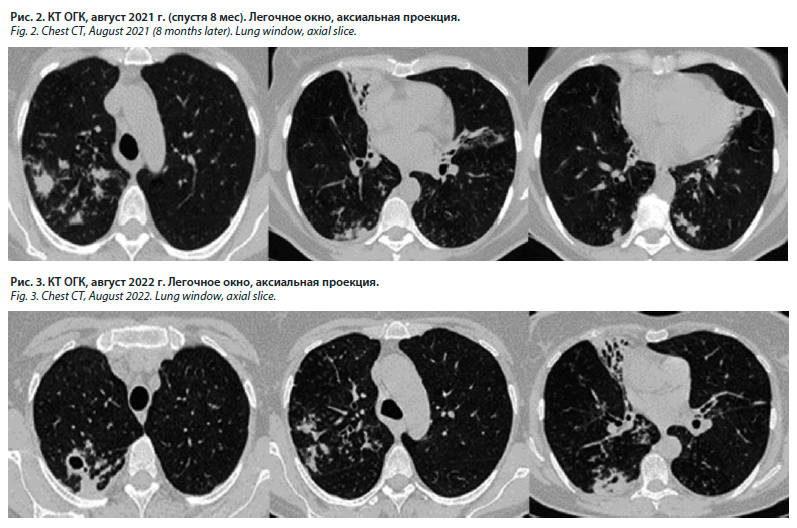
В августе 2022 г. пациентке выполнена повторная КТ ОГК, где повторно зарегистрирована отрицательная динамика в виде дальнейшего нарастания объема и распространенности очаговых изменений, появления новых бронхоэктазов в верхних долях легких и полости в верхней доле правого легкого (рис. 3). В связи с этим заподозрен аспергиллез, проведено обследование на грибы рода Aspergillus – иммуноглобулин (Ig) G крови отрицательный. Далее пациентка самостоятельно обратилась в ФГБНУ ЦНИИТ, была госпитализирована во 2-е терапевтическое отделение для обследования и лечения.
Состояние при поступлении средней степени тяжести. Пациентка предъявляла жалобы на периодический кашель с трудноотделяемой гнойной мокротой, общую слабость, утомляемость, чувство неполного вдоха. При осмотре кожа и слизистые оболочки чистые, физиологической окраски. Периферические лимфатические узлы не увеличены. Отеков нет. В легких на фоне везикулярного дыхания выслушивались сухие жужжащие и свистящие хрипы. Сатурация кислородом – 94% в покое. Тоны сердца приглушенные, ритмичные. Живот мягкий, безболезненный при пальпации. Печень у края реберной дуги.
В клиническом анализе крови регистрировалась ускоренная СОЭ 98 мм/ч. При исследовании функции внешнего дыхания отмечены уменьшение объема форсированного выдоха за 1-ю секунду (ОФВ1) до 56,9%, нарушение бронхиальной проходимости (максимальная объемная скорость при выдохе 25% форсированной жизненной емкости легких – МОС25 46% д.в.). Проба с бронхолитиком дала положительный результат, прирост по ОФВ1 – 19%. Анализ мокроты: трехкратно обнаружены кислотоустойчивые микобактерии (КУМ) методом люминесцентной микроскопии, ДНК НТМБ методом ПЦР, двукратно проведен посев НТМБ на жидкие питательные среды, выявлен рост M. avium.
В результате обследования пациентке установлен клинический диагноз: микобактериоз легких, вызванный M. аvium, полостная форма. Кислотоустойчивые микобактерии (+). Бронхиальная астма – легкое персистирующее неконтролируемое течение, обострение. Дыхательная недостаточность 1-й степени.
Исследование лекарственной чувствительности продемонстрировало устойчивость выделенных НТМБ к этамбутолу – одному из основных препаратов, рекомендованных для лечения. С учетом полученных данных назначена комплексная антибактериальная (кларитромицин 1,0 г, амикацин 1,0 г внутримышечно, моксифлоксацин 0,4 г, цефаперазона сульбактам 2,0 г внутримышечно), ингаляционная бронхолитическая и муколитическая терапия.
Таким образом, мы наблюдали женщину среднего возраста без признаков дефицита массы тела, без вредных привычек, тяжелого коморбидного фона и без явных признаков иммуносупрессии. Имеющаяся бронхиальная астма протекала с редкими обострениями и не требовала применения системных глюкокортикостероидных препаратов. Причины прогрессирующего течения заболевания могут быть объяснены неадекватным проведением антибактериальной терапии при выявлении заболевания. Однако осталась невыясненной причина, по которой у женщины с минимальными факторами риска произошло развитие тяжелой формы течения НТМ с формированием полости распада.
Как известно, на возникновение и развитие тяжелых форм мультифакторных заболеваний могут влиять генетические факторы, такие как однонуклеотидные замены (однонуклеотидный полиморфизм) в последовательности ДНК пациента. Замены могут приводить к изменению активности клеточных рецепторов иммунного ответа на проникновение патогена. При изучении литературных источников мы обнаружили случаи, когда однонуклеотидные замены были связаны с похожей клинической картиной [10, 12–14].
С целью оценки гуморального иммунитета определены уровни IgA, IgM, IgG. Полученные показатели – в пределах референсных значений.
Проведено исследование следующих генетических полиморфизмов в генах врожденного иммунитета: Толл-подобных рецепторов – rs5743551 (TLR1), rs5743708 (TLR2), rs3804100 (TLR2), rs3775291 (TLR3), rs4986790 (TLR4), rs5743810 (TLR6), rs3764880 (TLR8), а также полиморфизмов в других генах rs361525 (TNF-α), rs4733781 (ASAP1), rs1701730 (CHRNA3) и rs2285933 (OAS3) методом ПЦР в режиме реального времени.
Определены следующие аллели риска: rs5743551-C (TLR1), rs3804100-T (TLR2) и rs5743810-A (TLR6). В исследуемом образце ДНК наблюдалось сочетание гомозиготного генотипа rs5743551-CC с гетерозиготными rs3804100-CT и rs5743810-AG, найденными в генах Толл-подобных рецепторов TLR1, TLR2 и TLR6 соответственно.
В течение 1 мес стационарного лечения была получена положительная динамика: симптомы интоксикации исчезли, аускультативно хрипы в легких не выслушивались. Улучшились показатели гемограммы (уровень СОЭ снизился с 98 до 53 мм/ч) и спирометрии: ОФВ1 с 56,9 до 73,8% д.в., МОС 25 – с 46 до 54,3% д.в. Достигнут контроль над астмой. Пациентке рекомендовано продолжение терапии в амбулаторных условиях по месту жительства с контрольными визитами в клинику ФГБНУ ЦНИИТ.
Данный клинический пример интересен, на наш взгляд, двумя аспектами.
Рутинное клинико-функциональное и лабораторное обследование пациентки не позволило установить факторы и риски, создающие предпосылки для развития НТМ. Несмотря на проживание в сельской местности, пациентка находилась в удовлетворительных условиях с водопроводом, не вела придомового хозяйства, связанного с работой в земле, в теплицах, парниках, не имела домашнего скота и животных. В иммунограмме отклонений от нормы не выявлено.
Генетическое исследование позволило выявить сочетание однонуклеотидных последовательностей в генах рецепторов, образующих гетеродимеры TLR1:TLR2 и TLR2:TLR6. Их лиганды распознают липоманнан (иммуноагонист микобактерий), диацил и триацил липопептиды и липотейхоевые кислоты (компоненты клеточной стенки грамположительных бактерий) [11]. Можно предположить, что такое сочетание позволяет снизить активность клеток, вовлеченных в формирование иммунного ответа при инфицировании НМБТ, и, как следствие, уменьшить эффективность ответа на проникающий в организм патоген.
Редкие аллели Толл-подобных рецепторов могут быть ассоциированы с пониженной реакцией при передаче сигнала, запускающие иммунный ответ на патогены.
Поэтому одновременное сочетание аллелей риска в генах, продукты которых функциональны только в составе гетеродимеров, может приводить к неэффективному иммунному ответу на патоген и, как следствие, к осложненному течению НТМ-инфекций. В настоящее время ассоциативные исследования редких аллелей генов Толл-подобных рецепторов с тяжелым течением НТМ не проводились, не было изучено наблюдаемое нами сочетание аллелей риска в отношении этого заболевания, поэтому нельзя однозначно сказать о генетических рисках развития НТМ у наблюдаемой пациентки.
Наблюдаемый нами клинический случай демонстрирует последствия неверно выбранной терапевтической тактики на раннем этапе заболевания: тяжелое прогрессирование заболевания и развитие лекарственной устойчивости. На первом этапе лечения пациентке были назначены изониазид, рифампицин, пиразинамид и этамбутол в течение 6 мес. Как в дальнейшем показал результат микробиологического исследования, к изониазиду и этамбутолу имелась лекарственная устойчивость, а один из препаратов – пиразинамид – не используется в лечении инфекции, вызываемой M. avium. В ходе дальнейшего лечения пациентки при получении отрицательной рентгенологической динамики была назначена монотерапия левофлоксацином в свободном режиме на усмотрение самой пациентки. В перспективе формирования дальнейших схем лечения данный препарат можно считать «потерянным» вследствие высокой вероятности формирования резистентности. Заключительная схема, состоящая из левофлоксацина, пиразинамида и этамбутола, бесполезна ввиду отсутствия чувствительности.
Сложность в лечении данной пациентки для нас заключалась в формировании адекватной схемы терапии, которая, согласно рекомендациям, должна была включать не менее 4 препаратов [15]. В связи с тем что к этамбутолу у данного штамма НТМБ была лекарственная устойчивость, а линезолид, доксициклин и этионамид подавляли рост культуры только в концентрациях, превышающих терапевтические дозы, была выбрана 4-компонентная схема терапии, включавшая кларитромицин, амикацин, моксифлоксацин и цефоперазона
сульбактам. Поскольку, по данным опубликованных исследований, НТМ считается трудно поддающимся лечению заболеванием [15], то при неправильно выбранной тактике ведения оно часто приобретает статус хронической неизлечимой инфекции, как случилось у нашей пациентки.
Определение генетической предрасположенности к риску развития НТМ является важной клинической задачей, объясняющей особенности индивидуализированного ведения пациентов с НТМ для эффективного и безопасного назначения лечения (которое предполагает одновременное назначение нескольких препаратов) [15]. Наличие генетических особенностей системы врожденного иммунитета может оказывать влияние не только на динамику заболевания, но и на тактику лечения. Представленный клинический случай демонстрирует необходимость более глубокого изучения в том числе на уровне генетических факторов риска развития и характера течения НТМ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование выполнено без финансовой поддержки грантов, общественных, некоммерческих, коммерческих организаций и структур.
Funding. No financial support was provided for this research.
Информация об авторах
Information about the authors
Макарьянц Наталья Николаевна – д-р мед. наук, зав. отд. дифференциальной диагностики туберкулеза легких и экстракорпоральных методов лечения, ФГБНУ ЦНИИТ, вед. науч. сотр. каф. внутренних болезней с курсом кардиологии
и функциональной диагностики им. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: makaryantz@yandex.ru; ORCID: 0000-0002-6390-8759
Natalia N. Makariantz – Dr. Sci. (Med.), Department Head, Central Research Institute of Tuberculosis, Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: makaryantz@yandex.ru;
ORCID: 0000-0002-6390-8759
Карнаушкина Мария Александровна – д-р мед. наук, доц., проф. каф. внутренних болезней с курсом кардиологии
и функциональной диагностики им. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: kar3745@yandex.ru; ORCID: 0000-0002-8791-2920
Maria A. Karnaushkina – Dr. Sci. (Med.), Associated Professor, Patrice Lumumba Peoples' Friendship University
of Russia. E-mail: kar3745@yandex.ru;
ORCID: 0000-0002-8791-2920
Саламайкина Светлана Андреевна – мл. науч. сотр. научной группы по разработке новых методов выявления генетических полиморфизмов, ФБУН «ЦНИИ эпидемиологии».
E-mail: salamaykina@cmd.su; ORCID: 0000-0002-2517-5048
Svetlana A. Salamaikina – Research Assistant, Central Research Institute of Epidemiology.
E-mail: salamaykina@cmd.su; ORCID: 0000-0002-2517-5048
Миронов Константин Олегович – д-р биол. наук, рук. научной группы по разработке новых методов выявления генетических полиморфизмов, ФБУН «ЦНИИ эпидемиологии».
E-mail: mironov@pcr.ru; ORCID: 0000-0001-8207-9215
Konstantin O. Mironov – Dr. Sci. (Biol.), Central Research Institute of Epidemiology. E-mail: mironov@pcr.ru;
ORCID: 0000-0001-8207-9215
Бабак Сергей Львович – д-р мед. наук, доц., проф. каф. фтизиатрии и пульмонологии, ФГБОУ ВО «МГМСУ
им. А.И. Евдокимова». E-mail: sergbabak@mail.ru;
ORCID: 0000-0002-6571-1220
Sergey L. Babak – Dr. Sci. (Med.), Associated Professor, Yevdokimov Moscow State University of Medicine and Dentistry. E-mail: sergbabak@mail.ru;
ORCID: 0000-0002-6571-1220
Струтынская Анастасия Дмитриевна – канд. мед. наук, лаборант каф. внутренних болезней с курсом кардиологии
и функциональной диагностики им. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: strutynskaya@yandex.ru; ORСID: 0000-0001-9325-5587
Anastasia D. Strutynskaya – Cand. Sci. (Med.), Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: strutynskaya@yandex.ru;
ORСID: 0000-0001-9325-5587
Поступила в редакцию: 15.03.2024
Поступила после рецензирования: 19.03.2024
Принята к публикации: 21.03.2024
Received: 15.03.2024
Revised: 19.03.2024
Accepted: 21.03.2024
Клинический разбор в общей медицине №2 2024
Клинический случай прогрессирующего микобактериоза легких, потенциально связанный с генетической предрасположенностью, у пациентки с легким течением бронхиальной астмы
Номера страниц в выпуске:72-77
Аннотация
Микобактериоз – инфекционное заболевание, вызванное условно-патогенными нетуберкулезными микробактериями у пациентов с хронической патологией органов дыхания и снижением иммунологической реактивности. Число пациентов с данной патологией увеличивается не только в России, но и во всем мире. Внимание ученых привлек тот факт, что выделение из образцов мокроты пациента нетуберкулезных микобактерий не коррелирует с заболеваемостью нетуберкулезным микобактериозом и необходимостью его лечения. Это может быть связано с наличием полиморфизмов генов, влияющих на структуру, и функциональными особенностями факторов врожденного иммунитета. В статье представлен редкий клинический случай нетуберкулезного микобактериоза, вызванного Mycobacterium avium, у 50-летней женщины без тяжелых сопутствующих заболеваний и вторичного иммунодефицита. При проведении генетического исследования у пациентки были выявлены полиморфные аллели генов, возможно, являющиеся предрасполагающими факторами развития и тяжелого течения данного заболевания.
Ключевые слова: нетуберкулезный микобактериоз, заболевания легких, ослабленный иммунитет, полиморфизм генов, врожденный иммунитет.
Для цитирования: Макарьянц Н.Н., Карнаушкина М.А., Саламайкина С.А., Миронов К.О., Бабак С.Л., Струтынская А.Д. Клинический случай прогрессирующего микобактериоза легких, потенциально связанный с генетической предрасположенностью, у пациентки с легким течением бронхиальной астмы. Клинический разбор в общей медицине. 2024; 5 (2): 72–77. DOI: 10.47407/kr2023.5.2.00391
Микобактериоз – инфекционное заболевание, вызванное условно-патогенными нетуберкулезными микробактериями у пациентов с хронической патологией органов дыхания и снижением иммунологической реактивности. Число пациентов с данной патологией увеличивается не только в России, но и во всем мире. Внимание ученых привлек тот факт, что выделение из образцов мокроты пациента нетуберкулезных микобактерий не коррелирует с заболеваемостью нетуберкулезным микобактериозом и необходимостью его лечения. Это может быть связано с наличием полиморфизмов генов, влияющих на структуру, и функциональными особенностями факторов врожденного иммунитета. В статье представлен редкий клинический случай нетуберкулезного микобактериоза, вызванного Mycobacterium avium, у 50-летней женщины без тяжелых сопутствующих заболеваний и вторичного иммунодефицита. При проведении генетического исследования у пациентки были выявлены полиморфные аллели генов, возможно, являющиеся предрасполагающими факторами развития и тяжелого течения данного заболевания.
Ключевые слова: нетуберкулезный микобактериоз, заболевания легких, ослабленный иммунитет, полиморфизм генов, врожденный иммунитет.
Для цитирования: Макарьянц Н.Н., Карнаушкина М.А., Саламайкина С.А., Миронов К.О., Бабак С.Л., Струтынская А.Д. Клинический случай прогрессирующего микобактериоза легких, потенциально связанный с генетической предрасположенностью, у пациентки с легким течением бронхиальной астмы. Клинический разбор в общей медицине. 2024; 5 (2): 72–77. DOI: 10.47407/kr2023.5.2.00391
Clinical case of progressive pulmonary mycobacteriosis with potential genetic predisposition in a patient with mild bronchial asthma
Natalia N. Makariantz1,2, Maria A. Karnaushkina2, Svetlana A. Salamaikina3,Konstantin O. Mironov3, Sergey L. Babak4, Anastasia D. Strutynskaya2
1 Central Research Institute of Tuberculosis, Moscow, Russia;
2 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia;
3 Central Research Institute of Epidemiology, Moscow, Russia;
4 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia
strutynskaya@yandex.ru
Abstract
Mycobacteriosis is an infectious disease caused by opportunistic non-tuberculous microbacteria in patients with chronic respiratory pathology and decreased immunological reactivity. The number of patients with this pathology is increasing not only in Russia, but throughout the world. Scientists' attention was drawn to the fact that the isolation of non-tuberculous mycobacteria from patient’s sputum samples does not correlate with the incidence of non-tuberculous mycobacteriosis and the need for its treatment. This may be due to the presence of gene polymorphisms that affect the structure and functional characteristics of innate immune factors. The article presents a rare clinical case of non-tuberculous mycobacteriosis caused by Mycobacterium avium in a 50-year-old woman without severe concomitant diseases and secondary immunodeficiency. The genetic study revealed polymorphic gene alleles, which may predispose this patient for the infection and severe course of this disease.
Keywords: non-tuberculous mycobacteriosis, pulmonary disease, immunodeficiency, gene polymorphisms, innate immunity.
For citation: Makariantz N.N., Karnaushkina M.A., Salamaikina S.A., Mironov K.O., Babak S.L., Strutynskaya A.D. Clinical case of progressive pulmonary mycobacteriosis with potential genetic predisposition in a patient with mild bronchial asthma. Clinical analysis in general medicine. 2024; 5 (2): 72–77 (In Russ.). DOI: 10.47407/kr2023.5.2.00391
Введение
Микобактериоз – инфекционное заболевание, вызванное условно-патогенными нетуберкулезными микробактериями у пациентов с хронической патологией органов дыхания и снижением иммунологической реактивности [1, 2]. В настоящее время отмечается увеличение количества зарегистрированных случаев нетуберкулезного микобактериоза (НТМ) в мире, что может быть связано с рядом причин [3–6].Увеличилась продолжительность жизни людей, относящихся к группам риска развития НТМ, таких как пациенты, находящиеся на иммуносупрессивной терапии, люди с тяжелыми хроническими респираторными заболеваниями и пациенты с множественной коморбидной патологией. Совершенствование диагностики НТМ приводит к возрастанию осведомленности медицинского сообщества об этом заболевании, а следовательно – к своевременному назначению необходимых мер профилактики.
Нетуберкулезные микобактерии (НТМБ) – это условно-патогенные кислотоустойчивые микобактерии с сапрофитным типом питания, не относящиеся к Mycobacterium tuberculosis complex [7, 8]. Выделение из образцов мокроты пациента НТМБ не коррелирует с наличием симптомов заболевания и необходимостью проведения лечения [9]. Установление свойств НТМБ и выявление генетических факторов риска у пациентов, способствующих развитию данного инфекционного заболевания, является одним из направлений развития молекулярной диагностики инфекционных заболеваний в настоящее время. Поскольку однонуклеотидные замены в последовательности ДНК человека могут влиять на структуру и функциональные особенности факторов врожденного иммунитета, которые отвечают за реакцию на инвазию НТМБ, изучение данных полиморфизмов могло бы помочь в решении этой проблемы [9–11].
Отдельную сложность представляет собой выбор правильной тактики ведения пациентов с НТМ. Диапазон методов лечения варьирует от динамического наблюдения и использования симптоматической терапии с применением мукорегуляторов, бронходилататоров и дыхательной гимнастики до этиотропной комбинированной антибактериальной терапии и хирургических методов лечения. Решение в каждом конкретном случае должно приниматься индивидуально и основываться на принципе наименьшего вреда, поскольку осложнения от антибактериальной терапии зачастую тяжелее, чем сама болезнь.
Цель – рассмотреть редкий клинический случай развития НТМ, вызванного Mycobacterium avium, у 50-летней женщины без тяжелых сопутствующих заболеваний и вторичного иммунодефицита. Согласно литературным данным женский пол и средний возраст являются факторами риска развития легочных инфекций, вызванных НТМБ [5]. В этом описании клинического случая мы подчеркиваем важность понимания связи даже незначительных предрасполагающих факторов с полиморфизмами генов, участвующих в регуляции врожденного иммунитета.
Описание клинического случая
В соответствии с принципами этики пациентка подписала информированное согласие на представление данных ее истории болезни.Пациентка Л., 50 лет, индекс массы тела 31 кг/м2, правильного телосложения, жительница сельской местности, неработающая, в течение нескольких лет страдает бронхиальной астмой легкого течения, постоянной базисной терапии не получает, при возникновении затруднения дыхания использует будесонид/формотерол 160 мкг/4,5 мкг (не чаще 1 раза в неделю). Курение отрицает. Ухудшение самочувствия отметила осенью 2020 г., когда появился кашель с отделением гнойной мокроты, повысилась температура до субфебрильных цифр. На компьютерной томографии органов грудной клетки (КТ ОГК), выполненной в ноябре 2020 г. по месту жительства, обнаружены признаки диссеминированного процесса в легких и участок пневмофиброза и бронхоэктазов в нижней доле правого легкого (рис. 1).

Заподозрен туберкулез, в связи с чем пациентка госпитализирована в отделение дневного стационара противотуберкулезного диспансера по месту жительства, где при исследовании трахеобронхиального аспирата методом полимеразной цепной реакции (ПЦР) обнаружена ДНК НТМБ, что позволило поставить диагноз НТМ легких. Идентификация возбудителя и определение лекарственной чувствительности не проводились. Назначена терапия рифампицином, изониазидом, пиразинамидом и этамбутолом, которую пациентка принимала в течение 6 мес без существенной положительной клинической динамики: сохранялся кашель со слизисто-гнойной мокротой.
Пациентка направлена под наблюдение пульмонолога по месту жительства, рекомендована антибактериальная монотерапия левофлоксацином, который пациентка принимала по своему усмотрению каждый раз, когда усиливался кашель (короткими курсами в течение года). Также проводились ингаляции фенотерол 0,25 мг + ипратропия бромид 0,5 мг/мл в связи с возникновением жалоб на затруднение дыхания и чувство неполного вдоха. На контрольной КТ ОГК от августа 2021 г. (через 8 мес) зарегистрирована отрицательная динамика в виде нарастания очаговых изменений в легких с обеих сторон (рис. 2). Была назначена терапия левофлоксацином, пиразинамидом и этамбутолом, которую пациентка принимала в течение 3 мес без положительной клинической и рентгенологической динамики и затем самостоятельно прекратила.

В августе 2022 г. пациентке выполнена повторная КТ ОГК, где повторно зарегистрирована отрицательная динамика в виде дальнейшего нарастания объема и распространенности очаговых изменений, появления новых бронхоэктазов в верхних долях легких и полости в верхней доле правого легкого (рис. 3). В связи с этим заподозрен аспергиллез, проведено обследование на грибы рода Aspergillus – иммуноглобулин (Ig) G крови отрицательный. Далее пациентка самостоятельно обратилась в ФГБНУ ЦНИИТ, была госпитализирована во 2-е терапевтическое отделение для обследования и лечения.
Состояние при поступлении средней степени тяжести. Пациентка предъявляла жалобы на периодический кашель с трудноотделяемой гнойной мокротой, общую слабость, утомляемость, чувство неполного вдоха. При осмотре кожа и слизистые оболочки чистые, физиологической окраски. Периферические лимфатические узлы не увеличены. Отеков нет. В легких на фоне везикулярного дыхания выслушивались сухие жужжащие и свистящие хрипы. Сатурация кислородом – 94% в покое. Тоны сердца приглушенные, ритмичные. Живот мягкий, безболезненный при пальпации. Печень у края реберной дуги.
В клиническом анализе крови регистрировалась ускоренная СОЭ 98 мм/ч. При исследовании функции внешнего дыхания отмечены уменьшение объема форсированного выдоха за 1-ю секунду (ОФВ1) до 56,9%, нарушение бронхиальной проходимости (максимальная объемная скорость при выдохе 25% форсированной жизненной емкости легких – МОС25 46% д.в.). Проба с бронхолитиком дала положительный результат, прирост по ОФВ1 – 19%. Анализ мокроты: трехкратно обнаружены кислотоустойчивые микобактерии (КУМ) методом люминесцентной микроскопии, ДНК НТМБ методом ПЦР, двукратно проведен посев НТМБ на жидкие питательные среды, выявлен рост M. avium.
В результате обследования пациентке установлен клинический диагноз: микобактериоз легких, вызванный M. аvium, полостная форма. Кислотоустойчивые микобактерии (+). Бронхиальная астма – легкое персистирующее неконтролируемое течение, обострение. Дыхательная недостаточность 1-й степени.
Исследование лекарственной чувствительности продемонстрировало устойчивость выделенных НТМБ к этамбутолу – одному из основных препаратов, рекомендованных для лечения. С учетом полученных данных назначена комплексная антибактериальная (кларитромицин 1,0 г, амикацин 1,0 г внутримышечно, моксифлоксацин 0,4 г, цефаперазона сульбактам 2,0 г внутримышечно), ингаляционная бронхолитическая и муколитическая терапия.
Таким образом, мы наблюдали женщину среднего возраста без признаков дефицита массы тела, без вредных привычек, тяжелого коморбидного фона и без явных признаков иммуносупрессии. Имеющаяся бронхиальная астма протекала с редкими обострениями и не требовала применения системных глюкокортикостероидных препаратов. Причины прогрессирующего течения заболевания могут быть объяснены неадекватным проведением антибактериальной терапии при выявлении заболевания. Однако осталась невыясненной причина, по которой у женщины с минимальными факторами риска произошло развитие тяжелой формы течения НТМ с формированием полости распада.
Как известно, на возникновение и развитие тяжелых форм мультифакторных заболеваний могут влиять генетические факторы, такие как однонуклеотидные замены (однонуклеотидный полиморфизм) в последовательности ДНК пациента. Замены могут приводить к изменению активности клеточных рецепторов иммунного ответа на проникновение патогена. При изучении литературных источников мы обнаружили случаи, когда однонуклеотидные замены были связаны с похожей клинической картиной [10, 12–14].
С целью оценки гуморального иммунитета определены уровни IgA, IgM, IgG. Полученные показатели – в пределах референсных значений.
Проведено исследование следующих генетических полиморфизмов в генах врожденного иммунитета: Толл-подобных рецепторов – rs5743551 (TLR1), rs5743708 (TLR2), rs3804100 (TLR2), rs3775291 (TLR3), rs4986790 (TLR4), rs5743810 (TLR6), rs3764880 (TLR8), а также полиморфизмов в других генах rs361525 (TNF-α), rs4733781 (ASAP1), rs1701730 (CHRNA3) и rs2285933 (OAS3) методом ПЦР в режиме реального времени.
Определены следующие аллели риска: rs5743551-C (TLR1), rs3804100-T (TLR2) и rs5743810-A (TLR6). В исследуемом образце ДНК наблюдалось сочетание гомозиготного генотипа rs5743551-CC с гетерозиготными rs3804100-CT и rs5743810-AG, найденными в генах Толл-подобных рецепторов TLR1, TLR2 и TLR6 соответственно.
В течение 1 мес стационарного лечения была получена положительная динамика: симптомы интоксикации исчезли, аускультативно хрипы в легких не выслушивались. Улучшились показатели гемограммы (уровень СОЭ снизился с 98 до 53 мм/ч) и спирометрии: ОФВ1 с 56,9 до 73,8% д.в., МОС 25 – с 46 до 54,3% д.в. Достигнут контроль над астмой. Пациентке рекомендовано продолжение терапии в амбулаторных условиях по месту жительства с контрольными визитами в клинику ФГБНУ ЦНИИТ.
Обсуждение
Разработка диагностических алгоритмов и подходов к лечению пациентов с НТМ легких в настоящее время является чрезвычайно актуальной темой, разрабатываемой как в рамках практического звена здравоохранения, так и в качестве фундаментальной научной проблемы. Общепризнанным является взгляд на микобактериоз как на коморбидную патологию. Обязательным условием развития заболевания является наличие иммуносупрессии. Исследования некоторых авторов продемонстрировали, что легочные инфекции, вызванные НТМБ, отмечаются у женщин в постменопаузе без нарушений иммунитета, но эти женщины часто имеют сниженный индекс массы тела, сколиоз и пролапс митрального клапана [2, 5]. Другие менее распространенные факторы риска, описанные в литературе, включают гастроэзофагеальную рефлюксную болезнь, дефицит витамина D, низкий индекс массы тела и ревматоидный артрит [2]. Ни один из этих факторов риска также не был выявлен у представленной пациентки. Увеличение количества регистрируемых случаев НТМ без значимых факторов риска в анамнезе может быть связано с наличием генетических факторов, которые на данный момент остаются неизученными [14].Данный клинический пример интересен, на наш взгляд, двумя аспектами.
Рутинное клинико-функциональное и лабораторное обследование пациентки не позволило установить факторы и риски, создающие предпосылки для развития НТМ. Несмотря на проживание в сельской местности, пациентка находилась в удовлетворительных условиях с водопроводом, не вела придомового хозяйства, связанного с работой в земле, в теплицах, парниках, не имела домашнего скота и животных. В иммунограмме отклонений от нормы не выявлено.
Генетическое исследование позволило выявить сочетание однонуклеотидных последовательностей в генах рецепторов, образующих гетеродимеры TLR1:TLR2 и TLR2:TLR6. Их лиганды распознают липоманнан (иммуноагонист микобактерий), диацил и триацил липопептиды и липотейхоевые кислоты (компоненты клеточной стенки грамположительных бактерий) [11]. Можно предположить, что такое сочетание позволяет снизить активность клеток, вовлеченных в формирование иммунного ответа при инфицировании НМБТ, и, как следствие, уменьшить эффективность ответа на проникающий в организм патоген.
Редкие аллели Толл-подобных рецепторов могут быть ассоциированы с пониженной реакцией при передаче сигнала, запускающие иммунный ответ на патогены.
Поэтому одновременное сочетание аллелей риска в генах, продукты которых функциональны только в составе гетеродимеров, может приводить к неэффективному иммунному ответу на патоген и, как следствие, к осложненному течению НТМ-инфекций. В настоящее время ассоциативные исследования редких аллелей генов Толл-подобных рецепторов с тяжелым течением НТМ не проводились, не было изучено наблюдаемое нами сочетание аллелей риска в отношении этого заболевания, поэтому нельзя однозначно сказать о генетических рисках развития НТМ у наблюдаемой пациентки.
Наблюдаемый нами клинический случай демонстрирует последствия неверно выбранной терапевтической тактики на раннем этапе заболевания: тяжелое прогрессирование заболевания и развитие лекарственной устойчивости. На первом этапе лечения пациентке были назначены изониазид, рифампицин, пиразинамид и этамбутол в течение 6 мес. Как в дальнейшем показал результат микробиологического исследования, к изониазиду и этамбутолу имелась лекарственная устойчивость, а один из препаратов – пиразинамид – не используется в лечении инфекции, вызываемой M. avium. В ходе дальнейшего лечения пациентки при получении отрицательной рентгенологической динамики была назначена монотерапия левофлоксацином в свободном режиме на усмотрение самой пациентки. В перспективе формирования дальнейших схем лечения данный препарат можно считать «потерянным» вследствие высокой вероятности формирования резистентности. Заключительная схема, состоящая из левофлоксацина, пиразинамида и этамбутола, бесполезна ввиду отсутствия чувствительности.
Сложность в лечении данной пациентки для нас заключалась в формировании адекватной схемы терапии, которая, согласно рекомендациям, должна была включать не менее 4 препаратов [15]. В связи с тем что к этамбутолу у данного штамма НТМБ была лекарственная устойчивость, а линезолид, доксициклин и этионамид подавляли рост культуры только в концентрациях, превышающих терапевтические дозы, была выбрана 4-компонентная схема терапии, включавшая кларитромицин, амикацин, моксифлоксацин и цефоперазона
сульбактам. Поскольку, по данным опубликованных исследований, НТМ считается трудно поддающимся лечению заболеванием [15], то при неправильно выбранной тактике ведения оно часто приобретает статус хронической неизлечимой инфекции, как случилось у нашей пациентки.
Определение генетической предрасположенности к риску развития НТМ является важной клинической задачей, объясняющей особенности индивидуализированного ведения пациентов с НТМ для эффективного и безопасного назначения лечения (которое предполагает одновременное назначение нескольких препаратов) [15]. Наличие генетических особенностей системы врожденного иммунитета может оказывать влияние не только на динамику заболевания, но и на тактику лечения. Представленный клинический случай демонстрирует необходимость более глубокого изучения в том числе на уровне генетических факторов риска развития и характера течения НТМ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование выполнено без финансовой поддержки грантов, общественных, некоммерческих, коммерческих организаций и структур.
Funding. No financial support was provided for this research.
Информация об авторах
Information about the authors
Макарьянц Наталья Николаевна – д-р мед. наук, зав. отд. дифференциальной диагностики туберкулеза легких и экстракорпоральных методов лечения, ФГБНУ ЦНИИТ, вед. науч. сотр. каф. внутренних болезней с курсом кардиологии
и функциональной диагностики им. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: makaryantz@yandex.ru; ORCID: 0000-0002-6390-8759
Natalia N. Makariantz – Dr. Sci. (Med.), Department Head, Central Research Institute of Tuberculosis, Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: makaryantz@yandex.ru;
ORCID: 0000-0002-6390-8759
Карнаушкина Мария Александровна – д-р мед. наук, доц., проф. каф. внутренних болезней с курсом кардиологии
и функциональной диагностики им. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: kar3745@yandex.ru; ORCID: 0000-0002-8791-2920
Maria A. Karnaushkina – Dr. Sci. (Med.), Associated Professor, Patrice Lumumba Peoples' Friendship University
of Russia. E-mail: kar3745@yandex.ru;
ORCID: 0000-0002-8791-2920
Саламайкина Светлана Андреевна – мл. науч. сотр. научной группы по разработке новых методов выявления генетических полиморфизмов, ФБУН «ЦНИИ эпидемиологии».
E-mail: salamaykina@cmd.su; ORCID: 0000-0002-2517-5048
Svetlana A. Salamaikina – Research Assistant, Central Research Institute of Epidemiology.
E-mail: salamaykina@cmd.su; ORCID: 0000-0002-2517-5048
Миронов Константин Олегович – д-р биол. наук, рук. научной группы по разработке новых методов выявления генетических полиморфизмов, ФБУН «ЦНИИ эпидемиологии».
E-mail: mironov@pcr.ru; ORCID: 0000-0001-8207-9215
Konstantin O. Mironov – Dr. Sci. (Biol.), Central Research Institute of Epidemiology. E-mail: mironov@pcr.ru;
ORCID: 0000-0001-8207-9215
Бабак Сергей Львович – д-р мед. наук, доц., проф. каф. фтизиатрии и пульмонологии, ФГБОУ ВО «МГМСУ
им. А.И. Евдокимова». E-mail: sergbabak@mail.ru;
ORCID: 0000-0002-6571-1220
Sergey L. Babak – Dr. Sci. (Med.), Associated Professor, Yevdokimov Moscow State University of Medicine and Dentistry. E-mail: sergbabak@mail.ru;
ORCID: 0000-0002-6571-1220
Струтынская Анастасия Дмитриевна – канд. мед. наук, лаборант каф. внутренних болезней с курсом кардиологии
и функциональной диагностики им. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: strutynskaya@yandex.ru; ORСID: 0000-0001-9325-5587
Anastasia D. Strutynskaya – Cand. Sci. (Med.), Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: strutynskaya@yandex.ru;
ORСID: 0000-0001-9325-5587
Поступила в редакцию: 15.03.2024
Поступила после рецензирования: 19.03.2024
Принята к публикации: 21.03.2024
Received: 15.03.2024
Revised: 19.03.2024
Accepted: 21.03.2024
Список исп. литературыСкрыть список1. Зимина В.Н., Дегтярева С.Ю., Белобородова Е.Н. и др. Микобактериозы: современное состояние проблемы. Клиническая микробиология и антимикробная химиотерапия. 2017;19(4):276-82.
Zimina V.N., Degtjareva S.Ju., Beloborodova E.N. et al. Mycobacterioses: current state of the problem. Clinical microbiology and antimicrobial chemotherapy. 2017;19(4):276-82 (in Russian).
2. Макарова М.В., Гунтупова Л.Д. Нетуберкулезные микобактерии. БИОпрепараты. Профилактика, диагностика, лечение. 2020;20(2):97-102.
Makarova M.V., Guntupova L.D. Non-tuberculous mycobacteria. BIOpreparations. Prevention, diagnosis, treatment. 2020;20(2):97-102 (in Russian).
3. Лямин А.В., Ковалев А.М., Жестков А.В. и др. Нетуберкулезные микобактерии: современные возможности видовой идентификации. Клиническая микробиология и антибактериальная химиотерапия. 2017;19(1):11-4.
Ljamin A.V., Kovaljov A.M., Zhestkov A.V. et al. Non-tuberculous mycobacteria: modern possibilities of species identification. Clinical microbiology and antibacterial chemotherapy. 2017;19(1):11-4. (in Russian).
4. Brode SK, Marchand-Austin A, Jamieson FB, Marras TK. Nontuberculous Mycobacteria, Ontario, Canada. Emerg Infect Dis 2017;23(11):1898-901. DOI: 10.3201/eid2311.170959
5. Park SC, Kang MJ, Han CH et al. Prevalence, incidence, and mortality of nontuberculous mycobacterial infection in Korea: a nationwide population-based study. BMC Pulm Med 2019;19(1):140. DOI: 10.1186/s12890-019-0901-z
6. Donohue MJ, Wymer L. Increasing Prevalence Rate of Nontuberculous Mycobacteria Infections in Five States, 2008–2013. Annals ATS 2016;13(12):2143-50. DOI: 10.1513/AnnalsATS.201605-353OC
7. Chin KL, Sarmiento ME, Alvarez-Cabrera N et al. Pulmonary non-tuberculous mycobacterial infections: current state and future. Eur J Clin Microbiol Infect Dis 2020;39(5):799-826. DOI: 10.1007/s10096-019-03771-0
8. Henkle E, Winthrop KL. Nontuberculous mycobacteria infections in immunosuppressed hosts. Clin Chest Med 2015;36:91-9. DOI: 10.1016/j.ccm.2014.11.002
9. Koh WJ, Kwon OJ, Kim EJ et al. NRAMP1 Gene Polymorphism and Susceptibility to Nontuberculous Mycobacterial Lung Diseases. Chest 2005;128(1):94-101. DOI: 10.1378/chest.128.1.94
10. Wu MF, Shu CC, Wang JY et al. NLRP3 inflammasome is attenuated in patients with Mycobacterium avium complex lung disease and correlated with decreased interleukin-1β response and host susceptibility. Sci Rep 2019;9(1):12534. DOI: 10.1038/s41598-019-47609-3
11. Yim JJ, Kim HJ, Kwon OJ, Koh WJ. Association between microsatellite polymorphisms in intron II of the human Toll-like receptor 2 gene and nontuberculous mycobacterial lung disease in a Korean population. Human Immunology 2008;69(9):572-6. DOI: 10.1016/j.humimm.2008.06.003
12. Cho J, Park K, Choi SM et al. Genome-wide association study of non-tuberculous mycobacterial pulmonary disease. Thorax 2021;76(2):169-77. DOI: 10.1136/thoraxjnl-2019-214430
13. Pan SW, Feng JY, Wu LS et al. Sex-Specific Associations Between Susceptibility to Mycobacterium avium Complex Lung Disease and Programmed Cell Death 1 Gene Polymorphisms. J Infect Dis 2023;228(1):18-27. DOI: 10.1093/infdis/jiac396
14. Ratnatunga CN, Lutzky VP, Kupz A et al. The rise of non-tuberculosis mycobacterial lung disease. Front Immunol 2020;11:303. DOI: 10.3389/fimmu.2020.00303
15. Daley CL, Iaccarino JM, Lange C et al. Treatment of Nontuberculous Mycobacterial Pulmonary Disease: An Official ATS/ERS/ESCMID/IDSA Clinical Practice Guideline. Clin Infect Dis 2020;71(4):e1-e36. DOI: 10.1093/cid/ciaa241

