Клинический разбор в общей медицине №1 2024
Elena Yu. Andreeva
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
marinaamica@mail.ru
Abstract
The presented clinical observation shows the role of a multidisciplinary team of doctors in the treatment of acute kidney injury (AKI) in a patient suffering from bronchial asthma and metabolic syndrome (morbid obesity, arterial hypertension, type 2 diabetes mellitus). The importance of correcting metabolic disorders (diet, self-monitoring of glycemia, urate- and glucose-lowering therapy) has been demonstrated both as part of the complex therapy of AKI and for the prevention/slowing of further kidney damage.
Keywords: acute kidney injury, morbid obesity, hyperuricemia, multimorbid patient, glycemic control.
For citation: Lebedeva M.V., Kamyshova E.S., Taranova M.V., Beketov V.D., Andreeva E.Y. Acute kidney injury in polymorbid patients. Clinical review for general practice. 2024; 5 (1): 7–12 (In Russ.). DOI: 10.47407/kr2023.5.1.00352
Острое повреждение почек (ОПП) – это часто встречающееся полиэтиологическое состояние, с которым в повседневной клинической практике может встретиться врач любой специальности. Современные клинические рекомендации определяют ОПП как «патологическое состояние, развивающееся в результате непосредственного острого воздействия ренальных и/или экстраренальных повреждающих факторов, продолжающееся до 7 суток и характеризующееся быстрым (часы-дни) развитием признаков повреждения или дисфункции почек различной степени выраженности» [1]. Если ОПП не разрешилось в течение 7 дней, наступает стадия острой болезни почек, которая продолжается до 90 суток и в дальнейшем может трансформироваться в хроническую болезнь почек (ХБП), т.е. ОПП может являться частью своеобразного патологического континуума повреждения почек [1].
В клинической практике ОПП диагностируют при наличии хотя бы одного из трех следующих критериев:
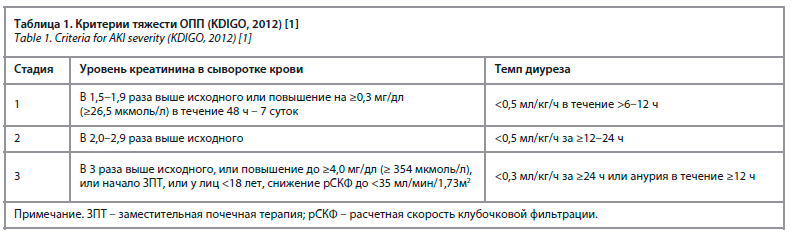
1) нарастание уровня креатинина в сыворотке крови (сКр) ≥0,3 мг/дл (≥26,5 мкмоль/л) в течение 48 ч, или 2) нарастание сКр ≥1,5 раза от исходного, которое, как известно или предполагается, произошло в течение 7 суток, или 3) темп диуреза <0,5 мл/кг/ч в течение 6 ч [1, 2]. Степень тяжести ОПП определяют согласно критериям KDIGO 2012 г. (табл. 1).
Причины ОПП разнообразны, в зависимости от патогенеза их подразделяют на связанные с 1) гипоперфузией почек (преренальные), 2) прямым повреждением основных компартментов органа – внутрипочечных сосудов, клубочков, канальцев и интерстиция (ренальные), 3) постренальной обструкцией тока мочи (постренальные) [1, 2]. В ряде случаев механизмы развития ОПП при повреждении разных структур почки могут пересекаться, в связи с чем не всегда возможно четко дифференцировать патогенетические варианты ОПП.
Этиология ОПП определяет ее эпидемиологию. Так, распространенность ОПП зависит от того, на каком этапе оно развивается: догоспитальном или в стационаре («внебольничное» или «внутрибольничное» ОПП соответственно). По данным когортного исследования, включавшего 50 835 взрослых жителей Великобритании, частота выявления ОПП составила 9%, при этом на долю внебольничного и внутрибольничного ОПП пришлось 38,9% и 61,1% случаев соответственно [3]. Госпитализация потребовалась 22,9% амбулаторных пациентов. Тридцатидневная смертность была максимальной у пациентов с внутрибольничным ОПП и у пациентов с внебольничным ОПП, которым потребовалась госпитализация (24,2% и 20,2% соответственно по сравнению с 2,6% у амбулаторно наблюдаемых пациентов с внебольничным ОПП) [3]. В этиологической структуре наиболее распространенными причинами внутрибольничного ОПП являются сепсис, пневмония, сердечно-сосудистые заболевания [4]. Пандемия COVID-19 также показала высокую частоту диагностики ОПП у госпитализированных пациентов с преобладанием поражения почек у коморбидных и полиморбидных пациентов: в крупных отечественных и зарубежных когортных исследованиях этот показатель составил 38–46% [5, 6]. В последние годы растет частота ятрогенных ОПП, в связи с чем большое значение приобретает оценка факторов риска и ассоциированных с ОПП состояний. В качестве факторов риска рассматривают возраст ≥65 лет и мужской пол, наличие гиповолемии, артериальной гипотензии, прием блокаторов ренин-ангиотензин-альдостероновой системы, нестероидных противовоспалительных средств, мочегонных, а под ассоциированными состояниями понимают наличие предсуществующих заболеваний, таких как ХБП, артериальная гипертония (АГ), сахарный диабет (СД), хроническая сердечная недостаточность (ХСН), двусторонний стеноз почечных артерий [1]. Наличие ожирения высоких градаций, хронической анемии, неконтролируемой гипергликемии, фактически не выявленного своевременно СД, возраст старше 50 лет также определяют высокий риск развития ОПП [1, 2, 7]. Кроме того, ОПП нередко осложняет течение ХБП (регистрируется у 45–55% пациентов с ХБП), что может способствовать прогрессированию почечной недостаточности [4].
Таким образом, пациенты с ОПП или высоким риском его развития могут встретиться в повседневной практике врача любой специальности, а значит, важна настороженность в плане своевременной диагностики этого состояния, а также представление о его профилактике и лечении [1, 3, 8, 9].
В анамнезе многолетняя бронхиальная астма с преобладанием аллергического компонента с базовым лечением коротко действующими бронходилататорами до 14 доз в сутки, морбидное ожирение (индекс массы тела – ИМТ 50,7 кг/м2), пиквикский синдром с выраженной дневной сонливостью, эпизодами непреднамеренного засыпания в период работы с документами, артериальная гипертензия, по поводу которой проводилась терапия блокатором рецепторов ангиотензина II, недигидропиридиновым антагонистом кальциевых каналов, агонистом I1-имидазолиновых рецепторов и петлевым диуретиком. В течение месяца до госпитализации пациентка отметила наличие никтурии на фоне
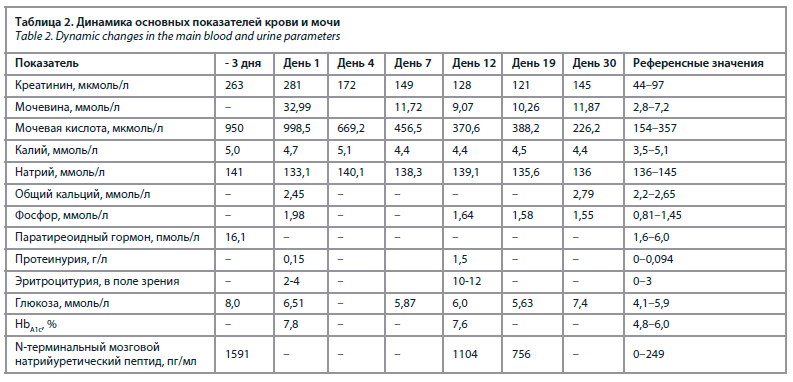
постепенного общего уменьшения количества выделяемой за сутки мочи, в связи с чем самостоятельно увеличила дозу петлевого диуретика (суточная доза превышала терапевтическую), однако явный мочегонный эффект отсутствовал. Обращала на себя внимание крайне высокая потребность пациентки в применении короткодействующих β2-агонистов для уменьшения одышки и кашля, за последние 2 года ежедневное количество ингаляций достигало 9–14 в сутки, что приносило лишь кратковременное облегчение симптомов. Согласно тесту контроля астмы (АСТ – Asthma Control Test) сохранялась высокая активность заболевания [10]. Пациентке требовалось не менее 20 мин для преодоления расстояния в 400 м с остановками. В анализах, сданных за 3 дня до госпитализации, отмечалось повышение уровней в крови креатинина, мочевины, мочевой кислоты (табл. 2). В день госпитализации пациентка выделила около 300 мл мочи к 17.00.
При объективном осмотре: состояние средней тяжести, стабильное. Тяжесть состояния обусловлена наличием дыхательной недостаточности, астенического синдрома. Пациентка могла находиться только в положении ортопноэ. Сознание ясное, ориентирована правильно. Частота дыхания 20 в минуту, сатурация кислорода, определенная методом пульсоксиметрии, – 90%, при минимальной физической нагрузке – 87–88%, температура тела нормальная, значительное абдоминальное ожирение. Кожные покровы обычной окраски, суховаты, теплые. Отеки лица, стоп, голеней неплотные. Над легкими дыхание везикулярное, выдох удлинен, значительно ослаблено в базальных отделах, масса сухих рассеянных свистящих хрипов с обеих сторон. Артериальное давление (АД) 160/100 мм рт. ст., тахикардия до 98 в минуту. Сердечные тоны незначительно приглушены, ритмичные. Акцент второго тона над клапаном легочной артерии. Со стороны других органов и систем без особенностей.
Во время сбора анамнеза была инициирована кислородная поддержка через назальные канюли – 75% со скоростью потока 3–5 л/мин. Через час пациентка без мочегонных выделила 600 мл мочи, объем выпитой жидкости к этому времени составил 550 мл.
В анализах при поступлении: повышение уровней креатинина, мочевины, мочевой кислоты, фосфора, глюкозы, гликированного гемоглобина, N-терминального мозгового натрийуретического пептида в крови, нормохромная, нормоцитарная анемия (см. табл. 2).
Диагностировано ОПП сложного генеза (сочетание преренального и ренального), в качестве причин которого обсуждались нарушение перфузии почек с развитием ишемии в результате декомпенсации ХСН, АГ и хронической гипоксии, обусловленной обострением бронхиальной астмы и морбидным ожирением, а также влияние вторичной гиперурикемии и, возможно, лекарственного поражения почек (прием высоких доз петлевого диуретика). С учетом полученных результатов была начата терапия ингибитором ксантиноксидазы в малых терапевтических дозах, продолжена кислородотерапия в прежнем режиме, инициирована тройная ингаляторная терапия бронхиальной астмы (ингаляционный глюкокортикостероид в высокой дозе, β2-агонист и м-холиноблокатор суточного действия). Принимая во внимание положительный спонтанный диурез (+0,8–1,2 л), низконормальные уровни АД, от назначения мочегонных было решено воздержаться, с целью коррекции АГ назначен кардиоселективный
β-блокатор в сочетании с минимальной дозой агониста I1-имидазолиновых рецепторов.
Пациентке рекомендовали ограничить количество жидкости до 1,5 л жидкости в сутки, из которых половину должна оставлять простая вода, соблюдать диету с ограничением поваренной соли, простых углеводов, белка до 0,8 г/кг массы тела в сутки, продуктов, богатых пуриновыми основаниями, фосфатами.
Через 4 дня отмечена положительная динамика показателей функции почек (см. табл. 2), пациентка полностью отказалась от применения коротко действующих бронходилататоров.
Выявление выраженной легочной гипертензии 2–3-й степени (систолическое давление в легочной артерии 62 мм рт. ст.), дилатации полостей обоих предсердий и правого желудочка требовало исключения тромбоэмболии легочной артерии (ТЭЛА), в связи с чем выполнена перфузионная сцинтиграфия легких, не выявившая очаговых перфузионных изменений легких, характерных для ТЭЛА, и шунта справа-налево, однако наличие при компьютерной томографии двух субсегментарных фиброателектазов, единичных рассеянных мелких кальцинатов в легких позволило обсуждать хроническую ТЭЛА, генез которой в настоящее время не ясен и требует уточнения (данных, подтверждающих антифосфолипидный синдром, заподозренный с учетом раннего начала АГ и осложненного акушерского анамнеза, не получено).
На основании повышенных значений гликированного гемоглобина до 7,8% и гликемии натощак
8,0 ммоль/л диагностирован СД 2-го типа, впервые выявленный. Принимая во внимание нормализацию уровней глюкозы в крови на фоне коррекции питания, от назначения инсулинотерапии воздержались, назначен ингибитор дипептидилпептидазы-4.
В течение госпитализации пациентке была подобрана диета, она была обучена самоконтролю гликемии. В настоящее время для самоконтроля уровня глюкозы крови рекомендуется применять глюкометры, предназначенные для персонального использования, в том числе с настройкой индивидуального целевого диапазона гликемии, а также передающие данные об уровне глюкозы на смартфон, откуда они могут быть использованы для удаленного мониторинга. Это особенно важно в начале терапии СД, когда пациент фактически адаптируется к новым условиям жизни. Будучи активным пользователем различных электронных устройств, пациентка выбрала глюкометр Контур Плюс Уан (Contour Plus One) с целью иметь возможность дистанционного общения с лечащим эндокринологом. Пациентку также привлекли наличие технологии «Второй шанс», позволяющей повторно измерить уровень глюкозы при помощи той же полоски (если первого образца крови недостаточно, вторую следует нанести в течение одной минуты), и легко читаемый дисплей с ночной подсветкой, надежность работы прибора в широких климатических условиях (жара, повышенная влажность ему не страшны). Лечащие врачи поддержали выбор пациентки, так как данная модель глюкометра выполняет коррекцию результата с учетом уровня гематокрита, обладает мультиимпульсной технологией, которая сканирует каплю крови несколько раз и выдает более точный результат, что было принципиально важно в данной клинической ситуации. Более того, больной было предложено пользоваться мобильным Приложением Контур Диабитис (Contour Diabetes) для составления отчета динамики показателей [11].
Через неделю терапии пациентка отметила существенное уменьшение одышки, улучшение переносимости физической нагрузки, масса тела уменьшилась на 5,5 кг, нормализовались гемодинамические показатели. Через 12 дней суммарное снижение массы тела составило 10 кг, уровень креатинина крови снизился до 128 мкмоль/л, мочевой кислоты – до 370 мкмоль/л.
К терапии добавлен блокатор рецепторов ангиотензина II в минимальной терапевтической дозе, антагонист альдостерона и петлевой диуретик в начальной дозе. К 19 суткам стационарного лечения масса тела снизилась на 12 кг, полностью разрешились отеки, гликемия при самоконтроле с помощью глюкометра была в пределах целевых значений, уровень натрийуретического пептида снизился в 2 раза, креатинина крови до 121 мкмоль/л.
После выписки пациентка продолжила прием препаратов, подобранных в клинике. Общее снижение массы тела составило 19 кг. Удавалось контролировать гемодинамические показатели, течение бронхиальной астмы, АСТ – 23 балла из 25 максимальных. Через 30 дней после ОПП достигнут целевой уровень мочевой кислоты (226,2 мкмоль/л), однако функция почек остается сниженной: креатинин 145 мкмоль/л, расчетная скорость клубочковой фильтрации (СКФ) 35,7 мл/мин/м2, сохраняются нарушения фосфорно-кальциевого обмена, вновь выявлена гипергликемия. Пациентка расширила диету, что, по-видимому, способствовало повышению уровня глюкозы крови. Эндокринологом рекомендован совместный с пациенткой контроль гликемии в зависимости от приемов пищи в Приложении Контур Диабитис. Рекомендовано продолжить проводимую терапию, ужесточить гипогликемическую диету. Через 2 недели отмечен стойкий уровень целевой гликемии. Пациентка положительно оценила возможность дистанционного наблюдения эндокринологом с помощью дистанционного Приложения [11]. С учетом персистирующего течения атопической бронхиальной астмы и высокой эозинофилии крови (0,93×109/л) планировалось назначение блокатора лейкотриеновых рецепторов.
Отсутствие данных об уровнях креатинина в крови, предшествующих острому почечному событию, не позволило констатировать полное разрешение ОПП. Наиболее вероятно, ОПП в данном случае развилось на фоне уже существующей ХБП. В пользу этого свидетельствует наличие факторов риска ХБП, таких как длительный стаж АГ, морбидное ожирение, СД 2-го типа, а также выявленные при первом обследовании нарушения фосфорно-кальциевого обмена (повышение уровня паратгормона и стойкая гиперфосфатемия, не разрешившаяся после улучшения функции почек), нормохромная, нормоцитарная анемия в сочетании
с УЗ-признаками нефропатии (обеднение почечного кровотока, диффузные изменения эхоструктуры обеих почек). Для точной диагностики наличия ХБП и ее стадии необходимо дальнейшее динамическое наблюдение. В то же время остается нерешенным вопрос о том, насколько острый эпизод способствовал дальнейшему снижению фильтрационной функции почек. Частично ответ будет получен при оценке результатов 3-месячного мониторирования почечных показателей. Важно учесть тот факт, что давность выявленного СД 2-го типа не известна. Очевидно, что длительно существовавшее морбидное ожирение, приверженность к быстро усвояемым углеводам, гиподинамия, бесконтрольный прием диуретиков уже давно способствовали формированию нарушения углеводного обмена [14].
Назначение адекватной терапии, контролирующей основные патологические процессы, позволило улучшить почечную функцию. Так, снижение массы тела, адекватный контроль астмы и АГ внесли вклад в уменьшение выраженности ишемического компонента хронической нефропатии, а нормализация уровней урикемии, гликемии, в свою очередь, способствовала минимизации метаболического компонента прогрессирования ХБП. Обращает на себя внимание быстрый эффект комбинированной ингаляционной терапии с применением больших доз глюкокортикоида и селективных бронходилататоров, что позволило купировать проявления астмы и уменьшить выраженность гипоксии [10]. Таким образом, задача предотвращения повторных эпизодов ОПП должна решаться контролем всех патологий, имеющихся у пациентки. Сложность настоящего клинического наблюдения заключается в сочетании патологий, каждая из которых представляет угрозу функции почек. Слаженная работа врачей различных специальностей – нефролога, пульмонолога, кардиолога и эндокринолога – помогла справиться с острой ситуацией, продемонстрировав уязвимость функции почек в условиях высокой коморбидности. Необходимо также подчеркнуть целесообразность ежегодного медицинского обследования, которое позволяет выявить в том числе СД и ХБП у пациентов, страдающих ожирением. Своевременные диагностика и лечение СД, АГ могли бы во многом улучшить «почечный» прогноз у нашей пациентки.
Заключение
Существуют неоспоримые аргументы для настороженности в отношении возможного нарушения почечной функции у пациентов различного профиля. Во-первых, дисфункция почек нередко встречается в популяции и клинической практике врача любой специальности, что определяется высокой частотой АГ, ожирения, ХСН, астмы, ХБП, СД и их сочетания. Во-вторых, почки представляют собой орган-мишень, повреждающийся при развитии и прогрессировании сердечно-сосудистых и метаболических заболеваний. Среди последних ведущая роль принадлежит СД любого типа. К сожалению, в рутинной практике нередко игнорируется очевидность расчета СКФ у пациентов не нефрологического профиля, несмотря на то, что даже банальное лечение сезонных острых инфекций, бронхита, не говоря уже о пневмониях, синдрома острой боли любого генеза без учета функции почек может привести к развитию ОПП. Принцип отечественной медицинской школы, заключающейся в интегральной оценке пациента, позволяет врачу любой специальности выявить или заподозрить АГ, СД – ведущие популяционные причины ухудшения функции почек. Рост распространенности СД во всем мире определяет настороженность врача в диагностике стойкой гипергликемии с одной стороны, а с другой, определяет необходимость учета влияния СД на течение коморбидной патологии. Учитывая большое количество ко- и полиморбидных пациентов, целесообразно призвать практикующих врачей включить в базовое обследование определение сывороточного креатинина с расчетом СКФ, гликемии, мочевой кислоты (при необходимости) и мониторирование этих показателей у пациентов при повторных обращениях. Это касается и организации ежегодной диспансеризации лиц, у которых врач общей практики может выявить признаки почечной дисфункции в обычных клинических проявлениях: уменьшение количества выделяемой мочи, наличие отеков лица, стоп, голеней, появление изменений в мочевом осадке, отрицательная динамика СКФ за время наблюдения, что позволит своевременно направить к профильному специалисту или обратиться за помощью к мультидисциплинарной команде врачей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Лебедева Марина Валерьевна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: marinaamica@mail.ru;
ORCID: 0000-0002-5923-1837
Marina V. Lebedeva – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: marinaamica@mail.ru; ORCID: 0000-0002-5923-1837
Камышова Елена Сергеевна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: kamyshova_e_s@staff.sechenov.ru;
ORCID: 0000-0002-1823-0125
Elena S. Kamyshova – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: kamyshova_e_s@staff.sechenov.ru;
ORCID: 0000-0002-1823-0125
Таранова Марина Владимировна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: mvtaranova@mail.ru;
ORCID: 0000-0002-7363-6195
Marina V. Taranova – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: mvtaranova@mail.ru; ORCID: 0000-0002-7363-6195
Бекетов Владимир Дмитриевич – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: beketov-vladimir@inbox.ru;
ORCID 0000-0002-6377-0630
Vladimir D. Beketov – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: beketov-vladimir@inbox.ru;
ORCID 0000-0002-6377-0630
Андреева Елена Юрьевна – канд. мед. наук, врач-нефролог отделения нефрологии Университетской клинической больницы №3, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: alena772004@mail.ru;
ORCID: 0009-0003-6188-1075
Elena Yu. Andreeva – Cand. Sci. (Med.), Nephrologist of the Department of Nephrology of the University Clinical Hospital No. 3, Sechenov First Moscow State Medical University (Sechenov University). E-mail: alena772004@mail.ru;
ORCID: 0009-0003-6188-1075
Поступила в редакцию: 12.02.2024
Поступила после рецензирования: 19.02.2024
Принята к публикации: 22.02.2024
Received: 12.02.2024
Revised: 19.02.2024
Accepted: 22.02.2024
Клинический разбор в общей медицине №1 2024
Клинический случай Острое повреждение почек у полиморбидных пациентов
Номера страниц в выпуске:7-12
Аннотация
В представленном клиническом наблюдении показана роль мультидисциплинарной команды врачей в терапии острого повреждения почек (ОПП) у пациентки, страдающей бронхиальной астмой и метаболическим синдромом (морбидное ожирение, артериальная гипертензия, сахарный диабет 2-го типа). Продемонстрировано значение коррекции метаболических нарушений (диета, самоконтроль гликемии, урат- и сахароснижающая терапия) как в рамках комплексной терапии ОПП, так и для профилактики/замедления дальнейшего повреждения почек.
Ключевые слова: острое повреждение почек, морбидное ожирение, гиперурикемия, полиморбидный пациент, контроль гликемии.
Для цитирования: Лебедева М.В., Камышова Е.С., Таранова М.В., Бекетов В.Д., Андреева Е.Ю. Острое повреждение почек у полиморбидных пациентов. Клинический разбор в общей медицине. 2024; 5 (1): 7–12. DOI: 10.47407/kr2023.5.1.00352
В представленном клиническом наблюдении показана роль мультидисциплинарной команды врачей в терапии острого повреждения почек (ОПП) у пациентки, страдающей бронхиальной астмой и метаболическим синдромом (морбидное ожирение, артериальная гипертензия, сахарный диабет 2-го типа). Продемонстрировано значение коррекции метаболических нарушений (диета, самоконтроль гликемии, урат- и сахароснижающая терапия) как в рамках комплексной терапии ОПП, так и для профилактики/замедления дальнейшего повреждения почек.
Ключевые слова: острое повреждение почек, морбидное ожирение, гиперурикемия, полиморбидный пациент, контроль гликемии.
Для цитирования: Лебедева М.В., Камышова Е.С., Таранова М.В., Бекетов В.Д., Андреева Е.Ю. Острое повреждение почек у полиморбидных пациентов. Клинический разбор в общей медицине. 2024; 5 (1): 7–12. DOI: 10.47407/kr2023.5.1.00352
Clinical Case Acute kidney injury in polymorbid patients
Marina V. Lebedeva, Elena S. Kamyshova, Marina V. Taranova, Vladimir D. Beketov,Elena Yu. Andreeva
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
marinaamica@mail.ru
Abstract
The presented clinical observation shows the role of a multidisciplinary team of doctors in the treatment of acute kidney injury (AKI) in a patient suffering from bronchial asthma and metabolic syndrome (morbid obesity, arterial hypertension, type 2 diabetes mellitus). The importance of correcting metabolic disorders (diet, self-monitoring of glycemia, urate- and glucose-lowering therapy) has been demonstrated both as part of the complex therapy of AKI and for the prevention/slowing of further kidney damage.
Keywords: acute kidney injury, morbid obesity, hyperuricemia, multimorbid patient, glycemic control.
For citation: Lebedeva M.V., Kamyshova E.S., Taranova M.V., Beketov V.D., Andreeva E.Y. Acute kidney injury in polymorbid patients. Clinical review for general practice. 2024; 5 (1): 7–12 (In Russ.). DOI: 10.47407/kr2023.5.1.00352
Острое повреждение почек (ОПП) – это часто встречающееся полиэтиологическое состояние, с которым в повседневной клинической практике может встретиться врач любой специальности. Современные клинические рекомендации определяют ОПП как «патологическое состояние, развивающееся в результате непосредственного острого воздействия ренальных и/или экстраренальных повреждающих факторов, продолжающееся до 7 суток и характеризующееся быстрым (часы-дни) развитием признаков повреждения или дисфункции почек различной степени выраженности» [1]. Если ОПП не разрешилось в течение 7 дней, наступает стадия острой болезни почек, которая продолжается до 90 суток и в дальнейшем может трансформироваться в хроническую болезнь почек (ХБП), т.е. ОПП может являться частью своеобразного патологического континуума повреждения почек [1].
В клинической практике ОПП диагностируют при наличии хотя бы одного из трех следующих критериев:
1) нарастание уровня креатинина в сыворотке крови (сКр) ≥0,3 мг/дл (≥26,5 мкмоль/л) в течение 48 ч, или 2) нарастание сКр ≥1,5 раза от исходного, которое, как известно или предполагается, произошло в течение 7 суток, или 3) темп диуреза <0,5 мл/кг/ч в течение 6 ч [1, 2]. Степень тяжести ОПП определяют согласно критериям KDIGO 2012 г. (табл. 1).

Причины ОПП разнообразны, в зависимости от патогенеза их подразделяют на связанные с 1) гипоперфузией почек (преренальные), 2) прямым повреждением основных компартментов органа – внутрипочечных сосудов, клубочков, канальцев и интерстиция (ренальные), 3) постренальной обструкцией тока мочи (постренальные) [1, 2]. В ряде случаев механизмы развития ОПП при повреждении разных структур почки могут пересекаться, в связи с чем не всегда возможно четко дифференцировать патогенетические варианты ОПП.
Этиология ОПП определяет ее эпидемиологию. Так, распространенность ОПП зависит от того, на каком этапе оно развивается: догоспитальном или в стационаре («внебольничное» или «внутрибольничное» ОПП соответственно). По данным когортного исследования, включавшего 50 835 взрослых жителей Великобритании, частота выявления ОПП составила 9%, при этом на долю внебольничного и внутрибольничного ОПП пришлось 38,9% и 61,1% случаев соответственно [3]. Госпитализация потребовалась 22,9% амбулаторных пациентов. Тридцатидневная смертность была максимальной у пациентов с внутрибольничным ОПП и у пациентов с внебольничным ОПП, которым потребовалась госпитализация (24,2% и 20,2% соответственно по сравнению с 2,6% у амбулаторно наблюдаемых пациентов с внебольничным ОПП) [3]. В этиологической структуре наиболее распространенными причинами внутрибольничного ОПП являются сепсис, пневмония, сердечно-сосудистые заболевания [4]. Пандемия COVID-19 также показала высокую частоту диагностики ОПП у госпитализированных пациентов с преобладанием поражения почек у коморбидных и полиморбидных пациентов: в крупных отечественных и зарубежных когортных исследованиях этот показатель составил 38–46% [5, 6]. В последние годы растет частота ятрогенных ОПП, в связи с чем большое значение приобретает оценка факторов риска и ассоциированных с ОПП состояний. В качестве факторов риска рассматривают возраст ≥65 лет и мужской пол, наличие гиповолемии, артериальной гипотензии, прием блокаторов ренин-ангиотензин-альдостероновой системы, нестероидных противовоспалительных средств, мочегонных, а под ассоциированными состояниями понимают наличие предсуществующих заболеваний, таких как ХБП, артериальная гипертония (АГ), сахарный диабет (СД), хроническая сердечная недостаточность (ХСН), двусторонний стеноз почечных артерий [1]. Наличие ожирения высоких градаций, хронической анемии, неконтролируемой гипергликемии, фактически не выявленного своевременно СД, возраст старше 50 лет также определяют высокий риск развития ОПП [1, 2, 7]. Кроме того, ОПП нередко осложняет течение ХБП (регистрируется у 45–55% пациентов с ХБП), что может способствовать прогрессированию почечной недостаточности [4].
Таким образом, пациенты с ОПП или высоким риском его развития могут встретиться в повседневной практике врача любой специальности, а значит, важна настороженность в плане своевременной диагностики этого состояния, а также представление о его профилактике и лечении [1, 3, 8, 9].
Клиническое наблюдение
Пациентка Н., 52 лет, менеджер, поступила в общетерапевтическую клинику в связи с выраженной одышкой при минимальной физической нагрузке, усилением непродуктивного кашля, повторными приступами удушья в течение дня, снижением количества выделяемой мочи до менее 1 л в сутки в течение последней недели, отеками лица, стоп, голеней, увеличением объема живота, выраженной слабостью.В анамнезе многолетняя бронхиальная астма с преобладанием аллергического компонента с базовым лечением коротко действующими бронходилататорами до 14 доз в сутки, морбидное ожирение (индекс массы тела – ИМТ 50,7 кг/м2), пиквикский синдром с выраженной дневной сонливостью, эпизодами непреднамеренного засыпания в период работы с документами, артериальная гипертензия, по поводу которой проводилась терапия блокатором рецепторов ангиотензина II, недигидропиридиновым антагонистом кальциевых каналов, агонистом I1-имидазолиновых рецепторов и петлевым диуретиком. В течение месяца до госпитализации пациентка отметила наличие никтурии на фоне
постепенного общего уменьшения количества выделяемой за сутки мочи, в связи с чем самостоятельно увеличила дозу петлевого диуретика (суточная доза превышала терапевтическую), однако явный мочегонный эффект отсутствовал. Обращала на себя внимание крайне высокая потребность пациентки в применении короткодействующих β2-агонистов для уменьшения одышки и кашля, за последние 2 года ежедневное количество ингаляций достигало 9–14 в сутки, что приносило лишь кратковременное облегчение симптомов. Согласно тесту контроля астмы (АСТ – Asthma Control Test) сохранялась высокая активность заболевания [10]. Пациентке требовалось не менее 20 мин для преодоления расстояния в 400 м с остановками. В анализах, сданных за 3 дня до госпитализации, отмечалось повышение уровней в крови креатинина, мочевины, мочевой кислоты (табл. 2). В день госпитализации пациентка выделила около 300 мл мочи к 17.00.

При объективном осмотре: состояние средней тяжести, стабильное. Тяжесть состояния обусловлена наличием дыхательной недостаточности, астенического синдрома. Пациентка могла находиться только в положении ортопноэ. Сознание ясное, ориентирована правильно. Частота дыхания 20 в минуту, сатурация кислорода, определенная методом пульсоксиметрии, – 90%, при минимальной физической нагрузке – 87–88%, температура тела нормальная, значительное абдоминальное ожирение. Кожные покровы обычной окраски, суховаты, теплые. Отеки лица, стоп, голеней неплотные. Над легкими дыхание везикулярное, выдох удлинен, значительно ослаблено в базальных отделах, масса сухих рассеянных свистящих хрипов с обеих сторон. Артериальное давление (АД) 160/100 мм рт. ст., тахикардия до 98 в минуту. Сердечные тоны незначительно приглушены, ритмичные. Акцент второго тона над клапаном легочной артерии. Со стороны других органов и систем без особенностей.
Во время сбора анамнеза была инициирована кислородная поддержка через назальные канюли – 75% со скоростью потока 3–5 л/мин. Через час пациентка без мочегонных выделила 600 мл мочи, объем выпитой жидкости к этому времени составил 550 мл.
В анализах при поступлении: повышение уровней креатинина, мочевины, мочевой кислоты, фосфора, глюкозы, гликированного гемоглобина, N-терминального мозгового натрийуретического пептида в крови, нормохромная, нормоцитарная анемия (см. табл. 2).
Диагностировано ОПП сложного генеза (сочетание преренального и ренального), в качестве причин которого обсуждались нарушение перфузии почек с развитием ишемии в результате декомпенсации ХСН, АГ и хронической гипоксии, обусловленной обострением бронхиальной астмы и морбидным ожирением, а также влияние вторичной гиперурикемии и, возможно, лекарственного поражения почек (прием высоких доз петлевого диуретика). С учетом полученных результатов была начата терапия ингибитором ксантиноксидазы в малых терапевтических дозах, продолжена кислородотерапия в прежнем режиме, инициирована тройная ингаляторная терапия бронхиальной астмы (ингаляционный глюкокортикостероид в высокой дозе, β2-агонист и м-холиноблокатор суточного действия). Принимая во внимание положительный спонтанный диурез (+0,8–1,2 л), низконормальные уровни АД, от назначения мочегонных было решено воздержаться, с целью коррекции АГ назначен кардиоселективный
β-блокатор в сочетании с минимальной дозой агониста I1-имидазолиновых рецепторов.
Пациентке рекомендовали ограничить количество жидкости до 1,5 л жидкости в сутки, из которых половину должна оставлять простая вода, соблюдать диету с ограничением поваренной соли, простых углеводов, белка до 0,8 г/кг массы тела в сутки, продуктов, богатых пуриновыми основаниями, фосфатами.
Через 4 дня отмечена положительная динамика показателей функции почек (см. табл. 2), пациентка полностью отказалась от применения коротко действующих бронходилататоров.
Выявление выраженной легочной гипертензии 2–3-й степени (систолическое давление в легочной артерии 62 мм рт. ст.), дилатации полостей обоих предсердий и правого желудочка требовало исключения тромбоэмболии легочной артерии (ТЭЛА), в связи с чем выполнена перфузионная сцинтиграфия легких, не выявившая очаговых перфузионных изменений легких, характерных для ТЭЛА, и шунта справа-налево, однако наличие при компьютерной томографии двух субсегментарных фиброателектазов, единичных рассеянных мелких кальцинатов в легких позволило обсуждать хроническую ТЭЛА, генез которой в настоящее время не ясен и требует уточнения (данных, подтверждающих антифосфолипидный синдром, заподозренный с учетом раннего начала АГ и осложненного акушерского анамнеза, не получено).
На основании повышенных значений гликированного гемоглобина до 7,8% и гликемии натощак
8,0 ммоль/л диагностирован СД 2-го типа, впервые выявленный. Принимая во внимание нормализацию уровней глюкозы в крови на фоне коррекции питания, от назначения инсулинотерапии воздержались, назначен ингибитор дипептидилпептидазы-4.
В течение госпитализации пациентке была подобрана диета, она была обучена самоконтролю гликемии. В настоящее время для самоконтроля уровня глюкозы крови рекомендуется применять глюкометры, предназначенные для персонального использования, в том числе с настройкой индивидуального целевого диапазона гликемии, а также передающие данные об уровне глюкозы на смартфон, откуда они могут быть использованы для удаленного мониторинга. Это особенно важно в начале терапии СД, когда пациент фактически адаптируется к новым условиям жизни. Будучи активным пользователем различных электронных устройств, пациентка выбрала глюкометр Контур Плюс Уан (Contour Plus One) с целью иметь возможность дистанционного общения с лечащим эндокринологом. Пациентку также привлекли наличие технологии «Второй шанс», позволяющей повторно измерить уровень глюкозы при помощи той же полоски (если первого образца крови недостаточно, вторую следует нанести в течение одной минуты), и легко читаемый дисплей с ночной подсветкой, надежность работы прибора в широких климатических условиях (жара, повышенная влажность ему не страшны). Лечащие врачи поддержали выбор пациентки, так как данная модель глюкометра выполняет коррекцию результата с учетом уровня гематокрита, обладает мультиимпульсной технологией, которая сканирует каплю крови несколько раз и выдает более точный результат, что было принципиально важно в данной клинической ситуации. Более того, больной было предложено пользоваться мобильным Приложением Контур Диабитис (Contour Diabetes) для составления отчета динамики показателей [11].
Через неделю терапии пациентка отметила существенное уменьшение одышки, улучшение переносимости физической нагрузки, масса тела уменьшилась на 5,5 кг, нормализовались гемодинамические показатели. Через 12 дней суммарное снижение массы тела составило 10 кг, уровень креатинина крови снизился до 128 мкмоль/л, мочевой кислоты – до 370 мкмоль/л.
К терапии добавлен блокатор рецепторов ангиотензина II в минимальной терапевтической дозе, антагонист альдостерона и петлевой диуретик в начальной дозе. К 19 суткам стационарного лечения масса тела снизилась на 12 кг, полностью разрешились отеки, гликемия при самоконтроле с помощью глюкометра была в пределах целевых значений, уровень натрийуретического пептида снизился в 2 раза, креатинина крови до 121 мкмоль/л.
После выписки пациентка продолжила прием препаратов, подобранных в клинике. Общее снижение массы тела составило 19 кг. Удавалось контролировать гемодинамические показатели, течение бронхиальной астмы, АСТ – 23 балла из 25 максимальных. Через 30 дней после ОПП достигнут целевой уровень мочевой кислоты (226,2 мкмоль/л), однако функция почек остается сниженной: креатинин 145 мкмоль/л, расчетная скорость клубочковой фильтрации (СКФ) 35,7 мл/мин/м2, сохраняются нарушения фосфорно-кальциевого обмена, вновь выявлена гипергликемия. Пациентка расширила диету, что, по-видимому, способствовало повышению уровня глюкозы крови. Эндокринологом рекомендован совместный с пациенткой контроль гликемии в зависимости от приемов пищи в Приложении Контур Диабитис. Рекомендовано продолжить проводимую терапию, ужесточить гипогликемическую диету. Через 2 недели отмечен стойкий уровень целевой гликемии. Пациентка положительно оценила возможность дистанционного наблюдения эндокринологом с помощью дистанционного Приложения [11]. С учетом персистирующего течения атопической бронхиальной астмы и высокой эозинофилии крови (0,93×109/л) планировалось назначение блокатора лейкотриеновых рецепторов.
Обсуждение
Представленное клиническое наблюдение отражает развитие ОПП у пациентки с высокой коморбидностью – ситуация, нередко встречающаяся в практике врача любой специальности [1–14]. Генез ОПП у нашей пациентки многофакторный, в качестве ведущего механизма обсуждается нарушение гемодинамики с развитием ишемии почек в рамках декомпенсации ХСН, АГ и хронической дыхательной недостаточности, обусловленной обострением бронхиальной астмы, легочной гипертензией, пиквикским синдромом, впервые выявленным СД, сопровождающимися хронической гипоксией. В пользу этого механизма свидетельствует быстрая положительная динамика показателей функции почек на фоне коррекции АД, отечного синдрома, в том числе нарастание диуреза и нормализация АД практически сразу после начала кислородотерапии без применения мочегонных. Дополнительным усугубляющим фактором, очевидно, послужила гиперурикемия, спровоцированная бесконтрольным приемом мочегонных по поводу тяжелого отечного синдрома. Наиболее частым поражением почек на фоне остро развившейся гиперурикемии является острая уратная нефропатия (острая мочекислая блокада), как правило, проявляющаяся олиго/анурией, болями в поясничной области с макрогематурией и дизурией, гипертоническим кризом [12]. Кроме того, гиперурикемия способствует активации внутрипочечной ренин-ангиотензиновой системы и циклооксигеназы 2, что в результате приводит к изменению внутриклубочковой гемодинамики и развитию почечной АГ [13]. Несомненно, важное значение в патогенезе повреждения почек как острого, так и хронического сыграла ранее не выявленная гипергликемия, фактически сформированный СД 2-го типа.Отсутствие данных об уровнях креатинина в крови, предшествующих острому почечному событию, не позволило констатировать полное разрешение ОПП. Наиболее вероятно, ОПП в данном случае развилось на фоне уже существующей ХБП. В пользу этого свидетельствует наличие факторов риска ХБП, таких как длительный стаж АГ, морбидное ожирение, СД 2-го типа, а также выявленные при первом обследовании нарушения фосфорно-кальциевого обмена (повышение уровня паратгормона и стойкая гиперфосфатемия, не разрешившаяся после улучшения функции почек), нормохромная, нормоцитарная анемия в сочетании
с УЗ-признаками нефропатии (обеднение почечного кровотока, диффузные изменения эхоструктуры обеих почек). Для точной диагностики наличия ХБП и ее стадии необходимо дальнейшее динамическое наблюдение. В то же время остается нерешенным вопрос о том, насколько острый эпизод способствовал дальнейшему снижению фильтрационной функции почек. Частично ответ будет получен при оценке результатов 3-месячного мониторирования почечных показателей. Важно учесть тот факт, что давность выявленного СД 2-го типа не известна. Очевидно, что длительно существовавшее морбидное ожирение, приверженность к быстро усвояемым углеводам, гиподинамия, бесконтрольный прием диуретиков уже давно способствовали формированию нарушения углеводного обмена [14].
Назначение адекватной терапии, контролирующей основные патологические процессы, позволило улучшить почечную функцию. Так, снижение массы тела, адекватный контроль астмы и АГ внесли вклад в уменьшение выраженности ишемического компонента хронической нефропатии, а нормализация уровней урикемии, гликемии, в свою очередь, способствовала минимизации метаболического компонента прогрессирования ХБП. Обращает на себя внимание быстрый эффект комбинированной ингаляционной терапии с применением больших доз глюкокортикоида и селективных бронходилататоров, что позволило купировать проявления астмы и уменьшить выраженность гипоксии [10]. Таким образом, задача предотвращения повторных эпизодов ОПП должна решаться контролем всех патологий, имеющихся у пациентки. Сложность настоящего клинического наблюдения заключается в сочетании патологий, каждая из которых представляет угрозу функции почек. Слаженная работа врачей различных специальностей – нефролога, пульмонолога, кардиолога и эндокринолога – помогла справиться с острой ситуацией, продемонстрировав уязвимость функции почек в условиях высокой коморбидности. Необходимо также подчеркнуть целесообразность ежегодного медицинского обследования, которое позволяет выявить в том числе СД и ХБП у пациентов, страдающих ожирением. Своевременные диагностика и лечение СД, АГ могли бы во многом улучшить «почечный» прогноз у нашей пациентки.
Заключение
Существуют неоспоримые аргументы для настороженности в отношении возможного нарушения почечной функции у пациентов различного профиля. Во-первых, дисфункция почек нередко встречается в популяции и клинической практике врача любой специальности, что определяется высокой частотой АГ, ожирения, ХСН, астмы, ХБП, СД и их сочетания. Во-вторых, почки представляют собой орган-мишень, повреждающийся при развитии и прогрессировании сердечно-сосудистых и метаболических заболеваний. Среди последних ведущая роль принадлежит СД любого типа. К сожалению, в рутинной практике нередко игнорируется очевидность расчета СКФ у пациентов не нефрологического профиля, несмотря на то, что даже банальное лечение сезонных острых инфекций, бронхита, не говоря уже о пневмониях, синдрома острой боли любого генеза без учета функции почек может привести к развитию ОПП. Принцип отечественной медицинской школы, заключающейся в интегральной оценке пациента, позволяет врачу любой специальности выявить или заподозрить АГ, СД – ведущие популяционные причины ухудшения функции почек. Рост распространенности СД во всем мире определяет настороженность врача в диагностике стойкой гипергликемии с одной стороны, а с другой, определяет необходимость учета влияния СД на течение коморбидной патологии. Учитывая большое количество ко- и полиморбидных пациентов, целесообразно призвать практикующих врачей включить в базовое обследование определение сывороточного креатинина с расчетом СКФ, гликемии, мочевой кислоты (при необходимости) и мониторирование этих показателей у пациентов при повторных обращениях. Это касается и организации ежегодной диспансеризации лиц, у которых врач общей практики может выявить признаки почечной дисфункции в обычных клинических проявлениях: уменьшение количества выделяемой мочи, наличие отеков лица, стоп, голеней, появление изменений в мочевом осадке, отрицательная динамика СКФ за время наблюдения, что позволит своевременно направить к профильному специалисту или обратиться за помощью к мультидисциплинарной команде врачей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Лебедева Марина Валерьевна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: marinaamica@mail.ru;
ORCID: 0000-0002-5923-1837
Marina V. Lebedeva – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: marinaamica@mail.ru; ORCID: 0000-0002-5923-1837
Камышова Елена Сергеевна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: kamyshova_e_s@staff.sechenov.ru;
ORCID: 0000-0002-1823-0125
Elena S. Kamyshova – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: kamyshova_e_s@staff.sechenov.ru;
ORCID: 0000-0002-1823-0125
Таранова Марина Владимировна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: mvtaranova@mail.ru;
ORCID: 0000-0002-7363-6195
Marina V. Taranova – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: mvtaranova@mail.ru; ORCID: 0000-0002-7363-6195
Бекетов Владимир Дмитриевич – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: beketov-vladimir@inbox.ru;
ORCID 0000-0002-6377-0630
Vladimir D. Beketov – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: beketov-vladimir@inbox.ru;
ORCID 0000-0002-6377-0630
Андреева Елена Юрьевна – канд. мед. наук, врач-нефролог отделения нефрологии Университетской клинической больницы №3, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: alena772004@mail.ru;
ORCID: 0009-0003-6188-1075
Elena Yu. Andreeva – Cand. Sci. (Med.), Nephrologist of the Department of Nephrology of the University Clinical Hospital No. 3, Sechenov First Moscow State Medical University (Sechenov University). E-mail: alena772004@mail.ru;
ORCID: 0009-0003-6188-1075
Поступила в редакцию: 12.02.2024
Поступила после рецензирования: 19.02.2024
Принята к публикации: 22.02.2024
Received: 12.02.2024
Revised: 19.02.2024
Accepted: 22.02.2024
Список исп. литературыСкрыть список1. Острое повреждение почек. Клинические рекомендации. М., 2020. URL: https://rusnephrology.org/wp-content/uploads/2020/12/AKI_final.pdf
Acute renal damage. Clinical guidelines in Russian. Moscow, 2020. URL: https://rusnephrology.org/wp-content/uploads/2020/12/AKI_ final.pdf (in Russian).
2. Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012;120(4):c179-c184. DOI: 10.1159/000339789
3. Sawhney S, Fluck N, Fraser SD et al. KDIGO-based acute kidney injury criteria operate differently in hospitals and the community-findings from a large population cohort. Nephrol Dial Transplant. 2016;31(6):922-9. DOI: 10.1093/ndt/gfw052
4. Zeng X, McMahon GM, Brunelli SM et al. Incidence, outcomes, and comparisons across definitions of AKI in hospitalized individuals. Clin J Am Soc Nephrol. 2014;9(1):12-20. DOI: 10.2215/CJN.02730313
5. Shchepalina A, Chebotareva N, Akulkina L et al. Acute Kidney Injury in Hospitalized Patients with COVID-19: Risk Factors and Serum Biomarkers. Biomedicines. 2023;11(5):1246. DOI: 10.3390/biomedicines11051246
6. Chan L, Chaudhary K, Saha A et al. AKI in Hospitalized Patients with COVID-19. J Am Soc Nephrol. 2021;32(1):151-60. DOI: 10.1681/ASN. 2020050615
7. James MT, Levey AS, Tonelli M et al. Incidence and prognosis of acute kidney diseases and disorders using an integrated approach to laboratory measurements in a universal health care system. JAMA Netw Open. 2019;2:e191795. DOI: 10.1001/jamanetworkopen.2019.1795
8. Kwiatkowska E, Kwiatkowski S, Dziedziejko V et al. Renal Microcirculation Injury as the Main Cause of Ischemic Acute Kidney Injury Development. Biology (Basel). 2023;12(2):327. DOI: 10.3390/ biology12020327
9. Ostermann M, Zarbock A, Goldstein S et al. Recommendations on Acute Kidney Injury Biomarkers From the Acute Disease Quality Initiative Consensus Conference: A Consensus Statement [published correction appears in JAMA Netw Open. 2020;3(11):e2029182]. JAMA Netw Open. 2020;3(10):e2019209. DOI: 10.1001/jamanetworkopen.2020. 19209
10. Чучалин А.Г., Авдеев С.Н., Айсанов З.Р. и др. Бронхиальная астма: федеральные клинические рекомендации по диагностике и лечению. Пульмонология. 2022;32(3):393-447. DOI: 10.18093/0869-0189-2022-32-3-393-447.
Chuchalin A.G., Avdeev S.N., Aisanov Z.R. et al. Federal guidelines on diagnosis and treatment of bronchial asthma. Pulmonologiya. 2022;32(3):393-447. DOI: 10.18093/0869-0189-2022-32-3-393-447 (in Russian).
11. Приложение Контур Диабитис (CONTOUR DIABETES)
https://www.diabetes.ascensia.com.ru/products/contour-diabetes-app/
Application Contour Diabitis in Russian. https://www.diabetes.ascensia.com.ru/products/contour-diabetes-app/ (in Russian).
12. Милованов Ю.С., Николаев А.Ю. Нарушения пуринового обмена и подагрическая нефропатия. Лечащий врач. 2006;10:54-7
Milovanov Yu.S., Nikolaev A.Yu. Purine metabolism disorders and gouty nephropathy. Lvrach.ru. 2006;10:54-7 (in Russian).
13. Kang DH, Nakagawa T, Feng L et al. A role for uric acid in the progression of renal disease. J Am Soc Nephrol. 2002;13(12):2888-97. DOI: 10.1097/01.asn.0000034910.58454.fd
14. Дедов И.И., Шестакова М.В., Галстян Г.Р. Распространенность сахарного диабета 2 типа у взрослого населения России (исследование NATION). Сахарный диабет. 2016;19(2):104-12
Dedov II, Shestakova MV, Galstyan GR. The prevalence of type 2 diabetes mellitus in the adult population of Russia (NATION study). Diabetes Mellitus. 2016;19(2):104-12 (In Russian.).


