Клинический разбор в общей медицине №1 2024
Nikita A. Usachev4
1 Omsk State Medical University, Omsk, Russia;
2 Omsk region "Clinical Diagnostic Center", Omsk, Russia;
3 Omsk region "City Clinical Emergency Hospital No.2", Omsk, Russia;
4 Omsk region "City polyclinic No.4", Omsk, Russia
elenav.usacheva@yandex.ru
Abstract
Comorbid pathology in therapeutic practice is difficult to diagnose, because it often has a complex clinical picture, atypical dynamics of the course of diseases, including those changing under the influence of ongoing therapy. The polysystemic nature of the lesion with an uneven degree of pathological damage to organs and systems can obscure the underlying disease when its symptoms are accepted as a separate disease. At the same time, the insufficient effectiveness of the therapy should make you think about other causes of the pathological process, suspect autoimmune, oncological and rare congenital or genetically determined diseases and syndromes.
Keywords: dermatopolymiositis, interstitial lung diseases, pneumonitis, panniculitis, comorbid pathology, polysystemic lesions.
For citation: Usacheva E.V., Gizatulina O.N., Dubrovskaya I.I., Nadey E.V., Usachev N.A. Therapeutic comorbidity – combination of dermatopolymiositis and Weber-Christian panniculitis: a difficult path to diagnosis. Clinical review for general practice. 2024; 5 (1): 13–19 (In Russ.). DOI: 10.47407/kr2023.5.1.00353
Первые публикации о дерматомиозите появились в научной литературе в 1784 г. Так, в публикации
W.R. Steiner [2] дерматомиозит определен как острое, подострое или хроническое заболевание неизвестного происхождения, характеризующееся постепенным началом с расплывчатыми и неопределяемыми продромами, за которыми следуют отек, дерматит и множественное воспаление. Данным автором приведено описание 28 клинических случаев, в 14 (50%) из которых были обнаружены признаки поражения бронхолегочной системы в виде бронхита и/или бронхопневмонии, послужившей в 8 случаях причиной смерти этих пациентов. Со времен первого литературного обзора, посвященного дерматомиозиту, понимание этой болезни практически не изменилось.
Поражение легких у пациентов с дерматомиозитом может проявляться в форме гиповентиляции, аспирационной пневмонии или интерстициального заболевания легких. Аспирационная пневмония у пациентов с миопатиями возникает в силу слабости дыхательных мышц и относится к крайне редким состояниям с высоким уровнем смертности. Интерстициальное поражение легочной ткани имеется у 36,6% пациентов с дерматомиозитом и является одним из наиболее распространенных внемышечных проявлений всех видов идиопатических воспалительных миопатий [3–5]. Интерстициальное поражение легочной ткани может возникать до, во время и после кожных или мышечных проявлений, характеризуется резистентностью к традиционной глюкокортикоидной терапии и неблагоприятным клиническим прогнозом.
При дерматомиозите наблюдается поражение кожи, которое служит патогномоничным признаком данного состояния. Одним из редких кожных проявлений при этой патологии является панникулит [6].
Нами представлен клинический случай дерматомиозита, основным проявлением которого было интерстициальное поражение легких в сочетании с панникулитом.
Анамнез заболевания: считает себя больной с мая 2015 г., когда впервые без каких-либо значимых провоцирующих факторов появились фебрильная температура и инспираторная одышка, что заставило через 4 дня самостоятельного лечения обратиться за медицинской помощью к участковому врачу-терапевту, по направлению которого с диагнозом «пневмония» была направлена в пульмонологическое отделение многопрофильного стационара, где был установлен диагноз двустороння полисегментарная пневмония, тяжелое течение, осложненная правосторонним экссудативным плевритом. В стационаре проведена плевральная пункция, назначена антибактериальная терапия. По данным лабораторных исследований, наблюдалась лейкопения (3×109/л) и цитолиз, превышающий норму в 8 раз. На фоне лечения получена положительная динамика, выписана на амбулаторное долечивание с открытым листком нетрудоспособности с диагнозом: внегоспитальная двусторонняя пневмония, осложнившаяся правосторонним экссудативным плевритом, постпневмонический двусторонний пневмофиброз, дыхательная недостаточность 1-й степени. Через 3 нед в связи с ухудшением самочувствия возникла необходимость в повторной госпитализации по неотложной помощи с теми же симптомами; в стационаре с учетом рецидивирующего плеврита была проведена торакоскопия с биопсией плевры – данных, подтверждающих онкологический процесс, не выявлено, описание гистологического исследования от 2015 г. не сохранилось. Проведен курс антибактериальной терапии, выписана на амбулаторное лечение с положительным эффектом, однако в связи с выраженной слабостью и одышкой к труду не приступила, с работы уволилась.
В 2016 г. на фоне сохраняющейся инспираторной одышки и общей слабости стала отмечать субфебрилитет, рентгенологически сохранялись выраженные изменения легочной ткани в виде выраженного двустороннего пневмофиброза, в связи с чем пациентка обследовалась у врача-фтизиатра – данных, подтверждающих туберкулез, не получено. Весной 2016 г. впервые появился несимметричный параорбитальный отек мягких тканей лица, терапевтом была направлена к врачу-офтальмологу. При осмотре врачом-офтальмологом был выставлен диагноз «реактивный отек», симптомы которого купировались на фоне дипроспана. Через 2 нед отек рецидивировал, в связи с чем была направлена к врачу-ревматологу, которым был назначен короткий курс метипреда в дозе 8 мг/сут 7 дней с кратковременным эффектом: отек был снова купирован, но через 2–4 нед он появлялся вновь, в связи с чем пациентка самостоятельно короткими курсами с положительным, но нестойким эффектом, принимала метипред или супрастин.
С 2016 г. пациентка стала отмечать постепенное снижение массы тела на фоне сохранного аппетита и привычного объема пищи. За 4 года снижение массы тела составило 17 кг. С учетом сохраняющегося субфебрилитета и спленомегалии (по результатам ультразвукового исследования органов брюшной полости – селезенка 55 см3), сохраняющейся лейкопении и цитолиза (трансаминазы в 5 раз выше нормы) была осмотрена врачом-гематологом, проведена пункция костного мозга, но данных, подтверждающих гемобластоз, не получено.
В 2017 г. за медицинской помощью не обращалась, занималась надомным трудом (швея).
В мае 2018 г. по поводу возникновения очага стойкой ограниченной отечности кожи на границе лобной, височной и параорбитальной области слева была госпитализирована в хирургическое отделение, где было проведено малоинвазивное хирургическое лечение, по данным гистологического исследования биопсийного материала был установлен диагноз «эпидермальная киста», которая была удалена, проведен курс антибактериальной терапия. В стационаре в раннем послеоперационном периоде возник параорбитальный отек мягких тканей с обеих сторон, лечащим врачом был выставлен диагноз «отек Квинке», который был купирован применением дипроспана. После выписки обследовалась у врача-аллерголога-иммунолога, при лабораторном обследовании показатели трансаминаз были в норме, однако было выявлено однократное повышение уровня креатинкиназы (КФК) и лактатдегидрогеназы (ЛДГ), анализных бланков не сохранилось.
В январе 2019 г. – ухудшение самочувствия в виде усиления одышки и общей слабости, снижения толерантности к бытовым физическим нагрузкам, появления фебрильной лихорадки, по поводу чего была вновь госпитализирована в пульмонологическое отделение, где проводилось лечение с диагнозом «внебольничная двусторонняя полисегментарная пневмония». В крови сохранялась умеренная лейкопения, цитолиз 1-й степени активности, повышение уровня антистрептолизина-О; по данным компьютерной томографии органов грудной клетки (КТ ОГК) – выраженные двусторонние интерстициальные изменения легких, интерпретированные рентгенологом как поствоспалительный пневмофиброз в исходе двусторонней пневмонии, осложненной экссудативным плевритом (2015 г., 2019 г.). Проводилась антибактериальная терапия, выписана с положительной динамикой, рекомендован КТ ОГК-контроль.
Через 10 мес, по данным контрольной КТ ОГК, выявлены признаки поствоспалительных фиброзных изменений в нижней доле правого легкого, небольшого осумкованного правостороннего плеврита, состояние после видеоторакоскопии справа, признаки хронического бронхита, легочной гипертензии. Клинически у пациентки сохранялись признаки хронической дыхательной недостаточности 2-й степени.
С учетом визуально выявленной выраженной гипотрофии мышц верхнего плечевого пояса пациентка была направлена на электронейромиографию мышц данной анатомической области, по результатам которой (23 декабря 2019 г.) выявлено первично-мышечное поражение, в связи с чем для установления причины миопатии проведено иммунологическое исследование (23 января 2020 г.): антитела к нуклеосомам – negative, антитела к дс-ДНК (нативная) – negative, антитела к гистонам – negative, антитела к антигену Смит (Sm) – ne-gative, антитела Sm/RNP комплексу – negative, антителаSS-A/Ro 60kD антигену – negative, антителаSS-A/Ro 52 kD антигену – negative, антитела SSB (La) антигену – negative, антитела к ДНК топоизомеразе I (Scl-70) – ne-gative, антитела Jo-1 – negative, антитела к PM-Scl 100 антигену – negative, антитела к Ku антигену – negative, антитела к тРНК-синтетазам PL-7 – negative, антитела к тРНК-синтетазам PL-12 – negative, антитела к компонентам сигнал-распознающей частицы SPR – negative, антитела к Mi-2 антигену – negative, на основании чего врачом-ревматологом системное заболевание соединительной ткани (СЗСТ) было исключено, рекомендовано лечение у врача-пульмонолога.
В феврале 2020 г. осмотрена врачом-гематологом, был выставлен диагноз вторичная лейкопения, генез которой не уточнен.
В марте 2020 г. осмотрена врачом-аллергологом-иммунологом, выставлен диагноз: вторичный иммунодефицит, лейкопения, простой герпес, внезапная экзантема, цитомегаловирусная инфекция, ремиссия, рецидивирующий отек. В этот же период вновь осмотрена врачом-фтизиатром: туберкулез исключен.
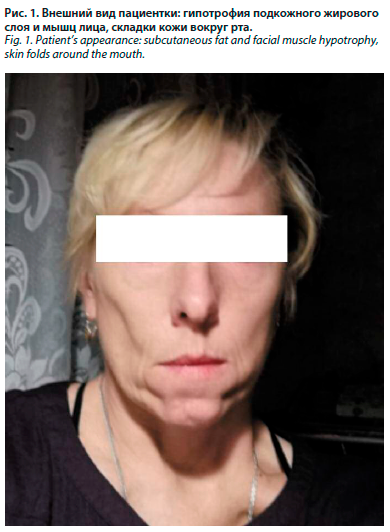 В июне 2020 г. осмотрена комиссионно (врач-терапевт, врач-ревматолог, врач-невролог, врач-пульмонолог): с диагнозом «интерстициальная пневмония» рекомендовано диспансерное наблюдение врача-пульмонолога. Поскольку клиническая картина заболевания не укладывалась в рамки идиопатического легочного фиброза, а физикальные данные, выявленные при общем осмотре, отражали признаки наличия миопатии (рис. 1), что подтверждала ранее проведенная электронейромиография, врачом-пульмонологом вновь было начато обследование для исключения СЗСТ.
В июне 2020 г. осмотрена комиссионно (врач-терапевт, врач-ревматолог, врач-невролог, врач-пульмонолог): с диагнозом «интерстициальная пневмония» рекомендовано диспансерное наблюдение врача-пульмонолога. Поскольку клиническая картина заболевания не укладывалась в рамки идиопатического легочного фиброза, а физикальные данные, выявленные при общем осмотре, отражали признаки наличия миопатии (рис. 1), что подтверждала ранее проведенная электронейромиография, врачом-пульмонологом вновь было начато обследование для исключения СЗСТ.
Сатурация (SpO2) – 94%. Исследование газов крови подтвердило наличие гипоксемии, по данным спирометрии выявлен рестриктивный тип вентиляционной недостаточности 2-й степени (анализные бланки не сохранились), рекомендовано оформление пакета документов для проведения медико-социальной экспертизы, вновь осмотр врача-ревматолога.
Анамнез жизни: туберкулез, гепатит, венерические заболевания, ВИЧ отрицает. Гемотрансфузий не было. Вредные привычки отсутствуют. В менопаузе с 43 лет. Аллергическая реакция – нет, не переносит преднизолон, что проявляется судорогами. Контакт с домашней птицей отрицает. В анамнезе хронический гастрит. Наследственность отягощена по заболеваниям суставов.
Status praesens при совместном осмотре пульмонолога и ревматолога в июле 2020 г.: общее состояние удовлетворительное, сознание ясное, положение активное, телосложение правильное, астеник. Масса тела – 56 кг, рост 170 см, индекс массы тела – 19,38 кг/м2. Кожа бледно-розовая, умеренной влажности, тургор сохранен, единичные рубиновые пятна на лице, гипотрофия скуловых мышц, очаг гиперемии и инфильтрации кожи на подбородке размером 1,0×2,5 см. Подкожный жировой слой развит слабо, распределен равномерно. Периферических отеков нет. Отсутствует полное смыкание век. Пальпируются мелкие подвижные подчелюстные лимфоузлы (по два лимфоузла с каждой стороны) размером 0,5 см. Щитовидная железа не увеличена, мягко эластичная, безболезненная. Молочные железы не изменены. Сколиоз позвоночника до 20 градусов с креном таза влево, выраженная гипотрофия мышц спины больше в грудном отделе. Ограничение ротационных движений в шейном отделе позвоночника. Мышцы верхнего плечевого пояса гипотрофичны, сила мышц сохранена, мышцы нормотоничные, безболезненные. Трапециевидная мышца справа пальпируется в виде болезненного валика. Болезненность при пальпации латеральных надмыщелков плечевых костей с обеих сторон. Распластанность передних отделов стоп, движения в полном объеме. Hallux valgus. Положительный тест сжатия стоп. При осмотре грудной клетки отмечается активное участие вспомогательной мускулатуры в акте дыхания, тип дыхания смешанный, дыхание ритмичное, поверхностное, частое. Частота дыхательных движений – 26 в мин. Аускультативно дыхание ослабленное везикулярное, побочные дыхательные шумы не выслушиваются. Частота сердечных сокращений – 82 уд/мин. Артериальное давление – 120/80 мм рт. ст. Тоны сердца ясные, ритмичные. Язык влажный, розовый, обложен рыхлым белым налетом. Живот не увеличен, при поверхностной пальпации передняя брюшная стенка мягкая, безболезненная. При глубокой пальпации патологических изменений со стороны брюшной полости не выявлено. При осмотре нижних конечностей – ретикулярный варикоз, гиперемия кожи подошвенной поверхности обеих стоп. Арахнодактилия, кисти на ощупь холодные, контрактура Дюпюитрена 4-го пальца правой кисти.
По результатам проведенного физикального исследования принято решение о проведении пересмотра гистологического материала, полученного при биопсии легкого (2015 г.), биопсии мягких тканей лица (2018 г.) и заборе для биопсии мягких тканей грудной стенки слева (кожно-мышечный лоскут). В августе 2020 г. была проведена биопсия кожно-мышечного лоскута мягких тканей передней грудной стенки слева.
Заключение по пересмотру биопсийного материала и биопсии мягких тканей лица и грудной стенки было получено 8 сентября 2020 г.: 1) мягкие ткани лобной области: морфологические признаки, характерные для склеродермии; 2) изменения в респираторном отделе легкого относятся к категории интерстициальных, нозологической специфичности не имеют; 3) мягкие ткани передней грудной стенки слева: изменения, характерные для склеродермии и дерматомиозита; структурные изменения скелетных мышц отражают воспалительную миопатию как групповое понятие, включающее и полимиозит, и дерматомиозит, и миозит при злокачественных заболеваниях.
Врачом-патологоанатомом было сформулировано общее заключение по совокупности выявленных при микроскопическом исследовании изменений: выявленные признаки, в равной степени характерные для системной склеродермии и полимиозита, могут отражать перекрестный синдром смешанного заболевания соединительной ткани, этому не противоречат интерстициальные изменения в респираторных отделах легкого, обнаруженные в материалах торакоскопической биопсии 2015 г.
30 сентября 2020 г. была проведена магнитно-резонансная томография (МРТ) мышц верхнего плечевого пояса. По результатам проведенного МРТ мягких тканей грудной клетки выявлены МР-признаки атрофических изменений правой трапециевидной мышцы, наиболее выраженные в ее восходящей части, Р-признаки миозита правой трапециевидной мышцы, шейной лимфаденопатии (увеличены шейные и надключичные лимфоузлы до 13 мм).
На основании данных морфологического исследования ревматологом 1 октября 2020 г. был выставлен диагноз: М35.9 Системные поражения соединительной ткани неуточненные. М33.9 Дерматополимиозит неуточненный, морфологически подтвержденный, хроническое течение миозита с исходом в фиброз. Перекрестный синдром вероятный. М35.6 Рецидивирующий панникулит Вебера–Крисчена. Лихорадка, снижение массы тела в дебюте. Гелиотропные высыпания на веках и подбородке. Интерстициальное поражение легких. Поражение дыхательных мышц и мышц диафрагмы. Перикардит. Поражение печени. Гепатолиенальный синдром. Синдром Рейно. Вторичный иммунодефицит. Моноцитоз. Назначено лечение: диета, обогащенная моно- и полиненасыщенными жирными кислотами, витамином D. Метилпреднизолон по 20 мг на прием утром, при хорошей переносимости увеличение дозы до 48 мг в три приема с интервалом 2–4 ч.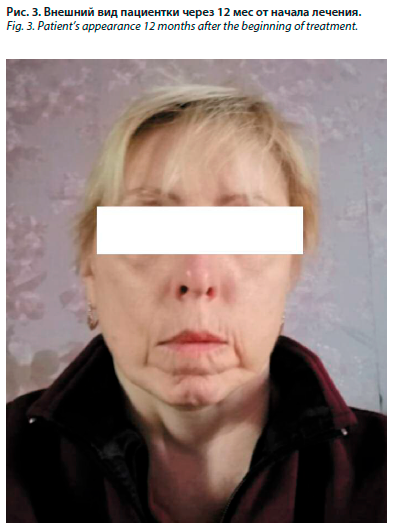
 Метотрексат 5 мг/нед. Колекальциферол по 4 капли (2000 МЕ) в сутки на время приема глюкокортикостероидов. Назначено дообследование: осмотр врача-оториноларинголога для исключения стеноза дыхательных путей и контрольные мероприятия на фоне лечения метилпреднизолоном, общий анализ крови (ОАК), биохимические исследования, исследование функции внешнего дыхания.
Метотрексат 5 мг/нед. Колекальциферол по 4 капли (2000 МЕ) в сутки на время приема глюкокортикостероидов. Назначено дообследование: осмотр врача-оториноларинголога для исключения стеноза дыхательных путей и контрольные мероприятия на фоне лечения метилпреднизолоном, общий анализ крови (ОАК), биохимические исследования, исследование функции внешнего дыхания.
При осмотре врачом-оториноларингологом патологии не выявлено.
Спирография (1 октября 2020 г.): несмотря на то что пациентка не смогла выполнить необходимые маневры, а исследование признано неинформативным, следует отметить, что выявлено снижение показателей, а именно рестриктивный компонент: жизненная емкость легких – 39,4%; обструктивный компонент: объем форсированного выдоха за 1-ю секунду – 38,8%; на основании чего установлено нарушение функции внешнего дыхания по смешанному типу 2-й степени тяжести (рис. 2).
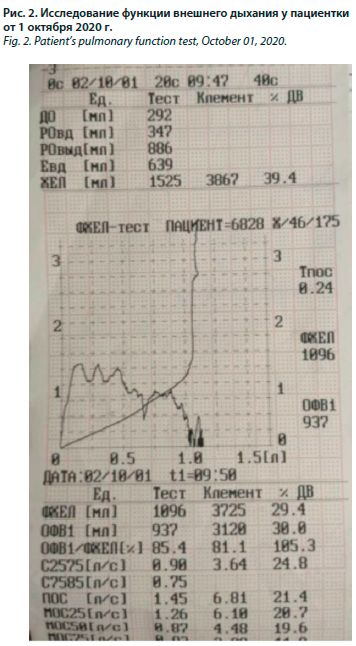
Через 12 мес не фоне лечения достигнута стабилизация состояния, прекратились рецидивирующие отеки лица, нормализовалась температура тела, уменьшилась выраженность слабости и одышки, расширилась двигательная активность пациентки, в ОАК зарегистрирована нормализация уровня лейкоцитов (ОАК 17 ноября 2021 г. – лейкоциты 9,9×109/л, остальные показатели ОАК и показатели биохимического анализа крови в пределах референтных значений). Однако на фоне лечения появились боли в спине, при обследовании выявлен остеопороз и патологический перелом грудного позвонка. К этому времени прием глюкокортикостероидов пациентка самостоятельно прекратила. В связи с плохой переносимостью метотрексата (выраженная тошнота), назначен азатиоприн 50 мг 2 раза в день длительно и сопутствующая терапия – альфакальцидол и золендроновая кислота. Диагноз уточнен: М33.1 Другие дерматомиозиты, морфологически верифицированный, хроническое течение миозита с исходом в фиброз. Перекрестный синдром вероятный. М35.6 Рецидивирующий панникулит Вебера–Крисчена. Лейкопения, лихорадка, снижение массы тела в дебюте. Параорбитальный отек. Интерстициальное поражение легких с исходом в базальный легочный фиброз. Поражение дыхательных мышц и мышц диафрагмы. ДН 3. Поражение сердечно-сосудистой системы (перикардит). Поражение печени. Гепатолиенальный синдром. Синдром Рейно. М80.8 Другой остеопороз с патологическим переломом тел позвонков в грудном отделе на фоне основной патологии и приема глюкокортикостероидов, тяжелая форма.
Пациентка получала лечение у врача-ревматолога в течение двух лет, состояние ее расценивалось как стабильное без прогрессирования. Однако в конце декабря 2022 г. на фоне эпидемиологически неблагополучной по новой коронавирусной инфекции в регионе ситуации пациентка была госпитализирована по неотложной помощи в пульмонологическое отделение многопрофильного стационара, где умерла на фоне прогрессирующей дыхательной недостаточности от двусторонней полисегментарной пневмонии через 14 дней от момента поступления.
На момент первого обращения пациентки за медицинской помощью в 2015 г. уже имелись признаки интерстициального поражения легких, интерпретированные как двусторонняя пневмония. Осложненное течение пневмонии в 2015 г. заставило пациентку в последующем обращать внимание на состояние своего здоровья и фиксировать рецидивирующие кожные изменения.
Известно, что частота интерстициальной болезни легких при дерматомиозите может достигать 65%, при этом клинические проявления варьируют от бессимптомного течения до острого респираторного дистресс-синдрома [8]. Для пациентов с дерматомиозитом одной из причин пневмонита является аспирация, однако у данной пациентки на момент обследования в 2020 г. признаков дисфагии не было, что позволяет нам утверждать об отсутствии аспирационного компонента в повреждении легочной ткани. Для пациентов с дерматомиозитом и интерстициальным поражением легких характерно наличие анти-Jo-1 и анти-MDA-5 антител, повышение СОЭ и С-реактивного белка [9], однако эти лабораторные маркеры СЗСТ в описываемом клиническом случае были в норме. В 50% случаев наблюдается повышение СОЭ, однако оно плохо коррелирует с активностью заболевания и ответом на терапию. Показатель С-реактивного белка не является специфичным, его увеличение может быть признаком сопутствующей инфекции.
Кроме интерстициальных изменений в легких, течение заболевания у пациентки характеризовалось рецидивирующим панникулитом. Появление признаков панникулита сопровождалось температурной реакцией, изменениями в ОАК в виде умеренной лейкопении. Поражение кожи может служить одним из тех симптомов болезни, которые причиняют страдание больному [6]. В данном случае, с учетом того, что признаки панникулита появлялись у пациентки на лице (надбровные области, подбородочная область), несколько деформировали лицо, создавали у молодой женщины эстетический дискомфорт, то именно они и доставляли страдание, заставлявшее обращаться за медицинской помощью. При дерматомиозите поражение кожи обычно предшествует появлению мышечной слабости или развивается одновременно с ней [8]; в данном случае отсутствуют анамнестические сведения, позволяющие оценить временную связь между этими симптомами, поскольку мышечная слабость нарастала постепенно. Слабость как основной симптом дерматомиозита у пациентки был ярко выражен, однако, с учетом того, что функции дистальных мышц конечностей нарушены не были, должного внимания этот симптом не получил.
Лейкопения регистрировалась у пациентки на протяжении всего периода наблюдения, периодически регистрировался синдром цитолиза, однократно – повышение уровня маркеров повреждения мышц – КФК, и однократно – ЛДГ. В 2020 г. на фоне нормального уровня С-реактивного белка был зарегистрирован подъем уровня антистрептолизина-О. Маркеры аутоиммунных заболеваний были отрицательными. Низкая информативность лабораторных маркеров в данном случае может быть обусловлена несвоевременностью забора биологического материла. Возможно, что забор был осуществлен в период нестойкой ремиссии аутоиммунного заболевания.
Особенностями лечения было наличие у пациентки непереносимости преднизолона и появление серьезных побочных эффектов на метилпреднизолон, что стало основанием для применения в данной клинической ситуации цитостатиков.
Анализ развития и течения дерматомиозита у данной пациентки демонстрирует манифестацию заболевания с симптомов поражения бронхолегочной системы, атипичную локализацию панникулита, отсутствие специфических стойких лабораторных маркеров воспалительного процесса и поражения мышечной ткани, отсутствие миозит-специфических аутоантител, необходимость проведения расширенного диагностического поиска в связи с полисиндромностью заболевания.
В помощь практическому врачу созданы диагностические системы – калькуляторы [10, 11], которые позволяют рассчитать вероятность диагноза воспалительной миопатии (www.imm.ki.se/biostatistics/calculators/iim) [9]. Ретроспективно мы ввели данные пациентки в онлайн-калькулятор в виде двух клинических ситуаций:
1) до биопсии мы получили результат, указывающий на вероятность заболевания равную 5%; 2) после биопсии – 87%. Второй калькулятор, который мы использовали – RheumaHelper (https://rheumahelper.com/): 1) до биопсии мы получили результат, указывающий на вероятность заболевания равную 3%; 2) после биопсии – 87%. С учетом полученной разницы онлайн-калькулятор позволяет установить достоверный диагноз только по результатам биопсии. Следует отметить, что биопсия не является методом диагностики, который назначается всем пациентам с подозрением на СЗСТ. Данный вид инвазивного диагностического вмешательства требует обоснованных показаний. Поэтому, несмотря на наличие калькуляторов, основой диагностики заболевания является клиническая оценка совокупности данных, которая благодаря клиническому мышлению врача позволяет принять решение о проведении инвазивной диагностики, по результатам которой диагноз «вероятный» становится «достоверным».
Таким образом, данный клинический случай показывает, что дерматомиозит является междисциплинарной проблемой, а повышенная осведомленность врачей смежных с ревматологией специальностей (в данном случае врача-терапевта и врача-пульмонолога) будет способствовать клинической настороженности, а врачам-ревматологам будет давать возможность своевременного выявления, определения успешности лечения, тем самым улучшая качество жизни данной категории больных.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Благодарность. Выражаем благодарность зав. отделением лучевой диагностики БУЗОО «ГКБ скорой медицинской помощи №1», врачу высшей квалификационной категории, д-ру мед. наук, заслуженному врачу РФ Галине Николаевне Доровских.
Acknowledgements. We express our gratitude to the head of the department of radiation diagnostics of BUZOO "City Clinical Emergency Hospital No.1", doctor of the highest qualification category, Dr. Sci. (Med.), Honored Doctor of the Russian Federation Galina N. Dorovskikh.
Информация об авторах
Information about the authors
Усачева Елена Владимировна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: elenav.usacheva@yandex.ru;
ORCID: 0000-0002-6134-1533; Researcher ID: I-4077-2017;
Scopus Author ID: 56380398700
Elena V. Usacheva – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: elenav.usacheva@yandex.ru; ORCID: 0000-0002-6134-1533; Researcher ID: I-4077-2017; Scopus Author ID: 56380398700
Гизатулина Ольга Николаевна – врач-ревматолог, БУЗ Омской области «Клинический диагностический центр».
E-mail: onig1410@yandex.ru
Olga N. Gizatulina – Rheumatologist, Omsk region "Clinical Diagnostic Center". E-mail: onig1410@yandex.ru
Дубровская Ирина Игоревна – врач-пульмонолог, зав. пульмонологическим отд-нием, БУЗ Омской области «ГКБ скорой медицинской помощи №2». E-mail: dubrowskaia.iri@yandex.ru
Irina I. Dubrovskaya – Pulmonologist, Omsk region "City Clinical Emergency Hospital No.2".
E-mail: dubrowskaia.iri@yandex.ru
Надей Елена Витальевна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: nadeyelena@yandex.ru; ORCID: 0000-0003-0440-7118
Elena V. Nadey – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: nadeyelena@yandex.ru;
ORCID: 0000-0003-0440-7118
Усачев Никита Андреевич – врач-терапевт, БУЗ Омской области «Городская поликлиника №4». E-mail: usakrule@gmail.com;
ORCID: 0000-0001-6051-1089
Nikita A. Usachev – General practitioner, Omsk region
"City polyclinic No.4". E-mail: usakrule@gmail.com; ORCID: 0000-0001-6051-1089
Поступила в редакцию: 22.01.2024
Поступила после рецензирования: 24.01.2024
Принята к публикации: 25.01.2024
Received: 22.01.2024
Revised: 24.01.2024
Accepted: 25.01.2024
Клинический разбор в общей медицине №1 2024
Терапевтическая коморбидность – сочетание дерматополимиозита и панникулита Вебера–Крисчена: трудный путь к диагнозу
Номера страниц в выпуске:13-19
Аннотация
Коморбидная патология в терапевтической практике сложна для диагностики, так как нередко имеет сложную клиническую картину, нетипичную динамику течения заболеваний, в том числе меняющуюся под действием проводимой терапии. Полисистемность поражения при неравномерной степени патологического повреждения органов и систем может завуалировать основное заболевание, когда его симптомы принимаются как отдельное заболевание. В то же время недостаточная эффективность проводимой терапии должна заставлять задуматься о иных причинах патологического процесса, заподозрить аутоиммунные, онкологические и редкие врожденные или генетически обусловленные заболевания и синдромы.
Ключевые слова: дерматополимиозит, интерстициальные заболевания легких, пневмонит, панникулит, коморбидная патология, полисистемные поражения.
Для цитирования: Усачева Е.В., Гизатулина О.Н., Дубровская И.И., Надей Е.В., Усачев Н.А. Терапевтическая коморбидность – сочетание дерматополимиозита и панникулита Вебера–Крисчена: трудный путь к диагнозу. Клинический разбор в общей медицине. 2024; 5 (1): 13–19. DOI: 10.47407/kr2023.5.1.00353
Коморбидная патология в терапевтической практике сложна для диагностики, так как нередко имеет сложную клиническую картину, нетипичную динамику течения заболеваний, в том числе меняющуюся под действием проводимой терапии. Полисистемность поражения при неравномерной степени патологического повреждения органов и систем может завуалировать основное заболевание, когда его симптомы принимаются как отдельное заболевание. В то же время недостаточная эффективность проводимой терапии должна заставлять задуматься о иных причинах патологического процесса, заподозрить аутоиммунные, онкологические и редкие врожденные или генетически обусловленные заболевания и синдромы.
Ключевые слова: дерматополимиозит, интерстициальные заболевания легких, пневмонит, панникулит, коморбидная патология, полисистемные поражения.
Для цитирования: Усачева Е.В., Гизатулина О.Н., Дубровская И.И., Надей Е.В., Усачев Н.А. Терапевтическая коморбидность – сочетание дерматополимиозита и панникулита Вебера–Крисчена: трудный путь к диагнозу. Клинический разбор в общей медицине. 2024; 5 (1): 13–19. DOI: 10.47407/kr2023.5.1.00353
Therapeutic comorbidity – combination of dermatopolymiositis and Weber-Christian panniculitis: a difficult path to diagnosis
Elena V. Usacheva1, Olga N. Gizatulina2, Irina I. Dubrovskaya3, Elena V. Nadey1,Nikita A. Usachev4
1 Omsk State Medical University, Omsk, Russia;
2 Omsk region "Clinical Diagnostic Center", Omsk, Russia;
3 Omsk region "City Clinical Emergency Hospital No.2", Omsk, Russia;
4 Omsk region "City polyclinic No.4", Omsk, Russia
elenav.usacheva@yandex.ru
Abstract
Comorbid pathology in therapeutic practice is difficult to diagnose, because it often has a complex clinical picture, atypical dynamics of the course of diseases, including those changing under the influence of ongoing therapy. The polysystemic nature of the lesion with an uneven degree of pathological damage to organs and systems can obscure the underlying disease when its symptoms are accepted as a separate disease. At the same time, the insufficient effectiveness of the therapy should make you think about other causes of the pathological process, suspect autoimmune, oncological and rare congenital or genetically determined diseases and syndromes.
Keywords: dermatopolymiositis, interstitial lung diseases, pneumonitis, panniculitis, comorbid pathology, polysystemic lesions.
For citation: Usacheva E.V., Gizatulina O.N., Dubrovskaya I.I., Nadey E.V., Usachev N.A. Therapeutic comorbidity – combination of dermatopolymiositis and Weber-Christian panniculitis: a difficult path to diagnosis. Clinical review for general practice. 2024; 5 (1): 13–19 (In Russ.). DOI: 10.47407/kr2023.5.1.00353
Введение
Несмотря на современные достижения медицины, проблема ранней диагностики ревматических заболеваний в настоящее время стоит достаточно остро. Ревматические болезни характеризуются хроническим прогрессирующим течением и полисистемностью поражения, поэтому эффективность их лечения и прогноз во многом зависят от своевременности постановки диагноза и начала терапии. Путь большинства пациентов начинается с участкового врача-терапевта. От того, как осведомлены врачи первичного звена о симптомах ревматических заболеваний, насколько правильно они могут провести дифференциальную диагностику, зависит в конечном итоге исход заболевания [1].Первые публикации о дерматомиозите появились в научной литературе в 1784 г. Так, в публикации
W.R. Steiner [2] дерматомиозит определен как острое, подострое или хроническое заболевание неизвестного происхождения, характеризующееся постепенным началом с расплывчатыми и неопределяемыми продромами, за которыми следуют отек, дерматит и множественное воспаление. Данным автором приведено описание 28 клинических случаев, в 14 (50%) из которых были обнаружены признаки поражения бронхолегочной системы в виде бронхита и/или бронхопневмонии, послужившей в 8 случаях причиной смерти этих пациентов. Со времен первого литературного обзора, посвященного дерматомиозиту, понимание этой болезни практически не изменилось.
Поражение легких у пациентов с дерматомиозитом может проявляться в форме гиповентиляции, аспирационной пневмонии или интерстициального заболевания легких. Аспирационная пневмония у пациентов с миопатиями возникает в силу слабости дыхательных мышц и относится к крайне редким состояниям с высоким уровнем смертности. Интерстициальное поражение легочной ткани имеется у 36,6% пациентов с дерматомиозитом и является одним из наиболее распространенных внемышечных проявлений всех видов идиопатических воспалительных миопатий [3–5]. Интерстициальное поражение легочной ткани может возникать до, во время и после кожных или мышечных проявлений, характеризуется резистентностью к традиционной глюкокортикоидной терапии и неблагоприятным клиническим прогнозом.
При дерматомиозите наблюдается поражение кожи, которое служит патогномоничным признаком данного состояния. Одним из редких кожных проявлений при этой патологии является панникулит [6].
Нами представлен клинический случай дерматомиозита, основным проявлением которого было интерстициальное поражение легких в сочетании с панникулитом.
Клинический случай
Пациентка К., 46 лет, в июле 2020 г. обратилась к врачу-ревматологу с жалобами на рецидивирующий несимметричный отек мягких тканей лица, выраженную постепенно прогрессирующую инспираторную одышку при бытовой физической нагрузке, сухость во рту, общую слабость и быструю утомляемость при минимальных физических нагрузках, постепенное снижение массы тела (на 17 кг за последние 4 года).Анамнез заболевания: считает себя больной с мая 2015 г., когда впервые без каких-либо значимых провоцирующих факторов появились фебрильная температура и инспираторная одышка, что заставило через 4 дня самостоятельного лечения обратиться за медицинской помощью к участковому врачу-терапевту, по направлению которого с диагнозом «пневмония» была направлена в пульмонологическое отделение многопрофильного стационара, где был установлен диагноз двустороння полисегментарная пневмония, тяжелое течение, осложненная правосторонним экссудативным плевритом. В стационаре проведена плевральная пункция, назначена антибактериальная терапия. По данным лабораторных исследований, наблюдалась лейкопения (3×109/л) и цитолиз, превышающий норму в 8 раз. На фоне лечения получена положительная динамика, выписана на амбулаторное долечивание с открытым листком нетрудоспособности с диагнозом: внегоспитальная двусторонняя пневмония, осложнившаяся правосторонним экссудативным плевритом, постпневмонический двусторонний пневмофиброз, дыхательная недостаточность 1-й степени. Через 3 нед в связи с ухудшением самочувствия возникла необходимость в повторной госпитализации по неотложной помощи с теми же симптомами; в стационаре с учетом рецидивирующего плеврита была проведена торакоскопия с биопсией плевры – данных, подтверждающих онкологический процесс, не выявлено, описание гистологического исследования от 2015 г. не сохранилось. Проведен курс антибактериальной терапии, выписана на амбулаторное лечение с положительным эффектом, однако в связи с выраженной слабостью и одышкой к труду не приступила, с работы уволилась.
В 2016 г. на фоне сохраняющейся инспираторной одышки и общей слабости стала отмечать субфебрилитет, рентгенологически сохранялись выраженные изменения легочной ткани в виде выраженного двустороннего пневмофиброза, в связи с чем пациентка обследовалась у врача-фтизиатра – данных, подтверждающих туберкулез, не получено. Весной 2016 г. впервые появился несимметричный параорбитальный отек мягких тканей лица, терапевтом была направлена к врачу-офтальмологу. При осмотре врачом-офтальмологом был выставлен диагноз «реактивный отек», симптомы которого купировались на фоне дипроспана. Через 2 нед отек рецидивировал, в связи с чем была направлена к врачу-ревматологу, которым был назначен короткий курс метипреда в дозе 8 мг/сут 7 дней с кратковременным эффектом: отек был снова купирован, но через 2–4 нед он появлялся вновь, в связи с чем пациентка самостоятельно короткими курсами с положительным, но нестойким эффектом, принимала метипред или супрастин.
С 2016 г. пациентка стала отмечать постепенное снижение массы тела на фоне сохранного аппетита и привычного объема пищи. За 4 года снижение массы тела составило 17 кг. С учетом сохраняющегося субфебрилитета и спленомегалии (по результатам ультразвукового исследования органов брюшной полости – селезенка 55 см3), сохраняющейся лейкопении и цитолиза (трансаминазы в 5 раз выше нормы) была осмотрена врачом-гематологом, проведена пункция костного мозга, но данных, подтверждающих гемобластоз, не получено.
В 2017 г. за медицинской помощью не обращалась, занималась надомным трудом (швея).
В мае 2018 г. по поводу возникновения очага стойкой ограниченной отечности кожи на границе лобной, височной и параорбитальной области слева была госпитализирована в хирургическое отделение, где было проведено малоинвазивное хирургическое лечение, по данным гистологического исследования биопсийного материала был установлен диагноз «эпидермальная киста», которая была удалена, проведен курс антибактериальной терапия. В стационаре в раннем послеоперационном периоде возник параорбитальный отек мягких тканей с обеих сторон, лечащим врачом был выставлен диагноз «отек Квинке», который был купирован применением дипроспана. После выписки обследовалась у врача-аллерголога-иммунолога, при лабораторном обследовании показатели трансаминаз были в норме, однако было выявлено однократное повышение уровня креатинкиназы (КФК) и лактатдегидрогеназы (ЛДГ), анализных бланков не сохранилось.
В январе 2019 г. – ухудшение самочувствия в виде усиления одышки и общей слабости, снижения толерантности к бытовым физическим нагрузкам, появления фебрильной лихорадки, по поводу чего была вновь госпитализирована в пульмонологическое отделение, где проводилось лечение с диагнозом «внебольничная двусторонняя полисегментарная пневмония». В крови сохранялась умеренная лейкопения, цитолиз 1-й степени активности, повышение уровня антистрептолизина-О; по данным компьютерной томографии органов грудной клетки (КТ ОГК) – выраженные двусторонние интерстициальные изменения легких, интерпретированные рентгенологом как поствоспалительный пневмофиброз в исходе двусторонней пневмонии, осложненной экссудативным плевритом (2015 г., 2019 г.). Проводилась антибактериальная терапия, выписана с положительной динамикой, рекомендован КТ ОГК-контроль.
Через 10 мес, по данным контрольной КТ ОГК, выявлены признаки поствоспалительных фиброзных изменений в нижней доле правого легкого, небольшого осумкованного правостороннего плеврита, состояние после видеоторакоскопии справа, признаки хронического бронхита, легочной гипертензии. Клинически у пациентки сохранялись признаки хронической дыхательной недостаточности 2-й степени.
С учетом визуально выявленной выраженной гипотрофии мышц верхнего плечевого пояса пациентка была направлена на электронейромиографию мышц данной анатомической области, по результатам которой (23 декабря 2019 г.) выявлено первично-мышечное поражение, в связи с чем для установления причины миопатии проведено иммунологическое исследование (23 января 2020 г.): антитела к нуклеосомам – negative, антитела к дс-ДНК (нативная) – negative, антитела к гистонам – negative, антитела к антигену Смит (Sm) – ne-gative, антитела Sm/RNP комплексу – negative, антителаSS-A/Ro 60kD антигену – negative, антителаSS-A/Ro 52 kD антигену – negative, антитела SSB (La) антигену – negative, антитела к ДНК топоизомеразе I (Scl-70) – ne-gative, антитела Jo-1 – negative, антитела к PM-Scl 100 антигену – negative, антитела к Ku антигену – negative, антитела к тРНК-синтетазам PL-7 – negative, антитела к тРНК-синтетазам PL-12 – negative, антитела к компонентам сигнал-распознающей частицы SPR – negative, антитела к Mi-2 антигену – negative, на основании чего врачом-ревматологом системное заболевание соединительной ткани (СЗСТ) было исключено, рекомендовано лечение у врача-пульмонолога.
В феврале 2020 г. осмотрена врачом-гематологом, был выставлен диагноз вторичная лейкопения, генез которой не уточнен.
В марте 2020 г. осмотрена врачом-аллергологом-иммунологом, выставлен диагноз: вторичный иммунодефицит, лейкопения, простой герпес, внезапная экзантема, цитомегаловирусная инфекция, ремиссия, рецидивирующий отек. В этот же период вновь осмотрена врачом-фтизиатром: туберкулез исключен.
 В июне 2020 г. осмотрена комиссионно (врач-терапевт, врач-ревматолог, врач-невролог, врач-пульмонолог): с диагнозом «интерстициальная пневмония» рекомендовано диспансерное наблюдение врача-пульмонолога. Поскольку клиническая картина заболевания не укладывалась в рамки идиопатического легочного фиброза, а физикальные данные, выявленные при общем осмотре, отражали признаки наличия миопатии (рис. 1), что подтверждала ранее проведенная электронейромиография, врачом-пульмонологом вновь было начато обследование для исключения СЗСТ.
В июне 2020 г. осмотрена комиссионно (врач-терапевт, врач-ревматолог, врач-невролог, врач-пульмонолог): с диагнозом «интерстициальная пневмония» рекомендовано диспансерное наблюдение врача-пульмонолога. Поскольку клиническая картина заболевания не укладывалась в рамки идиопатического легочного фиброза, а физикальные данные, выявленные при общем осмотре, отражали признаки наличия миопатии (рис. 1), что подтверждала ранее проведенная электронейромиография, врачом-пульмонологом вновь было начато обследование для исключения СЗСТ.Сатурация (SpO2) – 94%. Исследование газов крови подтвердило наличие гипоксемии, по данным спирометрии выявлен рестриктивный тип вентиляционной недостаточности 2-й степени (анализные бланки не сохранились), рекомендовано оформление пакета документов для проведения медико-социальной экспертизы, вновь осмотр врача-ревматолога.
Анамнез жизни: туберкулез, гепатит, венерические заболевания, ВИЧ отрицает. Гемотрансфузий не было. Вредные привычки отсутствуют. В менопаузе с 43 лет. Аллергическая реакция – нет, не переносит преднизолон, что проявляется судорогами. Контакт с домашней птицей отрицает. В анамнезе хронический гастрит. Наследственность отягощена по заболеваниям суставов.
Status praesens при совместном осмотре пульмонолога и ревматолога в июле 2020 г.: общее состояние удовлетворительное, сознание ясное, положение активное, телосложение правильное, астеник. Масса тела – 56 кг, рост 170 см, индекс массы тела – 19,38 кг/м2. Кожа бледно-розовая, умеренной влажности, тургор сохранен, единичные рубиновые пятна на лице, гипотрофия скуловых мышц, очаг гиперемии и инфильтрации кожи на подбородке размером 1,0×2,5 см. Подкожный жировой слой развит слабо, распределен равномерно. Периферических отеков нет. Отсутствует полное смыкание век. Пальпируются мелкие подвижные подчелюстные лимфоузлы (по два лимфоузла с каждой стороны) размером 0,5 см. Щитовидная железа не увеличена, мягко эластичная, безболезненная. Молочные железы не изменены. Сколиоз позвоночника до 20 градусов с креном таза влево, выраженная гипотрофия мышц спины больше в грудном отделе. Ограничение ротационных движений в шейном отделе позвоночника. Мышцы верхнего плечевого пояса гипотрофичны, сила мышц сохранена, мышцы нормотоничные, безболезненные. Трапециевидная мышца справа пальпируется в виде болезненного валика. Болезненность при пальпации латеральных надмыщелков плечевых костей с обеих сторон. Распластанность передних отделов стоп, движения в полном объеме. Hallux valgus. Положительный тест сжатия стоп. При осмотре грудной клетки отмечается активное участие вспомогательной мускулатуры в акте дыхания, тип дыхания смешанный, дыхание ритмичное, поверхностное, частое. Частота дыхательных движений – 26 в мин. Аускультативно дыхание ослабленное везикулярное, побочные дыхательные шумы не выслушиваются. Частота сердечных сокращений – 82 уд/мин. Артериальное давление – 120/80 мм рт. ст. Тоны сердца ясные, ритмичные. Язык влажный, розовый, обложен рыхлым белым налетом. Живот не увеличен, при поверхностной пальпации передняя брюшная стенка мягкая, безболезненная. При глубокой пальпации патологических изменений со стороны брюшной полости не выявлено. При осмотре нижних конечностей – ретикулярный варикоз, гиперемия кожи подошвенной поверхности обеих стоп. Арахнодактилия, кисти на ощупь холодные, контрактура Дюпюитрена 4-го пальца правой кисти.
По результатам проведенного физикального исследования принято решение о проведении пересмотра гистологического материала, полученного при биопсии легкого (2015 г.), биопсии мягких тканей лица (2018 г.) и заборе для биопсии мягких тканей грудной стенки слева (кожно-мышечный лоскут). В августе 2020 г. была проведена биопсия кожно-мышечного лоскута мягких тканей передней грудной стенки слева.
Заключение по пересмотру биопсийного материала и биопсии мягких тканей лица и грудной стенки было получено 8 сентября 2020 г.: 1) мягкие ткани лобной области: морфологические признаки, характерные для склеродермии; 2) изменения в респираторном отделе легкого относятся к категории интерстициальных, нозологической специфичности не имеют; 3) мягкие ткани передней грудной стенки слева: изменения, характерные для склеродермии и дерматомиозита; структурные изменения скелетных мышц отражают воспалительную миопатию как групповое понятие, включающее и полимиозит, и дерматомиозит, и миозит при злокачественных заболеваниях.
Врачом-патологоанатомом было сформулировано общее заключение по совокупности выявленных при микроскопическом исследовании изменений: выявленные признаки, в равной степени характерные для системной склеродермии и полимиозита, могут отражать перекрестный синдром смешанного заболевания соединительной ткани, этому не противоречат интерстициальные изменения в респираторных отделах легкого, обнаруженные в материалах торакоскопической биопсии 2015 г.
30 сентября 2020 г. была проведена магнитно-резонансная томография (МРТ) мышц верхнего плечевого пояса. По результатам проведенного МРТ мягких тканей грудной клетки выявлены МР-признаки атрофических изменений правой трапециевидной мышцы, наиболее выраженные в ее восходящей части, Р-признаки миозита правой трапециевидной мышцы, шейной лимфаденопатии (увеличены шейные и надключичные лимфоузлы до 13 мм).
На основании данных морфологического исследования ревматологом 1 октября 2020 г. был выставлен диагноз: М35.9 Системные поражения соединительной ткани неуточненные. М33.9 Дерматополимиозит неуточненный, морфологически подтвержденный, хроническое течение миозита с исходом в фиброз. Перекрестный синдром вероятный. М35.6 Рецидивирующий панникулит Вебера–Крисчена. Лихорадка, снижение массы тела в дебюте. Гелиотропные высыпания на веках и подбородке. Интерстициальное поражение легких. Поражение дыхательных мышц и мышц диафрагмы. Перикардит. Поражение печени. Гепатолиенальный синдром. Синдром Рейно. Вторичный иммунодефицит. Моноцитоз. Назначено лечение: диета, обогащенная моно- и полиненасыщенными жирными кислотами, витамином D. Метилпреднизолон по 20 мг на прием утром, при хорошей переносимости увеличение дозы до 48 мг в три приема с интервалом 2–4 ч.

 Метотрексат 5 мг/нед. Колекальциферол по 4 капли (2000 МЕ) в сутки на время приема глюкокортикостероидов. Назначено дообследование: осмотр врача-оториноларинголога для исключения стеноза дыхательных путей и контрольные мероприятия на фоне лечения метилпреднизолоном, общий анализ крови (ОАК), биохимические исследования, исследование функции внешнего дыхания.
Метотрексат 5 мг/нед. Колекальциферол по 4 капли (2000 МЕ) в сутки на время приема глюкокортикостероидов. Назначено дообследование: осмотр врача-оториноларинголога для исключения стеноза дыхательных путей и контрольные мероприятия на фоне лечения метилпреднизолоном, общий анализ крови (ОАК), биохимические исследования, исследование функции внешнего дыхания.При осмотре врачом-оториноларингологом патологии не выявлено.
Спирография (1 октября 2020 г.): несмотря на то что пациентка не смогла выполнить необходимые маневры, а исследование признано неинформативным, следует отметить, что выявлено снижение показателей, а именно рестриктивный компонент: жизненная емкость легких – 39,4%; обструктивный компонент: объем форсированного выдоха за 1-ю секунду – 38,8%; на основании чего установлено нарушение функции внешнего дыхания по смешанному типу 2-й степени тяжести (рис. 2).
Через 12 мес не фоне лечения достигнута стабилизация состояния, прекратились рецидивирующие отеки лица, нормализовалась температура тела, уменьшилась выраженность слабости и одышки, расширилась двигательная активность пациентки, в ОАК зарегистрирована нормализация уровня лейкоцитов (ОАК 17 ноября 2021 г. – лейкоциты 9,9×109/л, остальные показатели ОАК и показатели биохимического анализа крови в пределах референтных значений). Однако на фоне лечения появились боли в спине, при обследовании выявлен остеопороз и патологический перелом грудного позвонка. К этому времени прием глюкокортикостероидов пациентка самостоятельно прекратила. В связи с плохой переносимостью метотрексата (выраженная тошнота), назначен азатиоприн 50 мг 2 раза в день длительно и сопутствующая терапия – альфакальцидол и золендроновая кислота. Диагноз уточнен: М33.1 Другие дерматомиозиты, морфологически верифицированный, хроническое течение миозита с исходом в фиброз. Перекрестный синдром вероятный. М35.6 Рецидивирующий панникулит Вебера–Крисчена. Лейкопения, лихорадка, снижение массы тела в дебюте. Параорбитальный отек. Интерстициальное поражение легких с исходом в базальный легочный фиброз. Поражение дыхательных мышц и мышц диафрагмы. ДН 3. Поражение сердечно-сосудистой системы (перикардит). Поражение печени. Гепатолиенальный синдром. Синдром Рейно. М80.8 Другой остеопороз с патологическим переломом тел позвонков в грудном отделе на фоне основной патологии и приема глюкокортикостероидов, тяжелая форма.
Пациентка получала лечение у врача-ревматолога в течение двух лет, состояние ее расценивалось как стабильное без прогрессирования. Однако в конце декабря 2022 г. на фоне эпидемиологически неблагополучной по новой коронавирусной инфекции в регионе ситуации пациентка была госпитализирована по неотложной помощи в пульмонологическое отделение многопрофильного стационара, где умерла на фоне прогрессирующей дыхательной недостаточности от двусторонней полисегментарной пневмонии через 14 дней от момента поступления.
Обсуждение
Дерматомиозит как один из вариантов идиопатической воспалительной миопатии имеет характерное клиническое проявление – поражение скелетной мускулатуры проксимальных отделов верхних и нижних конечностей, мышц шеи, глотки, гортани [6, 7]. Помимо мышечного поражения, типичными для дерматомиозита считаются яркие изменения кожного покрова – эритема на лице, груди, плечах, спине, коже тыльной поверхности пястнофаланговых, проксимальных межфаланговых, локтевых и коленных суставов, параорбитальный гелиотропный отек, панникулит. При ретроспективном анализе клинической картины патологического процесса у данной пациентки складывается впечатление о типичном течении СЗСТ, однако путь к постановке диагноза занял около 5 лет (2015–2020 гг.).На момент первого обращения пациентки за медицинской помощью в 2015 г. уже имелись признаки интерстициального поражения легких, интерпретированные как двусторонняя пневмония. Осложненное течение пневмонии в 2015 г. заставило пациентку в последующем обращать внимание на состояние своего здоровья и фиксировать рецидивирующие кожные изменения.
Известно, что частота интерстициальной болезни легких при дерматомиозите может достигать 65%, при этом клинические проявления варьируют от бессимптомного течения до острого респираторного дистресс-синдрома [8]. Для пациентов с дерматомиозитом одной из причин пневмонита является аспирация, однако у данной пациентки на момент обследования в 2020 г. признаков дисфагии не было, что позволяет нам утверждать об отсутствии аспирационного компонента в повреждении легочной ткани. Для пациентов с дерматомиозитом и интерстициальным поражением легких характерно наличие анти-Jo-1 и анти-MDA-5 антител, повышение СОЭ и С-реактивного белка [9], однако эти лабораторные маркеры СЗСТ в описываемом клиническом случае были в норме. В 50% случаев наблюдается повышение СОЭ, однако оно плохо коррелирует с активностью заболевания и ответом на терапию. Показатель С-реактивного белка не является специфичным, его увеличение может быть признаком сопутствующей инфекции.
Кроме интерстициальных изменений в легких, течение заболевания у пациентки характеризовалось рецидивирующим панникулитом. Появление признаков панникулита сопровождалось температурной реакцией, изменениями в ОАК в виде умеренной лейкопении. Поражение кожи может служить одним из тех симптомов болезни, которые причиняют страдание больному [6]. В данном случае, с учетом того, что признаки панникулита появлялись у пациентки на лице (надбровные области, подбородочная область), несколько деформировали лицо, создавали у молодой женщины эстетический дискомфорт, то именно они и доставляли страдание, заставлявшее обращаться за медицинской помощью. При дерматомиозите поражение кожи обычно предшествует появлению мышечной слабости или развивается одновременно с ней [8]; в данном случае отсутствуют анамнестические сведения, позволяющие оценить временную связь между этими симптомами, поскольку мышечная слабость нарастала постепенно. Слабость как основной симптом дерматомиозита у пациентки был ярко выражен, однако, с учетом того, что функции дистальных мышц конечностей нарушены не были, должного внимания этот симптом не получил.
Лейкопения регистрировалась у пациентки на протяжении всего периода наблюдения, периодически регистрировался синдром цитолиза, однократно – повышение уровня маркеров повреждения мышц – КФК, и однократно – ЛДГ. В 2020 г. на фоне нормального уровня С-реактивного белка был зарегистрирован подъем уровня антистрептолизина-О. Маркеры аутоиммунных заболеваний были отрицательными. Низкая информативность лабораторных маркеров в данном случае может быть обусловлена несвоевременностью забора биологического материла. Возможно, что забор был осуществлен в период нестойкой ремиссии аутоиммунного заболевания.
Особенностями лечения было наличие у пациентки непереносимости преднизолона и появление серьезных побочных эффектов на метилпреднизолон, что стало основанием для применения в данной клинической ситуации цитостатиков.
Анализ развития и течения дерматомиозита у данной пациентки демонстрирует манифестацию заболевания с симптомов поражения бронхолегочной системы, атипичную локализацию панникулита, отсутствие специфических стойких лабораторных маркеров воспалительного процесса и поражения мышечной ткани, отсутствие миозит-специфических аутоантител, необходимость проведения расширенного диагностического поиска в связи с полисиндромностью заболевания.
В помощь практическому врачу созданы диагностические системы – калькуляторы [10, 11], которые позволяют рассчитать вероятность диагноза воспалительной миопатии (www.imm.ki.se/biostatistics/calculators/iim) [9]. Ретроспективно мы ввели данные пациентки в онлайн-калькулятор в виде двух клинических ситуаций:
1) до биопсии мы получили результат, указывающий на вероятность заболевания равную 5%; 2) после биопсии – 87%. Второй калькулятор, который мы использовали – RheumaHelper (https://rheumahelper.com/): 1) до биопсии мы получили результат, указывающий на вероятность заболевания равную 3%; 2) после биопсии – 87%. С учетом полученной разницы онлайн-калькулятор позволяет установить достоверный диагноз только по результатам биопсии. Следует отметить, что биопсия не является методом диагностики, который назначается всем пациентам с подозрением на СЗСТ. Данный вид инвазивного диагностического вмешательства требует обоснованных показаний. Поэтому, несмотря на наличие калькуляторов, основой диагностики заболевания является клиническая оценка совокупности данных, которая благодаря клиническому мышлению врача позволяет принять решение о проведении инвазивной диагностики, по результатам которой диагноз «вероятный» становится «достоверным».
Таким образом, данный клинический случай показывает, что дерматомиозит является междисциплинарной проблемой, а повышенная осведомленность врачей смежных с ревматологией специальностей (в данном случае врача-терапевта и врача-пульмонолога) будет способствовать клинической настороженности, а врачам-ревматологам будет давать возможность своевременного выявления, определения успешности лечения, тем самым улучшая качество жизни данной категории больных.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Благодарность. Выражаем благодарность зав. отделением лучевой диагностики БУЗОО «ГКБ скорой медицинской помощи №1», врачу высшей квалификационной категории, д-ру мед. наук, заслуженному врачу РФ Галине Николаевне Доровских.
Acknowledgements. We express our gratitude to the head of the department of radiation diagnostics of BUZOO "City Clinical Emergency Hospital No.1", doctor of the highest qualification category, Dr. Sci. (Med.), Honored Doctor of the Russian Federation Galina N. Dorovskikh.
Информация об авторах
Information about the authors
Усачева Елена Владимировна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: elenav.usacheva@yandex.ru;
ORCID: 0000-0002-6134-1533; Researcher ID: I-4077-2017;
Scopus Author ID: 56380398700
Elena V. Usacheva – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: elenav.usacheva@yandex.ru; ORCID: 0000-0002-6134-1533; Researcher ID: I-4077-2017; Scopus Author ID: 56380398700
Гизатулина Ольга Николаевна – врач-ревматолог, БУЗ Омской области «Клинический диагностический центр».
E-mail: onig1410@yandex.ru
Olga N. Gizatulina – Rheumatologist, Omsk region "Clinical Diagnostic Center". E-mail: onig1410@yandex.ru
Дубровская Ирина Игоревна – врач-пульмонолог, зав. пульмонологическим отд-нием, БУЗ Омской области «ГКБ скорой медицинской помощи №2». E-mail: dubrowskaia.iri@yandex.ru
Irina I. Dubrovskaya – Pulmonologist, Omsk region "City Clinical Emergency Hospital No.2".
E-mail: dubrowskaia.iri@yandex.ru
Надей Елена Витальевна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: nadeyelena@yandex.ru; ORCID: 0000-0003-0440-7118
Elena V. Nadey – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: nadeyelena@yandex.ru;
ORCID: 0000-0003-0440-7118
Усачев Никита Андреевич – врач-терапевт, БУЗ Омской области «Городская поликлиника №4». E-mail: usakrule@gmail.com;
ORCID: 0000-0001-6051-1089
Nikita A. Usachev – General practitioner, Omsk region
"City polyclinic No.4". E-mail: usakrule@gmail.com; ORCID: 0000-0001-6051-1089
Поступила в редакцию: 22.01.2024
Поступила после рецензирования: 24.01.2024
Принята к публикации: 25.01.2024
Received: 22.01.2024
Revised: 24.01.2024
Accepted: 25.01.2024
Список исп. литературыСкрыть список1. Склянова М.В., Калягин А.Н. Сложности ранней диагностики и лечения ревматических заболеваний. Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2012;5-2(87):160-5.
Sklyanova M.V., Kalyagin A.N. The difficulties of early diagnosis and treatment of rheumatic diseases. Bulletin of the East Siberian Scientific Center of the Siberian Branch of the Russian Academy of Medical Sciences. 2012;5-2(87):160-5 (in Russian)]
2. Steiner WR. Dermatomyositis, with report of a case which presented a rare muscle anomaly but once described in man. J Exp Med (JEM). 1905;6(4-6):407-42. DOI: 10.1084/jem.6.4-6.407
3. Шабанова Н.Д. Поражение легких при дерматомиозите. Forcipe. 2022; 5 (S3): 288-289.
Shabanova N.D. Lung damage in dermatomyositis. Forcipe. 2022; 5 (S3): 288-9 (in Russian).
4. Laporte A, Mariampillai K, Allenbach Y et al. Idiopathic inflammatory myopathies: CT characteristics of interstitial lung disease and their association(s) with myositis-specific autoantibodies. Eur Radiol. 2022;32(5):3480-9. DOI: 10.1007/s00330-021-08411-w
5. Qudsiya Z, Waseem M. Dermatomyositis. 2023. URL: https://www.ncbi.nlm.nih.gov/books/NBK558917/#article-20389.s3. PMID: 32644343.
6. Антелава О.А, Егорова О.Н., Белов Б.С. и др. Панникулит при дерматомиозите. Научно-практическая ревматология. 2016;54(2): 227-32. DOI: 10.14412/1995-4484-2016-227-232.
Antelava O.A, Egorova O.N., Belov B.S. et al. Panniculitis in dermatomyositis. Scientific and practical rheumatology. 2016;54(2):227-32. DOI: 10.14412/1995-4484-2016-227-232 (in Russian).
7. Трухан Д.И., Филимонов С.Н., Викторова И.А. Клиника, диагностика и принципы лечения основных ревматических болезней. Учебное пособие для системы послевузовского профессионального образования врачей. 2-е издание, дополненное и переработанное. СПб., 2023.
Truhan D.I., Filimonov S.N., Viktorova I.A. Clinic, diagnosis and principles of treatment of major rheumatic diseases. A textbook for the system of postgraduate professional education of doctors. 2nd ed., expanded and revised. St. Petersburg, 2023 (in Russian).
8. Callen J, Wortmann R. Dermatomyositis. Clinics in dermatology. 2006;24(5):363-73.
9. Зыкова А.С., Новиков П.И., Моисеев С.В. Дерматомиозит взрослых: новые критерии диагностики и перспективы терапии. Клиническая фармакология и терапия. 2017;26(2):83-92.
Zykova A.S., Novikov P.I., Moiseev S.V. Adult dermatomyositis: new diagnostic criteria and therapy prospects. Clinical pharmacology and therapy. 2017;26(2):83-92 (in Russian).
10. Urruticoechea-Arana A, León-Vázquez F, Giner-Ruiz V et al. Development of an application for mobile phones (App) based on the collaboration between the Spanish Society of Rheumatology and Spanish Society of Family Medicine for the referral of systemic autoimmune diseases from primary care to rheumatology. Reumatología clinica. 2020;16(5 Pt 2):373-7. DOI: 10.1016/j.reuma.2019.09.001
11. Salaffi F, Farah S, Di Carlo M. Smartphone APPlications in the clinical care and management of Rheumatic Diseases. Acta Biomed. 2018;89(1):7-26. DOI: 10.23750/abm.v89i1.6545


