Клинический разбор в общей медицине №1 2024
Ural State Medical University, Ekaterinburg, Russia
inna-reznik2008@yandex.ru
Abstract
The article discusses the safety of antiarrhythmic therapy for atrial fibrillation in the light of the development of cardiac and non-cardiac side effects, the presence of drug-drug interactions of antiarrhythmic drugs in the near (with anticoagulants) and far circle. The features of the choice of antiarrhythmic therapy for the prevention of relapses of atrial fibrillation, restoration of sinus rhythm, as well as heart rate control are presented, and aspects of the tactics of managing these patients are highlighted.
Keywords: atrial fibrillation, antiarrhythmic therapy, side effects, drug-drug interactions.
For citation: Reznik I.I., Bozhko Ya.G. Safety issues of antiarrhythmic therapy for atrial fibrillation. Clinical review for general practice. 2024; 5 (1): 38–43 (In Russ.). DOI: 10.47407/kr2023.5.1.00358
Есть больные, которым мы не можем помочь, но нет больных, которым мы не могли бы навредить.
E.C. Lambert
Сердечно-сосудистые заболевания продолжают оставаться ведущей причиной смертности и инвалидизации населения России [1]. В структуре кардиологических заболеваний, несомненно, важная роль отводится нарушениям сердечного ритма, среди которых по распространенности лидирует фибрилляция предсердий (ФП) [2, 3]. Развитие неклапанной ФП связано с ухудшением прогноза и качества жизни большинства пациентов. Сегодня ФП рассматривается как один из наиболее значимых факторов риска развития инсульта и транзиторных ишемических атак (ТИА): до 20% ишемических инсультов и 17% ТИА возникают вследствие ФП [4].
В последние годы получены убедительные доказательства в пользу контроля ритма при ФП. Данная стратегия приводит к лучшим исходам, чем контроль частоты сердечных сокращений [5], и для ее реализации требуется постоянный прием антиаритмических препаратов (ААП), зачастую даже после применения методов интервенционного лечения нарушений сердечного ритма.
Наиболее распространенным ААП является амиодарон, однако его применение, особенно у пациентов пожилого возраста, существенно ограничивают побочные эффекты [6]. Кардиальные нежелательные реакции (нарушение атриовентрикулярной проводимости, удлинение интервала QT с риском развития аритмии «torsades de pointes») при применении амиодарона встречаются довольно редко. Наибольшее беспокойство вызывают его некардиальные побочные эффекты, многие из которых обусловлены наличием йода в структуре препарата. Длительный период полувыведения (20–55 дней) и выраженная кумуляция во многих органах (печени, легких, селезенке, жировой ткани) осложняют не только применение препарата, в частности в нагрузочных дозах, но и дальнейший перевод пациента с амиодарона на другой ААП [7]. Серьезные нежелательные реакции, связанные с применением амиодарона, включают в себя микроотложения в эпителии роговицы (встречаются с частотой более 90%), фотосенсибилизацию (25–75%), нарушение функции щитовидной железы (до 24%), гепатотоксичность (повышение печеночных трансаминаз – 15–30%, гепатит и цирроз – 3%), пневмонит вплоть до развития фиброза (1–17%), а также нейропатию/неврит зрительного нерва (1–2%). Более того, при длительном применении амиодарон может вызывать существенное повышение уровня триглицеридов и общего холестерина. У 4–9% пациентов, получающих амиодарон, наблюдается серовато-голубоватое окрашивание отдельных участков кожи, которое может быть признаком кумуляции препарата. В целом, общая частота возникновения нежелательных реакций на фоне применения амиодарона достигает 70% [6, 8].
Учитывая токсический профиль амиодарона, препарат необходимо назначать в минимальной эффективной дозе, которая у многих пожилых с ФП составляет не более 100 мг/сут. В период лечения требуется осуществлять тщательный мониторинг частоты сердечных сокращений (во избежание развития чрезмерной брадикардии) и ЭКГ-контроль (интервал QT). При длительном лечении необходим регулярный контроль функции щитовидной железы, рентгенологической картины со стороны легких, а также наблюдение у офтальмолога [6, 7]. Функцию щитовидной железы необходимо контролировать до начала лечения, через 1 и 3 мес после начала, а далее через каждые 3–6 мес [9].
Из-за частого возникновения нежелательных явлений при приеме амиодарона нередко возникает необходимость перевода пациента на другой ААП, в частности на препараты I класса по классификации Vaughan Williams [10]. Такая возможность представляется лишь при отсутствии грубой органической (структурной) патологии сердца, под которой понимают острые формы ишемической болезни сердца, постинфарктный кардиосклероз, хроническую сердечную недостаточность (ХСН) с низкой фракцией выброса, гипертрофию левого желудочка более 1,4 см, либо наличие полной блокады ножек пучка Гиса [11]. Некоторые из препаратов IА класса (дизопирамид, хинидин) в определенной степени уже утратили свое клиническое значение, в то время как препараты IC класса (пропафенон, этацизин, аллапинин) заслуживают особого рассмотрения [12]. На сегодняшний день наибольшей доказательной базой обладает пропафенон (Пропанорм), в связи с чем он представлен в европейских клинических рекомендациях по ведению ФП, в то время как аллапинин и этацизин присутствуют только в отечественных рекомендациях [13].
 Являясь классическим блокатором быстрых натриевых каналов, пропанорм также обладает дополнительными свойствами β-адреноблокатора (β-АБ), что, несомненно, усиливает его антиаритмическую активность. Интересны результаты исследования ПРОМЕТЕЙ-ИНСК, включившего 388 пациентов с ФП продолжительностью менее года без структурной патологии сердца [14]. В исследовании была проведена оценка эффективности и времени восстановления синусового ритма при внутривенном болюсном введении амиодарона или пропанорма. Оба препарата продемонстрировали сопоставимую эффективность, однако восстановление синусового ритма быстрее достигалось в группе пропанорма (среднее время 22 мин), нежели в группе амиодарона (110 мин). В целом пропанорм оказывает выраженное антиаритмическое действие уже в первые несколько часов от начала введения, в то время как амиодарон – ко вторым суткам. Учитывая полученные в исследовании данные, а также токсический профиль амиодарона, последний не должен рассматриваться в качестве препарата 1-й линии для неотложной терапии у пациентов без выраженных структурных изменений сердца с недавно возникшей ФП.
Являясь классическим блокатором быстрых натриевых каналов, пропанорм также обладает дополнительными свойствами β-адреноблокатора (β-АБ), что, несомненно, усиливает его антиаритмическую активность. Интересны результаты исследования ПРОМЕТЕЙ-ИНСК, включившего 388 пациентов с ФП продолжительностью менее года без структурной патологии сердца [14]. В исследовании была проведена оценка эффективности и времени восстановления синусового ритма при внутривенном болюсном введении амиодарона или пропанорма. Оба препарата продемонстрировали сопоставимую эффективность, однако восстановление синусового ритма быстрее достигалось в группе пропанорма (среднее время 22 мин), нежели в группе амиодарона (110 мин). В целом пропанорм оказывает выраженное антиаритмическое действие уже в первые несколько часов от начала введения, в то время как амиодарон – ко вторым суткам. Учитывая полученные в исследовании данные, а также токсический профиль амиодарона, последний не должен рассматриваться в качестве препарата 1-й линии для неотложной терапии у пациентов без выраженных структурных изменений сердца с недавно возникшей ФП.
Следует добавить, что пропанорм, продемонстрировавший высокую эффективность в восстановлении ритма при ФП, является единственным препаратом с возможностью применения в режиме «таблетка в кармане» для купирования пароксизмов аритмии в домашних условиях [15].
Не менее важной задачей, помимо купирования пароксизмов ФП, является предупреждение рецидивирования аритмии, удержание синусового ритма. Согласно рекомендациям ESC 2020 г. по диагностике и лечению пациентов с ФП для удержания синусового ритма с классом рекомендаций I и уровнем доказательности А могут использоваться амиодарон, пропафенон и соталол [13].
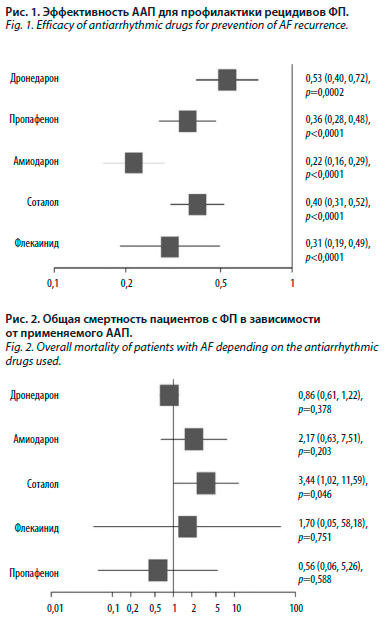
На рисунках представлены данные по эффективности ААП для профилактики рецидивов ФП (рис. 1), а также общей смертности пациентов с ФП в зависимости от применяемого ААП (рис. 2) [16].
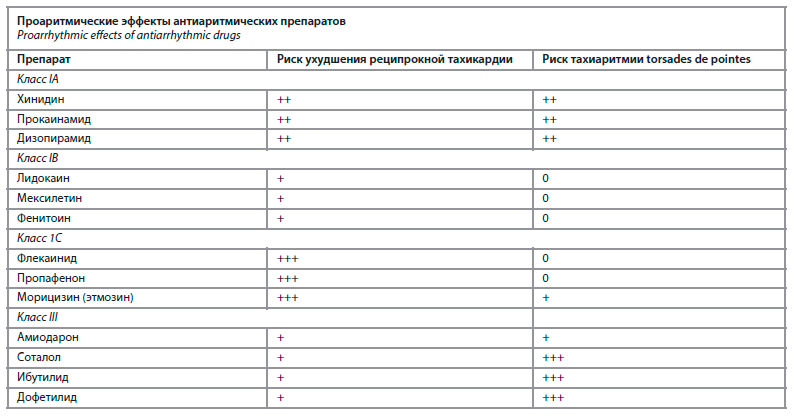
Как видно из представленных данных, на первом месте по эффективности оказался амиодарон, однако в плане безопасности наилучший профиль продемонстрировал пропафенон. Наиболее неблагоприятным оказалось применение соталола. Это обусловлено тем, что препарат способен значительно удлинять интервал QT, причем в большей степени, чем амиодарон (см. таблицу).
В результате резко возрастает риск развития полиморфной желудочковой тахикардии «torsades de pointеs» [17].
Как антиаритмический препарат соталол является неселективным β-АБ и в относительно высоких дозах – блокатором калиевых каналов. Он может применяться при желудочковых и суправентрикулярных тахикардиях, в том числе у пациентов с коронарной болезнью сердца [17, 18]. Соталол в суточной дозе до 160 мг проявляет себя как β-АБ и, соответственно, может использоваться для контроля частоты сердечных сокращений при ФП. Дозы соталола более 160 мг, а именно 240–320 мг, назначаются для контроля ритма, однако именно в таком режиме дозирования наиболее выражены проаритмические свойства препарата. В связи с этим соталол в терапии пациентов с постинфарктным кардиосклерозом должен назначаться в дозе не более 160 мг/сут, а ХСН с низкой фракцией выброса (менее 40%) является противопоказанием к его использованию. Лечение соталолом следует начинать в условиях стационара под контролем гемодинамических эффектов и продолжительности интервала QT на электрокардиографии (ЭКГ). Особенно тщательный мониторинг требуется пациентам с низкой массой тела или нарушением функции почек. В частности, при снижении скорости клубочковой фильтрации (СКФ) менее
60 мл/мин доза соталола должна быть снижена на четверть, и наполовину (!) – при СКФ менее 30 мл/мин. Поскольку препарат не метаболизируется в печени (менее 1%) и не влияет на активность изоферментов цитохрома Р450, то он практически не вступает в фармакокинетические взаимодействия с другими лекарственными средствами. Однако следует избегать одновременного применения соталола с другими препаратами, удлиняющими интервал QT: макролидами (эритромицин, кларитромицин, азитромицин), фторхинолонами (моксифлоксацин, левофлоксацин), противогрибковыми препаратами (кетоконазол, интраконазол), нейролептиками (аминазин, галоперидол, дроперидол), антидепрессантами (имипрамин, флуоксетин, праоксетин) и др. [18].
Межлекарственные взаимодействия антиаритмических препаратов в ближнем круге в первую очередь касаются антикоагулянтов. Известно, что амиодарон метаболизируется в печени с участием изоферментов цитохрома Р450 (СYP1А2, 2С9, 2D6, ЗА4 и др.), что обусловливает высокий риск лекарственных взаимодействий при его применении, среди которых наиболее опасным является взаимодействие с непрямым оральным антикоагулянтом варфарином [19, 20]. Это обусловлено взаимодействием препаратов через несколько подсемейств системы цитохрома P450 (СYP 2D6 и 3А4). Одновременное применение данных препаратов сопряжено с повышенным риском кровотечений. Не случайно существует установка, что если амиодарон неизбежен, то лучше назначить прямой оральный антикоагулянт (ПОАК) [20]. В отличие от амиодарона, пропанорм значительно меньше взаимодействует с варфарином, и в данной ситуации не требуется поиск альтернативных решений при проведении антикоагулянтной терапии, а лишь тщательный МНО-мониторинг. В отношении взаимодействия названных ААП с ПОАК также следует отметить значительно лучшие позиции пропанорма: он не взаимодействует ни с одним из антикоагулянтов данной группы, в то время как амиодарон усиливает действие дабигатрана и незначительно влияет на метаболизм ривароксабана и апиксабана [21].
Необходимо добавить, что всасывание и элиминацию ПОАК в основном обеспечивает семейство мембранных транспортных белков – P-гликопротеинов (P-gp), локализованных на мембранах энтероцитов, в почках, печени и других органах. Изменение функции P-gp под влиянием ингибиторов или индукторов может повлиять на плазменную и внутриклеточную концентрацию лекарственных препаратов, их биодоступность, всасывание в кишечнике или почечную элиминацию. В этой же системе частично метаболизируются уже упомянутые ААП – амиодарон и пропанорм. Оба препарата способны ингибировать метаболизм ПОАК, в результате чего концентрация последних увеличивается. Однако амиодарон в этой ситуации проявляет себя как сильный ингибитор, а пропанорм – слабый, поэтому применение пропанорма несомненно более безопасно [21].
При осуществлении контроля частоты сердечных сокращений используются, как известно, β-АБ, дигоксин, верапамил и дилтиазем. Верапамил может увеличивать антикоагулянтный эффект дабигатрана на 12–180% (!), а дилтиазем способен изменять метаболизм апиксабана, в результате чего антикоагулянтная активность последнего возрастает до 53%. Поэтому при назначении верапамила с целью контроля частоты сердечных сокращений при ФП в качестве антикоагулянта не следует рассматривать дабигатран, а в ситуации с дилтиаземом нежелателен апиаксабан [23].
Дигоксин метаболизируется как через систему изоферментов цитохрома P450 (преимущественно CYP 3A4), так и через гликопротеин P. В обоих случаях дигоксин является субстратом, а амиодарон ингибитором. Поэтому при совместном назначении этих препаратов существенно увеличивается риск дигиталисной интоксикации, в связи с чем доза дигоксина должна быть снижена не менее чем в 2 раза (вплоть до полной отмены!) [24].
Заслуживают внимания межлекарственные взаимодействия антиаритмических препаратов в дальнем круге. Амиодарон, являясь сильным ингибитором в подсемействе 3A4 цитохрома P450, замедляет метаболизм таких субстратов данной системы, как симвастатин и аторвастатин. При этом существенно возрастает риск развития миопатий, вплоть до развития рабдомиолиза. В этой ситуации необходимо помнить, что более безопасным с точки зрения межлекарственных взаимодействий является назначение розувастатина или питавастатина, которые не метаболизируются через подсемейство CYP 3A4. Кроме того, в период лечения амиодароном не рекомендуется употребление грейпфрутового сока, так как последний может на 50% повышать площадь под кривой «концентрация–время» (AUC) у данного препарата [24, 25].
В целом межлекарственные взаимодействия амиодарона реализуются через множество подсемейств цитохрома P450. Через подсемейство CYP 1А2 амиодарон замедляет метаболизм кофеина, парацетамола, теофиллина; подсемейство CYP 2С9 фигурирует во взаимодействии амиодарона с некоторыми нестероидными противовоспалительными препаратами, сартанами и петлевыми диуретиками (торасемид), а CYP 2D6 – с β-АБ, антидепрессантами и ненаркотическими анальгетиками (трамадол). Наконец, через уже названное подсемейство CYP 3А4 амиодарон замедляет метаболизм макролидов, бензодиазепиновых анксиолитиков, стероидных гормонов, а также β2-адреномиметиков, увеличивая риск возникновения побочных эффектов при их применении [24, 26].
Пропанорм характеризуется значительно меньшим спектром межлекарственных взаимодействий в дальнем круге в сравнении с амиодароном [24, 26].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Резник Инна Ильинична – д-р мед. наук, проф. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: inna-reznik2008@yandex.ru
Inna I. Reznik – Dr. Sci. (Med.), Prof., Ural State Medical University. E-mail: inna-reznik2008@yandex.ru
Божко Яков Григорьевич – канд. мед. наук, доц. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: yakov-bozhko@yandex.ru
Yakov G. Bozhko – Cand. Sci. (Med.), Ural State Medical University. E-mail: yakov-bozhko@yandex.ru
Поступила в редакцию: 12.02.2024
Поступила после рецензирования: 14.02.2024
Принята к публикации: 15.02.2024
Received: 12.02.2024
Revised: 14.02.2024
Accepted: 15.02.2024
Клинический разбор в общей медицине №1 2024
Вопросы безопасности антиаритмической терапии при фибрилляции предсердий
Номера страниц в выпуске:38-43
Аннотация
В статье рассмотрены вопросы безопасности антиаритмической терапии при фибрилляции предсердий в свете развития кардиальных и некардиальных побочных эффектов, наличия межлекарственных взаимодействий антиаритмических препаратов в ближнем (с антикоагулянтами) и дальнем круге. Представлены особенности выбора антиаритмической терапии для профилактики рецидивов фибрилляции предсердий, восстановления синусового ритма, а также контроля частоты сердечных сокращений, освещены аспекты тактики ведения данных больных.
Ключевые слова: фибрилляция предсердий, антиаритмическая терапия, побочные эффекты, межлекарственные взаимодействия.
Для цитирования: Резник И.И., Божко Я.Г. Вопросы безопасности антиаритмической терапии при фибрилляции предсердий. Клинический разбор в общей медицине. 2024; 5 (1): 38–43. DOI: 10.47407/kr2023.5.1.00358
В статье рассмотрены вопросы безопасности антиаритмической терапии при фибрилляции предсердий в свете развития кардиальных и некардиальных побочных эффектов, наличия межлекарственных взаимодействий антиаритмических препаратов в ближнем (с антикоагулянтами) и дальнем круге. Представлены особенности выбора антиаритмической терапии для профилактики рецидивов фибрилляции предсердий, восстановления синусового ритма, а также контроля частоты сердечных сокращений, освещены аспекты тактики ведения данных больных.
Ключевые слова: фибрилляция предсердий, антиаритмическая терапия, побочные эффекты, межлекарственные взаимодействия.
Для цитирования: Резник И.И., Божко Я.Г. Вопросы безопасности антиаритмической терапии при фибрилляции предсердий. Клинический разбор в общей медицине. 2024; 5 (1): 38–43. DOI: 10.47407/kr2023.5.1.00358
Safety issues of antiarrhythmic therapy for atrial fibrillation
I.I. Reznik, Ya.G. BozhkoUral State Medical University, Ekaterinburg, Russia
inna-reznik2008@yandex.ru
Abstract
The article discusses the safety of antiarrhythmic therapy for atrial fibrillation in the light of the development of cardiac and non-cardiac side effects, the presence of drug-drug interactions of antiarrhythmic drugs in the near (with anticoagulants) and far circle. The features of the choice of antiarrhythmic therapy for the prevention of relapses of atrial fibrillation, restoration of sinus rhythm, as well as heart rate control are presented, and aspects of the tactics of managing these patients are highlighted.
Keywords: atrial fibrillation, antiarrhythmic therapy, side effects, drug-drug interactions.
For citation: Reznik I.I., Bozhko Ya.G. Safety issues of antiarrhythmic therapy for atrial fibrillation. Clinical review for general practice. 2024; 5 (1): 38–43 (In Russ.). DOI: 10.47407/kr2023.5.1.00358
Есть больные, которым мы не можем помочь, но нет больных, которым мы не могли бы навредить.
E.C. Lambert
Сердечно-сосудистые заболевания продолжают оставаться ведущей причиной смертности и инвалидизации населения России [1]. В структуре кардиологических заболеваний, несомненно, важная роль отводится нарушениям сердечного ритма, среди которых по распространенности лидирует фибрилляция предсердий (ФП) [2, 3]. Развитие неклапанной ФП связано с ухудшением прогноза и качества жизни большинства пациентов. Сегодня ФП рассматривается как один из наиболее значимых факторов риска развития инсульта и транзиторных ишемических атак (ТИА): до 20% ишемических инсультов и 17% ТИА возникают вследствие ФП [4].
В последние годы получены убедительные доказательства в пользу контроля ритма при ФП. Данная стратегия приводит к лучшим исходам, чем контроль частоты сердечных сокращений [5], и для ее реализации требуется постоянный прием антиаритмических препаратов (ААП), зачастую даже после применения методов интервенционного лечения нарушений сердечного ритма.
Наиболее распространенным ААП является амиодарон, однако его применение, особенно у пациентов пожилого возраста, существенно ограничивают побочные эффекты [6]. Кардиальные нежелательные реакции (нарушение атриовентрикулярной проводимости, удлинение интервала QT с риском развития аритмии «torsades de pointes») при применении амиодарона встречаются довольно редко. Наибольшее беспокойство вызывают его некардиальные побочные эффекты, многие из которых обусловлены наличием йода в структуре препарата. Длительный период полувыведения (20–55 дней) и выраженная кумуляция во многих органах (печени, легких, селезенке, жировой ткани) осложняют не только применение препарата, в частности в нагрузочных дозах, но и дальнейший перевод пациента с амиодарона на другой ААП [7]. Серьезные нежелательные реакции, связанные с применением амиодарона, включают в себя микроотложения в эпителии роговицы (встречаются с частотой более 90%), фотосенсибилизацию (25–75%), нарушение функции щитовидной железы (до 24%), гепатотоксичность (повышение печеночных трансаминаз – 15–30%, гепатит и цирроз – 3%), пневмонит вплоть до развития фиброза (1–17%), а также нейропатию/неврит зрительного нерва (1–2%). Более того, при длительном применении амиодарон может вызывать существенное повышение уровня триглицеридов и общего холестерина. У 4–9% пациентов, получающих амиодарон, наблюдается серовато-голубоватое окрашивание отдельных участков кожи, которое может быть признаком кумуляции препарата. В целом, общая частота возникновения нежелательных реакций на фоне применения амиодарона достигает 70% [6, 8].
Учитывая токсический профиль амиодарона, препарат необходимо назначать в минимальной эффективной дозе, которая у многих пожилых с ФП составляет не более 100 мг/сут. В период лечения требуется осуществлять тщательный мониторинг частоты сердечных сокращений (во избежание развития чрезмерной брадикардии) и ЭКГ-контроль (интервал QT). При длительном лечении необходим регулярный контроль функции щитовидной железы, рентгенологической картины со стороны легких, а также наблюдение у офтальмолога [6, 7]. Функцию щитовидной железы необходимо контролировать до начала лечения, через 1 и 3 мес после начала, а далее через каждые 3–6 мес [9].
Из-за частого возникновения нежелательных явлений при приеме амиодарона нередко возникает необходимость перевода пациента на другой ААП, в частности на препараты I класса по классификации Vaughan Williams [10]. Такая возможность представляется лишь при отсутствии грубой органической (структурной) патологии сердца, под которой понимают острые формы ишемической болезни сердца, постинфарктный кардиосклероз, хроническую сердечную недостаточность (ХСН) с низкой фракцией выброса, гипертрофию левого желудочка более 1,4 см, либо наличие полной блокады ножек пучка Гиса [11]. Некоторые из препаратов IА класса (дизопирамид, хинидин) в определенной степени уже утратили свое клиническое значение, в то время как препараты IC класса (пропафенон, этацизин, аллапинин) заслуживают особого рассмотрения [12]. На сегодняшний день наибольшей доказательной базой обладает пропафенон (Пропанорм), в связи с чем он представлен в европейских клинических рекомендациях по ведению ФП, в то время как аллапинин и этацизин присутствуют только в отечественных рекомендациях [13].
 Являясь классическим блокатором быстрых натриевых каналов, пропанорм также обладает дополнительными свойствами β-адреноблокатора (β-АБ), что, несомненно, усиливает его антиаритмическую активность. Интересны результаты исследования ПРОМЕТЕЙ-ИНСК, включившего 388 пациентов с ФП продолжительностью менее года без структурной патологии сердца [14]. В исследовании была проведена оценка эффективности и времени восстановления синусового ритма при внутривенном болюсном введении амиодарона или пропанорма. Оба препарата продемонстрировали сопоставимую эффективность, однако восстановление синусового ритма быстрее достигалось в группе пропанорма (среднее время 22 мин), нежели в группе амиодарона (110 мин). В целом пропанорм оказывает выраженное антиаритмическое действие уже в первые несколько часов от начала введения, в то время как амиодарон – ко вторым суткам. Учитывая полученные в исследовании данные, а также токсический профиль амиодарона, последний не должен рассматриваться в качестве препарата 1-й линии для неотложной терапии у пациентов без выраженных структурных изменений сердца с недавно возникшей ФП.
Являясь классическим блокатором быстрых натриевых каналов, пропанорм также обладает дополнительными свойствами β-адреноблокатора (β-АБ), что, несомненно, усиливает его антиаритмическую активность. Интересны результаты исследования ПРОМЕТЕЙ-ИНСК, включившего 388 пациентов с ФП продолжительностью менее года без структурной патологии сердца [14]. В исследовании была проведена оценка эффективности и времени восстановления синусового ритма при внутривенном болюсном введении амиодарона или пропанорма. Оба препарата продемонстрировали сопоставимую эффективность, однако восстановление синусового ритма быстрее достигалось в группе пропанорма (среднее время 22 мин), нежели в группе амиодарона (110 мин). В целом пропанорм оказывает выраженное антиаритмическое действие уже в первые несколько часов от начала введения, в то время как амиодарон – ко вторым суткам. Учитывая полученные в исследовании данные, а также токсический профиль амиодарона, последний не должен рассматриваться в качестве препарата 1-й линии для неотложной терапии у пациентов без выраженных структурных изменений сердца с недавно возникшей ФП. Следует добавить, что пропанорм, продемонстрировавший высокую эффективность в восстановлении ритма при ФП, является единственным препаратом с возможностью применения в режиме «таблетка в кармане» для купирования пароксизмов аритмии в домашних условиях [15].
Не менее важной задачей, помимо купирования пароксизмов ФП, является предупреждение рецидивирования аритмии, удержание синусового ритма. Согласно рекомендациям ESC 2020 г. по диагностике и лечению пациентов с ФП для удержания синусового ритма с классом рекомендаций I и уровнем доказательности А могут использоваться амиодарон, пропафенон и соталол [13].
На рисунках представлены данные по эффективности ААП для профилактики рецидивов ФП (рис. 1), а также общей смертности пациентов с ФП в зависимости от применяемого ААП (рис. 2) [16].

Как видно из представленных данных, на первом месте по эффективности оказался амиодарон, однако в плане безопасности наилучший профиль продемонстрировал пропафенон. Наиболее неблагоприятным оказалось применение соталола. Это обусловлено тем, что препарат способен значительно удлинять интервал QT, причем в большей степени, чем амиодарон (см. таблицу).
В результате резко возрастает риск развития полиморфной желудочковой тахикардии «torsades de pointеs» [17].
Как антиаритмический препарат соталол является неселективным β-АБ и в относительно высоких дозах – блокатором калиевых каналов. Он может применяться при желудочковых и суправентрикулярных тахикардиях, в том числе у пациентов с коронарной болезнью сердца [17, 18]. Соталол в суточной дозе до 160 мг проявляет себя как β-АБ и, соответственно, может использоваться для контроля частоты сердечных сокращений при ФП. Дозы соталола более 160 мг, а именно 240–320 мг, назначаются для контроля ритма, однако именно в таком режиме дозирования наиболее выражены проаритмические свойства препарата. В связи с этим соталол в терапии пациентов с постинфарктным кардиосклерозом должен назначаться в дозе не более 160 мг/сут, а ХСН с низкой фракцией выброса (менее 40%) является противопоказанием к его использованию. Лечение соталолом следует начинать в условиях стационара под контролем гемодинамических эффектов и продолжительности интервала QT на электрокардиографии (ЭКГ). Особенно тщательный мониторинг требуется пациентам с низкой массой тела или нарушением функции почек. В частности, при снижении скорости клубочковой фильтрации (СКФ) менее
60 мл/мин доза соталола должна быть снижена на четверть, и наполовину (!) – при СКФ менее 30 мл/мин. Поскольку препарат не метаболизируется в печени (менее 1%) и не влияет на активность изоферментов цитохрома Р450, то он практически не вступает в фармакокинетические взаимодействия с другими лекарственными средствами. Однако следует избегать одновременного применения соталола с другими препаратами, удлиняющими интервал QT: макролидами (эритромицин, кларитромицин, азитромицин), фторхинолонами (моксифлоксацин, левофлоксацин), противогрибковыми препаратами (кетоконазол, интраконазол), нейролептиками (аминазин, галоперидол, дроперидол), антидепрессантами (имипрамин, флуоксетин, праоксетин) и др. [18].
Межлекарственные взаимодействия антиаритмических препаратов в ближнем круге в первую очередь касаются антикоагулянтов. Известно, что амиодарон метаболизируется в печени с участием изоферментов цитохрома Р450 (СYP1А2, 2С9, 2D6, ЗА4 и др.), что обусловливает высокий риск лекарственных взаимодействий при его применении, среди которых наиболее опасным является взаимодействие с непрямым оральным антикоагулянтом варфарином [19, 20]. Это обусловлено взаимодействием препаратов через несколько подсемейств системы цитохрома P450 (СYP 2D6 и 3А4). Одновременное применение данных препаратов сопряжено с повышенным риском кровотечений. Не случайно существует установка, что если амиодарон неизбежен, то лучше назначить прямой оральный антикоагулянт (ПОАК) [20]. В отличие от амиодарона, пропанорм значительно меньше взаимодействует с варфарином, и в данной ситуации не требуется поиск альтернативных решений при проведении антикоагулянтной терапии, а лишь тщательный МНО-мониторинг. В отношении взаимодействия названных ААП с ПОАК также следует отметить значительно лучшие позиции пропанорма: он не взаимодействует ни с одним из антикоагулянтов данной группы, в то время как амиодарон усиливает действие дабигатрана и незначительно влияет на метаболизм ривароксабана и апиксабана [21].
Необходимо добавить, что всасывание и элиминацию ПОАК в основном обеспечивает семейство мембранных транспортных белков – P-гликопротеинов (P-gp), локализованных на мембранах энтероцитов, в почках, печени и других органах. Изменение функции P-gp под влиянием ингибиторов или индукторов может повлиять на плазменную и внутриклеточную концентрацию лекарственных препаратов, их биодоступность, всасывание в кишечнике или почечную элиминацию. В этой же системе частично метаболизируются уже упомянутые ААП – амиодарон и пропанорм. Оба препарата способны ингибировать метаболизм ПОАК, в результате чего концентрация последних увеличивается. Однако амиодарон в этой ситуации проявляет себя как сильный ингибитор, а пропанорм – слабый, поэтому применение пропанорма несомненно более безопасно [21].
При осуществлении контроля частоты сердечных сокращений используются, как известно, β-АБ, дигоксин, верапамил и дилтиазем. Верапамил может увеличивать антикоагулянтный эффект дабигатрана на 12–180% (!), а дилтиазем способен изменять метаболизм апиксабана, в результате чего антикоагулянтная активность последнего возрастает до 53%. Поэтому при назначении верапамила с целью контроля частоты сердечных сокращений при ФП в качестве антикоагулянта не следует рассматривать дабигатран, а в ситуации с дилтиаземом нежелателен апиаксабан [23].
Дигоксин метаболизируется как через систему изоферментов цитохрома P450 (преимущественно CYP 3A4), так и через гликопротеин P. В обоих случаях дигоксин является субстратом, а амиодарон ингибитором. Поэтому при совместном назначении этих препаратов существенно увеличивается риск дигиталисной интоксикации, в связи с чем доза дигоксина должна быть снижена не менее чем в 2 раза (вплоть до полной отмены!) [24].
Заслуживают внимания межлекарственные взаимодействия антиаритмических препаратов в дальнем круге. Амиодарон, являясь сильным ингибитором в подсемействе 3A4 цитохрома P450, замедляет метаболизм таких субстратов данной системы, как симвастатин и аторвастатин. При этом существенно возрастает риск развития миопатий, вплоть до развития рабдомиолиза. В этой ситуации необходимо помнить, что более безопасным с точки зрения межлекарственных взаимодействий является назначение розувастатина или питавастатина, которые не метаболизируются через подсемейство CYP 3A4. Кроме того, в период лечения амиодароном не рекомендуется употребление грейпфрутового сока, так как последний может на 50% повышать площадь под кривой «концентрация–время» (AUC) у данного препарата [24, 25].
В целом межлекарственные взаимодействия амиодарона реализуются через множество подсемейств цитохрома P450. Через подсемейство CYP 1А2 амиодарон замедляет метаболизм кофеина, парацетамола, теофиллина; подсемейство CYP 2С9 фигурирует во взаимодействии амиодарона с некоторыми нестероидными противовоспалительными препаратами, сартанами и петлевыми диуретиками (торасемид), а CYP 2D6 – с β-АБ, антидепрессантами и ненаркотическими анальгетиками (трамадол). Наконец, через уже названное подсемейство CYP 3А4 амиодарон замедляет метаболизм макролидов, бензодиазепиновых анксиолитиков, стероидных гормонов, а также β2-адреномиметиков, увеличивая риск возникновения побочных эффектов при их применении [24, 26].
Пропанорм характеризуется значительно меньшим спектром межлекарственных взаимодействий в дальнем круге в сравнении с амиодароном [24, 26].
Заключение
Подводя итог, можно констатировать, что вопреки укоренившейся стратегии начала антиаритмической терапии при ФП с амиодарона, в случае отсутствия выраженной структурной патологии сердца следует отдавать предпочтение препарату IС класса пропанорму, который применяют не только для купирования пароксизмов аритмии, но и в целях удержания синусового ритма. Пропанорм отличается быстрым наступлением эффекта при внутривенном введении, а также возможностью купирования пароксизма ФП в домашних условиях (стратегия «таблетка в кармане»). При этом имеется более низкий риск межлекарственных взаимодействий пропанорма через систему цитохрома P450 и транспортного белка Р-гликопротеина в сравнении с амиодароном. Это позволяет длительно принимать данный препарат с минимальным риском изменения его клинических свойств при сопутствующей терапии антикоагулянтами. В отличие от амиодарона и соталола, пропанорм не удлиняет интервал QT, в связи с чем существенно снижается опасность проаритмического действия, в первую очередь «пируэтной» тахикардии.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Резник Инна Ильинична – д-р мед. наук, проф. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: inna-reznik2008@yandex.ru
Inna I. Reznik – Dr. Sci. (Med.), Prof., Ural State Medical University. E-mail: inna-reznik2008@yandex.ru
Божко Яков Григорьевич – канд. мед. наук, доц. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: yakov-bozhko@yandex.ru
Yakov G. Bozhko – Cand. Sci. (Med.), Ural State Medical University. E-mail: yakov-bozhko@yandex.ru
Поступила в редакцию: 12.02.2024
Поступила после рецензирования: 14.02.2024
Принята к публикации: 15.02.2024
Received: 12.02.2024
Revised: 14.02.2024
Accepted: 15.02.2024
Список исп. литературыСкрыть список1. Бойцов С.А., Шальнова С.А., Деев А.Д. Смертность от сердечно-сосудистых заболеваний в Российской Федерации и возможные механизмы ее изменения. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(8):98-103. DOI: 10.17116/jnevro201811808198
Boytsov S.A., Shalnova S.A., Deev A.D. Cardiovascular mortality in the Russian Federation and possible mechanisms of itschanges. Zhurnal Nevrologii I Psikhiatrii imeni S.S. Korsakova. 2018;118(8):98 103. DOI: 10.17116/jnevro201811808198 (in Russian).
2. Go AS, Mozaffarian D, Roger VL et al. Heart disease and stroke statistics-2014 update: a report from the American Heart Association. Circulation. 2014;129(3):28–292. DOI: 10.1161/01.cir.0000441139. 02102.80
3. Божко Я.Г., Архипов М.В., Молодых С.В. Особенности ведения пациентов с дисфункцией синусового узла неишемического генеза: в фокусе синдром тахибрадикардии. Уральский медицинский журнал. 2019;7(175):17-27.
Bozhko Ya.G., Arkhipov M.V., Molodykh S.V. Features of the management of patients with sinus node dysfunction of non-ischemic origin: tachy-bradycardia syndrome in focus. Ural Medical Journal. 2019;7(175):17-27. DOI: 10.25694/URMJ.2019.07.08 (in Russian).
4. Sheikh A, Patel NJ, Nalluri N et al. Trends in hospitalization for atrial fibrillation: epidemiology, cost, and implications for the future. Prog Cardiovasc Dis. 2015;58(2):105-16. DOI: 10.1016/j.pcad.2015.07.002
5. Krchhof P, Camm AJ, Goette A et al. Early Rhythm-Control Therapy in Patients with Atrial Fibrillation. N Engl J Med. 2020;383(14):1305-16. DOI: 10.1056/NEJMoa2019422
6. Гайсёнок О.В. Особенности применения амиодарона в клинической практике: к вопросу о побочных эффектах препарата. Рациональная фармакотерапия в кардиологии. 2010;6(6):823-7. DOI:10.20996/1819-6446-2010-6-6-823-827
Gaisenok O.V. The use of amiodarone in clinical practice: the problem of side effects. Rational Pharmacother Card. 2010;6(6):823-7. DOI:10.20996/1819-6446-2010-6-6-823-827 (in Russian).
7. Кардиальные и эндокринные аспекты применения амиодарона в современной практике лечения нарушений ритма сердца. Методическое пособие. Под ред. Е.И. Чазова, И.И. Дедова. М.: Прототип, 2005.
Cardiac and endocrine aspects of the use of amiodarone in the modern practice of treating cardiac arrhythmias. Manual. Eds. E.I. Chazov,
I.I. Dedov. Moscow: Prototip, 2005 (in Russian).
8. You HS, Yoon JH, Cho SB et al. Amiodarone-Induced Multi-Systemic Toxicity Involving the Liver, Lungs, Thyroid, and Eyes: A Case Report. Front Cardiovasc Med. 2022;28:9:839441. DOI: 10.3389/fcvm.2022. 839441
9. Mikosch P. Thyroid and treatment with amiodarone diagnosis, therapy and clinical management. Wien Med Wochenschr. 2008; 158(1-2):29-35. DOI: 10.1007/s10354-007-0475-x
10. Lei M, Wu L, Terrar DA et al. Modernized Classification of Cardiac Antiarrhythmic Drugs. Circulation. 2018;138(17):1879-96. DOI: 10.1161/CIRCULATIONAHA.118.035455
11. McNamara RL, Tamariz LJ, Segal JB et al. Management of atrial fibrillation: review of the evidence for the role of pharmacologic therapy, electrical cardioversion, and echocardiography. Ann Intern Med. 2003; 139(12):1018-33. DOI: 10.7326/0003-4819-139-12-200312160-00012
12. Kapustnick Yu, Lutsenko R, Sуdorenko А. Combined pharmacological therapy including several antiarrhythmic agents for treatment of different disorders of cardiac rhythm. Georgian Med News. 2021;(315):85-93.
13. Hindricks G, Potpara T, Dagres Net et al. Рекомендации ESC 2020 по диагностике и лечению пациентов с фибрилляцией предсердий, разработанные совместно с Европейской ассоциацией кардиоторакальной хирургии (EACTS). Российский кардиологический журнал. 2021;26(9):4701. DOI: 10.15829/1560-4071-2021-4701
Hindricks G, Potpara T, Dagres Net et al. ESC 2020 guidelines for the diagnosis and treatment of patients with atrial fibrillation, developed jointly with the European Association of Cardiothoracic Surgery (EACTS). Russian Journal of Cardiology. 2021;26(9):4701. DOI: 10.15829/1560-4071-2021-4701 (in Russian).
14. Тарасов А.В., Косых С.А., Бушуева Е.В. и др. Сравнение эффективности инъекционных форм антиаритмических препаратов пропафенона и амиодарона при проведении фармакологической кардиоверсии пароксизмальной фибрилляции предсердий. Consilium Medicum. 2019;21(1):81-6.
Tarasov A.V., Kosykh S.A., Bushueva E.V. et al. Comparison of the effectiveness of injectable forms of antiarrhythmic drugs propafenone and amiodarone during pharmacological cardioversion of paroxysmal atrial fibrillation. Consilium Medicum. 2019;21(1):81-6 (in Russian).
15. Capucci А. Pill in the Pocket: A Safe and Useful Antiarrhythmic Strategy. JACC Clin Electrophysiol. 2022;8(12):1521-2. DOI: 10.1016/j.jacep. 2022.11.001
16. Freemantle N, Lafuente-Lafuente C, Mitchell S et al. Mixed treatment comparison of dronedarone, amiodarone, sotalol, flecainide, and propafenone, for the management of atrial fibrillation. Europace. 2011;13(3):329-45. DOI: 10.1093/europace/euq450
17. Somberg J, Molnar J. Sotalol versus Amiodarone in Treatment of Atrial Fibrillation. J Atr Fibrillation. 2016;8(5):1359. DOI: 10.4022/jafib.1359
18. Anderson JL, Prystowsky EN. Sotalol: An important new antiarrhythmic. Am Heart J. 1999;137(3):388-409. DOI: 10.1016/s0002-8703(99)70484-9
19. Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmcol Ther. 2013;138:103-41. DOI:10.1016/ j.pharmthera.2012.12.007
20. Herink MC, Zhuo YF, Williams СD et al. Clinical management of pharmacokinetic drug interactions with direct oral anticoagulants (DOACs). Drugs. 2019;79(15):625-34. DOI: 10.1007/s40265-019-01183-0
21. Voukalis С, Lip GY, Shantsila E. Drug-drug interactions of nonvitamin K oral anticoagulants. Expert Opin Drug Metab Toxicol. 2016;12(12): 1445-61. DOI: 10.1080/17425 255.2016.1225037
22. Mendell J, Zahir H, Ridout G et al. Drug-drug interaction studies of cardiovascular drugs (amiodarone, digoxin, quinidine, atorvastatin and verapamil) involving P-glycoprotein (P-gp), an efflux transporter, on the pharmacokinetics and pharmacodynamics of edoxaban, an oral factor Xa inhibitor (abstr). J Am Coll Cardiol. 2011;57:E1510. DOI: 10.1016/S0735-1097(11)61510-6
23. Konieczny K, Dorian P. Clinically Important Drug–Drug Interactions Between Antiarrhythmic Drugs and Anticoagulants. J Innov Cardiac Rhythm Manage. 2019;10(3):3552-9. DOI: 10.19102/icrm.2019. 100304
24. Mar PL, Horbal P, Chung et al MK. Drug Interactions Affecting Antiarrhythmic Drug Use. Circ Arrhythm Electrophysiol. 2022;15(5): e007955. DOI:10.1161/CIRCEP.121.007955
25. Dan GA, Martinez-Rubio A, Agewal S et al. Antiarrhythmic drugs–clinical use and clinical decision making: a consensus document from the European Heart Rhythm Association (EHRA) and European Society of Cardiology (ESC) Working Group on Cardiovascular Pharmacology, endorsed by the Heart Rhythm Society (HRS), AsiaPacific Heart Rhythm Society (APHRS) and International Society of Cardiovascular Pharmacotherapy (ISCP). Europace. 2018;20(5):731-2an. DOI: 10.1093/europace/eux373
26. Sr DH, Nandkeolyar S, Lan H et al. Amiodarone: A Comprehensive Guide for Clinicians. Am J Cardiovasc Drugs. 2020;20(6):549-58. DOI: 10.1007/s40256-020-00401-5


