Клинический разбор в общей медицине №3 2024
Клинический разбор в общей медицине №3 2024
Нарушения менструального цикла. От правильного диагноза к грамотному лечению
Номера страниц в выпуске:6-17
Аннотация
Весной 2024 г. состоялось заседание экспертного клуба «Нарушения менструального цикла. От правильного диагноза к грамотному лечению». Ведущие специалисты в области акушерства и гинекологии обсудили действующие рекомендации FIGO в отношении классификации нарушений менструального цикла (НМЦ), роль метаболитов прогестерона в нейрофизиологической регуляции цикла, алгоритмы диагностики и эндокринные причины НМЦ. Были подробно освещены такие проблемы, как синдром поликистозных яичников, функциональная гипоталамическая аменорея, преждевременная недостаточность яичников, гиперпластические процессы эндометрия. На последних был сделан особый акцент: эксперты осветили принципы дифференциальной диагностики и роль микронизированного прогестерона в профилактике и терапии заболеваний.
Ключевые слова: нарушение менструального цикла, прогестерон, трансдермальные формы, эстроген.
Для цитирования: Нарушения менструального цикла. От правильного диагноза к грамотному лечению. Клинический разбор в общей медицине. 2024; 5 (3): 6–17. DOI: 10.47407/kr2023.5.3.00369
Весной 2024 г. состоялось заседание экспертного клуба «Нарушения менструального цикла. От правильного диагноза к грамотному лечению». Ведущие специалисты в области акушерства и гинекологии обсудили действующие рекомендации FIGO в отношении классификации нарушений менструального цикла (НМЦ), роль метаболитов прогестерона в нейрофизиологической регуляции цикла, алгоритмы диагностики и эндокринные причины НМЦ. Были подробно освещены такие проблемы, как синдром поликистозных яичников, функциональная гипоталамическая аменорея, преждевременная недостаточность яичников, гиперпластические процессы эндометрия. На последних был сделан особый акцент: эксперты осветили принципы дифференциальной диагностики и роль микронизированного прогестерона в профилактике и терапии заболеваний.
Ключевые слова: нарушение менструального цикла, прогестерон, трансдермальные формы, эстроген.
Для цитирования: Нарушения менструального цикла. От правильного диагноза к грамотному лечению. Клинический разбор в общей медицине. 2024; 5 (3): 6–17. DOI: 10.47407/kr2023.5.3.00369
Best practice
In spring 2024, the meeting of the expert club “Menstrual Disorders. From Correct Diagnosis to Competent Treatment” took place. The leading experts in obstetrics and gynecology discussed the current FIGO guidelines on classification of menstrual disorders (MDs), the role of progesterone metabolites in neurophysiological regulation of menstrual cycle, diagnostic algorithms and endocrine causes of MDs. Such issues, as polycystic ovary syndrome, functional hypothalamic amenorrhea, primary ovarian insufficiency, endometrial hyperplasia, were thoroughly discussed. Special emphasis was placed on the latter: the experts outlined the principles of differential diagnosis and the role of micronized progesterone in prevention and treatment of disorders.
Keywords: menstrual disorder, progesterone, transdermal forms, estrogen.
For citation: Menstrual disorders. From correct diagnosis to competent treatment. Clinical review for general practice. 2024; 5 (3): 6–17. (In Russ.). DOI: 10.47407/kr2023.5.3.00369
 Заседание открыла доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии ГБОУ ДПО РМАНПО Наталия Михайловна Подзолкова – она осветила основные изменения в терминологии и классификации аномальных маточных кровотечений (АМК), предложенных Международной федерацией акушерства и гинекологии (International Federation of Gynecology and Obstetrics – FIGO). Так, перемены коснулись терминологии нормального и аномального кровотечения: в новой редакции (2018 г.) аменорея входит в категорию «частота» (ранее в категорию «регулярность»), а также предложены улучшенные критерии регулярности (нормальные колебания от самого короткого до самого длинного цикла составляют 8 дней с незначительной разницей в зависимости от возраста (18–25 лет – ≤9 дней; 26–41 год – ≤7 дней, 42–45 лет – ≤9 дней). Категории длительности менструации также пересмотрены: теперь существует нормальная (≤8 дней) и длительная (>8 дней).
Заседание открыла доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии ГБОУ ДПО РМАНПО Наталия Михайловна Подзолкова – она осветила основные изменения в терминологии и классификации аномальных маточных кровотечений (АМК), предложенных Международной федерацией акушерства и гинекологии (International Federation of Gynecology and Obstetrics – FIGO). Так, перемены коснулись терминологии нормального и аномального кровотечения: в новой редакции (2018 г.) аменорея входит в категорию «частота» (ранее в категорию «регулярность»), а также предложены улучшенные критерии регулярности (нормальные колебания от самого короткого до самого длинного цикла составляют 8 дней с незначительной разницей в зависимости от возраста (18–25 лет – ≤9 дней; 26–41 год – ≤7 дней, 42–45 лет – ≤9 дней). Категории длительности менструации также пересмотрены: теперь существует нормальная (≤8 дней) и длительная (>8 дней).
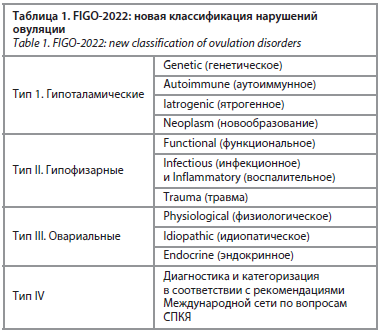
Попытка структурировать имеющиеся знания в 2022 г. привела к выделению трех типов нарушения овуляции, наиболее распространенной причины аменореи, АМК и бесплодия, а также частого проявления синдрома поликистозных яичников (СПКЯ); табл. 1. Это дает возможность клиницисту определить, на каком уровне «произошла поломка» и с чем она связана.
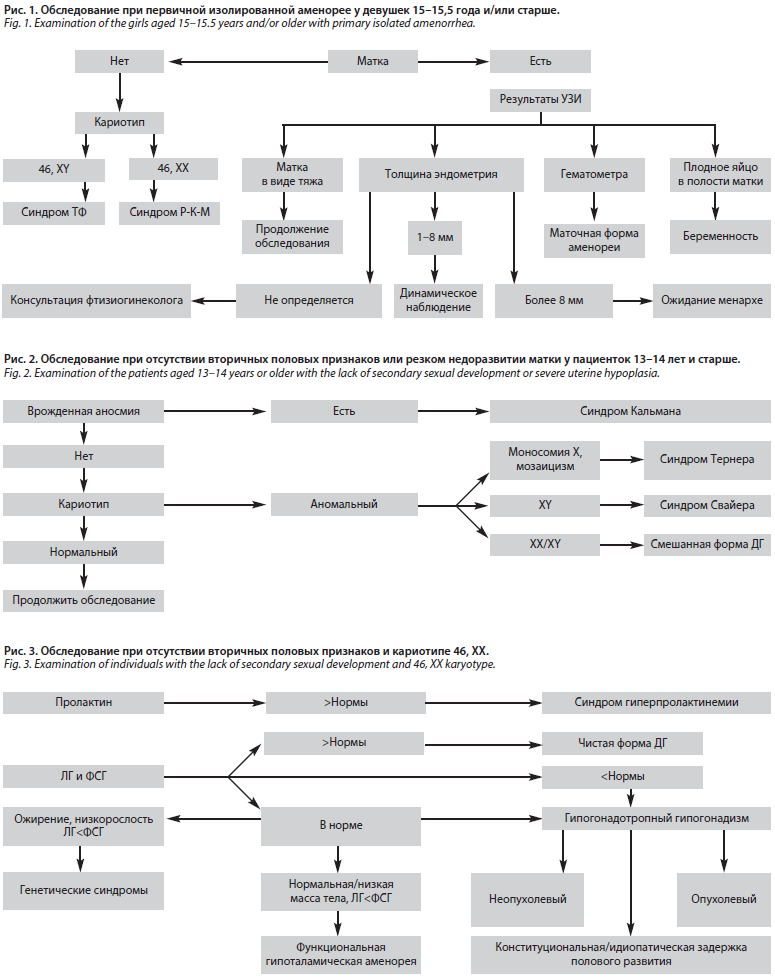
Алгоритмы диагностики нарушений менструального цикла представила Ирина Всеволодовна Кузнецова, доктор медицинских наук, профессор, президент Международной ассоциации гинекологов, эндокринологов и терапевтов (МАГЭТ), заместитель генерального директора по научно-исследовательской работе ООО «Витбиомед+». Важным аспектом диагностики нарушений менструального цикла становится верное использование терминологии в клинической практике. Так, под первичной аменореей сегодня понимают отсутствие спонтанных менструаций в возрасте старше 16 лет. У девушек с развитием вторичных половых признаков, соответствующим возрасту, обследование стоит инициировать в 15–15,5 года, в то время как у девушек с отсутствием вторичных половых признаков или их резким недоразвитием диагностику стоит начинать в 13–14 лет. Вторичная аменорея – это отсутствие менструаций в течение 3 мес при исходно регулярном ритме менструаций или в течение 6 мес при исходной олигоменорее – увеличении продолжительности менструального цикла более 38 дней не менее чем в течение 3 последних месяцев, или 9 или менее менструаций за предшествующие 12 мес.
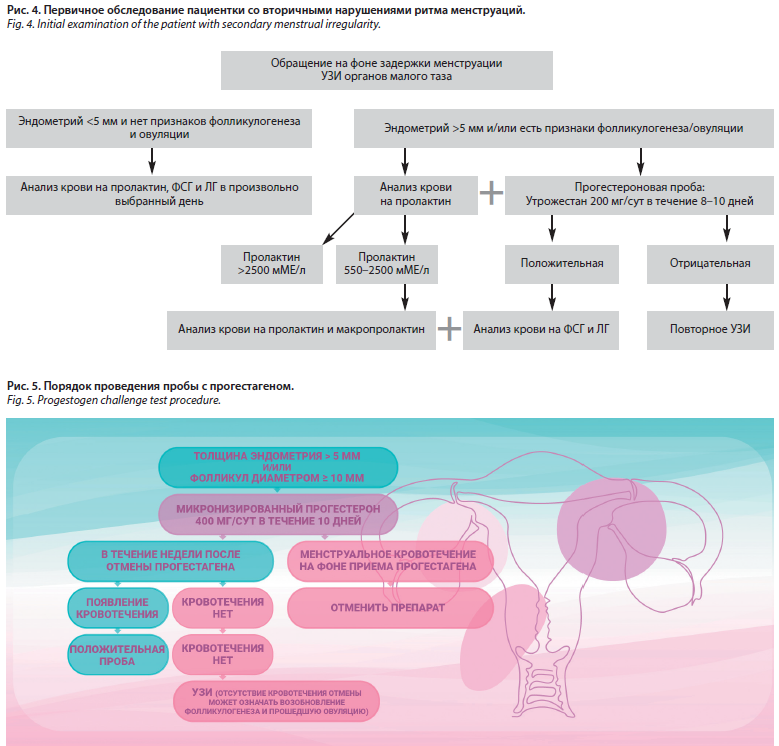
На фоне олигоменореи/аменореи возможно развитие АМК, каждое из которых требует обследования по системе PALM-COEIN. Ирина Всеволодовна предложила несколько схем обследований при первичной (рис. 1–3) и вторичной аменорее (рис. 4).
В условиях достаточной толщины эндометрия >5 мм и/или наличии фолликула диаметром ≥10 мм назначается микронизированный прогестерон 400 мг/сут в течение 10 дней. Если менструальное кровотечение начинается на фоне приема прогестагена, препарат следует отменить. Проба считается положительной при появлении кровотечения в течение недели после отмены прогестагена. При отрицательном результате следует выполнить ультразвуковое исследование (УЗИ), поскольку отсутствие кровотечения отмены может означать возобновление фолликулогенеза и прошедшую овуляцию (рис. 5).
Для того чтобы оценивать уровень андрогенов и правильно интерпретировать их результаты, необходимо учитывать показания по проведению диагностики.
У пациенток с олигоменореей исследование выполняется по следующим показаниям: наличие андрогензависимой дермопатии или признаков вирильного синдрома, а также поликистозная морфология яичников по данным УЗИ. Обязательный набор тестов включает общий тестостерон, дегидроэпиандростеронсульфат (ДГЭАС), 17-оксипрогестерон (если врожденная дисфункция коры надпочечников не исключена ранее).
У пациенток с клиническим гиперандрогенизмом для его подтверждения достаточно выявления высокого/нормального тестостерона и/или ДГЭАС. У пациенток с поликистозной морфологией яичников для подтверждения СПКЯ необходимо выявление повышенного общего тестостерона и/или свободного тестостерона, и/или глобулина, связывающего половые гормоны (ГСПГ). При подозрении на опухолевую гиперандрогенемию следует определять все доступные андрогены и их метаболиты в крови и моче.
Дополнительно для уточнения причин нарушения ритма менструаций при наличии признаков гиперкортицизма определяют уровень кортизола в слюне вечером и проводят малую пробу с дексаметазоном и направляют пациентку к эндокринологу при положительном результате хотя бы одного из тестов. При подозрении на соматотропиному также необходимо направить пациентку к эндокринологу. При наличии ожирения проводится оценка уровней глюкозы и инсулина натощак и через 2 ч после стандартной нагрузки глюкозой, а также оценка липидного профиля. Уровень прогестерона в плазме крови проводят для подтверждения овуляции или выявления ановуляции в регулярных менструальных циклах в рамках диагностики СПКЯ и бесплодного брака, а также для установления недостаточности лютеиновой фазы цикла в рамках обследования женщин со сниженной фертильностью. Выбор дня для взятия пробы обусловлен показателями стабильности цикла: так, при стабильной длительности диагностику проводят за 6–8 дней до начала менструального кровотечения, при нестабильном/вариабельном цикле – начиная с 16-го дня от начала менструального кровотечения, раз в неделю, до начала менструации, но не более 3 раз. Овуляцию подтверждает уровень прогестерона >5 нг/мл (15 нмоль/л), а полноценную лютеиновую фазу – >10 нг/мл (30 нмоль/л); рис. 6.

Контроль менструального ритма – задача, требующая решения вне зависимости от поиска причины нарушений. На этапе проведения диагностических манипуляций приемлемым способом восстановления ритма менструаций является применение прогестерона (Утрожестан®), эффекты которого многочисленны: это и анксиолитическое действие, и участие в регуляции качества сексуальной жизни, концентрации мышления, когнитивных функций, настроения, сна, аппетита, памяти, процессов обучения, болевой чувствительности. С учетом некоторых ограничений назначение прогестерона в циклическом режиме для индукции регулярных менструаций может принести дополнительную пользу.
Эндокринным причинам нарушений менструального цикла было посвящено выступление Ирэны Адольфовны Иловайской, доктора медицинских наук, руководителя отделения нейроэндокринных заболеваний отдела общей эндокринологии, профессора курса частной эндокринологии при кафедре эндокринологии факультета усовершенствования врачей ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». Клиницисту важно определить тип овуляторной дисфункции и отнести ее к гиперпролактинемической, гипогонадотропной, нормогонадотропной или гипергонадотропной, от чего будут зависеть подходы к терапии. Причинами нарушений менструального цикла могут стать СПКЯ, акромегалия, а также ожирение (рис. 7). Показано, что при индексе массы тела (ИМТ) более 30 кг/м2 частота менструальных нарушений возрастает в 5 раз, а частота бесплодия – в 2 раза.

Известно, что назначение метформина в составе комбинированной терапии оказывает выраженный эффект на массу тела при СПКЯ. При отсутствии однозначных официальных показаний для назначения метформина пациенткам с СПКЯ, можно предложить мио-инозитол, который по своей эффективности сравним с метформином (табл. 2). Препарат способствует повышению чувствительности рецепторов к инсулину, а также клеток гранулезы – к фолликулостимулирующему гормону (ФСГ).
Улучшение показателей углеводного обмена происходит и на фоне приема хрома пиколината – это показано в систематическом обзоре и метаанализе 28 рандомизированных клинических исследований (РКИ). Хрома пиколинат способствует снижению уровня инсулина и гликемии натощак, гликированного гемоглобина, индекса инсулинорезистентности HOMA-IR. У пациенток с СПКЯ на фоне дотации витамина D снижается уровень тестостерона и повышается толщина эндометрия, отмечается снижение уровня общего холестерина и С-реактивного белка (показателя воспалительной реакции). Учитывая эти данные, при прегравидарной подготовке пациенткам можно рекомендовать Витажиналь® Инозит, содержащий и мио-инозитол, и витамин D, и хрома пиколинат. Накопленный опыт и результаты исследований подтверждают, что клинический эффект мио-инозитола и других компонентов Витажиналя Инозит наиболее выражен при приеме 4 саше в сутки, однако суточная доза комплекса может определяться степенью выраженности клинических проявлений.
Комплексный подход к диагностике и лечению репродуктивных и метаболических нарушений при СПКЯ озвучила Галина Евгеньевна Чернуха, доктор медицинских наук, профессор, главный научный сотрудник отделения гинекологической эндокринологии ФГБУ «НМИЦ АГП им. В.И. Кулакова», президент МОО «Ассоциация гинекологов-эндокринологов».
В основе патофизиологических процессов заболевания лежит нарушение фолликулогенеза. Происходит ускоренное рекрутирование фолликулов из первичного пула и усиление их роста, увеличение выработки антимюллерова гормона (АМГ), за счет возрастания числа фолликулов и избыточной активности гранулезных клеток (ГК), задержка роста фолликулов и нарушение отбора доминантного фолликула (на стадии малых антральных фолликулов, когда гранулезные клетки начинают экспрессировать ароматазу и секретировать Е2), следствием чего становится овуляторная дисфункция. СПКЯ – это лишь «вершина айсберга», которую сопровождают и метаболические, и психоэмоциональные нарушения, и гестационные осложнения.
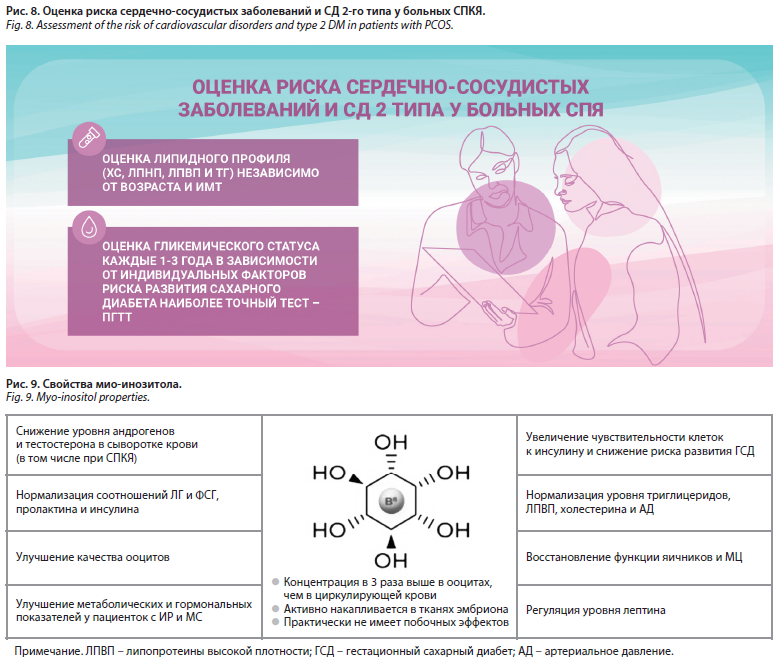
Наибольший интерес в теме СПКЯ представляют исследования по инсулинорезистентности (ИР), ожирению, метформину и метаболическому синдрому. ИР является патофизиологическим фактором развития СПКЯ, однако доступные анализы на инсулин имеют ограниченное клиническое значение и не рекомендуются в рутинной практике. Для оценки риска развития сердечно-сосудистых заболеваний и сахарного диабета (СД) 2-го типа у женщин с СПКЯ независимо от возраста и ИМТ должна быть проведена оценка липидного профиля (холестерина, липопротеинов низкой плотности, липопротеинов высокой плотности и триглицеридов). При постановке диагноза у всех взрослых и подростков с СПКЯ стоит оценивать гликемический статус. Следует рекомендовать пероральный тест на толерантность к глюкозе как наиболее точный тест для оценки гликемического статуса при СПКЯ, независимо от ИМТ. Гликемический статус нужно оценивать каждые 1–3 года в зависимости от индивидуальных факторов риска развития СД (рис. 8).
Каждая третья пациентка с СПКЯ при нормальном ИМТ имеет избыток жировой ткани или «скрытое ожирение», а в каждом третьем случае оно ассоциировано с гиперинсулинемией, ИР и дислипидемией, в каждом пятом – с нарушением толерантности к глюкозе (НТГ). При пороговом значении ИМТ≥23 кг/м2 в 100% случаев выявляется «скрытое ожирение», в 11 раз чаще встречается нарушенная толерантность к глюкозе, в 3 раза чаще гиперинсулинемия и дислипидемия, поэтому основными мишенями для фармакотерапии пациенток с СПКЯ становятся также ожирение, гиперандрогения, олиго-овуляция и ИР. Лечение должно быть длительным, адаптированным к меняющимся обстоятельствам, личным потребностям и ожиданиям пациенток.
Изменение образа жизни – первый и самый важный этап терапии. Снижение массы тела на 10–15% в течение 6 мес приводит к увеличению частоты овуляций в 3,7 раза, регуляции цикла – в 5,6 раза. Взрослым с СПКЯ и ИМТ≥25 кг/м2 следует рассмотреть вопрос о назначении метформина для коррекции антропометрических и метаболических показателей, включая ИР, уровень глюкозы и липидный профиль, однако необходимо учитывать показания для постоянного приема.
Открытие роли дефицита инозитол-фосфогликана в нарушении передачи инсулиновых сигналов открыло новые горизонты в лечении пациенток с СПКЯ. Перспективным становится назначение мио-инозитола – одного из стериоизомеров шестиатомного спирта инозита (рис. 9). Мио-инозитол – это вторичный мессенджер инсулиновых рецепторов, он повышает чувствительность к инсулину, регулирует захват глюкозы клеткой путем активации ферментов, контролирующих ее метаболизм, опосредует сигналы ФСГ, играет важную роль в созревании ооцитов, оказывает положительное влияние на созревание фолликулов и качество яйцеклеток. Дефицит инозитола способствует нарушению гормонального баланса и повышению уровня тестостерона.
В одном метаанализе 26 РКИ (1691 женщина с СПКЯ) проведено сравнение эффективности и безопасности инозитолов с плацебо и метформином (табл. 3). Показано, что эффективность метформина и инозитола сопоставимы, на основании чего авторы работы советуют включить инозитол в протокол лечения СПКЯ, особенно у женщин, имеющих побочные эффекты на фоне терапии метформином.
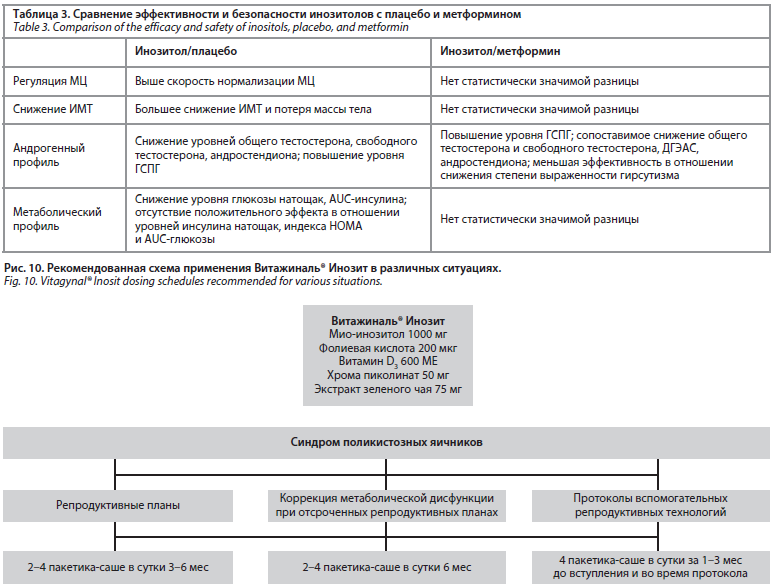
Инозитол (в любой форме) может быть рекомендован женщинам с СПКЯ с учетом индивидуальных предпочтений, несмотря на ограниченную эффективность для коррекции метаболических показателей, ановуляции, гирсутизма или массы тела. Стоит отметить, что конкретные типы, дозы или комбинации инозитола в настоящее время не могут быть рекомендованы из-за отсутствия качественных доказательств, но чаще всего Витажиналь® Инозит, содержащий мио-инозитол, витамин D, хрома пиколинат, фолиевую кислоту и экстракт зеленого чая, рекомендуют в дозе 2–4 саше в сутки (рис. 10).
Женщины с СПКЯ должны быть информированы о необходимости профилактики гиперплазии и рака эндометрия путем снижения массы тела и регуляции менструального цикла за счет терапии прогестагенами. Для защиты эндометрия могут быть рассмотрены монокомпонентные оральные контрацептивы, содержащие только прогестин. Циклические прогестины (например, микронизированный прогестерон 100–200 мг/день) являются разумной альтернативой контрацептивам, в частности, у женщин, заинтересованных в беременности. Такая терапия рекомендована пациенткам с олигоменореей для профилактики гиперплазии и рака эндометрия в связи с отсроченными рисками избыточного воздействия эстрогенов на эндометрий. Показано, что монотерапия Утрожестаном достоверно способствует снижению уровня лютеинизирующего гормона (ЛГ), АМГ, тестостерона и адростендиона, а также повышению уровня ГСПГ.
Во втором своем выступлении Ирэна Адольфовна Иловайская озвучила клинические подходы к ведению пациенток с гипогонадотропным гипогонадизмом – клиническим синдромом, характеризующимся снижением секреции половых стероидов и возникающим на фоне нарушения центральной регуляции/секреции гонадотропинов. В качестве «мягкого» варианта гипогонадо-тропного гипогонадизма можно рассматривать функциональную аменорею – форму хронической ановуляции, связанную не с идентифицируемыми органическими причинами, а чаще со стрессом, потерей массы тела, чрезмерными физическими нагрузками или их комбинацией (диагноз исключения). Несмотря на отсутствие органических нарушений, заболевание требует своевременной инициации гормональной терапии для предотвращения негативных последствий гипо-эстрогенемии и скорейшего восстановления центральной регуляции гонадотропной функции.
По данным Эндокринологического общества (Endocrine Society, 2018 г.), подросткам и женщинам, у которых не произошло восстановление менструального цикла после соответствующей коррекции питания, физических нагрузок и психологического статуса, рекомендовано краткосрочное использование трансдермального эстрадиола (0,06% во флаконе с помпой-дозатором). Трансдермальные эстрогены имеют ряд преимуществ у пациенток с функциональной гипоталамической аменореей: они не проходят «первичный» барьер в печени, поддерживают баланс эстрадиола и эстрона, не влияют на синтез белков системы гемостаза, содержание гормонов щитовидной железы, синтез ГСПГ и инсулиноподобного фактора роста 1 в печени и положительно влияют на состояние костной ткани.
Преждевременная недостаточность яичников (ПНЯ), по данным акушера-гинеколога, эндокринолога, кандидата медицинских наук Гродницкой Елены Эдуардовны, может осложняться повышением уровня депрессии, тревожности, стресса, низкой самооценкой, увеличением риска развития сексуальной дисфункции, остеопороза, сердечно-сосудистых и цереброваскулярных заболеваний, когнитивной дисфункции и даже летальных исходов. Ситуацию может скорректировать назначение эстроген-гестагенных препаратов: показано, что смертность от всех причин на фоне курса терапии снижается. Женщины с преждевременной менопаузой, начинающие менопаузальную гормональную терапию (МГТ) до 50 лет, достигают наиболее значительного преимущества с точки зрения продолжительности жизни.
Как подобрать терапию с учетом риска сердечно-сосудистых заболеваний? Согласно официальному ежегодному документу «White paper» Международной ассоциации по менопаузе (IMS), приуроченному ко Всемирному дню менопаузы (2023 г.), для женщин с риском сердечно-сосудистых заболеваний предпочтительна трансдермальная терапия эстрадиолом и микронизированным прогестероном. Трансдермальные препараты эстрадиола в меньшей степени влияют на факторы свертывания крови, АД, триглицериды, С-реактивный белок и ГСПГ, и в низких дозах предпочтительны для женщин с риском венозной тромбоэмболии – ВТЭ (пациентки с ранней – до 40 лет и поздней – после 55 лет менопаузой имеют в 1,5–1,8 раза больший риск ВТЭ по сравнению с женщинами с возрастом наступления менопаузы 40–49 лет, поэтому важно, чтобы такие пациентки получали трансдермальные формы эстрогенов), гипертензией, гипертриглицеридемией, ожирением, метаболическим синдромом, диабетом и болезнью желчного пузыря в анамнезе. При трансдермальном пути введения отсутствует «метаболический ответ»: нет усиления липидного и белкового обменов, повышения уровня ренина и ангиотензиногена (индукции вазоконстрикции и артериальной гипертензии), уровня С-реактивного белка, т.е. нет провоспалительного эффекта. Статистически значимо меньший риск развития инфаркта показан при трансдермальном применении эстрогенов по сравнению с пероральным.
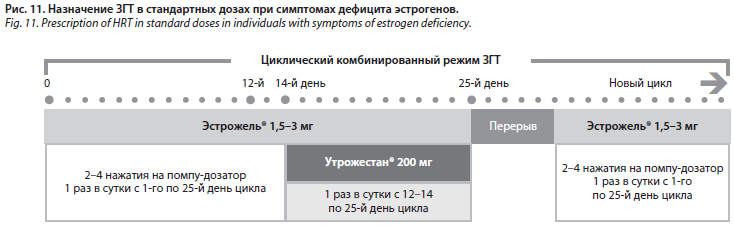
В комбинации с эстрогеном необходимо назначать гестаген для защиты эндометрия при интактной матке (рис. 11). Микронизированный прогестерон считается нейтральным в отношении риска тромбоза, не обладает андрогенной, минералкортикоидной и глюкокортикоидной активностью, может минимизировать метаболические нарушения и побочные эффекты, ассоциированные с другими гестагенами. Показано, что у женщин с ПНЯ и ранней менопаузой прогестерон способствует статистически значимому улучшению сердечного выброса, снижению диастолического давления и общего периферического сопротивления сосудов. Кроме того, данные наблюдений позволяют предположить, что микронизированный прогестерон может иметь меньшую ассоциацию с раком молочной железы, чем другие синтетические гестагены.
Комбинированный подход может быть целесообразным и при нарушениях сна: согласно исследованиям, комбинация эстрогена и прогестерона оказалась эффективной в отношении нарушений сна, в отличие от монотерапии эстрогенами.
Пациенткам с ПНЯ могут потребоваться более высокие дозы эстрадиола в составе заместительной гормональной терапии (ЗГТ). Например, 1,5–3,0 мг/сут эстрадиола гемигидрата в составе 0,06% накожного геля (2,5–5,0 г) для купирования менопаузальных симптомов и профилактики постменопаузального остеопороза (см. рис. 11).
Выбору терапии функциональных нарушений менструального цикла посвятила свой доклад доктор медицинских наук, профессор, Заслуженный врач РФ, Заслуженный деятель науки РФ, Лауреат премии Правительства РФ, заведующая кафедрой акушерства и гинекологии лечебного факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Юлия Эдуардовна Доброхотова.
При назначении медикаментозного лечения в распоряжении клинициста оказывается три класса гормональных средств: гестагены в циклическом режиме, комбинированные оральные контрацептивы (КОК) и циклическая ЗГТ. Если женщине необходима контрацепция, лечение гиперандрогенных состояний (гирсутизм, акне), а также при наличии у пациентки дисменореи, обильных менструаций, проявлений предменструального синдрома предпочтение лучше отдать КОК. Если женщина готовится к беременности (даже в ближайшей перспективе), но у нее выявлена недостаточность лютеиновой фазы, предпочтительны гестагены в циклическом режиме. При хроническом стрессе или центральных НМЦ (центральная нормогонадотропная олиго- или аменорея) при дефиците эндогенного прогестерона возможно назначение гестагенов в циклическом режиме, либо циклическая ЗГТ с натуральным эстрадиолом при дефиците эстрогенов. В случае назначения ЗГТ предпочтение стоит отдавать трансдермальному препарату Эстрожель®.
В отличие от синтетических гестагенов, микронизированный прогестерон (Утрожестан®) – антистрессовый гормон-адаптоген, обладающий анксиолитическим эффектом (благодаря его естественным α-метаболитам), что благоприятно сказывается на эмоциональном фоне и уровне тревожности. Также по данным исследования 2019 г., Утрожестан® эффективно контролирует МЦ даже после отмены терапии как минимум в течение 6 мес у 98% женщин. Однозначным преимуществом является выбор пути введения препарата (перорально или интравагинально).
Проблемы позднего репродуктивного возраста тесно пересекаются с проблемами перехода в менопаузу, считает Вера Ефимовна Балан, профессор, руководитель поликлинического отделения ГБУЗ МО МОНИИАГ, Президент междисциплинарной ассоциации специалистов по здоровому старению. В задачи клинициста входят и лечение НМЦ, и подбор контрацепции, и лечение климактерических расстройств с помощью циклической гормонотерапии.
Снижение уровня прогестерона – одно из основных причин нерегулярных менструаций в позднем репродуктивном возрасте. При этом часто наблюдается относительная гиперэстрогения и недостаточная секреторная трансформация эндометрия, что в 2,5 раза увеличивает риск развития гиперпластических процессов и АМК. Также недостаток прогестерона приводит к нарушениям психоэмоционального фона женщины, нарушениям сна (частые пробуждения, бессонница, трудности засыпания и ранние пробуждения). Таким пациенткам важно назначить терапию, которая физиологично восполнит уровень прогестерона, восстановит регулярный цикл, снизит риск развития гиперпластических процессов и повлияет на первые симптомы менопаузы.
Микронизированный прогестерон (Утрожестан®) отвечает критериям терапии НМЦ в позднем репродуктивном возрасте. Он физиологично восполняет уровень прогестерона, тем самым нормализует МЦ и снижает риск развития гиперпластических процессов эндометрия, является метаболически нейтральным гестагеном и не оказывает влияния на липидный и углеводный профили, не приводит к увеличению массы тела, не оказывает альдестеронового эффекта (отсутствие задержки жидкости и отеков, мигрени и мастодинии), за счет метаболита аллопрегнанолона является «физиологическим» регулятором сна и оказывает противотревожный эффект, а также снижает частоту первых симптомов менопаузы (ночная потливость, приливы) и улучшает качество сна. 200–400 мг микронизированного прогестерона в сутки на срок не менее 10–14 дней назначается женщинам в периоде менопаузального перехода для профилактики гиперпластических процессов эндометрия и регуляции менструального цикла.
Для полноценной профилактики серьезных неинфекционных заболеваний «взросления» (ментальных и сердечно-сосудистых заболеваний, урогенитальной атрофии, остеопороза и т.д.) необходимы раннее начало применения МГТ, правильный переход от одного вида ее к другому и длительный прием. МГТ, назначенная в рамках терапевтического «окна возможностей», может обеспечить профилактические эффекты в отношении ряда неинфекционных хронических заболеваний и снизить частоту развития СД на 30%, сердечно-сосудистую смертность на 12–54%, вазомоторные симптомы в 75% случаев, риски перелома шейки бедра на 30%, дополнительно снизить общую смертность на 31% у женщин в возрасте 50–59 лет. У женщин с климактерическими симптомами и наличием коморбидных состояний рекомендуется отдавать предпочтение трансдермальному пути введения эстрогенов, при этом можно придерживаться следующей схемы:
• в перименопаузе предпочесть циклический режим, с 1 по 25-й день цикла по 1 суточной дозе (2 нажатия на помпу-дозатор) Эстрожеля и одновременно в течение 12–14 последних дней 200 мг Утрожестана, далее перерыв;
• в постменопаузе придерживаться непрерывного режима, по 0,5 суточной дозы (1 нажатие на помпу-дозатор) Эстрожеля и 100 мг Утрожестана;
• при хирургической менопаузе целесообразен непрерывный режим по 0,5–1,0 суточной дозы (1–2 нажатия на помпу-дозатор) Эстрожеля.
Согласно российским клиническим рекомендациям, трансдермальные формы эстрогенов благодаря отсутствию первичной стадии печеночного метаболизма в отличие от пероральных форм эстрогенов имеют более благоприятный профиль безопасности – не повышают риск осложнений ВТЭ и желчнокаменной болезни. Использование трансдермальных форм эстрогенов ассоциировано с меньшим риском больших сердечно-сосудистых событий (инфаркта, инсульта) и осложнений ВТЭ, чем использование эквивалентных доз пероральных форм эстрогенов.
Протасова Анна Эдуардовна, доктор медицинских наук, профессор кафедры онкологии СПбГУ, профессор кафедры акушерства и гинекологии ФГБУ «СЗФМИЦ им. В.А. Алмазова», обсудила с собравшимися коллегами принципы диагностики гиперплазии эндометрия, занимающей второе место в структуре гинекологической заболеваемости. Согласно статистике, атипия выявляется лишь в 2,9% случаев заболевания, а гиперплазия не входит в список факторов риска рака эндометрия.
К УЗИ-признакам гиперплазии эндометрия относят несоответствие толщины эндометрия фазе менструального цикла, повышенную эхогенность, неоднородность и губчатость эхоструктуры эндометрия с множественными мелкими анэхогенными включениями и эффектом акустического усиления. Однако чувствительность этого метода в репродуктивном возрасте составляет не более 25% (в постменопаузе – более 90%). Целесообразно прибегать и к другим вариантам диагностики – допплеросонографии и эластографии эндометрия. Биопсия эндометрия также становится диагностическим инструментом, однако показана не всем пациенткам и проводится при сочетании факторов риска наличия предраковых или злокачественных изменений. Что касается компьютерной томографии, магнитно-резонансной томографии (МРТ) или определения биологических маркеров, их рутинное использование не рекомендуется, поскольку не существует доказательств ценности этих методов в качестве вспомогательных средств диагностики гиперплазии эндометрия. Однако МРТ рассматривается как перспективный метод в дифференциальной диагностике атипической гиперплазии эндометрия и рака эндометрия, поскольку МРТ с использованием диффузно взвешенных последовательностей позволяет выявить начальные признаки инвазии ткани эндометрия в миометрий, характерные для ранней стадии рака эндометрия.
Общие принципы терапии больных морфологически верифицированной гиперплазией эндометрия без атипии озвучила Наталия Михайловна Подзолкова. После морфологической верификации диагноза «гиперплазия эндометрия» рекомендуется введение левоноргестрелсодержащей внутриматочной системы (ЛНГ-ВМС), но в случае противопоказаний или отказа от ее введения целесообразна терапия прогестагенами в непрерывном или пролонгированном циклическом режиме (прогестагены в циклическом режиме менее эффективны для регрессии гиперплазии эндометрия без атипии по сравнению с непрерывным режимом приема и ЛНГ-ВМС). При сочетании гиперплазии эндометрия с миомой матки и эндометриозом рекомендуется применение агонистов гонадотропин-рилизинг-гормона. Для определения дальнейшей тактики ведения нужно проводить терапию в течение 6 мес с последующим исследованием биопсийного (операционного) материала эндометрия (при наличии внутриматочной терапевтической системы – без ее удаления). При отсутствии эффекта от консервативного лечения и прогрессировании гиперплазии эндометрия стоит рассмотреть вопрос о хирургическом лечении (гистерэктомия, по возможности, лапароскопическим доступом или резекция эндометрия под гистероскопическим контролем – гистерорезектоскопия).
Наталия Михайловна обратила внимание на результаты интересной работы, опубликованной в 2023 г. в журнале International Journal of Gynecology & Obstetrics, в которой проводилось сравнение эффективности вагинального микронизированного прогестерона и ЛНГ-ВМС у пациенток с гиперплазией эндометрия без атипии. Клиническая эффективность обоих препаратов оказалась сопоставима, что позволяет предлагать микронизированный прогестерон пациенткам репродуктивного периода с НМЦ и риском развития гиперплазии эндометрия.
Тему эффектов прогестерона и его метаболитов представила кандидат медицинских наук, доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО «РНИМУ им Н.И. Пирогова» Метанат Рафиговна Нариманова – в частности, она широко осветила нейропротективный эффект метаболитов прогестерона.
Метаболит прогестерона аллопрегнанолон действует как физиологический модулятор и защитный агент нервной системы. Одной из основных функций этого нейроактивного стероида является нейропротекция в случае поражения, ишемии или периферических невропатий (например, при диабете). Аллопрегнанолон может уменьшать симптомы нейродегенеративных заболеваний (например, болезни Альцгеймера, Паркинсона, болезни Нимана–Пика типа C, рассеянного склероза) на животных моделях. При исследовании в мышиной модели введение аллопрегнанолона способствовало нейрогенезу, уменьшению воспаления, восстановлению функции памяти и обучения. Как нейроактивный стероид прогестерон влияет на нервную систему, связываясь с NMDA- и GABAA ГАМК-рецепторами.
Аллопрегнанолон может стать возможным кандидатом для лечения нейропатической боли, расстройств настроения и тревожных расстройств. Метаболиты прогестерона как естественные положительные модуляторы нейрональных рецепторов ГАМК оказывают дозозависимое психофармакологическое действие: анксиолитическое, антидепрессивное, обезболивающее, противосудорожное, аналгезирующее. Во время острого стресса надпочечники синтезируют большое количество аллопрегнанолона, также увеличивается его локальный синтез в головном мозге – как механизм защиты от стресса.
Согласно исследованиям, прогестерон улучшает качество сна, что особенно актуально в позднем репродуктивном и переходном периоде. Утрожестан®, микронизированный прогестерон, способствует нормализации менструального цикла и сна. Последние данные говорят об эффективности его применения у пациенток в перименопаузе с нарушениями цикла, бессонницей и ночной потливостью.
Свойства прогестерона (табл. 4) подытожила Елена Ивановна Вовк, кандидат медицинских наук, доцент кафедры терапии и подростковой медицины ФГБОУ ВО РМАНПО. Плейотропное действие прогестерона – это результат его гибкого взаимодействия со всеми стероидными рецепторами в организме. В физиологических условиях афинность прогестерона к собственным рецепторам ниже, чем у дидрогестерона, как в половых органах, так и в других тканях-мишенях, и это обеспечивает тонкую настройку обратной связи с другими регуляторами.
Наличие антиальдостеронового действия у микронизированного прогестерона крайне важно не только во время беременности, но и в переходном периоде, поскольку в этот период женщины начинают отмечать пастозность, отечность, мастодинию, особенно во вторую фазу цикла, что связано со снижением выработки прогестерона и задержкой жидкости в организме на фоне относительной гиперэстрогении. Микронизированный прогестерон будет уменьшать эти симптомы, улучшая качество жизни женщины.
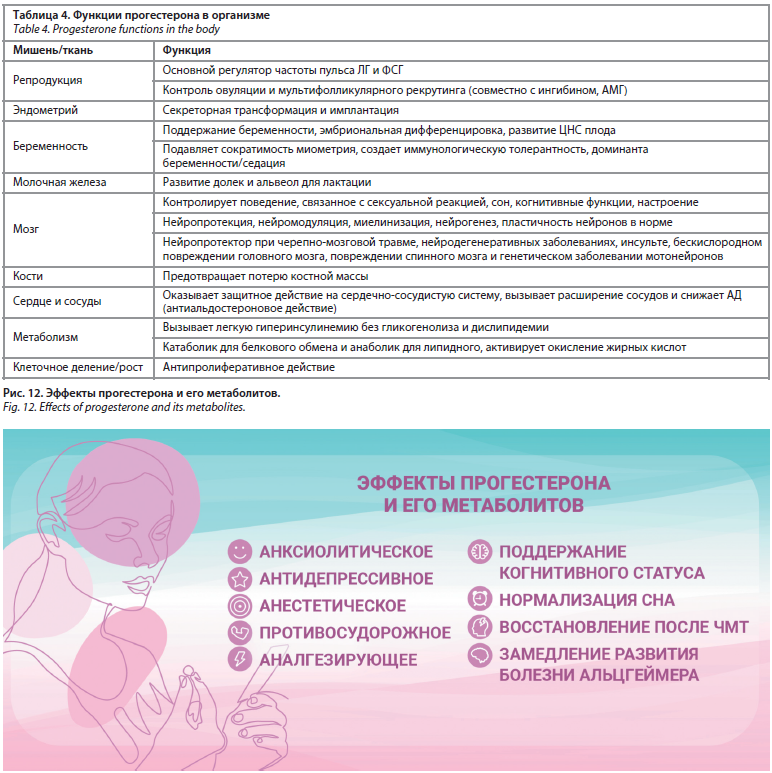
Посредством протеомных и рецепторно-опосредованных систем прогестерон как нейростероид оказывает плейотропное защитное действие в центральной нервной системе (ЦНС). Прогестерон и его метаболит аллопрегнанолон играют фундаментальную роль в обеспечении развития и функционировании ЦНС, адаптации к стрессу и реакции на повреждение. Научно доказаны механизмы трофического влияния прогестерона и его нейростероидных метаболитов: нейрогенез и активизация функции глиальных клеток, пролиферация нейронных клеток-предшественников, миелинизация, противовоспалительное действие. Елена Ивановна подтвердила данные, представленные другими спикерами: в многочисленных исследованиях показаны быстрые психофармакологические эффекты прогестерона и его метаболитов, а именно анксиолитическое, антидепрессивное, анестетическое, противосудорожное и аналгезирующее действие, а также способность к поддержанию когнитивного статуса, нормализации сна, восстановлению после черепно-мозговой травмы, замедлению развития болезни Альцгеймера (рис. 12).
Также прогестерон обладает противовоспалительным и иммуномодулирующим действием: ингибирует синтез провоспалительных цитокинов макрофагами и дендритными клетками, способствует выработке противовоспалительных цитокинов CD4+ Т-хелперами и переключению на противовоспалительный ответ Th2-типа, совместно с эстрадиолом стимулирует размножение Т-регуляторных клеток, поддерживая иммунную толерантность. Прогестерон дозозависимо модулирует сигнальные пути, которые включают супрессоры распространения опухоли в культуре клеток ER/PR-позитивного рака молочной железы. Лечение вазомоторных симптомов пероральным микронизированным прогестероном можно рассматривать как эффективную и безопасную терапию «замещающего типа» у женщин в перименопаузе, у которых сохранены менструации.
Таким образом, механизмы эффективности прогестерона множественны и тканеспецифичны, что позволяет применять препарат при широком спектре состояний, далеко выходящих за рамки акушерства и гинекологии.
Редакционный материал. Обзор подготовлен по материалам заседания экспертного клуба «Нарушения менструального цикла. От правильного диагноза к грамотному лечению» от 23 марта 2024 г.
Menstrual disorders. From correct diagnosis to competent treatment
AbstractIn spring 2024, the meeting of the expert club “Menstrual Disorders. From Correct Diagnosis to Competent Treatment” took place. The leading experts in obstetrics and gynecology discussed the current FIGO guidelines on classification of menstrual disorders (MDs), the role of progesterone metabolites in neurophysiological regulation of menstrual cycle, diagnostic algorithms and endocrine causes of MDs. Such issues, as polycystic ovary syndrome, functional hypothalamic amenorrhea, primary ovarian insufficiency, endometrial hyperplasia, were thoroughly discussed. Special emphasis was placed on the latter: the experts outlined the principles of differential diagnosis and the role of micronized progesterone in prevention and treatment of disorders.
Keywords: menstrual disorder, progesterone, transdermal forms, estrogen.
For citation: Menstrual disorders. From correct diagnosis to competent treatment. Clinical review for general practice. 2024; 5 (3): 6–17. (In Russ.). DOI: 10.47407/kr2023.5.3.00369
 Заседание открыла доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии ГБОУ ДПО РМАНПО Наталия Михайловна Подзолкова – она осветила основные изменения в терминологии и классификации аномальных маточных кровотечений (АМК), предложенных Международной федерацией акушерства и гинекологии (International Federation of Gynecology and Obstetrics – FIGO). Так, перемены коснулись терминологии нормального и аномального кровотечения: в новой редакции (2018 г.) аменорея входит в категорию «частота» (ранее в категорию «регулярность»), а также предложены улучшенные критерии регулярности (нормальные колебания от самого короткого до самого длинного цикла составляют 8 дней с незначительной разницей в зависимости от возраста (18–25 лет – ≤9 дней; 26–41 год – ≤7 дней, 42–45 лет – ≤9 дней). Категории длительности менструации также пересмотрены: теперь существует нормальная (≤8 дней) и длительная (>8 дней).
Заседание открыла доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии ГБОУ ДПО РМАНПО Наталия Михайловна Подзолкова – она осветила основные изменения в терминологии и классификации аномальных маточных кровотечений (АМК), предложенных Международной федерацией акушерства и гинекологии (International Federation of Gynecology and Obstetrics – FIGO). Так, перемены коснулись терминологии нормального и аномального кровотечения: в новой редакции (2018 г.) аменорея входит в категорию «частота» (ранее в категорию «регулярность»), а также предложены улучшенные критерии регулярности (нормальные колебания от самого короткого до самого длинного цикла составляют 8 дней с незначительной разницей в зависимости от возраста (18–25 лет – ≤9 дней; 26–41 год – ≤7 дней, 42–45 лет – ≤9 дней). Категории длительности менструации также пересмотрены: теперь существует нормальная (≤8 дней) и длительная (>8 дней). Попытка структурировать имеющиеся знания в 2022 г. привела к выделению трех типов нарушения овуляции, наиболее распространенной причины аменореи, АМК и бесплодия, а также частого проявления синдрома поликистозных яичников (СПКЯ); табл. 1. Это дает возможность клиницисту определить, на каком уровне «произошла поломка» и с чем она связана.
Алгоритмы диагностики нарушений менструального цикла представила Ирина Всеволодовна Кузнецова, доктор медицинских наук, профессор, президент Международной ассоциации гинекологов, эндокринологов и терапевтов (МАГЭТ), заместитель генерального директора по научно-исследовательской работе ООО «Витбиомед+». Важным аспектом диагностики нарушений менструального цикла становится верное использование терминологии в клинической практике. Так, под первичной аменореей сегодня понимают отсутствие спонтанных менструаций в возрасте старше 16 лет. У девушек с развитием вторичных половых признаков, соответствующим возрасту, обследование стоит инициировать в 15–15,5 года, в то время как у девушек с отсутствием вторичных половых признаков или их резким недоразвитием диагностику стоит начинать в 13–14 лет. Вторичная аменорея – это отсутствие менструаций в течение 3 мес при исходно регулярном ритме менструаций или в течение 6 мес при исходной олигоменорее – увеличении продолжительности менструального цикла более 38 дней не менее чем в течение 3 последних месяцев, или 9 или менее менструаций за предшествующие 12 мес.
На фоне олигоменореи/аменореи возможно развитие АМК, каждое из которых требует обследования по системе PALM-COEIN. Ирина Всеволодовна предложила несколько схем обследований при первичной (рис. 1–3) и вторичной аменорее (рис. 4).
В условиях достаточной толщины эндометрия >5 мм и/или наличии фолликула диаметром ≥10 мм назначается микронизированный прогестерон 400 мг/сут в течение 10 дней. Если менструальное кровотечение начинается на фоне приема прогестагена, препарат следует отменить. Проба считается положительной при появлении кровотечения в течение недели после отмены прогестагена. При отрицательном результате следует выполнить ультразвуковое исследование (УЗИ), поскольку отсутствие кровотечения отмены может означать возобновление фолликулогенеза и прошедшую овуляцию (рис. 5).


Для того чтобы оценивать уровень андрогенов и правильно интерпретировать их результаты, необходимо учитывать показания по проведению диагностики.
У пациенток с олигоменореей исследование выполняется по следующим показаниям: наличие андрогензависимой дермопатии или признаков вирильного синдрома, а также поликистозная морфология яичников по данным УЗИ. Обязательный набор тестов включает общий тестостерон, дегидроэпиандростеронсульфат (ДГЭАС), 17-оксипрогестерон (если врожденная дисфункция коры надпочечников не исключена ранее).
У пациенток с клиническим гиперандрогенизмом для его подтверждения достаточно выявления высокого/нормального тестостерона и/или ДГЭАС. У пациенток с поликистозной морфологией яичников для подтверждения СПКЯ необходимо выявление повышенного общего тестостерона и/или свободного тестостерона, и/или глобулина, связывающего половые гормоны (ГСПГ). При подозрении на опухолевую гиперандрогенемию следует определять все доступные андрогены и их метаболиты в крови и моче.
Дополнительно для уточнения причин нарушения ритма менструаций при наличии признаков гиперкортицизма определяют уровень кортизола в слюне вечером и проводят малую пробу с дексаметазоном и направляют пациентку к эндокринологу при положительном результате хотя бы одного из тестов. При подозрении на соматотропиному также необходимо направить пациентку к эндокринологу. При наличии ожирения проводится оценка уровней глюкозы и инсулина натощак и через 2 ч после стандартной нагрузки глюкозой, а также оценка липидного профиля. Уровень прогестерона в плазме крови проводят для подтверждения овуляции или выявления ановуляции в регулярных менструальных циклах в рамках диагностики СПКЯ и бесплодного брака, а также для установления недостаточности лютеиновой фазы цикла в рамках обследования женщин со сниженной фертильностью. Выбор дня для взятия пробы обусловлен показателями стабильности цикла: так, при стабильной длительности диагностику проводят за 6–8 дней до начала менструального кровотечения, при нестабильном/вариабельном цикле – начиная с 16-го дня от начала менструального кровотечения, раз в неделю, до начала менструации, но не более 3 раз. Овуляцию подтверждает уровень прогестерона >5 нг/мл (15 нмоль/л), а полноценную лютеиновую фазу – >10 нг/мл (30 нмоль/л); рис. 6.

Контроль менструального ритма – задача, требующая решения вне зависимости от поиска причины нарушений. На этапе проведения диагностических манипуляций приемлемым способом восстановления ритма менструаций является применение прогестерона (Утрожестан®), эффекты которого многочисленны: это и анксиолитическое действие, и участие в регуляции качества сексуальной жизни, концентрации мышления, когнитивных функций, настроения, сна, аппетита, памяти, процессов обучения, болевой чувствительности. С учетом некоторых ограничений назначение прогестерона в циклическом режиме для индукции регулярных менструаций может принести дополнительную пользу.
Эндокринным причинам нарушений менструального цикла было посвящено выступление Ирэны Адольфовны Иловайской, доктора медицинских наук, руководителя отделения нейроэндокринных заболеваний отдела общей эндокринологии, профессора курса частной эндокринологии при кафедре эндокринологии факультета усовершенствования врачей ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». Клиницисту важно определить тип овуляторной дисфункции и отнести ее к гиперпролактинемической, гипогонадотропной, нормогонадотропной или гипергонадотропной, от чего будут зависеть подходы к терапии. Причинами нарушений менструального цикла могут стать СПКЯ, акромегалия, а также ожирение (рис. 7). Показано, что при индексе массы тела (ИМТ) более 30 кг/м2 частота менструальных нарушений возрастает в 5 раз, а частота бесплодия – в 2 раза.

Известно, что назначение метформина в составе комбинированной терапии оказывает выраженный эффект на массу тела при СПКЯ. При отсутствии однозначных официальных показаний для назначения метформина пациенткам с СПКЯ, можно предложить мио-инозитол, который по своей эффективности сравним с метформином (табл. 2). Препарат способствует повышению чувствительности рецепторов к инсулину, а также клеток гранулезы – к фолликулостимулирующему гормону (ФСГ).
Улучшение показателей углеводного обмена происходит и на фоне приема хрома пиколината – это показано в систематическом обзоре и метаанализе 28 рандомизированных клинических исследований (РКИ). Хрома пиколинат способствует снижению уровня инсулина и гликемии натощак, гликированного гемоглобина, индекса инсулинорезистентности HOMA-IR. У пациенток с СПКЯ на фоне дотации витамина D снижается уровень тестостерона и повышается толщина эндометрия, отмечается снижение уровня общего холестерина и С-реактивного белка (показателя воспалительной реакции). Учитывая эти данные, при прегравидарной подготовке пациенткам можно рекомендовать Витажиналь® Инозит, содержащий и мио-инозитол, и витамин D, и хрома пиколинат. Накопленный опыт и результаты исследований подтверждают, что клинический эффект мио-инозитола и других компонентов Витажиналя Инозит наиболее выражен при приеме 4 саше в сутки, однако суточная доза комплекса может определяться степенью выраженности клинических проявлений.
Комплексный подход к диагностике и лечению репродуктивных и метаболических нарушений при СПКЯ озвучила Галина Евгеньевна Чернуха, доктор медицинских наук, профессор, главный научный сотрудник отделения гинекологической эндокринологии ФГБУ «НМИЦ АГП им. В.И. Кулакова», президент МОО «Ассоциация гинекологов-эндокринологов».
В основе патофизиологических процессов заболевания лежит нарушение фолликулогенеза. Происходит ускоренное рекрутирование фолликулов из первичного пула и усиление их роста, увеличение выработки антимюллерова гормона (АМГ), за счет возрастания числа фолликулов и избыточной активности гранулезных клеток (ГК), задержка роста фолликулов и нарушение отбора доминантного фолликула (на стадии малых антральных фолликулов, когда гранулезные клетки начинают экспрессировать ароматазу и секретировать Е2), следствием чего становится овуляторная дисфункция. СПКЯ – это лишь «вершина айсберга», которую сопровождают и метаболические, и психоэмоциональные нарушения, и гестационные осложнения.
Наибольший интерес в теме СПКЯ представляют исследования по инсулинорезистентности (ИР), ожирению, метформину и метаболическому синдрому. ИР является патофизиологическим фактором развития СПКЯ, однако доступные анализы на инсулин имеют ограниченное клиническое значение и не рекомендуются в рутинной практике. Для оценки риска развития сердечно-сосудистых заболеваний и сахарного диабета (СД) 2-го типа у женщин с СПКЯ независимо от возраста и ИМТ должна быть проведена оценка липидного профиля (холестерина, липопротеинов низкой плотности, липопротеинов высокой плотности и триглицеридов). При постановке диагноза у всех взрослых и подростков с СПКЯ стоит оценивать гликемический статус. Следует рекомендовать пероральный тест на толерантность к глюкозе как наиболее точный тест для оценки гликемического статуса при СПКЯ, независимо от ИМТ. Гликемический статус нужно оценивать каждые 1–3 года в зависимости от индивидуальных факторов риска развития СД (рис. 8).

Каждая третья пациентка с СПКЯ при нормальном ИМТ имеет избыток жировой ткани или «скрытое ожирение», а в каждом третьем случае оно ассоциировано с гиперинсулинемией, ИР и дислипидемией, в каждом пятом – с нарушением толерантности к глюкозе (НТГ). При пороговом значении ИМТ≥23 кг/м2 в 100% случаев выявляется «скрытое ожирение», в 11 раз чаще встречается нарушенная толерантность к глюкозе, в 3 раза чаще гиперинсулинемия и дислипидемия, поэтому основными мишенями для фармакотерапии пациенток с СПКЯ становятся также ожирение, гиперандрогения, олиго-овуляция и ИР. Лечение должно быть длительным, адаптированным к меняющимся обстоятельствам, личным потребностям и ожиданиям пациенток.
Изменение образа жизни – первый и самый важный этап терапии. Снижение массы тела на 10–15% в течение 6 мес приводит к увеличению частоты овуляций в 3,7 раза, регуляции цикла – в 5,6 раза. Взрослым с СПКЯ и ИМТ≥25 кг/м2 следует рассмотреть вопрос о назначении метформина для коррекции антропометрических и метаболических показателей, включая ИР, уровень глюкозы и липидный профиль, однако необходимо учитывать показания для постоянного приема.
Открытие роли дефицита инозитол-фосфогликана в нарушении передачи инсулиновых сигналов открыло новые горизонты в лечении пациенток с СПКЯ. Перспективным становится назначение мио-инозитола – одного из стериоизомеров шестиатомного спирта инозита (рис. 9). Мио-инозитол – это вторичный мессенджер инсулиновых рецепторов, он повышает чувствительность к инсулину, регулирует захват глюкозы клеткой путем активации ферментов, контролирующих ее метаболизм, опосредует сигналы ФСГ, играет важную роль в созревании ооцитов, оказывает положительное влияние на созревание фолликулов и качество яйцеклеток. Дефицит инозитола способствует нарушению гормонального баланса и повышению уровня тестостерона.
В одном метаанализе 26 РКИ (1691 женщина с СПКЯ) проведено сравнение эффективности и безопасности инозитолов с плацебо и метформином (табл. 3). Показано, что эффективность метформина и инозитола сопоставимы, на основании чего авторы работы советуют включить инозитол в протокол лечения СПКЯ, особенно у женщин, имеющих побочные эффекты на фоне терапии метформином.
Инозитол (в любой форме) может быть рекомендован женщинам с СПКЯ с учетом индивидуальных предпочтений, несмотря на ограниченную эффективность для коррекции метаболических показателей, ановуляции, гирсутизма или массы тела. Стоит отметить, что конкретные типы, дозы или комбинации инозитола в настоящее время не могут быть рекомендованы из-за отсутствия качественных доказательств, но чаще всего Витажиналь® Инозит, содержащий мио-инозитол, витамин D, хрома пиколинат, фолиевую кислоту и экстракт зеленого чая, рекомендуют в дозе 2–4 саше в сутки (рис. 10).

Женщины с СПКЯ должны быть информированы о необходимости профилактики гиперплазии и рака эндометрия путем снижения массы тела и регуляции менструального цикла за счет терапии прогестагенами. Для защиты эндометрия могут быть рассмотрены монокомпонентные оральные контрацептивы, содержащие только прогестин. Циклические прогестины (например, микронизированный прогестерон 100–200 мг/день) являются разумной альтернативой контрацептивам, в частности, у женщин, заинтересованных в беременности. Такая терапия рекомендована пациенткам с олигоменореей для профилактики гиперплазии и рака эндометрия в связи с отсроченными рисками избыточного воздействия эстрогенов на эндометрий. Показано, что монотерапия Утрожестаном достоверно способствует снижению уровня лютеинизирующего гормона (ЛГ), АМГ, тестостерона и адростендиона, а также повышению уровня ГСПГ.
Во втором своем выступлении Ирэна Адольфовна Иловайская озвучила клинические подходы к ведению пациенток с гипогонадотропным гипогонадизмом – клиническим синдромом, характеризующимся снижением секреции половых стероидов и возникающим на фоне нарушения центральной регуляции/секреции гонадотропинов. В качестве «мягкого» варианта гипогонадо-тропного гипогонадизма можно рассматривать функциональную аменорею – форму хронической ановуляции, связанную не с идентифицируемыми органическими причинами, а чаще со стрессом, потерей массы тела, чрезмерными физическими нагрузками или их комбинацией (диагноз исключения). Несмотря на отсутствие органических нарушений, заболевание требует своевременной инициации гормональной терапии для предотвращения негативных последствий гипо-эстрогенемии и скорейшего восстановления центральной регуляции гонадотропной функции.
По данным Эндокринологического общества (Endocrine Society, 2018 г.), подросткам и женщинам, у которых не произошло восстановление менструального цикла после соответствующей коррекции питания, физических нагрузок и психологического статуса, рекомендовано краткосрочное использование трансдермального эстрадиола (0,06% во флаконе с помпой-дозатором). Трансдермальные эстрогены имеют ряд преимуществ у пациенток с функциональной гипоталамической аменореей: они не проходят «первичный» барьер в печени, поддерживают баланс эстрадиола и эстрона, не влияют на синтез белков системы гемостаза, содержание гормонов щитовидной железы, синтез ГСПГ и инсулиноподобного фактора роста 1 в печени и положительно влияют на состояние костной ткани.
Преждевременная недостаточность яичников (ПНЯ), по данным акушера-гинеколога, эндокринолога, кандидата медицинских наук Гродницкой Елены Эдуардовны, может осложняться повышением уровня депрессии, тревожности, стресса, низкой самооценкой, увеличением риска развития сексуальной дисфункции, остеопороза, сердечно-сосудистых и цереброваскулярных заболеваний, когнитивной дисфункции и даже летальных исходов. Ситуацию может скорректировать назначение эстроген-гестагенных препаратов: показано, что смертность от всех причин на фоне курса терапии снижается. Женщины с преждевременной менопаузой, начинающие менопаузальную гормональную терапию (МГТ) до 50 лет, достигают наиболее значительного преимущества с точки зрения продолжительности жизни.
Как подобрать терапию с учетом риска сердечно-сосудистых заболеваний? Согласно официальному ежегодному документу «White paper» Международной ассоциации по менопаузе (IMS), приуроченному ко Всемирному дню менопаузы (2023 г.), для женщин с риском сердечно-сосудистых заболеваний предпочтительна трансдермальная терапия эстрадиолом и микронизированным прогестероном. Трансдермальные препараты эстрадиола в меньшей степени влияют на факторы свертывания крови, АД, триглицериды, С-реактивный белок и ГСПГ, и в низких дозах предпочтительны для женщин с риском венозной тромбоэмболии – ВТЭ (пациентки с ранней – до 40 лет и поздней – после 55 лет менопаузой имеют в 1,5–1,8 раза больший риск ВТЭ по сравнению с женщинами с возрастом наступления менопаузы 40–49 лет, поэтому важно, чтобы такие пациентки получали трансдермальные формы эстрогенов), гипертензией, гипертриглицеридемией, ожирением, метаболическим синдромом, диабетом и болезнью желчного пузыря в анамнезе. При трансдермальном пути введения отсутствует «метаболический ответ»: нет усиления липидного и белкового обменов, повышения уровня ренина и ангиотензиногена (индукции вазоконстрикции и артериальной гипертензии), уровня С-реактивного белка, т.е. нет провоспалительного эффекта. Статистически значимо меньший риск развития инфаркта показан при трансдермальном применении эстрогенов по сравнению с пероральным.
В комбинации с эстрогеном необходимо назначать гестаген для защиты эндометрия при интактной матке (рис. 11). Микронизированный прогестерон считается нейтральным в отношении риска тромбоза, не обладает андрогенной, минералкортикоидной и глюкокортикоидной активностью, может минимизировать метаболические нарушения и побочные эффекты, ассоциированные с другими гестагенами. Показано, что у женщин с ПНЯ и ранней менопаузой прогестерон способствует статистически значимому улучшению сердечного выброса, снижению диастолического давления и общего периферического сопротивления сосудов. Кроме того, данные наблюдений позволяют предположить, что микронизированный прогестерон может иметь меньшую ассоциацию с раком молочной железы, чем другие синтетические гестагены.

Комбинированный подход может быть целесообразным и при нарушениях сна: согласно исследованиям, комбинация эстрогена и прогестерона оказалась эффективной в отношении нарушений сна, в отличие от монотерапии эстрогенами.
Пациенткам с ПНЯ могут потребоваться более высокие дозы эстрадиола в составе заместительной гормональной терапии (ЗГТ). Например, 1,5–3,0 мг/сут эстрадиола гемигидрата в составе 0,06% накожного геля (2,5–5,0 г) для купирования менопаузальных симптомов и профилактики постменопаузального остеопороза (см. рис. 11).
Выбору терапии функциональных нарушений менструального цикла посвятила свой доклад доктор медицинских наук, профессор, Заслуженный врач РФ, Заслуженный деятель науки РФ, Лауреат премии Правительства РФ, заведующая кафедрой акушерства и гинекологии лечебного факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Юлия Эдуардовна Доброхотова.
При назначении медикаментозного лечения в распоряжении клинициста оказывается три класса гормональных средств: гестагены в циклическом режиме, комбинированные оральные контрацептивы (КОК) и циклическая ЗГТ. Если женщине необходима контрацепция, лечение гиперандрогенных состояний (гирсутизм, акне), а также при наличии у пациентки дисменореи, обильных менструаций, проявлений предменструального синдрома предпочтение лучше отдать КОК. Если женщина готовится к беременности (даже в ближайшей перспективе), но у нее выявлена недостаточность лютеиновой фазы, предпочтительны гестагены в циклическом режиме. При хроническом стрессе или центральных НМЦ (центральная нормогонадотропная олиго- или аменорея) при дефиците эндогенного прогестерона возможно назначение гестагенов в циклическом режиме, либо циклическая ЗГТ с натуральным эстрадиолом при дефиците эстрогенов. В случае назначения ЗГТ предпочтение стоит отдавать трансдермальному препарату Эстрожель®.
В отличие от синтетических гестагенов, микронизированный прогестерон (Утрожестан®) – антистрессовый гормон-адаптоген, обладающий анксиолитическим эффектом (благодаря его естественным α-метаболитам), что благоприятно сказывается на эмоциональном фоне и уровне тревожности. Также по данным исследования 2019 г., Утрожестан® эффективно контролирует МЦ даже после отмены терапии как минимум в течение 6 мес у 98% женщин. Однозначным преимуществом является выбор пути введения препарата (перорально или интравагинально).
Проблемы позднего репродуктивного возраста тесно пересекаются с проблемами перехода в менопаузу, считает Вера Ефимовна Балан, профессор, руководитель поликлинического отделения ГБУЗ МО МОНИИАГ, Президент междисциплинарной ассоциации специалистов по здоровому старению. В задачи клинициста входят и лечение НМЦ, и подбор контрацепции, и лечение климактерических расстройств с помощью циклической гормонотерапии.
Снижение уровня прогестерона – одно из основных причин нерегулярных менструаций в позднем репродуктивном возрасте. При этом часто наблюдается относительная гиперэстрогения и недостаточная секреторная трансформация эндометрия, что в 2,5 раза увеличивает риск развития гиперпластических процессов и АМК. Также недостаток прогестерона приводит к нарушениям психоэмоционального фона женщины, нарушениям сна (частые пробуждения, бессонница, трудности засыпания и ранние пробуждения). Таким пациенткам важно назначить терапию, которая физиологично восполнит уровень прогестерона, восстановит регулярный цикл, снизит риск развития гиперпластических процессов и повлияет на первые симптомы менопаузы.
Микронизированный прогестерон (Утрожестан®) отвечает критериям терапии НМЦ в позднем репродуктивном возрасте. Он физиологично восполняет уровень прогестерона, тем самым нормализует МЦ и снижает риск развития гиперпластических процессов эндометрия, является метаболически нейтральным гестагеном и не оказывает влияния на липидный и углеводный профили, не приводит к увеличению массы тела, не оказывает альдестеронового эффекта (отсутствие задержки жидкости и отеков, мигрени и мастодинии), за счет метаболита аллопрегнанолона является «физиологическим» регулятором сна и оказывает противотревожный эффект, а также снижает частоту первых симптомов менопаузы (ночная потливость, приливы) и улучшает качество сна. 200–400 мг микронизированного прогестерона в сутки на срок не менее 10–14 дней назначается женщинам в периоде менопаузального перехода для профилактики гиперпластических процессов эндометрия и регуляции менструального цикла.
Для полноценной профилактики серьезных неинфекционных заболеваний «взросления» (ментальных и сердечно-сосудистых заболеваний, урогенитальной атрофии, остеопороза и т.д.) необходимы раннее начало применения МГТ, правильный переход от одного вида ее к другому и длительный прием. МГТ, назначенная в рамках терапевтического «окна возможностей», может обеспечить профилактические эффекты в отношении ряда неинфекционных хронических заболеваний и снизить частоту развития СД на 30%, сердечно-сосудистую смертность на 12–54%, вазомоторные симптомы в 75% случаев, риски перелома шейки бедра на 30%, дополнительно снизить общую смертность на 31% у женщин в возрасте 50–59 лет. У женщин с климактерическими симптомами и наличием коморбидных состояний рекомендуется отдавать предпочтение трансдермальному пути введения эстрогенов, при этом можно придерживаться следующей схемы:
• в перименопаузе предпочесть циклический режим, с 1 по 25-й день цикла по 1 суточной дозе (2 нажатия на помпу-дозатор) Эстрожеля и одновременно в течение 12–14 последних дней 200 мг Утрожестана, далее перерыв;
• в постменопаузе придерживаться непрерывного режима, по 0,5 суточной дозы (1 нажатие на помпу-дозатор) Эстрожеля и 100 мг Утрожестана;
• при хирургической менопаузе целесообразен непрерывный режим по 0,5–1,0 суточной дозы (1–2 нажатия на помпу-дозатор) Эстрожеля.
Согласно российским клиническим рекомендациям, трансдермальные формы эстрогенов благодаря отсутствию первичной стадии печеночного метаболизма в отличие от пероральных форм эстрогенов имеют более благоприятный профиль безопасности – не повышают риск осложнений ВТЭ и желчнокаменной болезни. Использование трансдермальных форм эстрогенов ассоциировано с меньшим риском больших сердечно-сосудистых событий (инфаркта, инсульта) и осложнений ВТЭ, чем использование эквивалентных доз пероральных форм эстрогенов.
Протасова Анна Эдуардовна, доктор медицинских наук, профессор кафедры онкологии СПбГУ, профессор кафедры акушерства и гинекологии ФГБУ «СЗФМИЦ им. В.А. Алмазова», обсудила с собравшимися коллегами принципы диагностики гиперплазии эндометрия, занимающей второе место в структуре гинекологической заболеваемости. Согласно статистике, атипия выявляется лишь в 2,9% случаев заболевания, а гиперплазия не входит в список факторов риска рака эндометрия.
К УЗИ-признакам гиперплазии эндометрия относят несоответствие толщины эндометрия фазе менструального цикла, повышенную эхогенность, неоднородность и губчатость эхоструктуры эндометрия с множественными мелкими анэхогенными включениями и эффектом акустического усиления. Однако чувствительность этого метода в репродуктивном возрасте составляет не более 25% (в постменопаузе – более 90%). Целесообразно прибегать и к другим вариантам диагностики – допплеросонографии и эластографии эндометрия. Биопсия эндометрия также становится диагностическим инструментом, однако показана не всем пациенткам и проводится при сочетании факторов риска наличия предраковых или злокачественных изменений. Что касается компьютерной томографии, магнитно-резонансной томографии (МРТ) или определения биологических маркеров, их рутинное использование не рекомендуется, поскольку не существует доказательств ценности этих методов в качестве вспомогательных средств диагностики гиперплазии эндометрия. Однако МРТ рассматривается как перспективный метод в дифференциальной диагностике атипической гиперплазии эндометрия и рака эндометрия, поскольку МРТ с использованием диффузно взвешенных последовательностей позволяет выявить начальные признаки инвазии ткани эндометрия в миометрий, характерные для ранней стадии рака эндометрия.
Общие принципы терапии больных морфологически верифицированной гиперплазией эндометрия без атипии озвучила Наталия Михайловна Подзолкова. После морфологической верификации диагноза «гиперплазия эндометрия» рекомендуется введение левоноргестрелсодержащей внутриматочной системы (ЛНГ-ВМС), но в случае противопоказаний или отказа от ее введения целесообразна терапия прогестагенами в непрерывном или пролонгированном циклическом режиме (прогестагены в циклическом режиме менее эффективны для регрессии гиперплазии эндометрия без атипии по сравнению с непрерывным режимом приема и ЛНГ-ВМС). При сочетании гиперплазии эндометрия с миомой матки и эндометриозом рекомендуется применение агонистов гонадотропин-рилизинг-гормона. Для определения дальнейшей тактики ведения нужно проводить терапию в течение 6 мес с последующим исследованием биопсийного (операционного) материала эндометрия (при наличии внутриматочной терапевтической системы – без ее удаления). При отсутствии эффекта от консервативного лечения и прогрессировании гиперплазии эндометрия стоит рассмотреть вопрос о хирургическом лечении (гистерэктомия, по возможности, лапароскопическим доступом или резекция эндометрия под гистероскопическим контролем – гистерорезектоскопия).
Наталия Михайловна обратила внимание на результаты интересной работы, опубликованной в 2023 г. в журнале International Journal of Gynecology & Obstetrics, в которой проводилось сравнение эффективности вагинального микронизированного прогестерона и ЛНГ-ВМС у пациенток с гиперплазией эндометрия без атипии. Клиническая эффективность обоих препаратов оказалась сопоставима, что позволяет предлагать микронизированный прогестерон пациенткам репродуктивного периода с НМЦ и риском развития гиперплазии эндометрия.
Тему эффектов прогестерона и его метаболитов представила кандидат медицинских наук, доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО «РНИМУ им Н.И. Пирогова» Метанат Рафиговна Нариманова – в частности, она широко осветила нейропротективный эффект метаболитов прогестерона.
Метаболит прогестерона аллопрегнанолон действует как физиологический модулятор и защитный агент нервной системы. Одной из основных функций этого нейроактивного стероида является нейропротекция в случае поражения, ишемии или периферических невропатий (например, при диабете). Аллопрегнанолон может уменьшать симптомы нейродегенеративных заболеваний (например, болезни Альцгеймера, Паркинсона, болезни Нимана–Пика типа C, рассеянного склероза) на животных моделях. При исследовании в мышиной модели введение аллопрегнанолона способствовало нейрогенезу, уменьшению воспаления, восстановлению функции памяти и обучения. Как нейроактивный стероид прогестерон влияет на нервную систему, связываясь с NMDA- и GABAA ГАМК-рецепторами.
Аллопрегнанолон может стать возможным кандидатом для лечения нейропатической боли, расстройств настроения и тревожных расстройств. Метаболиты прогестерона как естественные положительные модуляторы нейрональных рецепторов ГАМК оказывают дозозависимое психофармакологическое действие: анксиолитическое, антидепрессивное, обезболивающее, противосудорожное, аналгезирующее. Во время острого стресса надпочечники синтезируют большое количество аллопрегнанолона, также увеличивается его локальный синтез в головном мозге – как механизм защиты от стресса.
Согласно исследованиям, прогестерон улучшает качество сна, что особенно актуально в позднем репродуктивном и переходном периоде. Утрожестан®, микронизированный прогестерон, способствует нормализации менструального цикла и сна. Последние данные говорят об эффективности его применения у пациенток в перименопаузе с нарушениями цикла, бессонницей и ночной потливостью.
Свойства прогестерона (табл. 4) подытожила Елена Ивановна Вовк, кандидат медицинских наук, доцент кафедры терапии и подростковой медицины ФГБОУ ВО РМАНПО. Плейотропное действие прогестерона – это результат его гибкого взаимодействия со всеми стероидными рецепторами в организме. В физиологических условиях афинность прогестерона к собственным рецепторам ниже, чем у дидрогестерона, как в половых органах, так и в других тканях-мишенях, и это обеспечивает тонкую настройку обратной связи с другими регуляторами.

Наличие антиальдостеронового действия у микронизированного прогестерона крайне важно не только во время беременности, но и в переходном периоде, поскольку в этот период женщины начинают отмечать пастозность, отечность, мастодинию, особенно во вторую фазу цикла, что связано со снижением выработки прогестерона и задержкой жидкости в организме на фоне относительной гиперэстрогении. Микронизированный прогестерон будет уменьшать эти симптомы, улучшая качество жизни женщины.
Посредством протеомных и рецепторно-опосредованных систем прогестерон как нейростероид оказывает плейотропное защитное действие в центральной нервной системе (ЦНС). Прогестерон и его метаболит аллопрегнанолон играют фундаментальную роль в обеспечении развития и функционировании ЦНС, адаптации к стрессу и реакции на повреждение. Научно доказаны механизмы трофического влияния прогестерона и его нейростероидных метаболитов: нейрогенез и активизация функции глиальных клеток, пролиферация нейронных клеток-предшественников, миелинизация, противовоспалительное действие. Елена Ивановна подтвердила данные, представленные другими спикерами: в многочисленных исследованиях показаны быстрые психофармакологические эффекты прогестерона и его метаболитов, а именно анксиолитическое, антидепрессивное, анестетическое, противосудорожное и аналгезирующее действие, а также способность к поддержанию когнитивного статуса, нормализации сна, восстановлению после черепно-мозговой травмы, замедлению развития болезни Альцгеймера (рис. 12).
Также прогестерон обладает противовоспалительным и иммуномодулирующим действием: ингибирует синтез провоспалительных цитокинов макрофагами и дендритными клетками, способствует выработке противовоспалительных цитокинов CD4+ Т-хелперами и переключению на противовоспалительный ответ Th2-типа, совместно с эстрадиолом стимулирует размножение Т-регуляторных клеток, поддерживая иммунную толерантность. Прогестерон дозозависимо модулирует сигнальные пути, которые включают супрессоры распространения опухоли в культуре клеток ER/PR-позитивного рака молочной железы. Лечение вазомоторных симптомов пероральным микронизированным прогестероном можно рассматривать как эффективную и безопасную терапию «замещающего типа» у женщин в перименопаузе, у которых сохранены менструации.
Таким образом, механизмы эффективности прогестерона множественны и тканеспецифичны, что позволяет применять препарат при широком спектре состояний, далеко выходящих за рамки акушерства и гинекологии.
Редакционный материал. Обзор подготовлен по материалам заседания экспертного клуба «Нарушения менструального цикла. От правильного диагноза к грамотному лечению» от 23 марта 2024 г.
4 июня 2024
Количество просмотров: 10873


