Клинический разбор в общей медицине №3 2024
Tatyana Yu. Kobyzeva1
1 Research Institute of Human Morphology named after Academician A.P. Avtsyna – Russian Scientific Centre of Surgery named after Academician B.V. Petrovsky, Moscow, Russia;
2 OJSC "Treatment Centre", Moscow, Russia;
3 Municipal Clinical Hospital No. 31 named after Academician G.M. Savelyeva of the Moscow City Health Department, Moscow, Russia;
4 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
5 Pirogov National Medical and Surgical Centre, Moscow, Russia
abelyarrin@yandexl.ru
Abstract
Abnormal uterine bleeding (AUB), common in a cohort of women in the reproductive period, is undoubtedly an extremely important factor reducing quality of life. Persistent endometrial inflammation is a pathogenetic link associated with endometrial dysfunction. The article reflects the modern paradigm of etiology, pathogenesis and management of patients with AUB on the background of chronic endometritis according to the data of domestic and foreign literature.
Keywords: abnormal uterine bleeding, chronic endometritis, endometrial dysfunction.
For citation: Mitrelis R.Yu., Mikhaleva L.M., Orazov M.R., Mikhalev S.A., Kobyzeva T.Yu. Chronic endometritis in the development of abnormal uterine bleeding, endometrial dysfunction and other reproductive disorders (literature review). Clinical review for general practice. 2024; 5 (3): 27–38. (In Russ.). DOI: 10.47407/kr2023.5.3.00371
Аномальные маточные кровотечения (АМК) среди женщин репродуктивного возраста распространены довольно в широких пределах от 3% до 50% как в России, так и во всем мире. В настоящее время по клиническим рекомендациям Российского общества акушеров-гинекологов диагноз «аномальные маточные кровотечения» определяется кровотечениями по продолжительности (больше 8 сут), объему кровопотери (более 80 мл) и/или частоте (меньше 24 дней).
Нормальный менструальный цикл женщины репродуктивного возраста имеет длительность от 24 до 38 дней, длительность менструации варьирует от 7 до 9 дней, с кровопотерей от 5 до 80 мл [1]. Более 50% женщин с АМК не обращаются к гинекологу за медицинской помощью, несмотря на ее доступность в настоящее время. Данный фактор способствует случайной частоте ошибок в заниженных показателях распространенности АМК. Это связано с тем, что нередко пациентки обращаются за клинической помощью к гинекологу уже в условиях только манифестации маточного кровотечения, несмотря на высокую доступность медицинских услуг в современном мире. Поэтому определение точной распространенности АМК в данное время остается достаточно вариативной [2, 3].
АМК влияют на различные уровни благополучного жизненного статуса женщины [4]. Кроме того, АМК провоцируют железодефицитные анемии и их последствия влияют на самочувствие женщины, что является фактором, увеличивающим материнскую заболеваемость и смертность у беременных женщин, страдающих анемией [5]. Женщины с нарушениями менструального цикла часто предъявляют жалобы на тревожность, депрессивное состояние, бессонницу или сонливость, снижение либидо по сравнению с женщинами, не имеющими нарушений менструального цикла [6]. В таблице приведены показатели и соответствующие им характеристики АМК по данным FIGO (2018 г.).
PALM–COEIN – это сокращенное обозначение единой системы, классифицирующей основные факторы АМК. «PALM» представляет структурные причины кровотечений. «COEI» – неструктурные причины. «N» характеризует, как «не классифицировано иначе».
• Р: полип;
• А: аденомиоз;
• L: лейомиома;
• M: гиперплазия/рак эндометрия;
• С: коагулопатия/нарушение свертываемости крови;
• О: овуляторная дисфункция;
• E: эндометриальные причины;
• I: ятрогенные причины;
• N: не классифицировано иначе;
В соответствии с данной системой у одной пациентки может быть одновременно не одна причина, приводящая к АМК. Однако важно отметить, что часть патологий, например полипы эндоцервикса или эндометрия, лейомиомы, могут не сопровождаться кровотечениями и, следовательно, не являться причиной АМК [1].
Проявления АМК в клинической практике разделяются на тяжелые менструальными кровопотери и межменструальные кровотечения. Ранее терминология была такова: «меноррагия», «менометроррагия» и «метроррагия». Межменструальные кровотечения, занимающие довольно весомое количество в популяции женщин репродуктивного возраста, увеличивают распространенность АМК до 75% и более.
Учитывая вариации продолжительности кровотечения, АМК следует дифференцировать на острые и хронические. Острое АМК характеризуется кровотечением, требующим экстренное медицинское вмешательство с целью предупреждения впоследствии кровопотери, несущей угрозу жизни. АМК острого течения наступает как само по себе, так и вследствие прогрессирующего хронического AМК. При хроническом АМК выявляются нарушения менструального цикла, представляющие собой межменструальные кровяные выделения, протекающие в течение нескольких месяцев [8–10]. Кроме того, существуют индивидуальные факторы нарушения менструального цикла, которые встречаются в подростковом или перименопаузальном возрасте [8–10].
Полип: АМК-P. Причина АМК при полипах эндометрия распространена в пределах от 4% до 60%. Полипы эндометрия часто являются причиной всех типов АМК, но при этом в ряде случаев полипы, развиваясь в эндометрии, не приводят к развитию маточных кровотечений у женщин. Учитывая изложенное, можно выделить следующие причины развития полипов матки, к которым относятся: нарушение экспрессии эстрогеновых и прогестероновых рецепторов в эндометрии, увеличение активности сигнальных путей, вызывающих гиперактивную пролиферацию и ангиогенез эндометрия, ослабление процессов апоптоза [12]. Помимо этого, по данным G.F. Peres и соавт. и M.J. Harmsen и соавт., генетические мутации и гиперэкспрессия ароматазы слизистой оболочки матки, которая повышает местный эстрогенный сигнал, может предшествовать возникновению полипов эндометрия [13, 14].
Аденомиоз: AМК-A. Аденомиоз представляет особое заболевание, характеризующееся присутствием желез эндометрия в миометрии с гипертрофией гладкой мышечной ткани [15, 16]. Аденомиоз чаще выявляется у женщин позднего репродуктивного возраста [17]. Патогенез АМК при аденомиозе до настоящего времени до конца не изучен. Как известно, у 1/3 пациенток аденомиоз протекает без клинических проявлений и в основном связан с иной патологией матки, например с гиперплазией, полипами эндометрия или лейомиомой [17].
Лейомиома: АМК-L. Лейомиомы/миомы матки являются доброкачественными новообразования миометрия и распространены в широких пределах среди женской популяции репродуктивного возраста. Лейомиомы могут протекать без клинических симптомов, но у 20–50% женщин появляются симптомы, которые можно напрямую отнести к миоме [18]. Миомы снижают сократительную функцию миометрия, могут повреждать эндометрий субмукозными лейомиоматозными узлами, создавать застой крови в миометрии и эндометрии посредством механического сдавления венозного сплетения. В 2018 г. FIGO представлена классификация миомы матки в зависимости от локализации. Считается, что именно локализация миоматозного узла и определяет клиническую симптоматику или ее отсутствие, в частности, именно подслизистые лейомиомы являются предикторами тяжелого маточного кровотечения.
Злокачественная опухоль: АМК-М. Факторы, провоцирующие гиперактивную пролиферацию эндометрия, потенциально служат причиной развития гиперплазии эндометрия (ГЭ) и канцерогенеза. Предикторами эстрогеново-прогестеронного дисбаланса является длительная эстрогенная стимуляция, а также факторы, предотвращающие эффекты прогестерона, создавая дисгормональное состояние. Общеизвестно, что факторами риска гиперплазии эндометрия и рака эндометрия являются ожирение, бесплодие, отсутствие родов, селективные модуляторы рецепторов эстрогена, диабет и синдром Линча [19]. Причинами провокации АМК служит дефицит физиологического падения уровня прогестерона для дальнейшей инициации отторжения гипертрофированной слизистой полости матки, а также ее пролиферативная гиперактивность, гиперактивный ангиогенез, необходимый для форсированного роста эндометриальной ткани. Перечисленные выше причины нередко приводят к длительному, обильному кровотечению. Таким образом, факторы, не контролирующие последовательный каскад процессов влияния прогестерона на эндометрий, такие как нарушение жирового обмена, синдром поликистозных яичников, сахарный диабет, эстроген-секретирующие опухоли яичников и прием тамоксифена, напрямую повышают риск возникновения рака эндометрия [20]. Типичная клиническая картина АМК, индуцированных раком эндометрия, является нерегулярной и непрерывной. Важно отметить, что кровотечение формируется вторично по отношению к дезинтеграции сосудов эндометрия вследствие инвазии злокачественной опухолью и патологического неоваскулогенеза [21].
Коагулопатия: AМК-С. Как известно, коагулопатиями страдают 13% женщин с АМК. Значительная часть из этого количества пациенток имеют болезнь Виллебранда [22]. Патологии гемостаза выявляются у 90% женщин при тщательном сборе структурированного анамнеза [1]. Выделяют 4 клинических варианта AМК-C: 1 – АМК во время антикоагулянтной терапии
(в настоящее время это группа АМК-I); 2 – АМК с наследственными нарушениями свертываемости; 3 – АМК, ассоциированное с цитопениями (в частности, тромбоцитопенией); 4 – АМК при серповидноклеточной анемии.
Овуляторная дисфункция: AМК-O. Причиной АМК также может быть овуляторная дисфункция, которую провоцируют нерегулируемое влияние эстрогенов на слизистую оболочку полости матки, катализируя гиперактивную пролиферацию и утолщение функционального слоя, что приводит к дальнейшим нарушениям менструального цикла в виде обильных менструаций, межменструальных кровяных выделений, задержки менструации. В данную категорию включают следующие патологические состояния при эндокринопатиях: гипотиреоз, гиперпролактинемия, синдром поликистозных яичников; потеря массы тела или ожирение, анорексия, психическое перенапряжение и экстремальные физические нагрузки также могут являться причиной ановуляторных циклов. Длительный прием наркотических веществ, как известно, усиливает уровень дофамина, поэтому включен в данную категорию. AМК-O – является диагнозом исключения.
Эндометриальная дисфункция: AМК-E. По данным современной литературы, до сих пор не изучены регуляторные процессы инициации и остановки менструального кровотечения. Реэпителизацию поверхностного эпителия эндометрия в настоящее время не принято оценивать ведущим фактором прекращения кровотечения, поскольку имеются данные гистологических подтверждений, что полная реэпителизация наблюдается уже в первые два дня менструации. В эндометриально-стромальном компартменте человека осуществляется систематический физиологический ангиогенез. В настоящее время подразумевается, что фактор роста эндотелия сосудов (Vascular endothelial growth factor, VEGF) продуцируется внутрисосудистыми нейтрофилами. Аномальный физиологический ангиогенез инициирует аномальные кровеносные сосуды с неполноценными стенками и вызывает развитие АМК. Также известно, что модифицирована экспрессия маркеров дифференцировки эндотелия сосудов при АМК [23]. АМК данной категории формируются в результате процессов активации ангиогенеза, усиленной продукции провоспалительных цитокинов, увеличения локального фибринолиза и дисбаланса простагландинов. Описанные процессы соответствуют персистирующему воспалению слизистой оболочки полости матки, а именно хроническому эндометриту (ХЭ).
Ятрогенные причины: AМК-I. Ятрогенными индукторами АМК является назначение экзогенной терапии, которая может привести к маточному кровотечению.
К этой категории относятся АМК, сопряженные с использованием системной фармакотерапии или внутриматочных систем или устройств. Помимо половых стероидов, эта группа включает нестероидные лекарственные препараты, приводящие к ановуляции, препараты, оказывающие действие на метаболизм дофамина, в частности фенотиазины и трициклические антидепрессанты. Пациентки с АМК, связанные с приемом антикоагулянтов, в новом пересмотре считаются ятрогенными и классифицируются – AМК-I [1]. Данная группа препаратов представляет собой: антагонисты витамина К и современные пероральные прямые антикоагулянты. Как известно, современные исследования продемонстрировали увеличенный риск АМК при приеме ривароксабана по сравнению с другими пероральными прямыми антикоагулянтами или варфарином.
Неклассифицированные как-либо иначе: АМК-N. Категория «АМК-N», «неклассифицированная как-либо иначе», была создана в исходной системе с целью установления причин АМК, которые встречаются крайне редко или трудно определены. Причины заключают в себе и выходят за рамки таких состояний, как артериовенозные мальформации, ниша после кесарева сечения, гипертрофия миометрия и другие нарушения функциональной состоятельности слизистой оболочки полости матки.
Особое место в настоящее время занимает категория эндометриальной дисфункции – AМК-E, поскольку существует глобальная проблема в клинической практике по недостатку общепринятых мер диагностики, лечения и раннего выявления ХЭ у женщин репродуктивного возраста. Генерирующее значение в развитии АМК, ассоциированного с ХЭ, имеют место заболевания женских половых органов воспалительного характера, в частности, которые развиваются после инфекций, передающихся половым путем, или после перенесенных внутриматочных вмешательств. Так, по данным Г.Т. Сухих (2013 г.), у 60% пациенток с ХЭ интенсивность кровянистых выделений отличалась от нормальных значений [24].
На протяжении последних лет, по данным научных исследований, идет активное изучение значимости ХЭ в развитии АМК [25–31]. По итогам исследований [25] ХЭ достоверно чаще диагностировался у пациенток с АМК, чем у здоровых женщин, увеличивая риск развития кровотечений.
Персистирующее воспаление эндометрия является патогенетическим звеном, ассоциированным с дисфункцией слизистой оболочки полости матки [28, 32, 30]. По заключениям В.Е. Радзинского (2019–2023 гг.), Л.М. Михалевой (2019–2023 гг.), М.Р. Оразова (2019–2023 гг.) ХЭ зачастую не имеет клинических проявлений на ранних этапах, следовательно, требуется разработка и выполнение общепринятых стандартов комплексного дообследования данной когорты пациенток.
ХЭ доминирует среди заболеваний эндометриальной дисфункции, частота обнаружения которого у женщин с бесплодием, по данным российских и зарубежных ученых, варьирует от 12% до 80% [31, 33–39]. Высокая распространенность ХЭ среди женщин репродуктивного возраста с бесплодием и ЭКО-неудачами определена специфичностью данного заболевания. Известно, что среди инициирующих предикторов развития ХЭ крайне увеличилась роль внутриматочной контрацепции и внутриматочных вмешательств, искусственного прерывания беременности и инфекций, передаваемых половым путем, характеризующихся длительным бессимптомным течением [29, 40–44].
В настоящее время установлена ключевая роль ХЭ в патогенезе эндометриальной дисфункции, приводящей к последующей дезорганизации рецептивности эндометрия и нарушению репродуктивной функции [45, 46]. Также необходимо отметить, что при ХЭ происходит расстройство рецепторного механизма эндометриального компартмента, ввиду персистирующего воспаления, приводящего к снижению экспрессии рецепторов путем дезорганизации кровообращения ткани и фиброзирования стромы эндометрия [31, 37, 47].
Провоцирующим фактором возникновения ХЭ является нахождение микробного фактора длительное время в микробиоценозе влагалища [40, 42, 43]. По данным современной литературы, известно, что в микробиотопах слизистой оболочки полости матки превалируют комплексы облигатно-анаэробных микробов, микроаэрофилов и вирусов, тропных к эндометрию.
E. Cicinelli, D. De Ziegler и соавт. [48] выявили более 70% случаев ХЭ – это результат негонококковой, нехламидийной этиологии даже у пациентов из группы риска.
В итоге активной жизнедеятельности в микробиоценозе влагалища патогенной или условно-патогенной микрофлоры, например Gardnerella vaginalis, Ureaplasma urealiticum, Mycoplasma genitalium и Mycoplasma hominis, – развитие ХЭ. При иммуногистохимическом анализе биоптатов эндометрия у пациенток, страдающих бесплодием, связанным с эндометриальной дисфункцией, до 89,4% выявлена неспецифическая причина развития ХЭ и лишь у 1,4% женщин диагностировано гранулематозное воспаление с эозинофильной инфильтрацией, типичной для специфических механизмов развития ХЭ (например, хламидиоза) [31, 35–39, 42–47, 49–58].
В настоящее время, по данным зарубежных и российских ученых, известно, что невынашивания, причиной которых являются неразвивающаяся беременность и самопроизвольный аборт, развиваются при наличии инфекционного процесса, включающего два и более патогенных или условно-патогенных фактора, и диагностируются у 66% пациенток из количества всех инфицированных [37]; при этом микст-инфекция (бактериально-вирусная) встречается в 81,4% наблюдений, а моноинфекция – 18,6% [37, 43, 50, 54, 57].
В научной литературе существуют сведения, что в когорте пациенток с верифицированным ХЭ бесплодие диагностируется от 60,4% до 80% и относится к общепринятому термину – маточное бесплодие.
Усилия, направленные на распознавание процессов формирования патологических изменений в эндометрии и их связи с невынашиванием, популяризирует исследовательскую деятельность российских и зарубежных ученых.
На фоне длительного персистирующего воспаления, которое оказывает травмирующее воздействие на эндометрий, регенерация ткани не происходит, тем самым дезорганизуется тканевой гомеостаз и развивается комплексный механизм последующих микроповреждений и извращение физиологических процессов [44]. Поскольку клинические проявления ХЭ отличаются вариабельностью, а также зачастую имеют скрытую симтоматику, характерные клинические признаки не присутствуют [58]. Как известно, ХЭ выражается расстройством менструального цикла в виде обильных и длительных менструальных (более 7 дней) выделений, межменструальных кровотечений, сопровождающихся также синдромом хронических тазовых болей, бесплодием маточного генеза и невынашиванием беременности, диспареунией, длительными белями умеренного или обильного характера, альгодисменореей, преждевременными родами. Учитывая описанные проявления и последствия персистирующего воспалительного процесса слизистой оболочки полости матки, ХЭ значительно ухудшает качество жизни женщин репродуктивного периода. Однако существует немалый процент невыявленных случаев заболевания ввиду его второго «лика» проявления на первых этапах развития в стромально-эндометриальном компартменте, т.е. его бессимтомного течения на протяжении длительного времени. Данное стечение обстоятельств осложняет задачу клиницисту в своевременной диагностике заболевания и существенно может снизить качество жизни пациентке в последующем. К сожалению, несмотря на многочисленные исследования российских и зарубежных ученых на протяжении долгих лет, ХЭ продолжает занимать доминирующее место среди заболеваний пациенток репродуктивного возраста, и пока, к сожалению, с невысоким уровнем диагностики.
Нередко ХЭ сочетается с иными хроническими заболеваниями половых органов. Расстройства менструального цикла, ассоциированные с ХЭ, определяются до 84% случаев, сочетание ХЭ с сопутствующей патологией слизистой оболочки полости матки – от 34%, патологии шейки матки – от 24%. Известно, что риск невынашивания беременности, интегрируемое ХЭ, свидетельствует о повышенной угрозе в дальнейшем репродуктивных потерь, в процентном содержании доходящее до 15–24% [2, 37, 47].
Как известно, патогены микробиоценоза урогенитального тракта, вызывающие ХЭ, способны нарушать нормальные физиологические процессы, такие как программируемая гибель клеток – апоптоз, одновременно создавая персистирующее воспаление эндометрия [34, 41, 44].
При хроническом воспалении эндометриального компартмента развивается ряд сосудистых нарушений, приводящих к обеднению оксигенации стромы эндометрия. В результате ишемии формируютя склеротические изменения спиральных артерий. В связи с персистенцией инфектов дестабилизируются эндотелиоциты, трансформируются коагуляционные свойства крови, включается механизм тромбообразования. На фоне ишемии эндометриального компартмента при ХЭ снижается количество сетей капилляров, плотность сосудов уменьшается с геометрической прогрессией в зависимости от степени выраженности ХЭ. Вследствие этого трансформируется архитектоника сосудов, которые становятся более извилистыми и с утолщенной стенкой. Данные патологические модификации сосудов препятствуют нормальному физиологическому кровотоку.
При хроническом персистирующем воспалении слизистой оболочки полости матки отмечается новообразование сосудов на системном уровне в связи с повышением концентрации в сыворотке крови сосудистого эндотелиального фактора роста – VEGF и снижением уровня растворимого типа рецепторов к VEGF [59, 60–62].
Кроме того, изменяется количественное и качественное соотношение клеток местной иммунной системы эндометрия, играющее ведущую роль в успешной имплантации бластоцисты и развитии оксигенации плаценты во время беременности.
Как известно, при ХЭ снижается количество прогестероновых рецепторов, в результате чего сокращается количество цитотоксических лимфоцитов, далее снижается прогестерон-индуцированный блокирующий фактор и растет количество NK. Таким образом, провоцируется иммунный ответ местного иммунитета, реализуемый лимфокин-активированными киллерами. Повышается количество цитокинов, прогрессирующих воспалительный процесс, активируется протромбиназа, дезорганизуя локальное кровообращение, где формируется персистирующий воспалительный процесс в эндометрии. Помимо этого существует вероятность образования тромбов. Комплекс вышеописанных процессов приводит к нарушениям менструального цикла, АМК, неразвивающейся беременности или к формированию плацентарной недостаточности [25, 29–31, 35, 50].
При имеющихся уже склеротических изменениях в базально-эндометриальном компартменте экспрессия рецепторов к прогестерону резко обеднена. Как известно, в течение менструального цикла здоровой женщины в овуляторную фазу выявляется выраженная экспрессия рецепторов к эстрогену и прогестерону, в то время как при хроническом персистирующем воспалении эндометрия наибольшая выраженность рецепторов наблюдается в пролиферативную фазу [47, 51, 54, 57].
В настоящее время нередко дискутируется значение несоответствия антиоксидантной и противоположной ей систем в формировании ХЭ за счет воздействия повреждающих факторов свободных радикалов. В ходе обменных процессов кислорода в клетках формируются его активные формы. Дефинитивные субстраты метаболизма кислорода подвергают окислению липиды, находящихся в микроструктуре мембран клеток, деструктируя целостность ДНК и белков, тем самым вызывая повреждающее воздействие на клеточные составляющие [62–66].
Протективную функцию на клеточном уровне человека представляет собой антиоксидантная система. Антиоксидантная система предотвращает окисление липидов, тем самым создает барьер клеточной мембраны от агрессивных воздействий, нарушающих структуру мембраны. Физиологический процесс трансформации кислорода, используемый митохондриями, продуцирует свободные радикалы. Следовательно, излишняя выработка активных форм кислорода создает агрессивное влияние в структурах базально-эндометриального компартмента. Протекцию от данных агрессивных механизмов на клеточную мембрану создает антиоксидантная система, путем комплексной работы следующих ферментов: глутатион пероксидаза и редуктаза, каталаза и супероксиддисмутаза. Супероксиддисмутаза модифицирует финитные метаболиты кислорода в пероксид водорода, и последовательно произведенные метаболиты трансформируются в воду [66–72].
По данным современной литературы, важная роль отводится пероксидазной системе в запрограммированной гибели клеток, а также в опухолевом перерождении и клеточной пролиферации. Как известно, активные метаболиты кислорода активируют пролиферацию, в то время как антиоксидантная система инициирует противоположные процессы [34, 41, 46, 49, 73].
A.M. Sharkey и соавт. был сделан вывод о том, что посредством активизации антиоксидантной системы во время лечения ХЭ создается комплексный подход к реабилитации клеточных структур эндометрия, что первостепенно профилактирует малигнизацию, препятствует гипоплазии эндометрия, а также предотвращает формирование гиперплазии эндометрия [74].
Кроме того, ХЭ приводит к местному нарушению метаболизма тканей и клеточного иммунитета. Локально персистирущее воспаление создает венозную гиперемию, и, как следствие, происходит обеднение оксигенации тканей, провоцируя в дальнейшем гипоактивность метаболизма. Данный каскад нарушенного механизма физиологического метаболизма формируется как из-за недостатка кислорода, так и вследствие трансформации структуры митохондрий. Нарушение морфологии митохондрий происходит путем дифференциации этапов аэробного окисления глюкозы и накопления доставленной энергии в виде аденозинтрифосфорной кислоты. Инициация окисления глюкозы сопровождается аккумуляцией кислотных соединений, понижению pH локального воспаления. Преобладание катаболических процессов приводит к увеличению более мелких молекул, в результате чего развивается увеличение онкотического и осмотического давления. Метаболический каскад извращенных физиологических процессов влияет и на соединительную ткань, находящуюся периваскулярно, деградируя трофику ткани локального воспаления [40, 43, 46].
Хроническое воспаление эндометриального компартмента приводит к нарушению обмена кислорода в строме эндометрия и его рецептивности. Это может приводить к нарушениям менструального цикла, а также к имплантационным нарушениям и ранней потере беременности [34, 37, 50, 51, 57].
Существует недостаточное количество исследований по проблеме ХЭ, ассоциированного АМК, а также отсутствует систематизация исследований АМК и его взаимосвязи с ХЭ.
В настоящее время патогенез ХЭ до конца не изучен, несмотря на его высокую распространенность в когорте гинекологических больных. По актуальным данным мировой и российской литературы имеются дифферентные заключения о патогенезе ХЭ, о специфичности его развития и воздействия на эндометрий, влекущие за собой порой необратимые осложнения в женской репродуктивной системе.
В современной литературе известно два вида рецепторов эстрогена (ER) – это ER-α, связанный с пролиферативными изменениями клеток, и ER-β, ассоциированный с фазой секреции менструального цикла и подготовкой сосудистого русла к сбалансированному кровоснабжению и механизмам децидуализации стромы слизистой оболочки полости матки. Рецептор прогестерона (PR) представлен двумя базисными изоформами – PR-A и PR-B. Рецепторы прогестерона А и В сходны по строению, но имеют различие в наличии 164 аминокислотных остатков на N-концевой последовательности PR-B, которая отсутствует в рецепторе прогестерона A. Необходимо обратить внимание на то, что снижение экспрессии рецепторов половых стероидных гормонов ER и RP в слизистой оболочке полости матки вне зависимости от фазы менструального цикла, свидетельствует о наличии хронического воспалительного процесса, приводящего в дальнейшем к эндометриальной дисфункции у пациенток с нарушением менструального цикла, бесплодию, невынашиванию беременности и неэффективным ВРТ-программам [46, 54, 57, 58].
Ведущую роль репродуктивного механизма женщины составляет стабильность физиологической микрофлоры и предотвращение воспалительных процессов. Местный иммунитет слизистой оболочки женских половых путей в разных ее отделах представлен определенным пулом Т-клеток, макрофагами/дендритными клетками, натуральными киллерами (NK), нейтрофилами и тучными клетками. Макрофаги, плазмоциты (синдиканы) и В-клетки присутствуют в слизистой оболочке полости матки на протяжении всего менструального цикла в незначительных количествах, а во время пролиферативной фазы синдиканы инициируют ангиогенез.
В базально-эндометриальном компартменте имеются истинные лимфоидные фолликулы, формирующиеся из зародышевых центров, светлые центры которых включают В-клетки, окруженные Т-клетками и внешним ореолом макрофагов.
Как известно, количество цитотоксических Т-лимфоцитов (CD8+) и Т-хелперов (CD4+) в слизистой оболочке полости матки составляет до 10 клеток в поле зрения, В-лимфоцитов (CD20+) – до 3 клеток в поле зрения [25, 30, 44, 45, 52]. Повышение количества клеток цитотоксических Т-лимфоцитов, В-лимфоцитов и наличие плазмоцитов (CD138+) достоверно свидетельствует о ХЭ.
Процесс децидуализации стромы слизистой оболочки полости матки обладает приостанавливающим воздействием на воспалительные процессы в функциональном слое, при этом базальный слой сохраняется интактным, что имеет основополагающее значение для эффективных регенеративных процессов эндометрия.
У лейкоцитов отсутствуют рецепторы к эстрогену и прогестерону, их инфильтрация в слизистую оболочку полости матки осуществляется путем хемотаксиса реакцией на физиологические и патологические воспалительные процессы в ткани. Специфичностью нейтрофилов на данном этапе является устойчивость к апоптозу и гипоксии за счет персистенции воспалительных медиаторов, что усугубляет повреждение ткани [64, 66, 72, 75].
Прогестерон, помимо секреторных трансформаций слизистой оболочки полости матки, влияет и на сократительное свойство миометрия. Снижение экспрессии PR в позднюю стадию фазы секреции менструального цикла создает инициацию миометрия и увеличение сократительной активности в фазе менструального распада, а также уровень прогестерона в сыворотке крови не взаимосвязано с концентрацией прогестерона в миометрии. В фазу десквамации чрезмерной интенсивности или же длительный во времени воспалительный ответ зачастую провоцирует к агрессивному повреждению ткани и полименорее, при этом увеличивается уровень фактора некроза опухоли и провоспалительных цитокинов, а также увеличивается экспрессия мРНК циклооксигеназы-2, что впоследствии может приводить к ацикличным кровяным выделениям и нарушениям менструального цикла [25, 30, 76].
Местные иммунные процессы при ХЭ крайне редко переходят в системное воспаление, это подтверждает факт показателей периферических уровней, циркулирующих в сыворотке крови лейкоцитов и сывороточного С-реактивного белка, которые остаются в референсных значениях [29]. По данным современной литературы, известно, что коммуникация патогенов с микроокружением эндометрия влечет за собой увеличение уровня лейкоцитов, выработке цитокинов и факторов роста, тем самым нарушая рецептивность слизистой полости матки [25, 46]. В итоге у пациенток с ХЭ выявляется модифицированная волнообразная перистальтика матки как во время периовуляторной, так и в середине лютеиновой фазы. Нарушение перистальтики матки может нарушать рецептивность и объяснять симптомы, связанные с ХЭ, такие как тазовая боль, АМК, нарушения менструального цикла и бесплодие [30, 35, 45].
Следовательно, комплекс молекулярных, эндокринных, биохимических, иммунологических процессов осуществляет полноценную трансформацию слизистой оболочки полости матки в течение всего менструального цикла. Секреторная модификация эндометрия с пропорциональной корреляцией и распределением экспрессии рецепторов эстрогена и прогестерона инициируют полнофункциональный ангиогенез и создают иммунологический комплекс, детерминирующий регуляции менструального цикла, имплантацию, плацентацию и развитие беременности.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Митрелис Рина Юрьевна – аспирант каф. НИИМЧ
им. акад. А.П. Авцына, ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», ООО «Лечебный Центр».
E-mail: abelyarrin@yandexl.ru
Rina Yu. Mitrelis – Graduate Student, Russian Scientific Centre of Surgery named after Academician B.V. Petrovsky, "Treatment Centre". E-mail: abelyarrin@yandexl.ru
Михалева Людмила Михайловна – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., директор ФГБНУ «НИИМЧ им. акад. А.П. Авцына», зав. патологоанатомическим отделением ГБУЗ «ГКБ № 31 им. акад. Г.М. Савельевой ДЗМ».
E-mail: mikhalevam@yandex.ru; ORCID: 0000-0003-2052-914X;
SPIN-код: 2086-7513
Liudmila M. Mikhaleva – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., director Research Institute of Human Morphology named after Academician A.P. Avtsyna, Head of the Pathology department Municipal Clinical Hospital No. 31 named after Academician G.M. Savelyeva. E-mail: mikhalevam@yandex.ru;
ORCID: 0000-0003-2052-914X; SPIN-код: 2086-7513
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Михалев Сергей Александрович – канд. мед. наук, cт. науч. сотр., ФГБУ «Национальный медико-хирургический центр
им. Н.И. Пирогова» Минздрава России, зав. отд-нием патологии беременности и гинекологии, Родильный дом №4 при ГБУЗ
«ГКБ №31 им. академика Г.М. Савельевой ДЗМ».
E-mail: Mikhalev@me.com; ORCID: 0000-0002-4822-0956
Sergey A. Mikhalev – Cand. Sci. (Med.), Pirogov National Medical and Surgical Centre, Head of the Department
of Pathology of Pregnancy and Gynecology, Municipal Clinical Hospital No. 31 named after Academician G.M. Savelyeva.
E-mail: Mikhalev@me.com; ORCID: 0000-0002-4822-0956
Кобызева Татьяна Юрьевна – заслуженный врач РФ, врач высшей категории, главный гинеколог, ООО «Лечебный Центр»,
E-mail: Kobyzeva_tu@lcenter.ru
Tatyana Yu. Kobyzeva – Honored Physician of the Russian Federation, Chief Gynaecologist, "Treatment Centre".
E-mail: Kobyzeva_tu@lcenter.ru
Поступила в редакцию: 27.03.2024
Поступила после рецензирования: 03.04.2024
Принята к публикации: 04.04.2024
Received: 27.03.2024
Revised: 03.04.2024
Accepted: 04.04.2024
Клинический разбор в общей медицине №3 2024
Хронический эндометрит в развитии аномальных маточных кровотечений, эндометриальной дисфункции и других нарушений репродукции (обзор литературы)
Номера страниц в выпуске:27-38
Аннотация
Аномальные маточные кровотечения, широко распространенные в когорте женщин фертильного возраста, несомненно, являются чрезвычайно важным фактором, снижающим качество жизни. Персистирующее воспаление эндометрия является патогенетическим звеном, ассоциированным с дисфункцией эндометрия. В статье отражена современная парадигма этиологии, патогенеза и менеджмента пациенток с аномальными маточными кровотечениями на фоне хронического эндометрита по данным отечественной и зарубежной литературы.
Ключевые слова: аномальные маточные кровотечения, хронический эндометрит, эндометриальная дисфункция.
Для цитирования: Митрелис Р.Ю., Михалева Л.М., Оразов М.Р., Михалев С.А., Кобызева Т.Ю. Хронический эндометрит в развитии аномальных маточных кровотечений, эндометриальной дисфункции и других нарушений репродукции (обзор литературы). Клинический разбор в общей медицине. 2024; 5 (3): 27–38. DOI: 10.47407/kr2023.5.3.00371
Аномальные маточные кровотечения, широко распространенные в когорте женщин фертильного возраста, несомненно, являются чрезвычайно важным фактором, снижающим качество жизни. Персистирующее воспаление эндометрия является патогенетическим звеном, ассоциированным с дисфункцией эндометрия. В статье отражена современная парадигма этиологии, патогенеза и менеджмента пациенток с аномальными маточными кровотечениями на фоне хронического эндометрита по данным отечественной и зарубежной литературы.
Ключевые слова: аномальные маточные кровотечения, хронический эндометрит, эндометриальная дисфункция.
Для цитирования: Митрелис Р.Ю., Михалева Л.М., Оразов М.Р., Михалев С.А., Кобызева Т.Ю. Хронический эндометрит в развитии аномальных маточных кровотечений, эндометриальной дисфункции и других нарушений репродукции (обзор литературы). Клинический разбор в общей медицине. 2024; 5 (3): 27–38. DOI: 10.47407/kr2023.5.3.00371
Chronic endometritis in the development of abnormal uterine bleeding, endometrial dysfunction and other reproductive disorders (literature review)
Rina Yu. Mitrelis1,2, Liudmila M. Mikhaleva1,3, Mekan R. Orazov4, Sergey A. Mikhalev3,5,Tatyana Yu. Kobyzeva1
1 Research Institute of Human Morphology named after Academician A.P. Avtsyna – Russian Scientific Centre of Surgery named after Academician B.V. Petrovsky, Moscow, Russia;
2 OJSC "Treatment Centre", Moscow, Russia;
3 Municipal Clinical Hospital No. 31 named after Academician G.M. Savelyeva of the Moscow City Health Department, Moscow, Russia;
4 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
5 Pirogov National Medical and Surgical Centre, Moscow, Russia
abelyarrin@yandexl.ru
Abstract
Abnormal uterine bleeding (AUB), common in a cohort of women in the reproductive period, is undoubtedly an extremely important factor reducing quality of life. Persistent endometrial inflammation is a pathogenetic link associated with endometrial dysfunction. The article reflects the modern paradigm of etiology, pathogenesis and management of patients with AUB on the background of chronic endometritis according to the data of domestic and foreign literature.
Keywords: abnormal uterine bleeding, chronic endometritis, endometrial dysfunction.
For citation: Mitrelis R.Yu., Mikhaleva L.M., Orazov M.R., Mikhalev S.A., Kobyzeva T.Yu. Chronic endometritis in the development of abnormal uterine bleeding, endometrial dysfunction and other reproductive disorders (literature review). Clinical review for general practice. 2024; 5 (3): 27–38. (In Russ.). DOI: 10.47407/kr2023.5.3.00371

Аномальные маточные кровотечения (АМК) среди женщин репродуктивного возраста распространены довольно в широких пределах от 3% до 50% как в России, так и во всем мире. В настоящее время по клиническим рекомендациям Российского общества акушеров-гинекологов диагноз «аномальные маточные кровотечения» определяется кровотечениями по продолжительности (больше 8 сут), объему кровопотери (более 80 мл) и/или частоте (меньше 24 дней).
Нормальный менструальный цикл женщины репродуктивного возраста имеет длительность от 24 до 38 дней, длительность менструации варьирует от 7 до 9 дней, с кровопотерей от 5 до 80 мл [1]. Более 50% женщин с АМК не обращаются к гинекологу за медицинской помощью, несмотря на ее доступность в настоящее время. Данный фактор способствует случайной частоте ошибок в заниженных показателях распространенности АМК. Это связано с тем, что нередко пациентки обращаются за клинической помощью к гинекологу уже в условиях только манифестации маточного кровотечения, несмотря на высокую доступность медицинских услуг в современном мире. Поэтому определение точной распространенности АМК в данное время остается достаточно вариативной [2, 3].
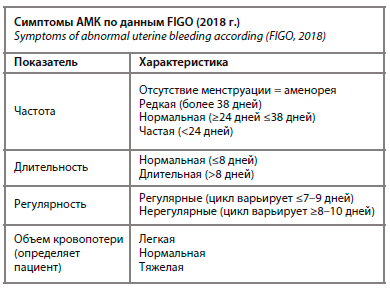
АМК влияют на различные уровни благополучного жизненного статуса женщины [4]. Кроме того, АМК провоцируют железодефицитные анемии и их последствия влияют на самочувствие женщины, что является фактором, увеличивающим материнскую заболеваемость и смертность у беременных женщин, страдающих анемией [5]. Женщины с нарушениями менструального цикла часто предъявляют жалобы на тревожность, депрессивное состояние, бессонницу или сонливость, снижение либидо по сравнению с женщинами, не имеющими нарушений менструального цикла [6]. В таблице приведены показатели и соответствующие им характеристики АМК по данным FIGO (2018 г.).
Классификация и терминология
Длительный период не существовало единой концепции и универсализации классификационной системы АМК, что вызывало большие затруднения при проведении научных исследований и стандартизации лечения пациенток. В 2011 г. Международная федерация гинекологии и акушерства (International Federation of Gynecology and Obstetrics – FIGO) сформировала единую систему, классифицирующую АМК, – PALM–COEIN [7].PALM–COEIN – это сокращенное обозначение единой системы, классифицирующей основные факторы АМК. «PALM» представляет структурные причины кровотечений. «COEI» – неструктурные причины. «N» характеризует, как «не классифицировано иначе».
• Р: полип;
• А: аденомиоз;
• L: лейомиома;
• M: гиперплазия/рак эндометрия;
• С: коагулопатия/нарушение свертываемости крови;
• О: овуляторная дисфункция;
• E: эндометриальные причины;
• I: ятрогенные причины;
• N: не классифицировано иначе;
В соответствии с данной системой у одной пациентки может быть одновременно не одна причина, приводящая к АМК. Однако важно отметить, что часть патологий, например полипы эндоцервикса или эндометрия, лейомиомы, могут не сопровождаться кровотечениями и, следовательно, не являться причиной АМК [1].
Проявления АМК в клинической практике разделяются на тяжелые менструальными кровопотери и межменструальные кровотечения. Ранее терминология была такова: «меноррагия», «менометроррагия» и «метроррагия». Межменструальные кровотечения, занимающие довольно весомое количество в популяции женщин репродуктивного возраста, увеличивают распространенность АМК до 75% и более.
Учитывая вариации продолжительности кровотечения, АМК следует дифференцировать на острые и хронические. Острое АМК характеризуется кровотечением, требующим экстренное медицинское вмешательство с целью предупреждения впоследствии кровопотери, несущей угрозу жизни. АМК острого течения наступает как само по себе, так и вследствие прогрессирующего хронического AМК. При хроническом АМК выявляются нарушения менструального цикла, представляющие собой межменструальные кровяные выделения, протекающие в течение нескольких месяцев [8–10]. Кроме того, существуют индивидуальные факторы нарушения менструального цикла, которые встречаются в подростковом или перименопаузальном возрасте [8–10].
Этиология и патогенез АМК
Многообразные аномальные физиологические процессы, являющиеся причиной нарушения работы физиологических, гемостатических, эндокринных и паракринных функций эндометрия, а также аномальной перистальтики матки, вызывают АМК [11].Полип: АМК-P. Причина АМК при полипах эндометрия распространена в пределах от 4% до 60%. Полипы эндометрия часто являются причиной всех типов АМК, но при этом в ряде случаев полипы, развиваясь в эндометрии, не приводят к развитию маточных кровотечений у женщин. Учитывая изложенное, можно выделить следующие причины развития полипов матки, к которым относятся: нарушение экспрессии эстрогеновых и прогестероновых рецепторов в эндометрии, увеличение активности сигнальных путей, вызывающих гиперактивную пролиферацию и ангиогенез эндометрия, ослабление процессов апоптоза [12]. Помимо этого, по данным G.F. Peres и соавт. и M.J. Harmsen и соавт., генетические мутации и гиперэкспрессия ароматазы слизистой оболочки матки, которая повышает местный эстрогенный сигнал, может предшествовать возникновению полипов эндометрия [13, 14].
Аденомиоз: AМК-A. Аденомиоз представляет особое заболевание, характеризующееся присутствием желез эндометрия в миометрии с гипертрофией гладкой мышечной ткани [15, 16]. Аденомиоз чаще выявляется у женщин позднего репродуктивного возраста [17]. Патогенез АМК при аденомиозе до настоящего времени до конца не изучен. Как известно, у 1/3 пациенток аденомиоз протекает без клинических проявлений и в основном связан с иной патологией матки, например с гиперплазией, полипами эндометрия или лейомиомой [17].
Лейомиома: АМК-L. Лейомиомы/миомы матки являются доброкачественными новообразования миометрия и распространены в широких пределах среди женской популяции репродуктивного возраста. Лейомиомы могут протекать без клинических симптомов, но у 20–50% женщин появляются симптомы, которые можно напрямую отнести к миоме [18]. Миомы снижают сократительную функцию миометрия, могут повреждать эндометрий субмукозными лейомиоматозными узлами, создавать застой крови в миометрии и эндометрии посредством механического сдавления венозного сплетения. В 2018 г. FIGO представлена классификация миомы матки в зависимости от локализации. Считается, что именно локализация миоматозного узла и определяет клиническую симптоматику или ее отсутствие, в частности, именно подслизистые лейомиомы являются предикторами тяжелого маточного кровотечения.
Злокачественная опухоль: АМК-М. Факторы, провоцирующие гиперактивную пролиферацию эндометрия, потенциально служат причиной развития гиперплазии эндометрия (ГЭ) и канцерогенеза. Предикторами эстрогеново-прогестеронного дисбаланса является длительная эстрогенная стимуляция, а также факторы, предотвращающие эффекты прогестерона, создавая дисгормональное состояние. Общеизвестно, что факторами риска гиперплазии эндометрия и рака эндометрия являются ожирение, бесплодие, отсутствие родов, селективные модуляторы рецепторов эстрогена, диабет и синдром Линча [19]. Причинами провокации АМК служит дефицит физиологического падения уровня прогестерона для дальнейшей инициации отторжения гипертрофированной слизистой полости матки, а также ее пролиферативная гиперактивность, гиперактивный ангиогенез, необходимый для форсированного роста эндометриальной ткани. Перечисленные выше причины нередко приводят к длительному, обильному кровотечению. Таким образом, факторы, не контролирующие последовательный каскад процессов влияния прогестерона на эндометрий, такие как нарушение жирового обмена, синдром поликистозных яичников, сахарный диабет, эстроген-секретирующие опухоли яичников и прием тамоксифена, напрямую повышают риск возникновения рака эндометрия [20]. Типичная клиническая картина АМК, индуцированных раком эндометрия, является нерегулярной и непрерывной. Важно отметить, что кровотечение формируется вторично по отношению к дезинтеграции сосудов эндометрия вследствие инвазии злокачественной опухолью и патологического неоваскулогенеза [21].
Коагулопатия: AМК-С. Как известно, коагулопатиями страдают 13% женщин с АМК. Значительная часть из этого количества пациенток имеют болезнь Виллебранда [22]. Патологии гемостаза выявляются у 90% женщин при тщательном сборе структурированного анамнеза [1]. Выделяют 4 клинических варианта AМК-C: 1 – АМК во время антикоагулянтной терапии
(в настоящее время это группа АМК-I); 2 – АМК с наследственными нарушениями свертываемости; 3 – АМК, ассоциированное с цитопениями (в частности, тромбоцитопенией); 4 – АМК при серповидноклеточной анемии.
Овуляторная дисфункция: AМК-O. Причиной АМК также может быть овуляторная дисфункция, которую провоцируют нерегулируемое влияние эстрогенов на слизистую оболочку полости матки, катализируя гиперактивную пролиферацию и утолщение функционального слоя, что приводит к дальнейшим нарушениям менструального цикла в виде обильных менструаций, межменструальных кровяных выделений, задержки менструации. В данную категорию включают следующие патологические состояния при эндокринопатиях: гипотиреоз, гиперпролактинемия, синдром поликистозных яичников; потеря массы тела или ожирение, анорексия, психическое перенапряжение и экстремальные физические нагрузки также могут являться причиной ановуляторных циклов. Длительный прием наркотических веществ, как известно, усиливает уровень дофамина, поэтому включен в данную категорию. AМК-O – является диагнозом исключения.
Эндометриальная дисфункция: AМК-E. По данным современной литературы, до сих пор не изучены регуляторные процессы инициации и остановки менструального кровотечения. Реэпителизацию поверхностного эпителия эндометрия в настоящее время не принято оценивать ведущим фактором прекращения кровотечения, поскольку имеются данные гистологических подтверждений, что полная реэпителизация наблюдается уже в первые два дня менструации. В эндометриально-стромальном компартменте человека осуществляется систематический физиологический ангиогенез. В настоящее время подразумевается, что фактор роста эндотелия сосудов (Vascular endothelial growth factor, VEGF) продуцируется внутрисосудистыми нейтрофилами. Аномальный физиологический ангиогенез инициирует аномальные кровеносные сосуды с неполноценными стенками и вызывает развитие АМК. Также известно, что модифицирована экспрессия маркеров дифференцировки эндотелия сосудов при АМК [23]. АМК данной категории формируются в результате процессов активации ангиогенеза, усиленной продукции провоспалительных цитокинов, увеличения локального фибринолиза и дисбаланса простагландинов. Описанные процессы соответствуют персистирующему воспалению слизистой оболочки полости матки, а именно хроническому эндометриту (ХЭ).
Ятрогенные причины: AМК-I. Ятрогенными индукторами АМК является назначение экзогенной терапии, которая может привести к маточному кровотечению.
К этой категории относятся АМК, сопряженные с использованием системной фармакотерапии или внутриматочных систем или устройств. Помимо половых стероидов, эта группа включает нестероидные лекарственные препараты, приводящие к ановуляции, препараты, оказывающие действие на метаболизм дофамина, в частности фенотиазины и трициклические антидепрессанты. Пациентки с АМК, связанные с приемом антикоагулянтов, в новом пересмотре считаются ятрогенными и классифицируются – AМК-I [1]. Данная группа препаратов представляет собой: антагонисты витамина К и современные пероральные прямые антикоагулянты. Как известно, современные исследования продемонстрировали увеличенный риск АМК при приеме ривароксабана по сравнению с другими пероральными прямыми антикоагулянтами или варфарином.
Неклассифицированные как-либо иначе: АМК-N. Категория «АМК-N», «неклассифицированная как-либо иначе», была создана в исходной системе с целью установления причин АМК, которые встречаются крайне редко или трудно определены. Причины заключают в себе и выходят за рамки таких состояний, как артериовенозные мальформации, ниша после кесарева сечения, гипертрофия миометрия и другие нарушения функциональной состоятельности слизистой оболочки полости матки.
Особое место в настоящее время занимает категория эндометриальной дисфункции – AМК-E, поскольку существует глобальная проблема в клинической практике по недостатку общепринятых мер диагностики, лечения и раннего выявления ХЭ у женщин репродуктивного возраста. Генерирующее значение в развитии АМК, ассоциированного с ХЭ, имеют место заболевания женских половых органов воспалительного характера, в частности, которые развиваются после инфекций, передающихся половым путем, или после перенесенных внутриматочных вмешательств. Так, по данным Г.Т. Сухих (2013 г.), у 60% пациенток с ХЭ интенсивность кровянистых выделений отличалась от нормальных значений [24].
На протяжении последних лет, по данным научных исследований, идет активное изучение значимости ХЭ в развитии АМК [25–31]. По итогам исследований [25] ХЭ достоверно чаще диагностировался у пациенток с АМК, чем у здоровых женщин, увеличивая риск развития кровотечений.
Персистирующее воспаление эндометрия является патогенетическим звеном, ассоциированным с дисфункцией слизистой оболочки полости матки [28, 32, 30]. По заключениям В.Е. Радзинского (2019–2023 гг.), Л.М. Михалевой (2019–2023 гг.), М.Р. Оразова (2019–2023 гг.) ХЭ зачастую не имеет клинических проявлений на ранних этапах, следовательно, требуется разработка и выполнение общепринятых стандартов комплексного дообследования данной когорты пациенток.
ХЭ доминирует среди заболеваний эндометриальной дисфункции, частота обнаружения которого у женщин с бесплодием, по данным российских и зарубежных ученых, варьирует от 12% до 80% [31, 33–39]. Высокая распространенность ХЭ среди женщин репродуктивного возраста с бесплодием и ЭКО-неудачами определена специфичностью данного заболевания. Известно, что среди инициирующих предикторов развития ХЭ крайне увеличилась роль внутриматочной контрацепции и внутриматочных вмешательств, искусственного прерывания беременности и инфекций, передаваемых половым путем, характеризующихся длительным бессимптомным течением [29, 40–44].
В настоящее время установлена ключевая роль ХЭ в патогенезе эндометриальной дисфункции, приводящей к последующей дезорганизации рецептивности эндометрия и нарушению репродуктивной функции [45, 46]. Также необходимо отметить, что при ХЭ происходит расстройство рецепторного механизма эндометриального компартмента, ввиду персистирующего воспаления, приводящего к снижению экспрессии рецепторов путем дезорганизации кровообращения ткани и фиброзирования стромы эндометрия [31, 37, 47].
Провоцирующим фактором возникновения ХЭ является нахождение микробного фактора длительное время в микробиоценозе влагалища [40, 42, 43]. По данным современной литературы, известно, что в микробиотопах слизистой оболочки полости матки превалируют комплексы облигатно-анаэробных микробов, микроаэрофилов и вирусов, тропных к эндометрию.
E. Cicinelli, D. De Ziegler и соавт. [48] выявили более 70% случаев ХЭ – это результат негонококковой, нехламидийной этиологии даже у пациентов из группы риска.
В итоге активной жизнедеятельности в микробиоценозе влагалища патогенной или условно-патогенной микрофлоры, например Gardnerella vaginalis, Ureaplasma urealiticum, Mycoplasma genitalium и Mycoplasma hominis, – развитие ХЭ. При иммуногистохимическом анализе биоптатов эндометрия у пациенток, страдающих бесплодием, связанным с эндометриальной дисфункцией, до 89,4% выявлена неспецифическая причина развития ХЭ и лишь у 1,4% женщин диагностировано гранулематозное воспаление с эозинофильной инфильтрацией, типичной для специфических механизмов развития ХЭ (например, хламидиоза) [31, 35–39, 42–47, 49–58].
В настоящее время, по данным зарубежных и российских ученых, известно, что невынашивания, причиной которых являются неразвивающаяся беременность и самопроизвольный аборт, развиваются при наличии инфекционного процесса, включающего два и более патогенных или условно-патогенных фактора, и диагностируются у 66% пациенток из количества всех инфицированных [37]; при этом микст-инфекция (бактериально-вирусная) встречается в 81,4% наблюдений, а моноинфекция – 18,6% [37, 43, 50, 54, 57].
В научной литературе существуют сведения, что в когорте пациенток с верифицированным ХЭ бесплодие диагностируется от 60,4% до 80% и относится к общепринятому термину – маточное бесплодие.
Усилия, направленные на распознавание процессов формирования патологических изменений в эндометрии и их связи с невынашиванием, популяризирует исследовательскую деятельность российских и зарубежных ученых.
На фоне длительного персистирующего воспаления, которое оказывает травмирующее воздействие на эндометрий, регенерация ткани не происходит, тем самым дезорганизуется тканевой гомеостаз и развивается комплексный механизм последующих микроповреждений и извращение физиологических процессов [44]. Поскольку клинические проявления ХЭ отличаются вариабельностью, а также зачастую имеют скрытую симтоматику, характерные клинические признаки не присутствуют [58]. Как известно, ХЭ выражается расстройством менструального цикла в виде обильных и длительных менструальных (более 7 дней) выделений, межменструальных кровотечений, сопровождающихся также синдромом хронических тазовых болей, бесплодием маточного генеза и невынашиванием беременности, диспареунией, длительными белями умеренного или обильного характера, альгодисменореей, преждевременными родами. Учитывая описанные проявления и последствия персистирующего воспалительного процесса слизистой оболочки полости матки, ХЭ значительно ухудшает качество жизни женщин репродуктивного периода. Однако существует немалый процент невыявленных случаев заболевания ввиду его второго «лика» проявления на первых этапах развития в стромально-эндометриальном компартменте, т.е. его бессимтомного течения на протяжении длительного времени. Данное стечение обстоятельств осложняет задачу клиницисту в своевременной диагностике заболевания и существенно может снизить качество жизни пациентке в последующем. К сожалению, несмотря на многочисленные исследования российских и зарубежных ученых на протяжении долгих лет, ХЭ продолжает занимать доминирующее место среди заболеваний пациенток репродуктивного возраста, и пока, к сожалению, с невысоким уровнем диагностики.
Нередко ХЭ сочетается с иными хроническими заболеваниями половых органов. Расстройства менструального цикла, ассоциированные с ХЭ, определяются до 84% случаев, сочетание ХЭ с сопутствующей патологией слизистой оболочки полости матки – от 34%, патологии шейки матки – от 24%. Известно, что риск невынашивания беременности, интегрируемое ХЭ, свидетельствует о повышенной угрозе в дальнейшем репродуктивных потерь, в процентном содержании доходящее до 15–24% [2, 37, 47].
Как известно, патогены микробиоценоза урогенитального тракта, вызывающие ХЭ, способны нарушать нормальные физиологические процессы, такие как программируемая гибель клеток – апоптоз, одновременно создавая персистирующее воспаление эндометрия [34, 41, 44].
При хроническом воспалении эндометриального компартмента развивается ряд сосудистых нарушений, приводящих к обеднению оксигенации стромы эндометрия. В результате ишемии формируютя склеротические изменения спиральных артерий. В связи с персистенцией инфектов дестабилизируются эндотелиоциты, трансформируются коагуляционные свойства крови, включается механизм тромбообразования. На фоне ишемии эндометриального компартмента при ХЭ снижается количество сетей капилляров, плотность сосудов уменьшается с геометрической прогрессией в зависимости от степени выраженности ХЭ. Вследствие этого трансформируется архитектоника сосудов, которые становятся более извилистыми и с утолщенной стенкой. Данные патологические модификации сосудов препятствуют нормальному физиологическому кровотоку.
При хроническом персистирующем воспалении слизистой оболочки полости матки отмечается новообразование сосудов на системном уровне в связи с повышением концентрации в сыворотке крови сосудистого эндотелиального фактора роста – VEGF и снижением уровня растворимого типа рецепторов к VEGF [59, 60–62].
Кроме того, изменяется количественное и качественное соотношение клеток местной иммунной системы эндометрия, играющее ведущую роль в успешной имплантации бластоцисты и развитии оксигенации плаценты во время беременности.
Как известно, при ХЭ снижается количество прогестероновых рецепторов, в результате чего сокращается количество цитотоксических лимфоцитов, далее снижается прогестерон-индуцированный блокирующий фактор и растет количество NK. Таким образом, провоцируется иммунный ответ местного иммунитета, реализуемый лимфокин-активированными киллерами. Повышается количество цитокинов, прогрессирующих воспалительный процесс, активируется протромбиназа, дезорганизуя локальное кровообращение, где формируется персистирующий воспалительный процесс в эндометрии. Помимо этого существует вероятность образования тромбов. Комплекс вышеописанных процессов приводит к нарушениям менструального цикла, АМК, неразвивающейся беременности или к формированию плацентарной недостаточности [25, 29–31, 35, 50].
При имеющихся уже склеротических изменениях в базально-эндометриальном компартменте экспрессия рецепторов к прогестерону резко обеднена. Как известно, в течение менструального цикла здоровой женщины в овуляторную фазу выявляется выраженная экспрессия рецепторов к эстрогену и прогестерону, в то время как при хроническом персистирующем воспалении эндометрия наибольшая выраженность рецепторов наблюдается в пролиферативную фазу [47, 51, 54, 57].
В настоящее время нередко дискутируется значение несоответствия антиоксидантной и противоположной ей систем в формировании ХЭ за счет воздействия повреждающих факторов свободных радикалов. В ходе обменных процессов кислорода в клетках формируются его активные формы. Дефинитивные субстраты метаболизма кислорода подвергают окислению липиды, находящихся в микроструктуре мембран клеток, деструктируя целостность ДНК и белков, тем самым вызывая повреждающее воздействие на клеточные составляющие [62–66].
Протективную функцию на клеточном уровне человека представляет собой антиоксидантная система. Антиоксидантная система предотвращает окисление липидов, тем самым создает барьер клеточной мембраны от агрессивных воздействий, нарушающих структуру мембраны. Физиологический процесс трансформации кислорода, используемый митохондриями, продуцирует свободные радикалы. Следовательно, излишняя выработка активных форм кислорода создает агрессивное влияние в структурах базально-эндометриального компартмента. Протекцию от данных агрессивных механизмов на клеточную мембрану создает антиоксидантная система, путем комплексной работы следующих ферментов: глутатион пероксидаза и редуктаза, каталаза и супероксиддисмутаза. Супероксиддисмутаза модифицирует финитные метаболиты кислорода в пероксид водорода, и последовательно произведенные метаболиты трансформируются в воду [66–72].
По данным современной литературы, важная роль отводится пероксидазной системе в запрограммированной гибели клеток, а также в опухолевом перерождении и клеточной пролиферации. Как известно, активные метаболиты кислорода активируют пролиферацию, в то время как антиоксидантная система инициирует противоположные процессы [34, 41, 46, 49, 73].
A.M. Sharkey и соавт. был сделан вывод о том, что посредством активизации антиоксидантной системы во время лечения ХЭ создается комплексный подход к реабилитации клеточных структур эндометрия, что первостепенно профилактирует малигнизацию, препятствует гипоплазии эндометрия, а также предотвращает формирование гиперплазии эндометрия [74].
Кроме того, ХЭ приводит к местному нарушению метаболизма тканей и клеточного иммунитета. Локально персистирущее воспаление создает венозную гиперемию, и, как следствие, происходит обеднение оксигенации тканей, провоцируя в дальнейшем гипоактивность метаболизма. Данный каскад нарушенного механизма физиологического метаболизма формируется как из-за недостатка кислорода, так и вследствие трансформации структуры митохондрий. Нарушение морфологии митохондрий происходит путем дифференциации этапов аэробного окисления глюкозы и накопления доставленной энергии в виде аденозинтрифосфорной кислоты. Инициация окисления глюкозы сопровождается аккумуляцией кислотных соединений, понижению pH локального воспаления. Преобладание катаболических процессов приводит к увеличению более мелких молекул, в результате чего развивается увеличение онкотического и осмотического давления. Метаболический каскад извращенных физиологических процессов влияет и на соединительную ткань, находящуюся периваскулярно, деградируя трофику ткани локального воспаления [40, 43, 46].
Хроническое воспаление эндометриального компартмента приводит к нарушению обмена кислорода в строме эндометрия и его рецептивности. Это может приводить к нарушениям менструального цикла, а также к имплантационным нарушениям и ранней потере беременности [34, 37, 50, 51, 57].
Существует недостаточное количество исследований по проблеме ХЭ, ассоциированного АМК, а также отсутствует систематизация исследований АМК и его взаимосвязи с ХЭ.
В настоящее время патогенез ХЭ до конца не изучен, несмотря на его высокую распространенность в когорте гинекологических больных. По актуальным данным мировой и российской литературы имеются дифферентные заключения о патогенезе ХЭ, о специфичности его развития и воздействия на эндометрий, влекущие за собой порой необратимые осложнения в женской репродуктивной системе.
В современной литературе известно два вида рецепторов эстрогена (ER) – это ER-α, связанный с пролиферативными изменениями клеток, и ER-β, ассоциированный с фазой секреции менструального цикла и подготовкой сосудистого русла к сбалансированному кровоснабжению и механизмам децидуализации стромы слизистой оболочки полости матки. Рецептор прогестерона (PR) представлен двумя базисными изоформами – PR-A и PR-B. Рецепторы прогестерона А и В сходны по строению, но имеют различие в наличии 164 аминокислотных остатков на N-концевой последовательности PR-B, которая отсутствует в рецепторе прогестерона A. Необходимо обратить внимание на то, что снижение экспрессии рецепторов половых стероидных гормонов ER и RP в слизистой оболочке полости матки вне зависимости от фазы менструального цикла, свидетельствует о наличии хронического воспалительного процесса, приводящего в дальнейшем к эндометриальной дисфункции у пациенток с нарушением менструального цикла, бесплодию, невынашиванию беременности и неэффективным ВРТ-программам [46, 54, 57, 58].
Ведущую роль репродуктивного механизма женщины составляет стабильность физиологической микрофлоры и предотвращение воспалительных процессов. Местный иммунитет слизистой оболочки женских половых путей в разных ее отделах представлен определенным пулом Т-клеток, макрофагами/дендритными клетками, натуральными киллерами (NK), нейтрофилами и тучными клетками. Макрофаги, плазмоциты (синдиканы) и В-клетки присутствуют в слизистой оболочке полости матки на протяжении всего менструального цикла в незначительных количествах, а во время пролиферативной фазы синдиканы инициируют ангиогенез.
В базально-эндометриальном компартменте имеются истинные лимфоидные фолликулы, формирующиеся из зародышевых центров, светлые центры которых включают В-клетки, окруженные Т-клетками и внешним ореолом макрофагов.
Как известно, количество цитотоксических Т-лимфоцитов (CD8+) и Т-хелперов (CD4+) в слизистой оболочке полости матки составляет до 10 клеток в поле зрения, В-лимфоцитов (CD20+) – до 3 клеток в поле зрения [25, 30, 44, 45, 52]. Повышение количества клеток цитотоксических Т-лимфоцитов, В-лимфоцитов и наличие плазмоцитов (CD138+) достоверно свидетельствует о ХЭ.
Процесс децидуализации стромы слизистой оболочки полости матки обладает приостанавливающим воздействием на воспалительные процессы в функциональном слое, при этом базальный слой сохраняется интактным, что имеет основополагающее значение для эффективных регенеративных процессов эндометрия.
У лейкоцитов отсутствуют рецепторы к эстрогену и прогестерону, их инфильтрация в слизистую оболочку полости матки осуществляется путем хемотаксиса реакцией на физиологические и патологические воспалительные процессы в ткани. Специфичностью нейтрофилов на данном этапе является устойчивость к апоптозу и гипоксии за счет персистенции воспалительных медиаторов, что усугубляет повреждение ткани [64, 66, 72, 75].
Прогестерон, помимо секреторных трансформаций слизистой оболочки полости матки, влияет и на сократительное свойство миометрия. Снижение экспрессии PR в позднюю стадию фазы секреции менструального цикла создает инициацию миометрия и увеличение сократительной активности в фазе менструального распада, а также уровень прогестерона в сыворотке крови не взаимосвязано с концентрацией прогестерона в миометрии. В фазу десквамации чрезмерной интенсивности или же длительный во времени воспалительный ответ зачастую провоцирует к агрессивному повреждению ткани и полименорее, при этом увеличивается уровень фактора некроза опухоли и провоспалительных цитокинов, а также увеличивается экспрессия мРНК циклооксигеназы-2, что впоследствии может приводить к ацикличным кровяным выделениям и нарушениям менструального цикла [25, 30, 76].
Местные иммунные процессы при ХЭ крайне редко переходят в системное воспаление, это подтверждает факт показателей периферических уровней, циркулирующих в сыворотке крови лейкоцитов и сывороточного С-реактивного белка, которые остаются в референсных значениях [29]. По данным современной литературы, известно, что коммуникация патогенов с микроокружением эндометрия влечет за собой увеличение уровня лейкоцитов, выработке цитокинов и факторов роста, тем самым нарушая рецептивность слизистой полости матки [25, 46]. В итоге у пациенток с ХЭ выявляется модифицированная волнообразная перистальтика матки как во время периовуляторной, так и в середине лютеиновой фазы. Нарушение перистальтики матки может нарушать рецептивность и объяснять симптомы, связанные с ХЭ, такие как тазовая боль, АМК, нарушения менструального цикла и бесплодие [30, 35, 45].
Следовательно, комплекс молекулярных, эндокринных, биохимических, иммунологических процессов осуществляет полноценную трансформацию слизистой оболочки полости матки в течение всего менструального цикла. Секреторная модификация эндометрия с пропорциональной корреляцией и распределением экспрессии рецепторов эстрогена и прогестерона инициируют полнофункциональный ангиогенез и создают иммунологический комплекс, детерминирующий регуляции менструального цикла, имплантацию, плацентацию и развитие беременности.
Заключение
АМК, широко распространенные в когорте женщин репродуктивного периода, несомненно, являются чрезвычайно важной медицинской и социальной проблемой. Учитывая причины развития АМК и их исход, данное заболевание становится междисциплинарным. Без совместных усилий акушеров-гинекологов, репродуктологов, онкологов и патологоанатомов невозможно ожидать успеха как в преодолении заболеваний, приводящих к АМК, так и в решении серьезных проблем, связанных с репродуктивными потерями и восстановлением демографии нашей страны. Особое место занимает ХЭ, требующий от врачей своевременной и точной диагностики и эффективной терапии, способной предотвратить развитие АМК, улучшить качество жизни молодых женщин и снизить риски репродуктивных потерь в будущем.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Митрелис Рина Юрьевна – аспирант каф. НИИМЧ
им. акад. А.П. Авцына, ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», ООО «Лечебный Центр».
E-mail: abelyarrin@yandexl.ru
Rina Yu. Mitrelis – Graduate Student, Russian Scientific Centre of Surgery named after Academician B.V. Petrovsky, "Treatment Centre". E-mail: abelyarrin@yandexl.ru
Михалева Людмила Михайловна – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., директор ФГБНУ «НИИМЧ им. акад. А.П. Авцына», зав. патологоанатомическим отделением ГБУЗ «ГКБ № 31 им. акад. Г.М. Савельевой ДЗМ».
E-mail: mikhalevam@yandex.ru; ORCID: 0000-0003-2052-914X;
SPIN-код: 2086-7513
Liudmila M. Mikhaleva – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., director Research Institute of Human Morphology named after Academician A.P. Avtsyna, Head of the Pathology department Municipal Clinical Hospital No. 31 named after Academician G.M. Savelyeva. E-mail: mikhalevam@yandex.ru;
ORCID: 0000-0003-2052-914X; SPIN-код: 2086-7513
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Михалев Сергей Александрович – канд. мед. наук, cт. науч. сотр., ФГБУ «Национальный медико-хирургический центр
им. Н.И. Пирогова» Минздрава России, зав. отд-нием патологии беременности и гинекологии, Родильный дом №4 при ГБУЗ
«ГКБ №31 им. академика Г.М. Савельевой ДЗМ».
E-mail: Mikhalev@me.com; ORCID: 0000-0002-4822-0956
Sergey A. Mikhalev – Cand. Sci. (Med.), Pirogov National Medical and Surgical Centre, Head of the Department
of Pathology of Pregnancy and Gynecology, Municipal Clinical Hospital No. 31 named after Academician G.M. Savelyeva.
E-mail: Mikhalev@me.com; ORCID: 0000-0002-4822-0956
Кобызева Татьяна Юрьевна – заслуженный врач РФ, врач высшей категории, главный гинеколог, ООО «Лечебный Центр»,
E-mail: Kobyzeva_tu@lcenter.ru
Tatyana Yu. Kobyzeva – Honored Physician of the Russian Federation, Chief Gynaecologist, "Treatment Centre".
E-mail: Kobyzeva_tu@lcenter.ru
Поступила в редакцию: 27.03.2024
Поступила после рецензирования: 03.04.2024
Принята к публикации: 04.04.2024
Received: 27.03.2024
Revised: 03.04.2024
Accepted: 04.04.2024
Список исп. литературыСкрыть список1. Munro MG, Critchley HOD, Fraser IS. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions. International Journal of Gynecology and Obstetrics. 2018;143(3):393-408. DOI: 10.1002/ijgo.12666
2. Sun Y, Wang Y, Mao L et al. Prevalence of abnormal uterine bleeding according to new International Federation of Gynecology and Obstetrics classification in Chinese women of reproductive age: A cross-sectional study. Medicine (Baltimore). 2018;97(31):e11457. DOI: 10.1097/MD.0000000000011457
3. Kazemijaliseh H, Tehrani FR, Beh- boudi-Gandevani S et al. A Population-Based Study of the Prevalence of Abnormal Uterine Bleeding and its Related Factors among Iranian Reproductive-Age Women: An Updated Data. Archives of Iranian Medicine. 2017;20(9):558-63.
4. Lee JHS, Cheng EOL, Choi KM et al. Hong Kong College of Obstetricians and Gynaecologists guideline on investigations of premenopausal women with abnormal uterine bleeding. Hong Kong Medical Journal. 2020;26(6):520-5. DOI: 10.12809/hkmj208897
5. Lam C, Anderson B, Lopes V et al. Assessing Abnormal Uterine Bleeding: Are Physicians Taking a Meaningful Clinical History? Journal of Women’s Health. 2017;26(7):762-7. DOI: 10.1089/jwh.2016.6155
6. Maqbool R, Maqbool M, Zehravi M et al. Menstrual distress in females of reproductive age: a literature review. International Journal of Adolescent Medicine and Health. 2021;34(2):11-7. DOI: 10.1515/ijamh-2021-0081
7. A Clinicopathological Correlation of International Federation of Gynecology and Obstetrics’s PALM–COEIN Classification of Abnormal Uterine Bleeding. Journal of Mid-Life Health. 2019;10(3):147-52. DOI: 10.4103/jmh.JMH_128_18
8. Darville TJ. Pelvic Inflammatory Disease Due to Neisseria gonorrhoeae and Chlamydia trachomatis: Immune Evasion Mechanisms and Pathogenic Disease Pathways. Infect Dis. 2021;224(12 Suppl. 2):S39-S46. DOI: 10.1093/infdis/jiab031. PMID: 34396413
9. Chen Y, Zheng S, Zhao X et al. Unveiling the protective effects of BMSCs/anti-miR-124-3p exosomes on LPS-induced endometrial injury. Funct Integr Genomics. 2024;24(2):32. DOI: 10.1007/s10142-024-01303-4. PMID: 38363406
10. 2021 exceptional surveillance of heavy menstrual bleeding: assessment and management (NICE guideline NG88). London: National Institute for Health and Care Excellence (NICE); 2021.
11. Hapangama DK, Bulmer JN. Pathophysiology of heavy menstrual bleeding. Women’s Health. 2015;12(1):3-13 DOI: 10.2217/whe.15.81
12. Uglietti A, Buggio L, Farella M et al. The risk of malignancy in uterine polyps: A systematic review and meta-analysis. European Journal of Obstetrics, Gynecology and Reproductive Biology. 2019;237:48-56. DOI: 10.1016/j.ejogrb.2019.04.009
13. Peres GF, Spadoto-Dias D, Bueloni-Dias FN et al. Immunohistochemical expression of hormone receptors, Ki-67, endoglin (CD105), claudins 3 and 4, MMP-2 and -9 in endometrial polyps and endometrial cancer type I. OncoTargets and Therapy. 2018;11:3949-58. DOI: 10.2147/ OTT.S160014
14. Harmsen MJ, Wong CFC, Mijatovic V. Role of angiogenesis in adenomyosis associated abnormal uterine bleeding and subfertility: a systematic review. Human Reproduction Update. 2019;25(5):647-71. DOI: 10.1093/humupd/dmz024
15. Stratopoulou CA, Donnez J, Dolmans MM. Origin and Pathogenic Mechanisms of Uter- ine Adenomyosis: What Is Known So Far. Reproductive Sciences. 2021; 28:2087-97. DOI: 10.1007/s43032-020-
00361-w
16. Bazot M, Darai E. Role of transvaginal sonography and magnetic resonance imaging in the diagnosis of uterine adenomyosis. Fertility and Sterility. 2018;109(3):389-97. DOI: 10.1016/j.fertnstert.2018.01.024
17. Taylor HS, Kotlyar AM, Flores VA. Endometriosis is a chronic systemic disease: Clinical challenges and novel innovations. The Lancet. 2021;397(10276):839-52. DOI: 10.1016/S0140-6736(21)00389-5
18. Wray S, Prendergast C. The Myometrium: From Excitation to Contractions and Labour. Advances in Experimental Medicine and Biology. 2019;1124:233-63. DOI: 10.1007/978-981-13-5895-1_10
19. Lax SF. New features in the 2014 WHO classification of uterine neoplasms. Der Pathologe. 2016;37(6):500-11. DOI: 10.1007/s00292-016-0230-4
20. Ragni MV, Machin N, Malec LM et al. Von Willebrand factor for menorrhagia: a survey and literature review. Haemophilia. 2016;22(3): 397-402. DOI: 10.1111/hae.12898
21. Crosbie EJ, Kitson SJ, McAlpine JN et al. Endometrial cancer. Lancet. 2022;399(10333):1412-28. DOI: 10.1016/S0140-6736(22)00323-3
22. Archer DF. Vascular dysfunction as a cause of endometrial bleeding. Gynecological Endocrinology. 2012;28(9):688-93. DOI: 10.3109/09513590.2011.588848
23. Eworuke E, Hou L, Zhang R et al. Risk of Severe Abnormal Uterine Bleeding Associated with Rivaroxaban Compared with Apixaban, Dabigatran and Warfarin. Drug Safety. 2021;44(7):753-73. DOI: 10.1007/s40264-021-01072-0
24. Сухих Г.Т., Шуршалина А.В. Хронический эндометрит. М.: ГЭОТАР-Медиа, 2013.
Sukhoi G.T., Shurshalina A.V. Chronic endometritis. Moscow: GEOTAR-Media, 2013 (in Russian).
25. Михалева Л.М., Болтовская М.Н., Михалев С.А. и др. Клинико-морфологические аспекты эндометриальной дисфункции, обусловленной хроническим эндометритом. Архив патологии. 2017;79(6):22-29.
Mikhaleva L.M., Boltovskaya M.N., Mikhalev S.A. et al. Endometrial dysfunction caused by chronic endometritis: сlinical and morphological aspects. Arkhiv Patologii. 2017;79(6):22-9. DOI: 10.17116/ patol201779622-29 (in Russian).
26. Михалева Л.М., Михалев С.А., Савельева Г.М. и др. Хронический эндометрит – показание для прегравидарной подготовки. Клиническая практика. 2018;9(2):36-41.
Mikhaleva L.M., Mikhalev S.A., Savelyeva G.M. et al. Chronic endometritis is an indication for pregravidar preparation. Clinical practice. 2018;9(2):36-41. (in Russian).
27. Kushnir VA, Solouki S, Sarig-Meth T et al. Systemic inflammation and autoimmunity in women with chronic endometritis. Am J Reprod Immunol. 2016;75(6):672-7. DOI: 10.1111/aji.12508
28. Радзинский В.Е., Петров Ю.А., Калинина Е.А. и др. Патогенетические особенности макротипов хронического эндометрита. Казанский медицинский журнал. 2017;98(1):27-34.
Radzinskii VE, Petrov YuA, Kalinina EA et al. Pathogenetic features of the macrotypes of chronic endometritis. Kazanskii meditsinskii zhurnal. 2017; 98(1):27-34. DOI: 10.17750/kmj2017-27 (in Russian).
29. Радзинский В.Е., Ордиянц И.М., Добрецова Т.А. Эндометрий в огне. Острое и хроническое воспаление эндометрия: от новых взглядов к новым стратегиям StatusPraesens. Гинекология, акушерство, бесплодный брак. 2016;2(31):126-32.
Radzinsky V.E., Ordiyants I.M., Dobretsova T.A. The endometrium is on fire. Acute and chronic endometrial inflammation: from new perspectives to new strategies of Status Praesens. Gynecology, obstetrics, infertile marriage. 2016;2(31):126-32 (in Russian).
30. Радзинский В.Е., Петров Ю.А., Калинина Е.А. и др. Патогенетические особенности макротипов хронического эндометрита. Казанский медицинский журнал. 2017;98(1):27-34.
Radzinsky V.E., Petrov Yu.A., Kalinina E.A. et al. Pathogenetic features of macrotypes of chronic endometritis. Kazan Medical Journal. 2017;98(1):27-34 (in Russian).
31. Оразов М.Р., Михалева Л.М., Семенов П.А. и др. Эффективность лечения хронического эндометрита у женщин с неудачами имплантации в анамнезе. Трудный пациент. 2020;18(8-9):7-12. . DOI: 10.24411/2074-1995-2020-10053
Orazov M.R., Mikhaleva L.M., Semenov P.A. et al. The effectiveness of treatment of chronic endometritis in women with a history of implantation failures. A difficult patient. 2020;18(8-9):7-12. . DOI: 10.24411/2074-1995-2020-10053 (in Russian).
32. Полина М.Л., Радзинский В.Е., Михалева Л.М. и др. Иммунологические аспекты нарушений имплантации при маточной форме бесплодия. Акушерство и гинекология: новости, мнения, обучение. 2023;11(Спецвыпуск):6-17. DOI: 10.33029/2303-9698-2023-11-suppl-6-17
Polina M.L., Radzinsky V.E., Mikhaleva L.M. et al. Immunological aspects of implantation disorders in uterine infertility. Obstetrics and gynecology: news, opinions, training. 2023;11(Special Edition):6-17. DOI: 10.33029/2303-9698-2023-11-suppl-6-17 (in Russian).
33. Стюшин А.М., Семенченко И.Б. Особенности патогенеза при хроническом эндометрите. В сборнике: Актуальные вопросы акушерства и гинекологии. Сборник материалов внутривузовской научно-практической конференции. Ростов-на-Дону, 2023.
Styushin A.M., Semenchenko I.B. Features of pathogenesis in chronic endometritis. In: Topical issues of obstetrics and gynecology. Anthology of materials of the intra-university scientific and practical conference. Rostov-on-Don, 2023. (in Russian).
34. Данилюк С.В., Кирия Д.Г., Долгая О.В., Олейник А.Е. Патогистологические и иммуногистохимические особенности эндометрия при хроническом эндометрите у женщин с бесплодием. Вестник проблем биологии и медицины. 2020;4(158):13-7.
Danilyuk S.V., Kiria D.G., Dolgaya O.V., Oleinik A.E. Pathohistological and immunohistochemical features of the endometrium in chronic endometritis in women with infertility. Bulletin of problems of Biology and Medicine. 2020;4(158):13-7 (in Russian).
35. Оразов М.Р., Токтар Л.Р., Михалева Л.М. и др. Хронический эндометрит и дисфункция эндометрия – есть ли причинно-следственная связь? Акушерство и гинекология. Новости. Мнения. Обучение. 2020;8(S3):61-9.
Orazov M.R., Toktar L.R., Mikhaleva L.M. et al. Chronic endometritis and endometrial dysfunction – is there a causal relationship? Obstetrics and gynecology. News. Opinions. Training. 2020;8(S3):61-9 (in Russian).
36. Оразов М.Р., Михалева Л.М., Исмаилзаде С.Я. и др. Внутриматочные синехии и хронический эндометрит – есть ли причинно-следственная связь? Гинекология. 2022;24(2):144-9. DOI: 10.26442/20795696.2022.2.201417
Orazov M.R., Mikhaleva L.M., Ismailzade S.Ya. et al. Intrauterine synechiae and chronic endometritis – is there a causal relationship? Gynecology. 2022;24(2):144-9. DOI: 10.26442/20795696.2022.2. 201417 (in Russian).
37. Радзинский В.Е., Оразов М.Р., Токтар Л.Р. и др. Вклад хронического эндометрита в нарушения репродуктивной системы у пациенток с повторными неудачами имплантации. Гинекология. 2021;23(1):102-6. DOI: 10.26442/20795696.2021.1.200671
Radzinsky V.E., Orazov M.R., Toktar L.R. et al. The contribution of chronic endometritis to reproductive system disorders in patients with repeated implantation failures. Gynecology. 2021;23(1):102-6. DOI: 10.26442/20795696.2021.1.200671 (in Russian).
38. Сорокин Ю.А., Гизингер О.А., Радзинский В.Е. Клинико-иммунологическое обоснование ультразвуковой кавитации в комплексном лечении бесплодия при хроническом эндометрите. Гинекология. 2022;24(5):355-61.
Sorokin Yu.A., Giesinger O.A., Radzinsky V.E. Clinical and immunological substantiation of ultrasonic cavitation in the complex treatment of infertility in chronic endometritis. Gynecology. 2022;24(5):355-61 (in Russian).
39. Оразов М.Р., Волкова С.В., Безуглова Т.В. Хронический эндометрит и неудачи имплантации: как не упустить последний шанс? Трудный пациент. 2022;20(1):17-21.
Orazov M.R., Volkova S.V., Bezuglova T.V. Chronic endometritis and implantation failures: how not to miss the last chance? A difficult patient. 2022;20(1):17-21 (in Russian).
40. Сндоян А.В., Ермаков А.Н. Иммунологическая перестройка при хроническом воспалении слизистой оболочки матки. Молодой ученый. 2016;22.1(126.1):39-43. URL: https://moluch.ru/archive/ 126/35012/
Sndoyan A.V., Ermakov A.N. Immunological restructuring in chronic inflammation of the uterine mucosa. A young scientist. 2016;22.1(126.1):39-43. URL: https://moluch.ru/archive/126/35012/ (in Russian).
41. Полина М.Л., Михалева Л.М., Витязева И.И. и др. Взаимосвязь типа микробиоты и ммунных ресурсов эндометрия бесплодных женщин в фазу имплантационного окна. Якутский медицинский журнал. 2023;82(2):8-13.
Polina M.L., Mikhaleva L.M., Vityazeva I.I. et al. The relationship between the type of microbiota and the immune resources of the endometrium of infertile women during the implantation window phase. Yakut Medical Journal. 2023;82(2):8-13 (in Russian).
42. Оразов М.Р., Михалева Л.М., Семенов П.А. и др. Хронический эндометрит и контраверсии антибактериальной терапии. Трудный пациент. 2020;18(10):41-6.
Orazov M.R., Mikhaleva L.M., Semenov P.A. et al. Chronic endometritis and contraversions of antibacterial therapy. A difficult patient. 2020;18(10):41-6 (in Russian).
43. Михалев С.А., Бабиченко И.И., Шахпазян Н.К. и др. Роль урогенитальной инфекции в развитии спонтанных преждевременных родов. Проблемы репродукции. 2019;25(2):88-94. DOI: 10.17116/repro 20192502188
Mikhalev S.A., Babichenko I.I., Shakhpazyan N.K. et al. The role of urogenital infection in the development of spontaneous premature birth. Reproduction problems. 2019;25(2):88-94. DOI:10.17116/repro 20192502188 (in Russian).
44. Оразов М.Р., Локшин В.Н., Силантьева Е.С. и др. Морфологические и молекулярно-биологические детерминанты повторных неудач имплантации. Вестник национальной академии наук республики Казахстан. 2020;3(385):15. DOI: 10.32014/2020.2518-1467.63
Orazov M.R., Lokshin V.N., Silantieva E.S. et al. Morphological and molecular biological determinants of repeated implantation failures. Bulletin of the National Academy of Sciences of the Republic of Kazakhstan. 2020;3(385):15. DOI: 10.32014/2020.2518-1467.63 (in Russian).
45. Михалева Л.М., Оразов М.Р., Силантьева Е.С. и др. Повторные неудачи имплантации. Патогенез иммунологических нарушений в эндометрии. Доктор.Ру. 2022;21(1):21-6. DOI: 10.31550/1727-2378-2022-21-1-21-26(RCI WoS)
Mikhaleva L.M., Orazov M.R., Silantieva E.S. et al. Repeated implantation failures. The pathogenesis of immunological disorders in the endometrium. Doctor.Ru. 2022;21(1):21-6. DOI: 10.31550/1727-2378-2022-21-1-21-26(RCI WoS) (in Russian).
46. Радзинский В.Е., Михалева Л.М., Оразов М.Р. и др. Рецептивность эндометрия пациенток с повторными неудачами имплантации. Доктор.Ру. 2022;21(1):27-33. DOI: 10.31550/1727-2378-2022-21-1-27-33(RCI WoS)
Radzinsky V.E., Mikhaleva L.M., Orazov M.R. et al. Endometrial receptivity in patients with repeated implantation failures. Doctor.Ru. 2022;21(1):27-33. DOI: 10.31550/1727-2378-2022-21-1-27-33(RCI WoS) (in Russian).
47. Радзинский В.Е., Оразов М.Р., Токтар Л.Р. и др. Эффект «разбросанных пазлов»: имплантационные нарушения при хроническом эндометрите. Гинекология. 2020;22(6):93-100. DOI: 10.26442/ 20795696.2020.6.200493
Radzinsky V.E., Orazov M.R., Toktar L.R. et al. The effect of «scattered puzzles»: implantation disorders in chronic endometritis. Gynecology. 2020;22(6):93-100. DOI: 10.26442/20795696.2020.6.200493 (in Russian).
48. Cicinelli E, Haimovich S, De Ziegler D et al.; International Working Group for Standardization of Chronic Endometritis Diagnosis. MUM-1 immunohistochemistry has high accuracy and reliability in the diagnosis of chronic endometritis: a multi-centre comparative study with CD-138 immunostaining. J Assist Reprod Genet. 2022;39(1):219-26. DOI: 10.1007/s10815-021-02356-1. PMID: 34791588
49. Кузнецова И.В., Землина Н.С., Мусина Р.А. et al. Применение аутологичных мезенхимальных стволовых клеток с целью восстановления эндометрия у пациенток со сниженной фертильностью. Вопросы гинекологии, акушерства и перинатологии. 2019;18 (60):34-40.
Kuznetsova I.V., Zemlina N.S., Musina R.A. и др. The use of autologous mesenchymal stem cells to restore the endometrium in patients with reduced fertility. Issues of gynecology, obstetrics and perinatology. 2019;18(60):34-40 (in Russian).
50. Краснопольская К.В., Михалева Л.М., Оразов М.Р., Долгов Е.Д. Возможности преодоления неудач имплантации при бесплодии маточного генеза, обусловленных хроническим эндометритом. Гинекология. 2022;24(5):400-7.
Krasnopolskaya K.V., Mikhaleva L.M., Orazov M.R., Dolgov E.D. The possibilities of overcoming implantation failures in infertility of uterine genesis caused by chronic endometritis. Gynecology. 2022;24(5):400-7 (in Russian).
51. Оразов М.Р., Орехов Р.Е., Камиллова Д.П. и др. Тайны патогенеза повторных неудач имплантации. Трудный пациент. 2020;18(4). DOI: 10.24411/2074-1995-2020-10030
Orazov M.R., Orekhov R.E., Kamilova D.P. et al. Secrets of the pathogenesis of repeated implantation failures. A difficult patient. 2020;18(4). DOI: 10.24411/2074-1995-2020-10030 (in Russian).
52. Оразов М.Р., Михалева Л.М., Семенов П.А. Хронический эндометрит: патогенез, диагностика, лечение и его связь с бесплодием. Клиническая и экспериментальная морфология. 2020;9(2):16-25. DOI:10.31088/CEM2020.9.2
Orazov M.R., Mikhaleva L.M., Semenov P.A. Chronic endometritis: pathogenesis, diagnosis, treatment and its connection with infertility. Clinical and experimental morphology. 2020;9(2):16-25. DOI:10.31088/ CEM2020.9.2 (in Russian).
53. Оразов М.Р., Радзинский В.Е., Волкова С.В. и др. Хронический эндометрит у женщин с эндометриоз-ассоциированным бесплодием. Гинекология. 2020;22(3):15-20. DOI: 10.26442/20795696.2020.3.200174
Orazov M.R., Radzinsky V.E., Volkova S.V. et al. Chronic endometritis in women with endometriosis-associated infertility. Gynecology. 2020;22(3):15-20. DOI: 10.26442/20795696.2020.3.200174 (in Russian).
54. Оразов М.Р., Краснопольская К.В., Силантьева Е.С. и др. «Проблемный» эндометрий как фактор бесплодия: поиск путей преодоления продолжается. Трудный пациент. 2020;18(8-9):13-9. DOI: 10.24411/2074-1995-2020-10054
Orazov M.R., Krasnopolskaya K.V., Silantieva E.S. et al. «Problematic» endometrium as a factor of infertility: the search for ways to overcome it continues. A difficult patient. 2020;18(8-9):13-9. DOI: 10.24411/2074-1995-2020-10054 (in Russian).
55. Оразов М.Р., Силантьева Е.С., Орехов Р.Е. и др. Повторные неудачи имплантации: этиология и возможности физиотерапии. Трудный пациент. 2020;18(8-9):20-4. DOI: 10.24411/2074-1995-2020-10055
Orazov M.R., Silantieva E.S., Orekhov R.E. et al. Repeated implantation failures: etiology and possibilities of physiotherapy. A difficult patient. 2020;18(8-9):20-4. DOI: 10.24411/2074-1995-2020-10055 (in Russian).
56. Оразов М.Р., Краснопольская К.В., Силантьева Е.С. и др. Эффективность альтернативных методов лечения бесплодия маточного генеза. Гинекология. 2021;23(1):92-6. DOI: 10.26442/20795696. 2021.1.200672
Orazov M.R., Krasnopolskaya K.V., Silantieva E.S. et al. The effectiveness of alternative methods of treatment of infertility of uterine origin. Gynecology. 2021;23(1):92-6. DOI: 10.26442/20795696.2021.1. 200672 (in Russian).
57. Радзинский В.Е., Оразов М.Р., Михалева Л.М. и др. Предикторы неудач ЭКО при имплантационной несостоятельности эндометрия. Трудный пациент. 2021;19(1):23-6. DOI: 10.24412/2074-1995-2021-1-18-22
Radzinsky V.E., Orazov M.R., Mikhaleva L.M. et al. Predictors of IVF failures in endometrial implantation failure. A difficult patient. 2021;19(1):23-6. DOI: 10.24412/2074-1995-2021-1-18-22 (in Russian).
58. Оразов М.Р., Михалёва Л.М., Силантьева Е.С., Орехов Р.Е. Хронический эндометрит у пациенток с повторными неудачами имплантации: эпидемиология, этиология, патогенез и преодоление бесплодия. Репродуктивная медицина. 2021;47(2):31-40. DOI: 10.37800/RM2021-2-3
Orazov M.R., Mikhaleva L.M., Silantieva E.S., Orekhov R.E. Chronic endometritis in patients with repeated implantation failures: epidemiology, etiology, pathogenesis and overcoming infertility. Reproductive medicine. 2021;47(2):31-40. DOI: 10.37800/RM2021-2-3 (in Russian).
59. Liu Z, Liu X, Li F et al. Overexpression of hypoxia-inducible factor 1alpha and excessive vascularization in the peri-implantation endometrium of infertile women with chronicendometritis. Front Endocrinol (Lausanne). 2022;13:1001437. DOI: 10.3389/fendo.2022.1001437. eCollection 2022. PMID: 36531509
60. Yasuo T, Kitaya K. Challenges in Clinical Diagnosis and Management of Chronic Endometritis. Diagnostics (Basel). 2022;12(11):2711. DOI: 10.3390/diagnostics12112711. PMID: 36359553
61. McQueen DB, Maniar KP, Hutchinson A et al. Redefining chronic endometritis: the importance of endometrial stromal changes. Fertil Steril. 2021;116(3):855-61. DOI: 10.1016/j.fertnstert.2021.04.036. PMID: 34120737
62. Cicinelli E, Vitagliano A, Loizzi V et al. Altered Gene Expression Encoding Cytochines, Grow Factors and Cell Cycle Regulators in the Endometrium of Women with Chronic Endometritis. Diagnostics (Basel). 2021;11(3):471. DOI: 10.3390/diagnostics11030471. PMID: 33800186
63. Germic N, Frangez Z, Yousefi S, Simon H.U. Regulation of the innate immune system by autophagy: neutrophils, eosinophils, mast cells, NK cells. Cell Death Differ. 2019;26(4):703-14.
64. Lawrence SM, Corriden R, Nizet V. How Neutrophils Meet Their End. Trends Immunol. 2020;41(6):531-44.
65. Brostjan C, Oehler R. The role of neutrophil death in chronic inflammation and cancer. Cell Death Discov. 2020;6: 26. DOI: 10.1038/s41420-020-0255-6
66. Щепеткин И.А., Буданова О.П., Малышев И.Ю., Аточин Д.Н. Молекулярные механизмы апоптоза нейтрофилов (обзор литературы). Патогенез. 2018;16(4):5-18.
Schepetkin I.A., Budanova O.P., Malyshev I.Yu., Atochin D.N. Molecular mechanisms of neutrophil apoptosis (review). Patogenez/Pathogenesis. 2018;16(4):5-18 (in Russian).
67. Kourtzelis I, Hajishengallis G, Chavakis T. Phagocytosis of Apoptotic Cells in Resolution of Inflammation. Front Immunol. 2020;11:553. DOI: 10.3389/fimmu.2020.00553
68. Liew PX, Kubes P. The Neutrophil’s Role During Health and Disease. Physiol Rev. 2019;99(2):1223–48.
69. Schett G, Neurath MF. Resolution of chronic inflammatory disease: universal and tissue-specific concepts. Nat Commun. 2018;9(1):3261. DOI: 10.1038/s41467-018-05800-6
70. Kumar S, Dikshit M. Metabolic Insight of Neutrophils in Health and Disease. Front Immunol. 2019;10:2099. DOI: 10.3389/fimmu.2019.02099
71. Оздоева И.М-Б., Петров Ю.А. хронический эндометрит: изменения основных звеньев иммунитета. Международный журнал прикладных и фундаментальных исследований. 2020;(4):26-30; URL: https://applied-research.ru/ru/article/view?id=13050
Ozdoeva I.M.-B., Petrov Yu.A. chronic endometritis: changes in the main links of immunity. International Journal of Applied and Fundamental Research. 2020;(4):26-30; URL: https://applied-research.ru/ru/article/view?id=13050 (in Russian).
72. Yang G, Zhang Q, Tan J et al. HMGB1 induces macrophage pyroptosis in chronic endometritis. Int Immunopharmacol. 2023;123:110706. DOI: 10.1016/j.intimp.2023.110706. Epub 2023 Aug 2. PMID: 37541110
73. Оразов М.Р., Краснопольская К.В., Силантьева Е.С. и др. Эффективность альтернативных методов лечения бесплодия маточного генеза. Гинекология. 2021;23(1):92-6.
Orazov M.R., Krasnopolskaya K.V., Silantieva E.S. et al. The effectiveness of alternative methods of treatment of infertility of uterine origin. Gynecology. 2021;23(1):92-6 (in Russian).
74. Sharkey AM, Smith SK. The endometrium as a cause of implantation failure. Best Practice and Research Clinical Obstetrics Gynecology. 2015;17(2):289-307.
75. Лызикова Ю.А. Выбор тактики лечения хронического эндометрита на основании иммуногистохимического и микробиологического исследований эндометрия. Вестник смоленской государственной медицинской академии. 2019;18(2):122-7.
Lyzikova Yu.A. The choice of tactics for the treatment of chronic endometritis based on immunohistochemical and microbiological studies of the endometrium. Bulletin of the Smolensk State Medical Academy. 2019;18(2):122-7 (in Russian).
76. Газизова Г.Х., Ящук А.Г., Масленников А.В. и др. Морфологические особенности эндометрия у пациенток с хроническим эндометритом атрофической формы и нарушения гемодинамики. Архив акушерства и гинекологии им. В.Ф. Снегирева. 2022;9(4):231-7.
Gazizova G.H., Yaschuk A.G., Maslennikov A.V. et al. Morphological features of the endometrium in patients with chronic atrophic endometritis and hemodynamic disorders. Archive of Obstetrics and Gynecology named after V.F. Snegirev. 2022;9(4):231-7 (in Russian).
77. Hosseini S, Abbasi H, Salehpour S et al. Prevalence of chronic endometritis in infertile women undergoing hysteroscopy and its association with intrauterine abnormalities: A Cross-Sectional study. JBRA Assist Reprod. 2024;Mar 28. DOI: 10.5935/1518-0557.20240011
76. Li JW, Xv H, Wan RT. Bibliometric analysis of the global trends in immune-related recurrent pregnancy loss research over the last two decades. J Obstet Gynaecol Res. 2024;Mar 11. DOI: 10.1111/jog.15907.
79. Blazheva S, Pachkova S, Bodurska T et al. Unlocking the Uterine Code: Microbiota, Immune Cells, and Therapy for Recurrent Reproductive Failure. Microorganisms. 2024; Mar 9;12(3):547. DOI: 10.3390/microorganisms12030547
80. Hiraoka T, Osuga Y, Hirota Y. Current perspectives on endometrial receptivity: A comprehensive overview of etiology and treatment. J Obstet Gynaecol Res. 2023;49(10):2397-409. DOI: 10.1111/jog.15759. Epub 2023 Aug 1. PMID: 37527810
81. Ryan E, Tolani AT, Zhang J et al. The menstrual cycle phase impacts the detection of plasma cells and the diagnosis of chronic endometritis in endometrial biopsy specimens. Fertil Steril. 2022;118(4):787-94. DOI: 10.1016/j.fertnstert.2022.07.011. PMID: 36182264
82. Kuroda K, Yamanaka A, Takamizawa S et al. Prevalence of and risk factors for chronic endometritis in patients with intrauterine disorders after hysteroscopic surgery. Fertil Steril. 2022;118(3):568-75. DOI: 10.1016/j.fertnstert.2022.05.029. Epub 2022 Jun 17. PMID: 35718544
83. Zeng S, Liu X, Liu D, Song W. Research update for the immune microenvironment of chronic endometritis. J Reprod Immunol. 2022;152:103637. DOI: 10.1016/j.jri.2022.103637. PMID: 35576684
84. Margulies SL, Flores V, Parkash V, Pal L. Chronic endometritis: A prevalent yet poorly understood entity. Int J Gynaecol Obstet. 2022;158(1):194-200. DOI: 10.1002/ijgo.13962. PMID: 34605024
85. Tsonis O, Gkrozou F, Dimitriou E, Paschopoulos M. Hysteroscopic detection of chronic endometritis: Evaluating proposed hysteroscopic features suggestive of chronic endometritis. J Gynecol Obstet Hum Reprod. 2021;50(9):102182. DOI: 10.1016/j.jogoh.2021.102182. PMID: 34111625
86. Ticconi C, Di Simone N, Campagnolo L, Fazleabas A. Clinical consequences of defective decidualization. Tissue Cell. 2021;72:101586. DOI: 10.1016/j.tice.2021.101586. PMID: 34217128
87. Guo L, Gu F, Tan J et al. Multiple endometrial polyps is associated with higher risk of chronicendometritis in reproductive-aged women. J Obstet Gynaecol Res. 2021;47(1):389-96. DOI: 10.1111/jog.14541. PMID: 33300233
88. Saxtorph MH, Hallager T, Persson G et al. Assessing endometrial receptivity after recurrent implantation failure: a prospective controlled cohort study. Reprod Biomed Online. 2020;41(6):998-1006. DOI: 10.1016/j.rbmo.2020.08.015. PMID: 32978074
89. Mlodzik N, Lukaszuk K, Sieg W et al. Endometrial microbiota – do they mean more than we have expected? Ginekol Pol. 2020;91(1):45-8. DOI: 10.5603/GP.2020.0010. PMID: 32039468
90. Zargar M, Ghafourian M, Nikbakht R et al. Evaluating Chronic Endometritis in Women with Recurrent Implantation Failure and Recurrent Pregnancy Loss by Hysteroscopy and Immunohistochemistry. J Minim Invasive Gynecol. 2020;27(1):116-21. DOI: 10.1016/j.jmig.2019. 02.016.PMID: 30851430
91. Yoneda E, Kim S, Tomita K et al. Evaluation of Lipopolysaccharide and Interleukin-6 as Useful Screening Tool for Chronic Endometritis. Int J Mol Sci. 2024;25(4):2017. DOI: 10.3390/ijms25042017. PMID: 38396694
92. Hue HJ, Choi H, Lee HK et al. Prevalence and confounders of chronic endometritis diagnosed using CD138in patients with recurrent implantation failure. Clin Exp Reprod Med. 2024. DOI: 10.5653/cerm. 2023.06170. Online ahead of print. PMID: 38263588
93. Retracted: Investigation of the Relationship between Chronic EndometritisManifestations under Hysteroscope and CD138 Expression. And Biomechanics AB.Appl Bionics Biomech. 2023 Dec 20;2023:9896519. DOI: 10.1155/2023/9896519. eCollection 2023. PMID: 38152755
94. Yang G, Zhang Q, Tan J et al. HMGB1 induces macrophage pyroptosis in chronic endometritis. Int Immunopharmacol. 2023;123:110706. DOI: 10.1016/j.intimp.2023.110706. PMID: 37541110
95. Takimoto K, Yamada H, Shimada S et al. Chronic Endometritis and Uterine Endometrium Microbiota in Recurrent Implantation Failure and Recurrent Pregnancy Loss. Biomedicines. 2023;11(9):2391. DOI: 10.3390/biomedicines11092391. PMID: 37760832
96. Oshina K, Kuroda K, Nakabayashi K et al. Gene expression signatures associated with chronic endometritis revealed by RNA sequencing. Front Med (Lausanne). 2023;10:1185284. DOI: 10.3389/fmed. 2023.1185284. eCollection 2023. PMID: 37547609
97. Kuroda K, Ishiyama S, Shiobara K et al. Therapeutic efficacy of gentle endometrial curettage on antibiotic-resistant chronic endometritis in infertile women. Reprod Med Biol. 2023;22(1):e12525. DOI: 10.1002/rmb2.12525. eCollection 2023 Jan-Dec. PMID: 37409240
98. Tian Y, Zeng Q, Cheng Y et al. Follicular helper T lymphocytes in the endometria of patients with reproductive failure: Association with pregnancy outcomes and inflammatory status of the endometria. Am J Reprod Immunol. 2023;90(1):e13708. DOI: 10.1111/aji.13708. PMID: 37095737
99. Gu J, Sun Q, Qi Y et al. The effect of chronic endometritis and treatment on patients with unexplained infertility. BMC Womens Health. 2023;23(1):345. DOI: 10.1186/s12905-023-02499-6. PMID: 37391747
100. Mihara M, Yasuo T, Kitaya K. Precision Medicine for Chronic Endometritis: Computer-Aided Diagnosis Using Deep Learning Model. Diagnostics (Basel). 2023;13(5):936. DOI: 10.3390/diagnostics 13050936. PMID: 36900079
101. Goto T, Goto S, Ozawa F et al. The association between chronic deciduitis and recurrent pregnancy loss. J Reprod Immunol. 2023;156:103824. DOI: 10.1016/j.jri.2023.103824. PMID: 36773493
102. Xiang R, Li M, Gu Z et al. Chronic endometritis positively correlates with the aggravation of intrauterine adhesions but has limited effects on reproductive prognosis with antibiotic application. Int J Gynaecol Obstet. 2023;160(3):986-92. DOI: 10.1002/ijgo.14434. PMID: 36049892
103. Wu X, Niu S, Zhao T. Establishment and verification of hysteroscopic scoring system for chronicendometritis in infertile patients. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2023;52(1):46-53. DOI: 10.3724/zdxbyxb-2022-0513. PMID: 37283117
104. Li J, Li X, Ding J et al. Analysis of pregnancy outcomes in patients with recurrent implantation failure complicated with chronic endometritis. Front Cell Dev Biol. 2023;11:1088586. DOI: 10.3389/fcell.2023. 1088586. eCollection 2023. PMID: 36861040
105. Li Y, Xu Y, Yu S et al. Chronic endometritis impairs embryo implantation in patients with repeated implantation failure: A retrospective study. Taiwan J Obstet Gynecol. 2022;61(6):984-8. DOI: 10.1016/ j.tjog.2021.01.034. PMID: 36428002
106. Murtinger M, Wirleitner B, Spitzer D et al. Diagnosing chronic endometritis: when simplification fails to clarify. Hum Reprod Open. 2022 Jun 7;2022(3):hoac023. DOI: 10.1093/hropen/hoac023. eCollection 2022. PMID: 35722504
107. Mitter VR, Meier S, Rau TT et al. Treatment following hysteroscopy and endometrial diagnostic biopsy increases the chance for live birth in women with chronic endometritis. Am J Reprod Immunol. 2021;86(5):e13482. DOI: 10.1111/aji.13482. Epub 2021 Aug 9. PMID: 34218478
108. Li J, Song D, Feng X et al. The association of chronic endometritis with mid-trimester loss due to cervical incompetence and the outcome of laparoscopic cervical cerclage. Arch Gynecol Obstet. 2021;304(5):1345-51. DOI: 10.1007/s00404-021-06029-3. PMID: 33811545
109. Lozano FM, Bernabeu A, Lledo B et al. Characterization of the vaginal and endometrial microbiome in patients with chronic endometritis. Eur J Obstet Gynecol Reprod Biol. 2021 Aug;263:25-32. DOI: 10.1016/j.ejogrb.2021.05.045. PMID: 34144490
110. Kitaya K, Ishikawa T. Chronic endometritis: simple can be harder than complex? Fertil Steril. 2021;115(6):1443-4. DOI: 10.1016/j.fertnstert.2021.03.023
111. Li Y, Xu S, Yu S et al. Diagnosis of chronic endometritis: How many CD138(+) cells/HPF in endometrial stroma affect pregnancy outcome of infertile women? Am J Reprod Immunol. 2021;85(5):e13369. DOI: 10.1111/aji.13369. PMID: 33152123
112. Ishida M, Takebayashi A, Kimura F et al. Induction of the epithelial-mesenchymal transition in the endometrium by chronic endometritis in infertile patients. PLoS One. 2021;16(4):e0249775. DOI: 10.1371/journal.pone.0249775. eCollection 2021. PMID: 33826645
113. Kitazawa J, Kimura F, Nakamura A et al. Alteration in endometrial helper T-cell subgroups in chronic endometritis. Am J Reprod Immunol. 2021;85(3):e13372. DOI: 10.1111/aji.13372. PMID: 33155317
114. Chiokadze M, Bär C, Pastuschek J et al. Beyond Uterine Natural Killer Cell Numbers in Unexplained Recurrent Pregnancy Loss: Combined Analysis of CD45, CD56, CD16, CD57, and CD138. Diagnostics (Basel). 2020 Aug 29;10(9):650. DOI: 10.3390/diagnostics10090650. PMID: 32872526
115. Liu H, Song J, Zhang F et al. A New Hysteroscopic Scoring System for Diagnosing Chronic Endometritis. Minim Invasive Gynecol. 2020;27(5):1127-32. DOI: 10.1016/j.jmig.2019.08.035. PMID: 32240839
116. Kuroda K, Horikawa T, Moriyama A et al. Impact of chronic endometritis on endometrial receptivity analysis results and pregnancy outcomes. Immun Inflamm Dis. 2020 Dec;8(4):650-8. DOI: 10.1002/iid3. 354. PMID: 32969185
117. Rimmer MP, Fishwick K, Henderson I et al. Quantifying CD138+ cells in the endometrium to assess chronic endometritisin women at risk of recurrent pregnancy loss: A prospective cohort study and rapid review. Obstet Gynaecol Res. 2021;47(2):689-97. DOI: 10.1111/jog.14585. PMID: 33274569
118. Kaku S, Kubo T, Kimura F et al. Relationship of chronic endometritis with chronic deciduitis in cases of miscarriage. BMC Womens Health. 2020;20(1):114. DOI: 10.1186/s12905-020-00982-y. PMID: 32487112
119. Chen X, Liu Y, Zhao Y et al. Association between chronic endometritis and uterine natural killer cell density in women with recurrent miscarriage: clinical implications. J Obstet Gynaecol Res. 2020;46(6):858-63. DOI: 10.1111/jog.14250. PMID: 32189458
120. Liu Y, Ko EY, Wong KK et al. Endometrial microbiota in infertile women with and without chronicendometritis as diagnosed using a quantitative and reference range-based method. Fertil Steril. 2019;112(4):707-17.e1. DOI: 10.1016/j.fertnstert.2019.05.015. PMID: 31327470
121. Liu L, Yang H, Guo Y et al. The impact of chronic endometritis on endometrial fibrosis and reproductive prognosis in patients with moderate and severe intrauterine adhesions: a prospective cohort study. Fertil Steril. 2019;111(5):1002-1010.e2. DOI: 10.1016/j.fertnstert.2019.01.006
122. Cao W, Fu X, Zhou J et al. The effect of the female genital tract and gut microbiome on reproductive dysfunction. Biosci Trends. 2024;17(6):458-74. DOI: 10.5582/bst.2023.01133. PMID: 38104979
123. HogenEsch E, Hojjati R, Komorowski A et al. J Chronic endometritis: screening, treatment, and pregnancy outcomes in an academic fertility center. Assist Reprod Genet. 2023;40(10):2463-71. DOI: 10.1007/s10815-023-02902-z. PMID: 37558906
124. Liang J, Li M, Zhang L et al. Analysis of the microbiota composition in the genital tract of infertile patients with chronic endometritis or endometrial polyps. Front Cell Infect Microbiol. 2023 May 22;13:1125640. DOI: 10.3389/fcimb.2023.1125640. eCollection 2023. PMID: 37284497
125. Margulies SL, Flores V, Parkash V, Pal L. Chronic endometritis: A prevalent yet poorly understood entity. Int J Gynaecol Obstet. 2022;158(1):194-200. DOI: 10.1002/ijgo.13962. PMID: 34605024
126. Molina NM, Sola-Leyva A, Saez-Lara MJ et al. New Opportunities for Endometrial Health by Modifying Uterine Microbial Composition: Present or Future? Biomolecules. 2020;10(4):593. DOI: 10.3390/biom10040593. PMID: 32290428
127. Taylor M, Jenkins SM, Pillarisetty LS. Endometritis. 2023 Oct 26. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024; Jan. PMID: 31985918
128. Zhang Z, Li T, Xu L et al. Extracellular superoxide produced by Enterococcus faecalis reduces endometrial receptivity via inflammatory injury. Am J Reprod Immunol. 2021 Oct;86(4):e13453. DOI: 10.1111/aji.13453. Epub 2021 May 24. PMID: 33991362


