Клинический разбор в общей медицине №3 2024
Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia
omekan@mail.ru
Abstract
The global relevance of endometriosis as one of the most common gynaecological nosologies is increasing every year. Currently available evidence-based data help to uncover the most intimate pathogenetic stigmas of the disease and identify key application points for its treatment. That said, the most common forms of endometriosis are currently deep infiltrative, superficial peritoneal, and endometrioid ovarian cysts. This review presents the key pathogenetic mechanisms of different phenotypes of the disease and highlights current strategies for their combined treatment.
Keywords: superficial peritoneal endometriosis, deep infiltrative endometriosis, endometrioid ovarian cysts, dienogest.
For citation: Orazov M.R., Radzinsky V.E., Dolgov E.D. Combined treatment (surgery + hormone therapy) of patients with various forms of endometriosis. Clinical review for general practice. 2024; 5 (3): 39–46. (In Russ.). DOI: 10.47407/kr2023.5.3.00372
В настоящее время преобладающими клинико-морфологическими формами заболевания являются поверхностный перитонеальный эндометриоз (ППЭ), глубокий инфильтративный эндометриоз (ГИЭ), а также эндометриомы/эндометриоидные кисты яичников (ЭКЯ) [9, 10]. Исходя из этого, необходимо рассмотреть клинико-эпидемиологические и патогенетические механизмы реализации данных форм эндометриоза и осветить современные возможности их комбинированного лечения.
«Три клинические формы, три судьбы, но единые лекала…»
В настоящее время эпидемиологические данные о распространенности эндометриоза в мире являются весьма вариабельными и до сих пор не могут прийти к «общему знаменателю». Прежде всего это связано с весьма нередкой асимптоматикой или латентным течением данного заболевания. Все чаще эндометриоз «надевает маски» и имеет стертое клиническое течение, либо же вовсе никак себя не проявляет. Согласно имеющимся данным, яркая клиническая манифестация эндометриоза отмечается лишь у 3% пациенток [4]. Вместе с тем классическая тетрада эндометриоза, а именно сочетание четырех «дис» (дисменорея, дисхезия, дизурия, диспареуния), у женщин, страдающих хронической тазовой болью, проявляется далеко не всегда, а главенствующее место занимает дисменорея, беспокоящая пациентку еще с подросткового возраста и ставшая для нее привычным «спутником» [11, 12]. При этом, по данным C.E. Lunde и соавт. (2024 г.), частота диагностирования заболевания у девочек-подростков при наличии того или иного фенотипа тазовой боли может достигать 73%, что демонстрирует чрезвычайную актуальность проведения тщательной дифференциальной диагностики болевого синдрома у данной когорты пациенток с целью ранней верификации эндометриоза [13]. Вместе с тем недооценка эндометриоз-ассоциированной (хотя и весьма неспецифичной) симптоматики еще на начальном этапе приводит к пролонгированию диагностического периода до 10 и более лет, что способствует укреплению патогенетических механизмов как самого заболевания, так и ассоциированной с ним алгологической симптоматики [10]. При этом необходимо отметить, что между наиболее распространенными формами эндометриоза (ППЭ, ЭКЯ и ГИЭ) отсутствуют какие-либо отличия симптоматического спектра, поскольку каждая из них имеет единый базисный патогенетический каскад и, соответственно, реализует схожие клинические «последствия» в виде алгологической симптоматики и различных форм бесплодия. А вместе с тем суммационным эффектом всех отмеченных особенностей эндометриоза является его поистине «эксклюзивная» и общеизвестная неизлечимость, которой не отмечается при других гинекологических нозологиях.
Согласно имеющимся данным, эндометриоз затрагивает до 10% женщин репродуктивного возраста по всему миру (U.L.R. Maggiore и соавт., 2024 г.) [14]. При этом поверхностная перитонеальная форма верифицируется наиболее часто и отмечается у 80% женщин с эндометриозом [15]. Не менее актуальной является и овариальная форма заболевания (ЭКЯ), которая, по данным J.M. Mifsud и соавт. (2023 г.), затрагивает до 44% женщин с верифицированным эндометриозом. При этом наименее распространенным фенотипом эндометриоза является глубокая инфильтративная форма, которая занимает до 20% в общей структуре эндометриоза (см. таблицу) [16].
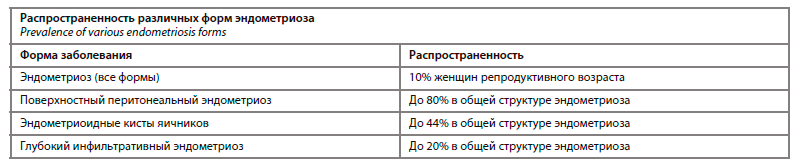
Вместе с тем необходимо отметить, что несмотря на различные данные о распространенности трех самых известных форм эндометриоза, каждая из них в изолированном варианте встречается крайне редко. Так, было доказано, что у 38% пациенток отмечается одновременное сочетание всех трех фенотипов, у 80,6% пациенток – сочетание поверхностной перитонеальной формы с ЭКЯ и у 43,2% женщин ГИЭ сочетался с ЭКЯ [17].
Таким образом, эпидемиологическая актуальность трех наиболее распространенных форм эндометриоза не оставляет никаких сомнений. Интересно, что их частое сочетание не является статистической случайностью, а обусловлено переплетением их общих патогенетических механизмов. В этой связи необходимо рассмотреть общий патогенетический базис «трио» эндометриоза и отметить доказанные в настоящее время точки «расхождения» трех его фенотипов.
В настоящее время глобальные патогенетические основы эндометриоза, несмотря на обилие «тайн», отчасти раскрыты. Благодаря результатам ряда исследований было раскрыто потенциальное первичное патогенетическое звено заболевания. Все чаще мировое гинекологическое сообщество поднимает вопрос о роли так называемой архиметры в патогенезе различных заболеваний, включая эндометриоз. Согласно имеющимся данным, архиметра – это ограниченный тканевый компартмент, включающий эндометриально-субэндометриальную зоны (вместе с junctional zone) и подсосудистый отдел миометрия [18]. Важность данной зоны в контексте патогенеза эндометриоза обусловлена расположением в ней пула эндометриальных стволовых клеток, которые, как и клетки-предшественницы других локусов, обладают повышенным адгезивным и пролиферативным потенциалом [19, 20]. Проецируя данные тезисы на общепринятую теорию Сэмпсона, подразумевающую транстубарный рефлюкс менструальной крови с фрагментами эндометрия, становится ясно, что субстратом для развития эндометриоза являются именно стволовые клетки, попавшие в брюшную полость путем «ретроградной» менструации [21, 22]. Однако причиной появления эндометриальных стволовых клеток в рефлюксе является травматизация «драгоценной» зоны архиметры за счет повышенной контрактильности миометрия (например, при первичной дисменорее) и появления микротравматизации в этой области [23]. Установлено, что у женщин с верифицированным ППЭ отмечается повышенное содержание эндометриальных стволовых клеток в менструальной крови, в сравнении с пациентками без эндометриоза [24].
Исходя из сказанного, важно резюмировать, что травматизация зоны архиметры, по-видимому, может являться первичным звеном патогенеза эндометриоза. Затем попавшие в ретроградный ток менструальной крови стволовые клетки эндометрия оседают на мезотелии брюшины и реализуют дальнейшие «классические» патогенетические механизмы, включая адгезию (за счет повышения активности N-кадгеринов и снижения активности T-кадгеринов), инвазию (за счет аномальной экспрессии синдеканов) и развитие локального аномального воспаления (за счет повышения экспрессии провоспалительных цитокинов, включая интерлейкин (ИЛ)-6, фактор некроза опухоли (ФНО)-α, ИЛ-1β и ИЛ-8); рис. 1 [25–27]. При этом нельзя не отметить ключевую роль сосудистого эндотелиального фактора роста (VEGF), гиперэкспрессия которого способствует поддержанию высокого инвазивного и пролиферативного потенциала дистопированных стволовых клеток эндометрия [28].
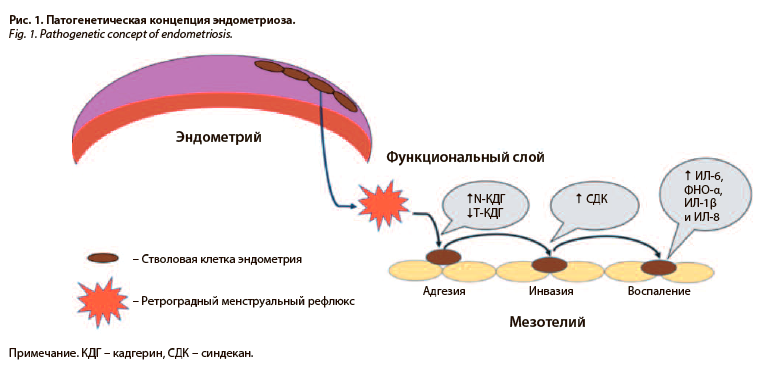
Таким образом, рассмотрены ключевые патогенетические механизмы всех трех фенотипов эндометриоза. И в этой связи важно отметить, что все формы эндометриоза имеют единые механизмы, что объединяет их в контексте ключевых терапевтических мишеней – пролиферация, воспаление и ангиогенез. При этом важно отметить, что ППЭ ограничивается этими патогенетическими паттернами. Однако две другие формы эндометриоза (ГИЭ и ЭКЯ) все же имеют некоторые отличия, которые также необходимо отметить.
Так, ГИЭ характеризуется более высоким инвазивным потенциалом и сопровождается прорастанием гетеротопий в перитонеальный компартмент (покрывающий органы малого таза или брюшной полости) на глубину 5 мм и более [29]. В отличие от других форм эндометриоза, морфологическая картина гетеротопий при ГИЭ представлена изобилием недифференцированных железистых клеток и высокодифференцированных стромальных клеток [30]. Ключевой особенностью ГИЭ является повышенная экспрессия всех типов стероидных рецепторов (как эстрогеновых, так и прогестероновых) и VEGF, существенно «обгоняющая» другие фенотипы эндометриоза [31, 32]. Вероятно, все эти особенности способствуют реализации бесконтрольного пролиферативного и инвазивного потенциала гетеротопий, что способствует их активному прорастанию в стенки соседних органов.
Вместе с тем в патогенезе ЭКЯ, вероятно, ведущую роль также имеет имплантация стволовых клеток эндометрия на поверхности яичника с последующей их инвагинацией в корковый слой и образованием кармана, в котором произойдет формирование кисты [33]. Интересен тот факт, что все остальные теории патогенеза ЭКЯ в настоящее время не нашли отклика и остаются на «ринге контраверсий».
Резюмируя все сказанное, необходимо отметить, что современное «трио» эндометриоза объединены едиными патогенетическими механизмами. Но, несмотря на это, имеющиеся в настоящее время стратегии ведения пациенток с различными формами эндометриоза существенно различаются. Исходя из этого, необходимо рассмотреть возможные пути клинического менеджмента данных пациенток и отметить имеющиеся модные тренды в данном контексте.
Вместе с тем необходимо упомянуть, что изолированная хирургическая тактика в ведении пациенток с разными формами эндометриоза в настоящее время не является состоятельной и требует сочетания с последующей медикаментозной терапией. Так, в контексте комбинированного лечения эндометриоза, как и в современном мире моды, чрезвычайно актуален индивидуальный подход, нацеленный как на эффективную терапию симптомов, так и на профилактику возврата эндометриоза de novo. Ниже мы рассмотрим эффективные схемы комбинированного лечения пациенток с различными формами эндометриоза, имеющие существенные различия в имеющемся арсенале хирургических методик. Однако возможности постоперационной гормональной терапии «эндометриоидного трио» также имеет индивидуализированные подходы, поскольку в настоящее время единственным универсальным гестагеном с таргетным патогенетически-оправданным механизмом действия является диеногест, с самой убедительной доказательной базой.
Диеногест относится к группе гестагенов IV поколения и обладает селективным в контексте эндометриоидных очагов механизмом действия. В настоящее время, согласно результатам ряда клинических и лабораторных исследований, доказано, что диеногест обладает выраженным антиангиогенным, проапоптотическим, антипролиферативным и противовоспалительным эффектами [35]. При этом в настоящее время на фармакологическом рынке диеногест представлен как в моно-варианте (например, известный препарат Зафрилла), так и в комбинации с этинилэстрадиолом в составе комбинированного орального контрацептива (например, препарат Силует), что предоставляет клиницисту возможность индивидуализации постоперационной терапевтической тактики. Исходя из всего сказанного, мы переходим к рассмотрению крайне актуального вопроса клинического ведения пациенток с различными формами эндометриоза в формате удобных блок-схем.
Согласно международным рекомендациям ESHRE (2022 г.), у пациенток с ППЭ предпочтительным является проведение эксцизии очага, в отличие от аблации [36]. При этом необходимо отметить, что в настоящее время отсутствуют убедительные доказательные данные, свидетельствующие о значимом превосходстве данной методики над аблацией. Так, по данным метаанализа K.A. Riley, числовые алгологические показатели у пациенток после эксцизии гетеротопий показали более выраженную тенденцию «на спад», но при этом не было выявлено статистической значимости в полученных результатах за исключением диспареунии (p=0,01) [37]. Аналогичные результаты были продемонстрированы в метаанализе C. Burks и соавт. (2021 г.), согласно которым у пациенток с верифицированным ППЭ после лапароскопической аблации и эксцизии очагов не отмечалось значимой разницы уже во всех алгологических доменах [38]. Исходя из этого, в настоящее время нельзя полностью исключить метод лапароскопической аблации гетеротопий из общего спектра хирургических методик коррекции ППЭ ввиду отсутствия убедительных доказательных данных.
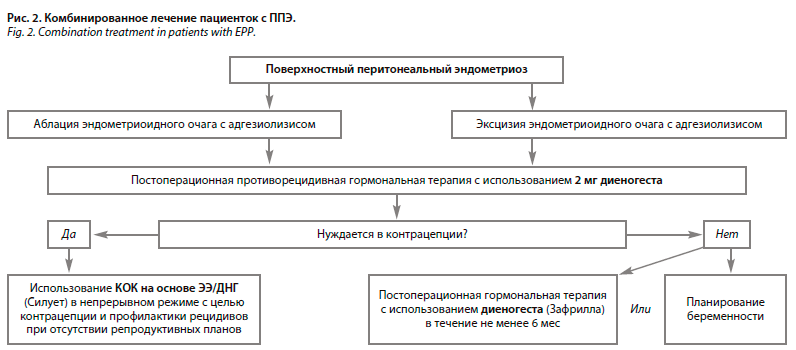
После хирургического удаления гетеротопий у пациенток с ППЭ необходимо назначение постоперационной гормональной терапии, которая поможет редуцировать эндометриоидные очаги, в том числе и микроскопические «остаточные», и будет способствовать снижению риска рецидивирования [36]. Важно отметить, что у пациенток данной когорты возможно использование монодиеногестотерапии не менее 6 мес (например, Зафрилла»), либо комбинированного орального контрацептива (КОК) на основе этинилэстрадиола и диеногеста (ЭЭ/ДНГ) в пролонгированном или традиционном режиме (например, Силует) пациенткам, нуждающимся в контрацепции (рис. 2).
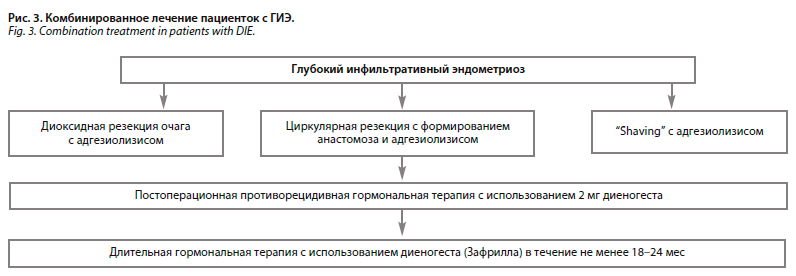
У пациенток с ГИЭ также актуальна постоперационная гормональная терапия, однако и терапевтическая схема у данной когорты пациенток также является более радикальной. Так, у женщин после удаления очагов ГИЭ необходимо назначение длительной (от 18–24 мес) гормональной терапии с использованием диеногеста (например, Зафрилла) с целью профилактики рецидивов заболевания и коррекции алгологических симптомов (рис. 3). Важно отметить, что многочисленными научными исследованиями доказана высокая эффективность, переносимость и безопасность длительного использования диеногеста от 3 до 9 лет у пациенток, страдающих ГИЭ [40, 41].
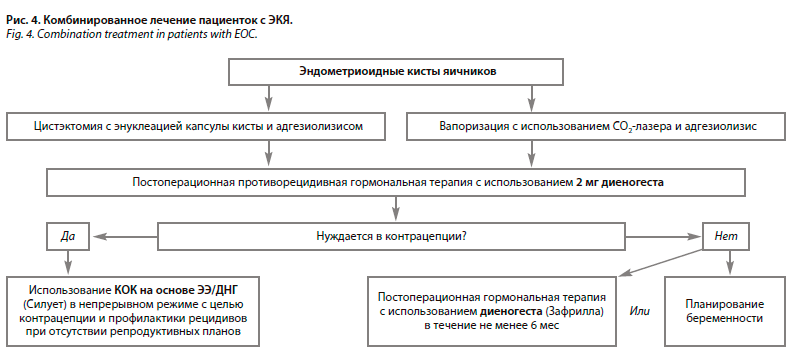
Стратегии постоперационного ведения пациенток с ЭКЯ не отличаются от таковых при ППЭ и могут включать как использование монодиеногестотерапии в течение не менее 6 мес (например, Зафрилла), так и КОК на основе ЭЭ/ДНГ в пролонгированном или традиционном режиме (например, Силует) пациенткам, нуждающимся в контрацепции с целью профилактики рецидивов заболевания и улучшения клинических исходов (рис. 4).
Императивные показания к назначению диеногеста (Зафрилла 2 мг) в терапии эндометриоза:
• тазовая боль, ассоциированная с эндометриозом;
• предотвращение прогрессирования заболевания;
• профилактика рецидивов заболевания после хирургического лечения, что уменьшает необходимость выполнения радикального оперативного вмешательства и позволяет сохранить репродуктивную функцию женщин;
• неполный объем хирургического лечения (в отсутствие возможности адекватно удалить все очаги эндометриоза);
• при инфильтративных формах эндометриоза без признаков стенозирования;
• имплантационные неудачи при бесплодии, ассоциированном с эндометриозом.
Доказана эффективность и безопасность долгосрочной послеоперационной диеногестотерапии (Зафрилла) для профилактики рецидивов эндометриоза яичников. Частота рецидивов эндометриом на фоне послеоперационного лечения диеногестом составила 1,22% (1 из 82, через 48 нед), в то время как частота рецидивов в группе пациенток без лечения – 22,7% (5 из 22, медиана времени до рецидива составила 36 нед (диапазон – 12–41 нед). Отказ от терапии диеногестом после хирургического лечения повышает шанс реализации рецидивов в 23,8 раза по сравнению с пролеченными, различия шансов были статистически значимыми (95% ДИ 2,614–217,122) [43].
Продемонстрировано, что современное «трио» эндометриоза фактически имеет единые патогенетические механизмы хоть и с небольшими расхождениями в клинических исходах. Кроме того, был освещен один из наиболее инновационных вопросов о роли «архиметры» в качестве триггера всех последующих патогенетических механизмов данных фенотипов эндометриоза.
Рассмотрены имеющиеся в настоящее время комбинированные стратегии ведения пациенток с разными формами эндометриоза, способные не только эффективно редуцировать имеющиеся клинические симптомы, но и профилактировать их возврат de novo.
Следует помнить о том, что прогрессивное увеличение частоты эндометриоза в целом и хронической тазовой боли в частности, а также рецидивов и прогрессирующего течения заболевания свидетельствует о необходимости использования диеногестотерапии с максимально длительными курсами у женщин, незаинтересованных в реализации репродуктивной функции в ближайшее время или отсроченном ее планировании.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ,
чл.-корр. РАН, д-р мед. наук, проф., зав. каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 20.03.2024
Поступила после рецензирования: 28.03.2024
Принята к публикации: 28.03.2024
Received: 20.03.2024
Revised: 28.03.2024
Accepted: 28.03.2024
Клинический разбор в общей медицине №3 2024
Комбинированное лечение (хирургия + гормонотерапия) пациенток с различными формами эндометриоза
Номера страниц в выпуске:39-46
Аннотация
Глобальная актуальность эндометриоза как одной из наиболее распространенных гинекологических нозологий нарастает с каждым годом. Имеющиеся на сегодняшний день доказательные данные помогают раскрыть самые сокровенные патогенетические стигмы заболевания и определить ключевые точки приложения для его лечения. При этом в настоящее время наиболее распространенными формами эндометриоза являются глубокая инфильтративная, поверхностная перитонеальная, а также эндометриоидные кисты яичников. В настоящем обзоре представлены ключевые патогенетические механизмы разных фенотипов заболевания и освещены современные стратегии их комбинированного лечения.
Ключевые слова: поверхностный перитонеальный эндометриоз, глубокий инфильтративный эндометриоз, эндометриоидные кисты яичников, диеногест.
Для цитирования: Оразов М.Р., Радзинский В.Е., Долгов Е.Д. Комбинированное лечение (хирургия + гормонотерапия) пациенток
с различными формами эндометриоза. Клинический разбор в общей медицине. 2024; 5 (3): 39–46. DOI: 10.47407/kr2023.5.3.00372
Глобальная актуальность эндометриоза как одной из наиболее распространенных гинекологических нозологий нарастает с каждым годом. Имеющиеся на сегодняшний день доказательные данные помогают раскрыть самые сокровенные патогенетические стигмы заболевания и определить ключевые точки приложения для его лечения. При этом в настоящее время наиболее распространенными формами эндометриоза являются глубокая инфильтративная, поверхностная перитонеальная, а также эндометриоидные кисты яичников. В настоящем обзоре представлены ключевые патогенетические механизмы разных фенотипов заболевания и освещены современные стратегии их комбинированного лечения.
Ключевые слова: поверхностный перитонеальный эндометриоз, глубокий инфильтративный эндометриоз, эндометриоидные кисты яичников, диеногест.
Для цитирования: Оразов М.Р., Радзинский В.Е., Долгов Е.Д. Комбинированное лечение (хирургия + гормонотерапия) пациенток
с различными формами эндометриоза. Клинический разбор в общей медицине. 2024; 5 (3): 39–46. DOI: 10.47407/kr2023.5.3.00372
Combined treatment (surgery + hormone therapy) of patients with various forms of endometriosis
Mekan R. Orazov, Viktor E. Radzinsky, Evgeny D. DolgovPatrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia
omekan@mail.ru
Abstract
The global relevance of endometriosis as one of the most common gynaecological nosologies is increasing every year. Currently available evidence-based data help to uncover the most intimate pathogenetic stigmas of the disease and identify key application points for its treatment. That said, the most common forms of endometriosis are currently deep infiltrative, superficial peritoneal, and endometrioid ovarian cysts. This review presents the key pathogenetic mechanisms of different phenotypes of the disease and highlights current strategies for their combined treatment.
Keywords: superficial peritoneal endometriosis, deep infiltrative endometriosis, endometrioid ovarian cysts, dienogest.
For citation: Orazov M.R., Radzinsky V.E., Dolgov E.D. Combined treatment (surgery + hormone therapy) of patients with various forms of endometriosis. Clinical review for general practice. 2024; 5 (3): 39–46. (In Russ.). DOI: 10.47407/kr2023.5.3.00372
Актуальность проблемы
Эндометриоз дефинируется как воспалительное, гормонозависимое заболевание, которое характеризуется разрастанием ткани, идентичной по морфологическим и функциональным характеристикам эндометрию, вне полости матки и является наиболее частой причиной появления хронической тазовой боли и бесплодия у женщин [1]. «По классике жанра», конечно же, речь идет о болезни, сопровождающейся появлением эндометриально подобной ткани за пределами полости матки и развитием персистирующего аномального воспаления не только на локальном, но и на системном уровне [1, 2]. Нужно отметить высокую распространенности эндометриоза, затрагивающего по разным оценкам от 190 до 256 млн женщин репродуктивного возраста [3–5]. Кроме того, эндометриоз по-прежнему является одной из главных причин женского бесплодия, которое отмечается у половины пациенток данной когорты, причем за счет разных факторов – от трубно-перитонеального до овариального и эндометриального [6]. Не меньшей проблемой оказываются и «алгологические узы» эндометриоза, поскольку именно он является ведущей причиной хронической тазовой боли у 60–70% женщин [7]. Суммационным и вполне закономерным эффектом от сочетания отмеченных факторов является финансовый удар эндометриоза по мировой экономике, поскольку общие ежегодные затраты на лечение заболевания и его последствий в мире достигают 80 млрд долларов США [8].В настоящее время преобладающими клинико-морфологическими формами заболевания являются поверхностный перитонеальный эндометриоз (ППЭ), глубокий инфильтративный эндометриоз (ГИЭ), а также эндометриомы/эндометриоидные кисты яичников (ЭКЯ) [9, 10]. Исходя из этого, необходимо рассмотреть клинико-эпидемиологические и патогенетические механизмы реализации данных форм эндометриоза и осветить современные возможности их комбинированного лечения.
«Три клинические формы, три судьбы, но единые лекала…»
В настоящее время эпидемиологические данные о распространенности эндометриоза в мире являются весьма вариабельными и до сих пор не могут прийти к «общему знаменателю». Прежде всего это связано с весьма нередкой асимптоматикой или латентным течением данного заболевания. Все чаще эндометриоз «надевает маски» и имеет стертое клиническое течение, либо же вовсе никак себя не проявляет. Согласно имеющимся данным, яркая клиническая манифестация эндометриоза отмечается лишь у 3% пациенток [4]. Вместе с тем классическая тетрада эндометриоза, а именно сочетание четырех «дис» (дисменорея, дисхезия, дизурия, диспареуния), у женщин, страдающих хронической тазовой болью, проявляется далеко не всегда, а главенствующее место занимает дисменорея, беспокоящая пациентку еще с подросткового возраста и ставшая для нее привычным «спутником» [11, 12]. При этом, по данным C.E. Lunde и соавт. (2024 г.), частота диагностирования заболевания у девочек-подростков при наличии того или иного фенотипа тазовой боли может достигать 73%, что демонстрирует чрезвычайную актуальность проведения тщательной дифференциальной диагностики болевого синдрома у данной когорты пациенток с целью ранней верификации эндометриоза [13]. Вместе с тем недооценка эндометриоз-ассоциированной (хотя и весьма неспецифичной) симптоматики еще на начальном этапе приводит к пролонгированию диагностического периода до 10 и более лет, что способствует укреплению патогенетических механизмов как самого заболевания, так и ассоциированной с ним алгологической симптоматики [10]. При этом необходимо отметить, что между наиболее распространенными формами эндометриоза (ППЭ, ЭКЯ и ГИЭ) отсутствуют какие-либо отличия симптоматического спектра, поскольку каждая из них имеет единый базисный патогенетический каскад и, соответственно, реализует схожие клинические «последствия» в виде алгологической симптоматики и различных форм бесплодия. А вместе с тем суммационным эффектом всех отмеченных особенностей эндометриоза является его поистине «эксклюзивная» и общеизвестная неизлечимость, которой не отмечается при других гинекологических нозологиях.
Согласно имеющимся данным, эндометриоз затрагивает до 10% женщин репродуктивного возраста по всему миру (U.L.R. Maggiore и соавт., 2024 г.) [14]. При этом поверхностная перитонеальная форма верифицируется наиболее часто и отмечается у 80% женщин с эндометриозом [15]. Не менее актуальной является и овариальная форма заболевания (ЭКЯ), которая, по данным J.M. Mifsud и соавт. (2023 г.), затрагивает до 44% женщин с верифицированным эндометриозом. При этом наименее распространенным фенотипом эндометриоза является глубокая инфильтративная форма, которая занимает до 20% в общей структуре эндометриоза (см. таблицу) [16].

Вместе с тем необходимо отметить, что несмотря на различные данные о распространенности трех самых известных форм эндометриоза, каждая из них в изолированном варианте встречается крайне редко. Так, было доказано, что у 38% пациенток отмечается одновременное сочетание всех трех фенотипов, у 80,6% пациенток – сочетание поверхностной перитонеальной формы с ЭКЯ и у 43,2% женщин ГИЭ сочетался с ЭКЯ [17].
Таким образом, эпидемиологическая актуальность трех наиболее распространенных форм эндометриоза не оставляет никаких сомнений. Интересно, что их частое сочетание не является статистической случайностью, а обусловлено переплетением их общих патогенетических механизмов. В этой связи необходимо рассмотреть общий патогенетический базис «трио» эндометриоза и отметить доказанные в настоящее время точки «расхождения» трех его фенотипов.
В настоящее время глобальные патогенетические основы эндометриоза, несмотря на обилие «тайн», отчасти раскрыты. Благодаря результатам ряда исследований было раскрыто потенциальное первичное патогенетическое звено заболевания. Все чаще мировое гинекологическое сообщество поднимает вопрос о роли так называемой архиметры в патогенезе различных заболеваний, включая эндометриоз. Согласно имеющимся данным, архиметра – это ограниченный тканевый компартмент, включающий эндометриально-субэндометриальную зоны (вместе с junctional zone) и подсосудистый отдел миометрия [18]. Важность данной зоны в контексте патогенеза эндометриоза обусловлена расположением в ней пула эндометриальных стволовых клеток, которые, как и клетки-предшественницы других локусов, обладают повышенным адгезивным и пролиферативным потенциалом [19, 20]. Проецируя данные тезисы на общепринятую теорию Сэмпсона, подразумевающую транстубарный рефлюкс менструальной крови с фрагментами эндометрия, становится ясно, что субстратом для развития эндометриоза являются именно стволовые клетки, попавшие в брюшную полость путем «ретроградной» менструации [21, 22]. Однако причиной появления эндометриальных стволовых клеток в рефлюксе является травматизация «драгоценной» зоны архиметры за счет повышенной контрактильности миометрия (например, при первичной дисменорее) и появления микротравматизации в этой области [23]. Установлено, что у женщин с верифицированным ППЭ отмечается повышенное содержание эндометриальных стволовых клеток в менструальной крови, в сравнении с пациентками без эндометриоза [24].
Исходя из сказанного, важно резюмировать, что травматизация зоны архиметры, по-видимому, может являться первичным звеном патогенеза эндометриоза. Затем попавшие в ретроградный ток менструальной крови стволовые клетки эндометрия оседают на мезотелии брюшины и реализуют дальнейшие «классические» патогенетические механизмы, включая адгезию (за счет повышения активности N-кадгеринов и снижения активности T-кадгеринов), инвазию (за счет аномальной экспрессии синдеканов) и развитие локального аномального воспаления (за счет повышения экспрессии провоспалительных цитокинов, включая интерлейкин (ИЛ)-6, фактор некроза опухоли (ФНО)-α, ИЛ-1β и ИЛ-8); рис. 1 [25–27]. При этом нельзя не отметить ключевую роль сосудистого эндотелиального фактора роста (VEGF), гиперэкспрессия которого способствует поддержанию высокого инвазивного и пролиферативного потенциала дистопированных стволовых клеток эндометрия [28].

Таким образом, рассмотрены ключевые патогенетические механизмы всех трех фенотипов эндометриоза. И в этой связи важно отметить, что все формы эндометриоза имеют единые механизмы, что объединяет их в контексте ключевых терапевтических мишеней – пролиферация, воспаление и ангиогенез. При этом важно отметить, что ППЭ ограничивается этими патогенетическими паттернами. Однако две другие формы эндометриоза (ГИЭ и ЭКЯ) все же имеют некоторые отличия, которые также необходимо отметить.
Так, ГИЭ характеризуется более высоким инвазивным потенциалом и сопровождается прорастанием гетеротопий в перитонеальный компартмент (покрывающий органы малого таза или брюшной полости) на глубину 5 мм и более [29]. В отличие от других форм эндометриоза, морфологическая картина гетеротопий при ГИЭ представлена изобилием недифференцированных железистых клеток и высокодифференцированных стромальных клеток [30]. Ключевой особенностью ГИЭ является повышенная экспрессия всех типов стероидных рецепторов (как эстрогеновых, так и прогестероновых) и VEGF, существенно «обгоняющая» другие фенотипы эндометриоза [31, 32]. Вероятно, все эти особенности способствуют реализации бесконтрольного пролиферативного и инвазивного потенциала гетеротопий, что способствует их активному прорастанию в стенки соседних органов.
Вместе с тем в патогенезе ЭКЯ, вероятно, ведущую роль также имеет имплантация стволовых клеток эндометрия на поверхности яичника с последующей их инвагинацией в корковый слой и образованием кармана, в котором произойдет формирование кисты [33]. Интересен тот факт, что все остальные теории патогенеза ЭКЯ в настоящее время не нашли отклика и остаются на «ринге контраверсий».
Резюмируя все сказанное, необходимо отметить, что современное «трио» эндометриоза объединены едиными патогенетическими механизмами. Но, несмотря на это, имеющиеся в настоящее время стратегии ведения пациенток с различными формами эндометриоза существенно различаются. Исходя из этого, необходимо рассмотреть возможные пути клинического менеджмента данных пациенток и отметить имеющиеся модные тренды в данном контексте.
Возможности комбинированного лечения пациенток с различными формами эндометриоза
Современные возможности лечения эндометриоза в целом и его ключевых фенотипов в частности являются поистине безграничными. Благодаря результатам ряда клинических исследований, следует стратифицировать пациенток на 2 основные группы – нуждающихся в хирургическом лечении или не нуждающихся соответственно. Вопрос выбора стратегии является весьма непростым, а его решение должно основываться на ряде показателей, включая возраст пациентки, коморбидный фон, ее предпочтения и, конечно же, клиническую форму эндометриоза и степень ее тяжести [34].Вместе с тем необходимо упомянуть, что изолированная хирургическая тактика в ведении пациенток с разными формами эндометриоза в настоящее время не является состоятельной и требует сочетания с последующей медикаментозной терапией. Так, в контексте комбинированного лечения эндометриоза, как и в современном мире моды, чрезвычайно актуален индивидуальный подход, нацеленный как на эффективную терапию симптомов, так и на профилактику возврата эндометриоза de novo. Ниже мы рассмотрим эффективные схемы комбинированного лечения пациенток с различными формами эндометриоза, имеющие существенные различия в имеющемся арсенале хирургических методик. Однако возможности постоперационной гормональной терапии «эндометриоидного трио» также имеет индивидуализированные подходы, поскольку в настоящее время единственным универсальным гестагеном с таргетным патогенетически-оправданным механизмом действия является диеногест, с самой убедительной доказательной базой.
Диеногест относится к группе гестагенов IV поколения и обладает селективным в контексте эндометриоидных очагов механизмом действия. В настоящее время, согласно результатам ряда клинических и лабораторных исследований, доказано, что диеногест обладает выраженным антиангиогенным, проапоптотическим, антипролиферативным и противовоспалительным эффектами [35]. При этом в настоящее время на фармакологическом рынке диеногест представлен как в моно-варианте (например, известный препарат Зафрилла), так и в комбинации с этинилэстрадиолом в составе комбинированного орального контрацептива (например, препарат Силует), что предоставляет клиницисту возможность индивидуализации постоперационной терапевтической тактики. Исходя из всего сказанного, мы переходим к рассмотрению крайне актуального вопроса клинического ведения пациенток с различными формами эндометриоза в формате удобных блок-схем.
Поверхностный перитонеальный эндометриоз: тактика клинициста
ППЭ является наиболее типичной и «легкой» формой заболевания, не требующей проведения «сложных или сложносоставных» хирургических вмешательств.Согласно международным рекомендациям ESHRE (2022 г.), у пациенток с ППЭ предпочтительным является проведение эксцизии очага, в отличие от аблации [36]. При этом необходимо отметить, что в настоящее время отсутствуют убедительные доказательные данные, свидетельствующие о значимом превосходстве данной методики над аблацией. Так, по данным метаанализа K.A. Riley, числовые алгологические показатели у пациенток после эксцизии гетеротопий показали более выраженную тенденцию «на спад», но при этом не было выявлено статистической значимости в полученных результатах за исключением диспареунии (p=0,01) [37]. Аналогичные результаты были продемонстрированы в метаанализе C. Burks и соавт. (2021 г.), согласно которым у пациенток с верифицированным ППЭ после лапароскопической аблации и эксцизии очагов не отмечалось значимой разницы уже во всех алгологических доменах [38]. Исходя из этого, в настоящее время нельзя полностью исключить метод лапароскопической аблации гетеротопий из общего спектра хирургических методик коррекции ППЭ ввиду отсутствия убедительных доказательных данных.
После хирургического удаления гетеротопий у пациенток с ППЭ необходимо назначение постоперационной гормональной терапии, которая поможет редуцировать эндометриоидные очаги, в том числе и микроскопические «остаточные», и будет способствовать снижению риска рецидивирования [36]. Важно отметить, что у пациенток данной когорты возможно использование монодиеногестотерапии не менее 6 мес (например, Зафрилла»), либо комбинированного орального контрацептива (КОК) на основе этинилэстрадиола и диеногеста (ЭЭ/ДНГ) в пролонгированном или традиционном режиме (например, Силует) пациенткам, нуждающимся в контрацепции (рис. 2).

Глубокий инфильтративный эндометриоз: тактика клинициста
Как мы отметили выше, ГИЭ признан наиболее тяжелой формой заболевания, что неизбежно сказалось на стратегиях клинического менеджмента пациенток данной когорты. Хирургические методики лечения данного фенотипа эндометриоза являются наиболее радикальными и включают дискоидную резекцию очагов (иссечение очага), «shaving» (поверхностное «сбривание» без вскрытия просвета органа), а также циркулярную резекцию кишки с формированием анастомоза. При этом выбор хирургической тактики должен опираться на следующие характеристики эндометриоидного инфильтрата: размер очага, степень стенозирования кишечника, глубина поражения, расстояние от анального отверстия и вовлеченность регионарных лимфоузлов в патологический процесс [39].У пациенток с ГИЭ также актуальна постоперационная гормональная терапия, однако и терапевтическая схема у данной когорты пациенток также является более радикальной. Так, у женщин после удаления очагов ГИЭ необходимо назначение длительной (от 18–24 мес) гормональной терапии с использованием диеногеста (например, Зафрилла) с целью профилактики рецидивов заболевания и коррекции алгологических симптомов (рис. 3). Важно отметить, что многочисленными научными исследованиями доказана высокая эффективность, переносимость и безопасность длительного использования диеногеста от 3 до 9 лет у пациенток, страдающих ГИЭ [40, 41].

Эндометриоидные кисты яичников: тактика клинициста
Согласно международным и отечественным рекомендациям у пациенток с эндометриозом овариальной локализации необходима цистэктомия с последующей энуклеацией капсулы кисты, что в дальнейшем позволит снизить риск возврата эндометриоза de novo [36, 42]. Однако кроме «классической» методики, согласно рекомендациям ESHRE, у пациенток данной когорты возможна вапоризация эндометриоидной кисты с использованием CO2-лазера. При этом, по имеющимся данным, данные методики являются в равной степени эффективными и имеют схожие риски возврата овариального эндометриоза de novo в течение 1 года после операции [36].Стратегии постоперационного ведения пациенток с ЭКЯ не отличаются от таковых при ППЭ и могут включать как использование монодиеногестотерапии в течение не менее 6 мес (например, Зафрилла), так и КОК на основе ЭЭ/ДНГ в пролонгированном или традиционном режиме (например, Силует) пациенткам, нуждающимся в контрацепции с целью профилактики рецидивов заболевания и улучшения клинических исходов (рис. 4).

Императивные показания к назначению диеногеста (Зафрилла 2 мг) в терапии эндометриоза:
• тазовая боль, ассоциированная с эндометриозом;
• предотвращение прогрессирования заболевания;
• профилактика рецидивов заболевания после хирургического лечения, что уменьшает необходимость выполнения радикального оперативного вмешательства и позволяет сохранить репродуктивную функцию женщин;
• неполный объем хирургического лечения (в отсутствие возможности адекватно удалить все очаги эндометриоза);
• при инфильтративных формах эндометриоза без признаков стенозирования;
• имплантационные неудачи при бесплодии, ассоциированном с эндометриозом.
Доказана эффективность и безопасность долгосрочной послеоперационной диеногестотерапии (Зафрилла) для профилактики рецидивов эндометриоза яичников. Частота рецидивов эндометриом на фоне послеоперационного лечения диеногестом составила 1,22% (1 из 82, через 48 нед), в то время как частота рецидивов в группе пациенток без лечения – 22,7% (5 из 22, медиана времени до рецидива составила 36 нед (диапазон – 12–41 нед). Отказ от терапии диеногестом после хирургического лечения повышает шанс реализации рецидивов в 23,8 раза по сравнению с пролеченными, различия шансов были статистически значимыми (95% ДИ 2,614–217,122) [43].
Заключение
В настоящее время эндометриоз является одним из самых загадочных и актуальных заболеваний современной гинекологии. Широкий спектр клинических проявлений и негативных «последствий» заболевания накладывают «темный отпечаток» на мировую систему здравоохранения, а высокие показатели распространенности характеризуют эндометриоз как одну из самых «сложных» нозологий в мире.Продемонстрировано, что современное «трио» эндометриоза фактически имеет единые патогенетические механизмы хоть и с небольшими расхождениями в клинических исходах. Кроме того, был освещен один из наиболее инновационных вопросов о роли «архиметры» в качестве триггера всех последующих патогенетических механизмов данных фенотипов эндометриоза.
Рассмотрены имеющиеся в настоящее время комбинированные стратегии ведения пациенток с разными формами эндометриоза, способные не только эффективно редуцировать имеющиеся клинические симптомы, но и профилактировать их возврат de novo.
Следует помнить о том, что прогрессивное увеличение частоты эндометриоза в целом и хронической тазовой боли в частности, а также рецидивов и прогрессирующего течения заболевания свидетельствует о необходимости использования диеногестотерапии с максимально длительными курсами у женщин, незаинтересованных в реализации репродуктивной функции в ближайшее время или отсроченном ее планировании.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ,
чл.-корр. РАН, д-р мед. наук, проф., зав. каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 20.03.2024
Поступила после рецензирования: 28.03.2024
Принята к публикации: 28.03.2024
Received: 20.03.2024
Revised: 28.03.2024
Accepted: 28.03.2024
Список исп. литературыСкрыть список1. Lamceva J, Uljanovs R, Strumfa I. The main theories on the pathogenesis of endometriosis. International journal of molecular sciences. 2023;24(5):4254.
2. Yilmaz BD, Bulun SE. Endometriosis and nuclear receptors. Human reproduction update. 2019;25(4):473-85.
3. Ellis K, Munro D, Clarke J. Endometriosis is undervalued: a call to action. Frontiers in Global Women’s Health. 2022;3:54.
4. Parazzini F, Esposito G, Tozzi L et al. Epidemiology of endometriosis and its comorbidities. Eur J Obstetrics Gynecology Reproductive Biology. 2017;209:3-7.
5. Yarmolinskaya M, Suslova E, Tkachenko N et al. Dopamine agonists as genital endometriosis target therapy. Gynecological Endocrinology. 2020;36(Supl 1):7-11.
6. Raja MHR, Farooqui N, Zuberi N et al. Endometriosis, infertility and MicroRNA’s: A review. J Gynecology Obstetrics Human Reproduction. 2021;50(9):102157.
7. Arnold MJ, Osgood AT, Aust A. Chronic Pelvic Pain in Women: ACOG Updates Recommendations. Am Fam Physician. 2021;103(3):186-8. PMID: 33507045.
8. Horne AW, Saunders PTK. SnapShot: Endometriosis. Cell. 2019;179:1677.
9. Imperiale L, Nisolle M, Noël JC, Fastrez M. Three types of endometriosis: pathogenesis, diagnosis and treatment. State of the art. J Clin Med.2023;12(3):994.
10. Cardoso JV, Machado DE, Silva MCD et al. Epidemiological profile of women with endometriosis: a retrospective descriptive study. Revista Brasileira de Saúde Materno Infantil. 2021;20:1057-67.
11. Quintana RL. Endometriosis infiltrativa profunda en la vejiga, resección quirúrgica por laparoscopia. Reporte de un caso y revisión de la bibliografía. Revista Mexicana de Medicina De La Reproducción. 2022;13(d).
12. Kor E et al. Relationship between the severity of endometriosis symptoms (dyspareunia, dysmenorrhea and chronic pelvic pain) and the spread of the disease on ultrasound. BMC Research Notes. 2020;13:1-8.
13. Lunde CE, Wu Z, Reinecke A, Sieberg CB. The Application of Cognitive Behavioral Therapy for Adolescent Patients With Endometriosis: A Topical Review. Cognitive and Behavioral Practice. 2024.
14. Maggiore ULR, Chiappa V, Ceccaroni M et al. Epidemiology of infertility in women with endometriosis. Best Practice & Research Clinical Obstetrics & Gynaecology. 2024: 102454.
15. Johnson NP, Hummelshoj L, World Endometriosis Society Montpellier Consortium. Consensus on current management of endometriosis. Hum Reprod. 2013;28:1552-68.
16. Mifsud JM, Pellegrini L, Cozzolino M. Oocyte Cryopreservation in Women with Ovarian Endometriosis. Journal of Clinical Medicine. 2023;12(21):6767.
17. Piriyev E, Schiermeier S, Römer T. Coexistence of endometriomas with extraovarian endometriosis and adhesions. Eur J Obstet Gynecol Reprod Biol. 2021;263:20-4.
18. Leyendecker G, Kunz G, Noe M et al. Endometriosis: A dysfunction and disease of the archimetra. Hum Reprod Update. 1998;4: 752-62.
19. Habiba M, Benagiano G, Guo SW. An Appraisal of the Tissue Injury and Repair (TIAR) Theory on the Pathogenesis of Endometriosis and Adenomyosis. Biomolecules. 2023;13(6):975.
20. Leyendecker G, Wildt L, Laschke MW, Mall G. Archimetrosis: The evolution of a disease and its extant presentation: Pathogenesis and pathophysiology of archimetrosis (uterine adenomyosis and endometriosis). Archives of Gynecology and Obstetrics. 2023;307(1):93-112.
21. Anastasiu CV, Moga MA, Elena Neculau A et al. Biomarkers for the Noninvasive Diagnosis of Endometriosis: State of the Art and Future Perspectives. Int J Mol Sci 2020;21:1750. DOI: 10.3390/ijms21051750
22. Halme J, Hammond MG, Hulka JF et al. Retrograde menstruation in healthy women and in patients with endometriosis. Obstet. Gynecol. 1984;64:151-4.
23. Leyendecker G, Bilgicyildirim A, Inacker M et al. Adenomyosis and endometriosis. Revisiting their association and further insights into the mechanisms of autotraumatisation. An MRI study. Arch. Gynecol Obstet. 2015;291:917-32.
24. Leyendecker G, Herbertz M, Kunz G, Mall G. Endometriosis results from the dislocation of basal endometrium. Hum Reprod. 2002;17:2725-36.
25. Goławski K et al. The Role of Cadherin 12 (CDH12) in the Peritoneal Fluid among Patients with Endometriosis and Endometriosis-Related Infertility. Int J Environmental Research and Public Health. 2022;19 (18):11586.
26. Ponandai-Srinivasan S et al. Syndecan-1 modulates the invasive potential of endometrioma via TGF-β signalling in a subgroup of women with endometriosis. Human Reproduction. 2020;35(10):2280-93.
27. Smolarz B, Szyłło K, Romanowicz H. Endometriosis: epidemiology, classification, pathogenesis, treatment and genetics (review of literature). Int J Molecular Sciences. 2021;22(19):10554.
28. Laganà AS et al. The pathogenesis of endometriosis: molecular and cell biology insights. Int J Molec Sci. 2019;20(22):5615.
29. Koninckx PR, Ussia A, Adamyan LV et al. Deep endometriosis: definition, diagnosis, and treatment. Fertil Steril. 2012;98(3):564-71.
30. Abrao M, Neme R, Carvalho F et al. Histological classification of endometriosis as a predictor of response to treatment. Int J Gynecol Obstet. 2003;82.
31. Estrogen Receptor α, Progesterone Receptor, and Progesterone Receptor B Proteins in Rectosigmoid Endometriosis: A Tissue Microarray Study. Reprod Sci. 2014;22:31-7.
32. Tosti C, Pinzauti S, Santulli P et al. Pathogenetic Mechanisms of Deep Infiltrating Endometriosis. Reprod. Sci. 2015;22:1053-9.
33. Оразов М.Р., Радзинский В.Е., Долгов Е.Д. «Всегда в моде». Неоклассика, или Излюбленные локализации эндометриоза. Клинический разбор в общей медицине. 2023;4(9):6-14. DOI: 10.47407/kr2023. 4.9.0
Orazov M.R., Radzinskii V.E., Dolgov E.D. «Always trendy». Neoclassic, or Favorite endometriosis localizations. Clinical review for general practice. 2023;4(9):6-14. DOI: 10.47407/kr2023.4.9.00323 (in Russian).
34. Оразов М.Р., Долгов Е.Д. Профилактика рецидивов эндометриоза: сказки братьев Гримм или суровая реальность в классическом бальзаковском жанре. Women’s Clinic. 2022;4:57-65.
Orazov M.R., Dolgov E.D. Prevention of relapses of endometriosis: fairy tales of the brothers Grimm or harsh reality in the classical Balzac genre. Women’s Clinic. 2022;4:57-65 (in Russian).
35. Оразов М.Р., Радзинский В.Е., Долгов Е.Д., Абрамашвили Ю.Г. Патогенез и патогенетические опции в менеджменте эндометриоза. Вопросы гинекологии, акушерства и перинатологии. 2023;22(1):92-104. DOI: 10.20953/1726-1678-2023-1-92-104
Orazov M.R., Radzinsky V.E., Dolgov E.D., Abramashvili Yu.G. Pathogenesis and pathogenetic options in endometriosis management. Issues of gynecology, obstetrics and perinatology. 2023;22(1):92-104. DOI: 10.20953/1726-1678-2023-1-92-104 (in Russian).
36. Guideline of European Society of Human Reproduction and Embryology. Endometriosis. 2022.
37. Riley KA, Benton AS, Deimling TA et al. Surgical excision versus ablation for superficial endometriosis-associated pain: a randomized controlled trial. Journal of Minimally Invasive Gynecology. 2019;26(1):71-7.
38. Burks C, Lee M, DeSarno M et al. Excision versus ablation for management of minimal to mild endometriosis: a systematic review and meta-analysis. Journal of Minimally Invasive Gynecology. 2021;28(3):587-97.
39. Попов А.А., Пучков К.В., Федоров А.А. и др. Хирургическое лечение больных с колоректальным эндометриозом: анатомические особенности, показания, техника операций, осложнения. Российский вестник акушера-гинеколога. 2020;20(2):95-104. DOI: 10.17116/ rosakush20202002195
Popov A.A., Puchkov K.V., Fedorov A.A. et al. Surgical treatment of patients with colorectal endometriosis: anatomical features, indications, surgical technique, complications. Russian bulletin of the obstetrician-gynaecologist. 2020;20(2):95-104. DOI: 10.17116/rosakush 20202002195 (in Russian).
40. La Torre F, Vannuccini S, Toscano F et al. Long-term treatment for endometriosis with dienogest: efficacy, side effects and tolerability. Gynecological Endocrinology. 2024;40(1):2336121.
41. Maiorana A et al. Evaluation of long-term efficacy and safety of dienogest in patients with chronic cyclic pelvic pain associated with endometriosis. Arch Gynecol Obstet. 2024;309:589-97.
42. Эндометриоз. Федеральные клинические рекомендации. М., 2020.
Endometriosis. Federal Clinical Guidelines. Moscow, 2020 (in Russian).
43. Оразов М.Р., Радзинский В.Е., Орехов Р.Е., Таирова М.Б. Эффективность профилактики рецидивов после хирургического лечения эндометриоза яичников. Вопросы гинекологии, акушерства и перинатологии. 2022; 21(3):53-62. DOI: 10.20953/ 1726-1678-2022-3-53-62
Orazov M.R., Radzinsky V.E., Orekhov R.E., Tairova M.B. Effectiveness of recurrence prevention after surgical treatment of ovarian endometriosis. Issues of gynecology, obstetrics and perinatology. 2022; 21(3):53-62. DOI: 10.20953/1726-1678-2022-3-53-62 (in Russian).


