Клинический разбор в общей медицине №3 2024
1 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Ott Research Institute of Obstetrics, Gynecology and Reproductology, Saint Petersburg, Russia;
3 Mechnikov North-Western State Medical University, Saint Petersburg, Russia
iu.pavlova@yandex.ru
Abstract
The steady increase in the number of patients with abnormal uterine bleeding (AUB) has a negative impact on a woman's reproductive health. Obesity is defined as one of the risk factors for AUB and its role in the development of AUB-M and AUB-O has been studied to date. However, our earlier analysis of the results of histological examination of endometrial biopsies showed that in obese women with AUB, the desquamation phase (AUB-E) is significantly more common in the endometrium than in normal-weight women. One of the possible pathogenetic mechanisms may be abnormal endometrial vascularization due to systemic proinflammatory status and local tissue hypoxia.
Aim. To identify the features of the expression of endothelial markers CD34+ and eNOS in endometrial biopsies of patients with AUB and obesity and their role in the pathogenesis of endometrial dysfunction.
Materials and methods. A prospective randomized cohort study included 40 patients of reproductive age with AUB-E. Depending on the presence of obesity, women were stratified into 2 groups: 20 patients with AUB-E and obesity (group 1) and 20 normal-weight patients with AUB-E (group 2). 10 healthy women of reproductive age were included as a control group. All patients underwent endometrial biopsy followed by histological examination according to the standard procedure. At the second stage, an immunohistochemical study of CD34+ and eNOS angiogenesis markers was performed using monoclonal mouse antibodies in standard dilution. The IBM SPSS Statistics v.26 program (IBM Corporation, USA) was used for statistical data analysis.
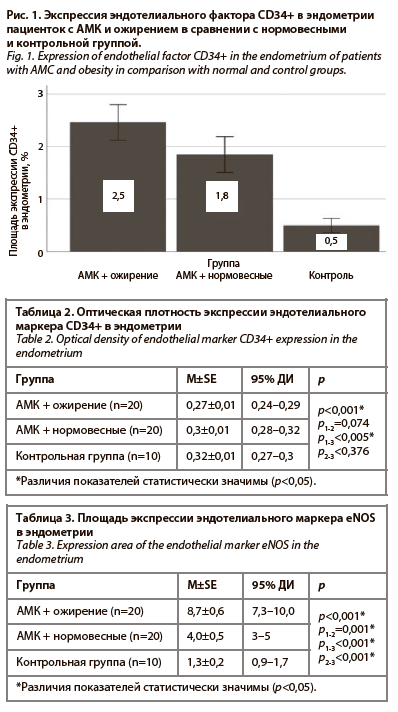
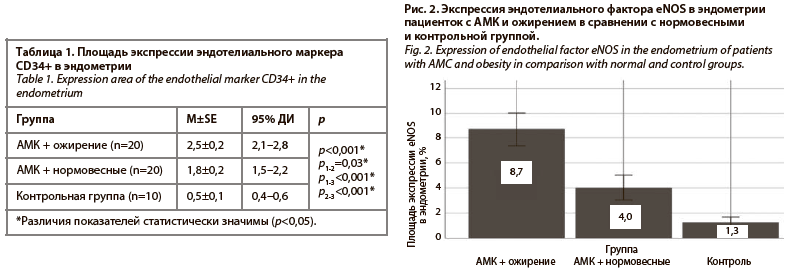
Results. CD34+ expression in patients with AUB and obesity was significantly higher than in normal-weight patients with AUB and healthy women (2,5±0,2, respectively; 95% CI 2,1–2,8 vs. 1,8±0,2; 95% CI 1,5–2,2 and 0,5±0,1; 95% CI 0,4–0,6; p1-2=0,03; p1-3<0,001; p2-3<0,001), as well as eNOS expression (respectively 8,7±0,6; 95% CI 7,3–10,0 vs. 4,0±0,5; 95% CI 3–5 and 1,3±0,2; 95% CI 0,9–1,7; p1-2<0,001; p1-3<0,001; p2-3<0,001).
Conclusion. Patients with AUB-E and obesity are characterized by increased expression of CD34+ and eNOS in endometrial tissue, which indicates pathological activation of neoangigenesis. Perhaps one of the mechanisms of pathogenesis is the formation of a proinflammatory profile against the background of obesity, which contributes to the pathological hypervascularization of the endometrium. Effective weight loss measures can probably reduce the incidence and recurrence of AUB-E.
Keywords: abnormal uterine bleeding, obesity, endometrial dysfunction, CD34+, eNOS.
For citation: Khamoshina M.B., Tolibova G.H., Tral T.G., Artemenko Y.S. The role of angiogenic factor in the development of endothelial dysfunction in women of reproductive age with abnormal uterine bleeding and obesity. Clinical review for general practice. 2024; 5 (3):47–53. (In Russ.). DOI: 10.47407/kr2023.5.3.00373
Отсутствие четкого понимания механизмов остановки менструального кровотечения и недостаточное количество исследований в области первичного заболевания эндометрия как одной из причин АМК приводит к необоснованным инвазивным вмешательствам и дефициту патогенетически оправданных методов лечения.
В настоящее время известны три составляющих для адекватной остановки менструального кровотечения: сужение спиральных артериол для контроля кровотока; эффективный гемостатический ответ, который восстанавливает поврежденные сосуды в функциональном слое; и своевременно произведенная реэпителизация обнаженного базального эндометрия [6]. Отмена прогестерона вызывает местную воспалительную реакцию в эндометрии, во время менструаций наблюдается увеличение проницаемости и хрупкости кровеносных сосудов эндометрия, разрушение тканей и приток клеток врожденного иммунитета в эндометрий, особенно нейтрофилов и макрофагов [7]. Разрешение воспаления имеет решающее значение для ограничения повреждения эндометрия и контроля менструальной кровопотери. Не менее значимым в остановке менструального кровотечения является вазоконстрикция спиральных артериол [8].
Во время менструального цикла ангиогенез регулируется пространственно и во времени: восстановление сосудов в базальном слое в фазе менструации; ангиогенез в функциональном слое в фазе пролиферации поддерживает рост эндометрия; и рост и сворачивание спиральных артериол в секреторной фазе [9]. В недавнем исследовании было продемонстрировано, что гипоксия эндометрия необходима для нормального его восстановления [10]. Формирование гипоксической реакции в эндометрии за счет сосудистого сокращения способствует активации фактора, индуцируемого гипоксией (HIF), который состоит из α-субъединицы и β-субъединицы. При нормоксии α-субъединица быстро деградирует, а β-субъединица экспрессируется [11]. При гипоксии, которая присутствует в перименструальном эндометрии, происходит α-β-димеризация, и HIF транслоцируется в ядро, что вызывает транскрипцию нижестоящих генов-мишеней, включая гены, кодирующие протеиназы, ремоделирующие внеклеточный матрикс и гены ангиогенеза/репарации тканей, таких как VEGF, фактор роста соединительной ткани, эндотелин и ангиопоэтин 2 [8].
Отличие физиологического ангиогенеза от ангиогенеза при патологических состояниях обусловлено дисбалансом между про- и антиангиогенными факторами в эндометрии, что может приводить к аномальной васкуляризации эндометрия и, таким образом, содействовать эндометриальным и ятрогенным АМК [12].
У пациенток с АМК ангиогенез гипотетически может быть нарушен ввиду усиленной отслойки перицитов, миграцией и пролиферацией эндотелиальных клеток, что в конечном счете приводит к усиленному и аберрантному ангиогенезу и/или нарушению созревания сосудов [13]. У пациенток с АМК-Е наблюдаются более тяжелые и продолжительные менструальные кровотечения, вероятно, вызванные снижением вазоконстрикции и изменением созревания сосудов преимущественно спиральных артериол [6].
Повышенная экспрессия VEGFA, ключевого медиатора сосудистой функции, и рецепторов VEGF 1 и 2 в эндометрии способствуют нарушению созревания спиральных артериол и увеличению их в диаметре у пациенток с обильными маточными кровотечениями (ОМК) [6]. Важный проангиогенный эффект VEGFA обусловлен за счет регуляции работы эндотелиальной синтазы оксида азота (eNOS) и синтеза оксида азота (NO), тем самым увеличивая расширение сосудов, проницаемость эндотелиальных клеток и ангиогенез [13]. Напротив, J. Maybin и соавт. (2018 г.) не обнаружили различий в уровнях VEGF как в пролиферативной, так и в секреторной фазе, но HIF-1α и VEGF действительно снижались во время менструации у пациенток с АМК-E по сравнению с контролем [10]. Это может свидетельствовать о задержке восстановления эндометрия во время менструации у пациенток с АМК-E. Эндотелиальный фактор CD34+ тоже является одним из маркеров адекватного роста и созревания сосудов. M. Harmsen и соавт. (2019 г.) в своей работе продемонстрировали повышенную экспрессию проангиогенных факторов, включая CD34+, у женщин с аденомиозом, сделав заключение, что повышенный ангиогенез способствует хрупкости и увеличению проницаемости сосудов, что приводит к АМК [14]. Также в исследовании Biswas S. Shivhare и соавт. (2018 г.) была отмечена повышенная экспрессия маркера эндотелиальный клеток CD34+ у женщин с ОМК по сравнению с контрольной группой [9].
Ожирение – это чрезмерное накопление жира в организме, представляющее риск для здоровья и количественно определяемое как ИМТ≥30 кг/м2 [15]. Функциональный плейотропизм жировой ткани зависит от ее способности синтезировать и высвобождать большое количество гормонов, цитокинов, белков внеклеточного матрикса и факторов роста и вазоактивных факторов, которые в совокупности называются адипокинами, влияющими на различные физиологические и патофизиологические процессы [16]. 39% пациентов всего мира страдают избыточным весом и ожирением, и данный показатель ежегодно растет [17], а влияние данной патологии на АМК до конца не изучено. Известно лишь то, что ожирение является фактором риска гиперплазии и рака эндометрия, а также овуляторной дисфункции, приводящими к АМК. В нашем исследовании мы обнаружили, что у женщин с ожирением по результатам рутинного патоморфологического исследования биоптатов эндометрия статистически значимо чаще встречалось АМК на фоне фазы десквамации по сравнению с нормовесными пациентами, напротив значимой разницы в частоте встречаемости гиперплазии эндометрия не было зафиксировано [18]. Исходя из результатов, возникает острая необходимость в поиске патогенетических механизмов влияния ожирения на первичное заболевание эндометрия и как следствие АМК-Е. Новое понимание генеза этого заболевания важно для разработки новых терапевтических стратегий. Мы предположили, что одним из таких механизмов может быть формирование провоспалительного профиля у пациенток с ожирением, приводящее к развитию эндотелиальной дисфункции и нарушению ангиогенеза в эндометрии и как следствие АМК-Е.
Цель исследования – выявить особенности экспрессии маркеров ангиогенеза CD34+ и eNOS в биоптатах эндометрия пациенток с АМК и ожирением и их роль в патогенезе дисфункции эндометрия.
 Средний возраст пациенток в 1-й группе составил 36,2±8,8 года (95% ДИ 32,0–40,5), во 2-й группе – 35,0±9,1 года (95% ДИ 30,6–39,3) и в контрольной группе – 32,5±7,9 года (95% ДИ 26,9–38,2), p=0,56. Во всех исследованных образцах была исключена структурная патология эндометрия. Рутинная патологическая морфология показала, что у 13 (65%) пациенток 1-й группы эндометрий находился в фазе десквамации, у 5 (25%) – в пролиферативной фазе, у 2 (10%) – в секреторной фазе, во 2-й группе у 9 (45%) пациенток эндометрий находился в десквамативной фазе, у 8 (40%) – отмечали фазу пролиферации и у 3 (15%) – секреторную фазу. В контрольной группе у 4 (40%) женщин эндометрий находился в фазе десквамации, у 4 (40%) – в пролиферативной и у 2 (20%) – в секреторной.
Средний возраст пациенток в 1-й группе составил 36,2±8,8 года (95% ДИ 32,0–40,5), во 2-й группе – 35,0±9,1 года (95% ДИ 30,6–39,3) и в контрольной группе – 32,5±7,9 года (95% ДИ 26,9–38,2), p=0,56. Во всех исследованных образцах была исключена структурная патология эндометрия. Рутинная патологическая морфология показала, что у 13 (65%) пациенток 1-й группы эндометрий находился в фазе десквамации, у 5 (25%) – в пролиферативной фазе, у 2 (10%) – в секреторной фазе, во 2-й группе у 9 (45%) пациенток эндометрий находился в десквамативной фазе, у 8 (40%) – отмечали фазу пролиферации и у 3 (15%) – секреторную фазу. В контрольной группе у 4 (40%) женщин эндометрий находился в фазе десквамации, у 4 (40%) – в пролиферативной и у 2 (20%) – в секреторной.
При иммуногистохимическом исследовании результаты показали статистически значимую разницу в экспрессии эндотелиального маркера CD34+ в биоптатах эндометрия пациенток изучаемой когорты (p<0,001). При межгрупповом сравнении наиболее выраженная экспрессия отмечалась у пациенток с АМК и ожирением по сравнению с нормовесными и контрольной группой (табл. 1; рис. 1).
При оценке оптической плотности экспрессии CD34+ в контрольной группе выявлено статистически значимое повышение экспрессии данного маркера в сравнении с пациентками с АМК и ожирением (р<0,005), табл. 2.
Экспрессия eNOS в биоптатах эндометрия показала аналогичные результаты и была статистически значимо выше в группе пациенток с АМК и ожирением по сравнению с нормовесными и контрольной группой (табл. 3, рис. 2). При сравнении оптической плотности экспрессии данного маркера результаты показали, что она была более выражена у пациенток с АМК и нормальной массой тела, а также пациенток контрольной группы в сравнении с группой с АМК и ожирением (табл. 4).
Обсуждение
В настоящем исследовании нами зафиксировано, что ожирение может способствовать активации патологического неоангиогенеза в эндометрии, за счет которого в последствии происходит формирование АМК-Е. Ранее в статье уже отмечалось, что жировая ткань представляет собой динамичную ткань, которая помимо эндокринной функции, является источником про- и антивоспалительных цитокинов. Дисфункция адипоцитов при ожирении способствует неконтролируемому выбросу фактора некроза опухоли α, интерлейкина (ИЛ)-6, ИЛ-12, ИЛ-1β в системный кровоток, что приводит к формированию в организме человека с избыточной массой субклинического латентного воспаления [19]. Поддерживают воспалительную реакцию синтезируемые жировой тканью адипокины, в частности лептин, присутствующий у пациентов с ожирением в большом количестве. Получены данные о том, что присутствие низкоуровневого воспаления приводит к нарушению функций других органов и тканей, в частности, поджелудочной железы [20] и яичников [21]. На сегодняшний день нет достоверных данных о влиянии ожирения на функциональную активность эндометрия, однако исследование J.J. Reavey и соавт. (2021 г.) показало положительную корреляцию между менструальными кровотечениями и индексом массы тела у женщин, а также подтвердило, что диета с высоким содержанием жиров значительно замедляет восстановление эндометрия в мышиной модели менструации. Кроме того, медиаторы воспаления эндометрия были значительно повышены, а пролиферация эпителиальных клеток эндометрия была снижена у мышей с избыточной массой тела [22], несмотря на то, что в предыдущей работе
S.J. Holdsworth-Carson и соавт. (2020 г.) не было статистически значимого повышения этих же медиаторов воспаления в эндометрии у женщин с ожирением по сравнению с нормовесными [23].
Сосудистая сеть матки играет важную роль в поддержании нормальной функции эндометрия. Патологическая неоваскуляризация, формирующаяся на фоне воспалительных явлений, ухудшает структурно-функциональные характеристики эндометрия и, конечно, негативно сказывается на его функции [24]. Изучение эндотелиального маркера CD34+ в гравидарном эндометрии женщин с хроническим эндометритом в анамнезе при неразвивающихся беременностях также показал его выраженную экспрессию, что свидетельствовало об активации патологического неоангиогенеза, нарушении кровоснабжения ткани, следовательно, эндометриальной функции [25]. Исследование S. Biswas Shivhare и соавт. продемонстрировало, что измененная экспрессия маркеров эндотелиальных клеток и компонентов внеклеточного матрикса, вероятно, отражает нарушение регуляции развития и структурную нестабильность сосудов эндометрия и, следовательно, измененную функцию, что может способствовать АМК и ОМК [9].
У лиц, страдающих ожирением, наиболее часто из встречающихся сосудистых изменений выявляют дисфункцию эндотелия и повышение жесткости сосудов [26]. Наше исследование показало, что экспрессия эндотелиальных маркеров в эндометрии в группе нормовесных пациенток с АМК превалировала над здоровыми пациентками, однако в случае с пациентками с АМК и ожирением была в 1,5 и 2 раза выше, что демонстрирует возможное влияние избытка массы тела на ангиогенез в эндометрии.
Патологическая активация неоангиогенеза на фоне хронического низкоуровневого воспаления и избытка провоспалительных цитокинов в ткани эндометрия рассматривается как один из возможных патогенетических вариантов формирования АМК-Е у женщин с ожирением. Избыточный рост сосудов, по-видимому, изменяет параметры физиологической гипоксии в эндометрии, что приводит к нарушению регенерирующей способности эндометрия. HIF-1α присутствует в эндометрии человека только во время менструации, а адекватная гипоксия необходима для восстановления поврежденного эндометрия [11]. У женщин с ОМК наблюдается снижение уровня HIF-1α в эндометрии во время менструации, что приводит к длительному менструальному кровотечению. В экспериментальном исследовании у мышей создание условий гипероксии во время менструации снижает индукцию HIF-1α и задерживает восстановление эндометрия, а индукция гипоксии путем фармакологической стабилизации HIF-1α предотвращает замедленное восстановление эндометрия у мышей с дефицитом гипоксии [10]. В настоящее время не определена роль гипоксии в развитии ожирения, известно, что гипоксия в жировой ткани мышиной модели играет важную роль в ее дисфункции, наблюдаемой при ожирении, но это не было подтверждено в исследованиях на людях [27]. Влияние любой подобной гипоксии жировой ткани на функцию конечных органов еще предстоит определить.
Таким образом, ожирение играет определенную роль в развитии первичного заболевания эндометрия и нарушении его функции. Вероятно, одним из таких путей патогенеза является создание провоспалительного профиля, который приводит к патологической гиперваскуляризации эндометрия. Своевременная профилактика и лечение ожирения позволит снизить частоту возникновения и рецидивов АМК.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Источники финансирования. Публикация выполнена в рамках проекта РУДН № 030145-0-000
Вклад авторов. М.Б. Хамошина – концепция и дизайн исследования;
Ю.С. Артеменко – обзор литературы, сбор и обработка материалов; Г.Х. Толибова, Т.Г. Траль – проведение исследования; Ю.С. Артеменко, Г.Х. Толибова – статистическая обработка данных; Ю.С. Артеменко – написание текста. Все авторы внесли существенный вклад в разработку концепции, проведение исследования
и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Funding. This publication has been supported by project of RUDN University
№030145-0-000.
Contribution of the authors. M.B. Khamoshina – concept and design of the study;
Yu.S. Artemenko – literature review, collection and processing of materials; G.H. Tolibova, T.G. Tral – conducting research; Yu.S. Artemenko, G.H. Tolibova – statistical data processing; Yu.S. Artemenko – text writing. All the authors made a significant contribution to the development of the concept, research and preparation of the article, read and approved the final version before publication.
Информация об авторах
Information about the authors
Хамошина Марина Борисовна – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН.
Е-mail: khamoshina@mail.ru; ORCID: 0000-0003-1940-4534
Marina B. Khamoshina – Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). Е-mail: khamoshina@mail.ru;
ORCID: 0000-0003-1940-4534
Толибова Гулрухсор Хайбуллоевна – д-р мед. наук, вед. науч. сотр., зав. отделом патоморфологии, ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта», доц. каф. акушерства и гинекологии им. С.Н. Давыдова, ФГБОУ ВО «СЗГМУ им. И.И. Мечникова». E-mail: gulyatolibova@yandex.ru;
ORCID: 0000-0002-6216-6220
Gulrukhsor Kh. Tolibova – Dr. Sci. (Med.), Head of the Pathomorphology Department, Ott Research Institute of Obstetrics, Gynecology and Reproductology; Assoc. Prof., Mechnikov North-Western State Medical University.
E-mail: gulyatolibova@yandex.ru;
ORCID: 0000-0002-6216-6220
Траль Татьяна Георгиевна – канд. мед. наук, зав. лабораторией иммуногистохимии патологоанатомического отделения, ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта». E-mail: ttg.tral@yandex.ru; ORCID: 0000-0001-8948-4811
Tatyana G. Tral – Cand. Sci. (Med.), Head of the Laboratory of Immunohistochemistry, Ott Research Institute of Obstetrics, Gynecology and Reproductology. E-mail: ttg.tral@yandex.ru; ORCID: 0000-0001-8948-4811
Артеменко Юлия Сергеевна – аспирант каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: iu.pavlova@yandex.ru;
ORCID: 0000-0003-2116-1420
Yulia S. Artemenko – Graduate Student, Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: iu.pavlova@yandex.ru; ORCID: 0000-0003-2116-1420
Поступила в редакцию: 17.03.2024
Поступила после рецензирования: 27.03.2024
Принята к публикации: 28.03.2024
Received: 17.03.2024
Revised: 27.03.2024
Accepted: 28.03.2024
Клинический разбор в общей медицине №3 2024
Роль ангиогенного фактора в развитии эндометриальной дисфункции у женщин репродуктивного возраста с аномальными маточными кровотечениями и ожирением
Номера страниц в выпуске:47-53
Аннотация
Неуклонный рост числа пациенток с аномальным маточным кровотечением (АМК) оказывает негативное влияние на репродуктивное здоровье женщины. Ожирение определяют как один из факторов риска АМК, и на сегодняшний день изучена его роль в развитии АМК-М и АМК-О. Однако проведенный ранее нами анализ результатов гистологического исследования биоптатов эндометрия показал, что у женщин с ожирением при АМК в эндометрии значимо чаще встречается фаза десквамации (АМК-Е), чем у нормовесных. Одним из возможных патогенетических механизмов может являться аномальная васкуляризация эндометрия вследствие системного провоспалительного статуса и локальной гипоксии ткани.
Цель. Выявить особенности экспрессии эндотелиальных маркеров CD34+ и eNOS в биоптатах эндометрия пациенток с АМК и ожирением и их роль в патогенезе дисфункции эндометрия.
Материалы и методы. В когортное проспективное рандомизированное исследование были включены 40 пациенток репродуктивного возраста с АМК-Е. В зависимости от наличия ожирения женщины были стратифицированы на две группы: 20 пациенток с АМК-Е и ожирением (1-я группа) и 20 нормовесных пациенток с АМК-Е (2-я группа). В качестве группы контроля были включены 10 здоровых женщин репродуктивного возраста. Всем пациенткам выполнена биопсия эндометрия с последующим гистологическим исследованием по стандартной методике. На втором этапе выполнено иммуногистохимическое исследование маркеров ангиогенеза CD34+ и eNOS с использованием моноклональных мышиных антител в стандартном разведении. Для статистического анализа данных использовали программу IBM SPSS Statistics v.26 (IBM Corporation, США).
Результаты. Экспрессия CD34+ у пациенток с АМК и ожирением оказалась значимо выше, чем у нормовесных с АМК и здоровых женщин (соответственно 2,5±0,2; 95% ДИ 2,1–2,8 против 1,8±0,2; 95% ДИ 1,5–2,2 и 0,5±0,1; 95% ДИ 0,4–0,6; p1-2=0,03; p1-3<0,001; p2-3<0,001), равно как и экспрессия eNOS (соответственно 8,7±0,6; 95% ДИ 7,3–10,0 против 4,0±0,5; 95% ДИ 3–5 и 1,3±0,2; 95% ДИ 0,9–1,7; p1-2<0,001; p1-3<0,001; p2-3<0,001).
Заключение. Для пациенток с АМК-Е и ожирением характерно повышение экспрессии CD34+ и eNOS в ткани эндометрия, что свидетельствует о патологической активации неоангиогенеза. Возможно, одним из механизмов патогенеза служит формирование на фоне ожирения провоспалительного профиля, который способствует патологической гиперваскуляризации эндометрия. Эффективные меры по снижению массы тела, вероятно, могут снизить частоту возникновения и рецидивов АМК-Е.
Ключевые слова: аномальное маточное кровотечение, ожирение, эндометриальная дисфункция, CD34+, eNOS.
Для цитирования: Хамошина М.Б., Толибова Г.Х., Траль Т.Г., Артеменко Ю.С. Роль ангиогенного фактора в развитии эндометриальной дисфункции у женщин репродуктивного возраста с аномальными маточными кровотечениями и ожирением. Клинический разбор в общей медицине. 2024; 5 (3): 47–53. DOI: 10.47407/kr2023.5.3.00373
Неуклонный рост числа пациенток с аномальным маточным кровотечением (АМК) оказывает негативное влияние на репродуктивное здоровье женщины. Ожирение определяют как один из факторов риска АМК, и на сегодняшний день изучена его роль в развитии АМК-М и АМК-О. Однако проведенный ранее нами анализ результатов гистологического исследования биоптатов эндометрия показал, что у женщин с ожирением при АМК в эндометрии значимо чаще встречается фаза десквамации (АМК-Е), чем у нормовесных. Одним из возможных патогенетических механизмов может являться аномальная васкуляризация эндометрия вследствие системного провоспалительного статуса и локальной гипоксии ткани.
Цель. Выявить особенности экспрессии эндотелиальных маркеров CD34+ и eNOS в биоптатах эндометрия пациенток с АМК и ожирением и их роль в патогенезе дисфункции эндометрия.
Материалы и методы. В когортное проспективное рандомизированное исследование были включены 40 пациенток репродуктивного возраста с АМК-Е. В зависимости от наличия ожирения женщины были стратифицированы на две группы: 20 пациенток с АМК-Е и ожирением (1-я группа) и 20 нормовесных пациенток с АМК-Е (2-я группа). В качестве группы контроля были включены 10 здоровых женщин репродуктивного возраста. Всем пациенткам выполнена биопсия эндометрия с последующим гистологическим исследованием по стандартной методике. На втором этапе выполнено иммуногистохимическое исследование маркеров ангиогенеза CD34+ и eNOS с использованием моноклональных мышиных антител в стандартном разведении. Для статистического анализа данных использовали программу IBM SPSS Statistics v.26 (IBM Corporation, США).
Результаты. Экспрессия CD34+ у пациенток с АМК и ожирением оказалась значимо выше, чем у нормовесных с АМК и здоровых женщин (соответственно 2,5±0,2; 95% ДИ 2,1–2,8 против 1,8±0,2; 95% ДИ 1,5–2,2 и 0,5±0,1; 95% ДИ 0,4–0,6; p1-2=0,03; p1-3<0,001; p2-3<0,001), равно как и экспрессия eNOS (соответственно 8,7±0,6; 95% ДИ 7,3–10,0 против 4,0±0,5; 95% ДИ 3–5 и 1,3±0,2; 95% ДИ 0,9–1,7; p1-2<0,001; p1-3<0,001; p2-3<0,001).
Заключение. Для пациенток с АМК-Е и ожирением характерно повышение экспрессии CD34+ и eNOS в ткани эндометрия, что свидетельствует о патологической активации неоангиогенеза. Возможно, одним из механизмов патогенеза служит формирование на фоне ожирения провоспалительного профиля, который способствует патологической гиперваскуляризации эндометрия. Эффективные меры по снижению массы тела, вероятно, могут снизить частоту возникновения и рецидивов АМК-Е.
Ключевые слова: аномальное маточное кровотечение, ожирение, эндометриальная дисфункция, CD34+, eNOS.
Для цитирования: Хамошина М.Б., Толибова Г.Х., Траль Т.Г., Артеменко Ю.С. Роль ангиогенного фактора в развитии эндометриальной дисфункции у женщин репродуктивного возраста с аномальными маточными кровотечениями и ожирением. Клинический разбор в общей медицине. 2024; 5 (3): 47–53. DOI: 10.47407/kr2023.5.3.00373
The role of angiogenic factor in the development of endothelial dysfunction in women of reproductive age with abnormal uterine bleeding and obesity
Marina B. Khamoshina1, Gulrukhsor Kh. Tolibova2,3, Tatyana G. Tral2, Yulia S. Artemenko11 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Ott Research Institute of Obstetrics, Gynecology and Reproductology, Saint Petersburg, Russia;
3 Mechnikov North-Western State Medical University, Saint Petersburg, Russia
iu.pavlova@yandex.ru
Abstract
The steady increase in the number of patients with abnormal uterine bleeding (AUB) has a negative impact on a woman's reproductive health. Obesity is defined as one of the risk factors for AUB and its role in the development of AUB-M and AUB-O has been studied to date. However, our earlier analysis of the results of histological examination of endometrial biopsies showed that in obese women with AUB, the desquamation phase (AUB-E) is significantly more common in the endometrium than in normal-weight women. One of the possible pathogenetic mechanisms may be abnormal endometrial vascularization due to systemic proinflammatory status and local tissue hypoxia.
Aim. To identify the features of the expression of endothelial markers CD34+ and eNOS in endometrial biopsies of patients with AUB and obesity and their role in the pathogenesis of endometrial dysfunction.
Materials and methods. A prospective randomized cohort study included 40 patients of reproductive age with AUB-E. Depending on the presence of obesity, women were stratified into 2 groups: 20 patients with AUB-E and obesity (group 1) and 20 normal-weight patients with AUB-E (group 2). 10 healthy women of reproductive age were included as a control group. All patients underwent endometrial biopsy followed by histological examination according to the standard procedure. At the second stage, an immunohistochemical study of CD34+ and eNOS angiogenesis markers was performed using monoclonal mouse antibodies in standard dilution. The IBM SPSS Statistics v.26 program (IBM Corporation, USA) was used for statistical data analysis.
Results. CD34+ expression in patients with AUB and obesity was significantly higher than in normal-weight patients with AUB and healthy women (2,5±0,2, respectively; 95% CI 2,1–2,8 vs. 1,8±0,2; 95% CI 1,5–2,2 and 0,5±0,1; 95% CI 0,4–0,6; p1-2=0,03; p1-3<0,001; p2-3<0,001), as well as eNOS expression (respectively 8,7±0,6; 95% CI 7,3–10,0 vs. 4,0±0,5; 95% CI 3–5 and 1,3±0,2; 95% CI 0,9–1,7; p1-2<0,001; p1-3<0,001; p2-3<0,001).
Conclusion. Patients with AUB-E and obesity are characterized by increased expression of CD34+ and eNOS in endometrial tissue, which indicates pathological activation of neoangigenesis. Perhaps one of the mechanisms of pathogenesis is the formation of a proinflammatory profile against the background of obesity, which contributes to the pathological hypervascularization of the endometrium. Effective weight loss measures can probably reduce the incidence and recurrence of AUB-E.
Keywords: abnormal uterine bleeding, obesity, endometrial dysfunction, CD34+, eNOS.
For citation: Khamoshina M.B., Tolibova G.H., Tral T.G., Artemenko Y.S. The role of angiogenic factor in the development of endothelial dysfunction in women of reproductive age with abnormal uterine bleeding and obesity. Clinical review for general practice. 2024; 5 (3):47–53. (In Russ.). DOI: 10.47407/kr2023.5.3.00373
Введение
Одним из показателей нормального функционирования женской репродуктивной системы является регулярный менструальный цикл, который включает в себя ежемесячное при отсутствии наступления беременности маточное кровотечение. Учитывая тот факт, что женщина менструирует больший период своей жизни, а менструации могут оказывать значительное влияние на физическое, психическое и социальное благополучие, менструальное здоровье следует признать неотъемлемой частью общего состояния здоровья [1]. Порядка 30% женщин в мире подвержены изменениям в объеме или характере менструального кровотечения, которые определяются как аномальные маточные кровотечения (АМК) – кровотечения чрезмерные по длительности, объему и/или частоте [2, 3]. Несмотря на медикаментозные и хирургические варианты лечения АМК, последние продолжают оказывать негативное влияние на качество жизни и приводят к более активному использованию ресурсов здравоохранения [4]. Таким образом, в то время как система здравоохранения занимается устранением последствий АМК, недостаточно внимания уделяется практическому применению и ранней профилактике развития этого заболевания. Четко стандартизированная терминология в понимании структуры причин АМК обеспечивает точную диагностику и назначение специфического лечение. Система классификации PALM-COINE, связанная с АМК, включает органические (структурные) изменения тела матки (PALM): полип (АМК-P), аденомиоз (АМК-A), субмукозная лейомиома (AМК-L) и злокачественные/ предраковые заболевания эндометрия (AМК-M). Группа COIEN содержит «неструктурные» причины, такие как коагулопатия (AМК-C), овуляторная дисфункция (AМК-O), дисфункция эндометрия (АМК-E), ятрогенные (АМК-I) и не относящиеся ни к какой из категорий (АМК-N) [2, 5].Отсутствие четкого понимания механизмов остановки менструального кровотечения и недостаточное количество исследований в области первичного заболевания эндометрия как одной из причин АМК приводит к необоснованным инвазивным вмешательствам и дефициту патогенетически оправданных методов лечения.
В настоящее время известны три составляющих для адекватной остановки менструального кровотечения: сужение спиральных артериол для контроля кровотока; эффективный гемостатический ответ, который восстанавливает поврежденные сосуды в функциональном слое; и своевременно произведенная реэпителизация обнаженного базального эндометрия [6]. Отмена прогестерона вызывает местную воспалительную реакцию в эндометрии, во время менструаций наблюдается увеличение проницаемости и хрупкости кровеносных сосудов эндометрия, разрушение тканей и приток клеток врожденного иммунитета в эндометрий, особенно нейтрофилов и макрофагов [7]. Разрешение воспаления имеет решающее значение для ограничения повреждения эндометрия и контроля менструальной кровопотери. Не менее значимым в остановке менструального кровотечения является вазоконстрикция спиральных артериол [8].
Во время менструального цикла ангиогенез регулируется пространственно и во времени: восстановление сосудов в базальном слое в фазе менструации; ангиогенез в функциональном слое в фазе пролиферации поддерживает рост эндометрия; и рост и сворачивание спиральных артериол в секреторной фазе [9]. В недавнем исследовании было продемонстрировано, что гипоксия эндометрия необходима для нормального его восстановления [10]. Формирование гипоксической реакции в эндометрии за счет сосудистого сокращения способствует активации фактора, индуцируемого гипоксией (HIF), который состоит из α-субъединицы и β-субъединицы. При нормоксии α-субъединица быстро деградирует, а β-субъединица экспрессируется [11]. При гипоксии, которая присутствует в перименструальном эндометрии, происходит α-β-димеризация, и HIF транслоцируется в ядро, что вызывает транскрипцию нижестоящих генов-мишеней, включая гены, кодирующие протеиназы, ремоделирующие внеклеточный матрикс и гены ангиогенеза/репарации тканей, таких как VEGF, фактор роста соединительной ткани, эндотелин и ангиопоэтин 2 [8].
Отличие физиологического ангиогенеза от ангиогенеза при патологических состояниях обусловлено дисбалансом между про- и антиангиогенными факторами в эндометрии, что может приводить к аномальной васкуляризации эндометрия и, таким образом, содействовать эндометриальным и ятрогенным АМК [12].
У пациенток с АМК ангиогенез гипотетически может быть нарушен ввиду усиленной отслойки перицитов, миграцией и пролиферацией эндотелиальных клеток, что в конечном счете приводит к усиленному и аберрантному ангиогенезу и/или нарушению созревания сосудов [13]. У пациенток с АМК-Е наблюдаются более тяжелые и продолжительные менструальные кровотечения, вероятно, вызванные снижением вазоконстрикции и изменением созревания сосудов преимущественно спиральных артериол [6].
Повышенная экспрессия VEGFA, ключевого медиатора сосудистой функции, и рецепторов VEGF 1 и 2 в эндометрии способствуют нарушению созревания спиральных артериол и увеличению их в диаметре у пациенток с обильными маточными кровотечениями (ОМК) [6]. Важный проангиогенный эффект VEGFA обусловлен за счет регуляции работы эндотелиальной синтазы оксида азота (eNOS) и синтеза оксида азота (NO), тем самым увеличивая расширение сосудов, проницаемость эндотелиальных клеток и ангиогенез [13]. Напротив, J. Maybin и соавт. (2018 г.) не обнаружили различий в уровнях VEGF как в пролиферативной, так и в секреторной фазе, но HIF-1α и VEGF действительно снижались во время менструации у пациенток с АМК-E по сравнению с контролем [10]. Это может свидетельствовать о задержке восстановления эндометрия во время менструации у пациенток с АМК-E. Эндотелиальный фактор CD34+ тоже является одним из маркеров адекватного роста и созревания сосудов. M. Harmsen и соавт. (2019 г.) в своей работе продемонстрировали повышенную экспрессию проангиогенных факторов, включая CD34+, у женщин с аденомиозом, сделав заключение, что повышенный ангиогенез способствует хрупкости и увеличению проницаемости сосудов, что приводит к АМК [14]. Также в исследовании Biswas S. Shivhare и соавт. (2018 г.) была отмечена повышенная экспрессия маркера эндотелиальный клеток CD34+ у женщин с ОМК по сравнению с контрольной группой [9].
Ожирение – это чрезмерное накопление жира в организме, представляющее риск для здоровья и количественно определяемое как ИМТ≥30 кг/м2 [15]. Функциональный плейотропизм жировой ткани зависит от ее способности синтезировать и высвобождать большое количество гормонов, цитокинов, белков внеклеточного матрикса и факторов роста и вазоактивных факторов, которые в совокупности называются адипокинами, влияющими на различные физиологические и патофизиологические процессы [16]. 39% пациентов всего мира страдают избыточным весом и ожирением, и данный показатель ежегодно растет [17], а влияние данной патологии на АМК до конца не изучено. Известно лишь то, что ожирение является фактором риска гиперплазии и рака эндометрия, а также овуляторной дисфункции, приводящими к АМК. В нашем исследовании мы обнаружили, что у женщин с ожирением по результатам рутинного патоморфологического исследования биоптатов эндометрия статистически значимо чаще встречалось АМК на фоне фазы десквамации по сравнению с нормовесными пациентами, напротив значимой разницы в частоте встречаемости гиперплазии эндометрия не было зафиксировано [18]. Исходя из результатов, возникает острая необходимость в поиске патогенетических механизмов влияния ожирения на первичное заболевание эндометрия и как следствие АМК-Е. Новое понимание генеза этого заболевания важно для разработки новых терапевтических стратегий. Мы предположили, что одним из таких механизмов может быть формирование провоспалительного профиля у пациенток с ожирением, приводящее к развитию эндотелиальной дисфункции и нарушению ангиогенеза в эндометрии и как следствие АМК-Е.
Цель исследования – выявить особенности экспрессии маркеров ангиогенеза CD34+ и eNOS в биоптатах эндометрия пациенток с АМК и ожирением и их роль в патогенезе дисфункции эндометрия.
Материалы и методы
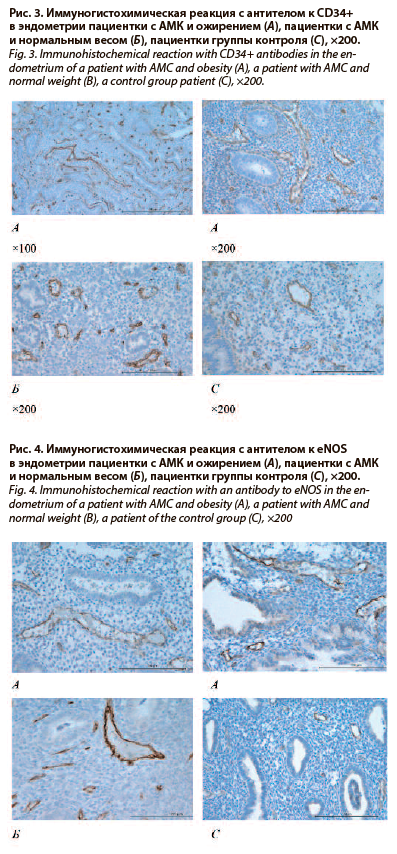
В исследование были включены 40 образцов биопсии эндометрия, взятых в момент маточного кровотечения у пациенток с подтвержденным диагнозом АМК, классифицированным как АМК-Е. Пациентки были разделены на две группы в зависимости от степени ожирения: 1-я группа (n=20) – пациентки с ожирением (ИМТ≥30 кг/м2) и 2-я группа (n=20) – пациентки с нормальным весом (ИМТ=18,5–24,9 кг/м2). В качестве контрольной группы (n=10) образцы биоптатов эндометрия были получены у здоровых женщин репродуктивного возраста на 2–3-й день менструального цикла. Образцы фиксировали в 10% нейтральном формалине, затем обезвоживали в концентрированном спирте. Срезы толщиной 3–4 мкм готовили, заливая их в парафин. Затем срезы депарафинировали и окрашивали гематоксилином и эозином. Структуру железистого и интерстициального компонентов и их соответствие фазам цикла оценивали под оптическим микроскопом (увеличение ×100, ×200 и ×400). Иммуногистохимические исследования (НИИ АГиР им. Д.О. Отта, отдел патологической анатомии, лаборатория иммуногистохимии, зав. отделом – д-р мед. наук Г.Х. Толибова, зав. лабораторией – Т.Г. Траль) проводили на парафиновых срезах. Для иммуногистохимических реакций использовали одностадийный протокол с демаскированием антигена. Верификацию эндотелиального фактора CD34+ проводили с использованием моноклональных мышиных антител в стандартном разведении (1:25) [клон QBEnd-10] согласно протоколу производителя Dako Cytomation (Дания). Экспрессию eNOS оценивали с использованием моноклональных мышиных антител в стандартном разведении (1:60) [клон RN 5] от Leica Biosystems (США). Визуализацию экспрессии маркеров проводили с помощью микроскопа Olympus BX46 и программного обеспечения CellSens 47 Entry. Площадь экспрессии маркера в эндометрии определяли методом морфометрии с помощью программы «ВидеоТестМорфология 5.2» (Россия) на 10 микрофотографиях из каждого микрообразца. Площадь экспрессии рассчитывали по формуле S (%) = Spositive/Sotal×100. Для статистической обработки данных использовали пакет программ SPSS Statistics 26. Для определения статистически значимых различий между количественными параметрами с нормальным распределением использовали однофакторный дисперсионный анализ (ANOVA) с расчетом 95% доверительного интервала (ДИ) с последующим post-hoc тестом Геймса–Хоуэлла для множественных сравнений. Различия считали значимыми при p<0,05.Результаты
 Средний возраст пациенток в 1-й группе составил 36,2±8,8 года (95% ДИ 32,0–40,5), во 2-й группе – 35,0±9,1 года (95% ДИ 30,6–39,3) и в контрольной группе – 32,5±7,9 года (95% ДИ 26,9–38,2), p=0,56. Во всех исследованных образцах была исключена структурная патология эндометрия. Рутинная патологическая морфология показала, что у 13 (65%) пациенток 1-й группы эндометрий находился в фазе десквамации, у 5 (25%) – в пролиферативной фазе, у 2 (10%) – в секреторной фазе, во 2-й группе у 9 (45%) пациенток эндометрий находился в десквамативной фазе, у 8 (40%) – отмечали фазу пролиферации и у 3 (15%) – секреторную фазу. В контрольной группе у 4 (40%) женщин эндометрий находился в фазе десквамации, у 4 (40%) – в пролиферативной и у 2 (20%) – в секреторной.
Средний возраст пациенток в 1-й группе составил 36,2±8,8 года (95% ДИ 32,0–40,5), во 2-й группе – 35,0±9,1 года (95% ДИ 30,6–39,3) и в контрольной группе – 32,5±7,9 года (95% ДИ 26,9–38,2), p=0,56. Во всех исследованных образцах была исключена структурная патология эндометрия. Рутинная патологическая морфология показала, что у 13 (65%) пациенток 1-й группы эндометрий находился в фазе десквамации, у 5 (25%) – в пролиферативной фазе, у 2 (10%) – в секреторной фазе, во 2-й группе у 9 (45%) пациенток эндометрий находился в десквамативной фазе, у 8 (40%) – отмечали фазу пролиферации и у 3 (15%) – секреторную фазу. В контрольной группе у 4 (40%) женщин эндометрий находился в фазе десквамации, у 4 (40%) – в пролиферативной и у 2 (20%) – в секреторной.При иммуногистохимическом исследовании результаты показали статистически значимую разницу в экспрессии эндотелиального маркера CD34+ в биоптатах эндометрия пациенток изучаемой когорты (p<0,001). При межгрупповом сравнении наиболее выраженная экспрессия отмечалась у пациенток с АМК и ожирением по сравнению с нормовесными и контрольной группой (табл. 1; рис. 1).
При оценке оптической плотности экспрессии CD34+ в контрольной группе выявлено статистически значимое повышение экспрессии данного маркера в сравнении с пациентками с АМК и ожирением (р<0,005), табл. 2.
Экспрессия eNOS в биоптатах эндометрия показала аналогичные результаты и была статистически значимо выше в группе пациенток с АМК и ожирением по сравнению с нормовесными и контрольной группой (табл. 3, рис. 2). При сравнении оптической плотности экспрессии данного маркера результаты показали, что она была более выражена у пациенток с АМК и нормальной массой тела, а также пациенток контрольной группы в сравнении с группой с АМК и ожирением (табл. 4).
Обсуждение
В настоящем исследовании нами зафиксировано, что ожирение может способствовать активации патологического неоангиогенеза в эндометрии, за счет которого в последствии происходит формирование АМК-Е. Ранее в статье уже отмечалось, что жировая ткань представляет собой динамичную ткань, которая помимо эндокринной функции, является источником про- и антивоспалительных цитокинов. Дисфункция адипоцитов при ожирении способствует неконтролируемому выбросу фактора некроза опухоли α, интерлейкина (ИЛ)-6, ИЛ-12, ИЛ-1β в системный кровоток, что приводит к формированию в организме человека с избыточной массой субклинического латентного воспаления [19]. Поддерживают воспалительную реакцию синтезируемые жировой тканью адипокины, в частности лептин, присутствующий у пациентов с ожирением в большом количестве. Получены данные о том, что присутствие низкоуровневого воспаления приводит к нарушению функций других органов и тканей, в частности, поджелудочной железы [20] и яичников [21]. На сегодняшний день нет достоверных данных о влиянии ожирения на функциональную активность эндометрия, однако исследование J.J. Reavey и соавт. (2021 г.) показало положительную корреляцию между менструальными кровотечениями и индексом массы тела у женщин, а также подтвердило, что диета с высоким содержанием жиров значительно замедляет восстановление эндометрия в мышиной модели менструации. Кроме того, медиаторы воспаления эндометрия были значительно повышены, а пролиферация эпителиальных клеток эндометрия была снижена у мышей с избыточной массой тела [22], несмотря на то, что в предыдущей работе
S.J. Holdsworth-Carson и соавт. (2020 г.) не было статистически значимого повышения этих же медиаторов воспаления в эндометрии у женщин с ожирением по сравнению с нормовесными [23].
Сосудистая сеть матки играет важную роль в поддержании нормальной функции эндометрия. Патологическая неоваскуляризация, формирующаяся на фоне воспалительных явлений, ухудшает структурно-функциональные характеристики эндометрия и, конечно, негативно сказывается на его функции [24]. Изучение эндотелиального маркера CD34+ в гравидарном эндометрии женщин с хроническим эндометритом в анамнезе при неразвивающихся беременностях также показал его выраженную экспрессию, что свидетельствовало об активации патологического неоангиогенеза, нарушении кровоснабжения ткани, следовательно, эндометриальной функции [25]. Исследование S. Biswas Shivhare и соавт. продемонстрировало, что измененная экспрессия маркеров эндотелиальных клеток и компонентов внеклеточного матрикса, вероятно, отражает нарушение регуляции развития и структурную нестабильность сосудов эндометрия и, следовательно, измененную функцию, что может способствовать АМК и ОМК [9].
У лиц, страдающих ожирением, наиболее часто из встречающихся сосудистых изменений выявляют дисфункцию эндотелия и повышение жесткости сосудов [26]. Наше исследование показало, что экспрессия эндотелиальных маркеров в эндометрии в группе нормовесных пациенток с АМК превалировала над здоровыми пациентками, однако в случае с пациентками с АМК и ожирением была в 1,5 и 2 раза выше, что демонстрирует возможное влияние избытка массы тела на ангиогенез в эндометрии.


Патологическая активация неоангиогенеза на фоне хронического низкоуровневого воспаления и избытка провоспалительных цитокинов в ткани эндометрия рассматривается как один из возможных патогенетических вариантов формирования АМК-Е у женщин с ожирением. Избыточный рост сосудов, по-видимому, изменяет параметры физиологической гипоксии в эндометрии, что приводит к нарушению регенерирующей способности эндометрия. HIF-1α присутствует в эндометрии человека только во время менструации, а адекватная гипоксия необходима для восстановления поврежденного эндометрия [11]. У женщин с ОМК наблюдается снижение уровня HIF-1α в эндометрии во время менструации, что приводит к длительному менструальному кровотечению. В экспериментальном исследовании у мышей создание условий гипероксии во время менструации снижает индукцию HIF-1α и задерживает восстановление эндометрия, а индукция гипоксии путем фармакологической стабилизации HIF-1α предотвращает замедленное восстановление эндометрия у мышей с дефицитом гипоксии [10]. В настоящее время не определена роль гипоксии в развитии ожирения, известно, что гипоксия в жировой ткани мышиной модели играет важную роль в ее дисфункции, наблюдаемой при ожирении, но это не было подтверждено в исследованиях на людях [27]. Влияние любой подобной гипоксии жировой ткани на функцию конечных органов еще предстоит определить.
Таким образом, ожирение играет определенную роль в развитии первичного заболевания эндометрия и нарушении его функции. Вероятно, одним из таких путей патогенеза является создание провоспалительного профиля, который приводит к патологической гиперваскуляризации эндометрия. Своевременная профилактика и лечение ожирения позволит снизить частоту возникновения и рецидивов АМК.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Источники финансирования. Публикация выполнена в рамках проекта РУДН № 030145-0-000
Вклад авторов. М.Б. Хамошина – концепция и дизайн исследования;
Ю.С. Артеменко – обзор литературы, сбор и обработка материалов; Г.Х. Толибова, Т.Г. Траль – проведение исследования; Ю.С. Артеменко, Г.Х. Толибова – статистическая обработка данных; Ю.С. Артеменко – написание текста. Все авторы внесли существенный вклад в разработку концепции, проведение исследования
и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Funding. This publication has been supported by project of RUDN University
№030145-0-000.
Contribution of the authors. M.B. Khamoshina – concept and design of the study;
Yu.S. Artemenko – literature review, collection and processing of materials; G.H. Tolibova, T.G. Tral – conducting research; Yu.S. Artemenko, G.H. Tolibova – statistical data processing; Yu.S. Artemenko – text writing. All the authors made a significant contribution to the development of the concept, research and preparation of the article, read and approved the final version before publication.
Информация об авторах
Information about the authors
Хамошина Марина Борисовна – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН.
Е-mail: khamoshina@mail.ru; ORCID: 0000-0003-1940-4534
Marina B. Khamoshina – Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). Е-mail: khamoshina@mail.ru;
ORCID: 0000-0003-1940-4534
Толибова Гулрухсор Хайбуллоевна – д-р мед. наук, вед. науч. сотр., зав. отделом патоморфологии, ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта», доц. каф. акушерства и гинекологии им. С.Н. Давыдова, ФГБОУ ВО «СЗГМУ им. И.И. Мечникова». E-mail: gulyatolibova@yandex.ru;
ORCID: 0000-0002-6216-6220
Gulrukhsor Kh. Tolibova – Dr. Sci. (Med.), Head of the Pathomorphology Department, Ott Research Institute of Obstetrics, Gynecology and Reproductology; Assoc. Prof., Mechnikov North-Western State Medical University.
E-mail: gulyatolibova@yandex.ru;
ORCID: 0000-0002-6216-6220
Траль Татьяна Георгиевна – канд. мед. наук, зав. лабораторией иммуногистохимии патологоанатомического отделения, ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта». E-mail: ttg.tral@yandex.ru; ORCID: 0000-0001-8948-4811
Tatyana G. Tral – Cand. Sci. (Med.), Head of the Laboratory of Immunohistochemistry, Ott Research Institute of Obstetrics, Gynecology and Reproductology. E-mail: ttg.tral@yandex.ru; ORCID: 0000-0001-8948-4811
Артеменко Юлия Сергеевна – аспирант каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: iu.pavlova@yandex.ru;
ORCID: 0000-0003-2116-1420
Yulia S. Artemenko – Graduate Student, Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: iu.pavlova@yandex.ru; ORCID: 0000-0003-2116-1420
Поступила в редакцию: 17.03.2024
Поступила после рецензирования: 27.03.2024
Принята к публикации: 28.03.2024
Received: 17.03.2024
Revised: 27.03.2024
Accepted: 28.03.2024
Список исп. литературыСкрыть список1. Critchley HOD, Babayev E, Bulun SE et al. Menstruation: science and society. Am J Obstet Gynecol. 2020;223(5):624-64. DOI: 10.1016/j. ajog.2020.06.004
2. Munro MG, Critchley HOD, Fraser IS; FIGO Menstrual Disorders Committee. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions. Int J Gynaecol Obstet. 2018;143(3):393-408. DOI: 10.1002/ijgo.12666
3. Аномальные маточные кровотечения. Клинические рекомендации. Минздрав России. М., 2021. Дата обращения: 12.03.2024. URL: https://cr.minzdrav.gov.ru/recomend/645_1
Abnormal uterine bleeding. Clinical recommendations Ministry of Health of the Russian Federation. Moscow, 2021. URL: https://cr.minzdrav.gov.ru/recomend/645_1. Date of application: 12.03.2024 (in Russian).
4. Matteson KA, Raker CA, Clark MA, Frick KD. Abnormal uterine bleeding, health status, and usual source of medical care: analyses using the Medical Expenditures Panel Survey. J Womens Health (Larchmt). 2013;22(11):959-65. DOI: 10.1089/jwh.2013.4288
5. Munro MG, Critchley HO, Broder MS, Fraser IS. FIGO classification system (PALM- COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet. 2011;113:3-13. DOI: 10.1016/j.ijgo.2010.11.011
6. Jain V, Chodankar RR, Maybin JA, Critchley HOD. Uterine bleeding: how understanding endometrial physiology underpins menstrual health. Nat Rev Endocrinol. 2022;18(5):290-308. DOI: 10.1038/ s41574-021-00629-4
7. Armstrong GM, Maybin JA, Murray AA. Endometrial apoptosis and neutrophil infiltration during menstruation exhibits spatial and temporal dynamics that are recapitulated in a mouse model. Sci Rep. 2017;7:17416. DOI: 10.1038/s41598-017-17565-x
8. Critchley HOD, Maybin JA, Armstrong GM, Williams ARW. Physiology of the endometrium and regulation of menstruation. Physiol Rev. 2020; 100: 1149-79. DOI: 10.1152/physrev.00031.2019
9. Biswas Shivhare S, Bulmer JN, Innes BA et al. Endometrial vascular development in heavy menstrual bleeding: altered spatio-temporal expression of endothelial cell markers and extracellular matrix components. Hum Reprod. 2018;33(3):399-410. DOI: 10.1093/humrep/dex378
10. Maybin JA, Murray AA, Saunders PTK et al. Hypoxia and hypoxia inducible factor-1α are required for normal endometrial repair during menstruation. Nat Commun. 2018;9(1):295. DOI: 10.1038/s41467-017-02375-6
11. Vannuccini S, Jain V, Critchley H, Petraglia F. From menarche to menopause, heavy menstrual bleeding is the underrated compass in reproductive health. Fertil Steril. 2022;118(4):625-36. DOI: 10.1016/ j.fertnstert.2022.07.021
12. Yetkin-Arik B, Kastelein AW, Klaassen I et al. Angiogenesis in gynecological cancers and the options for anti-angiogenesis therapy. Biochim Biophys Acta Rev Cancer. 2021;1875(1):188446. DOI: 10.1016/j.bbcan. 2020.188446
13. Middelkoop MA, Don EE, Hehenkamp WJK et al. Angiogenesis in abnormal uterine bleeding: a narrative review. Hum Reprod Update. 2023;29(4):457-85. DOI: 10.1093/humupd/dmad004
14. Harmsen MJ, Wong CFC, Mijatovic V et al. Role of angiogenesis in adenomyosis-associated abnormal uterine bleeding and subfertility: a systematic review. Hum Reprod Update. 2019;25(5):647-71. DOI: 10.1093/humupd/dmz024
15. Ожирение и избыточный вес. Информационный бюллетень ВОЗ. Веб-сайт: https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight (дата обращения 14.03.2024)
16. Unamuno X, Gómez-Ambrosi J, Rodríguez A et al. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. 2018;48(9):e12997. DOI: 10.1111/eci.12997
17. Ng M, Fleming T, Robinson M et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2014;384(9945):766-81. DOI: 10.1016/S0140-6736(14)60460-8
18. Артеменко Ю.С., Хамошина М.Б., Петренко Н.В., Демина О.А. Патоморфологические особенности эндометрия при аномальных маточных кровотечениях у пациенток репродуктивного возраста с ожирением. Акушерство и гинекология: новости, мнения, обучение. 2023;11(Спецвыпуск):36-41. DOI: 10.33029/2303-9698-2023-11-suppl-36-41
Artemenko Yu.S., Khamoshina M.B., Petrenko N.V., Demina О.А. Pathomorphological features of endometrium in abnormal uterine bleeding in obese patients of reproductive age. Akusherstvo i ginekologiya: novosti, mneniya, obuchenie = Obstetrics and Gynecology: News, Opinions, Training. 2023;11(Supplement): 36-41. DOI: 10.33029/ 2303-9698-2023-11-suppl-36-41 (in Russian).
19. Murray PJ, Allen JE, Biswas SK et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 2014;41(1):14-20. DOI: 10.1016/j.immuni.2014.06.008
20. Saltiel AR, Olefsky JM. Inflammatory mechanisms linking obesity and metabolic disease. J Clin Invest. 2017;127(1):1-4. DOI: 10.1172/ JCI92035
21. Nteeba J, Ortinau LC, Perfield JW 2nd, Keating AF. Diet-induced obesity alters immune cell infiltration and expression of inflammatory cytokine genes in mouse ovarian and peri-ovarian adipose depot tissues. Mol Reprod Dev. 2013;80(11):948-58. DOI: 10.1002/mrd.22231
22. Reavey JJ, Walker C, Murray AA et al. Obesity is associated with heavy menstruation that may be due to delayed endometrial repair. J Endocrinol. 2021;249(2):71-82. DOI: 10.1530/JOE-20-0446
23. Holdsworth-Carson SJ, Chung J, Sloggett C et al. Obesity does not alter endometrial gene expression in women with endometriosis. Reprod Biomed Online. 2020;41(1):113-8. DOI:10.1016/j.rbmo.2020.03.015
24. Schoots MH, Gordijn SJ, Scherjon SA et al. Oxidative stress in placental pathology. Placenta. 2018;69:153-61. DOI: 10.1016/j.placenta. 2018.03.003
25. Траль Т.Г., Толибова Г.Х. Экспрессия эндотелиального фактора CD34+ в гравидарном эндометрии при репродуктивных потерях после эко и привычном невынашивании беременности. Современные проблемы науки и образования. 2022;(6). DOI: 10.17513/spno. 32173
Tral TG, Tolibova GKh. Expression of endothelial factor cd34+ in the gravid endometrium in women with reproductive losses after ivf and recurrent miscarriage. Sovremennie problemi nauki i obrazovania = Modern problems of science and education. 2022;(6). DOI: 10.17513/spno.32173 (in Rissian).
26. Martínez-Martínez E, Souza-Neto FV, Jiménez-González S, Cachofeiro V. Oxidative Stress and Vascular Damage in the Context of Obesity: The Hidden Guest. Antioxidants (Basel). 2021;10(3):406. DOI: 0.3390/antiox10030406
27. Goossens GH, Blaak EE. Adipose tissue dysfunction and impaired metabolic health in human obesity: a matter of oxygen? Front Endocrinol (Lausanne). 2015;(6):55. DOI: 10.3389/fendo.2015.00055


