Клинический разбор в общей медицине №3 2024
Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia
omekan@mail.ru
Abstract
Polycystic ovary syndrome is a proven risk factor for both endometrial hyperplasia and cancer. The article reflects the current paradigm of etiology, pathogenesis and management of patients with endometrial hyperplasia on the background of polycystic ovary syndrome, according to the data of domestic and foreign literature.
Keywords: endometrial hyperplasia, polycystic ovary syndrome, endometrial cancer, gestagens, myo-inositol.
For citation: Orazov M.R., Radzinsky V.E., Dolgov E.D. "Ringed by fate". Carcinogenic risks in patients with polycystic ovary syndrome. Clinical review for general practice. 2024; 5 (3): 54–62. (In Russ.). DOI: 10.47407/kr2023.5.3.00374
За последнее столетие доказательная медицина совершила значимый скачок, позволив каждому клиницисту из разных уголков мира получить актуальные и самые современные знания. Благодаря этому мир увидел поразительное число научных исследований, демонстрирующих четкую ассоциацию между избыточной массой тела или ожирением и эндокринными/сердечно-сосудистыми заболеваниями. Ожирение и стеатоз печени, ожирение и сахарный диабет 2-го типа, ожирение и артериальная гипертензия, ожирение и нарушение мозгового кровообращения или инфаркт миокарда – этими заголовками буквально пестрят современные базы научных данных. В умах современных клиницистов и пациенток укоренились эти сочетания. Однако оказалось, что эти нозологические «коннекты» с общим знаменателем в виде ожирения – не предел.
На настоящий момент глобальная распространенность ожирения в наиболее экономически развитых странах растет в «геометрической прогрессии» с каждым днем. По состоянию на 2024 г., встречаемость женского ожирения в Российской Федерации достигает 31,4%, в Соединенных Штатах Америки – 42,7%, а в Австралии – 31,3%. При этом средний индекс массы тела (ИМТ) в данных регионах составляет 26,4 кг/м2, 28,9 кг/м2 и 26,7 кг/м2 соответственно [1]. Вместе с тем, согласно данным Всемирной организации здравоохранения, суммарная распространенность ожирения в мире достигла 60%, что характеризует его как пандемию XXI в. [2].
Прямым отражением тенденции стремительного повышения распространенности ожирения в мире послужило пропорциональное увеличение заболеваемости раком эндометрия (РЭ). В настоящее время РЭ «укрепил свои позиции» и «сместил» рак шейки матки на 3-е место в структуре заболеваемости злокачественными новообразованиями органов репродуктивной системы. По прогнозам Американского онкологического общества, в 2024 г. РЭ затронет около 67 тыс. женщин в США, а смертность от него достигнет 19% [3]. И в этой связи необходимо отметить ключевые предикторы развития РЭ, к которым относятся [4–6]:
• избыточная масса тела;
• ожирение;
• сахарный диабет 2-го типа;
• синдром поликистозных яичников (СПЯ);
• употребление алкоголя;
• курение;
• генетическая предрасположенность (синдром Линча);
• абсолютная или относительная гиперэстрогения.
Несмотря на все разнообразие факторов риска реализации РЭ, именно избыточная масса тела и ожирение являются «мажорными» индукторами реализации опухолевого процесса. Но вместе с тем не менее важным вопросом современной гинекологии является гиперплазия и канцерогенные риски эндометрия, возникшие на фоне СПЯ.
Метаанализ, основанный на результатах рандомизированных клинических испытаний (B. Meczekalski и соавт., 2020 г.), продемонстрировал, что СПЯ напрямую связан с развитием именно РЭ, в отличие от других анатомических локализаций злокачественных опухолей органов репродуктивной системы (отношение шансов – ОШ 3,66; 95% ДИ 2,05–6,54, p<0,001) [11]. Небезынтересными оказались данные зарубежных коллег
J.E. Johnson и соавт. (2023 г.), показавшие, что у пациенток с верифицированным СПЯ риск развития РЭ повышается в 5 раз (ОШ 4,07; 95% ДИ 2,13–7,78, p<0,0001) [12].
В этой связи необходимо селективно рассмотреть факторы патогенеза СПЯ, связанные с развитием гиперплазии эндометрия (ГЭ) и РЭ соответственно.
Доказано, что у пациенток с СПЯ, инсулинорезистентностью и ожирением потенцируется риск развития атипической ГЭ за счет формирования аномальной воспалительной среды и опосредованной с ней прогестеронорезистентностью, снижением экспрессии гена PTEN, отмечаемой у 55% пациенток с верифицированным РЭ [14–19].
Вместе с тем следует подчеркнуть результаты исследования A. Kolano и соавт. (2024 г.), согласно которым было выявлено, что у пациенток с ожирением в связи с отмеченными эндокринно-метаболическими нарушениями адипозной ткани, повышение ИМТ пропорционально коррелирует с высоким кумулятивным риском смертности от РЭ (максимальный риск отмечается при ИМТ>40 кг/м2) [20].
Вторым по порядку, но не по значимости, патогенетическим компонентом реализации ГЭ является генетически-обусловленная относительная гиперэстрогения, возникающая вследствие развития резистентности эндометрия к прогестерону, что обусловлено следующими факторами:
• нарушение экспрессии индуцируемого митогеном гена 6 (MIG-6) и, соответственно, передачи по сигнальному пути прогестерона [23];
• снижение экспрессии гена HOXA10, что способствует развитию прогестеронорезистентности, снижению рецептивности эндометрия и его имплантационного потенциала [24, 25].
Необходимо отметить, что у пациенток на фоне ожирения может отмечаться снижение концентрации ГСПГ, из-за чего эстрогены переходят в «свободную» фракцию и способствуют развитию уже абсолютной гиперэстрогении с последующей активацией α-подтипа эстрогеновых рецепторов и реализацией митогенного и антиапоптотического эффектов. На все это накладывается способность самих адипоцитов секретировать эстрогены (так называемый внегонадный синтез), а избыточное развитие жировой клетчатки способствует потенцированию данного свойства [26].
Таким образом, необходимо резюмировать, что патогенетический каскад реализации ГЭ у пациенток с СПЯ является многосоставным и включает инсулинорезистентность и ассоциированные с ней эффекты, развитие прогестеронорезистентности из-за нарушения экспрессии ряда генов, а также абсолютной гиперэстрогении вследствие дисфункции жировой ткани. Исходя из сказанного, необходимо рассмотреть варианты лечения ГЭ у пациенток на фоне СПЯ, влияющие на ключевые стигмы патогенеза заболевания.
В контексте влияния дефектного микробиома на развитие РЭ у пациенток с СПЯ важно отметить, что возникает аналогичный/дополнительный эффект гиперэстрогенизма, только обеспечиваемый несколько иными механизмами. Кроме того, аномальная экспрессия провоспалительных цитокинов «по классике жанра» патофизиологии может индуцировать экспрессию антиапоптотических генов, что создает условия для реализации аномальной и непрогнозируемой пролиферации клеток эндометрия и служит триггером для канцерогенной трансформации.
Таким образом, необходимо резюмировать, что патогенетические взаимоотношения между СПЯ и гиперплазией или РЭ являются крайне сложными и еще не до конца изученными. Однако все же описанные реперные патогенетические стигмы в настоящее время не подвергаются сомнению в связи с четко выявленной ассоциацией между СПЯ и канцерогенными рисками. Исходя из этого, необходимо перейти к рассмотрению ключевого вопроса терапевтических стратегий ведения пациенток данной когорты и возможностей комплексной посттерапевтической профилактики возврата ГЭ
de novo.
• Согласно действующим отечественным рекомендациям, у пациенток с верифицированной ГЭ без атипии терапией 1-й линии является использование левоноргестрел-выделяющей внутриматочной системы (ЛНГ-ВМС), обладающей высоким терапевтическим потенциалом и способствующей морфологическому регрессу ГЭ у 90–100% пациенток [32–35].
• При наличии противопоказаний к использованию ЛНГ-ВМС пациенткам с ГЭ без атипии возможно назначение пероральных гестагенов, также способствующие достижению высокой частоты морфологического регресса [32]. Наиболее распространенные гестагены и их эффективность достижения морфологического регресса в рамках лечения ГЭ без атипии рассмотрены в табл. 1.
Необходимо отметить, что длительность терапии независимо от типа гестагена (локальные или пероральные) ГЭ без атипии должна составлять не менее 6 мес с последующим морфологическим контролем эффективности лечения, что позволяет улучшить потенциальные терапевтические исходы и снижает частоту рецидивов [32]. При отсутствии морфологического регресса ГЭ необходим повторный курс терапии гестагенами в течение 6 мес, однако при повторной неудаче и/или рецидивирующем течении болезни необходимо рассмотреть вопрос о хирургическом лечении [41].
• Согласно действующим отечественным клиническим рекомендациям, у пациенток с ГЭ без атипии в сочетании с эндометриозом и/или миомой матки возможно назначение агонистов гонадотропного рилизинг-гормона. Однако при использовании данной группы препаратов необходимо помнить о возможном развитии гипоэстрогении и других нежелательных явлений через 3 и более месяцев лечения [32].
После достижения морфологического регресса ГЭ без атипии следующим компонентом терапии пациенток рассматриваемой когорты является лечение СПЯ: устранение проявлений андрогензависимой дерматопатии, нормализация массы тела и коррекция метаболических нарушений, регуляция менструального цикла для профилактики ГЭ, восстановление овуляторного менструального цикла и фертильности, предупреждение поздних осложнений. В рамках индивидуализации терапии (с учетом жалоб, репродуктивных установок, наличия риска сердечно-сосудистых заболеваний и прочих факторов) в действующих отечественных рекомендациях указывается использование комбинированных оральных контрацептивов (КОК). Метформин и другие фармакологические препараты при СПЯ являются off-label (без официальных показаний в инструкции), однако имеется множество исследований, подтверждающих их эффективность. При этом с уровнем высокой степени доказательности (В-I) в качестве терапии 1-й линии СПЯ (нарушения менструального цикла, симптомы гиперандрогении: гирсутизм и акне) рекомендуется использование КОК. Следует помнить, что эффективность КОК прежде всего обусловлена подавлением секреции лютеинизирующего гормона (ЛГ), что приводит к снижению продукции овариальных андрогенов, а также эстрогенный компонент способствует повышению уровней ГСПГ, что, в свою очередь, снижает уровень свободно циркулирующего тестостерона; прогестин в составе КОК может осуществлять конкурентное взаимодействие с 5α-редуктазой на уровне рецепторов к андрогенам. Одним из них, который полностью соответствует критериям для эффективного использования при СПЯ, является КОК на основе 30 мкг этинилэстрадиола и 2 мг хлормадинона ацетата.
Достоинства хлормадинона ацетата заключаются не только в том, что этот прогестин является производным натурального прогестерона, но и также в том, что это единственный из прогестинов с антиандрогеновыми эффектами, с доказанным профилем безопасности (тромботические и другие риски) в долгосрочной перспективе.
Но вместе с тем необходимо селективно рассмотреть и другие актуальные рекомендации по коррекции СПЯ в сочетании с ГЭ.
• Согласно отечественным (2021 г.) и международным рекомендациям ESHRE (2023 г.), всем пациенткам с СПЯ необходима модификация образа жизни, включая регулярное выполнение физических упражнений, правильное питание и снижение массы тела [42, 43]. Необходимо отметить, что снижение массы тела – основной компонент лечения СПЯ. Эффективность снижения массы тела в контексте профилактики канцерогенных рисков также является крайне высокой. Так, согласно имеющимся новым данным (2024 г.), целенаправленное снижение массы тела всего лишь на 5% в течение 3 лет связано со снижением риска заболеваемости РЭ на 39% (95% ДИ 12–58%) [44].
• Согласно последним международным рекомендациям ESHRE (2023 г.) у пациенток с СПЯ и ИМТ≥25 кг/м2 возможно использование метформина с учетом антропометрических и метаболических показателей, включая инсулинорезистентность, уровень глюкозы и липидный профиль. Следует помнить, что метформин, как и другие лекарственные средства, как правило, не имеют официальных показаний для лечения СПЯ (препараты off-label). Однако, по имеющимся данным, назначение метформина возможно и в когорте пациенток с ИМТ<25 кг/м2, но их уровень доказательности остается ограниченным [43]. Метформин обладает доказанными гипогликемическим, антиинсулинорезистентным и гипоинсулинемическим эффектами. Кроме того, использование данного препарата крайне актуально у пациенток с сахарным диабетом 2-го типа на фоне СПЯ, поскольку у них отмечается значимое снижение массы тела на фоне его приема [45]. Следует помнить, что, несмотря на убедительную доказательную базу эффективности метформина в комплексной коррекции репродуктивной дисфункции и метаболических нарушений у пациенток с СПЯ, нередко возникают побочные эффекты (дефицит витамина В12, тошнота, рвота, диарея, нейропатия и другие гастроинтестинальные расстройства). Все вышеизложенное определяет острую необходимость и перспективность разработки инновационных подходов к комплексной терапии метаболических расстройств при СПЯ, с минимальной/ низкой частотой нежелательных явлений.
• Согласно международным рекомендациям ESHRE (2023 г.), у пациенток с СПЯ, инсулинорезистентностью и ожирением возможно использование препаратов, обладающих доказанным эффектом в контексте снижения массы тела (семаглутид, лираглутид, агонисты глюкагоноподобного пептида-1, орлистат) [43].
• Согласно международным рекомендациям ESHRE (2023 г.), у пациенток с СПЯ в рамках индивидуальных предпочтений и комплексной терапии рекомендовано использование инозитола в связи с потенциальным положительным действием на метаболические нарушения [43]. Между тем, мио-инозитол – один из девяти стереоизомеров шестиатомного спирта инозитола. Патогенетическим обоснованием к использованию мио-инозитола при СПЯ служат резистентность к инсулину и ассоциированных с ней других метаболических дисфункций.
На сегодняшний день доказано, что мио-инозитол обладает рядом позитивных метаболических эффектов в контексте коррекции признаков СПЯ, что подтверждается результатами ряда исследований. В этой связи необходимо представить актуальное доказательное «досье» использования мио-инозитола в комплексной терапии СПЯ.
• Согласно результатам нового исследования P. Mellonie и соавт. (2024 г.), было выявлено, что использование мио-инозитола в течение 6 мес у 90 пациенток с СПЯ способствовало нормализации менструального цикла, снижению уровня ЛГ (с 10,31±7,92 до 7,42±6,25; р=0,002), соотношения ЛГ/фолликулостимулирующего гормона (ФСГ) (с 2,34±0,34 до 1,91±0,32; р<0,0001), уровня инсулина сыворотки крови (с 16,71±13,92 до 13,18±9,41; р=0,041) и выраженности инсулинорезистентности (от 4,52±1,34 до 2,74±1,28; р=0,041) [46].
• По данным исследования D. Greff и соавт. (2023 г.), было выявлено, что у пациенток на фоне использования мио-инозитола также отмечались регуляция менструального цикла, снижение ИМТ, уровней свободного и общего тестостерона, андростендиона, глюкозы и инсулина. Кроме того, было доказано, что мио-инозитол способствует индукции синтеза ГСПГ, снижая концентрацию свободных стероидов, купируя гиперандрогению и снижая потенциальные канцерогенные риски при СПЯ [47].
• Согласно исследованию A.S. Laganà и соавт. (2024 г.), доказано, что использование мио-инозитола у пациенток с СПЯ сопоставимо по эффективности с метформином, позволяет эффективно купировать признаки гиперандрогении, инсулинорезистентности и нарушения менструального цикла [48].
• Согласно результатам исследования P. Raj и соавт. (2024 г.), было показано, что мио-инозитол в контексте комплексного лечения СПЯ также имеет схожую с метформином клиническую эффективность. У пациенток после использования мио-инозитола отмечается значимое снижение ИМТ, уровня глюкозы и инсулина. Кроме того, у женщин наблюдалось значимое улучшение показателей липидного спектра, причем данный эффект более значимым оказался именно у мио-инозитола (p<0,0001). Интересно, что у 65% после комплексного лечения с использованием мио-инозитола отмечалась регуляция менструального цикла, а частота спонтанной беременности оказалась в 1,6 раза выше, в сравнении с метформином [49].
• Необходимо отметить результаты исследования отечественных коллег, включавшего 45 пациенток с верифицированным СПЯ. Было установлено, что использование мио-инозитола (Иноферт) способствовало значимому снижению уровней глюкозы и инсулина натощак, ИМТ, концентрации андростендиона, тестостерона и ЛГ (p<0,05 для всех показателей). Вместе с тем следует подчеркнуть, что у пациенток после терапии отмечалась нормализация соотношения ЛГ/ФСГ, купирование клинических признаков гиперандрогении, а также восстановление менструального цикла [50].
Таким образом, ведение пациенток с ГЭ без атипии на фоне СПЯ должно быть комплексным и направленным на все патогенетические механизмы указанных нозологий. Включение мио-инозитола (Иноферт или Иноферт Форте, ITALFARMACO) в комплексную терапию СПЯ перспективно для улучшения результатов лечения и купирования метаболических дисфункций.

При этом важно помнить, что, несмотря на отсутствие зарегистрированных показаний в действующей инструкции, данная группа препаратов используется в качестве терапии 1-й линии симптомов СПЯ, что отражено в отечественных и международных рекомендациях ESHRE [42, 43].
Использование КОК у женщин после лечения и достижения морфологического регресса ГЭ без атипии на фоне СПЯ является не только методом надежной контрацепции, но и эффективной/оправданной мерой в снижении частоты рецидивов болезни. Однако, за исключением доказанного противорецидивного и редуцирующего влияния КОК на признаки гиперандрогении, данная группа препаратов не позволяет достичь патогенетически значимых эндокринно-метаболических эффектов, именно поэтому крайне актуально использование мио-инозитола.
Выше мы отметили высокий терапевтический потенциал и патогенетическую обоснованность использования мио-инозитола в контексте лечения СПЯ и ассоциированной с ним ГЭ без атипии, вследствие чего возможно продолжение его использования и в отдаленном периоде. Однако в настоящее время появляется все большее количество данных, свидетельствующих о повышении распространенности резистентности к инозитолу у пациенток, проявляющейся замедлением восстановления нормальных паттернов менструальной функции и ослаблением гликемического контроля [54]. Согласно имеющимся данным, резистентность к использованию различных форм инозитола может затрагивать до 40% пациенток. Так, по данным
S. Gerli и соавт., использование мио-инозитола в течение 14 мес приводило к развитию резистентности у 30% пациенток [55]. Также, согласно результатам исследования Z. Kamenov и соавт., резистентность к мио-инозитолу затрагивала более 38% женщин [56]. В заключение необходимо отметить результаты исследования M. Iuorno и соавт., согласно которым использование D-хиро-инозитола в течение 6–8 нед приводило к развитию резистентности у 40% пациенток [57].
Необходимо резюмировать, что столь высокая частота резистентности к инозитолу у пациенток связана с рядом факторов, наиболее значимыми из которых являются: абсорбционная конкуренция с другими молекулами (глюкоза, сорбит и др.), лекарственными препаратами (статины, метформин, ингибиторы протонной помпы, β-адреноблокаторы, селективные ингибиторы обратного захвата серотонина), а также несоответствие дозы эффективным терапевтическим показателям (эффективная доза – 4 г порошка или 1200 мг в капсулах) [58–61]. В связи с тем, что нарушение всасывания независимо от причины является превалирующим фактором развития резистентности к инозитолу, то в данном контексте весьма актуально использование специфических индукторов абсорбции, одним из которых является альфа-лактальбумин. Данный белок хорошо известен с биологической точки зрения, поскольку именно он обусловливает основные полезные свойства молочной сыворотки. Данный биологически активный агент кроме усиления абсорбции обладает рядом других позитивных эффектов, включая иммуномодулирующий, антистрессовый, антибактериальный и противоязвенный [62]. Вместе с тем, по результатам имеющихся исследований, было показано, что использование альфа-лактальбумина позволяет повысить биодоступность мио-инозитола и его концентрацию в сыворотке крови на 32% и 30% соответственно [56, 62]. В исследовании другой степени доказательности также было установлено, что добавление альфа-лактальбумина к мио-инозитолу позволяет повысить сывороточную концентрацию последнего более чем в 2 раза, что способствует более эффективной регуляции овуляторной функции пациенток с СПЯ [63]. Аналогичные данные представлены в исследовании A.S. Laganà и соавт. (2024 г.), согласно которым сочетание альфа-лактальбумина с мио-инозитолом позволяет существенно повысить его биодоступность и эффективность терапии соответственно [48].
Таким образом, необходимо резюмировать, что использование мио-инозитола в сочетании с альфа-лактальбумином (Иноферт Форте, ITALFARMACO) у пациенток на фоне комплексной терапии СПЯ повышает результативность терапии и снижает частоту рецидивов.
Использование в комплексной терапии СПЯ мио-инозитола в сочетании с альфа-лактальбумином (Иноферт Форте, ITALFARMACO) патогенетически оправдано с позиции коррекции инсулинорезистентности и других метаболических дисфункций.
Между тем, согласно международным рекомендациям ESHRE (2023 г.), мио-инозитол следует рассматривать в рамках комплексной терапии СПЯ с имеющимися доказательствами эффективности в настоящее время. Следует помнить, что нормативный статус (доза) и контроль качества инозитола в любой форме могут отличаться – Иноферт Форте полностью соответствует вышеуказанным требованиям.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., зав. каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 25.03.2024
Поступила после рецензирования: 04.04.2024
Принята к публикации: 04.04.2024
Received: 25.03.2024
Revised: 01.04.2024
Accepted: 04.04.2024
Клинический разбор в общей медицине №3 2024
«Закольцованы судьбой». Канцерогенные риски у пациенток на фоне синдрома поликистозных яичников
Номера страниц в выпуске:54-62
Аннотация
Синдромом поликистозных яичников является доказанным фактором риска как гиперплазии, так и рака эндометрия. В статье отражена современная парадигма этиологии, патогенеза и менеджмента пациенток с гиперплазией эндометрия на фоне синдрома поликистозных яичников, по данным отечественной и зарубежной литературы.
Ключевые слова: гиперплазия эндометрия, синдром поликистозных яичников, рак эндометрия, гестагены, мио-инозитол.
Для цитирования: Оразов М.Р., Радзинский В.Е., Долгов Е.Д. «Закольцованы судьбой». Канцерогенные риски у пациенток на фоне синдрома поликистозных яичников. Клинический разбор в общей медицине. 2024; 5 (3): 54–62. DOI: 10.47407/kr2023.5.3.00374
Синдромом поликистозных яичников является доказанным фактором риска как гиперплазии, так и рака эндометрия. В статье отражена современная парадигма этиологии, патогенеза и менеджмента пациенток с гиперплазией эндометрия на фоне синдрома поликистозных яичников, по данным отечественной и зарубежной литературы.
Ключевые слова: гиперплазия эндометрия, синдром поликистозных яичников, рак эндометрия, гестагены, мио-инозитол.
Для цитирования: Оразов М.Р., Радзинский В.Е., Долгов Е.Д. «Закольцованы судьбой». Канцерогенные риски у пациенток на фоне синдрома поликистозных яичников. Клинический разбор в общей медицине. 2024; 5 (3): 54–62. DOI: 10.47407/kr2023.5.3.00374
"Ringed by fate". Carcinogenic risks in patients with polycystic ovary syndrome
Mekan R. Orazov, Viktor E. Radzinsky, Evgeny D. DolgovPatrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia
omekan@mail.ru
Abstract
Polycystic ovary syndrome is a proven risk factor for both endometrial hyperplasia and cancer. The article reflects the current paradigm of etiology, pathogenesis and management of patients with endometrial hyperplasia on the background of polycystic ovary syndrome, according to the data of domestic and foreign literature.
Keywords: endometrial hyperplasia, polycystic ovary syndrome, endometrial cancer, gestagens, myo-inositol.
For citation: Orazov M.R., Radzinsky V.E., Dolgov E.D. "Ringed by fate". Carcinogenic risks in patients with polycystic ovary syndrome. Clinical review for general practice. 2024; 5 (3): 54–62. (In Russ.). DOI: 10.47407/kr2023.5.3.00374
Актуальность проблемы
Долгие столетия величайшие художники и скульпторы воспевали в своих произведениях красоту женского тела. Весьма часто объектами искусства были женщины «пышнотелых» форм, которые раньше ассоциировались с крепким здоровьем и неиссякаемой способностью к деторождению. Например, в произведении отечественного импрессиониста Абрама Архипова 1919 г. «Женщина в красном» героиня картины предстает перед нами как воплощение молодости, здоровья, красоты: у нее широкая улыбка, яркий румянец на щеках. Кроме того, известный фразеологизм «кровь с молоком» был связан именно с этими дамами, вдохновляющими художников на великие свершения. Однако стремительное развитие медицины привело к понимаю того, что не всегда пышные формы – «про здоровье».За последнее столетие доказательная медицина совершила значимый скачок, позволив каждому клиницисту из разных уголков мира получить актуальные и самые современные знания. Благодаря этому мир увидел поразительное число научных исследований, демонстрирующих четкую ассоциацию между избыточной массой тела или ожирением и эндокринными/сердечно-сосудистыми заболеваниями. Ожирение и стеатоз печени, ожирение и сахарный диабет 2-го типа, ожирение и артериальная гипертензия, ожирение и нарушение мозгового кровообращения или инфаркт миокарда – этими заголовками буквально пестрят современные базы научных данных. В умах современных клиницистов и пациенток укоренились эти сочетания. Однако оказалось, что эти нозологические «коннекты» с общим знаменателем в виде ожирения – не предел.
На настоящий момент глобальная распространенность ожирения в наиболее экономически развитых странах растет в «геометрической прогрессии» с каждым днем. По состоянию на 2024 г., встречаемость женского ожирения в Российской Федерации достигает 31,4%, в Соединенных Штатах Америки – 42,7%, а в Австралии – 31,3%. При этом средний индекс массы тела (ИМТ) в данных регионах составляет 26,4 кг/м2, 28,9 кг/м2 и 26,7 кг/м2 соответственно [1]. Вместе с тем, согласно данным Всемирной организации здравоохранения, суммарная распространенность ожирения в мире достигла 60%, что характеризует его как пандемию XXI в. [2].
Прямым отражением тенденции стремительного повышения распространенности ожирения в мире послужило пропорциональное увеличение заболеваемости раком эндометрия (РЭ). В настоящее время РЭ «укрепил свои позиции» и «сместил» рак шейки матки на 3-е место в структуре заболеваемости злокачественными новообразованиями органов репродуктивной системы. По прогнозам Американского онкологического общества, в 2024 г. РЭ затронет около 67 тыс. женщин в США, а смертность от него достигнет 19% [3]. И в этой связи необходимо отметить ключевые предикторы развития РЭ, к которым относятся [4–6]:
• избыточная масса тела;
• ожирение;
• сахарный диабет 2-го типа;
• синдром поликистозных яичников (СПЯ);
• употребление алкоголя;
• курение;
• генетическая предрасположенность (синдром Линча);
• абсолютная или относительная гиперэстрогения.
Несмотря на все разнообразие факторов риска реализации РЭ, именно избыточная масса тела и ожирение являются «мажорными» индукторами реализации опухолевого процесса. Но вместе с тем не менее важным вопросом современной гинекологии является гиперплазия и канцерогенные риски эндометрия, возникшие на фоне СПЯ.
СПЯ и канцерогенные риски эндометрия: в свете доказательной медицины
Согласно классическим представлениям, СПЯ – это генетически и эпигенетически детерминированное полигенное эндокринное расстройство, сопровождающееся развитием признаков гиперандрогении, ановуляцией и поликистозной морфологией яичников по данным сонографии. По различным оценкам, СПЯ затрагивает от 6 до 21% пациенток подросткового и репродуктивного возраста [7]. Необходимо упомянуть, что патогенетический каскад реализации СПЯ является крайне сложным и не до конца изученным. При этом у пациенток с СПЯ отмечается экспоненциальное повышение рисков реализации гиперплазии и РЭ. Было доказано, что у пациенток с толщиной эндометрия >7 мм и СПЯ риск развития эндометриальной неоплазии достигает 8,7% [8, 9]. Аналогично данным, полученным выше, и шведские коллеги показали значимое повышение риска реализации РЭ у пациенток на фоне СПЯ (относительный риск 2,62; 95% доверительный интервал – ДИ 1,58–4,35) [10].Метаанализ, основанный на результатах рандомизированных клинических испытаний (B. Meczekalski и соавт., 2020 г.), продемонстрировал, что СПЯ напрямую связан с развитием именно РЭ, в отличие от других анатомических локализаций злокачественных опухолей органов репродуктивной системы (отношение шансов – ОШ 3,66; 95% ДИ 2,05–6,54, p<0,001) [11]. Небезынтересными оказались данные зарубежных коллег
J.E. Johnson и соавт. (2023 г.), показавшие, что у пациенток с верифицированным СПЯ риск развития РЭ повышается в 5 раз (ОШ 4,07; 95% ДИ 2,13–7,78, p<0,0001) [12].
В этой связи необходимо селективно рассмотреть факторы патогенеза СПЯ, связанные с развитием гиперплазии эндометрия (ГЭ) и РЭ соответственно.
СПЯ, инсулинорезистентность и ожирение
Важно отметить, что ГЭ, в частности атипическая, имеет те же реперные патогенетические точки, что и РЭ, за исключением наличия аномальной онкогенной пролиферации. В этой связи ключевыми патогенетическими предикторами развития ГЭ также являются ожирение и инсулинорезистентность. Эти факторы являются неотъемлемыми «спутниками» СПЯ и реализуют ряд важных механизмов. Доказано, что около 1/3 пациенток с СПЯ и гиперпролиферативными болезнями эндометрия имеют инсулинорезистентность. Необходимо отметить, что у пациенток с СПЯ-ассоциированной инсулинорезистентностью наблюдается ряд метаболических сдвигов и дисфункция жировой ткани. Согласно недавно проведенному исследованию F. Bril и соавт. (2024 г.), у пациенток с СПЯ отмечается нарушение процессов регуляции метаболизма в адипоцитах; гипоксия и гиперплазия жировой ткани; нарушение адипогенеза; изменение паттернов сигнальных путей инсулина и транспорта глюкозы. Причем, предполагается, что все эти нарушения провоцируются аномальной эпигенетической регуляцией, а также нарушением экспрессии ряда микро-РНК [13].Доказано, что у пациенток с СПЯ, инсулинорезистентностью и ожирением потенцируется риск развития атипической ГЭ за счет формирования аномальной воспалительной среды и опосредованной с ней прогестеронорезистентностью, снижением экспрессии гена PTEN, отмечаемой у 55% пациенток с верифицированным РЭ [14–19].
Вместе с тем следует подчеркнуть результаты исследования A. Kolano и соавт. (2024 г.), согласно которым было выявлено, что у пациенток с ожирением в связи с отмеченными эндокринно-метаболическими нарушениями адипозной ткани, повышение ИМТ пропорционально коррелирует с высоким кумулятивным риском смертности от РЭ (максимальный риск отмечается при ИМТ>40 кг/м2) [20].
СПЯ: гиперандрогенемия и гиперэстрогенизм во всех проявлениях
Классическим «спутником» СПЯ, являющимся одновременно его диагностическим критерием, остается гиперандрогенемия (клиническая и биохимическая) [21]. Повышенная секреция лютеинизирующего гормона способствует избыточной продукции метаболически активных андрогенов при участии ферментов – ароматаз, повышения активности тека-клеток и угнетения синтеза глобулина, связывающего половые гормоны (ГСПГ). В дальнейшем производные андростендиона могут подвергаться избыточной периферической конвертации в эстрогены в жировой ткани, что способствует развитию у пациентки гиперэстрогении, способствующей избыточной пролиферации эндометриальных клеток [22].Вторым по порядку, но не по значимости, патогенетическим компонентом реализации ГЭ является генетически-обусловленная относительная гиперэстрогения, возникающая вследствие развития резистентности эндометрия к прогестерону, что обусловлено следующими факторами:
• нарушение экспрессии индуцируемого митогеном гена 6 (MIG-6) и, соответственно, передачи по сигнальному пути прогестерона [23];
• снижение экспрессии гена HOXA10, что способствует развитию прогестеронорезистентности, снижению рецептивности эндометрия и его имплантационного потенциала [24, 25].
Необходимо отметить, что у пациенток на фоне ожирения может отмечаться снижение концентрации ГСПГ, из-за чего эстрогены переходят в «свободную» фракцию и способствуют развитию уже абсолютной гиперэстрогении с последующей активацией α-подтипа эстрогеновых рецепторов и реализацией митогенного и антиапоптотического эффектов. На все это накладывается способность самих адипоцитов секретировать эстрогены (так называемый внегонадный синтез), а избыточное развитие жировой клетчатки способствует потенцированию данного свойства [26].
Таким образом, необходимо резюмировать, что патогенетический каскад реализации ГЭ у пациенток с СПЯ является многосоставным и включает инсулинорезистентность и ассоциированные с ней эффекты, развитие прогестеронорезистентности из-за нарушения экспрессии ряда генов, а также абсолютной гиперэстрогении вследствие дисфункции жировой ткани. Исходя из сказанного, необходимо рассмотреть варианты лечения ГЭ у пациенток на фоне СПЯ, влияющие на ключевые стигмы патогенеза заболевания.
СПЯ, микробиом эндометрия и канцерогенные риски
Одним из самых инновационных вопросов современной медицины является изучение микробиома различных соматических локусов. Тенденции последних лет продемонстрировали чрезвычайную актуальность оценки изменений количества и качества микробиологических изменений в контексте ряда нозологий, что также нашло свое отражение в рутинной практике. Согласно имеющимся данным, нарушения микробиоценоза служат одной из ключевых клинических детерминант СПЯ (G. Cocomazzi и соавт., 2024 г.) [27]. В настоящее время наиболее интересным с точки зрения канцерогенных рисков эндометрия является изменение микробиоты полости матки. Важно отметить, что до недавнего времени общепринятая гипотеза о стерильности матки была опровергнута. Было доказано, что микробиота полости матки по качественному составу соотносится с таковой во влагалище (хотя и не во всем!) [28–30]. Между тем у пациенток с РЭ отмечаются выраженные изменения состава микробиома с выявлением «специфических» ассоциаций Firmicutes, Spirochaetes, Atopobium, Proteobacteria (Bacteroides и Porphyromonas) [31]. Было выявлено, что бактерии Atopobium и Porphyromonas могут напрямую способствовать повышению экспрессии ряда цитокинов – интерлейкина (ИЛ)-1α, ИЛ-1β, ИЛ-17α, фактора некроза опухоли α, что может потенцировать ключевые процессы онкогенеза в эндометрии на фоне персистирующего низкоинтенсивного воспаления. Кроме того, бактерии, в целом, как микробные представители обеспечивают энтерогепатическую рециркуляцию эстрогенов и продуцируют β-глюкуронидазу, участвующую в метаболизме/ конъюгации эстрогенов в активные формы [27].В контексте влияния дефектного микробиома на развитие РЭ у пациенток с СПЯ важно отметить, что возникает аналогичный/дополнительный эффект гиперэстрогенизма, только обеспечиваемый несколько иными механизмами. Кроме того, аномальная экспрессия провоспалительных цитокинов «по классике жанра» патофизиологии может индуцировать экспрессию антиапоптотических генов, что создает условия для реализации аномальной и непрогнозируемой пролиферации клеток эндометрия и служит триггером для канцерогенной трансформации.
Таким образом, необходимо резюмировать, что патогенетические взаимоотношения между СПЯ и гиперплазией или РЭ являются крайне сложными и еще не до конца изученными. Однако все же описанные реперные патогенетические стигмы в настоящее время не подвергаются сомнению в связи с четко выявленной ассоциацией между СПЯ и канцерогенными рисками. Исходя из этого, необходимо перейти к рассмотрению ключевого вопроса терапевтических стратегий ведения пациенток данной когорты и возможностей комплексной посттерапевтической профилактики возврата ГЭ
de novo.
Современные методы лечения ГЭ без атипии на фоне СПЯ
Основной парадигмой клинического менеджмента пациенток с ГЭ без атипии на фоне СПЯ, кроме купирования аномальных маточных кровотечений с использованием гестагенов, является профилактика канцерогенной трансформации. И здесь важно отметить, что «фармакологический карт-бланш» в руках клинициста имеется только в случае выявления у пациентки морфологических признаков ГЭ без атипии. При этом, согласно действующим отечественным рекомендациям, при выявлении атипической ГЭ у женщин с реализованной репродуктивной функцией основным методом лечения является – гистерэктомия. Вместе с тем у пациенток, страдающих бесплодием, либо же, в случае если женщина крайне заинтересована в ближайшее время в реализации репродуктивной функции, с целью определения окончательной тактики ведения целесообразна консультация онколога [32].• Согласно действующим отечественным рекомендациям, у пациенток с верифицированной ГЭ без атипии терапией 1-й линии является использование левоноргестрел-выделяющей внутриматочной системы (ЛНГ-ВМС), обладающей высоким терапевтическим потенциалом и способствующей морфологическому регрессу ГЭ у 90–100% пациенток [32–35].
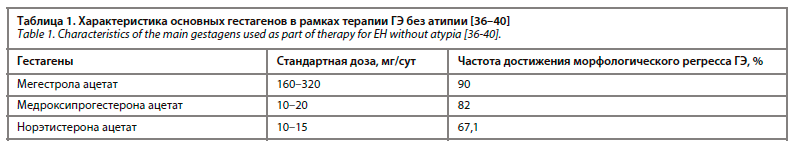
• При наличии противопоказаний к использованию ЛНГ-ВМС пациенткам с ГЭ без атипии возможно назначение пероральных гестагенов, также способствующие достижению высокой частоты морфологического регресса [32]. Наиболее распространенные гестагены и их эффективность достижения морфологического регресса в рамках лечения ГЭ без атипии рассмотрены в табл. 1.

Необходимо отметить, что длительность терапии независимо от типа гестагена (локальные или пероральные) ГЭ без атипии должна составлять не менее 6 мес с последующим морфологическим контролем эффективности лечения, что позволяет улучшить потенциальные терапевтические исходы и снижает частоту рецидивов [32]. При отсутствии морфологического регресса ГЭ необходим повторный курс терапии гестагенами в течение 6 мес, однако при повторной неудаче и/или рецидивирующем течении болезни необходимо рассмотреть вопрос о хирургическом лечении [41].
• Согласно действующим отечественным клиническим рекомендациям, у пациенток с ГЭ без атипии в сочетании с эндометриозом и/или миомой матки возможно назначение агонистов гонадотропного рилизинг-гормона. Однако при использовании данной группы препаратов необходимо помнить о возможном развитии гипоэстрогении и других нежелательных явлений через 3 и более месяцев лечения [32].
После достижения морфологического регресса ГЭ без атипии следующим компонентом терапии пациенток рассматриваемой когорты является лечение СПЯ: устранение проявлений андрогензависимой дерматопатии, нормализация массы тела и коррекция метаболических нарушений, регуляция менструального цикла для профилактики ГЭ, восстановление овуляторного менструального цикла и фертильности, предупреждение поздних осложнений. В рамках индивидуализации терапии (с учетом жалоб, репродуктивных установок, наличия риска сердечно-сосудистых заболеваний и прочих факторов) в действующих отечественных рекомендациях указывается использование комбинированных оральных контрацептивов (КОК). Метформин и другие фармакологические препараты при СПЯ являются off-label (без официальных показаний в инструкции), однако имеется множество исследований, подтверждающих их эффективность. При этом с уровнем высокой степени доказательности (В-I) в качестве терапии 1-й линии СПЯ (нарушения менструального цикла, симптомы гиперандрогении: гирсутизм и акне) рекомендуется использование КОК. Следует помнить, что эффективность КОК прежде всего обусловлена подавлением секреции лютеинизирующего гормона (ЛГ), что приводит к снижению продукции овариальных андрогенов, а также эстрогенный компонент способствует повышению уровней ГСПГ, что, в свою очередь, снижает уровень свободно циркулирующего тестостерона; прогестин в составе КОК может осуществлять конкурентное взаимодействие с 5α-редуктазой на уровне рецепторов к андрогенам. Одним из них, который полностью соответствует критериям для эффективного использования при СПЯ, является КОК на основе 30 мкг этинилэстрадиола и 2 мг хлормадинона ацетата.
Достоинства хлормадинона ацетата заключаются не только в том, что этот прогестин является производным натурального прогестерона, но и также в том, что это единственный из прогестинов с антиандрогеновыми эффектами, с доказанным профилем безопасности (тромботические и другие риски) в долгосрочной перспективе.
Но вместе с тем необходимо селективно рассмотреть и другие актуальные рекомендации по коррекции СПЯ в сочетании с ГЭ.
• Согласно отечественным (2021 г.) и международным рекомендациям ESHRE (2023 г.), всем пациенткам с СПЯ необходима модификация образа жизни, включая регулярное выполнение физических упражнений, правильное питание и снижение массы тела [42, 43]. Необходимо отметить, что снижение массы тела – основной компонент лечения СПЯ. Эффективность снижения массы тела в контексте профилактики канцерогенных рисков также является крайне высокой. Так, согласно имеющимся новым данным (2024 г.), целенаправленное снижение массы тела всего лишь на 5% в течение 3 лет связано со снижением риска заболеваемости РЭ на 39% (95% ДИ 12–58%) [44].
• Согласно последним международным рекомендациям ESHRE (2023 г.) у пациенток с СПЯ и ИМТ≥25 кг/м2 возможно использование метформина с учетом антропометрических и метаболических показателей, включая инсулинорезистентность, уровень глюкозы и липидный профиль. Следует помнить, что метформин, как и другие лекарственные средства, как правило, не имеют официальных показаний для лечения СПЯ (препараты off-label). Однако, по имеющимся данным, назначение метформина возможно и в когорте пациенток с ИМТ<25 кг/м2, но их уровень доказательности остается ограниченным [43]. Метформин обладает доказанными гипогликемическим, антиинсулинорезистентным и гипоинсулинемическим эффектами. Кроме того, использование данного препарата крайне актуально у пациенток с сахарным диабетом 2-го типа на фоне СПЯ, поскольку у них отмечается значимое снижение массы тела на фоне его приема [45]. Следует помнить, что, несмотря на убедительную доказательную базу эффективности метформина в комплексной коррекции репродуктивной дисфункции и метаболических нарушений у пациенток с СПЯ, нередко возникают побочные эффекты (дефицит витамина В12, тошнота, рвота, диарея, нейропатия и другие гастроинтестинальные расстройства). Все вышеизложенное определяет острую необходимость и перспективность разработки инновационных подходов к комплексной терапии метаболических расстройств при СПЯ, с минимальной/ низкой частотой нежелательных явлений.
• Согласно международным рекомендациям ESHRE (2023 г.), у пациенток с СПЯ, инсулинорезистентностью и ожирением возможно использование препаратов, обладающих доказанным эффектом в контексте снижения массы тела (семаглутид, лираглутид, агонисты глюкагоноподобного пептида-1, орлистат) [43].
• Согласно международным рекомендациям ESHRE (2023 г.), у пациенток с СПЯ в рамках индивидуальных предпочтений и комплексной терапии рекомендовано использование инозитола в связи с потенциальным положительным действием на метаболические нарушения [43]. Между тем, мио-инозитол – один из девяти стереоизомеров шестиатомного спирта инозитола. Патогенетическим обоснованием к использованию мио-инозитола при СПЯ служат резистентность к инсулину и ассоциированных с ней других метаболических дисфункций.
На сегодняшний день доказано, что мио-инозитол обладает рядом позитивных метаболических эффектов в контексте коррекции признаков СПЯ, что подтверждается результатами ряда исследований. В этой связи необходимо представить актуальное доказательное «досье» использования мио-инозитола в комплексной терапии СПЯ.
• Согласно результатам нового исследования P. Mellonie и соавт. (2024 г.), было выявлено, что использование мио-инозитола в течение 6 мес у 90 пациенток с СПЯ способствовало нормализации менструального цикла, снижению уровня ЛГ (с 10,31±7,92 до 7,42±6,25; р=0,002), соотношения ЛГ/фолликулостимулирующего гормона (ФСГ) (с 2,34±0,34 до 1,91±0,32; р<0,0001), уровня инсулина сыворотки крови (с 16,71±13,92 до 13,18±9,41; р=0,041) и выраженности инсулинорезистентности (от 4,52±1,34 до 2,74±1,28; р=0,041) [46].
• По данным исследования D. Greff и соавт. (2023 г.), было выявлено, что у пациенток на фоне использования мио-инозитола также отмечались регуляция менструального цикла, снижение ИМТ, уровней свободного и общего тестостерона, андростендиона, глюкозы и инсулина. Кроме того, было доказано, что мио-инозитол способствует индукции синтеза ГСПГ, снижая концентрацию свободных стероидов, купируя гиперандрогению и снижая потенциальные канцерогенные риски при СПЯ [47].
• Согласно исследованию A.S. Laganà и соавт. (2024 г.), доказано, что использование мио-инозитола у пациенток с СПЯ сопоставимо по эффективности с метформином, позволяет эффективно купировать признаки гиперандрогении, инсулинорезистентности и нарушения менструального цикла [48].
• Согласно результатам исследования P. Raj и соавт. (2024 г.), было показано, что мио-инозитол в контексте комплексного лечения СПЯ также имеет схожую с метформином клиническую эффективность. У пациенток после использования мио-инозитола отмечается значимое снижение ИМТ, уровня глюкозы и инсулина. Кроме того, у женщин наблюдалось значимое улучшение показателей липидного спектра, причем данный эффект более значимым оказался именно у мио-инозитола (p<0,0001). Интересно, что у 65% после комплексного лечения с использованием мио-инозитола отмечалась регуляция менструального цикла, а частота спонтанной беременности оказалась в 1,6 раза выше, в сравнении с метформином [49].
• Необходимо отметить результаты исследования отечественных коллег, включавшего 45 пациенток с верифицированным СПЯ. Было установлено, что использование мио-инозитола (Иноферт) способствовало значимому снижению уровней глюкозы и инсулина натощак, ИМТ, концентрации андростендиона, тестостерона и ЛГ (p<0,05 для всех показателей). Вместе с тем следует подчеркнуть, что у пациенток после терапии отмечалась нормализация соотношения ЛГ/ФСГ, купирование клинических признаков гиперандрогении, а также восстановление менструального цикла [50].
Таким образом, ведение пациенток с ГЭ без атипии на фоне СПЯ должно быть комплексным и направленным на все патогенетические механизмы указанных нозологий. Включение мио-инозитола (Иноферт или Иноферт Форте, ITALFARMACO) в комплексную терапию СПЯ перспективно для улучшения результатов лечения и купирования метаболических дисфункций.
Противорецидивные технологии в профилактике ГЭ без атипии: реалии и перспективы
Важно упомянуть, что ведение пациенток после достижения морфологического регресса ГЭ без атипии на фоне СПЯ также должно быть комплексным. Весьма удачным вариантом профилактики рецидивов неатипической ГЭ для пациенток, нуждающихся в контрацепции, является использование КОК, что доказано рядом международных исследований (табл. 2).
При этом важно помнить, что, несмотря на отсутствие зарегистрированных показаний в действующей инструкции, данная группа препаратов используется в качестве терапии 1-й линии симптомов СПЯ, что отражено в отечественных и международных рекомендациях ESHRE [42, 43].
Использование КОК у женщин после лечения и достижения морфологического регресса ГЭ без атипии на фоне СПЯ является не только методом надежной контрацепции, но и эффективной/оправданной мерой в снижении частоты рецидивов болезни. Однако, за исключением доказанного противорецидивного и редуцирующего влияния КОК на признаки гиперандрогении, данная группа препаратов не позволяет достичь патогенетически значимых эндокринно-метаболических эффектов, именно поэтому крайне актуально использование мио-инозитола.
Выше мы отметили высокий терапевтический потенциал и патогенетическую обоснованность использования мио-инозитола в контексте лечения СПЯ и ассоциированной с ним ГЭ без атипии, вследствие чего возможно продолжение его использования и в отдаленном периоде. Однако в настоящее время появляется все большее количество данных, свидетельствующих о повышении распространенности резистентности к инозитолу у пациенток, проявляющейся замедлением восстановления нормальных паттернов менструальной функции и ослаблением гликемического контроля [54]. Согласно имеющимся данным, резистентность к использованию различных форм инозитола может затрагивать до 40% пациенток. Так, по данным
S. Gerli и соавт., использование мио-инозитола в течение 14 мес приводило к развитию резистентности у 30% пациенток [55]. Также, согласно результатам исследования Z. Kamenov и соавт., резистентность к мио-инозитолу затрагивала более 38% женщин [56]. В заключение необходимо отметить результаты исследования M. Iuorno и соавт., согласно которым использование D-хиро-инозитола в течение 6–8 нед приводило к развитию резистентности у 40% пациенток [57].
Необходимо резюмировать, что столь высокая частота резистентности к инозитолу у пациенток связана с рядом факторов, наиболее значимыми из которых являются: абсорбционная конкуренция с другими молекулами (глюкоза, сорбит и др.), лекарственными препаратами (статины, метформин, ингибиторы протонной помпы, β-адреноблокаторы, селективные ингибиторы обратного захвата серотонина), а также несоответствие дозы эффективным терапевтическим показателям (эффективная доза – 4 г порошка или 1200 мг в капсулах) [58–61]. В связи с тем, что нарушение всасывания независимо от причины является превалирующим фактором развития резистентности к инозитолу, то в данном контексте весьма актуально использование специфических индукторов абсорбции, одним из которых является альфа-лактальбумин. Данный белок хорошо известен с биологической точки зрения, поскольку именно он обусловливает основные полезные свойства молочной сыворотки. Данный биологически активный агент кроме усиления абсорбции обладает рядом других позитивных эффектов, включая иммуномодулирующий, антистрессовый, антибактериальный и противоязвенный [62]. Вместе с тем, по результатам имеющихся исследований, было показано, что использование альфа-лактальбумина позволяет повысить биодоступность мио-инозитола и его концентрацию в сыворотке крови на 32% и 30% соответственно [56, 62]. В исследовании другой степени доказательности также было установлено, что добавление альфа-лактальбумина к мио-инозитолу позволяет повысить сывороточную концентрацию последнего более чем в 2 раза, что способствует более эффективной регуляции овуляторной функции пациенток с СПЯ [63]. Аналогичные данные представлены в исследовании A.S. Laganà и соавт. (2024 г.), согласно которым сочетание альфа-лактальбумина с мио-инозитолом позволяет существенно повысить его биодоступность и эффективность терапии соответственно [48].
Таким образом, необходимо резюмировать, что использование мио-инозитола в сочетании с альфа-лактальбумином (Иноферт Форте, ITALFARMACO) у пациенток на фоне комплексной терапии СПЯ повышает результативность терапии и снижает частоту рецидивов.
Заключение
В заключение необходимо отметить, что ГЭ и СПЯ с патогенетической точки зрения являются нозологиями «закольцованными судьбой» с высокими канцерогенными рисками. Несмотря на высокую эффективность гормональной терапии при СПЯ, перспективны средства, повышающие чувствительность к инсулину, снижающие секрецию инсулина и андрогенов.Использование в комплексной терапии СПЯ мио-инозитола в сочетании с альфа-лактальбумином (Иноферт Форте, ITALFARMACO) патогенетически оправдано с позиции коррекции инсулинорезистентности и других метаболических дисфункций.
Между тем, согласно международным рекомендациям ESHRE (2023 г.), мио-инозитол следует рассматривать в рамках комплексной терапии СПЯ с имеющимися доказательствами эффективности в настоящее время. Следует помнить, что нормативный статус (доза) и контроль качества инозитола в любой форме могут отличаться – Иноферт Форте полностью соответствует вышеуказанным требованиям.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., зав. каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 25.03.2024
Поступила после рецензирования: 04.04.2024
Принята к публикации: 04.04.2024
Received: 25.03.2024
Revised: 01.04.2024
Accepted: 04.04.2024
Список исп. литературыСкрыть список1. Obesity Rates by Country 2024. [Electronic resource]. URL: https://worldpopulationreview.com/country-rankings/obesity-rates-by-country
2. Boutari C, Mantzoros CS. A 2022 update on the epidemiology of obesity and a call to action: as its twin COVID-19 pandemic appears to be receding, the obesity and dysmetabolism pandemic continues to rage on. Metabolism. 2022;133:155217. DOI: 10.1016/j.metabol.2022.155217
3. Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024. CA Cancer J Clin. 2024;74(1):12-49. DOI: 10.3322/caac.21820. Epub 2024 Jan 17. Erratum in: CA Cancer J Clin. 2024;74(2):203. PMID: 38230766.
4. Kokts-Porietis RL et al. Prospective cohort of pre-and post-diagnosis alcohol consumption and cigarette smoking on survival outcomes: an Alberta Endometrial Cancer Cohort Study. Cancer Causes & Control. 2024;35(1):121-32.
5. Lee-may Chen et al. Endometrial carcinoma: Epidemiology, risk factors, and prevention. UpToDate. 2024;Feb 16.
6. Power RF et al. Modifiable Risk Factors and Risk of Colorectal and Endometrial Cancers in Lynch Syndrome: A Systematic Review and Meta-Analysis. JCO Precision Oncology. 2024;8:e2300196.
7. Witchel SF, Oberfield SE, Peña AS. Polycystic ovary syndrome: pathophysiology, presentation, and treatment with emphasis on adolescent girls. Journal of the Endocrine Society. 2019;3(8):1545-73.
8. Fearnley EJ, Marquart L, Spurdle AB, Weinstein P et al. Polycystic ovary syndrome increases the risk of endometrial cancer in women aged less than 50 years: an Australian case-control study. Cancer Causes Control. 2010;21(12):2303-8
9. Indhavivadhana S, Rattanachaiyanont M, Wongwananuruk T et al. Endometrial neoplasia in reproductive-aged Thai women with polycystic ovary syndrome. Int J Gynecol Obstet. 2018;142(2):170-5.
10. Yin W, Falconer H, Yin L et al. Association between polycystic ovary syndrome and cancer risk. JAMA Oncol. 2019;5(1):106-7.
11. Meczekalski B, Perez-Roncero GR, Lopez-Baena MT et al. The polycystic ovary syndrome and gynecological cancer risk. Gynecol Endocrinol. 2020;36(4):289-93.
12. Johnson JE, Daley D, Tarta C, Stanciu PI. Risk of endometrial cancer in patients with polycystic ovarian syndrome: A meta-analysis. Oncology Letters. 2023;25(4):1-9.
13. Bril F, Ezeh U, Amiri M et al. Adipose tissue dysfunction in polycystic ovary syndrome. J Clin Endocrinol Metab. 2024;109(1):10-24.
14. Patel BG, Rudnicki M, Yu J et al. Progesterone resistance in endometriosis: origins, consequences and interventions. Acta Obstet Gynecol Scand. 2017;96:623-32. DOI: 10.1111/aogs.13156
15. Fernandez-Montoli M-E, Sabadell J, Contreras-Perez N-A. Fertility-sparing treatment for atypical endometrial hyperplasia and endometrial cancer: a cochrane systematic review protocol. Adv Ther. 2021;38:2717-31. DOI: 10.1007/s12325-021-01693-y
16. Kliemann N, Viallon V, Murphy N et al. Metabolic signatures of greater body size and their associations with risk of colorectal and endometrial cancers in the European prospective investigation into cancer and nutrition. BMC Med. 2021;19:101. DOI: 10.1186/s12916-021-01970-1
17. Yang HP, Meeker A, Guido R et al. PTEN expression in benign human endometrial tissue and cancer in relation to endometrial cancer risk factors. Cancer Causes Control. 2015.26:, 1729-36. DOI: 10.1007/s10552-015-0666-5
18. Lv Q, Xie L, Cheng Y et al. A20-mediated deubiquitination of ERα in the microenvironment of CD163+ macrophages sensitizes endometrial cancer cells to estrogen. Cancer Lett. 2019;442:137-47. DOI: 10.1016/j.canlet.2018.10.019
19. Byrne FL, Martin AR, Kosasih M et al. The role of hyperglycemia in endometrial cancer pathogenesis. Cancers. 2020;12:1191. DOI: 10.3390/cancers12051191
20. Kolano A, Pejas A, Markowiak S et al. The Impact of Obesity on Endometrial Cancer: A Comprehensive Analysis. J Education Health Sport. 2024;51:179-97.
21. Wal A et al. Role of inflammation, oxidative stress, and angiogenesis in polycystic ovary syndrome (PCOS): Current perspectives. Targeting Angiogenesis, Inflammation, and Oxidative Stress in Chronic Diseases. 2024:459-85. DOI: 10.1016/B978-0-443-13587-3.00018-7
22. Dadachanji R, Shaikh N, Mukherjee S. Genetic variants associated with hyperandrogenemia in PCOS pathophysiology. Genetics Research International. 2018. DOI: 10.1155/2018/7624932
23. Yoo J-Y, Kang H-B, Broaddus RR et al. MIG-6 suppresses endometrial epithelial cell proliferation by inhibiting phospho-AKT. BMC Cancer. 2018;18:605. DOI: 10.1186/s12885-018-4502-7
24. Kara M, Ozcan SS, Aran T et al. Evaluation of endometrial receptivity by measuring HOXA-10, HOXA-11, and leukemia inhibitory factor expression in patients with polycystic ovary syndrome. Gynecology and minimally invasive therapy. 2019;8(3):118-22.
25. He B, Ni Z-L, Kong S-B et al. Homeobox genes for embryo implantation: from mouse to human. Animal Models Exp Med. 2018;1:14-22. DOI: 10.1002/ame2.12002
26. Оразов М.Р., Радзинский В.Е., Хамошина М.Б. и др. Metabesity – патогенетические основы и возможности предикции. Гинекология. 2023;25(4). DOI: 10.26442/20795696.2023.4.202520
Orazov M.R., Radzinsky V.E., Khamoshina M.B. et al. Metabesity – pathogenetic foundations and possibilities of prediction. Gynecology. 2023;25(4). DOI: 10.26442/20795696.2023.4.202520 (in Russian).
27. Cocomazzi G, Del Pup L, Contu V et al. Gynecological Cancers and Microbiota Dynamics: Insights into Pathogenesis and Therapy. Int J Molecular Sciences. 2024;25(4);2237.
28. Mitchell CM, Haick A, Nkwopara E et al. Colonization of the upper genital tract by vaginal bacterial species in nonpregnant women. Am J Obstetric Gyn. 2015;212(5):611-e1.
29. Moreno I, Codoñer FM, Vilella F et al. Evidence that the endometrial microbiota has an effect on implantation success or failure. Am J Obstetric Gyn. 2016;215(6):684-703.
30. Carosso A, Revelli A, Gennarelli G. Controlled ovarian stimulation and progesterone supplementation affect vaginal and endometrial microbiota in IVF cycles: a pilot study. J Assist Reproduct Gen. 2020;37:2315-26.
31. Walther-António MR, Chen J, Multinu F et al. Potential contribution of the uterine microbiome in the development of endometrial cancer. Genome Med. 2016;8:122.
32. Гиперплазия эндометрия. Федеральные клинические рекомендации. М., 2021.
Endometrial hyperplasia. Federal Clinical Guidelines. Moscow, 2021 (in Russian).
33. Classification and Management of Endometrial Hyperplasia. Erratum to Guideline No. 390. Journal of Obstetrics and Gynaecology Canada. 2019;42(10):1789-1800.
34. Singh G, Puckett Y. Endometrial Hyperplasia. [Updated 2023 Jul 17]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing, 2023. URL: https://www.ncbi.nlm.nih.gov/books/NBK560693/
35. Chandra V, Kim JJ, Benbrook et al. Therapeutic options for management of endometrial hyperplasia. J Gynecol Oncol. 2016;27(1).
36. Nooh AM, Abdeldayem HM, Girbash EF. Depo-Provera versus norethisterone acetate in management of endometrial hyperplasia without atypia. Reproductive Sciences. 2016;23(4):448-54.
37. Vereide AB, Arnes M, Straume B et al. Nuclear morphometric changes and therapy monitoring in patients with endometrial hyperplasia: a study comparing effects of intrauterine levonorgestrel and systemic medroxyprogesterone. Gynecol Oncol. 2003; 91:526-33.
38. Güven M, Dikmen Y, Terek MC et al. Metabolic effects associated with high-dose continuous megestrol acetate administration in the treatment of endometrial pathology. Arch Gynecol Obstet. 2001; 265:183-6.
39. Gal D, Edman CD, Vellios F, Forney JP. Long-term effect of megestrol acetate in the treatment of endometrial hyperplasia. Am J Obstet Gynecol. 1983;146:316-22.
40. Brun JL, Belaisch J, Rivel J, Hocké C. Endometrial hyperplasias resistant to progestins: alternatives to traditional treatments. Gynecol Obstet Fertil. 2002;30:244-51.
41. Оразов М.Р., Радзинский В.Е., Хамошина М.Б. и др. Рецидивирующая гиперплазия эндометрия без атипии: как не попасть в порочный круг? Клинический разбор в общей медицине. 2023;4(9):21-30. DOI: 10.47407/kr2023.4.9.00324
Orazov M.R., Radzinsky V.E., Khamoshina M.B. et al. Recurrent endometrial hyperplasia without atypia: how to avoid falling into a vicious circle? Clinical review for general practice. 2023;4(9):21-30. DOI: 10.47407/kr2023.4.9.00324 (in Russian).
42. Синдром поликистоза яичников. Федеральные клинические рекомендации. М., 2021.
Polycystic ovarian syndrome. Federal Clinical Guidelines. Moscow, 2021 (in Russian).
43. International evidence-based guideline for the assessment and management of polycystic ovary syndrome (PCOS). ESHRE, 2023.
44. Baker-Rand H, Kitson SJ. Recent Advances in Endometrial Cancer Prevention, Early Diagnosis and Treatment. Cancers. 2024;16(5):1028.
45. Lv Z, Guo Y. Metformin and its benefits for various diseases. Frontiers in endocrinology. 2020;11:490991.
46. Mellonie P, Manivannan A, Thangaraj P, Logeswari BM. The Effectiveness of Myo-Inositol in Women With Polycystic Ovary Syndrome: A Prospective Clinical Study. Cureus. 2024;16(2).
47. Greff D, Juhász AE, Váncsa S et al. Inositol is an effective and safe treatment in polycystic ovary syndrome: A systematic review and meta-analysis of randomized controlled trials. Reproductive Biology and Endocrinology. 2023;21(1):10.
48. Laganà AS, Myers, SH, Forte G et al. Inositols in treating polycystic ovary syndrome and non-insulin dependent diabetes mellitus: now and the future. Expert Opinion on Drug Metabolism & Toxicology. 2024:1-12.
49. Raj P, Samal, S, Chandrasekaran S et al. Comparison of Metformin and Myoinositol on Clinical, Hormonal and Metabolic Profile of Patients with Polycystic Ovarian Syndrome: An Open-label Randomised Clinical Trial. Journal of Clinical & Diagnostic Research. 2024;18(1).
50. Хурасева А.Б., Святченко К.С., Медведева И.Н. Новые возможности в лечении синдрома поликистозных яичников. Медицинский алфавит. 2022;(4):27-30.
Khuraseva A.B., Svyatchenko K.S., Medvedeva I.N. New possibilities in the treatment of polycystic ovary syndrome. Medical Alphabet. 2022;(4):27-30 (in Russian).
51. Iversen L, Fielding S, Lidegaard Ø, Hannaford PC. Contemporary hormonal contraception and risk of endometrial cancer in women younger than age 50: a retrospective cohort study of Danish women. Contraception. 2020;102(3):152-8.
52. He Y, Wang J, Wang Y et al. Maintenance Therapy Can Improve the Oncologic Prognosis and Obstetrical Outcome of Patients With Atypical Endometrial Hyperplasia and Endometrial Cancer After Fertility-Preserving Treatment: A Multicenter Retrospective Study. Frontiers in Oncology. 2021;11:808881.
53. Wang Y, Nisenblat V, Tao L et al. Combined estrogen-progestin pill is a safe and effective option for endometrial hyperplasia without atypia: a three-year single center experience. J Gynecol Oncol. 2019;30(3).
54. Montanino Oliva M et al. Effects of myo-inositol plus alpha-lactalbumin in myo-inositol-resistant PCOS women. J Ovarian Res. 2018;11: 38. DOI: 10.1186/s13048-018-0411-2
55. Gerli S, Papaleo E, Ferrari A, Di Renzo GC. Randomized, double blind placebo-controlled trial: effects of myo-inositol on ovarian function and metabolic factors in women with PCOS. Eur Rev Med Pharmacol Sci. 2007;11(5):347-54.
56. Kamenov Z, Kolarov G, Gateva A et al. Ovulation induction with myo-inositol alone and in combination with clomiphene citrate in polycystic ovarian syndrome patients with insulin resistance. Gynecol Endocrinol. 2015;31(2):131-5
57. Iuorno M, Jakubowicz D, Baillargeon J-P et al. Effects of d-chiro-inositol in lean women with the polycystic ovary syndrome. Endocr Pract. 2002 Nov-Dec;8(6):417-23. DOI: 10.4158/EP.8.6.417
58. Garzon S, Laganà AS, Monastra G. Risk of reduced intestinal absorption of myo-inositol caused by D-chiro-inositol or by glucose transporter inhibitors. Expert Opinion on Drug Metabolism & Toxicology. 2019. DOI: 10.1080/17425255.2019.1651839
59. Lepore E, Lauretta R, Bianchini M et al. Inositols Depletion and Resistance: Principal Mechanisms and Therapeutic Strategies. Int J Mol Sci. 2021;22:6796. DOI: 10.3390/ijms22136796
60. Carlomagno G, Unfer V. Inositol safety: Clinical evidences. Eur Rev Med Pharm Sci. 2011;15:931-6.
61. Lepore E, Lauretta R, Bianchini M et al. Inositols depletion and resistance: Principal mechanisms and therapeutic strategies. Int J Molecular Sciences. 2021;22(13):6796.
62. Monastra G, Sambuy Y, Ferruzza S et al. Alpha-lactalbumin Effect on Myo-inositol Intestinal Absorption: In vivo and In vitro. Curr Drug Deliv. 2018;15(9):1305-11.
63. Montanino Oliva M et al. Effects of myo-inositol plus alpha-lactalbumin in myo-inositol-resistant PCOS women. J Ovarian Res. 2018;11:38. DOI: 10.1186/s13048-018-0411-2


