Клинический разбор в общей медицине №3 2024
1 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Tsyba Medical Radiological Research Center – branch of the National Medical Research Center for Radiology, Obninsk, Russia
omekan@mail.ru
Abstract
Regenerative medicine remains the most rapidly growing and innovative branch of modern medicine. The key substrate of tissue regeneration is the stem cell, which has various differentiation pathways and is the source for various tissue morphotypes. In this regard, the medical community has asked a legitimate question about the potential of using stem cells for the treatment of various nosologies, including gynaecological ones. One of the most interesting, progressive and convenient methods of regenerative medicine is the use of microfragmented stromal-vascular fraction of autologous adipose tissue. On this basis, it is necessary to understand the molecular-biological features of this substance and evaluate its potential within the framework of correction of various gynaecological diseases.
Keywords: regenerative medicine, microfragmented stromal-vascular fraction, adipose tissue, stem cells.
For citation: Orazov M.R., Radzinsky V.E., Kiseleva M.V., Dolgov E.D. Regenerative medicine at the equator of women's health and quality of life: the role of microfragmented stromal-vascular fraction of adipose tissue in modern regenerative medicine. Clinical review for general practice. 2024; 5 (3): 68–73. (In Russ.). DOI: 10.47407/kr2023.5.3.00382
Согласно общепринятому определению, регенеративная медицина – это междисциплинарный раздел современной медицинской науки, изучающий методы медико-биологической инженерии с целью регенерации различных типов тканей [1]. Между тем регенерация (восстановление) – способность живых организмов со временем восстанавливать поврежденные ткани.
Виды регенерации [1]: физиологическая, репаративная, патологическая.
Физиологическая регенерация предусматривает процессы восстановления и обновления в каждом организме на протяжении всей его жизни, а репаративной называют регенерацию, происходящую после повреждения или утраты какой-либо части тела.
Ключевым механизмом тканевой регенерации является активная пролиферация клеток-предшественниц, активируемая вследствие альтерации. Благодаря ряду революционных открытий стало очевидно, что главным субстратом тканевой регенерации и регенеративной медицины является стволовая клетка. Стремительное развитие цитологии привело нас к пониманию того, что каждая зрелая клетка нашего организма является дочерней и развивается из целой цепочки так называемых прогениторных клеток, обладающих различным потенциалом мультипотентности (каждая новая клеточная популяция имеет более ограниченный потенциал относительно предыдущей генерации). Однако «вершиной» этой цепочки является стволовая клетка-предшественница, обладающая высоким пролиферативным, регенераторным и молекулярно-биологическим потенциалом [2]. Открытие этих свойств стволовых клеток создало ряд перспектив перед медицинским сообществом: от возможности выращивания отдельных тканей и органов с целью дальнейшей трансплантации до регенерации поврежденных тканей in situ. И в этой связи стало совершенно очевидно, что регенеративная медицина является всеобъемлющей и охватывает все медицинские специальности.
На сегодняшний день в мире активно используется микрофрагментированная стромально-васкулярная фракция (СВФ) адипозной ткани с целью регенерации тканей in situ. За последнее время терапия СВФ широко зарекомендовала себя в самых различных областях медицины и, конечно же, «не обошла стороной» современную гинекологию. Огромный спектр позитивных молекулярно-биологических эффектов данной субстанции и простота ее выделения характеризует ее как наилучшего «кандидата» для патогенетически оправданной регенеративной коррекции ряда гинекологических нозологий.
Исходя из сказанного, важно отметить, что целью данной статьи является освещение крайне актуального и вместе с тем не менее инновационного вопроса о месте терапии микрофрагментированной СВФ в современной гинекологии.
обусловливающих ее высокий регенераторный потенциал. Ключевой особенностью СВФ является полная синергичность молекулярно-биологических эффектов со стороны всех ее составляющих, что обусловливает ее высокую эффективность и универсальность для использования в самых различных сферах медицины [3]. На сегодняшний момент доказано, что микрофрагментированная СВФ обладает:
• выраженным регенераторным эффектом;
• проангиогенным эффектом;
• противовоспалительным эффектом;
• иммуномодулирующим эффектом.
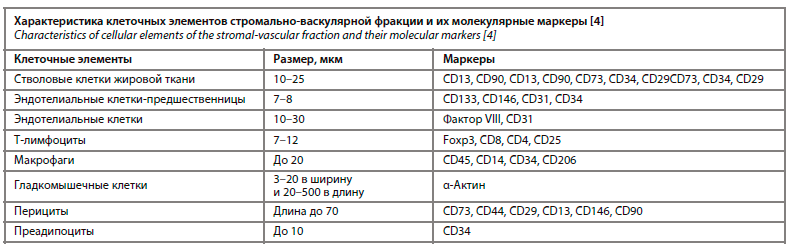
Важно отметить, что молекулярно-клеточный состав СВФ является внушительным. Основными клеточными элементами СВФ являются: стволовые клетки жировой ткани, преадипоциты, эндотелиальные клетки-предшественницы, эндотелиоциты, Т-лимфоциты, макрофаги, гладкомышечные клетки, перициты, а также мезенхимальные стволовые клетки (МСК). Необходимо упомянуть, что каждый клеточный элемент СВФ отличается не только своими морфологическими характеристиками, но и составом своих молекулярных маркеров, что позволило подобрать максимально удачный состав СВФ благодаря использованию современных фрагментирующих технологий (см. таблицу) [4]. В этой связи важно тезисно рассмотреть функционал каждой клетки СВФ и отметить ее клинико-биологический потенциал.
МСК играет ключевую роль в составе СВФ. Важно отметить, что МСК является универсальным предшественником для большинства тканей организма. Потенциал дифференцировки данного клеточного элемента существенно превышает таковой у других клеток. В сравнении с гемопоэтическими стволовыми клетками МСК носят на поверхности гораздо больше молекулярных маркеров, включая CD34, CD45, CD14, HLA-DR, что отражает их поразительную универсальность и больший спектр возможных взаимодействий [5]. В процессе эмбриогенеза МСК имеет 3 пути дифференцировки.
1. Эктодерма (например, нервная ткань) – за счет действия протеинкиназы-А и белка Notch-1.
2. Энтодерма (например, гепатоциты, секреторные островки и т.д.) – за счет взаимодействия с трансформирующим фактором роста.
3. Мезодерма (например, остеоциты, хондроциты, адипоциты и т.д.) – за счет взаимодействия с трансформирующим фактором роста, а также рядом факторов (PPAR, Smad3, SOX9).
Таким образом, приоритетная роль МСК в СВФ отводится именно регенерации ткани. Большое разнообразие линий дифференцировки позволяет использовать МСК как универсальный клеточный источник, стимулируемый паракринно за счет локально продуцируемых факторов роста и сигнальных белков.
Следующим не менее важным звеном в составе СВФ являются Т-лимфоциты. Их ключевая функция – поддержание локального иммунного гомеостаза в месте введения СВФ. Т-лимфоциты обладают выраженной паракринной активностью за счет способности к продукции ряда цитокинов [6, 7].
Важно отметить, что Т-хелперы 2-го типа активируют еще одно клеточное звено – тканевые макрофаги 2-го типа, также способствующие поддержанию клеточно-молекулярного баланса. Данная субпопуляция макрофагов обладает выраженной противовоспалительной активностью за счет способности к выработке противовоспалительных цитокинов, включая интерлейкины (ИЛ) 4, 5, 9 и 13-го типов. Также на сегодняшний день доказан и высокий регенераторный потенциал данной клеточной линии при наличии альтерации тканей [8, 9].
Следующим крайне важным компонентом СВФ являются адипозные стволовые клетки. Предшественники зрелых адипоцитов обладают выраженной паракринной активностью за счет продукции различных факторов роста, цитокинов и антиоксидантов в интерстиции. Кроме того, адипозные стволовые клетки реализуют противовоспалительный и иммуномодулирующий эффект в тканях за счет тех же молекулярных агентов. Вместе с тем следует отметить, что активно пролиферирующие преадипоциты могут проявлять значимую фагоцитарную активность в отношении чужеродных микроорганизмов, т.е. обладают макрофагоподобным эффектом [10, 11].
Необходимо также отметить гладкомышечные клетки, которые способствуют формированию каркаса в месте введения, восстановлению физиологичной гистоархитектоники и потенциируют армирующий эффект новосинтезированных (de nova) коллагеновых волокон [12].
Заключительным и наиболее важным компонентом в составе СВФ являются эндотелиальные стволовые клетки. Данный клеточный элемент обладает выраженным проангиогенным эффектом за счет продукции эндотелиального фактора роста, реализуя ключевые процессы
неоангиогенеза. Кроме того, предшественники эндотелиоцитов контролируют реологические свойства крови, ингибируют воспалительные процессы и предотвращают гиперкоагуляционные состояния в тканях [13].
Исходя из вышесказанного, важно резюмировать, что все клеточные элементы СВФ демонстрируют функциональную разнонаправленность и одновременную синергичность, что позволяет достичь высокого регенераторного эффекта в месте введения субстанции.
Однако кроме клеточных элементов необходимо рассмотреть молекулярные агенты СВФ, способствующие поддержанию локального тканевого гомеостаза [10].
1. Инсулиноподобный фактор роста-1 способствует поддержанию дифференцировки и пролиферации адипозных стволовых клеток.
2. Фактор роста тромбоцитов поддерживает процессы дифференцировки и пролиферации клеточной массы, а также реализует антиапоптотический эффект и поддерживает процессы хемотаксиса мезенхимальных стволовых клеток.
3. Эндотелиальный фактор роста реализует ключевые процессы неоангиогенеза и васкуляризации ткани в месте введения СВФ.
4. Фактор роста фибробластов поддерживает локальные пролиферативные процессы, способствует рекрутингу и стимуляции активности фибробластов и, соответственно, продукции коллагеновых волокон, реализуя локальный армирующий эффект.
5. Матриксные металлопротеиназы способствуют развитию жировой ткани, а также утолщению и ремоделированию коллагеновых волокон.
Важно отметить, что за счет всех вышеописанных механизмов, реализуемых клеточными элементами и локально продуцируемыми биологически-активными агентами, СВФ реализует целый ряд позитивных молекулярно-биологических эффектов в месте введения субстанции [3]:
• противовоспалительный эффект за счет снижения уровня ИЛ-1β и ИЛ-6, а также супрессии катаболизма ИЛ-1, связанной с активацией ИЛ-1Rα;
• повышение уровня гликозаминогликанов за счет активной дифференцировки строгальной стволовой клетки и активации синтеза внеклеточного матрикса хондроцитами;
• обеспечение тканевого гомеостаза за счет активации синтеза протеаз ADAMTS 4 и 5-го типов, а также повышения уровня тканевых ингибиторов металлопротеиназ 1, 3 и 4-го типов.
Таким образом, важно отметить, что каждый элемент микрофрагментированной СВФ является одновременно самостоятельной единицей, но вместе с тем может регулироваться паракринно другими компонентами системы регенерации. В этой связи мы резюмируем, что СВФ – это весьма гармоничная со всех точек зрения биологически-активная субстанция, обладающая высоким регенеративным и терапевтическим потенциалом.
• верхняя – жировая фракция;
• средняя – конденсированный липоаспират;
• нижняя – водная фракция;
• СВФ.
Однако на сегодняшний день стало возможным использование портативных технологий выделения микрофрагментированной СВФ адипозной ткани. Так, единственной зарегистрированной технологией портативного выделения СВФ из липоаспирата является LIPO-STEM DUOTM. Данный инструмент представляет стерильный одноразовый комплект, предназначенный для забора, микрофрагментации и очистки аутолипоаспирата. За счет технологии микрофильтрации в условиях замкнутого цикла также происходит фрагментация субстанции на фракции [14, 15].
Бережная технология фрагментации, используемая в портативных аппаратах микрофрагментации, имеет целый ряд преимуществ, включая эффективную микрофрагментацию липоаспирата, надежную очистку фрагментов тканей, высокое качество полученных клеток, а также быстрота процедуры (обработка 400 мл липоаспирата осуществляется за 5–10 мин) [15]. Учитывая сказанное, необходимо рассмотреть основные этапы проведения процедуры портативной микрофрагментации липоаспирата.
В рамках подготовительного этапа необходима подготовка так называемого раствора Кляйна. Данный раствор необходимо ввести локально в локусе липосакции, что позволит уменьшить объем кровопотери, создать инфильтративный объем в данной области. В качестве источника липоаспирата возможно выбрать анатомические зоны: живот, ягодицы и бедро, при этом живот является предпочтительным местом для проведения липосакции.
После забора аутологичного липоаспирата к разъему WASH IN необходимо подсоединить емкость с физиологическим раствором через инфузионную систему с целью выведения воздуха из системы в пакет для отходов и наполнения системы раствором.
После этого необходимо ввести через порт LIPO IN полученный липоаспират, а затем плавными движениями шпателя по пакету устройства необходимо провести липоаспират через внутренний фильтр в нижнюю часть устройства. Данный шаг способствует микрофрагментации и очищению липоаспирата от крови и липидных капель. Данный процесс выполняется, пока содержимое пакета не приобретет бледно-желтый цвет. Затем необходимо перекрыть поступление физиологического раствора, а его избыток вывести шпателем через открытый порт WASH IN. Полученную субстанцию или уже сформированную микрофрагментированную СВФ выводят через порт LIPO OUT для дальнейшего использования [14, 15].
Таким образом, важно отметить, что использование устройства LIPO-STEM DUOTM позволяет бережно получить высококачественную стромально-васкулярную фракцию путем микрофрагментации аутолипоаспирата за короткое время. Данный факт позволяет использовать портативные технологии для получения СВФ с высокой эффективностью и скоростью, что позволит существенно сократить время проведения процедуры и расходы клиники на лабораторное оборудование.
• в офтальмологии: для лечения ишемической ретинопатии;
• в травматологии: для лечения остеоартритов, тендинопатий;
• в эндокринологии: для лечения диабетической стопы;
• в нейрохирургии: для регенерации периферических нервов;
• в пластической хирургии: для лечения атрофических деформаций;
• в онкологии: для лечения атрофических процессов после химиолучевой терапии.
На настоящий момент микрофрагментированная СВФ адипозной ткани в рамках современной гинекологии имеет наибольший потенциал в лечении склероатрофического лихена, а также ректовагинальных свищей [17]. В этой связи необходимо рассмотреть результаты имеющихся научных исследований, демонстрирующих высокую эффективность и безопасность использования СВФ в современной гинекологии.
Так, по данным S. Tamburino и соавт. (2016 г.), использование СВФ-терапии у пациенток с верифицированным склероатрофическим лихеном после хирургической коррекции имеющихся стриктур способствует выраженному снижению интенсивности клинической симптоматики и коррекции атрофических изменений вульвы. При этом было выявлено, что значительное нивелирование симптоматики у пациенток отмечалось через 2 мес после лечения, а затем показатели оставались стабильно высокими с небольшим увеличением между вторым и пятым месяцами [18].
Вместе с тем необходимо отметить результаты исследования отечественных коллег, включавшего 24 пациентки с верифицированными ректовагинальными свищами после предшествующей химиолучевой терапии по поводу злокачественных новообразований органов репродуктивной системы. Согласно полученным данным, у пациенток на фоне СВФ-терапии отмечалось стабильное уменьшение средних размеров свищей: диаметр до лечения – 2,5 см, через 3 мес – 1,35 см, через 6 мес – 1,12 см. Кроме того было выявлено, что у всех пациенток отмечалась полная эпителизация свищей и полное отсутствие рецидивов [19].
Весьма интересными оказались результаты исследования J. Monreal и соавт. (2020 г.), включающего 39 пациенток с верифицированным склероатрофическим лихеном. В качестве терапии у пациенток был выполнен липографтинг вульвы с использованием аутологичной жировой ткани и СВФ. В результате было выявлено, что после терапии у 95% пациенток наблюдалось значимое снижение баллов согласно модифицированному опроснику вульвовагинальных симптомов как через 6, так и через 24 мес после лечения (p<0,05). Было продемонстрировано значимое улучшение состояния пациенток по каждому из четырех доменов шкалы: симптомы и признаки заболевания, социальное функционирование и качество сексуальной жизни (p<0,05 по всем доменам) [20].
В заключение необходимо представить результаты клинического наблюдения M. Kim и соавт. (2021 г.) двух пациенток 61 и 59 лет, перенесших химиолучевую терапию по поводу рака прямой кишки. У обеих пациенток после проведенного лечения были верифицированы ректовагинальные свищи. Исходя из этого, была проведена фистулопластика с последующим введением микрофрагментированной СВФ адипозной ткани. В результате у обеих пациенток через 5 мес наблюдения вовсе не отмечалось признаков газовой и каловой инконтиненции, в течение 1 года рецидивов свищей не наблюдалось [21].
Важно отметить, что на сегодняшний день «доказательное досье» использования СВФ в различных сферах медицины является не столь внушительным ввиду новизны самой методики. Но, несмотря на это, становится совершенно очевидно, что количество исследований разной степени доказательности, демонстрирующих эффективность и безопасность СВФ-терапии, будет увеличиваться в геометрической прогрессии, поскольку данный метод является не только чрезвычайно удобным, но также патогенетически оправданным и эффективным.
Исходя из вышесказанного, необходимо отметить, что современная регенеративная медицина демонстрирует поразительные темпы развития и укрепляется в самых различных медицинских сферах, включая гинекологию. Можно предположить, что регенеративная медицина на современном этапе – это медицина «без границ», позволяющая пациентке и клиницисту быть на «одной волне» – «волне» в достижении клинического успеха и повышения качества жизни!
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia.
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia.
E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Киселева Марина Викторовна – д-р мед. наук, зав. отделением новых медицинских технологий с группой лечения заболеваний молочной железы, ФГБУ «НМИЦ радиологии», проф. каф. акушерства и гинекологии ИПК ФМБА. E-mail: kismarvic@mail.ru
Marina V. Kiseleva – Dr. Sci. (Med.), National Medical Research Center for Radiology. E-mail: kismarvic@mail.ru
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia.
E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 13.03.2024
Поступила после рецензирования: 26.03.2024
Принята к публикации: 28.03.2024
Received: 13.03.2024
Revised: 26.03.2024
Accepted: 28.03.2024
Клинический разбор в общей медицине №3 2024
Регенеративная медицина на экваторе женского здоровья и качества жизни: роль микрофрагментированной стромально-васкулярной фракции адипозной ткани в современной регенеративной медицине
Номера страниц в выпуске:68-73
Аннотация
Регенеративная медицина остается наиболее стремительно развивающимся и инновационным разделом современной медицины. Ключевым субстратом тканевой регенерации является стволовая клетка, имеющая различные пути дифференцировки и являющаяся источником для различных морфотипов тканей. В этой связи медицинское сообщество задалось закономерным вопросом о потенциале использования стволовых клеток с целью лечения различных нозологий, в том числе и гинекологических. Одним из наиболее интересных, прогрессивных и удобных методов регенеративной медицины является использование микрофрагментированной стромально-васкулярной фракции аутологичной адипозной ткани. Исходя из этого, необходимо разобраться в молекулярно-биологических особенностях данной субстанции и оценить ее потенциал в рамках коррекции различных гинекологических заболеваний.
Ключевые слова: регенеративная медицина, микрофрагментированная стромально-васкулярная фракция, адипозная ткань, стволовые клетки.
Для цитирования: Оразов М.Р., Радзинский В.Е., Киселева М.В., Долгов Е.Д. Регенеративная медицина на экваторе женского здоровья и качества жизни: роль микрофрагментированной стромально-васкулярной фракции адипозной ткани в современной регенеративной медицине. Клинический разбор в общей медицине. 2024; 5 (3): 68–73. DOI: 10.47407/kr2023.5.3.00382
Регенеративная медицина остается наиболее стремительно развивающимся и инновационным разделом современной медицины. Ключевым субстратом тканевой регенерации является стволовая клетка, имеющая различные пути дифференцировки и являющаяся источником для различных морфотипов тканей. В этой связи медицинское сообщество задалось закономерным вопросом о потенциале использования стволовых клеток с целью лечения различных нозологий, в том числе и гинекологических. Одним из наиболее интересных, прогрессивных и удобных методов регенеративной медицины является использование микрофрагментированной стромально-васкулярной фракции аутологичной адипозной ткани. Исходя из этого, необходимо разобраться в молекулярно-биологических особенностях данной субстанции и оценить ее потенциал в рамках коррекции различных гинекологических заболеваний.
Ключевые слова: регенеративная медицина, микрофрагментированная стромально-васкулярная фракция, адипозная ткань, стволовые клетки.
Для цитирования: Оразов М.Р., Радзинский В.Е., Киселева М.В., Долгов Е.Д. Регенеративная медицина на экваторе женского здоровья и качества жизни: роль микрофрагментированной стромально-васкулярной фракции адипозной ткани в современной регенеративной медицине. Клинический разбор в общей медицине. 2024; 5 (3): 68–73. DOI: 10.47407/kr2023.5.3.00382
Regenerative medicine at the equator of women's health and quality of life: the role of microfragmented stromal-vascular fraction of adipose tissue in modern regenerative medicine
Mekan R. Orazov1, Viktor E. Radzinsky1, Marina V. Kiseleva2, Evgeny D. Dolgov11 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Tsyba Medical Radiological Research Center – branch of the National Medical Research Center for Radiology, Obninsk, Russia
omekan@mail.ru
Abstract
Regenerative medicine remains the most rapidly growing and innovative branch of modern medicine. The key substrate of tissue regeneration is the stem cell, which has various differentiation pathways and is the source for various tissue morphotypes. In this regard, the medical community has asked a legitimate question about the potential of using stem cells for the treatment of various nosologies, including gynaecological ones. One of the most interesting, progressive and convenient methods of regenerative medicine is the use of microfragmented stromal-vascular fraction of autologous adipose tissue. On this basis, it is necessary to understand the molecular-biological features of this substance and evaluate its potential within the framework of correction of various gynaecological diseases.
Keywords: regenerative medicine, microfragmented stromal-vascular fraction, adipose tissue, stem cells.
For citation: Orazov M.R., Radzinsky V.E., Kiseleva M.V., Dolgov E.D. Regenerative medicine at the equator of women's health and quality of life: the role of microfragmented stromal-vascular fraction of adipose tissue in modern regenerative medicine. Clinical review for general practice. 2024; 5 (3): 68–73. (In Russ.). DOI: 10.47407/kr2023.5.3.00382
На стыке регенеративной медицины и гинекологии
На протяжении всей истории человечества философские вопросы, направленные на раскрытие тайн мироздания и поиск своего предназначения, являлись и являются по сей день «двигателем» идеологической эволюции мира. С самых древних времен люди искали ключ к излечению всех заболеваний и эволюционно прошли через множество этапов, включая шаманство, использование лекарственных растений, поиск философского камня и т.д. Однако универсального ответа на миллионы вопросов медицины найдено не было. Но и поиски на этом не закончились. Последнее столетие в эволюции медицины как науки до сих пор сотрясает мир революционными открытиями: робот-ассистированная хирургия, таргетная терапия злокачественных новообразований, телемедицинские технологии и многое другое. Но вместе с тем уже долгое время наиболее перспективным направлением является регенеративная медицина.Согласно общепринятому определению, регенеративная медицина – это междисциплинарный раздел современной медицинской науки, изучающий методы медико-биологической инженерии с целью регенерации различных типов тканей [1]. Между тем регенерация (восстановление) – способность живых организмов со временем восстанавливать поврежденные ткани.
Виды регенерации [1]: физиологическая, репаративная, патологическая.
Физиологическая регенерация предусматривает процессы восстановления и обновления в каждом организме на протяжении всей его жизни, а репаративной называют регенерацию, происходящую после повреждения или утраты какой-либо части тела.

Ключевым механизмом тканевой регенерации является активная пролиферация клеток-предшественниц, активируемая вследствие альтерации. Благодаря ряду революционных открытий стало очевидно, что главным субстратом тканевой регенерации и регенеративной медицины является стволовая клетка. Стремительное развитие цитологии привело нас к пониманию того, что каждая зрелая клетка нашего организма является дочерней и развивается из целой цепочки так называемых прогениторных клеток, обладающих различным потенциалом мультипотентности (каждая новая клеточная популяция имеет более ограниченный потенциал относительно предыдущей генерации). Однако «вершиной» этой цепочки является стволовая клетка-предшественница, обладающая высоким пролиферативным, регенераторным и молекулярно-биологическим потенциалом [2]. Открытие этих свойств стволовых клеток создало ряд перспектив перед медицинским сообществом: от возможности выращивания отдельных тканей и органов с целью дальнейшей трансплантации до регенерации поврежденных тканей in situ. И в этой связи стало совершенно очевидно, что регенеративная медицина является всеобъемлющей и охватывает все медицинские специальности.
На сегодняшний день в мире активно используется микрофрагментированная стромально-васкулярная фракция (СВФ) адипозной ткани с целью регенерации тканей in situ. За последнее время терапия СВФ широко зарекомендовала себя в самых различных областях медицины и, конечно же, «не обошла стороной» современную гинекологию. Огромный спектр позитивных молекулярно-биологических эффектов данной субстанции и простота ее выделения характеризует ее как наилучшего «кандидата» для патогенетически оправданной регенеративной коррекции ряда гинекологических нозологий.
Исходя из сказанного, важно отметить, что целью данной статьи является освещение крайне актуального и вместе с тем не менее инновационного вопроса о месте терапии микрофрагментированной СВФ в современной гинекологии.
СВФ-терапия – новое слово в современной гинекологии
Микрофрагментированная СВФ (Stromal-Vascular Fraction) является универсальной биологически-активной субстанцией. В состав СВФ входит целый комплекс стволовых клеточных структур и факторов роста,обусловливающих ее высокий регенераторный потенциал. Ключевой особенностью СВФ является полная синергичность молекулярно-биологических эффектов со стороны всех ее составляющих, что обусловливает ее высокую эффективность и универсальность для использования в самых различных сферах медицины [3]. На сегодняшний момент доказано, что микрофрагментированная СВФ обладает:
• выраженным регенераторным эффектом;
• проангиогенным эффектом;
• противовоспалительным эффектом;
• иммуномодулирующим эффектом.
Важно отметить, что молекулярно-клеточный состав СВФ является внушительным. Основными клеточными элементами СВФ являются: стволовые клетки жировой ткани, преадипоциты, эндотелиальные клетки-предшественницы, эндотелиоциты, Т-лимфоциты, макрофаги, гладкомышечные клетки, перициты, а также мезенхимальные стволовые клетки (МСК). Необходимо упомянуть, что каждый клеточный элемент СВФ отличается не только своими морфологическими характеристиками, но и составом своих молекулярных маркеров, что позволило подобрать максимально удачный состав СВФ благодаря использованию современных фрагментирующих технологий (см. таблицу) [4]. В этой связи важно тезисно рассмотреть функционал каждой клетки СВФ и отметить ее клинико-биологический потенциал.
МСК играет ключевую роль в составе СВФ. Важно отметить, что МСК является универсальным предшественником для большинства тканей организма. Потенциал дифференцировки данного клеточного элемента существенно превышает таковой у других клеток. В сравнении с гемопоэтическими стволовыми клетками МСК носят на поверхности гораздо больше молекулярных маркеров, включая CD34, CD45, CD14, HLA-DR, что отражает их поразительную универсальность и больший спектр возможных взаимодействий [5]. В процессе эмбриогенеза МСК имеет 3 пути дифференцировки.
1. Эктодерма (например, нервная ткань) – за счет действия протеинкиназы-А и белка Notch-1.
2. Энтодерма (например, гепатоциты, секреторные островки и т.д.) – за счет взаимодействия с трансформирующим фактором роста.
3. Мезодерма (например, остеоциты, хондроциты, адипоциты и т.д.) – за счет взаимодействия с трансформирующим фактором роста, а также рядом факторов (PPAR, Smad3, SOX9).
Таким образом, приоритетная роль МСК в СВФ отводится именно регенерации ткани. Большое разнообразие линий дифференцировки позволяет использовать МСК как универсальный клеточный источник, стимулируемый паракринно за счет локально продуцируемых факторов роста и сигнальных белков.
Следующим не менее важным звеном в составе СВФ являются Т-лимфоциты. Их ключевая функция – поддержание локального иммунного гомеостаза в месте введения СВФ. Т-лимфоциты обладают выраженной паракринной активностью за счет способности к продукции ряда цитокинов [6, 7].
Важно отметить, что Т-хелперы 2-го типа активируют еще одно клеточное звено – тканевые макрофаги 2-го типа, также способствующие поддержанию клеточно-молекулярного баланса. Данная субпопуляция макрофагов обладает выраженной противовоспалительной активностью за счет способности к выработке противовоспалительных цитокинов, включая интерлейкины (ИЛ) 4, 5, 9 и 13-го типов. Также на сегодняшний день доказан и высокий регенераторный потенциал данной клеточной линии при наличии альтерации тканей [8, 9].
Следующим крайне важным компонентом СВФ являются адипозные стволовые клетки. Предшественники зрелых адипоцитов обладают выраженной паракринной активностью за счет продукции различных факторов роста, цитокинов и антиоксидантов в интерстиции. Кроме того, адипозные стволовые клетки реализуют противовоспалительный и иммуномодулирующий эффект в тканях за счет тех же молекулярных агентов. Вместе с тем следует отметить, что активно пролиферирующие преадипоциты могут проявлять значимую фагоцитарную активность в отношении чужеродных микроорганизмов, т.е. обладают макрофагоподобным эффектом [10, 11].
Необходимо также отметить гладкомышечные клетки, которые способствуют формированию каркаса в месте введения, восстановлению физиологичной гистоархитектоники и потенциируют армирующий эффект новосинтезированных (de nova) коллагеновых волокон [12].
Заключительным и наиболее важным компонентом в составе СВФ являются эндотелиальные стволовые клетки. Данный клеточный элемент обладает выраженным проангиогенным эффектом за счет продукции эндотелиального фактора роста, реализуя ключевые процессы
неоангиогенеза. Кроме того, предшественники эндотелиоцитов контролируют реологические свойства крови, ингибируют воспалительные процессы и предотвращают гиперкоагуляционные состояния в тканях [13].
Исходя из вышесказанного, важно резюмировать, что все клеточные элементы СВФ демонстрируют функциональную разнонаправленность и одновременную синергичность, что позволяет достичь высокого регенераторного эффекта в месте введения субстанции.
Однако кроме клеточных элементов необходимо рассмотреть молекулярные агенты СВФ, способствующие поддержанию локального тканевого гомеостаза [10].
1. Инсулиноподобный фактор роста-1 способствует поддержанию дифференцировки и пролиферации адипозных стволовых клеток.
2. Фактор роста тромбоцитов поддерживает процессы дифференцировки и пролиферации клеточной массы, а также реализует антиапоптотический эффект и поддерживает процессы хемотаксиса мезенхимальных стволовых клеток.
3. Эндотелиальный фактор роста реализует ключевые процессы неоангиогенеза и васкуляризации ткани в месте введения СВФ.
4. Фактор роста фибробластов поддерживает локальные пролиферативные процессы, способствует рекрутингу и стимуляции активности фибробластов и, соответственно, продукции коллагеновых волокон, реализуя локальный армирующий эффект.
5. Матриксные металлопротеиназы способствуют развитию жировой ткани, а также утолщению и ремоделированию коллагеновых волокон.
Важно отметить, что за счет всех вышеописанных механизмов, реализуемых клеточными элементами и локально продуцируемыми биологически-активными агентами, СВФ реализует целый ряд позитивных молекулярно-биологических эффектов в месте введения субстанции [3]:
• противовоспалительный эффект за счет снижения уровня ИЛ-1β и ИЛ-6, а также супрессии катаболизма ИЛ-1, связанной с активацией ИЛ-1Rα;
• повышение уровня гликозаминогликанов за счет активной дифференцировки строгальной стволовой клетки и активации синтеза внеклеточного матрикса хондроцитами;
• обеспечение тканевого гомеостаза за счет активации синтеза протеаз ADAMTS 4 и 5-го типов, а также повышения уровня тканевых ингибиторов металлопротеиназ 1, 3 и 4-го типов.
Таким образом, важно отметить, что каждый элемент микрофрагментированной СВФ является одновременно самостоятельной единицей, но вместе с тем может регулироваться паракринно другими компонентами системы регенерации. В этой связи мы резюмируем, что СВФ – это весьма гармоничная со всех точек зрения биологически-активная субстанция, обладающая высоким регенеративным и терапевтическим потенциалом.
Методология микрофрагментации липоаспирата и получения микрофрагментированной стромально-васкулярной фракции
До недавнего времени выделение микрофрагментированной СВФ адипозной ткани возможно было только в лабораторных условиях, в частности в условиях центрифугирования. В итоге после проведения центрифугирования липоаспирата на скорости 2500–3000 оборотов в минуту в течение 4 мин при комнатной температуре способствовало фрагментации жидкости на несколько фракций [3]:• верхняя – жировая фракция;
• средняя – конденсированный липоаспират;
• нижняя – водная фракция;
• СВФ.
Однако на сегодняшний день стало возможным использование портативных технологий выделения микрофрагментированной СВФ адипозной ткани. Так, единственной зарегистрированной технологией портативного выделения СВФ из липоаспирата является LIPO-STEM DUOTM. Данный инструмент представляет стерильный одноразовый комплект, предназначенный для забора, микрофрагментации и очистки аутолипоаспирата. За счет технологии микрофильтрации в условиях замкнутого цикла также происходит фрагментация субстанции на фракции [14, 15].
Бережная технология фрагментации, используемая в портативных аппаратах микрофрагментации, имеет целый ряд преимуществ, включая эффективную микрофрагментацию липоаспирата, надежную очистку фрагментов тканей, высокое качество полученных клеток, а также быстрота процедуры (обработка 400 мл липоаспирата осуществляется за 5–10 мин) [15]. Учитывая сказанное, необходимо рассмотреть основные этапы проведения процедуры портативной микрофрагментации липоаспирата.
В рамках подготовительного этапа необходима подготовка так называемого раствора Кляйна. Данный раствор необходимо ввести локально в локусе липосакции, что позволит уменьшить объем кровопотери, создать инфильтративный объем в данной области. В качестве источника липоаспирата возможно выбрать анатомические зоны: живот, ягодицы и бедро, при этом живот является предпочтительным местом для проведения липосакции.
После забора аутологичного липоаспирата к разъему WASH IN необходимо подсоединить емкость с физиологическим раствором через инфузионную систему с целью выведения воздуха из системы в пакет для отходов и наполнения системы раствором.
После этого необходимо ввести через порт LIPO IN полученный липоаспират, а затем плавными движениями шпателя по пакету устройства необходимо провести липоаспират через внутренний фильтр в нижнюю часть устройства. Данный шаг способствует микрофрагментации и очищению липоаспирата от крови и липидных капель. Данный процесс выполняется, пока содержимое пакета не приобретет бледно-желтый цвет. Затем необходимо перекрыть поступление физиологического раствора, а его избыток вывести шпателем через открытый порт WASH IN. Полученную субстанцию или уже сформированную микрофрагментированную СВФ выводят через порт LIPO OUT для дальнейшего использования [14, 15].
Таким образом, важно отметить, что использование устройства LIPO-STEM DUOTM позволяет бережно получить высококачественную стромально-васкулярную фракцию путем микрофрагментации аутолипоаспирата за короткое время. Данный факт позволяет использовать портативные технологии для получения СВФ с высокой эффективностью и скоростью, что позволит существенно сократить время проведения процедуры и расходы клиники на лабораторное оборудование.
СВФ-терапия в современной гинекологии: на пути к «регенеративной революции»
На сегодняшний день спектр применения СВФ в медицине в целом является в буквальном смысле «безграничным». Так, на сегодняшний день доказано, что микрофрагментированная СВФ адипозной ткани с высокой клинической эффективностью и безопасностью активно используется в следующих областях медицины [16]:• в офтальмологии: для лечения ишемической ретинопатии;
• в травматологии: для лечения остеоартритов, тендинопатий;
• в эндокринологии: для лечения диабетической стопы;
• в нейрохирургии: для регенерации периферических нервов;
• в пластической хирургии: для лечения атрофических деформаций;
• в онкологии: для лечения атрофических процессов после химиолучевой терапии.
На настоящий момент микрофрагментированная СВФ адипозной ткани в рамках современной гинекологии имеет наибольший потенциал в лечении склероатрофического лихена, а также ректовагинальных свищей [17]. В этой связи необходимо рассмотреть результаты имеющихся научных исследований, демонстрирующих высокую эффективность и безопасность использования СВФ в современной гинекологии.
Так, по данным S. Tamburino и соавт. (2016 г.), использование СВФ-терапии у пациенток с верифицированным склероатрофическим лихеном после хирургической коррекции имеющихся стриктур способствует выраженному снижению интенсивности клинической симптоматики и коррекции атрофических изменений вульвы. При этом было выявлено, что значительное нивелирование симптоматики у пациенток отмечалось через 2 мес после лечения, а затем показатели оставались стабильно высокими с небольшим увеличением между вторым и пятым месяцами [18].
Вместе с тем необходимо отметить результаты исследования отечественных коллег, включавшего 24 пациентки с верифицированными ректовагинальными свищами после предшествующей химиолучевой терапии по поводу злокачественных новообразований органов репродуктивной системы. Согласно полученным данным, у пациенток на фоне СВФ-терапии отмечалось стабильное уменьшение средних размеров свищей: диаметр до лечения – 2,5 см, через 3 мес – 1,35 см, через 6 мес – 1,12 см. Кроме того было выявлено, что у всех пациенток отмечалась полная эпителизация свищей и полное отсутствие рецидивов [19].
Весьма интересными оказались результаты исследования J. Monreal и соавт. (2020 г.), включающего 39 пациенток с верифицированным склероатрофическим лихеном. В качестве терапии у пациенток был выполнен липографтинг вульвы с использованием аутологичной жировой ткани и СВФ. В результате было выявлено, что после терапии у 95% пациенток наблюдалось значимое снижение баллов согласно модифицированному опроснику вульвовагинальных симптомов как через 6, так и через 24 мес после лечения (p<0,05). Было продемонстрировано значимое улучшение состояния пациенток по каждому из четырех доменов шкалы: симптомы и признаки заболевания, социальное функционирование и качество сексуальной жизни (p<0,05 по всем доменам) [20].
В заключение необходимо представить результаты клинического наблюдения M. Kim и соавт. (2021 г.) двух пациенток 61 и 59 лет, перенесших химиолучевую терапию по поводу рака прямой кишки. У обеих пациенток после проведенного лечения были верифицированы ректовагинальные свищи. Исходя из этого, была проведена фистулопластика с последующим введением микрофрагментированной СВФ адипозной ткани. В результате у обеих пациенток через 5 мес наблюдения вовсе не отмечалось признаков газовой и каловой инконтиненции, в течение 1 года рецидивов свищей не наблюдалось [21].
Заключение
Таким образом, в рамках данной статьи нам удалось рассмотреть весьма нестандартный вопрос использования микрофрагментированной стромально-васкулярной фракции в регенеративной медицине. Установлена «регенеративная роль» каждого компонента (как молекулярного, так и клеточного) СВФ с точки зрения их биологических эффектов.Важно отметить, что на сегодняшний день «доказательное досье» использования СВФ в различных сферах медицины является не столь внушительным ввиду новизны самой методики. Но, несмотря на это, становится совершенно очевидно, что количество исследований разной степени доказательности, демонстрирующих эффективность и безопасность СВФ-терапии, будет увеличиваться в геометрической прогрессии, поскольку данный метод является не только чрезвычайно удобным, но также патогенетически оправданным и эффективным.
Исходя из вышесказанного, необходимо отметить, что современная регенеративная медицина демонстрирует поразительные темпы развития и укрепляется в самых различных медицинских сферах, включая гинекологию. Можно предположить, что регенеративная медицина на современном этапе – это медицина «без границ», позволяющая пациентке и клиницисту быть на «одной волне» – «волне» в достижении клинического успеха и повышения качества жизни!
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia.
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia.
E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Киселева Марина Викторовна – д-р мед. наук, зав. отделением новых медицинских технологий с группой лечения заболеваний молочной железы, ФГБУ «НМИЦ радиологии», проф. каф. акушерства и гинекологии ИПК ФМБА. E-mail: kismarvic@mail.ru
Marina V. Kiseleva – Dr. Sci. (Med.), National Medical Research Center for Radiology. E-mail: kismarvic@mail.ru
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia.
E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 13.03.2024
Поступила после рецензирования: 26.03.2024
Принята к публикации: 28.03.2024
Received: 13.03.2024
Revised: 26.03.2024
Accepted: 28.03.2024
Список исп. литературыСкрыть список1. Mao AS, Mooney DJ. Regenerative medicine: Current therapies and future directions. Proceedings of the National Academy of Sciences. 2015;112(47):14452-9.
2. Lovell-Badge R. The future for stem cell research. Nature. 2001;414 (6859):88-91.
3. Goncharov EN et al. Analyzing the Clinical Potential of Stromal Vascular Fraction: A Comprehensive Literature Review. Medicina. 2024;60(2):221.
4. Павлов В.Н. и др. Современные возможности клинического применения стромально-васкулярной фракции жировой ткани. Медицинский вестник Башкортостана. 2020;(90).
Pavlov V.N. et al. Modern possibilities of clinical application of stromal vascular fraction of adipose tissue. Medical Bulletin of Bashkortostan. 2020;(90) (in Russian).
5. Ding DC, Sheu WC, Lin SZ. Mesenchymal stem cells. Cell transplantation. 2011;20(11):5-14.
6. Busato A et al. Simple and Rapid Non-Enzymatic Procedure Allows the Isolation of Structurally Preserved Connective Tissue Micro-Fragments Enriched with SVF. Cells. 2020;10(36).
7. Dulong J et al. CD40L-expressing CD4+ T cells prime adipose-derived stromal cells to produce inflammatory chemokines. Cytotherapy. 2022;24:500-7.
8. Contreras GA et al. Macrophage infiltration in the omental and subcutaneous adipose tissues of dairy cows with displaced abomasum.
J Dairy Sci. 2015;98:6176-87.
9. Dey A et al. A multi-colour confocal microscopy method for identifying and enumerating macrophage subtypes and adherent cells in the stromal vascular fraction of human adipose. J Immunol Methods. 2021;491:112988.
10. Bora P, Majumdar A.S. Adipose tissue-derived stromal vascular fraction in regenerative medicine: A brief review on biology and translation. Stem Cell Res Ther. 2017;8:145.
11. Matsuo FS et al. RANKL induces beige adipocyte differentiation in preadipocytes. Am J Physiol Endocrinol Metab. 2020;318:E866-E877.
12. Guimarães-Camboa N et al. Pericytes of Multiple Organs Do Not Behave as Mesenchymal Stem Cells In Vivo. Cell Stem Cell. 2017;20:345-59
13. Gulyaeva O, Dempersmier J, Sul HS. Genetic and epigenetic control of adipose development. Biochim. Biophys. Acta Mol Cell Biol Lipids. 2019;1864,3-12.
14. LIPO-STEM. Mesenchymal stem cells collection kit from adipose tissue. Surgical technique (BPB MEDICA). URL: https://mst.ru/products/ biosystems/lipostem/Lipostem_mar20.pdf
15. Система для аспирации и обработки аутологичной жировой ткани LIPO-STEM DUO™. URL: https://mst.ru/products/biosystems/lipostem/
LIPO-STEM DUO™ system for aspiration and treatment of autologous adipose tissue. URL: https://mst.ru/products/biosystems/lipostem/ (in Russian).
16. Nguyen A et al. Stromal vascular fraction: A regenerative reality? Part 1: Current concepts and review of the literature. Journal of Plastic, Reconstructive & Aesthetic Surgery. 2016;69(2):170-9.
17. Bapat A. Stem Cells and Recent Advances in Aesthetic and Regenerative Gynecology. Aesthetic and Regenerative Gynecology. 2022;1:327-57. DOI: 10.1007/978-981-16-1743-0_31
18. Tamburino S et al. The Role of Nanofat Grafting in Vulvar Lichen Sclerosus: A Preliminary Report. Arch Plast Surg. 2016;43(1):93-5. DOI: 10.5999/aps.2016.43.1.93
19. Терюшкова Ж.И., Васильев В.С., Важенин А.В. и др. Липографтинг и стромально-васкулярная фракция жировой ткани в лечении пациенток с постлучевыми ректовагинальными свищами. Онкологическая колопроктология. 2019;9(1):34-41.
Teryushkova Zh.I., Vasiliev V.S., Vazhenin A.V. et al. Lipografting and stromal vascular fraction of adipose tissue in the treatment of patients with postradiative rectovaginal fistulas. Oncological coloproctology. 2019;9(1):34-41 (in Russian).
20. Monreal J. Safety and efficacy of stromal vascular fraction enriched fat grafting therapy for vulvar lichen sclerosus. Cureus. 2020;2(2).
21. Kim M, Lew DH, Roh TS, Song SY. Stromal vascular fraction injection to treat intractable radiation-induced rectovaginal fistula. Archives of Plastic Surgery. 2021;48(1):127-30.


