Клинический разбор в общей медицине №5 2024
Sergey M. Kryzhanovskiy2,7, Elena I. Chukanova8
1 Central Clinical Hospital with polyclinic of the Office of the President of the Russian Federation, Moscow, Russia;
2 Medical Research Center "KoMed" (LLC "LR"), Moscow, Russia;
3 City Polyclinic No 23, Branch No 1, Moscow, Russia;
4 Diagnostics LLC, Moscow, Russia;
5 Diagnostic Center No 3, Branch No 2 (City Polyclinic No 133), Moscow, Russia;
6 Demikhov City Clinical Hospital, Moscow, Russia;
7 Central State Medical Academy of the Office of the President of the Russian Federation, Moscow, Russia;
8 Pirogov Russian National Research Medical University, Moscow, Russia
chukanova-elena@yandex.ru
Abstract
Aim: to estimate efficacy, tolerability, and safety of Ambenium® parenteral [phenylbutazone sodium 400 mg and lidocaine hydrochloride 4 mg] used for treatment of patients with low back pain.
Methods. A total of 100 patients with low back pain (LBP), who received a single intramuscular injection of Ambenium® parenteral, were included in the study. The follow-up period was 3 days. The change in pain severity on VAS (mm) was selected as a primary outcome measure for efficacy. The pain syndrome severity was estimated before administration of the drug (visit 1) and 4, 6, 8 and 12 h after the drug administration, as well as during visits 2 (day 2) and 3 (day 4). The McGill Pain Questionnaire, muscle syndrome index (MSI), Roland-Morris Disability Questionnaire pain estimates were used as the secondary diagnostic criteria. The percentage of patients with the positive response relative to baseline (the decrease in pain severity on VAS by more than 50%) was also determined.
Results. The dynamics of the primary efficacy measure (pain severity on VAS) was as follows: 7.4 ± 0.92 cm (mean ± standard deviation) during visit 1, 5.6 ± 1.49 cm after 2 h, 4.6 ± 1.74 cm after 4 h, 3.0 ± 1.79 cm after 8 h; the VAS score was 2.3 ± 1.70 cm after 12 h (р<0.001). The share of patients who responded to therapy (with the decrease in pain severity on VAS by more than 50% relative to baseline) was 84% [95% CI: 75.0 – 91.0] 24 h after the first administration, 94% during visit 3 [95% CI: 87.0 – 98.0], р<0.001. The secondary efficacy criteria (muscle syndrome index and McGill Pain Questionnaire score) showed significant positive dynamics (р<0.001). No systemic adverse events were reported.
Conclusion. The study showed that a single intramuscular injection of Ambenium® parenteral was an efficient, well-tolerated and safe treatment option for low back pain. Administration of a single drug dose makes it possible to ensure a significant clinical effect reflected in the pain severity decrease and restoration of the patient’s motor activity.
Keywords: back pain, treatment, ambenium parenteral, phenylbutazone, lidocaine.
For citation: Kurilchenko D.S., Kazakova M.A., Kupryashkina Yu.G., Feoktistova M.V., Kryzhanovskiy S.M., Chukanova E.I. Back pain. Results of a non-interventional study of using Ambenium® parenteral in routine clinical practice. Clinical analysis in general medicine. 2024; 5 (5): 21–26 (In Russ.). DOI: 10.47407/kr2024.5.5.00401
Основными фармакологическими группами, применяемыми для купирования боли являются: нестероидные противовоспалительные препараты (НПВП), миорелаксанты, противосудорожные препараты, антидепрессанты, препараты местного действия, содержащие НПВП [4]. В группу НПВП включен препарат Амбениум® [АТХ М01AА01, N01ВВ02] парентерал, раствор для внутримышечного введения. В состав препарата входят фенилбутазон натрия 400 мг и лидокаина гидрохлорид 4 мг. Фенилбутазон относится к группе производных пиразолона. Механизм действия пиразолоновых препаратов заключается в ингибировании циклооксигеназ (1 и 2-го типа), нарушении метаболизма арахидоновой кислоты, уменьшении простагландинов в очаге воспаления [5]. Наличие лидокаина гидрохлорида делает инъекцию препарата практически безболезненной, что повышает комплаенс пациентов. Объем раствора 2 мл способствует снижению риска развития абсцесса и повреждения мягких тканей [6].
Цель исследования – оценка эффективности, переносимости и безопасности препарата Амбениум® парентерал у пациентов с БНЧС (скелетно-мышечная неспецифическая боль).
Исследование проводилось в соответствии с принципами доброкачественной клинической и эпидемиологической практики [7]. Исследование было одобрено Независимым междисциплинарным комитетом по этической экспертизе клинических исследований (выписка из заседания совета по этике, протокола №02 от 1 февраля 2023 г.). Популяцию исследования составили пациенты с БНЧС (скелетно-мышечная неспецифическая боль) с выраженностью интенсивности боли по по визуальной аналоговой шкале (ВАШ) ≥60 мм (6 см).
В исследование включались пациенты в возрасте от 18 до 65 лет, которым был назначен препарат Амбениум® парентерал. Все пациенты подписывали информированное согласие.
Критерии включения в исследование:
1. Мужчины и женщины в возрасте от 18 до 65 лет включительно.
2. Пациенты с БНЧС (скелетно-мышечной неспецифической), влияющей на жизнедеятельность пациента: интенсивность боли по шкале ВАШ ≥60 мм; по опроснику нарушений жизнедеятельности Роланда–Морриса ≥7 баллов и показатели балльной оценки по госпитальной шкале тревоги и депрессии (HADS) ≤7 баллов по каждой из подшкал для исключения влияния на интенсивность боли нарушений эмоционального состояния.
Основные критерии невключения: гиперчувствительность к фенилбутазону, лидокаину, анестетикам амидного типа или вспомогательным компонентам препарата, активные эрозивно-язвенные поражения желудка или двенадцатиперстной кишки или язвенная болезнь желудка и двенадцатиперстной кишки, язвенный колит, болезнь Крона, желудочно-кишечное кровотечение, спровоцированное приемом НПВП, в анамнезе, беременность, период грудного вскармливания.
Препарат назначался согласно инструкции к препарату Амбениум® парентерал [5], внутримышечно, однократно, медленно глубоко в мышцу в дозе 373,4 мг (2 мл). Продолжительность наблюдения составляла 3 сут и включала 3 визита: включение в исследование и введение препарата, наблюдение через 24 и через 72 ч.
Анализировались демографические и антропометрические параметры (возраст, пол, рост, масса тела, расчет индекса массы тела), анамнез боли, общемедицинский анамнез (данные о наличии сопутствующих заболеваний), лабораторные и инструментальные данные (рентгенография, магнитно-резонансная или компьютерная томография пояснично-крестцового отдела позвоночника) при их наличии.
Для оценки эффективности препарата использованы подходы, описанные в европейском руководстве по разработке лекарственных препаратов для лечения боли (EMA/CHMP/970057/2011) [8]. Были оценены: интенсивность и динамика боли, функциональное и эмоциональное состояние пациента, нарушения жизнедеятельности, доля пациентов, ответивших на терапию (пациенты, у которых на фоне терапии отмечается снижении интенсивности более чем на 50% относительно исходной оценки).
Первичной конечной точкой была выбрана динамика выраженности боли по ВАШ 0–10 [9]. Динамику интенсивности боли оценивали по ВАШ через 2, 4, 6, 8, 12, 24 и 72 ч после введения препарата. Пациента инструктировали, что боль оценивается после движения. Вторичными конечными точками были: динамика характера боли по опроснику Мак-Гилла (опросник боли Мак-Гилла в модификации В.В. Кузьменко и соавт., 1986) [10]; динамика наличия нарушений жизнедеятельности по опроснику Роланда–Морриса «Боль в нижней части спины и нарушение жизнедеятельности» (М. Roland и соавт., 1983) [11]; динамика индекса мышечного синдрома (ИМС) [12]. Также высчитывался процент пациентов с «положительным ответом» – снижение интенсивности боли по ВАШ через 48 ч по сравнению с исходным значением (до введения препарата) более чем на 50%.
Для исключения влияния нарушений эмоционального состояния на выраженность интенсивности боли у пациентов при скрининге использовалась HADS [13].
В исследование не включались пациенты, имеющие более 7 баллов по каждой подшкале HADS.
Безопасность и переносимость препарата оценивалась по зарегистрированным нежелательным явлениям, что предусматривало оценку жалоб, данных физикального обследования и осмотра места введения препарата.
Первичным критерием эффективности являлось изменение интенсивности боли по ВАШ относительно исходного состояния пациентов. Перед началом терапии интенсивность боли по ВАШ составила 7,4±0,92 см, через 2 ч – 5,6±1,49 см, через 4 ч – 4,6±1,74 см, через 8 ч – 3,0±1,79 см, через 12 ч – 2,3±1,70 см. При анализе методом смешанной линейной модели с повторными измерениями изменения относительно исходного значения были статистически значимыми на всех временных промежутках (р<0,001).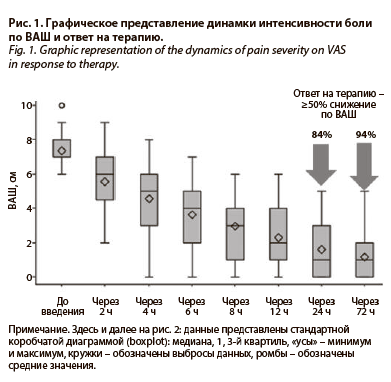
Доля пациентов, ответивших на терапию через 24 ч после 1-го введения, составила 84% (84/100) [95% ДИ 75,0–91,0], на визите 3 – 94% (94/100) [95% ДИ 87,0–98,0]; р<0,001. На рис. 1 представлено графическое изображение динамики интенсивности боли по ВАШ.
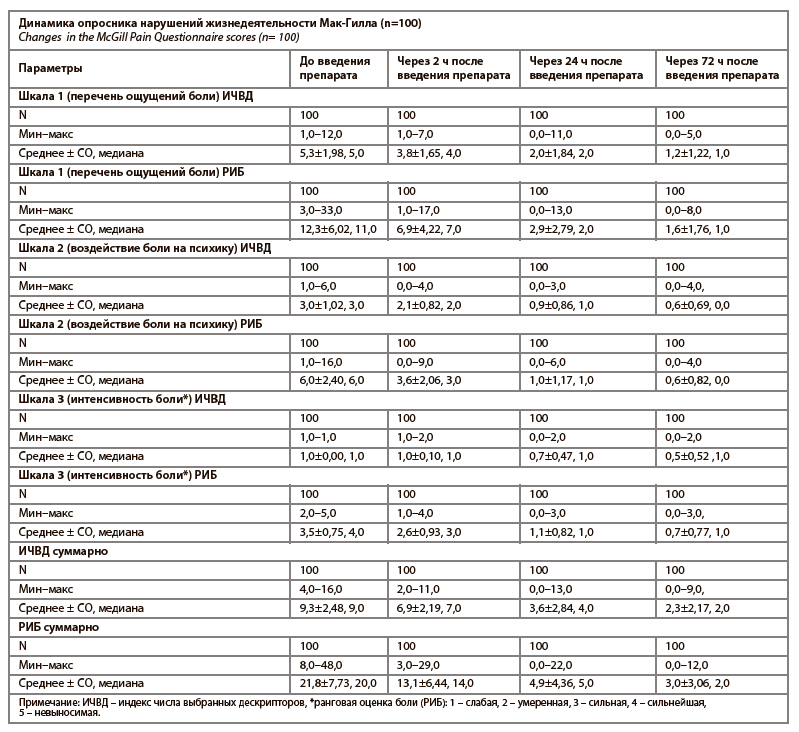
В ходе исследования также оценивалось ощущение боли по опроснику боли Мак-Гилла, который зарекомендовал себя как надежный и достоверный инструмент измерения компонентов боли [14]. Опросник включает в себя три шкалы: сенсорную (перечень ощущений боли) – шкала 1, аффективную (воздействие боли на психику) – шкала 2 и эвалюативную (оценка интенсивности боли) – шкала 3. В таблице представлены результаты анализа опросника нарушений жизнедеятельности Мак-Гилла.
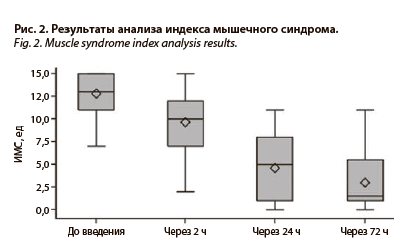 Влияние препарата на выраженность мышечно-тонического синдрома (МТС) осуществлялось при помощи вычисления ИМС до применения препарата Амбениум® парентерал и после. Оценка проводилась лечащим врачом по 7 критериям, каждый из них оценивался по 3-балльной системе. Критерии соответствуют состоянию пациента на момент заполнения опросника. Оценка ИМС (по сумме баллов названных критериев/признаков): 1-я степень (легкая) – ИМС до 5 баллов; 2-я (средняя, умеренная) – от 5 до 12 баллов; 3-я (тяжелая, выраженная) – более 12 баллов. Исследование показало клинически значимое улучшение – ИМС на визите 1 составил (средняя арифметическая ± СО, медиана) 12,8±2,13, 13,0 ед, через 2 ч после введения – 9,6±3,38, 10,0 ед, через 24 ч – 4,6±3,49, 5,0 ед, на визите 3 – 3,0±2,97, 1,5 ед; р<0,001. Результаты оценки качества жизни у пациентов после применения препарата будут представлены в отдельной публикации.
Влияние препарата на выраженность мышечно-тонического синдрома (МТС) осуществлялось при помощи вычисления ИМС до применения препарата Амбениум® парентерал и после. Оценка проводилась лечащим врачом по 7 критериям, каждый из них оценивался по 3-балльной системе. Критерии соответствуют состоянию пациента на момент заполнения опросника. Оценка ИМС (по сумме баллов названных критериев/признаков): 1-я степень (легкая) – ИМС до 5 баллов; 2-я (средняя, умеренная) – от 5 до 12 баллов; 3-я (тяжелая, выраженная) – более 12 баллов. Исследование показало клинически значимое улучшение – ИМС на визите 1 составил (средняя арифметическая ± СО, медиана) 12,8±2,13, 13,0 ед, через 2 ч после введения – 9,6±3,38, 10,0 ед, через 24 ч – 4,6±3,49, 5,0 ед, на визите 3 – 3,0±2,97, 1,5 ед; р<0,001. Результаты оценки качества жизни у пациентов после применения препарата будут представлены в отдельной публикации.
При анализе возникновения нежелательных явлений отмечено, что в ходе исследования, у 1 (1%) пациента была припухлость в месте введения препарата, гиперемия – у 4 (4%) и болезненность в месте введения – у 12 (12%) пациентов. Все явления были легкими и незначительными и к моменту завершения наблюдения полностью регрессировали. Системных нежелательных явлений не было зарегистрировано.
Основной целью медикаментозной терапии является купирование боли с максимально возможным функциональным восстановлением [16, 17]. В связи с этим для практического врача важно понимание, через какое время можно ожидать наступление обезболивающего эффекта препарата, возможная длительность его лечебного эффекта, а также у какого процента пациентов может быть достигнут положительный ответ на проводимое лечение.
Для получения дополнительных данных об эффективности и безопасности препарата Амбениум® парентерал в условиях рутинной клинической практики было проведено настоящее исследование. Дизайн исследования был разработан с учетом рекомендаций Европейского агентства по изучению препаратов, обладающих обезболивающими эффектами (EMEA) [14]. Для более объективной оценки противоболевого эффекта проводимого лечения из исследования были исключены пациенты с тревогой и депрессией. Критерием ответа на терапию было снижение интенсивности боли по ВАШ более чем на 50%. У 84% пациентов через 1 сут после введения препарата был достигнут положительный лечебный эффект, а через 72 ч – у 94%. За 12 ч интенсивность боли снизилась с 7,4±0,92 см до 2,3±1,70 см; р<0,001. Применение опросника Мак-Гилла позволило оценить влияние препарата на компоненты боли. После однократного внутримышечного введения препарата Амбениум® парентерал отмечена положительная динамика балльной оценки характера боли по всем 3 подшкалам опросника Мак-Гилла.
Результаты данного исследования в условиях рутинной клинической практики согласуются с ранее проведенным сравнительным рандомизированным исследованием эффективности препарата Амбениум® парентерал в купировании острой БНЧС [10], в котором в качестве препарата сравнения был выбран диклофенак натрия (раствор для внутримышечного введения 75 мг). Анализ показал, что аналгезирующий эффект после введения препарата Амбениум® парентерал наступал статистически значимо (р=0,013) раньше (на 2 ч по медиане [95% ДИ 4,0–4,0]), чем после введения препарата диклофенак натрия (95% ДИ 6,0–6,0). Положительный клинический эффект формировался через 1 ч и длился в течение 24 ч после введения препарата. Число пациентов, у которых не наблюдали полного исчезновения боли или уменьшения боли на 75% и более по ВАШ за исследуемый временной промежуток (точка более 24 ч), составило 6 (7,32%) человек против 28 (34,15%) обследуемых лиц в группе препарата сравнения. Представленные параметры статистически значимо (р<0,001) различались более чем в 4,5 раза.
Еще одной задачей проведенного исследования явилась оценка влияния препарата Амбениум® парентерал на МТС, который может возникать рефлекторно у пациентов с болевым синдромом. В 1-е сутки после применения терапии у пациентов, участвующих в исследовании, отмечено уменьшение выраженности МТС от умеренно-тяжелой степени (медиана 13 баллов) до легкой (через 24 ч – медиана ИМС была равна 5 баллам).
В конце исследования (через 72 ч после введения препарата) медиана ИМС составила 1,5 балла. Полученные в ходе исследования данные свидетельствуют об эффективности препарата в купировании боли в спине.
К ограничениям данного исследования можно отнести неинтервенционный характер исследования и отсутствие группы сравнения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Курильченко Дмитрий Станиславович – канд. мед. наук, врач-невролог ФГБУ «ЦКБ с поликлиникой» УД Президента РФ, МИЦ «КоМед» (ООО «ЛР»). AuthorID: 361997
Dmitry S. Kurilchenko – Cand. Sci. (Med.), Central Clinical Hospital with polyclinic of the Office of the President of the Russian Federation, Medical Research Center "KoMed" (LLC "LR"). AuthorID: 361997
Казакова Майя Александровна – врач-невролог ГБУЗ ГП №23, ООО «Диагностика». E-mail: lap-ru@mail
Maya A. Kazakova – Neurologist, City Polyclinic No 23, Branch No 1, Diagnostics LLC. E-mail: lap-ru@mail
Купряшкина Юлия Геннадьевна – врач-невролог ГБУЗ «ДЦ №3», фил. 2. E-mail: Q89631467084@yandex.ru
Yulia G. Kupryashkina – Neurologist, Diagnostic Center No 3, Branch No 2 (City Polyclinic No 133).
E-mail: Q89631467084@yandex.ru
Феоктистова Мария Викторовна – врач-невролог, ФГБУ ФНКЦ ФМБА России
E-mail: maria-feoktistova@yandex.ru
Maria V. Feoktistova – Neurologist, Federal Scientific and Clinical Center of the FMBA of Russia.
E-mail: maria-feoktistova@yandex.ru
Крыжановский Сергей Михайлович – канд. мед. наук, доц. каф. неврологии ФГБУ ДПО ЦГМА УД Президента РФ, врач-невролог МИЦ «КоМед» (ООО «ЛР»). E-mail: smk@inbox.ru;
ORCID: 0000-0003-4010-4288; Scopus author ID: 35773345200;
Web of Science Researcher ID: AGN-5141-2022; РИНЦ AuthorID: 926648
Sergey M. kryzhanovskiy – Cand. Sci. (Med.), Central State Medical Academy of the Office of the President of the Russian Federation, Medical Research Center "KoMed" (LLC "LR").
E-mail: smk@inbox.ru; ORCID: 0000-0003-4010-4288;
Scopus author ID: 35773345200; Web of Science Researcher ID: AGN-5141-2022; Author ID: 926648
Чуканова Елена Игоревна – доц., проф. каф. неврологии, нейрохирургии и медицинской генетики лечебного фак-та, ФГБОУ ВО «РНИМУ им. Н.И. Пирогова».
E-mail: chukanova-elena@yandex.ru. ORCID: 0000-0002-32919615; Scopus: Registration ID 266132249804x87
Elena I. Chukanova – Assoc. Prof., Pirogov Russian National Research Medical University.
E-mail: chukanova-elena@yandex.ru.
ORCID: 0000-0002-32919615;
Scopus: Registration ID 266132249804x87
Статья поступила: 24.05.2024
Рецензия: 29.05.2024
Принята: 30.05.2024
Received: 24.05.2024
Revised: 29.05.2024
Accepted: 30.05.2024
Клинический разбор в общей медицине №5 2024
Боль в спине. Результаты неинтервенционного исследования применения препарата Амбениум® парентерал в условиях реальной клинической практики
Номера страниц в выпуске:21-26
Аннотация
Цель. Оценить эффективность, переносимость и безопасность препарата Амбениум® парентерал (фенилбутазон натрия 400 мг и лидокаина гидрохлорид 4 мг) при лечении пациентов с болью в нижней части спины (БНЧС).
Материалы и методы. В исследование включены 100 пациентов с БНЧС, которые получали однократно внутримышечно препарат Амбениум® парентерал. Продолжительность наблюдения составляла 3 сут. В качестве первичного критерия эффективности выбрано изменение интенсивности боли по визуальной аналоговой шкале – ВАШ (мм). Выраженность болевого синдрома оценивалась перед началом введения препарата (визит 1) и далее через 4, 6, 8 и 12 ч после его введения; а также на визите 2 (день 2) и на визите 3 (день 4). В качестве вторичных критериев диагностики использовалась оценка характера боли по опроснику характера боли Мак-Гилла, индексу мышечного синдрома, опроснику нарушения жизнедеятельности Роланда–Морриса. Также оценивался процент пациентов с «положительным ответом» по сравнению с исходным уровнем (снижение интенсивности боли по ВАШ более чем на 50%).
Результаты. Динамика первичного критерия эффективности – интенсивность боли по шкале ВАШ составила на визите 1 (средняя арифметическая + стандартное отклонение) 7,4±0,92 см, через 2 ч – 5,6±1,49 см, через 4 ч – 4,6±1,74 см, через 8 ч 3,0±1,79 см, через 12 ч – 2,3±1,70 см (р<0,001). Доля пациентов, ответивших на терапию, – снижение по шкале ВАШ более чем на 50% относительно исходного значения, – через 24 ч после первого введения составила 84% (95% доверительный интервал 75,0–91,0), на визите 3 – 94% (95% доверительный интервал 87,0–98,0); р<0,001. Динамика вторичных критериев эффективности – показатели индекса мышечного синдрома и балльная оценка по опроснику характера боли Мак-Гилла – показали достоверную положительную динамику (р<0,001). Системных нежелательных явлений не было зарегистрировано.
Заключение. Исследование продемонстрировало, что однократное внутримышечное введение препарата Амбениум® парентерал является эффективным, хорошо переносимым и безопасным средством для лечения БНЧС. Однократное применение препарата позволяет добиться значимого клинического эффекта в снижении интенсивности боли и восстановлении двигательной активности пациента.
Ключевые слова: боль в спине, лечение, Амбениум парентерал, фенилбутазон, лидокаин.
Для цитирования: Курильченко Д.С., Казакова М.А., Купряшкина Ю.Г., Феоктистова М.В., Крыжановский С.М., Чуканова Е.И. Боль в спине. Результаты неинтервенционного исследования применения препарата Амбениум® парентерал в условиях реальной клинической практики. Клинический разбор в общей медицине. 2024; 5 (5): 21–26. DOI: 10.47407/kr2024.5.5.00401
Цель. Оценить эффективность, переносимость и безопасность препарата Амбениум® парентерал (фенилбутазон натрия 400 мг и лидокаина гидрохлорид 4 мг) при лечении пациентов с болью в нижней части спины (БНЧС).
Материалы и методы. В исследование включены 100 пациентов с БНЧС, которые получали однократно внутримышечно препарат Амбениум® парентерал. Продолжительность наблюдения составляла 3 сут. В качестве первичного критерия эффективности выбрано изменение интенсивности боли по визуальной аналоговой шкале – ВАШ (мм). Выраженность болевого синдрома оценивалась перед началом введения препарата (визит 1) и далее через 4, 6, 8 и 12 ч после его введения; а также на визите 2 (день 2) и на визите 3 (день 4). В качестве вторичных критериев диагностики использовалась оценка характера боли по опроснику характера боли Мак-Гилла, индексу мышечного синдрома, опроснику нарушения жизнедеятельности Роланда–Морриса. Также оценивался процент пациентов с «положительным ответом» по сравнению с исходным уровнем (снижение интенсивности боли по ВАШ более чем на 50%).
Результаты. Динамика первичного критерия эффективности – интенсивность боли по шкале ВАШ составила на визите 1 (средняя арифметическая + стандартное отклонение) 7,4±0,92 см, через 2 ч – 5,6±1,49 см, через 4 ч – 4,6±1,74 см, через 8 ч 3,0±1,79 см, через 12 ч – 2,3±1,70 см (р<0,001). Доля пациентов, ответивших на терапию, – снижение по шкале ВАШ более чем на 50% относительно исходного значения, – через 24 ч после первого введения составила 84% (95% доверительный интервал 75,0–91,0), на визите 3 – 94% (95% доверительный интервал 87,0–98,0); р<0,001. Динамика вторичных критериев эффективности – показатели индекса мышечного синдрома и балльная оценка по опроснику характера боли Мак-Гилла – показали достоверную положительную динамику (р<0,001). Системных нежелательных явлений не было зарегистрировано.
Заключение. Исследование продемонстрировало, что однократное внутримышечное введение препарата Амбениум® парентерал является эффективным, хорошо переносимым и безопасным средством для лечения БНЧС. Однократное применение препарата позволяет добиться значимого клинического эффекта в снижении интенсивности боли и восстановлении двигательной активности пациента.
Ключевые слова: боль в спине, лечение, Амбениум парентерал, фенилбутазон, лидокаин.
Для цитирования: Курильченко Д.С., Казакова М.А., Купряшкина Ю.Г., Феоктистова М.В., Крыжановский С.М., Чуканова Е.И. Боль в спине. Результаты неинтервенционного исследования применения препарата Амбениум® парентерал в условиях реальной клинической практики. Клинический разбор в общей медицине. 2024; 5 (5): 21–26. DOI: 10.47407/kr2024.5.5.00401
Back pain. Results of a non-interventional study of using Ambenium® parenteral in routine clinical practice
Dmitry S. Kurilchenko1,2, Maya A. Kazakova3,4, Yulia G. Kupryashkina5, Maria V. Feoktistova6,Sergey M. Kryzhanovskiy2,7, Elena I. Chukanova8
1 Central Clinical Hospital with polyclinic of the Office of the President of the Russian Federation, Moscow, Russia;
2 Medical Research Center "KoMed" (LLC "LR"), Moscow, Russia;
3 City Polyclinic No 23, Branch No 1, Moscow, Russia;
4 Diagnostics LLC, Moscow, Russia;
5 Diagnostic Center No 3, Branch No 2 (City Polyclinic No 133), Moscow, Russia;
6 Demikhov City Clinical Hospital, Moscow, Russia;
7 Central State Medical Academy of the Office of the President of the Russian Federation, Moscow, Russia;
8 Pirogov Russian National Research Medical University, Moscow, Russia
chukanova-elena@yandex.ru
Abstract
Aim: to estimate efficacy, tolerability, and safety of Ambenium® parenteral [phenylbutazone sodium 400 mg and lidocaine hydrochloride 4 mg] used for treatment of patients with low back pain.
Methods. A total of 100 patients with low back pain (LBP), who received a single intramuscular injection of Ambenium® parenteral, were included in the study. The follow-up period was 3 days. The change in pain severity on VAS (mm) was selected as a primary outcome measure for efficacy. The pain syndrome severity was estimated before administration of the drug (visit 1) and 4, 6, 8 and 12 h after the drug administration, as well as during visits 2 (day 2) and 3 (day 4). The McGill Pain Questionnaire, muscle syndrome index (MSI), Roland-Morris Disability Questionnaire pain estimates were used as the secondary diagnostic criteria. The percentage of patients with the positive response relative to baseline (the decrease in pain severity on VAS by more than 50%) was also determined.
Results. The dynamics of the primary efficacy measure (pain severity on VAS) was as follows: 7.4 ± 0.92 cm (mean ± standard deviation) during visit 1, 5.6 ± 1.49 cm after 2 h, 4.6 ± 1.74 cm after 4 h, 3.0 ± 1.79 cm after 8 h; the VAS score was 2.3 ± 1.70 cm after 12 h (р<0.001). The share of patients who responded to therapy (with the decrease in pain severity on VAS by more than 50% relative to baseline) was 84% [95% CI: 75.0 – 91.0] 24 h after the first administration, 94% during visit 3 [95% CI: 87.0 – 98.0], р<0.001. The secondary efficacy criteria (muscle syndrome index and McGill Pain Questionnaire score) showed significant positive dynamics (р<0.001). No systemic adverse events were reported.
Conclusion. The study showed that a single intramuscular injection of Ambenium® parenteral was an efficient, well-tolerated and safe treatment option for low back pain. Administration of a single drug dose makes it possible to ensure a significant clinical effect reflected in the pain severity decrease and restoration of the patient’s motor activity.
Keywords: back pain, treatment, ambenium parenteral, phenylbutazone, lidocaine.
For citation: Kurilchenko D.S., Kazakova M.A., Kupryashkina Yu.G., Feoktistova M.V., Kryzhanovskiy S.M., Chukanova E.I. Back pain. Results of a non-interventional study of using Ambenium® parenteral in routine clinical practice. Clinical analysis in general medicine. 2024; 5 (5): 21–26 (In Russ.). DOI: 10.47407/kr2024.5.5.00401
Введение
Боль в нижней части спины (БНЧС) является серьезной проблемой здравоохранения и одной из основных причин инвалидизации. Хотя бы раз испытывали БНЧС 84% населения, из них в 44–78% случаев отмечаются рецидивы [1]. По данным эпидемиологических исследований, распространенность боли в спине варьирует в зависимости от социально-экономического уровня популяции, достигая 30% в странах с развитой экономикой [2]. Лечение боли представляет собой сложную проблему, что связано с разнообразием этиологических и патогенетических моментов развития БНЧС, вариабельности клинических проявлений и длительности течения, а также имеющихся определенных сложностей диагностики [3, 4].Основными фармакологическими группами, применяемыми для купирования боли являются: нестероидные противовоспалительные препараты (НПВП), миорелаксанты, противосудорожные препараты, антидепрессанты, препараты местного действия, содержащие НПВП [4]. В группу НПВП включен препарат Амбениум® [АТХ М01AА01, N01ВВ02] парентерал, раствор для внутримышечного введения. В состав препарата входят фенилбутазон натрия 400 мг и лидокаина гидрохлорид 4 мг. Фенилбутазон относится к группе производных пиразолона. Механизм действия пиразолоновых препаратов заключается в ингибировании циклооксигеназ (1 и 2-го типа), нарушении метаболизма арахидоновой кислоты, уменьшении простагландинов в очаге воспаления [5]. Наличие лидокаина гидрохлорида делает инъекцию препарата практически безболезненной, что повышает комплаенс пациентов. Объем раствора 2 мл способствует снижению риска развития абсцесса и повреждения мягких тканей [6].
Цель исследования – оценка эффективности, переносимости и безопасности препарата Амбениум® парентерал у пациентов с БНЧС (скелетно-мышечная неспецифическая боль).
Материалы и методы
Проведено открытое проспективное многоцентровое исследование с участием 4 клинических центров с февраля 2023 по июнь 2023 г. В исследовании принимали участие неврологи, травматологи и другие специалисты в центрах, где наблюдаются пациенты с БНЧС, как отражение реальной лечебной поликлинической практики.Исследование проводилось в соответствии с принципами доброкачественной клинической и эпидемиологической практики [7]. Исследование было одобрено Независимым междисциплинарным комитетом по этической экспертизе клинических исследований (выписка из заседания совета по этике, протокола №02 от 1 февраля 2023 г.). Популяцию исследования составили пациенты с БНЧС (скелетно-мышечная неспецифическая боль) с выраженностью интенсивности боли по по визуальной аналоговой шкале (ВАШ) ≥60 мм (6 см).
В исследование включались пациенты в возрасте от 18 до 65 лет, которым был назначен препарат Амбениум® парентерал. Все пациенты подписывали информированное согласие.
Критерии включения в исследование:
1. Мужчины и женщины в возрасте от 18 до 65 лет включительно.
2. Пациенты с БНЧС (скелетно-мышечной неспецифической), влияющей на жизнедеятельность пациента: интенсивность боли по шкале ВАШ ≥60 мм; по опроснику нарушений жизнедеятельности Роланда–Морриса ≥7 баллов и показатели балльной оценки по госпитальной шкале тревоги и депрессии (HADS) ≤7 баллов по каждой из подшкал для исключения влияния на интенсивность боли нарушений эмоционального состояния.
Основные критерии невключения: гиперчувствительность к фенилбутазону, лидокаину, анестетикам амидного типа или вспомогательным компонентам препарата, активные эрозивно-язвенные поражения желудка или двенадцатиперстной кишки или язвенная болезнь желудка и двенадцатиперстной кишки, язвенный колит, болезнь Крона, желудочно-кишечное кровотечение, спровоцированное приемом НПВП, в анамнезе, беременность, период грудного вскармливания.
Препарат назначался согласно инструкции к препарату Амбениум® парентерал [5], внутримышечно, однократно, медленно глубоко в мышцу в дозе 373,4 мг (2 мл). Продолжительность наблюдения составляла 3 сут и включала 3 визита: включение в исследование и введение препарата, наблюдение через 24 и через 72 ч.
Анализировались демографические и антропометрические параметры (возраст, пол, рост, масса тела, расчет индекса массы тела), анамнез боли, общемедицинский анамнез (данные о наличии сопутствующих заболеваний), лабораторные и инструментальные данные (рентгенография, магнитно-резонансная или компьютерная томография пояснично-крестцового отдела позвоночника) при их наличии.
Для оценки эффективности препарата использованы подходы, описанные в европейском руководстве по разработке лекарственных препаратов для лечения боли (EMA/CHMP/970057/2011) [8]. Были оценены: интенсивность и динамика боли, функциональное и эмоциональное состояние пациента, нарушения жизнедеятельности, доля пациентов, ответивших на терапию (пациенты, у которых на фоне терапии отмечается снижении интенсивности более чем на 50% относительно исходной оценки).
Первичной конечной точкой была выбрана динамика выраженности боли по ВАШ 0–10 [9]. Динамику интенсивности боли оценивали по ВАШ через 2, 4, 6, 8, 12, 24 и 72 ч после введения препарата. Пациента инструктировали, что боль оценивается после движения. Вторичными конечными точками были: динамика характера боли по опроснику Мак-Гилла (опросник боли Мак-Гилла в модификации В.В. Кузьменко и соавт., 1986) [10]; динамика наличия нарушений жизнедеятельности по опроснику Роланда–Морриса «Боль в нижней части спины и нарушение жизнедеятельности» (М. Roland и соавт., 1983) [11]; динамика индекса мышечного синдрома (ИМС) [12]. Также высчитывался процент пациентов с «положительным ответом» – снижение интенсивности боли по ВАШ через 48 ч по сравнению с исходным значением (до введения препарата) более чем на 50%.
Для исключения влияния нарушений эмоционального состояния на выраженность интенсивности боли у пациентов при скрининге использовалась HADS [13].
В исследование не включались пациенты, имеющие более 7 баллов по каждой подшкале HADS.
Безопасность и переносимость препарата оценивалась по зарегистрированным нежелательным явлениям, что предусматривало оценку жалоб, данных физикального обследования и осмотра места введения препарата.
Статистические методы
Анализ данных проводился при помощи методов описательной статистики. Для описания непрерывных переменных были использованы: среднее арифметическое значение, стандартное отклонение, 95% доверительные интервалы (ДИ), медиана, верхний и нижний квартили. Категориальные переменные представлены в виде процентов и 95% ДИ. Критические значение p и ДИ были рассчитаны как двусторонние. В исследовании был принят уровень статистической значимости 0,05 (двустороннее тестирование, все значения p были округлены до двух знаков после запятой). Замещение и восстановление пропущенных данных не предусматривались. Для тестирования значимости различий, нормально распределенных данных использованы соответствующие разновидности дисперсионного анализа с повторными измерениями (ANOVA repeated measures). В случае иных распределений был использован тест Вилкоксона. Для тестирования значимости различий категориальных данных были использованы тест хи-квадрат или точный тест Фишера. Количественные данные представлены в виде среднего арифметического и стандартного отклонения (СО). Для статистических расчетов был использован программный пакет R version 4.1.2 (The R Foundation for Statistical Computing, Vienna, Austria).Результаты
Проанализированы данные 100 пациентов (34 мужчин и 66 женщин) в возрасте от 22 до 65 лет, средний возраст составил 46,6±11,9 (медиана – 47,0). Индекс массы тела был равен 27,2±4,82 (медиана – 26,8, от 18,4 до 46,4 ед). Наиболее часто встречающимися сопутствующими заболеваниями у пациентов, вошедших в исследование, были: эссенциальная гипертензия – у 29 (29,0%), сахарный диабет – у 6 (6,0%) пациентов. У пациентов отсутствовал преморбидный фон эмоциональных расстройств, который мог бы оказать влияние на интерпретацию боли: показатели по HADS до введения препарата составили по подшкале «тревога» 3,0±2,18 и по подшкале «депрессия» 2,1±2,04. На момент 1-го дня исследования 28 пациентов принимали сопутствующую терапию. Основными сопутствующими препаратами (частота встречаемости более 8%) были миорелаксанты (12,0%), ингибиторы ангиотензинпревращающего фермента (11,0%), витамин B1 и его комбинация с витаминами B6 и B12 (9,0%).Первичным критерием эффективности являлось изменение интенсивности боли по ВАШ относительно исходного состояния пациентов. Перед началом терапии интенсивность боли по ВАШ составила 7,4±0,92 см, через 2 ч – 5,6±1,49 см, через 4 ч – 4,6±1,74 см, через 8 ч – 3,0±1,79 см, через 12 ч – 2,3±1,70 см. При анализе методом смешанной линейной модели с повторными измерениями изменения относительно исходного значения были статистически значимыми на всех временных промежутках (р<0,001).

Доля пациентов, ответивших на терапию через 24 ч после 1-го введения, составила 84% (84/100) [95% ДИ 75,0–91,0], на визите 3 – 94% (94/100) [95% ДИ 87,0–98,0]; р<0,001. На рис. 1 представлено графическое изображение динамики интенсивности боли по ВАШ.
В ходе исследования также оценивалось ощущение боли по опроснику боли Мак-Гилла, который зарекомендовал себя как надежный и достоверный инструмент измерения компонентов боли [14]. Опросник включает в себя три шкалы: сенсорную (перечень ощущений боли) – шкала 1, аффективную (воздействие боли на психику) – шкала 2 и эвалюативную (оценка интенсивности боли) – шкала 3. В таблице представлены результаты анализа опросника нарушений жизнедеятельности Мак-Гилла.

 Влияние препарата на выраженность мышечно-тонического синдрома (МТС) осуществлялось при помощи вычисления ИМС до применения препарата Амбениум® парентерал и после. Оценка проводилась лечащим врачом по 7 критериям, каждый из них оценивался по 3-балльной системе. Критерии соответствуют состоянию пациента на момент заполнения опросника. Оценка ИМС (по сумме баллов названных критериев/признаков): 1-я степень (легкая) – ИМС до 5 баллов; 2-я (средняя, умеренная) – от 5 до 12 баллов; 3-я (тяжелая, выраженная) – более 12 баллов. Исследование показало клинически значимое улучшение – ИМС на визите 1 составил (средняя арифметическая ± СО, медиана) 12,8±2,13, 13,0 ед, через 2 ч после введения – 9,6±3,38, 10,0 ед, через 24 ч – 4,6±3,49, 5,0 ед, на визите 3 – 3,0±2,97, 1,5 ед; р<0,001. Результаты оценки качества жизни у пациентов после применения препарата будут представлены в отдельной публикации.
Влияние препарата на выраженность мышечно-тонического синдрома (МТС) осуществлялось при помощи вычисления ИМС до применения препарата Амбениум® парентерал и после. Оценка проводилась лечащим врачом по 7 критериям, каждый из них оценивался по 3-балльной системе. Критерии соответствуют состоянию пациента на момент заполнения опросника. Оценка ИМС (по сумме баллов названных критериев/признаков): 1-я степень (легкая) – ИМС до 5 баллов; 2-я (средняя, умеренная) – от 5 до 12 баллов; 3-я (тяжелая, выраженная) – более 12 баллов. Исследование показало клинически значимое улучшение – ИМС на визите 1 составил (средняя арифметическая ± СО, медиана) 12,8±2,13, 13,0 ед, через 2 ч после введения – 9,6±3,38, 10,0 ед, через 24 ч – 4,6±3,49, 5,0 ед, на визите 3 – 3,0±2,97, 1,5 ед; р<0,001. Результаты оценки качества жизни у пациентов после применения препарата будут представлены в отдельной публикации.При анализе возникновения нежелательных явлений отмечено, что в ходе исследования, у 1 (1%) пациента была припухлость в месте введения препарата, гиперемия – у 4 (4%) и болезненность в месте введения – у 12 (12%) пациентов. Все явления были легкими и незначительными и к моменту завершения наблюдения полностью регрессировали. Системных нежелательных явлений не было зарегистрировано.
Обсуждение
Клинические проявления БНЧС разнообразны, имеют различные этиологические и патогенетические моменты их формирования, а также зависят от ряда усугубляющих факторов: состояние психического здоровья, сопутствующих заболеваний, социально-экономических факторов, генетической предрасположенности [14]. На выбор эффективного лекарственного средства, используемого для купирования боли, влияют точность диагностики и понимание механизмов формирования боли у каждого конкретного пациента [15].Основной целью медикаментозной терапии является купирование боли с максимально возможным функциональным восстановлением [16, 17]. В связи с этим для практического врача важно понимание, через какое время можно ожидать наступление обезболивающего эффекта препарата, возможная длительность его лечебного эффекта, а также у какого процента пациентов может быть достигнут положительный ответ на проводимое лечение.
Для получения дополнительных данных об эффективности и безопасности препарата Амбениум® парентерал в условиях рутинной клинической практики было проведено настоящее исследование. Дизайн исследования был разработан с учетом рекомендаций Европейского агентства по изучению препаратов, обладающих обезболивающими эффектами (EMEA) [14]. Для более объективной оценки противоболевого эффекта проводимого лечения из исследования были исключены пациенты с тревогой и депрессией. Критерием ответа на терапию было снижение интенсивности боли по ВАШ более чем на 50%. У 84% пациентов через 1 сут после введения препарата был достигнут положительный лечебный эффект, а через 72 ч – у 94%. За 12 ч интенсивность боли снизилась с 7,4±0,92 см до 2,3±1,70 см; р<0,001. Применение опросника Мак-Гилла позволило оценить влияние препарата на компоненты боли. После однократного внутримышечного введения препарата Амбениум® парентерал отмечена положительная динамика балльной оценки характера боли по всем 3 подшкалам опросника Мак-Гилла.
Результаты данного исследования в условиях рутинной клинической практики согласуются с ранее проведенным сравнительным рандомизированным исследованием эффективности препарата Амбениум® парентерал в купировании острой БНЧС [10], в котором в качестве препарата сравнения был выбран диклофенак натрия (раствор для внутримышечного введения 75 мг). Анализ показал, что аналгезирующий эффект после введения препарата Амбениум® парентерал наступал статистически значимо (р=0,013) раньше (на 2 ч по медиане [95% ДИ 4,0–4,0]), чем после введения препарата диклофенак натрия (95% ДИ 6,0–6,0). Положительный клинический эффект формировался через 1 ч и длился в течение 24 ч после введения препарата. Число пациентов, у которых не наблюдали полного исчезновения боли или уменьшения боли на 75% и более по ВАШ за исследуемый временной промежуток (точка более 24 ч), составило 6 (7,32%) человек против 28 (34,15%) обследуемых лиц в группе препарата сравнения. Представленные параметры статистически значимо (р<0,001) различались более чем в 4,5 раза.
Еще одной задачей проведенного исследования явилась оценка влияния препарата Амбениум® парентерал на МТС, который может возникать рефлекторно у пациентов с болевым синдромом. В 1-е сутки после применения терапии у пациентов, участвующих в исследовании, отмечено уменьшение выраженности МТС от умеренно-тяжелой степени (медиана 13 баллов) до легкой (через 24 ч – медиана ИМС была равна 5 баллам).
В конце исследования (через 72 ч после введения препарата) медиана ИМС составила 1,5 балла. Полученные в ходе исследования данные свидетельствуют об эффективности препарата в купировании боли в спине.
К ограничениям данного исследования можно отнести неинтервенционный характер исследования и отсутствие группы сравнения.
Заключение
Исследование продемонстрировало, что однократное внутримышечное введение препарата Амбениум® парентерал является эффективным, хорошо переносимым и безопасным средством для лечения БНЧС. Однократное применение препарата позволяет добиться значимого клинического эффекта в снижении интенсивности боли и восстановлении двигательной активности пациента.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Курильченко Дмитрий Станиславович – канд. мед. наук, врач-невролог ФГБУ «ЦКБ с поликлиникой» УД Президента РФ, МИЦ «КоМед» (ООО «ЛР»). AuthorID: 361997
Dmitry S. Kurilchenko – Cand. Sci. (Med.), Central Clinical Hospital with polyclinic of the Office of the President of the Russian Federation, Medical Research Center "KoMed" (LLC "LR"). AuthorID: 361997
Казакова Майя Александровна – врач-невролог ГБУЗ ГП №23, ООО «Диагностика». E-mail: lap-ru@mail
Maya A. Kazakova – Neurologist, City Polyclinic No 23, Branch No 1, Diagnostics LLC. E-mail: lap-ru@mail
Купряшкина Юлия Геннадьевна – врач-невролог ГБУЗ «ДЦ №3», фил. 2. E-mail: Q89631467084@yandex.ru
Yulia G. Kupryashkina – Neurologist, Diagnostic Center No 3, Branch No 2 (City Polyclinic No 133).
E-mail: Q89631467084@yandex.ru
Феоктистова Мария Викторовна – врач-невролог, ФГБУ ФНКЦ ФМБА России
E-mail: maria-feoktistova@yandex.ru
Maria V. Feoktistova – Neurologist, Federal Scientific and Clinical Center of the FMBA of Russia.
E-mail: maria-feoktistova@yandex.ru
Крыжановский Сергей Михайлович – канд. мед. наук, доц. каф. неврологии ФГБУ ДПО ЦГМА УД Президента РФ, врач-невролог МИЦ «КоМед» (ООО «ЛР»). E-mail: smk@inbox.ru;
ORCID: 0000-0003-4010-4288; Scopus author ID: 35773345200;
Web of Science Researcher ID: AGN-5141-2022; РИНЦ AuthorID: 926648
Sergey M. kryzhanovskiy – Cand. Sci. (Med.), Central State Medical Academy of the Office of the President of the Russian Federation, Medical Research Center "KoMed" (LLC "LR").
E-mail: smk@inbox.ru; ORCID: 0000-0003-4010-4288;
Scopus author ID: 35773345200; Web of Science Researcher ID: AGN-5141-2022; Author ID: 926648
Чуканова Елена Игоревна – доц., проф. каф. неврологии, нейрохирургии и медицинской генетики лечебного фак-та, ФГБОУ ВО «РНИМУ им. Н.И. Пирогова».
E-mail: chukanova-elena@yandex.ru. ORCID: 0000-0002-32919615; Scopus: Registration ID 266132249804x87
Elena I. Chukanova – Assoc. Prof., Pirogov Russian National Research Medical University.
E-mail: chukanova-elena@yandex.ru.
ORCID: 0000-0002-32919615;
Scopus: Registration ID 266132249804x87
Статья поступила: 24.05.2024
Рецензия: 29.05.2024
Принята: 30.05.2024
Received: 24.05.2024
Revised: 29.05.2024
Accepted: 30.05.2024
Список исп. литературыСкрыть список1. Traeger A, Buchbinder R, Harris I, Maher C. Diagnosis and management of low-back pain in primary care. CMAJ 2017;(189):E1386-95. DOI: 10.1503/cmaj.170527
2. Low da Silva OT, Joaquim AF, Patel AA. Management of Low Back Pain. In: Joaquim A, Ghizoni E, Tedeschi H, Ferreira M (eds). Fundamentals of Neurosurgery. Springer, Cham. 2019. DOI: 10.1007/978-3-030-17649-5_13
3. Refshauge KM, Maher CG. Low back pain investigations and prognosis: a review. Br J Sports Med 2006;40:494-8. DOI: 10.1136/bjsm. 2004.016659
4. Corp N, Mansell G, Stynes S et al. Evidence-based treatment recommendations for neck and low back pain across Europe: a systematic review of guidelines. Eur J Pain 2021;25:275-95. DOI: 10.1002/ejp.1679
5. Инструкция по медицинскому применению лекарственного препарата АМБЕНИУМ® парентерал. Номер РУ ЛП-006040. Эл. ресурс: https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid= 9d406fac-ebbf-40a3-936f-88a8783d8619
Instructions for the medical use of the drug AMBENIUM parenteral. RU LP number-006040. E-resource: https://grls.minzdrav.gov.ru/ Grls_View_v2.aspx?routingGuid=9d406fac-ebbf-40a3-936f-88a8783 d8619 (in Russian).
6. Лукьянчук Е. Выбор нестероидных противовоспалительных препаратов для купирования острой боли при ревматических заболеваниях. Український ревматологічний журнал. 2015;(2):29-30.
Lukyanchuk E. The choice of nonsteroidal anti-inflammatory drugs for the relief of acute pain in rheumatic diseases. Ukrainian Rheumatology journal. 2015;(2):29-30 (in Russian).
7. ICH Topic E 6 (R1) Guideline for Good Clinical Prac-tice. URL:http://www.ema.europa.eu/pdfs/human/ich/013595en.pdf
8. Guideline on the clinical development of medicinal products intended for the treatment of pain/15 December 2016 EMA/CHMP/970057/ 2011 Committee for Medicinal Products for Human Use (CHMP) Microsoft Word – Guideline on the clinical development of medicinal products intended for the treatment of pain (europa.eu).
9. Gélinas C, Puntillo KA, Levin P, et al: The Behavior Pain Assessment Tool for critically illadults: A validation study in 28 countries. Pain 2017;158:811-21.
10. Кузьменко В.В., Фокин В.А., Соков Е.Л. и др. Психологические методы количественной оценки боли. Советская медицина. 1986;10:44-8.
Kuzmenko V.V., Fokin V.A., Sokov E.L., etc. Psychological methods for quantifying pain. Soviet medicine. 1986;10:44-8.
11. Roland M, Morris R. A study of the natural history of low-back pain: part II: development of guidelines for trials of treatment in primary care. Spine. 1983 Mar 1;8(2):145-50.
12. Салихов И.Г., Хабиров Р.А., Попелянский Я.Ю. Клинические проявления поражения скелетных мышц при ревматоидном артрите. Ревматология. 1987;(1):43.
Salikhov, I. G., Khabirov R. A., Popelyansky Ya. Yu. Clinical manifestations of skeletal muscle damage in rheumatoid arthritis. Rheumatology. 1987;(1):43.
13. Zigmond AS, Snaith RP. The Hospital Anxiety and Depression Scale. Acta psychiatrica Scandinavica. 1983;67(6):361-370. DOI: 10.1111/j.1600-0447.1983.tb09716.x
14. Vlaeyen JW, Maher CG, Wiech K et al. Low back pain. Nat Rev Dis Primers. 2018;(4):52. DOI: 10.1038/s41572-018-0052-1
15. Varrassi G, Coaccioli S, De-Andrés J, et al. Expert consensus on clinical use of an orally administered dexketoprofen plus tramadol fixed-dose combination in moderate-to-severe acute pain: a Delphi study. Adv Ther. 2019, 36:3174-85. DOI: 10.1007/s12325-019-01096-0
16. Varrassi G, Hanna M, Macheras G et al. Multimodal analgesia in moderate-to-severe pain: a role for a new fixed combination of dexketoprofen and tramadol. Curr Med Res Opin 2017, 33:1165-73. DOI: 10.1080/ 03007995.2017.1310092
17. Elwyn G, Frosch DL, Kobrin S. Implementing shared decision-making: consider all the consequences. Implement Sci 2016;(11):114. DOI: 10.1186/s13012-016-0480-9
18. Василюк В.Б., Фарапонова М.В., Сыраева Г.И. Выбор НПВП для лечения острой и хронической боли у пациентов с ревматоидным артритом на амбулаторно-поликлиническом этапе. Русский медицинский журнал. 2020;28(12):30-4.
Vasilyuk V.B., Faraponova M.V., Suraeva G.I. The choice of NSAIDs for the treatment of acute and chronic pain in patients with rheumatoid arthritis at the outpatient stage. Russian Medical Journal. 2020;28(12):30-4.
18 июня 2024
Количество просмотров: 492

