Клинический разбор в общей медицине №5 2024
Pavlov First Saint Petersburg State Medical University, Saint Petersburg, Russia
kushnir.yana2014@yandex.ru
Abstract
Chronic inflammatory demyelinating polyneuropathy (CIDP) is an orphan disease of the peripheral nervous system. The clinical phenotypes of CIDP may influence the choice of primary pathogenetic therapy. In some cases, viral infection may be a trigger for the development of an immune-mediated process. The role of coronavirus infection (COVID-19) as a trigger of the clinical manifestation of CIDP, as well as the impact of COVID-19 on the disease course and response to pathogenetic therapy remains an unexplored issue. The paper presents a series of clinical cases CIDP with manifestations after COVID-19 infection and review of publications.
Keywords: Chronic inflammatory demyelinating polyneuropathy, coronavirus infection, COVID-19, electroneuromyography.
For citation: Kushnir Y.B., Bezvodinskikh A.I., Vladykina A.V., Totolyan N.A. Phenotypes of chronic inflammatory demyelinating polyneuropathies with manifestation after coronavirus infection COVID-19. Clinical review for general practice. 2024; 5 (5): 28–32 (In Russ.). DOI: 10.47407/kr2024.5.5.00402
Этиология и патогенез ХВДП остаются не до конца изученными, однако установлен вклад клеточного и гуморального звеньев иммунитета: срыв ауторегуляции Т-лимфоцитов с утратой аутотолерантности, с пролиферацией аутореактивных В-лимфоцитов и, как следствие, возникновением участков демиелинизации периферических нервных волокон с последующей дегенерацией аксонов [2].
С учетом дизиммунной природы заболевания, в качестве 1-й линии терапии рассматриваются внутривенная высокодозная иммунотерапия человеческим иммуно-глобулином (ВВИГ), глюкокортикостероиды (ГКС) и экстракорпоральные методы терапии – высокообъемный плазмаферез.
В качестве 2-й линии терапии в настоящее время предпочтительным остается назначение анти-CD20 препарата Ритуксимаб, не зарегистрированного по показанию ХВДП, который может быть рассмотрен при неэффективности терапии 1-й линии, так как риск причинения вреда здоровью вследствие его применения при ХВДП не превышает ожидаемой эффективности [3–6].
Продолжает накапливаться опыт наблюдений за пациентами с дебютом ХВДП после новой коронавирусной инфекции (COVID-19). Согласно результатам данного наблюдательного исследования, эта подгруппа больных может отличаться по выраженности и особенностям клинических проявлений, а также по лабораторным признакам.
Цель: охарактеризовать клинико-лабораторные особенности и подходы к патогенетической терапии у пациентов с дебютом ХВДП после перенесенного COVID-19 в сравнении с доступными научно-медицинскими данными.
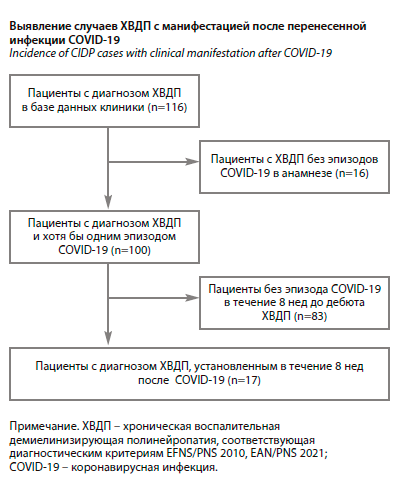 В ретроспективно-проспективном исследовании, проведенном в клинике неврологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» в период с 2020 по 2023 г., были проанализированы данные 116 пациентов с ХВДП (см. рисунок), соответствующих диагностическим критериям EFNS/PNS 2010, EAN/PNS 2021. Среди них подгруппа из 100 пациентов (54 мужчины и 46 женщин) имела в анамнезе инфекцию COVID-19, 17 пациентам (11 мужчин и 6 женщин) диагноз ХВДП установлен в течение 8 нед после инфицирования COVID-19. Всем пациентам выполнялось общепринятое обследование для подтверждения диагноза и исключения альтернативных заболеваний, которое включало оценку неврологического статуса, оценку наличия парапротеина сыворотки методом иммунофиксации, люмбальная пункция с определением уровня белка в ликворе, электронейромиография (ЭНМГ) верхних и нижних конечностей, скрининг ревматологической патологии, генетическое исследование для исключения наследственных полинейропатий: 29% (n=5) пациентов скринированы на наследственную транстиретиновую полинейропатию. Проведен анализ данных доступных источников из базы PubMed, описывающих клинические случаи ассоциации ХВДП и COVID-19, в анализ включены все публикации (9 источников), вне зависимости от количества представленных в них наблюдений и других критериев.
В ретроспективно-проспективном исследовании, проведенном в клинике неврологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» в период с 2020 по 2023 г., были проанализированы данные 116 пациентов с ХВДП (см. рисунок), соответствующих диагностическим критериям EFNS/PNS 2010, EAN/PNS 2021. Среди них подгруппа из 100 пациентов (54 мужчины и 46 женщин) имела в анамнезе инфекцию COVID-19, 17 пациентам (11 мужчин и 6 женщин) диагноз ХВДП установлен в течение 8 нед после инфицирования COVID-19. Всем пациентам выполнялось общепринятое обследование для подтверждения диагноза и исключения альтернативных заболеваний, которое включало оценку неврологического статуса, оценку наличия парапротеина сыворотки методом иммунофиксации, люмбальная пункция с определением уровня белка в ликворе, электронейромиография (ЭНМГ) верхних и нижних конечностей, скрининг ревматологической патологии, генетическое исследование для исключения наследственных полинейропатий: 29% (n=5) пациентов скринированы на наследственную транстиретиновую полинейропатию. Проведен анализ данных доступных источников из базы PubMed, описывающих клинические случаи ассоциации ХВДП и COVID-19, в анализ включены все публикации (9 источников), вне зависимости от количества представленных в них наблюдений и других критериев.
У 12 из 17 пациентов в дебюте заболевания был выявлен типичный клинический фенотип ХВДП (табл. 1).
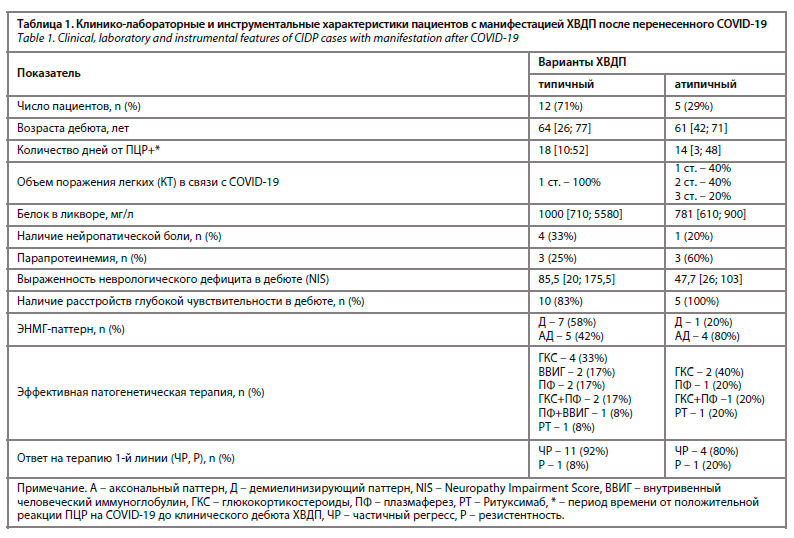
Структура атипичных вариантов ХВДП была представлена следующими фенотипами: изолированный сенсорный фенотип (n=1; 6%), моторный (n=2; 12%), мультифокальная приобретенная сенсорная и моторная нейропатия (n=1; 6%), ХВДП с острым началом (n=1; 6%). У 29% (n=5) пациентов нейропатический болевой синдром был одной из ведущих жалоб в дебюте заболевания. Прогрессирующее течение в первый год заболевания было выявлено у 53% (n=9) пациентов: из них 56% (n=5) с типичным фенотипом и 44% (n=4) с атипичным. Медиана выраженности неврологического дефицита по NIS до начала патогенетической терапии составляла 76 [20; 175,5] баллов. У 10 из 17 пациентов выявлено значимое коморбидное потенциально дизиммунное состояние. Среди них моноклональная гаммапатия неврологического значения выявлена у 6 (35%) пациентов, злокачественное новообразование – у 2 (12%) пациентов, язвенный колит – у 1 (6%) пациента и эссенциальная тромбоцитопения – у 1 (6%). У 2 (12%) был сахарный диабет 2-го типа.
На момент постановки диагноза люмбальная пункция выполнялась 13 пациентам, у всех зафиксировано повышение уровня белка в ликворе, с медианой 0,9 [0,61; 5,58] г/мл. Все пациенты получали стартовую патогенетическую терапию 1-й линии, но 2 (12%) пациентам потребовался переход к терапии 2-й линии в связи с неэффективностью терапии 1-й линии.
ХВДП относится к орфанным неврологическим заболеваниям с распространенностью 2,81–4,77 на 100 тыс. человек [7, 8]. Механизм демиелинизации при ХВДП полностью не изучен, включает в себя клеточные и гуморальные иммуноопосредованные реакции. Основными мишенями аутоагрессии считаются перехваты Ранвье, начальный сегмент аксона и паранодальная область. Различные патогенетические мишени и определяют фенотипические варианты ХВДП [9]. Описаны случаи дебюта ХВДП после перенесенного инфекционного процесса и реже вакцинации. Прямая причинно-следственная связь остается недоказанной, факт перенесенной инфекции, вероятно, является триггером развития аутоиммунного процесса [10]. Механизм молекулярной мимикрии между инфекционными агентами и компонентами периферических нервов также является потенциальным механизмом развития ХВДП [11]. В научной литературе описаны серии случаев дебюта ХВДП на фоне перенесенной вирусной инфекции. Так, в исследовании итальянской базы данных P. Doneddu и соавт. [12] показано, что предшествующая респираторная инфекция в течение 1–42 дней до начала ХВДП зарегистрирована у 12% пациентов. В исследовании Y. Rajabally и соавт. [10] сообщалось о развитии ХВДП в течение 6 нед после респираторной или желудочно-кишечной инфекции у 9,3% пациентов. Данная группа пациентов отличалась более молодым возрастом дебюта и чаще – острым началом ХВДП [10]. Важно отметить, что случаи манифестации ХВДП в период после перенесенных инфекций отмечаются с невысокой частотой, что может свидетельствовать о роли инфекции как дополнительного триггера уже имеющегося субклинического процесса. Достоверная причинно-следственная связь между респираторными инфекциями и ХВДП, в отличие от острой воспалительной демиелинизирующей полинейропатии (ОВДП), на текущий момент не выявлена.
Общая частота нейропсихиатрических осложнений COVID-19 в среднем составляет 33%, данные о частоте ХВДП после перенесенного COVID-19 отсутствуют, а публикации ограничены описанием отдельных клинических случаев [23]. В исследование N. Hasrat и соавт. были включены 896 пациентов без COVID-19 – у 0,29% (n=3) была выявлена дизиммунная полинейропатия; 1344 пациента перенесли коронавирусную инфекцию за 12 мес до дебюта неврологических симптомов: воспалительная полинейропатия была выявлена у 1,14% (ОВДП n=13; ХВДП n=5). Авторы исследования рассматривают COVID-19 как возможный триггер увеличения частоты дизиммунных полинейропатий [24].
В литературе описаны случаи стремительного развития симптомов после COVID-19: так, в публикации M. Ates и соавт. [22] описан случай дизиммунной полинейропатии с наличием трех пиков нарастания неврологического дефицита в течение первых 8 нед заболевания, в связи с чем первоначально пациенту был установлен диагноз ОВДП.
На основании анализа представленных в данной публикации собственных 17 случаев дебюта ХВДП после перенесенного COVID-19 может быть продемонстрировано наличие общих клинико-лабораторных особенностей, а именно: данная группа характеризуется выраженным неврологическим дефицитом у всех 17 (100%) пациентов с расстройствами глубокой чувствительности у 15 из 17 (88%) в дебюте заболевания, высоким содержанием белка в ликворе у 17 (100%), а у 6 (35%) из 17 был выявлен парапротеин в сыворотке крови.
В изученной литературе [15, 17–22] описаны дебюты 1 (10% [1/10]) атипичного варианта ХВДП и 9 типичных (90% [9/10]), в то время как в результате собственных наблюдений выявлено 5 атипичных вариантов (29% [5/17]) против 12 (71% [12/17]) типичных. Нейропатический болевой синдром в дебюте встречался у 10% (1/10) пациентов по данным публикаций, в собственной выборке таких пациентов оказалось 29% (5/17). У всех пациентов из проанализированных публикаций был получен полный или частичный ответ на патогенетическую терапию 1-й линии – ВВИГ (n=6), ГКС (n=4), в отличие от личных данных – 12% (2/17) пациентов не ответили на терапию 1-й линии. По данным, представленным в публикациях, не проводилась оценка парапротеина в сыворотке крови.
По результатам собственных наблюдений, типичная ХВДП развивалась после легкого течения COVID-19 (КТ-1 в 100% случаев), в то время как атипичные варианты ХВДП зафиксированы после любой тяжести инфекционного процесса. Для получения достоверных статистических данных по атипичным вариантам ХВДП необходимо продолжение исследований с увеличением размера выборки.
2. ХВДП с манифестацией в короткие сроки после инфекции COVID-19 по результатам серии 17 ретроспективно-проспективных наблюдений представляет группу с преимущественно тяжелым течением и высокой частотой коморбидности иммунопатологических состояний.
3. Особенности течения случаев ХВДП после инфекции COVID-19 могут включать более высокую частоту резистентности к патогенетической терапии 1-й линии, что требует разработки алгоритмов мониторинга эффективности терапии
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Кушнир Яна Богдановна – врач-невролог отделения неврологии №1, ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова».
E-mail: kushnir.yana2014@yandex.ru; ORCID: 0000-0001-7891-9883
Yana B. Kushnir – Neurologist, Pavlov First Saint Petersburg State Medical University.
E-mail: kushnir.yana2014@yandex.ru;
ORCID: 0000-0001-7891-9883
Александр Игоревич Безводинских – клин. ординатор отд-ния неврологии №1, ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова».
E-mail: a.bezvodinskih@mail.ru:ORCID iD: 0000-0003-2846-6411
Alexander I. Bezvodinskikh – Clinical Resident, Pavlov First Saint Petersburg State Medical University.
E-mail: a.bezvodinskih@mail.ru;
ORCID: 0000-0003-2846-6411
Владыкина Анастасия Владимировна – клин. ординатор отд-ния неврологии №1, ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова».
E-mail: vladykina.anastasiya@gmail.com;
ORCID: 0000-0003-3666-9622
Anastasia V. Vladykina – Clinical Resident, Pavlov First Saint Petersburg State Medical University.
E-mail: vladykina.anastasiya@gmail.com;
ORCID: 0000-0003-3666-9622
Наталья Агафоновна Тотолян – д-р мед. наук, проф. каф. неврологии, ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова».
E-mail: ntotolyan@mail.ru; ORCID: 0000-0002-6715-8203
Natalia A. Totolyan – Dr. Sci. (Med.), Prof., Pavlov First Saint Petersburg State Medical University. E-mail: ntotolyan@mail.ru; ORCID: 0000-0002-6715-8203
Поступила в редакцию: 24.04.2024
Поступила после рецензирования: 08.05.2024
Принята к публикации: 16.05.2024
Received: 24.04.2024
Revised: 08.05.2024
Accepted: 16.05.2024
Клинический разбор в общей медицине №5 2024
Особенности фенотипов хронических воспалительных демиелинизирующих полинейропатий с дебютами после перенесенного COVID-19
Номера страниц в выпуске:28-32
Аннотация
Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) – орфанное заболевание периферической нервной системы. Клинические фенотипы ХВДП могут значимо влиять на выбор первичной патогенетической терапии. В ряде случаев вирусная инфекция может быть триггером развития иммунопатологического процесса. Роль коронавирусной инфекции (COVID-19) в качестве триггера манифестации ХВДП, а также ее влияние на течение заболевания и ответ на патогенетическую терапию остается неизученным вопросом. В статье представлена серия собственных клинических наблюдений пациентов с дебютами ХВДП после перенесенной инфекции COVID-19 с кратким обзором публикаций.
Ключевые слова: хроническая воспалительная демиелинизирующая полинейропатия, инфекция COVID-19, электронейромиография.
Для цитирования: Кушнир Я.Б., Безводинских А.И., Владыкина А.В., Тотолян Н.А. Особенности фенотипов хронических воспалительных демиелинизирующих полинейропатий с дебютами после перенесенного COVID-19. Клинический разбор в общей медицине. 2024; 5 (5): 28–32. DOI: 10.47407/kr2024.5.5.00402
Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) – орфанное заболевание периферической нервной системы. Клинические фенотипы ХВДП могут значимо влиять на выбор первичной патогенетической терапии. В ряде случаев вирусная инфекция может быть триггером развития иммунопатологического процесса. Роль коронавирусной инфекции (COVID-19) в качестве триггера манифестации ХВДП, а также ее влияние на течение заболевания и ответ на патогенетическую терапию остается неизученным вопросом. В статье представлена серия собственных клинических наблюдений пациентов с дебютами ХВДП после перенесенной инфекции COVID-19 с кратким обзором публикаций.
Ключевые слова: хроническая воспалительная демиелинизирующая полинейропатия, инфекция COVID-19, электронейромиография.
Для цитирования: Кушнир Я.Б., Безводинских А.И., Владыкина А.В., Тотолян Н.А. Особенности фенотипов хронических воспалительных демиелинизирующих полинейропатий с дебютами после перенесенного COVID-19. Клинический разбор в общей медицине. 2024; 5 (5): 28–32. DOI: 10.47407/kr2024.5.5.00402
Phenotypes of chronic inflammatory demyelinating polyneuropathies with manifestation after coronavirus infection COVID-19
Yana B. Kushnir, Alexander I. Bezvodinskikh, Anastasia V. Vladykina, Natalia A. TotolyanPavlov First Saint Petersburg State Medical University, Saint Petersburg, Russia
kushnir.yana2014@yandex.ru
Abstract
Chronic inflammatory demyelinating polyneuropathy (CIDP) is an orphan disease of the peripheral nervous system. The clinical phenotypes of CIDP may influence the choice of primary pathogenetic therapy. In some cases, viral infection may be a trigger for the development of an immune-mediated process. The role of coronavirus infection (COVID-19) as a trigger of the clinical manifestation of CIDP, as well as the impact of COVID-19 on the disease course and response to pathogenetic therapy remains an unexplored issue. The paper presents a series of clinical cases CIDP with manifestations after COVID-19 infection and review of publications.
Keywords: Chronic inflammatory demyelinating polyneuropathy, coronavirus infection, COVID-19, electroneuromyography.
For citation: Kushnir Y.B., Bezvodinskikh A.I., Vladykina A.V., Totolyan N.A. Phenotypes of chronic inflammatory demyelinating polyneuropathies with manifestation after coronavirus infection COVID-19. Clinical review for general practice. 2024; 5 (5): 28–32 (In Russ.). DOI: 10.47407/kr2024.5.5.00402
Введение
Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) – группа гетерогенных по клинической картине дизиммунных полинейропатий с периодом нарастания симптомов от дебюта заболевания до стабилизации более 8 нед и определенными электрофизиологическими признаками [1].Этиология и патогенез ХВДП остаются не до конца изученными, однако установлен вклад клеточного и гуморального звеньев иммунитета: срыв ауторегуляции Т-лимфоцитов с утратой аутотолерантности, с пролиферацией аутореактивных В-лимфоцитов и, как следствие, возникновением участков демиелинизации периферических нервных волокон с последующей дегенерацией аксонов [2].
С учетом дизиммунной природы заболевания, в качестве 1-й линии терапии рассматриваются внутривенная высокодозная иммунотерапия человеческим иммуно-глобулином (ВВИГ), глюкокортикостероиды (ГКС) и экстракорпоральные методы терапии – высокообъемный плазмаферез.
В качестве 2-й линии терапии в настоящее время предпочтительным остается назначение анти-CD20 препарата Ритуксимаб, не зарегистрированного по показанию ХВДП, который может быть рассмотрен при неэффективности терапии 1-й линии, так как риск причинения вреда здоровью вследствие его применения при ХВДП не превышает ожидаемой эффективности [3–6].
Продолжает накапливаться опыт наблюдений за пациентами с дебютом ХВДП после новой коронавирусной инфекции (COVID-19). Согласно результатам данного наблюдательного исследования, эта подгруппа больных может отличаться по выраженности и особенностям клинических проявлений, а также по лабораторным признакам.
Цель: охарактеризовать клинико-лабораторные особенности и подходы к патогенетической терапии у пациентов с дебютом ХВДП после перенесенного COVID-19 в сравнении с доступными научно-медицинскими данными.
Материалы и методы
 В ретроспективно-проспективном исследовании, проведенном в клинике неврологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» в период с 2020 по 2023 г., были проанализированы данные 116 пациентов с ХВДП (см. рисунок), соответствующих диагностическим критериям EFNS/PNS 2010, EAN/PNS 2021. Среди них подгруппа из 100 пациентов (54 мужчины и 46 женщин) имела в анамнезе инфекцию COVID-19, 17 пациентам (11 мужчин и 6 женщин) диагноз ХВДП установлен в течение 8 нед после инфицирования COVID-19. Всем пациентам выполнялось общепринятое обследование для подтверждения диагноза и исключения альтернативных заболеваний, которое включало оценку неврологического статуса, оценку наличия парапротеина сыворотки методом иммунофиксации, люмбальная пункция с определением уровня белка в ликворе, электронейромиография (ЭНМГ) верхних и нижних конечностей, скрининг ревматологической патологии, генетическое исследование для исключения наследственных полинейропатий: 29% (n=5) пациентов скринированы на наследственную транстиретиновую полинейропатию. Проведен анализ данных доступных источников из базы PubMed, описывающих клинические случаи ассоциации ХВДП и COVID-19, в анализ включены все публикации (9 источников), вне зависимости от количества представленных в них наблюдений и других критериев.
В ретроспективно-проспективном исследовании, проведенном в клинике неврологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» в период с 2020 по 2023 г., были проанализированы данные 116 пациентов с ХВДП (см. рисунок), соответствующих диагностическим критериям EFNS/PNS 2010, EAN/PNS 2021. Среди них подгруппа из 100 пациентов (54 мужчины и 46 женщин) имела в анамнезе инфекцию COVID-19, 17 пациентам (11 мужчин и 6 женщин) диагноз ХВДП установлен в течение 8 нед после инфицирования COVID-19. Всем пациентам выполнялось общепринятое обследование для подтверждения диагноза и исключения альтернативных заболеваний, которое включало оценку неврологического статуса, оценку наличия парапротеина сыворотки методом иммунофиксации, люмбальная пункция с определением уровня белка в ликворе, электронейромиография (ЭНМГ) верхних и нижних конечностей, скрининг ревматологической патологии, генетическое исследование для исключения наследственных полинейропатий: 29% (n=5) пациентов скринированы на наследственную транстиретиновую полинейропатию. Проведен анализ данных доступных источников из базы PubMed, описывающих клинические случаи ассоциации ХВДП и COVID-19, в анализ включены все публикации (9 источников), вне зависимости от количества представленных в них наблюдений и других критериев. Результаты
Всего проанализированы данные 116 пациентов с ХВДП (см. рисунок), из них 17 пациентов перенесли COVID-19 в течение 8 нед до манифестации ХВДП. Возраст дебюта пациентов с ХВДП после перенесенной инфекции COVID-19 составил 63 (±26,77) года. Средний срок развития развернутых симптомов полинейропатии от даты положительного результата теста на COVID-19 методом полимеразной цепной реакции (ПЦР) составил 3 нед. Данные компьютерной томографии (КТ) свидетельствовали о поражении легких первой степени тяжести у 82% (n=14), второй – у 12% (n=2), третьей – у 6% пациентов (n=1). Ни одному пациенту не потребовалась инвазивная вентиляция легких. Медиана времени наблюдения составляла 14 мес (3; 40).У 12 из 17 пациентов в дебюте заболевания был выявлен типичный клинический фенотип ХВДП (табл. 1).

Структура атипичных вариантов ХВДП была представлена следующими фенотипами: изолированный сенсорный фенотип (n=1; 6%), моторный (n=2; 12%), мультифокальная приобретенная сенсорная и моторная нейропатия (n=1; 6%), ХВДП с острым началом (n=1; 6%). У 29% (n=5) пациентов нейропатический болевой синдром был одной из ведущих жалоб в дебюте заболевания. Прогрессирующее течение в первый год заболевания было выявлено у 53% (n=9) пациентов: из них 56% (n=5) с типичным фенотипом и 44% (n=4) с атипичным. Медиана выраженности неврологического дефицита по NIS до начала патогенетической терапии составляла 76 [20; 175,5] баллов. У 10 из 17 пациентов выявлено значимое коморбидное потенциально дизиммунное состояние. Среди них моноклональная гаммапатия неврологического значения выявлена у 6 (35%) пациентов, злокачественное новообразование – у 2 (12%) пациентов, язвенный колит – у 1 (6%) пациента и эссенциальная тромбоцитопения – у 1 (6%). У 2 (12%) был сахарный диабет 2-го типа.
На момент постановки диагноза люмбальная пункция выполнялась 13 пациентам, у всех зафиксировано повышение уровня белка в ликворе, с медианой 0,9 [0,61; 5,58] г/мл. Все пациенты получали стартовую патогенетическую терапию 1-й линии, но 2 (12%) пациентам потребовался переход к терапии 2-й линии в связи с неэффективностью терапии 1-й линии.
Обсуждение
В раздел обсуждения включено сопоставление собственных наблюдений пациентов с ХВДП с манифестацией после инфекции COVID-19 и имеющихся данных научных публикаций.ХВДП относится к орфанным неврологическим заболеваниям с распространенностью 2,81–4,77 на 100 тыс. человек [7, 8]. Механизм демиелинизации при ХВДП полностью не изучен, включает в себя клеточные и гуморальные иммуноопосредованные реакции. Основными мишенями аутоагрессии считаются перехваты Ранвье, начальный сегмент аксона и паранодальная область. Различные патогенетические мишени и определяют фенотипические варианты ХВДП [9]. Описаны случаи дебюта ХВДП после перенесенного инфекционного процесса и реже вакцинации. Прямая причинно-следственная связь остается недоказанной, факт перенесенной инфекции, вероятно, является триггером развития аутоиммунного процесса [10]. Механизм молекулярной мимикрии между инфекционными агентами и компонентами периферических нервов также является потенциальным механизмом развития ХВДП [11]. В научной литературе описаны серии случаев дебюта ХВДП на фоне перенесенной вирусной инфекции. Так, в исследовании итальянской базы данных P. Doneddu и соавт. [12] показано, что предшествующая респираторная инфекция в течение 1–42 дней до начала ХВДП зарегистрирована у 12% пациентов. В исследовании Y. Rajabally и соавт. [10] сообщалось о развитии ХВДП в течение 6 нед после респираторной или желудочно-кишечной инфекции у 9,3% пациентов. Данная группа пациентов отличалась более молодым возрастом дебюта и чаще – острым началом ХВДП [10]. Важно отметить, что случаи манифестации ХВДП в период после перенесенных инфекций отмечаются с невысокой частотой, что может свидетельствовать о роли инфекции как дополнительного триггера уже имеющегося субклинического процесса. Достоверная причинно-следственная связь между респираторными инфекциями и ХВДП, в отличие от острой воспалительной демиелинизирующей полинейропатии (ОВДП), на текущий момент не выявлена.
ХВДП и COVID-19
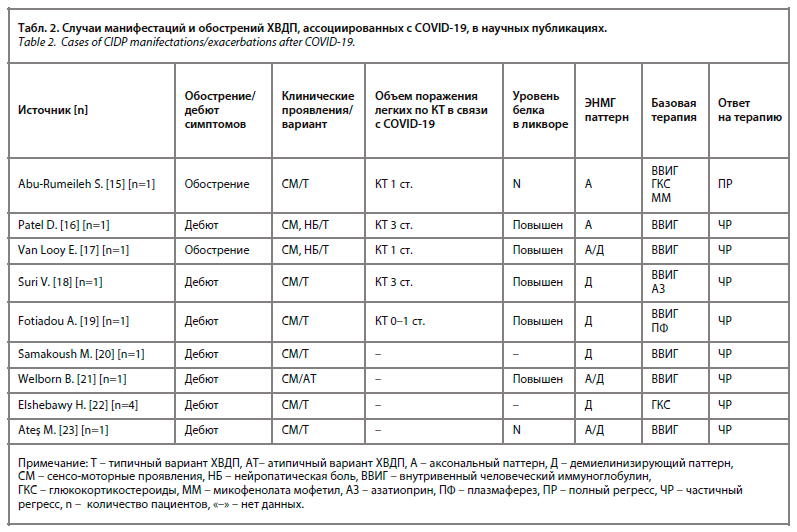
Одним из установленных неврологических осложнений COVID-19 может быть как центральная, так и периферическая демиелинизация [13]. Опубликованы единичные случаи манифестации и обострений ХВДП после перенесенного COVID-19 (табл. 2).
Общая частота нейропсихиатрических осложнений COVID-19 в среднем составляет 33%, данные о частоте ХВДП после перенесенного COVID-19 отсутствуют, а публикации ограничены описанием отдельных клинических случаев [23]. В исследование N. Hasrat и соавт. были включены 896 пациентов без COVID-19 – у 0,29% (n=3) была выявлена дизиммунная полинейропатия; 1344 пациента перенесли коронавирусную инфекцию за 12 мес до дебюта неврологических симптомов: воспалительная полинейропатия была выявлена у 1,14% (ОВДП n=13; ХВДП n=5). Авторы исследования рассматривают COVID-19 как возможный триггер увеличения частоты дизиммунных полинейропатий [24].
В литературе описаны случаи стремительного развития симптомов после COVID-19: так, в публикации M. Ates и соавт. [22] описан случай дизиммунной полинейропатии с наличием трех пиков нарастания неврологического дефицита в течение первых 8 нед заболевания, в связи с чем первоначально пациенту был установлен диагноз ОВДП.
На основании анализа представленных в данной публикации собственных 17 случаев дебюта ХВДП после перенесенного COVID-19 может быть продемонстрировано наличие общих клинико-лабораторных особенностей, а именно: данная группа характеризуется выраженным неврологическим дефицитом у всех 17 (100%) пациентов с расстройствами глубокой чувствительности у 15 из 17 (88%) в дебюте заболевания, высоким содержанием белка в ликворе у 17 (100%), а у 6 (35%) из 17 был выявлен парапротеин в сыворотке крови.
В изученной литературе [15, 17–22] описаны дебюты 1 (10% [1/10]) атипичного варианта ХВДП и 9 типичных (90% [9/10]), в то время как в результате собственных наблюдений выявлено 5 атипичных вариантов (29% [5/17]) против 12 (71% [12/17]) типичных. Нейропатический болевой синдром в дебюте встречался у 10% (1/10) пациентов по данным публикаций, в собственной выборке таких пациентов оказалось 29% (5/17). У всех пациентов из проанализированных публикаций был получен полный или частичный ответ на патогенетическую терапию 1-й линии – ВВИГ (n=6), ГКС (n=4), в отличие от личных данных – 12% (2/17) пациентов не ответили на терапию 1-й линии. По данным, представленным в публикациях, не проводилась оценка парапротеина в сыворотке крови.
По результатам собственных наблюдений, типичная ХВДП развивалась после легкого течения COVID-19 (КТ-1 в 100% случаев), в то время как атипичные варианты ХВДП зафиксированы после любой тяжести инфекционного процесса. Для получения достоверных статистических данных по атипичным вариантам ХВДП необходимо продолжение исследований с увеличением размера выборки.
Выводы
1. Учитывая орфанный характер ХВДП, редкие случаи их манифестации после инфекции COVID-19 не позволяют на данном этапе с высокой степенью убедительности оценить значимость как особенностей проявлений, так и подходы к патогенетической терапии, и требуют дальнейшего проведения совокупного анализа всех публикуемых данных.2. ХВДП с манифестацией в короткие сроки после инфекции COVID-19 по результатам серии 17 ретроспективно-проспективных наблюдений представляет группу с преимущественно тяжелым течением и высокой частотой коморбидности иммунопатологических состояний.
3. Особенности течения случаев ХВДП после инфекции COVID-19 могут включать более высокую частоту резистентности к патогенетической терапии 1-й линии, что требует разработки алгоритмов мониторинга эффективности терапии
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Кушнир Яна Богдановна – врач-невролог отделения неврологии №1, ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова».
E-mail: kushnir.yana2014@yandex.ru; ORCID: 0000-0001-7891-9883
Yana B. Kushnir – Neurologist, Pavlov First Saint Petersburg State Medical University.
E-mail: kushnir.yana2014@yandex.ru;
ORCID: 0000-0001-7891-9883
Александр Игоревич Безводинских – клин. ординатор отд-ния неврологии №1, ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова».
E-mail: a.bezvodinskih@mail.ru:ORCID iD: 0000-0003-2846-6411
Alexander I. Bezvodinskikh – Clinical Resident, Pavlov First Saint Petersburg State Medical University.
E-mail: a.bezvodinskih@mail.ru;
ORCID: 0000-0003-2846-6411
Владыкина Анастасия Владимировна – клин. ординатор отд-ния неврологии №1, ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова».
E-mail: vladykina.anastasiya@gmail.com;
ORCID: 0000-0003-3666-9622
Anastasia V. Vladykina – Clinical Resident, Pavlov First Saint Petersburg State Medical University.
E-mail: vladykina.anastasiya@gmail.com;
ORCID: 0000-0003-3666-9622
Наталья Агафоновна Тотолян – д-р мед. наук, проф. каф. неврологии, ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова».
E-mail: ntotolyan@mail.ru; ORCID: 0000-0002-6715-8203
Natalia A. Totolyan – Dr. Sci. (Med.), Prof., Pavlov First Saint Petersburg State Medical University. E-mail: ntotolyan@mail.ru; ORCID: 0000-0002-6715-8203
Поступила в редакцию: 24.04.2024
Поступила после рецензирования: 08.05.2024
Принята к публикации: 16.05.2024
Received: 24.04.2024
Revised: 08.05.2024
Accepted: 16.05.2024
Список исп. литературыСкрыть список1. Van den Bergh PYK, van Doorn PA, Hadden RDM et al. European Academy of Neurology/Peripheral Nerve Society guideline on diagnosis and treatment of chronic inflammatory demyelinating polyradiculoneuropathy: Report of a joint Task Force-Second revision. Journal of the peripheral nervous system : JPNS. 2021;26(3):242-68. DOI: 10.1111/jns.12455
2. Rezania K, Gundogdu B, Soliven B. Pathogenesis of chronic inflammatory demyelinating polyradiculoneuropathy. Front Biosci. 2004;9:939-45. DOI: 10.2741/1286
3. Lim JY, Lim YH, Choi EH. Acute-onset chronic inflammatory demyelinating polyneuropathy in hantavirus and hepatitis B virus coinfection: A case report. Medicine (Baltimore). 2016;95(49):e5580. DOI: 10.1097/MD.0000000000005580
4. Stübgen JP. A review of the use of biological agents for chronic inflammatory demyelinating polyradiculoneuropathy. J Neurol Sci. 2013;326(1-2):1-9. DOI: 10.1016/j.jns.2013.01.003
5. Altinkaya A, Topcular B, Sakalli NK et al. Chronic inflammatory demyelinating polyradiculoneuropathy associated intracranial hypertension. Neurol Sci. 2013;34(6):1027-29. DOI: 10.1007/s10072-012-1179-6
6. Gaebel K, Blackhouse G, Campbell K et al. Intravenous immunoglobulin for the treatment of chronic inflammatory demyelinating polyradiculoneuropathy: a systematic review and meta-analysis. Open Med. 2010;4(3):e154-e166.
7. Rajabally YA, Simpson BS, Beri S et al. Epidemiologic variability of chronic inflammatory demyelinating polyneuropathy with different diagnostic criteria: study of a UK population. Muscle & nerve. 2009;39(4):432-8. DOI: 10.1002/mus.21206
8. Broers MC, Bunschoten C, Nieboer D et al. Incidence and Prevalence of Chronic Inflammatory Demyelinating Polyradiculoneuropathy: A Systematic Review and Meta-Analysis. Neuroepidemiology. 2019;52(3-4):161-72. DOI: 10.1159/000494291
9. Koike H, Katsuno M. Paraproteinemia and neuropathy. Neurological sciences. 2021;42(11):4489-501. DOI: 10.1007/s10072-021-
05583-7
10. Rajabally Y, Perić S, Bozovic I et al. Antecedent infections and vaccinations in chronic inflammatory demyelinating polyneuropathy: A European collaborative study. Muscle & Nerve. 2021;64:657-61. DOI: 10.1002/mus.27374
11. Goedee H. Antecedent infections in CIDP: A relevant clue in a complex disease? Muscle & Nerve. 2021;64. DOI: 10.1002/mus.27424.
12. Doneddu PE, Bianchi E, Cocito D et al; Italian CIDP Database Study Group Risk factors for chronic inflammatory demyelinating polyradiculoneuropathy (CIDP): antecedent events, lifestyle and dietary habits. Data from the Italian CIDP Database. European Journal of Neurology. 2020;27(1):136-43. DOI: 10.1111/ene.14044
13. Shabani Z. Demyelination as a result of an immune response in patients with COVID-19. Acta neurologica Belgica. 2021;121(4):859-66.
DOI: 10.1007/s13760-021-01691-5
14. Abu-Rumeileh S, Garibashvili T, Ruf W et al. Exacerbation of chronic inflammatory demyelinating polyneuropathy in concomitance with
COVID-19. Journal of the Neurological Sciences. 2020;418:117106. DOI: 10.1016/j.jns.2020.117106
15. Patel D, Mandal G, Chukwueke L, Woods K. A Rare Case of COVID-19-Induced Chronic Demyelinating Polyneuropathy. Cureus. 2022;14(5), e25165. DOI: 10.7759/cureus.25165
16. Van Looy E, Veenker L, Steyaert A et al. COVID-19-induced exacerbation of chronic inflammatory demyelinating polyneuropathy. Journal of neurology. 2021;268(9):3129-31. DOI: 10.1007/s00415-021-10417-9
17. Suri V, Pandey S, Singh J, Jena A. Acute-onset chronic inflammatory demyelinating polyneuropathy after COVID-19 infection and subsequent ChAdOx1 nCoV-19 vaccination. BMJ case reports. 2021;14(10):e245816. DOI: 10.1136/bcr-2021-245816
18. Fotiadou A, Tsiptsios D, Karatzetzou S et al. Acute-onset chronic inflammatory demyelinating polyneuropathy complicating SARS-CoV-2 infection and Ad26.COV2.S vaccination: report of two cases. The Egyptian journal of neurology, psychiatry and neurosurgery. 2022;58(1):116. DOI: 10.1186/s41983-022-00515-4
19. Abedi Samakoush M, Davoodi L, Khademian M et al. New-onset chronic inflammatory demyelinating polyradiculoneuropathy after COVID-19 infection: a case report. Annals of medicine and surgery.2023;85(10):5031-34. DOI: 10.1097/MS9.0000000000000352
20. Welborn BL, Benjamin J. Development of Lewis-Sumner Syndrome or Multifocal Acquired Demyelinating Sensory and Motor Neuropathy (MADSAM) Following COVID-19 Infection. Cureus. 2023;15(10): e46643. DOI: 10.7759/cureus.46643
21. Elshebawy H, Ezzeldin MY, Elzamarany EH. Characteristics of COVID and post COVID polyneuropathies in adults and pediatrics: an Egyptian sample. The Egyptian journal of neurology, psychiatry and neurosurgery. 2021;57(1):178. DOI: 10.1186/s41983-021-00435-9
22. Ateş MF, Kendirli S, Karşıdağ S et al. Acute Onset Chronic Inflammatory Demyelinating Polyneuropathy Following COVID-19. Duzce Medical Journal. 2022;24(1):95-7. DOI: 10.18678/dtfd.1034475
23. Taquet M, Geddes JR, Husain M et al. 6-month neurological and psychiatric outcomes in 236 379 survivors of COVID-19: a retrospective cohort study using electronic health records. The lancet. Psychiatry. 2021;8(5):416-27. DOI: 10.1016/S2215-0366(21)00084-5
24. Hasrat NH, Kadhum HJ, Hashim AR et al. Neurographic Evidence of Inflammatory Polyneuropathies in Peri-COVID-19 Circumstances and Their Relationship With Acute Disease Severity and Inflammatory Storm. Cureus. 2022;14(3):e23517. DOI: 10.7759/cureus.23517

