Клинический разбор в общей медицине №5 2024
1 State budgetary healthcare institution of the Moscow region “Kotelnikovskaya City Clinic”», Kotelniki, Russia;
2 Moscow University of Industry and Finance (Synergy University), Moscow, Russia
md.mac@yandex.ru
Keywords: cognitive impairment, anxiety disorders, depression, Pantogam Active, nootropic therapy.
For citation: Davidov D.R. Moskvicheva A.S. Functional masks of neurological disorders: differential diagnosis of organic and psychogenic disorders. Clinical review for general practice. 2024; 5 (5): 42–48 (In Russ.). DOI: 10.47407/kr2024.5.5.00405
Для многих патологий нервной системы органическая природа заболевания может быть установлена далеко не сразу, так как возникновение жалоб у пациента опережает презентацию клинической картины и изменения результатов объективных обследований; с другой стороны, органическая природа некоторых психических заболеваний была установлена относительно недавно. Например, в настоящее время доказано, что для шизофрении характерны прогрессирующие структурные изменения головного мозга, но они столь малы и не специфичны, что не позволяют использовать их в качестве маркера болезни. Кроме того, в абсолютном большинстве случаев при выявлении органической патологии центральной нервной системы к соматической дисфункции пациента присоединяется психоэмоциональный компонент, связанный со страхом беспомощности, потери работы и тревогой за будущее. Зачастую именно эти проблемы являются наиболее дестабилизирующими, ухудшают течение и прогноз основного заболевания и требуют первостепенного внимания врача [1].
В неврологической практике при оказании первичной медико-санитарной помощи у значительного количества пациентов, обращающихся с соматическими жалобами, в ходе осмотра удается выявить также негрубый когнитивный дефицит, тревожные и депрессивные расстройства в сочетании с общей астенизацией. Наиболее типично сочетание органической и функциональной природы в комплексной картине болезни наблюдается: при хронической ишемии головного мозга (особенно связанной с атеросклеротическим поражением артериальной системы) и эпилепсии, после перенесенных черепно-мозговых травм, у пациентов с экстрапирамидными гиперкинезами.
В клинической картине психогенного расстройства характерны изобилие и разнообразие жалоб пациента, не соответствующие клиническим проявлениям; несоответствие объективной симптоматики типичному течению заболевания (например, отсутствие падений и повреждений при психогенном миоклонусе), нормальный соматический и неврологический статус; спонтанные ремиссии, изменение презентации симптоматики в зависимости от эмоционального состояния, наличия зрителей или на введение плацебо, сочетание с другими психогенными расстройствами; отсутствие серьезных повреждений при падениях и несоответствие между тяжестью симптомов и степенью ограничения повседневной активности; частое сочетание с тревожными и депрессивными расстройствами [2].
В последнее время в литературе широко обсуждаются «медиаторные» теории возникновения как органических, так и психогенных расстройств. В том числе обсуждается роль γ-аминомасляной кислоты (ГАМК) – основного тормозного медиатора нервной системы. Ключевую роль отводят ГАМК-эргической трансмиссии: дефицит указанного медиатора приводит к появлению клинических признаков патологии, причем зачастую биохимические изменения значительно опережают клиническую презентацию [3]. Так, в исследованиях описаны изменения генов в сигнальных путях ГАМК-рецепторов в генетике функциональных судорожных приступов [4]. Показано, что низкий контроль над частотой эпилептических приступов наблюдается в целом у пациентов с преобладанием глутамата над ГАМК [5]. Доказана роль нейромедиаторной природы в нарушении нейромодуляции процессов возбуждения и торможения как патофизиологической основы избыточных двигательных актов, таких как гиперкинезы, навязчивые движения, моторные стереотипии и других. В терапии тревожных и депрессивных расстройств оценивается возможность воздействия на ГАМКв-рецепторы, так как их функциональная активность изменяется при длительном приеме антидепрессантов [6].
В развитии когнитивных нарушений важную роль играет хронический стресс, вызывающий изменение соотношения возбуждающих и тормозных медиаторов в нервной системе: этот вид нарушения и снижение уровня ГАМК в исследованиях коррелировали с выраженностью когнитивной дисфункции [7].
Обобщая данные литературных источников, можно сделать вывод, что нарушения в ГАМК-эргической системе являются важным инициаторным звеном патологических состояний, значимым маркером и перспективной терапевтической мишенью одновременно, встречаясь при различных заболеваниях.
Воздействие на ГАМК-эргическую систему возможно, в том числе при помощи препаратов ноотропной группы. Их фармакологическое действие зачастую реализуется, имитируя естественные метаболические пути, что приводит к более плавному эффекту воздействия и лучшей переносимости терапии. Одним из естественных метаболитов ГАМК является D,L-гопантеновая кислота (Пантогам Актив).
Цель исследования – оценить эффективность и безопасность Пантогама Актив у пациентов в комплексной терапии заболеваний неврологического и психиатрического профиля в амбулаторных условиях.
Пациенты с основным диагнозом «Психические расстройства и расстройства поведения» (коды по МКБ-10 F00-F99) не наблюдаются в амбулаторных условиях городской поликлиники. Такие заболевания встречались как сопутствующая патология у большинства участников исследования (n=103, 86%) и детально в настоящем исследовании не описывались. Органическая природа заболевания устанавливалась в соответствии со стандартами оказания первичной медико-санитарной помощи и клиническими рекомендациями Минздрава России, действующими на момент написания статьи. Для определения выраженности тревожных и депрессивных расстройств использовались оценки по шкалам и нейрокогнитивные тесты. Пациенты были разделены на 2 группы, сходные по социальным, демографическим и клиническим параметрам: 1-й группе в дополнение к основной терапии заболевания был рекомендован прием Пантогама Актив в определенных врачом дозировках в соответствие с инструкцией по применению препарата, 2-я группа получала только основную терапию (группа контроля); в рамках этих групп выполнено деление на подгруппы по основному заболеванию в соответствии с группой МКБ-10 (табл. 2).
Доза Пантогама Актив варьировала от 600 мг до 1200 мг/сут в зависимости от клинической картины и длительности течения основного заболевания; среднесуточная доза составила 900 мг. Состояние пациентов оценивалось до начала и в конце курса терапии.
Вне зависимости от основного заболевания все участники исследования имели когнитивные нарушения, признаки астенического синдрома, тревожных и депрессивных расстройств различной степени выраженности. Распределение пациентов по группам выполнено случайным образом.
Оценка эффективности и переносимости терапии осуществлялась на основании заключения врача-специалиста и общепринятых шкал оценки депрессии и тревоги (Hospital Anxiety and Depression Scale – HADS), Монреальской шкалы оценки когнитивных функций (Montreal Cognitive Assessment МоСА-test), опросника качества жизни (European Quality of Life Questionnaire – EQ-5D), шкалы побочных явлений (UKU Side-Effect Rating Scale). Все шкалы заполнялись в обеих группах в день включения пациента в исследование и через 3 мес после. Оценка динамики состояния пациентов проводилась с использованием теста Вилкоксона. Статистическая обработка данных выполнена в программе SPSS 21.0. Статистически значимыми приняты различия при p≤0,05.
В зависимости от нозологической группы пациенты сообщали о преимущественно тех или иных превалирующих изменениях самочувствия на повторном приеме. Так, пациенты с черепно-мозговой травмой отметили выраженное улучшение когнитивных процессов (скорость мышления, внимания, реакции) и регресс цефалгического синдрома. Пациенты с хронической ишемией головного мозга сообщали также о когнитивных улучшениях, дополнительно отмечая облегчение контроля течения сопутствующей артериальной гипертензии, предполагая, что эффект связан с увеличившейся эмоциональной стабильностью и изменениям в реакциях на стрессовые события. Пациенты, страдающие эпилепсией, сообщили об улучшении общего самочувствия и лучшей переносимости базовой терапии (уменьшение раздражительности, сонливости, стабилизация настроения). Пациенты с экстрапирамидными заболеваниями отметили выраженное снижение частоты и облигатности насильственных движений.
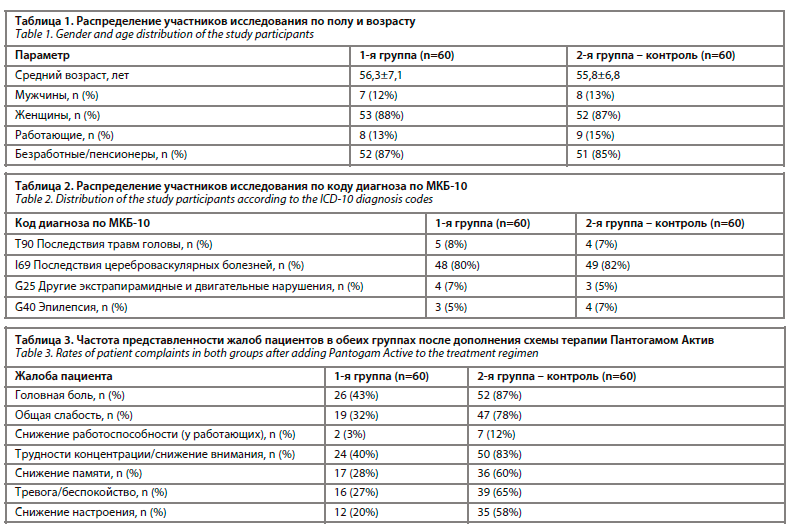
При оценке по шкале HADS до начала лечения суммарный балл составил 19,3±4,5 в 1-й группе и 18,8±5,1 – во 2-й группе; через 3 мес в 1-й группе наблюдалась выраженная редукция суммарного балла тревоги и депрессии до 11,9±2,3, тогда как во второй группе эти значения не претерпели существенной динамики – 18,9±3,8. В группе, получавшей комбинированное лечение, зафиксировано снижение тревожности на 41%, депрессии – на 35%; в контрольной группе показатели не претерпели значимых изменений. Детальное распределение средних показателей и суммарного балла до и после лечение в обеих группах показано на рис. 1.
 По результатам оценки по шкале побочных явлений UKU в 1-й группе снизилась частота нежелательных явлений на фоне проводимого лечения: до начала терапии в среднем 5,2 на одного пациента, через 3 мес – 3,9 на 1 пациента. В обеих группах преимущественно выявлялись психовегетативные нарушения, что согласуется с результатами, представленными в других работах [8]. Наиболее значительные изменения наблюдались в когнитивных функциях (улучшение памяти, концентрации) и снижении частоты и интенсивности головной боли.
По результатам оценки по шкале побочных явлений UKU в 1-й группе снизилась частота нежелательных явлений на фоне проводимого лечения: до начала терапии в среднем 5,2 на одного пациента, через 3 мес – 3,9 на 1 пациента. В обеих группах преимущественно выявлялись психовегетативные нарушения, что согласуется с результатами, представленными в других работах [8]. Наиболее значительные изменения наблюдались в когнитивных функциях (улучшение памяти, концентрации) и снижении частоты и интенсивности головной боли.
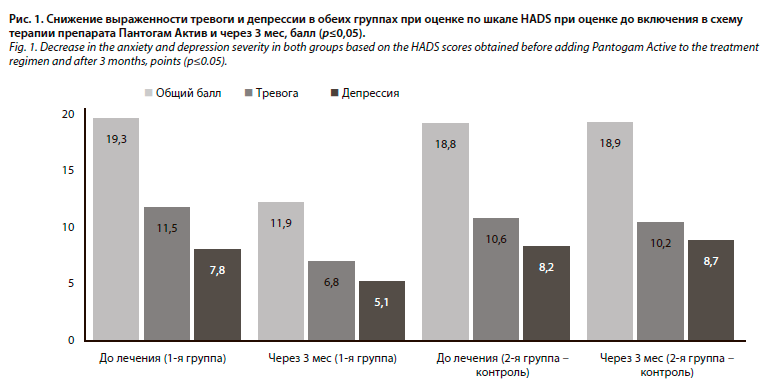
Среднее значение при оценке по шкале оценки когнитивных функций (МоСА-test) в 1-й группе до начала комплексной терапии составило 23,9±3,8, через 3 мес – 27,1±1,6; во 2-й группе (контроль): до начала исследования составило 23,7±3,6, спустя 3 мес – 24,8±3,9. В 1-й группе наблюдался значимый прирост показателя на 13%, во 2-й группе изменений не выявлено. Графическое представление результатов выполнено на рис. 2. Данные коррелируют с результатами, полученными в аналогичных исследованиях [9].
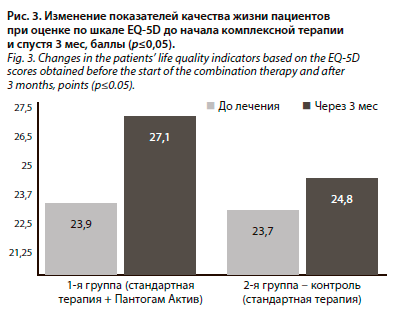 По шкале EQ-5D в 1-й группе средние значения составили 68,4±9,9 балла до начала комплексной терапии, во второй группе – 67,0±9,2 балла; через 3 мес в 1-й группе средние значения составили 81,3±8,7 балла, во второй группе – 69,1±8,4 балла. Таким образом, выявлено достоверное улучшение общих показателей на 19% у пациентов в 1-й группе, наиболее значимые изменения зафиксированы в разделах «привычная повседневная деятельность» и «тревога/депрессия» (р≤0,05), в контрольной группе изменения незначительны (рис. 3).
По шкале EQ-5D в 1-й группе средние значения составили 68,4±9,9 балла до начала комплексной терапии, во второй группе – 67,0±9,2 балла; через 3 мес в 1-й группе средние значения составили 81,3±8,7 балла, во второй группе – 69,1±8,4 балла. Таким образом, выявлено достоверное улучшение общих показателей на 19% у пациентов в 1-й группе, наиболее значимые изменения зафиксированы в разделах «привычная повседневная деятельность» и «тревога/депрессия» (р≤0,05), в контрольной группе изменения незначительны (рис. 3).
Аллергических и нежелательных реакций в ходе исследования зафиксировано не было.
В соматическом статусе: кожные покровы и видимые слизистые бледные, локальный гипергидроз ладоней и стоп. Индекс массы тела (ИМТ) – 29,8. АД – 130/80 мм рт. ст., пульс – 72 уд/мин. Живот мягкий, при пальпации незначительно болезненный в проекции желчного пузыря. Стул – склонность к запорам. Диурез без особенностей. В неврологическом статусе: фон настроения снижен, мимика и презентация жалоб экспрессивна, однако пациентка быстро истощается. Исследование черепных нервов – без патологии. Парезов нет. Фибрилляции и фасцикулляции не вызываются. Мышечный тонус несколько повышен в проксимальных группах мышц конечностей. Сухожильные рефлексы симметричны, оживлены. Патологические рефлексы не вызываются. Координаторные пробы выполняет с легким интенционным тремором без промахивания, в пробе Ромберга неустойчива. Тремор век при закрытых глазах. Нарушений поверхностной и глубокой чувствительности не выявлено. Функции тазовых органов не нарушены. Оценка по шкалам: МоСА-test – 23 балла, HADS – 12 баллов (тревога) и 6 баллов (депрессия).
При объективном обследовании в биохимическом анализе крови выявлена гиперхолестеринемия 6,6 ммоль/л (3,1–5,2 ммоль/л). Индекс атерогенности 3,7. Ультразвуковое исследование брахиоцефальных артерий выявило утолщение комплекса интима–медиа в бифуркации правой общей сонной артерии до 1,3 мм, в левой общей сонной артерии до 1,2 мм. Пациенткой самостоятельно выполнена магнитно-резонансная томография головного мозга: очаговых патологических изменений нет.
Совместно с кардиологом назначена диета (цель – снижение массы тела и коррекция гиперлипидемии), гипотензивная и антиагрегантная терапия, а также дополнительно рекомендован прием Пантогама Актив в дозировке 300 мг по 2 капсулы 2 раза в сутки на протяжении 3 мес. При контрольном визите через 21 день пациентка отметила выраженное улучшение общего состояния, снижение эмоциональной лабильности и повышение работоспособности, стабилизацию цифр АД. На приеме через 3 мес. зафиксирована нормализация ИМТ (24,7 кг/м2), полный регресс неврологической симптоматики, проведена попытка отмены гипотензивной терапии. Оценка по шкале МоСА-test – 30 баллов, шкала HADS: 3 балла (тревога) и 1 балл (депрессия). Пациентка смогла вернуться к привычному образу жизни, сохранив корректировки, рекомендованные специалистами; кроме того, сообщила о позитивной реакции близких людей на изменившееся поведение и самочувствие.
В отечественном препарате Пантогам Актив (D,L-гопантеновая кислота) представлена рацемическая смесь равных количеств R-формы гопантеновой кислоты и ее S-изомера, что улучшает транспорт молекулы и ее взаимодействие с рецептором ГАМК, усиливая действие. Особая структура Пантогам Актив наделяет его возможностью комбинированного действия на несколько нейромедиаторных систем головного мозга (помимо ГАМК-эргической, задействуются холин- и дофаминергические системы рецепторов). Это позволяет применять его у самых разных в клиническом аспекте пациентов, имеющих общие патофизиологические основы развития заболевания. За счет ноотропного, нейровегето-тропного, антиастенического, антидепрессивного, противотревожного и противосудорожного эффектов, а также нейропротективного действия он успешно применяется в комплексной терапии коморбидных состояний при артериальной гипертензии, снижает риск и частоту развития тревожных и депрессивных расстройств у пациентов с цереброваскулярными заболеваниями, а также купирует возникновение гипертонических кризов, провоцируемых психоэмоциональными событиями. Его сочетание с кардиотропной и вазоактивной терапией лишено значимых нежелательных событий, препарат лишен эффекта привыкания и «синдрома отмены», что повышает не только комплаентность, но и качество жизни пациента [11]. Кроме того, рекомендация о применении Пантогам Актив в комплексной терапии когнитивных расстройств приводится в Национальном руководстве по неврологии [2].
Информация об авторах
Information about the authors
Давидов Давид Рудольфович – канд. мед. наук, зам. глав. врача по клинико-экспертной работе, ГБУЗ Московской области «Котельниковская городская поликлиника», доц. каф., НОЧУ ВО «Московский финансово-промышленный университет „Синергия“». E-mail: pcep40@list.ru; ORCID: 0000-0003-4576-6854;
Scopus Author ID: 57209411228
David R. Davidov – Сand. Sci. (Med.), Moscow region “Kotelnikovskaya City Clinic”, Assoc. Prof., Moscow University of Industry and Finance (Synergy University).
E-mail: pcep40@list.ru; ORC ID: 0000-0003-4576-6854; Scopus Author ID: 57209411228
Москвичева Александра Станиславовна – канд. мед. наук, доц. каф. НОЧУ ВО «Московский финансово-промышленный университет „Синергия“». E-mail: md.mac@yandex.ru;
ORCID: 0000-0002-0381-4662; Scopus Author ID: 57216653355
Aleksandra S. Moskvicheva – Сand. Sci. (Med.),
Assoc. Prof., Moscow University of Industry and Finance
(Synergy University). E-mail: md.mac@yandex.ru;
ORCID: 0000-0002-0381-4662;
Scopus Author ID: 57216653355
Поступила в редакцию: 20.05.2024
Поступила после рецензирования: 23.05.2025
Принята к публикации: 23.05.2024
Received: 20.05.2024
Revised: 23.05.2025
Accepted: 23.05.2024
Клинический разбор в общей медицине №5 2024
Функциональные маски неврологических нарушений: дифференциальный диагноз органического и психогенного расстройства
Номера страниц в выпуске:42-48
Аннотация
Дифференциация органических и психогенных расстройств является одной из наиболее трудных задач неврологии и психиатрии как из-за сложностей определения генеза самого состояния, так и по причине их частой коморбидности. Определенная общность патогенетической природы обоих нарушений позволяет при выборе терапевтической тактики опираться на препараты, влияющие на центральное звено патофизиологии этих процессов – дисбаланс медиаторных систем. Целью настоящего исследования было определено изучение эффективности и безопасности Пантогама Актив у пациентов в комплексной терапии заболеваний неврологического и психиатрического профиля в амбулаторных условиях. В анализ включены 120 человек, разделенные на 2 группы: 1-я группа принимала основную терапию и Пантогам Актив по рекомендации лечащего врача в суточной дозировке 600–1200 мг (среднесуточная дозировка – 900 мг), 2-я группа – только основную терапию. Пациенты распределялись в группы случайным образом. Длительность исследования составила 3 мес. Эффективность и безопасность оценивались при контрольном осмотре специалиста и по результатам оценочных шкал. Результаты исследования демонстрируют позитивное влияние как на субъективные ощущения (самочувствие пациентов, получавших комплексную терапию), так и изменения при объективной оценке. Дополнение основной терапевтической схемы препаратом Пантогам Актив рекомендовано пациентам с целью коррекции сопутствующей симптоматики, снижающей качество жизни и приверженность лечению: астенического синдрома, тревожных и депрессивных расстройств, когнитивных нарушений.
Ключевые слова: когнитивные нарушения, тревожные расстройства, депрессия, Пантогам Актив, ноотропная терапия.
Для цитирования: Давидов Д.Р. Москвичева А.С. «Функциональные маски» неврологических нарушений: дифференциальный диагноз органического и психогенного расстройства. Клинический разбор в общей медицине. 2024; 5 (5): 42–48. DOI: 10.47407/kr2023. 5.5.00405
Дифференциация органических и психогенных расстройств является одной из наиболее трудных задач неврологии и психиатрии как из-за сложностей определения генеза самого состояния, так и по причине их частой коморбидности. Определенная общность патогенетической природы обоих нарушений позволяет при выборе терапевтической тактики опираться на препараты, влияющие на центральное звено патофизиологии этих процессов – дисбаланс медиаторных систем. Целью настоящего исследования было определено изучение эффективности и безопасности Пантогама Актив у пациентов в комплексной терапии заболеваний неврологического и психиатрического профиля в амбулаторных условиях. В анализ включены 120 человек, разделенные на 2 группы: 1-я группа принимала основную терапию и Пантогам Актив по рекомендации лечащего врача в суточной дозировке 600–1200 мг (среднесуточная дозировка – 900 мг), 2-я группа – только основную терапию. Пациенты распределялись в группы случайным образом. Длительность исследования составила 3 мес. Эффективность и безопасность оценивались при контрольном осмотре специалиста и по результатам оценочных шкал. Результаты исследования демонстрируют позитивное влияние как на субъективные ощущения (самочувствие пациентов, получавших комплексную терапию), так и изменения при объективной оценке. Дополнение основной терапевтической схемы препаратом Пантогам Актив рекомендовано пациентам с целью коррекции сопутствующей симптоматики, снижающей качество жизни и приверженность лечению: астенического синдрома, тревожных и депрессивных расстройств, когнитивных нарушений.
Ключевые слова: когнитивные нарушения, тревожные расстройства, депрессия, Пантогам Актив, ноотропная терапия.
Для цитирования: Давидов Д.Р. Москвичева А.С. «Функциональные маски» неврологических нарушений: дифференциальный диагноз органического и психогенного расстройства. Клинический разбор в общей медицине. 2024; 5 (5): 42–48. DOI: 10.47407/kr2023. 5.5.00405
Functional masks of neurological disorders: differential diagnosis of organic and psychogenic disorders
David R. Davidov1,2, Aleksandra S. Moskvicheva21 State budgetary healthcare institution of the Moscow region “Kotelnikovskaya City Clinic”», Kotelniki, Russia;
2 Moscow University of Industry and Finance (Synergy University), Moscow, Russia
md.mac@yandex.ru
Abstract
Differentiation of organic and psychogenic disorders is one of the most difficult tasks of neurology and psychiatry, both because of the difficulties in determining the genesis of the condition itself, and because of their frequent comorbidity. A certain commonality of the pathogenetic nature of both disorders allows, when choosing therapeutic tactics, to rely on drugs that affect the central link in the pathophysiology of these processes – an imbalance of mediator systems. The purpose of this study was to study the efficacy and safety of Pantogam Active in patients in the complex therapy of neurological and psychiatric diseases in outpatient settings. The analysis included 120 people divided into 2 groups: group 1 took the main therapy and Pantogam Active on the recommendation of the attending physician at a daily dosage of 600–1200 mg (the average daily dosage is 900 mg), group 2 – only the main therapy. Patients were randomly assigned to groups. The duration of the study was 3 months. The effectiveness and safety were evaluated during a control examination by a specialist and based on the results of evaluation scales. The results of the study demonstrate a positive effect on both subjective feelings (well-being of patients receiving complex therapy) and changes in an objective assessment. The addition of the main therapeutic regimen with Pantogam Active is recommended for patients in order to correct concomitant symptoms that reduce the quality of life and adherence to treatment: asthenic syndrome, anxiety and depressive disorders, cognitive impairment.Keywords: cognitive impairment, anxiety disorders, depression, Pantogam Active, nootropic therapy.
For citation: Davidov D.R. Moskvicheva A.S. Functional masks of neurological disorders: differential diagnosis of organic and psychogenic disorders. Clinical review for general practice. 2024; 5 (5): 42–48 (In Russ.). DOI: 10.47407/kr2024.5.5.00405
Введение
Одной из наиболее трудных клинических задач является дифференциальная диагностика органических и психогенных расстройств. В первом случае речь идет о заболеваниях, имеющих определенные признаки, выявляемые клинически, коррелирующие с данными лабораторных и/или инструментальных методов исследования; под функциональными расстройствами обычно обозначают клинические проявления, соответствующие жалобам, имитирующим заболевания, без четко установленной органической природы по результатам сбора анамнеза и клинического обследования.Для многих патологий нервной системы органическая природа заболевания может быть установлена далеко не сразу, так как возникновение жалоб у пациента опережает презентацию клинической картины и изменения результатов объективных обследований; с другой стороны, органическая природа некоторых психических заболеваний была установлена относительно недавно. Например, в настоящее время доказано, что для шизофрении характерны прогрессирующие структурные изменения головного мозга, но они столь малы и не специфичны, что не позволяют использовать их в качестве маркера болезни. Кроме того, в абсолютном большинстве случаев при выявлении органической патологии центральной нервной системы к соматической дисфункции пациента присоединяется психоэмоциональный компонент, связанный со страхом беспомощности, потери работы и тревогой за будущее. Зачастую именно эти проблемы являются наиболее дестабилизирующими, ухудшают течение и прогноз основного заболевания и требуют первостепенного внимания врача [1].
В неврологической практике при оказании первичной медико-санитарной помощи у значительного количества пациентов, обращающихся с соматическими жалобами, в ходе осмотра удается выявить также негрубый когнитивный дефицит, тревожные и депрессивные расстройства в сочетании с общей астенизацией. Наиболее типично сочетание органической и функциональной природы в комплексной картине болезни наблюдается: при хронической ишемии головного мозга (особенно связанной с атеросклеротическим поражением артериальной системы) и эпилепсии, после перенесенных черепно-мозговых травм, у пациентов с экстрапирамидными гиперкинезами.
В клинической картине психогенного расстройства характерны изобилие и разнообразие жалоб пациента, не соответствующие клиническим проявлениям; несоответствие объективной симптоматики типичному течению заболевания (например, отсутствие падений и повреждений при психогенном миоклонусе), нормальный соматический и неврологический статус; спонтанные ремиссии, изменение презентации симптоматики в зависимости от эмоционального состояния, наличия зрителей или на введение плацебо, сочетание с другими психогенными расстройствами; отсутствие серьезных повреждений при падениях и несоответствие между тяжестью симптомов и степенью ограничения повседневной активности; частое сочетание с тревожными и депрессивными расстройствами [2].
В последнее время в литературе широко обсуждаются «медиаторные» теории возникновения как органических, так и психогенных расстройств. В том числе обсуждается роль γ-аминомасляной кислоты (ГАМК) – основного тормозного медиатора нервной системы. Ключевую роль отводят ГАМК-эргической трансмиссии: дефицит указанного медиатора приводит к появлению клинических признаков патологии, причем зачастую биохимические изменения значительно опережают клиническую презентацию [3]. Так, в исследованиях описаны изменения генов в сигнальных путях ГАМК-рецепторов в генетике функциональных судорожных приступов [4]. Показано, что низкий контроль над частотой эпилептических приступов наблюдается в целом у пациентов с преобладанием глутамата над ГАМК [5]. Доказана роль нейромедиаторной природы в нарушении нейромодуляции процессов возбуждения и торможения как патофизиологической основы избыточных двигательных актов, таких как гиперкинезы, навязчивые движения, моторные стереотипии и других. В терапии тревожных и депрессивных расстройств оценивается возможность воздействия на ГАМКв-рецепторы, так как их функциональная активность изменяется при длительном приеме антидепрессантов [6].
В развитии когнитивных нарушений важную роль играет хронический стресс, вызывающий изменение соотношения возбуждающих и тормозных медиаторов в нервной системе: этот вид нарушения и снижение уровня ГАМК в исследованиях коррелировали с выраженностью когнитивной дисфункции [7].
Обобщая данные литературных источников, можно сделать вывод, что нарушения в ГАМК-эргической системе являются важным инициаторным звеном патологических состояний, значимым маркером и перспективной терапевтической мишенью одновременно, встречаясь при различных заболеваниях.
Воздействие на ГАМК-эргическую систему возможно, в том числе при помощи препаратов ноотропной группы. Их фармакологическое действие зачастую реализуется, имитируя естественные метаболические пути, что приводит к более плавному эффекту воздействия и лучшей переносимости терапии. Одним из естественных метаболитов ГАМК является D,L-гопантеновая кислота (Пантогам Актив).
Цель исследования – оценить эффективность и безопасность Пантогама Актив у пациентов в комплексной терапии заболеваний неврологического и психиатрического профиля в амбулаторных условиях.
Материалы и методы
Исследование проводилось в течение 3 мес на базе городской поликлиники Московской области, число участников – 120 человек. Критериями включения являлись: наличие одного из заболеваний в анамнезе, длительностью течения не менее 6 мес (хроническая ишемия головного мозга, последствия черепно-мозговой травмы, эпилепсия, экстрапирамидные гиперкинезы, когнитивные нарушения легкой и умеренной выраженности, тревожное и/или депрессивное расстройство), возраст старше 18 лет, согласие на участие в исследовании. Отказов от участия не было. Половозрастная характеристика участников представлена в табл. 1.
Пациенты с основным диагнозом «Психические расстройства и расстройства поведения» (коды по МКБ-10 F00-F99) не наблюдаются в амбулаторных условиях городской поликлиники. Такие заболевания встречались как сопутствующая патология у большинства участников исследования (n=103, 86%) и детально в настоящем исследовании не описывались. Органическая природа заболевания устанавливалась в соответствии со стандартами оказания первичной медико-санитарной помощи и клиническими рекомендациями Минздрава России, действующими на момент написания статьи. Для определения выраженности тревожных и депрессивных расстройств использовались оценки по шкалам и нейрокогнитивные тесты. Пациенты были разделены на 2 группы, сходные по социальным, демографическим и клиническим параметрам: 1-й группе в дополнение к основной терапии заболевания был рекомендован прием Пантогама Актив в определенных врачом дозировках в соответствие с инструкцией по применению препарата, 2-я группа получала только основную терапию (группа контроля); в рамках этих групп выполнено деление на подгруппы по основному заболеванию в соответствии с группой МКБ-10 (табл. 2).
Доза Пантогама Актив варьировала от 600 мг до 1200 мг/сут в зависимости от клинической картины и длительности течения основного заболевания; среднесуточная доза составила 900 мг. Состояние пациентов оценивалось до начала и в конце курса терапии.
Вне зависимости от основного заболевания все участники исследования имели когнитивные нарушения, признаки астенического синдрома, тревожных и депрессивных расстройств различной степени выраженности. Распределение пациентов по группам выполнено случайным образом.
Оценка эффективности и переносимости терапии осуществлялась на основании заключения врача-специалиста и общепринятых шкал оценки депрессии и тревоги (Hospital Anxiety and Depression Scale – HADS), Монреальской шкалы оценки когнитивных функций (Montreal Cognitive Assessment МоСА-test), опросника качества жизни (European Quality of Life Questionnaire – EQ-5D), шкалы побочных явлений (UKU Side-Effect Rating Scale). Все шкалы заполнялись в обеих группах в день включения пациента в исследование и через 3 мес после. Оценка динамики состояния пациентов проводилась с использованием теста Вилкоксона. Статистическая обработка данных выполнена в программе SPSS 21.0. Статистически значимыми приняты различия при p≤0,05.
Результаты
До начала терапии пациенты в обеих группах предъявляли классический спектр жалоб на головную боль, общую слабость и быструю утомляемость, снижение работоспособности и трудности поддержания концентрации/внимания, забывчивость; со слов пациентов, это приводило к нарастающим тревоге и беспокойству за будущее, к снижению настроения из-за страха инвалидизации и беспомощности. Через 3 мес после начала терапии по данным медицинской документации в 1-й группе зафиксированы клинические улучшения в виде снижения частоты представленности и выраженности жалоб пациентов, во 2-й группе значимых изменений не зарегистрировано. Результаты отражены в табл. 3.В зависимости от нозологической группы пациенты сообщали о преимущественно тех или иных превалирующих изменениях самочувствия на повторном приеме. Так, пациенты с черепно-мозговой травмой отметили выраженное улучшение когнитивных процессов (скорость мышления, внимания, реакции) и регресс цефалгического синдрома. Пациенты с хронической ишемией головного мозга сообщали также о когнитивных улучшениях, дополнительно отмечая облегчение контроля течения сопутствующей артериальной гипертензии, предполагая, что эффект связан с увеличившейся эмоциональной стабильностью и изменениям в реакциях на стрессовые события. Пациенты, страдающие эпилепсией, сообщили об улучшении общего самочувствия и лучшей переносимости базовой терапии (уменьшение раздражительности, сонливости, стабилизация настроения). Пациенты с экстрапирамидными заболеваниями отметили выраженное снижение частоты и облигатности насильственных движений.
При оценке по шкале HADS до начала лечения суммарный балл составил 19,3±4,5 в 1-й группе и 18,8±5,1 – во 2-й группе; через 3 мес в 1-й группе наблюдалась выраженная редукция суммарного балла тревоги и депрессии до 11,9±2,3, тогда как во второй группе эти значения не претерпели существенной динамики – 18,9±3,8. В группе, получавшей комбинированное лечение, зафиксировано снижение тревожности на 41%, депрессии – на 35%; в контрольной группе показатели не претерпели значимых изменений. Детальное распределение средних показателей и суммарного балла до и после лечение в обеих группах показано на рис. 1.

 По результатам оценки по шкале побочных явлений UKU в 1-й группе снизилась частота нежелательных явлений на фоне проводимого лечения: до начала терапии в среднем 5,2 на одного пациента, через 3 мес – 3,9 на 1 пациента. В обеих группах преимущественно выявлялись психовегетативные нарушения, что согласуется с результатами, представленными в других работах [8]. Наиболее значительные изменения наблюдались в когнитивных функциях (улучшение памяти, концентрации) и снижении частоты и интенсивности головной боли.
По результатам оценки по шкале побочных явлений UKU в 1-й группе снизилась частота нежелательных явлений на фоне проводимого лечения: до начала терапии в среднем 5,2 на одного пациента, через 3 мес – 3,9 на 1 пациента. В обеих группах преимущественно выявлялись психовегетативные нарушения, что согласуется с результатами, представленными в других работах [8]. Наиболее значительные изменения наблюдались в когнитивных функциях (улучшение памяти, концентрации) и снижении частоты и интенсивности головной боли.Среднее значение при оценке по шкале оценки когнитивных функций (МоСА-test) в 1-й группе до начала комплексной терапии составило 23,9±3,8, через 3 мес – 27,1±1,6; во 2-й группе (контроль): до начала исследования составило 23,7±3,6, спустя 3 мес – 24,8±3,9. В 1-й группе наблюдался значимый прирост показателя на 13%, во 2-й группе изменений не выявлено. Графическое представление результатов выполнено на рис. 2. Данные коррелируют с результатами, полученными в аналогичных исследованиях [9].
 По шкале EQ-5D в 1-й группе средние значения составили 68,4±9,9 балла до начала комплексной терапии, во второй группе – 67,0±9,2 балла; через 3 мес в 1-й группе средние значения составили 81,3±8,7 балла, во второй группе – 69,1±8,4 балла. Таким образом, выявлено достоверное улучшение общих показателей на 19% у пациентов в 1-й группе, наиболее значимые изменения зафиксированы в разделах «привычная повседневная деятельность» и «тревога/депрессия» (р≤0,05), в контрольной группе изменения незначительны (рис. 3).
По шкале EQ-5D в 1-й группе средние значения составили 68,4±9,9 балла до начала комплексной терапии, во второй группе – 67,0±9,2 балла; через 3 мес в 1-й группе средние значения составили 81,3±8,7 балла, во второй группе – 69,1±8,4 балла. Таким образом, выявлено достоверное улучшение общих показателей на 19% у пациентов в 1-й группе, наиболее значимые изменения зафиксированы в разделах «привычная повседневная деятельность» и «тревога/депрессия» (р≤0,05), в контрольной группе изменения незначительны (рис. 3).Аллергических и нежелательных реакций в ходе исследования зафиксировано не было.
Выводы
Повышение качества жизни пациента является одной из ключевых задач терапии. Комбинация основной терапии и Пантогама Актив привела к выраженным клиническим улучшениям как субъективного (улучшение общего самочувствия, повышение работоспособности, снижение тревожности, улучшение настроения), так и объективного характера (выявляемые при осмотре врачом-специалистом и подтвержденные изменением оценок по шкалам).Клинический случай
Пациентка, 52 лет. Обратилась с жалобами на частые головные боли диффузной локализации, снижение памяти, внимания, трудности концентрации, нарушение речи (стала долго «подбирать необходимое слово»), головокружение и ощущение неустойчивости, эпизодически возникающее «сердцебиение», регулярные подъемы артериального давления (АД) до 150/90 мм рт. ст. и «подергивание» в мышцах рук и ног, преобладающие в вечернее время. На консультацию к неврологу обратилась из-за нарушения сна на фоне нарастающего беспокойства за состояние своего здоровья и опасения развития тяжелого заболевания. Анамнез жизни без особенностей, подъемы АД до указанных значений беспокоят около двух лет. Регулярно медикаментозную терапию не получает, давление контролирует эпизодически, так как повышение значений связывает со стрессовыми событиями. Сообщает о незначительном нарастании симптоматики в течение последних двух лет, первоначальное ухудшение самочувствия связывает с назначением на руководящую должность (испытывает беспокойство и высокое чувство ответственности за свою работу).В соматическом статусе: кожные покровы и видимые слизистые бледные, локальный гипергидроз ладоней и стоп. Индекс массы тела (ИМТ) – 29,8. АД – 130/80 мм рт. ст., пульс – 72 уд/мин. Живот мягкий, при пальпации незначительно болезненный в проекции желчного пузыря. Стул – склонность к запорам. Диурез без особенностей. В неврологическом статусе: фон настроения снижен, мимика и презентация жалоб экспрессивна, однако пациентка быстро истощается. Исследование черепных нервов – без патологии. Парезов нет. Фибрилляции и фасцикулляции не вызываются. Мышечный тонус несколько повышен в проксимальных группах мышц конечностей. Сухожильные рефлексы симметричны, оживлены. Патологические рефлексы не вызываются. Координаторные пробы выполняет с легким интенционным тремором без промахивания, в пробе Ромберга неустойчива. Тремор век при закрытых глазах. Нарушений поверхностной и глубокой чувствительности не выявлено. Функции тазовых органов не нарушены. Оценка по шкалам: МоСА-test – 23 балла, HADS – 12 баллов (тревога) и 6 баллов (депрессия).
При объективном обследовании в биохимическом анализе крови выявлена гиперхолестеринемия 6,6 ммоль/л (3,1–5,2 ммоль/л). Индекс атерогенности 3,7. Ультразвуковое исследование брахиоцефальных артерий выявило утолщение комплекса интима–медиа в бифуркации правой общей сонной артерии до 1,3 мм, в левой общей сонной артерии до 1,2 мм. Пациенткой самостоятельно выполнена магнитно-резонансная томография головного мозга: очаговых патологических изменений нет.
Совместно с кардиологом назначена диета (цель – снижение массы тела и коррекция гиперлипидемии), гипотензивная и антиагрегантная терапия, а также дополнительно рекомендован прием Пантогама Актив в дозировке 300 мг по 2 капсулы 2 раза в сутки на протяжении 3 мес. При контрольном визите через 21 день пациентка отметила выраженное улучшение общего состояния, снижение эмоциональной лабильности и повышение работоспособности, стабилизацию цифр АД. На приеме через 3 мес. зафиксирована нормализация ИМТ (24,7 кг/м2), полный регресс неврологической симптоматики, проведена попытка отмены гипотензивной терапии. Оценка по шкале МоСА-test – 30 баллов, шкала HADS: 3 балла (тревога) и 1 балл (депрессия). Пациентка смогла вернуться к привычному образу жизни, сохранив корректировки, рекомендованные специалистами; кроме того, сообщила о позитивной реакции близких людей на изменившееся поведение и самочувствие.
Обсуждение (дискуссия)
Гопантеновая кислота – известное на протяжении десятилетий вещество, обладающее широким спектром эффектов на нервную систему. Она улучшает метаболические и трофические процессы, оказывает протективное, мягкое седативное и стимулирующее действие, повышает устойчивость клеток к гипоксии и воздействию токсических веществ [10]. С точки зрения воздействия на клиническую симптоматику, молекула может быть эффективна при терапии когнитивно сниженных пациентов (причем как на фоне органического поражения головного мозга, так и при тревожных и депрессивных расстройствах) [8].В отечественном препарате Пантогам Актив (D,L-гопантеновая кислота) представлена рацемическая смесь равных количеств R-формы гопантеновой кислоты и ее S-изомера, что улучшает транспорт молекулы и ее взаимодействие с рецептором ГАМК, усиливая действие. Особая структура Пантогам Актив наделяет его возможностью комбинированного действия на несколько нейромедиаторных систем головного мозга (помимо ГАМК-эргической, задействуются холин- и дофаминергические системы рецепторов). Это позволяет применять его у самых разных в клиническом аспекте пациентов, имеющих общие патофизиологические основы развития заболевания. За счет ноотропного, нейровегето-тропного, антиастенического, антидепрессивного, противотревожного и противосудорожного эффектов, а также нейропротективного действия он успешно применяется в комплексной терапии коморбидных состояний при артериальной гипертензии, снижает риск и частоту развития тревожных и депрессивных расстройств у пациентов с цереброваскулярными заболеваниями, а также купирует возникновение гипертонических кризов, провоцируемых психоэмоциональными событиями. Его сочетание с кардиотропной и вазоактивной терапией лишено значимых нежелательных событий, препарат лишен эффекта привыкания и «синдрома отмены», что повышает не только комплаентность, но и качество жизни пациента [11]. Кроме того, рекомендация о применении Пантогам Актив в комплексной терапии когнитивных расстройств приводится в Национальном руководстве по неврологии [2].
Информация об авторах
Information about the authors
Давидов Давид Рудольфович – канд. мед. наук, зам. глав. врача по клинико-экспертной работе, ГБУЗ Московской области «Котельниковская городская поликлиника», доц. каф., НОЧУ ВО «Московский финансово-промышленный университет „Синергия“». E-mail: pcep40@list.ru; ORCID: 0000-0003-4576-6854;
Scopus Author ID: 57209411228
David R. Davidov – Сand. Sci. (Med.), Moscow region “Kotelnikovskaya City Clinic”, Assoc. Prof., Moscow University of Industry and Finance (Synergy University).
E-mail: pcep40@list.ru; ORC ID: 0000-0003-4576-6854; Scopus Author ID: 57209411228
Москвичева Александра Станиславовна – канд. мед. наук, доц. каф. НОЧУ ВО «Московский финансово-промышленный университет „Синергия“». E-mail: md.mac@yandex.ru;
ORCID: 0000-0002-0381-4662; Scopus Author ID: 57216653355
Aleksandra S. Moskvicheva – Сand. Sci. (Med.),
Assoc. Prof., Moscow University of Industry and Finance
(Synergy University). E-mail: md.mac@yandex.ru;
ORCID: 0000-0002-0381-4662;
Scopus Author ID: 57216653355
Поступила в редакцию: 20.05.2024
Поступила после рецензирования: 23.05.2025
Принята к публикации: 23.05.2024
Received: 20.05.2024
Revised: 23.05.2025
Accepted: 23.05.2024
Список исп. литературыСкрыть список1. Bell V, Wilkinson S, Greco M et al. What is the functional/organic distinction actually doing in psychiatry and neurology? Wellcome Open Res. 2020;5:138. DOI: 10.12688/wellcomeopenres.16022.1
2. Неврология. Национальное руководство. Краткое издание. Под ред. Е.И. Гусева,
А.Н. Коновалова, А.Б. Гехт. М.: ГЭОТАР-Медиа, 2018. ISBN: 978-5-9704-4405-4
Neurology. National leadership. Brief edition. Ed. E.I. Guseva, A.N. Konovalova, A.B. Gekht. Moscow: GEOTAR-Media, 2018. ISBN: 978-5-9704-4405-4 (In Russian).
3. Кудлач А.И., Шалькевич Л.В., Симоненко А.В. и др. Патологическая избыточность двигательного акта: современные представления о патогенезе и подходы к медикаментозной коррекции. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017; 117(11):161-7. DOI: 10.17116/ jnevro2017 117111161-167
Kudlatch A.I., Shalkevich L.V., Simonenko A.V. et al. Pathological redundancy of the motor act: modern concepts of the pathogenesis and approaches to the pharmacological treatment. S.S. Korsakov Journal of Neurology and Psychiatry. 2017;117(11):161-7. DOI: 10.17116/ jnevro2017 117111161-167 (in Russian).
4. Asadi-Pooya AA, Hallett M, Mirzaei Damabi N et al. Genetics of Functional Seizures; A Scoping Systematic Review. Genes (Basel). 2023;14(8):1537. DOI: 10.3390/ genes14081537
5. Rane S, Elrahi S, Villarreal J et al. Low Serum Pyridoxine Levels Worsen Seizure Control in Adult Epilepsy Patients. Cureus. 2022;14(6): e25669. DOI: 10.7759/cureus.25669
6. Felice D, Cryan JF, O'Leary OF. GABAB Receptors: Anxiety and Mood Disorders. Curr Top Behav Neurosci. 2022;52:241-65. DOI: 10.1007/7854_2020_171
7. Yang Y, Rui Q, Han S et al. Reduced GABA levels in the medial prefrontal cortex are associated with cognitive impairment in patients with NMOSD. Mult Scler Relat Disord. 2022;58:103496. DOI: 10.1016/ j.msard.2022.103496
8. Гехт А.Б., Канаева Л.С., Аведисова А.С. и др. Возможности применения рац-гопантеновой кислоты в комплексном лечении тревожно-депрессивных расстройств у больных с хронической ишемией головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016;116(11):45-57. DOI: 10. 17116/ jnevro201611611145-57
Guekht A.B., Kanaeva L.S., Avedisova A.S. et al. Possible applications of rac-hopantenic acid in the treatment of anxiety and depressive disorders in patients with chronic cerebral ischemia. S.S. Korsakov Journal of Neurology and Psychiatry. 2016;116(11):45-57 DOI: 10. 17116/ jnevro201611611145-57 (in Russian).
9. Смулевич А.Б., Волель Б.А., Терновая Е.С. и др. Применение препарата пантогам актив (D-, L-гопантеновая кислота) в терапии когнитивных и тревожных расстройств у пациентов с артериальной гипертензией. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015; 115(12):40-9. DOI: 10.17116/jnevro201511511240-49
Smulevich A.B., Volel B.A., Ternovaya E.S. et al. Pantogam activ (D-, L-hopantenic acid) in the treatment of cognitive and anxiety disorders in patients with arterial hypertension. S.S. Korsakov Journal of Neurology and Psychiatry. 2015;115(12):40-9. DOI: 10.17116/jnevro 201511511240-49 (in Russian).
10. Громова О.А., Торшин И.Ю., Лиманова О.А. и др. Нейротропные, противовоспалительные и противоопухолевые свойства молекулы гопантеновой кислоты по данным хемоинформационного анализа. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2015;115(5-2):61-71. DOI: 10.17116/ jnevro20151155261-71
Gromova O.A., Torshin I.Yu., Limanova O.A. et al. Neurotropic, anti-inflammatory and antitumor properties of hopantenic acid: a chemoinformatic analysis of its molecule. S.S. Korsakov Journal of Neurology and Psychiatry. 2015;115(5-2):61-71. DOI: 10.17116/ jnevro 20151155261-71 (in Russian).
11. Остроумова О.Д. Возможности D-, L-гопантеновой кислоты в лечении когнитивных и тревожных расстройств у больных с эссенциальной артериальной гипертензией. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(10):115-21. DOI: 10.17116/ jnevro2018118101115
Ostroumova OD. Possible applications of rac- hopantenic acid in the treatment of cognitive, anxiety and depressive disorders in patients with essential arterial hypertension. S.S. Korsakov Journal of Neurology and Psychiatry. 2018;118(10):115-21. DOI: 10.17116/ jnevro 2018118101115 (in Russian).

