Клинический разбор в общей медицине №4 2024
Vernadsky Crimean Federal University, Simferopol, Russia
kayalieva00@mail.ru
Аbstract
The article discusses current ideas about the pathogenesis, risk factors, and new methods of diagnosis and treatment of diabetic retinopathy. This disease is a specific microvascular ocular complication of diabetes mellitus and is part of the group of ischemic retinopathies, which are characterized by a significant violation of capillary perfusion, the development of intraocular newly formed vessels and retinal edema. Statistics show that almost 366 million people in the world suffer from diabetes mellitus (IDF Atlas, 2011). According to forecasts, this number is expected to double by 2030, and this global growth will have a huge impact on the prevalence of diabetic retinopathy. Over the past decade, advances in medical technology and the development of new treatment methods have significantly improved the diagnosis and treatment of patients, but nevertheless, diabetic macular edema and proliferative diabetic retinopathy remain the leading causes of vision loss.
Keywords: diabetic retinopathy, diabetes mellitus, hyperglycemia, hemato-retinal barrier, VEGF, cytokines, chemokines, angiopoietin-2, panretinal photocoagulation.
For citation: Kayalieva E.Z., Khalilova S.R., Kaliberdenko V.B. Modern aspects of the pathogenesis, diagnosis and treatment of diabetic retinopathy. Clinical review for general practice. 2024; 5 (4): 15–22 (In Russ.). DOI: 10.47407/kr2024.5.4.00415
Статистика гласит, что около 366 млн человек в мире страдают сахарным диабетом – СД (IDF Atlas, 2011). По прогнозам, к 2030 г. ожидается увеличение числа больных в два раза, и этот глобальный рост окажет огромное влияние на распространенность диабетической ретинопатии (ДРП) [1].
СД – это системное заболевание, при котором уровень глюкозы в крови хронически и часто резко повышается по двум причинам:
1) инсулин не секретируется островковыми клетками поджелудочной железы (СД 1-го типа);
2) секретируемый инсулин по ряду причин менее эффективен, чем обычно (СД 2-го типа).
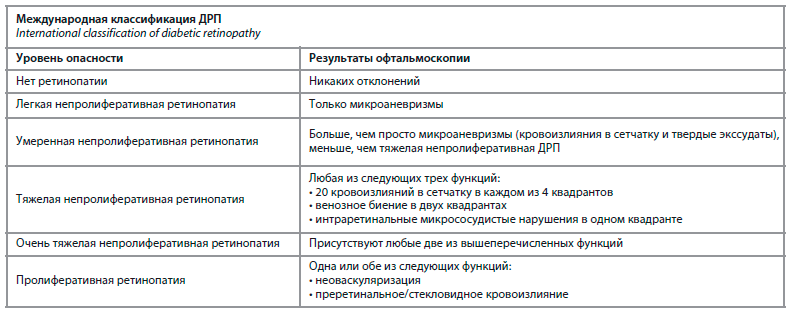
За годы хронической гипергликемии у многих людей развиваются серьезные повреждения сетчатки. Симптомы ДРП широко варьируются и могут быть непропорциональны тяжести патологии органа. Например, глаза с легким диабетическим макулярным отеком (ДМО), поражающим ямку одного глаза, могут иметь симптоматическое снижение зрения, тогда как глаза с тяжелой пролиферативной ретинопатией могут иметь остроту зрения 20/20 и не иметь никаких симптомов до тех пор, пока не начнет развиваться кровоизлияние в стекловидное тело. Это несоответствие между структурой и функцией является основанием для программ скрининга групп риска с целью выявления и лечения пациентов, имеющих риск потери зрения. В настоящее время разработана международная классификация ДРП, благодаря которой по результатам офтальмоскопии можно выставить ту или иную форму заболевания (см. таблицу).
Самыми ранними проявлениями ДРП считаются микроаневризмы или очаговые расширения микрососудов сетчатки, которые проявляются в виде темно-красных точек, преимущественно в заднем полюсе. Обычно эти поражения появляются и исчезают с течением времени и сами по себе не вызывают никаких симптомов. К клиническим проявлениям заболевания, по данным E. Fenwick и соавт., относятся: интраретинальные кровоизлияния, ватные пятна, венозные бусы или интраретинальные микрососудистые аномалии, микроаневризмы, а также появление новых кровеносных сосудов [2].
Современные достижения в понимании сложной патофизиологии ДРП позволили идентифицировать многие типы клеток, участвующих в патогенезе, однако к единому мнению ученые так и не пришли.
VEGF. Фактор роста эндотелия сосудов (vascular endothelium growth factor, VEGF) является наиболее широко исследованным фактором в отношении изменения гемато-ретинального барьера (ГРБ). Уровни VEGF значительно повышены у пациентов с ДМО по сравнению с недиабетическими заболеваниями глаз [3]. VEGF является мощным вазоактивным цитокином, вызывающим повышенную проницаемость сосудов. Он влияет на белки плотных соединений эндотелия, что приводит к «подтеканию» плазмы и отеку сетчатки. Исследования показали, что данный фактор индуцирует фосфорилирование VE-кадгерина, окклюдина и ZO-1 и таким образом дополнительно вызывает нарушение барьера. В научных работах D. Antonetti писал о том, что VEGF также стимулирует усиление лейкостаза в микрососудах сетчатки, а в дальнейшем лейкоциты высвобождают цитокины, что вызывает разрушение ГРБ [4].
Цитокины. Роль воспаления в развитии и прогрессировании ДРП изучается уже давно, но в последние 10 лет растет количество проводимых исследований в данном направлении. Это объясняется важностью молекулярных механизмов для разработки новых терапевтических подходов и методов лечения. Еще в 1960 г.
E. Powell и R. Field заметили, что у пациентов с СД, получавших противовоспалительные лекарственные средства, наблюдался более низкий уровень заболеваемости ДРП [5]. Годами ранее исследования G. Lutty и соавт. выявили важную роль лейкоцитов в развитии данного заболевания, а последующее исследование установило, что ДРП является «воспалительным заболеванием» [6].
По мнению S. Rangasamy и соавт., существуют общие наборы воспалительных цитокинов, активность которых повышается как в сыворотке, так и в образцах стекловидного тела и водянистой влаги у пациентов с ДРП, и эти цитокины могут иметь множественные взаимодействия, влияющие на патогенез заболевания [7].
Ключевые факторы воспаления, участвующие в изменении ГРБ:
1) повышенная экспрессия молекул эндотелиальной адгезии, таких как ICAM1, VCAM1, PECAM-1 и P-селектин;
2) адгезия лейкоцитов к эндотелия;
3) высвобождение воспалительных хемокинов, цитокинов и факторов проницаемости сосудов;
4) изменение адгезивов и белков плотных соединений между эндотелиальными клетками;
5) инфильтрация лейкоцитов в нейросетчатку, что приводит к изменению ГРБ.
Гипергликемия. Патогенез ДРП, вызванный гипергликемией, связан с четырьмя основными биохимическими изменениями:
1) увеличение потока полиольных путей;
2) повышенное образование конечных продуктов гликирования;
3) активация изоформ протеинкиназы C;
4) увеличение потока гексозамина [8].
Эти пути приводят к сосудистой дисфункции и воспалению, после чего увеличиваются проницаемость, окклюзия сосудов и локальная ишемия. Кроме того, данные процессы усиливают регуляцию проангиогенных и воспалительных факторов, таких как VEGF, инсулиноподобный фактор роста (IGF), ангиопоэтины (Ang-2), фактор роста стромального происхождения-1 (SDF-1), основной фактор роста фибробластов-2 (bFGF), фактор роста гепатоцитов (HGF), фактор некроза опухоли (TNF) и интерлейкин (IL)-6.
Хемокины. Группа ученых во главе с A. Meleth провели ряд исследований, в которых изучали уровни хемокинов и молекул клеточной адгезии в водянистой влаге и стекловидном теле у пациентов с ДРП. Иммуноокрашивание глаз показало, что TNF-α, MCP-1, RANTES и ICAM-1 выявляются в глазах больных СД [9]. Через пару лет Y. Suzuki и соавт. в своей научной работе описали проведенное ими комплексное исследование с использованием набора цитокинов. Выяснилось, что уровни IL-6, IL-8 (CXCL8), IL-10 (CXCL10), IL-13, IP-10, MCP-1 (CCL2), MIP-1β (CCL4), PDGF и VEGF в жидкости стекловидного тела значительно выше нормы у больных ДРП [10]. Кроме того, воспалительные факторы
IP-10 и MCP-1 были обнаружены в слезах у пациентов с СД [11]. Подтверждается сказанное исследованиями
M. Funk и соавт., в ходе которых стало ясно, что селективное блокирование VEGF с помощью инъекций бевацизумаба (анти-VEGF) не влияет на контроль других иммуногенных цитокинов, таких как MCP-1 и IL-6 в водянистой влаге [12]. Моноцитарный хемотаксический белок-1 (MCP-1), также известный как хемокиновый лиганд 2 (CCL2), вырабатывается эндотелиальными клетками сосудов сетчатки, пигментными эпителиальными клетками и глиальными клетками Мюллера в ответ на гипергликемию. Исследования, проведенные в лаборатории под руководством N. Katakami, показали, что генетический нокаут гена CCL2 у мышей с диабетом предотвращает изменение ГРБ [13]. Полученные данные свидетельствуют о том, что селективное ингибирование гена CCL2 может предотвратить появление изменений в ГРБ.
Лейкостаз. S. Schröder впервые описал лейкостаз в сосудистой сети сетчатки как важный феномен, связанный с увеличением количества нейтрофилов и моноцитов, которые связаны с сосудистыми нарушениями сетчатки на моделях крыс с СД [14]. Повышенная плотность нейтрофилов была обнаружена в сосудистой сети сетчатки при диабете, особенно вокруг диска зрительного нерва и макулы. Адгезии лейкоцитов в диабетической сетчатке способствует повышенная экспрессия молекул адгезии, таких как ICAM-1 и P-селектин, на эндотелии и его лейкоцитарном контррецепторе CD18 [15]. Это приводит к потере эндотелиальных клеток и разрушению внутреннего ГРБ. Нормальный внутренний ГРБ непроницаем для лейкоцитов, но активация лейкоцитов приводит к его временному распаду, что становится толчком к усилению провоспалительной реакции в сетчатке глаза.
Фоторецепторы. Роль фоторецепторов внешней части сетчатки обычно не рассматривалась в патогенезе ДРП, отчасти из-за значительного расстояния между фоторецепторами и микрососудистой сетью сетчатки, на которую оказывают влияние метаболические нарушения при СД. Тем не менее имеющиеся данные позволяют предположить, что уникальная восприимчивость сетчатки к повреждениям на самом деле является результатом присутствия фоторецепторов. В поддержку гипотезы фоторецепторов G. Arden и соавт. разослали опросник пациентам с СД, у которых был выявлен пигментный ретинит [16]. Результаты этих ответов показали, что ДРП была менее тяжелой у пациентов, у которых также был пигментный ретинит (и, следовательно, дегенерация фоторецепторов). Анализируя сказанное, можно сделать вывод о том, что фоторецепторы оказывают выраженное влияние на патогенез и развитие ДРП.
Ангиопоэтин-2. Ангиопоэтины представляют собой семейство воспалительных факторов роста. Они связываются с рецепторной тирозинкиназой TIE2 и являются важными модуляторами ангиогенеза. Уровни ангиопоэтина-2 (Ang-2) в стекловидном теле значительно повышены у пациентов с клинически значимым макулярным отеком, что указывает на роль ангиопоэтина-2 в изменении ГРБ [17]. В 2011 г. S. Rangasamy и соавт. обнаружили повышенную экспрессию мРНК и белков Ang-2 в сетчатке глаз животных, больных диабетом [18]. К тому же ученые производили интравитреальное введение Ang-2 крысам, не страдающим СД, что показало трехкратное увеличение проницаемости сосудов сетчатки. Годами раннее был проведен эксперимент, во главе которого был U. Fiedler. Было выявлено, что Ang-2 способствует адгезии моноцитов путем повышения чувствительности эндотелиальных клеток к TNF-α и модулирует индуцированную TNF-α экспрессию молекул адгезии эндотелиальных клеток, а также вызывает потерю VE-кадгерина [19]. Это открытие идентифицирует Ang-2 как аутокринный регулятор воспалительных реакций эндотелиальных клеток, тем самым становится важной терапевтической мишенью при лечении больных ДРП.
Гемодинамические изменения. Висконсинское эпидемиологическое исследование ДРП (WESDR), а также Британское проспективное исследование СД (UKPDS) сообщили о значительной роли артериального давления (АД) в прогрессировании ДРП [20, 21]. Во многих научных работах описывается высокая частота обнаружения артериальной гипертензии у лиц с СД [22,23]. V. Patel после ряда наблюдений выяснил, что после успешной фотокоагуляции приток крови к сетчатке снижается, что было интерпретировано как коррекция гемодинамической ауторегуляции [24]. Артериальная гипертензия оказывает влияние на прогрессирование ДРП посредством двух механизмов. Во-первых, механическое растяжение и явное напряжение, оказываемое на эндотелиальные клетки высоким кровяным давлением и увеличением перфузии сетчатки, а также более высокой вязкостью крови, приводят к эндотелиальной дисфункции [25]. Во-вторых, ренин-ангиотензин-альдостероновая система (РААС), участвующая в регуляции АД, также независимо участвует в патогенезе ДРП [26]. При проведении исследований выяснилось, что в сетчатке больных ДРП увеличивается экспрессия рецепторов и сигнальных молекул РААС, а именно ренина, ангиотензинпревращающих ферментов I и II (ACE I и ACE II), а также рецепторов ангиотензина [27]. Эти данные дают новое представление о значении блокады РААС как нового метода лечения ДРП.
Изменения в ГРБ. Нарушения в ГРБ являются отличительной чертой патогенеза ДРП. В норме этот барьер на уровне капилляров сетчатки включает эндотелиальные межклеточные соединения, базальную мембрану и перициты, которые покрывают сосуды снаружи. При СД происходят следующие изменения: потеря межклеточных соединений эндотелия, утолщение базальной мембраны и селективная потеря перицитов. Последнее является одним из ранних гистопатологических поражений, наблюдаемых при ДРП. В норме перициты (модифицированные гладкомышечные клетки) сокращаются и поддерживают капиллярный кровоток в сетчатке. Их потеря ведет к очаговому ослаблению капиллярной стенки, а также к неингибированной очаговой пролиферации эндотелиальных клеток, что становится причиной образования микроаневризм. Позже эндотелиальные клетки также погибают, что вызывает нарушение перфузии сетчатки. Распад ГРБ приводит к внутриретинальным кровоизлияниям, твердым экссудатам и макулярному отеку.
Пациенты с СД 1-го типа должны ежегодно проходить обследование сетчатки, начиная с 11 лет и/или через 5 лет после постановки диагноза. В случае выявления изменений сетчатки рекомендуются более короткие интервалы наблюдения. При СД 2-го типа первое обследование сетчатки следует проводить сразу после постановки диагноза, поскольку предыдущая продолжительность заболевания неизвестна. Ежегодные контрольные осмотры рекомендуются при отсутствии изменений сетчатки, в противном случае рекомендуются более короткие интервалы. Беременность несет повышенный риск ухудшения ДРП из-за гормональных изменений. Во время беременности ДРП может начаться примерно в 10% случаев и может ухудшиться в еще большем проценте случаев при уже существующей ДРП до наступления беременности [27]. В случае пролиферативной ДРП до или вскоре после зачатия следует провести панретинальную лазерную коагуляцию, поскольку изменения сетчатки могут ухудшиться. Поэтому всем женщинам с диабетом, которые планируют забеременеть, следует проходить исследование глазного дна до зачатия, а затем каждые 3 мес во время беременности, чтобы при необходимости можно было своевременно вмешаться.
Профилактика потери зрения требует лучшего понимания фундаментальных процессов, которые ухудшают зрение, и улучшения диагностических тестов, позволяющих определить параметры для оценки реакции на фармакологическое вмешательство. Дисфункция сетчатки при диабете начинается до появления микрососудистых поражений. К счастью, современные технологические достижения позволили применять новые методы визуализации при заболеваниях сетчатки в клинической практике.
Дилатационная фундоскопия является важнейшим клиническим исследованием у больных СД при скрининговом осмотре у офтальмолога. Расширение зрачка необходимо для обеспечения правильного стереоскопического изображения, нужного для оценки макулярного отека, а также для визуализации периферической части сетчатки.
Флюоресцентная ангиография была введена в клиническую офтальмологическую практику H. Novotny и соавт. [28] в 1960-е годы. Она позволяет оценить сосудистый статус сетчатки. В ходе исследования флуоресцеин, флуоресцентный краситель, вводится внутривенно и распределяется по всему организму. В глазу флуоресценция активируется синим светом с длиной волны 490 нм. Благодаря флюоресцентной ангиографии можно увидеть утечку сосудов, окклюзию капилляров, ишемические участки сетчатки и неоваскуляризацию.
Фотография глазного дна в широком поле (2-лазерная немидриатическая сканирующая лазерная офтальмоскопия со сверхширокоугольным полем обзора 200°) является новым методом диагностики. Его можно комбинировать с флуоресцентной ангиографией и получить информацию о периферической ишемии сетчатки или периферической неоваскуляризации. Согласно недавним исследованиям, широкоугольные изображения и традиционная цветная фотография глазного дна при мидриазе коррелируют с классификацией ДРП и визуализацией ДМО [29, 30].
Оптическая когерентная томография (ОКТ) – диагностическое исследование структур глаза, при котором используется специальное оборудование – когерентный томограф. Исследование предоставляет данные об объеме сетчатки и конфигурации макулярной области. В последние годы разрешение и скорость записи были значительно улучшены с помощью метода ОКТ в спектральной области (SD-ОКТ). Высокое разрешение, доступное при ОКТ в спектральной области, позволяет тщательно изучать слои и клетки сетчатки при СД и ее реакцию на лечение. При ДМО SD-ОКТ является очень ценным методом диагностики, позволяющим сравнивать последующие визиты с исходными данными, поскольку современные ОКТ-устройства используют отслеживание глаз для нахождения того же положения изображения во время последующих обследований. Карты толщины макулы и изображения ОКТ служат руководством для определения реакции на терапию анти-VEGF и макулярную лазерную терапию и широко используются в крупных клинических исследованиях.
Исследование по контролю диабета и осложнениям показало, что строгий контроль уровня глюкозы (гликированный гемоглобин <6% или 42,1 ммоль/моль) у людей с СД 1-го типа предотвращает развитие ДРП и замедляет прогрессирование существующей ДРП на 76% [34].
Что касается контроля АД, исследование UKPDS обнаружило, что контроль АД также приводит к значительному снижению потери зрения [35]. Но в то же время исследование ACCORD Eye показало, что строгий контроль гипертензии не приводит к значительному снижению частоты ДРП [36]. Что касается контроля липидов, то R. Benarous и соавт. выяснили, что уровни холестерина липопротеидов низкой плотности и триглицеридов напрямую связаны с частотой и тяжестью ДРП, тогда как уровень холестерина липопротеидов высокой плотности связан с этим косвенно [37]. Исследование «Вмешательство фенофибратом и снижение частоты случаев диабета» показало, что фенофибрат (200 мг в день) снижает потребность в лазерном лечении ретинопатии у людей с диабетом 2-го типа [38]. Это было дополнительно подтверждено исследованием ACCORD Eye, которое предоставило доказательства того, что фенофибрат, добавленный к терапии симвастатином у людей с СД 2-го типа, замедлял прогрессирование ДРП через 4 года [36]. Целью лечения АГ должно быть достижение систолического АД<140 мм рт. ст., а к терапии статинами следует добавить фенофибрат для оптимального контроля липидов в крови.
Большинство препаратов, которые проходят клинические испытания, являются препаратами, нацеленными на молекулу VEGF. В настоящее время благодаря использованию анти-VEGF-агентов стало доступно больше возможностей для предотвращения и даже обращения вспять потери зрения. Лекарственными средствами, которые непосредственно ингибируют молекулу VEGF, являются пегаптаниб (Macugen, OSI Pharmaceuticals), фрагмент моноклонального антитела ранибизумаб (Lucentis, Genentech Inc., Сан-Франциско) и полноразмерное антитело бевацизумаб (Avastin, Genentech Inc., Сан-Франциско). Некоторые методы лечения используют растворимые аналоги рецептора VEGF, ловушку VEGF (Regeneron Pharmaceuticals, Тэрритаун, Нью-Йорк), малые интерферирующие РНК, бевасираниб (Opko Health Inc., Майами, Флорида) и рапамицин (Sirolimus, MacuSight Inc., Юнион-Сити).
Ранибизумаб представляет собой моноклональное антитело, которое блокирует все изоформы VEGF-A и имеет «повышенное сродство», обеспечивающее сильное сродство к связыванию с VEGF-A. В 2012 г. интравитреальный ранибизумаб получил одобрение Food and Drug Administration (FDA) для лечения ДМО на основании результатов нескольких крупных клинических исследований [39–44]. Эти испытания продемонстрировали, что интравитреальное введение ранибизумаба значительно уменьшает отек желтого пятна и приводит к улучшению остроты зрения у пациентов. READ-2 сравнил монотерапию ранибизумабом с комбинацией ранибизумаба и лазерного лечения и обнаружил, что средняя острота зрения с наилучшей коррекцией лучше при монотерапии ранибизумабом с устойчивой эффективностью [42]. RESTORE также продемонстрировало превосходство монотерапии ранибизумабом над макулярной лазерной фотокоагуляцией и не выявило дополнительных преимуществ терапии ранибизумабом в сочетании с макулярной лазерной терапией [44]. Исследования RISE и RIDE предоставили дополнительные доказательства того, что монотерапия ранибизумабом обеспечивает быстрые и устойчивые результаты в уменьшении макулярного отека.
Бевацизумаб (Авастин, Genentech) представляет собой полноразмерное гуманизированное моноклональное антитело, почти в три раза превышающее размер молекулы ранибизумаба, которое также блокирует все изоформы VEGF-A. В исследовании BOLT (bevacizumab or laser therapy) проводилось сравнение интравитреального бевацизумаба с лазерной терапией и обнаружилось, что средняя максимальная корригированная острота зрения значительно лучше в группе бевацизумаба по сравнению с только лазерной терапией [45]. Бевацизумаб также применялся до и после операции для использования при витрэктомии по поводу ДРП. В исследованиях изучалось его влияние на интраоперационные маневры и интраоперационное кровотечение, а также на частоту послеоперационных кровоизлияний в стекловидное тело [46]. Тем не менее по-прежнему отсутствуют высококачественные доказательства, подтверждающие явную пользу. Другой препарат против VEGF, афлиберцепт, получил одобрение FDA в 2014 г. для лечения ДМО и потенциально может снизить частоту необходимых инъекций [47]. Использование анти-VEGF-агентов позволило значительно улучшить возможности лечения ДРП. Тем не менее использование фокальной/сетчатой макулярной лазерной терапии по-прежнему играет решающую роль в лечении этого заболевания.
Учитывая, что воспаление играет решающую роль при ДРП, для лечения ДМО используются различные кортикостероиды. T. Gardner и соавт. в своих работах указывают на то, что помимо противовоспалительного действия глюкокортикостероиды также ингибируют VEGF и увеличивают плотные контакты между эндотелиальными клетками капилляров [48]. Интравитреальное применение триамцинолона в сочетании с фокальной/сетчатой лазерной терапией продемонстрировало равную эффективность по сравнению с монотерапией ранибизумабом [40, 43]. Однако в недавних исследованиях интравитреальное введение триамцинолона в качестве монотерапии было менее эффективным по сравнению с макулярной лазерной фотокоагуляцией [49]. В 2013 г. появились доказательства того, что интравитреальный триамцинолон может замедлять прогрессирование пролиферативной ДРП [50]. В другом рандомизированном многоцентровом трехлетнем исследовании FAME интравитреальные введения флуоцинолона ацетонида (0,2 и 0,5 мкг в день) обеспечили существенное улучшение зрения у пациентов с ДМО, однако почти у всех пациентов, получавших флуоцинолона ацетонид, наблюдалось образование катаракты, а частота инцизионных операций по поводу глаукомы составляла 4,8% (низкая доза) и 8,1% (высокая доза) [51]. Интересно отметить, что была также обнаружена повышенная эффективность использования флуоцинолона ацетонида при хроническом ДМО (продолжительностью >3 лет) по сравнению с нехроническим ДМО (продолжительностью <3 лет) [52]. На основании этого выдвинута гипотеза, что заболевание может быть вызвано VEGF на ранних стадиях заболевания, но при хроническом ДМО изменения микроокружения требуют воздействия стероидов на множество молекул-медиаторов.
Поскольку ежемесячные интравитреальные инъекции анти-VEGF являются бременем лечения не только для пациентов, но и для врачей, продолжаются исследования новых методов лечения с использованием биоразрушаемых имплантатов, биоразрушаемых микросфер и инкапсулированных клеток. Недавно было завершено клиническое исследование I фазы с использованием многоразового небиоразлагаемого имплантата для долгосрочной доставки лекарственного средства ранибизумаба на 20 пациентах с дегенерацией желтого пятна. Исследование показало постоянное среднее улучшение зрения на 10 букв в течение 1 года [53].
Панретинальная фотокоагуляция (PRP) в настоящее время остается стандартным лечением ДРП и значительно снижает риск потери зрения. Существуют убедительные доказательства использования фокальной макулярной лазерной фотокоагуляции для предотвращения потери зрения вследствие ДМО [54–56]. При этой процедуре ожоги большого размера и большей интенсивности (500 мкм) размещаются в средней периферии сетчатки на 360° за один или два сеанса. Лечение вызывает регресс новых сосудов примерно через 6 нед, но следует учитывать побочные эффекты, а именно ухудшение ранее существовавшего макулярного отека и нарушение функции периферической сетчатки и ночного видения [57]. Применение PRP принципиально не менялось до появления в последние годы PASCAL. Целью этого устройства было сократить время процедуры лазерного лечения и уменьшить боль пациента за счет снижения стимуляции цилиарных нервов в сосудистой оболочке, обеспечивая при этом те же терапевтические результаты. S. Al-Hussainy и соавт. в своих исследованиях выяснили, что PASCAL требует более короткой продолжительности фотокоагуляции, но большей мощности, что, как было показано, действительно уменьшает боль у пациентов с аналогичными результатами по сравнению с традиционной PRP [58]. Недавнее исследование PETER PAN [59] показало, что при более низкой мощности были достигнуты аналогичные результаты с меньшей потерей зрения по сравнению со стандартными настройками PRP.
Несмотря на значительные успехи консервативной терапии в лечении ДРП, хирургическое вмешательство остается незаменимым вариантом лечения пациентов с осложнениями, включая неразрешающиеся кровоизлияния в стекловидное тело и тракционные отслойки сетчатки. Витрэктомия с индукцией задней отслойки стекловидного тела может быть использована для лечения ДМО с тракционным компонентом. Операция включает в себя трехпортовую технику с удалением стекловидного тела и крови, а также эндолазерную фотокоагуляцию, аналогичную лазерному лечению PRP. Внедрение системы Constellation со сверхскоростными фрезами, контролем рабочего цикла, улучшенной струйной системой и мощной эндоиллюминацией, а также хирургическими вмешательствами малого калибра (23 и 25 калибра) значительно улучшило зрение у пациентов.
В последние годы возросло число исследований метода избирательного применения субтермального воздействия на клетки ретинального пигментного эпителия. Преимуществом данного лечения является сохранение нейросенсорной сетчатки и, следовательно, уменьшение ятрогенных побочных эффектов, вызванных функциональной потерей ткани сетчатки и глубокими ожогами, которые вызывают долговременное рубцевание и фиброз. Два принципа помогают достичь этой цели. Во-первых, используются более длинные волны лазера: криптоновый красный 647 нм и диодный лазер 810 нм, чтобы уменьшить интенсивность ожога и избежать поглощения макулярными хромофорами. Во-вторых, разработка методов микропульсаров, которые увеличивают задержку между импульсами и уменьшают размеры поражений сетчатки за счет устранения диффузии тепла и роста поражений после лечения.
В 2005 г. исследование подпорогового диодного микропульсарного лазера (SDM), в котором используется диодный лазер с длиной волны 810 нм с субоптимальной интенсивностью, применяемый ко всем областям утолщения желтого пятна, показало, что лазерная фотокоагуляция SDM аналогична предыдущим лазерным методам лечения, но при этом снижается процент ятрогенных побочных эффектов.
Большинство методов лечения установленных сосудистых поражений при ДРП снижают риск слепоты и потери зрения, но редко восстанавливают нормальное зрение. Продолжающееся воздействие гипергликемии, гипертензии и других системных заболеваний в конечном итоге все больше ухудшает зрение. В долгосрочном исследовании G. Blankenship и соавт. у пациентов, получавших панретинальную фотокоагуляцию, сохранялось хорошее зрение, но со временем оно постепенно ухудшалось [60]. Можно сделать вывод, что лечение долгосрочных последствий метаболической дисфункции на нейроретинальных клетках по-прежнему представляет собой проблему, которую ученым еще предстоит решить.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Каялиева Эльмаз Зевжетовна – студентка 2-го медицинского фак-та Ордена Трудового Красного Знамени Медицинского института им. С.И. Георгиевского ФГАОУ ВО
«КФУ им. В.И. Вернадского». E-mail: kayalieva00@mail.ru
Elmaz Z. Kayalieva – Student, Vernadsky Crimean Federal University. E-mail: kayalieva00@mail.ru
Халилова Севиля Руслановна – студентка 2-го медицинского фак-та Ордена Трудового Красного Знамени Медицинского института им. С.И. Георгиевского ФГАОУ ВО
«КФУ им. В.И. Вернадского». E-mail: sevilyahalilova4@mail.ru
Sevilya R. Khalilova – Student, Vernadsky Crimean Federal University. E-mail: sevilyahalilova4@mail.ru
Калиберденко Виталий Борисович – канд. мед. наук, доц. каф. внутренней медицины №2 Ордена Трудового Красного Знамени Медицинского института им. С.И. Георгиевского ФГАОУ ВО
«КФУ им. В.И. Вернадского».
Vitaliy B. Kaliberdenko – Cand. Sci. (Med.), Associate Professor, Vernadsky Crimean Federal University
Поступила в редакцию: 22.03.2024
Поступила после рецензирования: 28.03.2024
Принята к публикации: 04.04.2024
Received: 22.03.2024
Revised: 28.03.2024
Accepted: 04.04.2024
Клинический разбор в общей медицине №4 2024
Современные аспекты патогенеза, диагностики и лечения диабетической ретинопатии
Номера страниц в выпуске:15-22
Аннотация
В статье рассмотрены современные представления о патогенезе, факторах риска, новых методах диагностики и лечения диабетической ретинопатии. Данное заболевание является специфическим микрососудистым глазным осложнением сахарного диабета и входит в группу ишемических ретинопатий, которые характеризуются значительным нарушением капиллярной перфузии, развитием внутриглазных новообразованных сосудов и ретинальным отеком. По статистике, около 366 млн человек в мире страдают сахарным диабетом – (IDF Atlas, 2011), а к 2030 г. ожидается увеличение числа больных в 2 раза, и этот глобальный рост окажет огромное влияние на распространенность диабетической ретинопатии. За последнее десятилетие достижения в области медицинских технологий и разработка новых методов лечения значительно улучшили диагностику и лечение пациентов, но тем не менее диабетический макулярный отек и пролиферативная диабетическая ретинопатия остаются ведущими причинами потери зрения.
Ключевые слова: диабетическая ретинопатия, сахарный диабет, гипергликемия, гемато-ретинальный барьер, VEGF, цитокины, хемокины, ангиопоэтин-2, панретинальная фотокоагуляция.
Для цитирования: Каялиева Э.З., Халилова С.Р., Калиберденко В.Б. Современные аспекты патогенеза, диагностики и лечения диабетической ретинопатии. Клинический разбор в общей медицине. 2024; 5 (4): 15–22. DOI: 10.47407/kr2024.5.4.00415
В статье рассмотрены современные представления о патогенезе, факторах риска, новых методах диагностики и лечения диабетической ретинопатии. Данное заболевание является специфическим микрососудистым глазным осложнением сахарного диабета и входит в группу ишемических ретинопатий, которые характеризуются значительным нарушением капиллярной перфузии, развитием внутриглазных новообразованных сосудов и ретинальным отеком. По статистике, около 366 млн человек в мире страдают сахарным диабетом – (IDF Atlas, 2011), а к 2030 г. ожидается увеличение числа больных в 2 раза, и этот глобальный рост окажет огромное влияние на распространенность диабетической ретинопатии. За последнее десятилетие достижения в области медицинских технологий и разработка новых методов лечения значительно улучшили диагностику и лечение пациентов, но тем не менее диабетический макулярный отек и пролиферативная диабетическая ретинопатия остаются ведущими причинами потери зрения.
Ключевые слова: диабетическая ретинопатия, сахарный диабет, гипергликемия, гемато-ретинальный барьер, VEGF, цитокины, хемокины, ангиопоэтин-2, панретинальная фотокоагуляция.
Для цитирования: Каялиева Э.З., Халилова С.Р., Калиберденко В.Б. Современные аспекты патогенеза, диагностики и лечения диабетической ретинопатии. Клинический разбор в общей медицине. 2024; 5 (4): 15–22. DOI: 10.47407/kr2024.5.4.00415
Modern aspects of the pathogenesis, diagnosis and treatment of diabetic retinopathy
Elmaz Z. Kayalieva, Sevilya R. Khalilova, Vitaliy B. KaliberdenkoVernadsky Crimean Federal University, Simferopol, Russia
kayalieva00@mail.ru
Аbstract
The article discusses current ideas about the pathogenesis, risk factors, and new methods of diagnosis and treatment of diabetic retinopathy. This disease is a specific microvascular ocular complication of diabetes mellitus and is part of the group of ischemic retinopathies, which are characterized by a significant violation of capillary perfusion, the development of intraocular newly formed vessels and retinal edema. Statistics show that almost 366 million people in the world suffer from diabetes mellitus (IDF Atlas, 2011). According to forecasts, this number is expected to double by 2030, and this global growth will have a huge impact on the prevalence of diabetic retinopathy. Over the past decade, advances in medical technology and the development of new treatment methods have significantly improved the diagnosis and treatment of patients, but nevertheless, diabetic macular edema and proliferative diabetic retinopathy remain the leading causes of vision loss.
Keywords: diabetic retinopathy, diabetes mellitus, hyperglycemia, hemato-retinal barrier, VEGF, cytokines, chemokines, angiopoietin-2, panretinal photocoagulation.
For citation: Kayalieva E.Z., Khalilova S.R., Kaliberdenko V.B. Modern aspects of the pathogenesis, diagnosis and treatment of diabetic retinopathy. Clinical review for general practice. 2024; 5 (4): 15–22 (In Russ.). DOI: 10.47407/kr2024.5.4.00415
Статистика гласит, что около 366 млн человек в мире страдают сахарным диабетом – СД (IDF Atlas, 2011). По прогнозам, к 2030 г. ожидается увеличение числа больных в два раза, и этот глобальный рост окажет огромное влияние на распространенность диабетической ретинопатии (ДРП) [1].
СД – это системное заболевание, при котором уровень глюкозы в крови хронически и часто резко повышается по двум причинам:
1) инсулин не секретируется островковыми клетками поджелудочной железы (СД 1-го типа);
2) секретируемый инсулин по ряду причин менее эффективен, чем обычно (СД 2-го типа).
За годы хронической гипергликемии у многих людей развиваются серьезные повреждения сетчатки. Симптомы ДРП широко варьируются и могут быть непропорциональны тяжести патологии органа. Например, глаза с легким диабетическим макулярным отеком (ДМО), поражающим ямку одного глаза, могут иметь симптоматическое снижение зрения, тогда как глаза с тяжелой пролиферативной ретинопатией могут иметь остроту зрения 20/20 и не иметь никаких симптомов до тех пор, пока не начнет развиваться кровоизлияние в стекловидное тело. Это несоответствие между структурой и функцией является основанием для программ скрининга групп риска с целью выявления и лечения пациентов, имеющих риск потери зрения. В настоящее время разработана международная классификация ДРП, благодаря которой по результатам офтальмоскопии можно выставить ту или иную форму заболевания (см. таблицу).

Самыми ранними проявлениями ДРП считаются микроаневризмы или очаговые расширения микрососудов сетчатки, которые проявляются в виде темно-красных точек, преимущественно в заднем полюсе. Обычно эти поражения появляются и исчезают с течением времени и сами по себе не вызывают никаких симптомов. К клиническим проявлениям заболевания, по данным E. Fenwick и соавт., относятся: интраретинальные кровоизлияния, ватные пятна, венозные бусы или интраретинальные микрососудистые аномалии, микроаневризмы, а также появление новых кровеносных сосудов [2].
Современные достижения в понимании сложной патофизиологии ДРП позволили идентифицировать многие типы клеток, участвующих в патогенезе, однако к единому мнению ученые так и не пришли.
VEGF. Фактор роста эндотелия сосудов (vascular endothelium growth factor, VEGF) является наиболее широко исследованным фактором в отношении изменения гемато-ретинального барьера (ГРБ). Уровни VEGF значительно повышены у пациентов с ДМО по сравнению с недиабетическими заболеваниями глаз [3]. VEGF является мощным вазоактивным цитокином, вызывающим повышенную проницаемость сосудов. Он влияет на белки плотных соединений эндотелия, что приводит к «подтеканию» плазмы и отеку сетчатки. Исследования показали, что данный фактор индуцирует фосфорилирование VE-кадгерина, окклюдина и ZO-1 и таким образом дополнительно вызывает нарушение барьера. В научных работах D. Antonetti писал о том, что VEGF также стимулирует усиление лейкостаза в микрососудах сетчатки, а в дальнейшем лейкоциты высвобождают цитокины, что вызывает разрушение ГРБ [4].
Цитокины. Роль воспаления в развитии и прогрессировании ДРП изучается уже давно, но в последние 10 лет растет количество проводимых исследований в данном направлении. Это объясняется важностью молекулярных механизмов для разработки новых терапевтических подходов и методов лечения. Еще в 1960 г.
E. Powell и R. Field заметили, что у пациентов с СД, получавших противовоспалительные лекарственные средства, наблюдался более низкий уровень заболеваемости ДРП [5]. Годами ранее исследования G. Lutty и соавт. выявили важную роль лейкоцитов в развитии данного заболевания, а последующее исследование установило, что ДРП является «воспалительным заболеванием» [6].
По мнению S. Rangasamy и соавт., существуют общие наборы воспалительных цитокинов, активность которых повышается как в сыворотке, так и в образцах стекловидного тела и водянистой влаги у пациентов с ДРП, и эти цитокины могут иметь множественные взаимодействия, влияющие на патогенез заболевания [7].
Ключевые факторы воспаления, участвующие в изменении ГРБ:
1) повышенная экспрессия молекул эндотелиальной адгезии, таких как ICAM1, VCAM1, PECAM-1 и P-селектин;
2) адгезия лейкоцитов к эндотелия;
3) высвобождение воспалительных хемокинов, цитокинов и факторов проницаемости сосудов;
4) изменение адгезивов и белков плотных соединений между эндотелиальными клетками;
5) инфильтрация лейкоцитов в нейросетчатку, что приводит к изменению ГРБ.
Гипергликемия. Патогенез ДРП, вызванный гипергликемией, связан с четырьмя основными биохимическими изменениями:
1) увеличение потока полиольных путей;
2) повышенное образование конечных продуктов гликирования;
3) активация изоформ протеинкиназы C;
4) увеличение потока гексозамина [8].
Эти пути приводят к сосудистой дисфункции и воспалению, после чего увеличиваются проницаемость, окклюзия сосудов и локальная ишемия. Кроме того, данные процессы усиливают регуляцию проангиогенных и воспалительных факторов, таких как VEGF, инсулиноподобный фактор роста (IGF), ангиопоэтины (Ang-2), фактор роста стромального происхождения-1 (SDF-1), основной фактор роста фибробластов-2 (bFGF), фактор роста гепатоцитов (HGF), фактор некроза опухоли (TNF) и интерлейкин (IL)-6.
Хемокины. Группа ученых во главе с A. Meleth провели ряд исследований, в которых изучали уровни хемокинов и молекул клеточной адгезии в водянистой влаге и стекловидном теле у пациентов с ДРП. Иммуноокрашивание глаз показало, что TNF-α, MCP-1, RANTES и ICAM-1 выявляются в глазах больных СД [9]. Через пару лет Y. Suzuki и соавт. в своей научной работе описали проведенное ими комплексное исследование с использованием набора цитокинов. Выяснилось, что уровни IL-6, IL-8 (CXCL8), IL-10 (CXCL10), IL-13, IP-10, MCP-1 (CCL2), MIP-1β (CCL4), PDGF и VEGF в жидкости стекловидного тела значительно выше нормы у больных ДРП [10]. Кроме того, воспалительные факторы
IP-10 и MCP-1 были обнаружены в слезах у пациентов с СД [11]. Подтверждается сказанное исследованиями
M. Funk и соавт., в ходе которых стало ясно, что селективное блокирование VEGF с помощью инъекций бевацизумаба (анти-VEGF) не влияет на контроль других иммуногенных цитокинов, таких как MCP-1 и IL-6 в водянистой влаге [12]. Моноцитарный хемотаксический белок-1 (MCP-1), также известный как хемокиновый лиганд 2 (CCL2), вырабатывается эндотелиальными клетками сосудов сетчатки, пигментными эпителиальными клетками и глиальными клетками Мюллера в ответ на гипергликемию. Исследования, проведенные в лаборатории под руководством N. Katakami, показали, что генетический нокаут гена CCL2 у мышей с диабетом предотвращает изменение ГРБ [13]. Полученные данные свидетельствуют о том, что селективное ингибирование гена CCL2 может предотвратить появление изменений в ГРБ.
Лейкостаз. S. Schröder впервые описал лейкостаз в сосудистой сети сетчатки как важный феномен, связанный с увеличением количества нейтрофилов и моноцитов, которые связаны с сосудистыми нарушениями сетчатки на моделях крыс с СД [14]. Повышенная плотность нейтрофилов была обнаружена в сосудистой сети сетчатки при диабете, особенно вокруг диска зрительного нерва и макулы. Адгезии лейкоцитов в диабетической сетчатке способствует повышенная экспрессия молекул адгезии, таких как ICAM-1 и P-селектин, на эндотелии и его лейкоцитарном контррецепторе CD18 [15]. Это приводит к потере эндотелиальных клеток и разрушению внутреннего ГРБ. Нормальный внутренний ГРБ непроницаем для лейкоцитов, но активация лейкоцитов приводит к его временному распаду, что становится толчком к усилению провоспалительной реакции в сетчатке глаза.
Фоторецепторы. Роль фоторецепторов внешней части сетчатки обычно не рассматривалась в патогенезе ДРП, отчасти из-за значительного расстояния между фоторецепторами и микрососудистой сетью сетчатки, на которую оказывают влияние метаболические нарушения при СД. Тем не менее имеющиеся данные позволяют предположить, что уникальная восприимчивость сетчатки к повреждениям на самом деле является результатом присутствия фоторецепторов. В поддержку гипотезы фоторецепторов G. Arden и соавт. разослали опросник пациентам с СД, у которых был выявлен пигментный ретинит [16]. Результаты этих ответов показали, что ДРП была менее тяжелой у пациентов, у которых также был пигментный ретинит (и, следовательно, дегенерация фоторецепторов). Анализируя сказанное, можно сделать вывод о том, что фоторецепторы оказывают выраженное влияние на патогенез и развитие ДРП.
Ангиопоэтин-2. Ангиопоэтины представляют собой семейство воспалительных факторов роста. Они связываются с рецепторной тирозинкиназой TIE2 и являются важными модуляторами ангиогенеза. Уровни ангиопоэтина-2 (Ang-2) в стекловидном теле значительно повышены у пациентов с клинически значимым макулярным отеком, что указывает на роль ангиопоэтина-2 в изменении ГРБ [17]. В 2011 г. S. Rangasamy и соавт. обнаружили повышенную экспрессию мРНК и белков Ang-2 в сетчатке глаз животных, больных диабетом [18]. К тому же ученые производили интравитреальное введение Ang-2 крысам, не страдающим СД, что показало трехкратное увеличение проницаемости сосудов сетчатки. Годами раннее был проведен эксперимент, во главе которого был U. Fiedler. Было выявлено, что Ang-2 способствует адгезии моноцитов путем повышения чувствительности эндотелиальных клеток к TNF-α и модулирует индуцированную TNF-α экспрессию молекул адгезии эндотелиальных клеток, а также вызывает потерю VE-кадгерина [19]. Это открытие идентифицирует Ang-2 как аутокринный регулятор воспалительных реакций эндотелиальных клеток, тем самым становится важной терапевтической мишенью при лечении больных ДРП.
Гемодинамические изменения. Висконсинское эпидемиологическое исследование ДРП (WESDR), а также Британское проспективное исследование СД (UKPDS) сообщили о значительной роли артериального давления (АД) в прогрессировании ДРП [20, 21]. Во многих научных работах описывается высокая частота обнаружения артериальной гипертензии у лиц с СД [22,23]. V. Patel после ряда наблюдений выяснил, что после успешной фотокоагуляции приток крови к сетчатке снижается, что было интерпретировано как коррекция гемодинамической ауторегуляции [24]. Артериальная гипертензия оказывает влияние на прогрессирование ДРП посредством двух механизмов. Во-первых, механическое растяжение и явное напряжение, оказываемое на эндотелиальные клетки высоким кровяным давлением и увеличением перфузии сетчатки, а также более высокой вязкостью крови, приводят к эндотелиальной дисфункции [25]. Во-вторых, ренин-ангиотензин-альдостероновая система (РААС), участвующая в регуляции АД, также независимо участвует в патогенезе ДРП [26]. При проведении исследований выяснилось, что в сетчатке больных ДРП увеличивается экспрессия рецепторов и сигнальных молекул РААС, а именно ренина, ангиотензинпревращающих ферментов I и II (ACE I и ACE II), а также рецепторов ангиотензина [27]. Эти данные дают новое представление о значении блокады РААС как нового метода лечения ДРП.
Изменения в ГРБ. Нарушения в ГРБ являются отличительной чертой патогенеза ДРП. В норме этот барьер на уровне капилляров сетчатки включает эндотелиальные межклеточные соединения, базальную мембрану и перициты, которые покрывают сосуды снаружи. При СД происходят следующие изменения: потеря межклеточных соединений эндотелия, утолщение базальной мембраны и селективная потеря перицитов. Последнее является одним из ранних гистопатологических поражений, наблюдаемых при ДРП. В норме перициты (модифицированные гладкомышечные клетки) сокращаются и поддерживают капиллярный кровоток в сетчатке. Их потеря ведет к очаговому ослаблению капиллярной стенки, а также к неингибированной очаговой пролиферации эндотелиальных клеток, что становится причиной образования микроаневризм. Позже эндотелиальные клетки также погибают, что вызывает нарушение перфузии сетчатки. Распад ГРБ приводит к внутриретинальным кровоизлияниям, твердым экссудатам и макулярному отеку.
Диагностика
Ранние изменения на сетчатке глаза при ДРП не ощущаются пациентами из-за частого отсутствия симптомов нарушения и потери зрения. Таким образом, у больных СД необходимы регулярные исследования сетчатки при расширении зрачка, чтобы своевременно выявить угрожающие зрению изменения и дать возможность офтальмологам провести лечение.Пациенты с СД 1-го типа должны ежегодно проходить обследование сетчатки, начиная с 11 лет и/или через 5 лет после постановки диагноза. В случае выявления изменений сетчатки рекомендуются более короткие интервалы наблюдения. При СД 2-го типа первое обследование сетчатки следует проводить сразу после постановки диагноза, поскольку предыдущая продолжительность заболевания неизвестна. Ежегодные контрольные осмотры рекомендуются при отсутствии изменений сетчатки, в противном случае рекомендуются более короткие интервалы. Беременность несет повышенный риск ухудшения ДРП из-за гормональных изменений. Во время беременности ДРП может начаться примерно в 10% случаев и может ухудшиться в еще большем проценте случаев при уже существующей ДРП до наступления беременности [27]. В случае пролиферативной ДРП до или вскоре после зачатия следует провести панретинальную лазерную коагуляцию, поскольку изменения сетчатки могут ухудшиться. Поэтому всем женщинам с диабетом, которые планируют забеременеть, следует проходить исследование глазного дна до зачатия, а затем каждые 3 мес во время беременности, чтобы при необходимости можно было своевременно вмешаться.
Профилактика потери зрения требует лучшего понимания фундаментальных процессов, которые ухудшают зрение, и улучшения диагностических тестов, позволяющих определить параметры для оценки реакции на фармакологическое вмешательство. Дисфункция сетчатки при диабете начинается до появления микрососудистых поражений. К счастью, современные технологические достижения позволили применять новые методы визуализации при заболеваниях сетчатки в клинической практике.
Дилатационная фундоскопия является важнейшим клиническим исследованием у больных СД при скрининговом осмотре у офтальмолога. Расширение зрачка необходимо для обеспечения правильного стереоскопического изображения, нужного для оценки макулярного отека, а также для визуализации периферической части сетчатки.
Флюоресцентная ангиография была введена в клиническую офтальмологическую практику H. Novotny и соавт. [28] в 1960-е годы. Она позволяет оценить сосудистый статус сетчатки. В ходе исследования флуоресцеин, флуоресцентный краситель, вводится внутривенно и распределяется по всему организму. В глазу флуоресценция активируется синим светом с длиной волны 490 нм. Благодаря флюоресцентной ангиографии можно увидеть утечку сосудов, окклюзию капилляров, ишемические участки сетчатки и неоваскуляризацию.
Фотография глазного дна в широком поле (2-лазерная немидриатическая сканирующая лазерная офтальмоскопия со сверхширокоугольным полем обзора 200°) является новым методом диагностики. Его можно комбинировать с флуоресцентной ангиографией и получить информацию о периферической ишемии сетчатки или периферической неоваскуляризации. Согласно недавним исследованиям, широкоугольные изображения и традиционная цветная фотография глазного дна при мидриазе коррелируют с классификацией ДРП и визуализацией ДМО [29, 30].
Оптическая когерентная томография (ОКТ) – диагностическое исследование структур глаза, при котором используется специальное оборудование – когерентный томограф. Исследование предоставляет данные об объеме сетчатки и конфигурации макулярной области. В последние годы разрешение и скорость записи были значительно улучшены с помощью метода ОКТ в спектральной области (SD-ОКТ). Высокое разрешение, доступное при ОКТ в спектральной области, позволяет тщательно изучать слои и клетки сетчатки при СД и ее реакцию на лечение. При ДМО SD-ОКТ является очень ценным методом диагностики, позволяющим сравнивать последующие визиты с исходными данными, поскольку современные ОКТ-устройства используют отслеживание глаз для нахождения того же положения изображения во время последующих обследований. Карты толщины макулы и изображения ОКТ служат руководством для определения реакции на терапию анти-VEGF и макулярную лазерную терапию и широко используются в крупных клинических исследованиях.
Варианты лечения
Ключом к предотвращению и контролю глазных осложнений СД являются строгий гликемический контроль и контроль АД. Пациентам следует объяснять важность контроля основного заболевания, что было доказано в нескольких крупных клинических исследованиях [31–33]. Связь уровня глюкозы в крови с ретинопатией непрерывна и не имеет порогового значения, хотя у лиц с уровнем гликированного гемоглобина (показатель хронической гликемии) менее 6,5% ретинопатия обычно развивается незначительно или вообще не развивается.Исследование по контролю диабета и осложнениям показало, что строгий контроль уровня глюкозы (гликированный гемоглобин <6% или 42,1 ммоль/моль) у людей с СД 1-го типа предотвращает развитие ДРП и замедляет прогрессирование существующей ДРП на 76% [34].
Что касается контроля АД, исследование UKPDS обнаружило, что контроль АД также приводит к значительному снижению потери зрения [35]. Но в то же время исследование ACCORD Eye показало, что строгий контроль гипертензии не приводит к значительному снижению частоты ДРП [36]. Что касается контроля липидов, то R. Benarous и соавт. выяснили, что уровни холестерина липопротеидов низкой плотности и триглицеридов напрямую связаны с частотой и тяжестью ДРП, тогда как уровень холестерина липопротеидов высокой плотности связан с этим косвенно [37]. Исследование «Вмешательство фенофибратом и снижение частоты случаев диабета» показало, что фенофибрат (200 мг в день) снижает потребность в лазерном лечении ретинопатии у людей с диабетом 2-го типа [38]. Это было дополнительно подтверждено исследованием ACCORD Eye, которое предоставило доказательства того, что фенофибрат, добавленный к терапии симвастатином у людей с СД 2-го типа, замедлял прогрессирование ДРП через 4 года [36]. Целью лечения АГ должно быть достижение систолического АД<140 мм рт. ст., а к терапии статинами следует добавить фенофибрат для оптимального контроля липидов в крови.
Большинство препаратов, которые проходят клинические испытания, являются препаратами, нацеленными на молекулу VEGF. В настоящее время благодаря использованию анти-VEGF-агентов стало доступно больше возможностей для предотвращения и даже обращения вспять потери зрения. Лекарственными средствами, которые непосредственно ингибируют молекулу VEGF, являются пегаптаниб (Macugen, OSI Pharmaceuticals), фрагмент моноклонального антитела ранибизумаб (Lucentis, Genentech Inc., Сан-Франциско) и полноразмерное антитело бевацизумаб (Avastin, Genentech Inc., Сан-Франциско). Некоторые методы лечения используют растворимые аналоги рецептора VEGF, ловушку VEGF (Regeneron Pharmaceuticals, Тэрритаун, Нью-Йорк), малые интерферирующие РНК, бевасираниб (Opko Health Inc., Майами, Флорида) и рапамицин (Sirolimus, MacuSight Inc., Юнион-Сити).
Ранибизумаб представляет собой моноклональное антитело, которое блокирует все изоформы VEGF-A и имеет «повышенное сродство», обеспечивающее сильное сродство к связыванию с VEGF-A. В 2012 г. интравитреальный ранибизумаб получил одобрение Food and Drug Administration (FDA) для лечения ДМО на основании результатов нескольких крупных клинических исследований [39–44]. Эти испытания продемонстрировали, что интравитреальное введение ранибизумаба значительно уменьшает отек желтого пятна и приводит к улучшению остроты зрения у пациентов. READ-2 сравнил монотерапию ранибизумабом с комбинацией ранибизумаба и лазерного лечения и обнаружил, что средняя острота зрения с наилучшей коррекцией лучше при монотерапии ранибизумабом с устойчивой эффективностью [42]. RESTORE также продемонстрировало превосходство монотерапии ранибизумабом над макулярной лазерной фотокоагуляцией и не выявило дополнительных преимуществ терапии ранибизумабом в сочетании с макулярной лазерной терапией [44]. Исследования RISE и RIDE предоставили дополнительные доказательства того, что монотерапия ранибизумабом обеспечивает быстрые и устойчивые результаты в уменьшении макулярного отека.
Бевацизумаб (Авастин, Genentech) представляет собой полноразмерное гуманизированное моноклональное антитело, почти в три раза превышающее размер молекулы ранибизумаба, которое также блокирует все изоформы VEGF-A. В исследовании BOLT (bevacizumab or laser therapy) проводилось сравнение интравитреального бевацизумаба с лазерной терапией и обнаружилось, что средняя максимальная корригированная острота зрения значительно лучше в группе бевацизумаба по сравнению с только лазерной терапией [45]. Бевацизумаб также применялся до и после операции для использования при витрэктомии по поводу ДРП. В исследованиях изучалось его влияние на интраоперационные маневры и интраоперационное кровотечение, а также на частоту послеоперационных кровоизлияний в стекловидное тело [46]. Тем не менее по-прежнему отсутствуют высококачественные доказательства, подтверждающие явную пользу. Другой препарат против VEGF, афлиберцепт, получил одобрение FDA в 2014 г. для лечения ДМО и потенциально может снизить частоту необходимых инъекций [47]. Использование анти-VEGF-агентов позволило значительно улучшить возможности лечения ДРП. Тем не менее использование фокальной/сетчатой макулярной лазерной терапии по-прежнему играет решающую роль в лечении этого заболевания.
Учитывая, что воспаление играет решающую роль при ДРП, для лечения ДМО используются различные кортикостероиды. T. Gardner и соавт. в своих работах указывают на то, что помимо противовоспалительного действия глюкокортикостероиды также ингибируют VEGF и увеличивают плотные контакты между эндотелиальными клетками капилляров [48]. Интравитреальное применение триамцинолона в сочетании с фокальной/сетчатой лазерной терапией продемонстрировало равную эффективность по сравнению с монотерапией ранибизумабом [40, 43]. Однако в недавних исследованиях интравитреальное введение триамцинолона в качестве монотерапии было менее эффективным по сравнению с макулярной лазерной фотокоагуляцией [49]. В 2013 г. появились доказательства того, что интравитреальный триамцинолон может замедлять прогрессирование пролиферативной ДРП [50]. В другом рандомизированном многоцентровом трехлетнем исследовании FAME интравитреальные введения флуоцинолона ацетонида (0,2 и 0,5 мкг в день) обеспечили существенное улучшение зрения у пациентов с ДМО, однако почти у всех пациентов, получавших флуоцинолона ацетонид, наблюдалось образование катаракты, а частота инцизионных операций по поводу глаукомы составляла 4,8% (низкая доза) и 8,1% (высокая доза) [51]. Интересно отметить, что была также обнаружена повышенная эффективность использования флуоцинолона ацетонида при хроническом ДМО (продолжительностью >3 лет) по сравнению с нехроническим ДМО (продолжительностью <3 лет) [52]. На основании этого выдвинута гипотеза, что заболевание может быть вызвано VEGF на ранних стадиях заболевания, но при хроническом ДМО изменения микроокружения требуют воздействия стероидов на множество молекул-медиаторов.
Поскольку ежемесячные интравитреальные инъекции анти-VEGF являются бременем лечения не только для пациентов, но и для врачей, продолжаются исследования новых методов лечения с использованием биоразрушаемых имплантатов, биоразрушаемых микросфер и инкапсулированных клеток. Недавно было завершено клиническое исследование I фазы с использованием многоразового небиоразлагаемого имплантата для долгосрочной доставки лекарственного средства ранибизумаба на 20 пациентах с дегенерацией желтого пятна. Исследование показало постоянное среднее улучшение зрения на 10 букв в течение 1 года [53].
Панретинальная фотокоагуляция (PRP) в настоящее время остается стандартным лечением ДРП и значительно снижает риск потери зрения. Существуют убедительные доказательства использования фокальной макулярной лазерной фотокоагуляции для предотвращения потери зрения вследствие ДМО [54–56]. При этой процедуре ожоги большого размера и большей интенсивности (500 мкм) размещаются в средней периферии сетчатки на 360° за один или два сеанса. Лечение вызывает регресс новых сосудов примерно через 6 нед, но следует учитывать побочные эффекты, а именно ухудшение ранее существовавшего макулярного отека и нарушение функции периферической сетчатки и ночного видения [57]. Применение PRP принципиально не менялось до появления в последние годы PASCAL. Целью этого устройства было сократить время процедуры лазерного лечения и уменьшить боль пациента за счет снижения стимуляции цилиарных нервов в сосудистой оболочке, обеспечивая при этом те же терапевтические результаты. S. Al-Hussainy и соавт. в своих исследованиях выяснили, что PASCAL требует более короткой продолжительности фотокоагуляции, но большей мощности, что, как было показано, действительно уменьшает боль у пациентов с аналогичными результатами по сравнению с традиционной PRP [58]. Недавнее исследование PETER PAN [59] показало, что при более низкой мощности были достигнуты аналогичные результаты с меньшей потерей зрения по сравнению со стандартными настройками PRP.
Несмотря на значительные успехи консервативной терапии в лечении ДРП, хирургическое вмешательство остается незаменимым вариантом лечения пациентов с осложнениями, включая неразрешающиеся кровоизлияния в стекловидное тело и тракционные отслойки сетчатки. Витрэктомия с индукцией задней отслойки стекловидного тела может быть использована для лечения ДМО с тракционным компонентом. Операция включает в себя трехпортовую технику с удалением стекловидного тела и крови, а также эндолазерную фотокоагуляцию, аналогичную лазерному лечению PRP. Внедрение системы Constellation со сверхскоростными фрезами, контролем рабочего цикла, улучшенной струйной системой и мощной эндоиллюминацией, а также хирургическими вмешательствами малого калибра (23 и 25 калибра) значительно улучшило зрение у пациентов.
В последние годы возросло число исследований метода избирательного применения субтермального воздействия на клетки ретинального пигментного эпителия. Преимуществом данного лечения является сохранение нейросенсорной сетчатки и, следовательно, уменьшение ятрогенных побочных эффектов, вызванных функциональной потерей ткани сетчатки и глубокими ожогами, которые вызывают долговременное рубцевание и фиброз. Два принципа помогают достичь этой цели. Во-первых, используются более длинные волны лазера: криптоновый красный 647 нм и диодный лазер 810 нм, чтобы уменьшить интенсивность ожога и избежать поглощения макулярными хромофорами. Во-вторых, разработка методов микропульсаров, которые увеличивают задержку между импульсами и уменьшают размеры поражений сетчатки за счет устранения диффузии тепла и роста поражений после лечения.
В 2005 г. исследование подпорогового диодного микропульсарного лазера (SDM), в котором используется диодный лазер с длиной волны 810 нм с субоптимальной интенсивностью, применяемый ко всем областям утолщения желтого пятна, показало, что лазерная фотокоагуляция SDM аналогична предыдущим лазерным методам лечения, но при этом снижается процент ятрогенных побочных эффектов.
Большинство методов лечения установленных сосудистых поражений при ДРП снижают риск слепоты и потери зрения, но редко восстанавливают нормальное зрение. Продолжающееся воздействие гипергликемии, гипертензии и других системных заболеваний в конечном итоге все больше ухудшает зрение. В долгосрочном исследовании G. Blankenship и соавт. у пациентов, получавших панретинальную фотокоагуляцию, сохранялось хорошее зрение, но со временем оно постепенно ухудшалось [60]. Можно сделать вывод, что лечение долгосрочных последствий метаболической дисфункции на нейроретинальных клетках по-прежнему представляет собой проблему, которую ученым еще предстоит решить.
Заключение
ДРП и связанная с ней потеря зрения имеют множество отягощающих последствий, включая нарушение функционирования, отношений в семье, усиление социальной изоляции. Сообщалось также о ряде неблагоприятных эмоциональных реакций, таких как симптомы депрессии и тревоги. Увеличение числа больных значительно влияет на мировые системы здравоохранения, поэтому выявление лиц, наиболее подверженных риску прогрессирования ДРП, и раннее медицинское вмешательство могут ограничить потерю зрения и снизить затраты, связанные с лечением более запущенного заболевания. Таким образом, системы здравоохранения должны всячески поддерживать проведение исследований по созданию новых методов диагностики и лечения ДРП.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Каялиева Эльмаз Зевжетовна – студентка 2-го медицинского фак-та Ордена Трудового Красного Знамени Медицинского института им. С.И. Георгиевского ФГАОУ ВО
«КФУ им. В.И. Вернадского». E-mail: kayalieva00@mail.ru
Elmaz Z. Kayalieva – Student, Vernadsky Crimean Federal University. E-mail: kayalieva00@mail.ru
Халилова Севиля Руслановна – студентка 2-го медицинского фак-та Ордена Трудового Красного Знамени Медицинского института им. С.И. Георгиевского ФГАОУ ВО
«КФУ им. В.И. Вернадского». E-mail: sevilyahalilova4@mail.ru
Sevilya R. Khalilova – Student, Vernadsky Crimean Federal University. E-mail: sevilyahalilova4@mail.ru
Калиберденко Виталий Борисович – канд. мед. наук, доц. каф. внутренней медицины №2 Ордена Трудового Красного Знамени Медицинского института им. С.И. Георгиевского ФГАОУ ВО
«КФУ им. В.И. Вернадского».
Vitaliy B. Kaliberdenko – Cand. Sci. (Med.), Associate Professor, Vernadsky Crimean Federal University
Поступила в редакцию: 22.03.2024
Поступила после рецензирования: 28.03.2024
Принята к публикации: 04.04.2024
Received: 22.03.2024
Revised: 28.03.2024
Accepted: 04.04.2024
Список исп. литературыСкрыть список1. Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Res Clin Pract. 2010;(87):4-14.
2. Fenwick E, Rees G, Pesudovs K et al. Social and emotional impact of diabetic retinopathy: a review. Clin Experim Ophthalmol 2012;(40):
27-38.
3. Klein R, Klein BE, Moss SE et al. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. X. Four-year incidence and progression of diabetic retinopathy when age at diagnosis is 30 years or more. Arch Ophthalmol 1989;(107):244-9.
4. Antonetti DA, Barber AJ, Hollinger LA et al. Vascular endothelial growth factor induces rapid phosphorylation of tight junction proteins occludin and zonula occluden 1. A potential mechanism for vascular permeability in diabetic retinopathy and tumors. J Biol Chem 1999;(274):23463-7.
5. Powell ED, Field RA. Diabetic retinopathy and rheumatoid arthritis. Lancet 1964;(2):17-8.
6. Lutty GA, Cao J, McLeod DS. Relationship of polymorphonuclear leukocytes to capillary dropout in the human diabetic choroid. Am J Pathol 1997;(151):707-14.
7. Rangasamy S, McGuire PG, Das A. Diabetic retinopathy and inflammation: novel therapeutic targets. Middle East Afr J Ophthalmol 2012;19(1):52-9.
8. Sang DN, D’Amore PA. Is blockade of vascular endothelial growth factor beneficial for all types of diabetic retinopathy? Diabetologia 2008;(51):1570-3.
9. Meleth AD, Agrón E, Chan CC et al. Serum inflammatory markers in diabetic retinopathy. Invest Ophthalmol Vis Sci 2005;(46):4295-301.
10. Suzuki Y, Nakazawa M, Suzuki K et al. Expression profiles of cytokines and chemokines in vitreous fluid in diabetic retinopathy and central retinal vein occlusion. Jpn J Ophthalmol 2011;(55):256-63.
11. Liu J, Shi B, He S et al. Changes to tear cytokines of type 2 diabetic patients with or without retinopathy. Mol Vis 2010;(16):2931-8.
12. Funk M, Schmidinger G, Maar N et al. Angiogenic and inflammatory markers in the intraocular fluid of eyes with diabetic macular edema and influence of therapy with bevacizumab. Retina 2010;(30):1412-9.
13. Katakami N, Matsuhisa M, Kaneto H et al. Monocyte chemoattractant protein-1 (MCP-1) gene polymorphism as a potential risk factor for diabetic retinopathy in Japanese patients with type 2 diabetes. Diabetes Res Clin Pract 2010;(89):e9-12.
14. Schröder S, Palinski W, Schmid-Schönbein GW. Activated monocytes and granulocytes, capillary nonperfusion, and neovascularization in diabetic retinopathy. Am J Pathol 1991;(139):81-100.
15. Adamis AP, Berman AJ. Immunological mechanisms in the pathogenesis of diabetic retinopathy. Semin Immunopathol 2008;(30):65-84.
16. Arden GB. The absence of diabetic retinopathy in patients with retinitis pigmentosa: implications for pathophysiology and possible treatment. Br J Ophthalmol 2001;(85):366-70.
17. Patel JI, Hykin PG, Gregor ZJ et al. Angiopoietin concentrations in diabetic retinopathy. Br J Ophthalmol 2005;(89):480-3.
18. Rangasamy S, Srinivasan R, Maestas J et al. A potential role for angiopoietin-2 in the regulation of the blood-retinal barrier in diabetic retinopathy. Invest Ophthalmol Vis Sci 2011;(52):3784-91.
19. Fiedler U, Reiss Y, Scharpfenecker M et al. Angiopoietin-2 sensitizes endothelial cells to TNF-alpha and has a crucial role in the induction of inflammation. Nat Med 2006;(12):235-9.
20. Klein R, Klein BEK. Blood pressure control and diabetic retinopathy. British Journal of Ophthalmology 2002;86(4):365-7.
21. Matthews DR, Stratton IM, Aldington SJ et al. Risks of progression of retinopathy and vision loss related to tight blood pressure control in type 2 diabetes mellitus: UKPDS 69. Archives of Ophthalmology 2004;122(11):1631-40.
22. Simonson DC. Etiology and prevalence of hypertension in diabetic patients. Diabetes Care 1988;11(10):821-7.
23. Mancia G. The association of hypertension and diabetes: prevalence, cardiovascular risk and protection by blood pressure reduction. Acta Diabetologica 2005;42(Suppl.1):S17-S25.
24. Patel V, Rassam S, Newsom R et al. Retinal blood flow in diabetic retinopathy. British Medical Journal 1992;305(6855):678-83.
25. Kohner EM. The retinal blood flow in diabetes. Diabete et Metabolisme 1993;19(5):401-4.
26. Wilkinson-Berka JL. Angiotensin and diabetic retinopathy. International Journal of Biochemistry and Cell Biology 2006;38(5-6):752-65.
27. Pescosolido N, Campagna O, Barbato A. Diabetic retinopathy and pregnancy. Int Ophthalmol 2014;(34):989-97.
28. Novotny HR, Alvis DL. A method of photographing fluorescence in circulating blood in the human retina. Circulation 1961;(24):82-6.
29. Kernt M, Hadi I, Pinter F et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care 2012;(35):2459-63.
30. Silva PS, Cavallerano JD, Sun JK et al. Nonmydriatic ultrawide field retinal imaging compared with dilated standard 7-field 35-mm photography and retinal specialist examination for evaluation of diabetic retinopathy. Am J Ophthalmol 2012;(154):549-559.e2.
31. Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus.
N Engl J Med 1993;329(14):977-86.
32. Diabetes Control and Complications Trial Research Group. Progression of retinopathy with intensive versus conventional treatment in the Diabetes Control and Complications Trial. Ophthalmology 1995;(102):647-61.
33. Stratton IM, Kohner EM, Aldington SJ et al. UKPDS 50: risk factors for incidence and progression of retinopathy in type II diabetes over 6 years from diagnosis. Diabetologia 2001;(44):156-63.
34. Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;(329):977-86.
35. King P, Peacock I, Donnelly R. The UK Prospective Diabetes Study (UKPDS): clinical and therapeutic implications for Type 2 diabetes. Br J Clin Pharmacol 1999;(48):643-8.
36. The ACCORD, Study Group ACCORD, Eye Study Group. Effects of medical therapies on retinopathy progression in type 2 diabetes. N Engl J Med 2010;(363):233-44.
37. Benarous R, Sasongko MB, Qureshi S et al. Differential association of serum lipids with diabetic retinopathy and diabetic macular edema. Invest Ophthalmol Vis Sci 2011;(52):7464-9.
38. Keech AC, Mitchell P, Summanen PA et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomised controlled trial. Lancet 2007;(370):1687-97.
39. Brown DM, Nguyen QD, Marcus DM et al. Long-term outcomes of ranibizumab therapy for diabetic macular edema: the 36-month results from two phase III trials: RISE and RIDE. Ophthalmology 2013;(120):2013-22.
40. Diabetic Retinopathy Clinical Research Network. Elman MJ, Aiello LP, et al. Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2010;(117):1064.e35-1077.e35.
41. Diabetic Retinopathy Clinical Research Network. Elman MJ, Qin H, et al. Intra-vitreal ranibizumab for diabetic macular edema with prompt versus deferred laser treatment: three-year randomized trial results. Ophthalmology 2012;(119):2312-8.
42. Do DV, Nguyen QD, Khwaja AA et al. Ranibizumab for Edema of the Macula in Diabetes study: 3-year outcomes and the need for prolonged frequent treatment. JAMA Ophthalmol 2013;(131):139-45.
43. Elman MJ, Bressler NM, Qin H et al. Expanded 2-year follow-up of ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology. 2011;(118): 609-14.
44. Mitchell P, Bandello F, Schmidt-Erfurth U et al. The RESTORE study: ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011;(118): 615-25.
45. Rajendram R, Fraser-Bell S, Kaines A et al. A 2-year prospective randomized controlled trial of intravitreal bevacizumab or laser therapy (BOLT) in the management of diabetic macular edema: 24-month data: report 3. Arch Ophthalmol 2012;(130):972-9.
46. Ahn J, Woo SJ, Chung H, Park KH. The effect of adjunctive intravitreal bevacizumab for preventing postvitrectomy hemorrhage in proliferative diabetic retinopathy. Ophthalmology 2011;(118):2218-26.
47. Moradi A, Sepah YJ, Sadiq MA et al. Vascular endothelial growth factor Trap-Eye (aflibercept) for the management of diabetic macular edema. World J Diabetes 2013;(4):303-9.
48. Gardner TW, Antonetti DA, Barber AJ et al. Diabetic retinopathy: more than meets the eye. Surv Ophthalmol 2002;47(Suppl.2):S253-S262.
49. Diabetic Retinopathy Clinical Research Network. A randomized trial comparing intravitreal triamcinolone acetonide and focal/grid photocoagulation for diabetic macular edema. Ophthalmology 2008;(115): 1447-9;1449.e1–1449.e10.
50. Bressler SB, Qin H, Melia M et al. Exploratory analysis of the effect of intravitreal ranibizumab or triamcinolone on worsening of diabetic retinopathy in a randomized clinical trial. JAMA Ophthalmol. 2013;(131):1033-40.
51. Campochiaro P, Brown DM, Pearson A et al, FAME Study Group. Sustained delivery fluocinolone acetonide vitreous inserts provide benefit for at least 3 years in patients with diabetic macular edema. Ophthalmology 2012;(110):2125-32.
52. Cunha-Vaz J, Ashton P, Iezzi R et al, FAME Study Group. Sustained delivery fluocinolone acetonide vitreous implants: long-term benefit in patients with chronic diabetic macular edema. Ophthalmology 2014;(119):2125-32.
53. Rubio R. Long-acting anti-VEGF delivery: How close are we? Presented at the World Ophthalmology Congress, Tokyo, Japan, 2–6 April 2014.
54. Photocoagulation treatment of proliferative diabetic retinopathy. Clinical application of Diabetic Retinopathy Study (DRS) findings, DRS Report Number 8. The Diabetic Retinopathy Study Research Group. Ophthalmology 1981;(88):583-600.
55. Mohamed Q, Gillies MC, Wong TY. Management of diabetic retinopathy: a systematic review. JAMA 2007;(298):902-16.
56. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study research group. Arch Ophthalmol 1985;(103):1796-806.
57. Fong DS, Girach A, Boney A. Visual side effects of successful scatter laser photocoagulation surgery for proliferative diabetic retinopathy: a literature review. Retina 2007;(27):816-24.
58. Al-Hussainy S, Dodson PM, Gibson JM. Pain response and follow-up of patients undergoing panretinal laser photocoagulation with reduced exposure times. Eye 2008;(22):96-9.
59. Muqit MM, Young LB, McKenzie R et al. Pilot randomised clinical trial of Pascal TargETEd Retinal versus variable fluence PANretinal 20 ms laser in diabetic retinopathy: PETER PAN Study. Br J Ophthalmol 2013;(97):220-7.
60. Blankenship GW. Fifteen-year argon laser and xenon photocoagulation visual results of Bascom Palmer Eye Institute's patients participating in the Diabetic Retinopathy Study. Trans Am Ophthalmol Soc 1990;(88):179-85; discussion 85-9.
12 июня 2024
Количество просмотров: 519

