Клинический разбор в общей медицине №4 2024
Today, clinicians deal with many practical issues when prescribing menopausal or hormone replacement therapy. The main goal of the expert workshop was to discuss the principles of prescribing hormone therapy to patients of various age groups with various gynecological and somatic disorders and comorbidities, to determine the tactics for selection of the type of therapy based on the personalization principles.
Keywords: estrogens, progesterone, transdermal forms, hypoestrogenism
For citation: Personalization of hormone therapy: interdisciplinary approach. Clinical review for general practice. 2024; 5 (4): 61–70
(In Russ.). DOI: 10.47407/kr2024.5.4.00420
 Обзор последних данных по эстрогенодефицитным состояниям у пациенток репродуктивного возраста представила Карина Рустамовна Бондаренко, доктор медицинских наук, доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.
Обзор последних данных по эстрогенодефицитным состояниям у пациенток репродуктивного возраста представила Карина Рустамовна Бондаренко, доктор медицинских наук, доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.
Факторов гипоэстрогении в репродуктивном возрасте немало: это и физиологические причины (лактационная аменорея), и возможные хирургические вмешательства, такие как двусторонняя овариэктомия, и гиперпролактинемия, и функциональная гипоталамическая аменорея (ФГА), и органические поражения гипоталамо-гипофизарной области (синдром пустого турецкого седла, болезнь Иценко–Кушинга, краниофарингиома, синдром Шихана), и преждевременная недостаточность яичников (ПНЯ), и длительный прием некоторых лекарственных препаратов. Спикер отметила, что синдром поликистозных яичников (СПКЯ) не относится к гипоэстрогенным состояниям и не требует назначения заместительной гормональной терапии (ЗГТ) с эстрогенами.
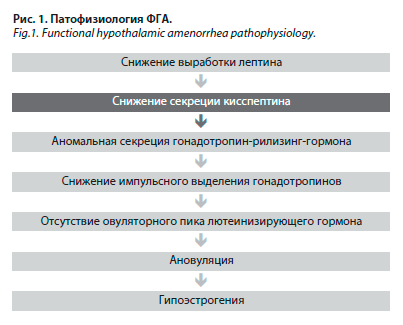
Что касается ФГА, то это состояние возникает без идентифицируемых органических причин – например, на фоне стрессовых факторов или активных спортивных занятий. На фоне снижения объема адипоцитов запускается каскад патологических реакций, приводящих к гипоэстрогении при ФГА (рис. 1). При стрессе кортикотропин-рилизинг-гормон ингибирует частоту выброса гонатотропин-рилизинг-гормона, а кортизол подавляет репродуктивную функцию на уровне гипоталамуса, гипофиза и матки. Сопутствующий энергетический дисбаланс может повышать чувствительность гипоталамо-гипофизарно-яичниковой оси к стрессу.
К другим факторам развития ФГА относят гиперметаболические состояния, мальабсорбцию (глютеновая энтеропатия, целиакия), ограничение определенных продуктов (жиров), а также генетическую предрасположенность.
Клиническую картину ФГА составляют олиго- и аменорея, задержка полового созревания, бесплодие, сексуальные нарушения, вульвовагинальная атрофия, отсутствие вазомоторных симптомов, а также остеопороз и низкоэнергетические переломы. В целом ФГА – это диагноз исключения, поэтому необходимо проанализировать наличие каких-либо возможных органических заболеваний и тщательно собрать анамнез пациентки (указания на перенесенный стресс, интенсивные занятия спортом, расстройство пищевого поведения). Стоит оценить уровни хорионического гонадотропина человека, тироксина, лютеинизирующего, фолликулостимулирющего гормона, эстрадиола, антимюллерова гормона, пролактина, общего тестостерона, дегидроэпиандростерон-сульфата‚ 17-ОН-прогестерона у пациенток с клинической гиперандрогенией, провести пробу с микронизированным прогестероном (Утрожестан®), ультразвуковое исследование (УЗИ) органов малого таза, магнитно-резонансную томографию головного мозга. После верификации диагноза стоит оценить минеральную плотность костной ткани (МПК) с помощью двухэнергетической рентгеновской абсорбциометрии у женщин с аменореей длительностью более полугода и проанализировать липидный профиль.
Последствия гипоэстрогении в репродуктивном возрасте неблагоприятны для сердечно-сосудистой системы. Исследование женского ишемического синдрома (The Women's Ischemia Syndrome Evaluation – WISE) показало, что гипоэстрогения гипоталамического происхождения связана с повышенным риском ишемической болезни сердца у женщин в репродуктивном возрасте. У спортсменок с ФГА подтверждены формирование эндотелиальной дисфункции, а также изменение липидного профиля в сторону повышения уровня холестерина и липопротеидов низкой плотности.
Модификация образа жизни (увеличение потребления калорий, снижение физической активности) становится важным аспектом терапии ФГА. При отсутствии эффекта от терапии, направленной на модификацию образа жизни, назначают трансдермальный эстрадиол – ТДЭ (например, Эстрожель®) с циклическим гестагеном в течение 12–14 дней ежемесячно (для защиты эндометрия) короткими курсами. Показано, что на фоне использования трансдермальных эстрогенов наблюдается увеличение МПК, в то время как гормональные пероральные контрацептивы не рекомендуется назначать пациенткам с аменореей с целью профилактики потери МПК. Восстановление менструальной функции может произойти в течение 6 мес (до 33 мес) после нормализации массы тела (согласно исследованиям, менструации возобновлялись в среднем при наборе массы тела до значений на 2,05 кг больших, чем масса тела, при которой развивалась аменорея). Достаточное содержание подкожно-жирового слоя в организме является необходимым, но недостаточным условием для возобновления менструаций.
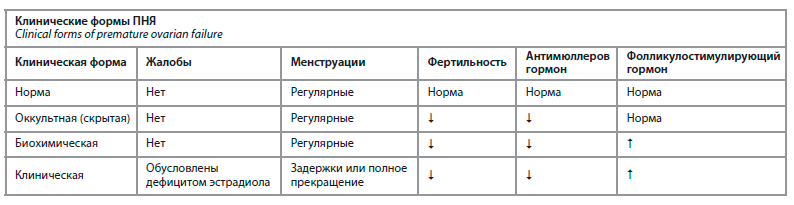
Вопросы эффективности и безопасности назначения ЗГТ при различных клинических формах ПНЯ (см. таблицу) рассмотрела Светлана Владимировна Юренева, доктор медицинских наук, ведущий научный сотрудник отделения гинекологической эндокринологии ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России.
В задачи терапии входят облегчение вазомоторных и урогенитальных симптомов, положительное действие на качество жизни (настроение, когнитивная функция, жизненный тонус, состояние костно-мышечной системы), повышение шансов на наступление беременности естественным путем, минимизация долгосрочных рисков ПНЯ.
После постановки окончательного диагноза важно оценить возраст пациентки. Так, в пубертатном периоде стоит начинать с низких доз эстрогенов в сочетании с микронизированным прогестероном, избегая назначения комбинированных оральных контрацептивов. В репродуктивном возрасте наряду с психологической поддержкой стоит рассмотреть прием ЗГТ до возраста естественной менопаузы. Отечественные работы показывают, что ЗГТ с низкими и, в ряде случаев, стандартными дозами эстрадиола не позволяет полностью купировать симптомы эстрогенодефицита у женщин с ПНЯ и обеспечить высокий уровень качества жизни. Требуются более высокие, чем стандартные, дозы эстрадиола (в рамках инструкции) и более высокие дозы гестагенов для нивелирования симптомов или поддержки состояния МПК (эту позицию поддерживают ЕМАS, IМS и NIСЕ).
Еще в одной российской работе, проведенной на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова», оценивалось качество жизни пациенток с ПНЯ, принимающих ЗГТ. Женщинам назначали разные дозы эстрогенов: низкую (1 мг эстрадиола перорально), стандартную (2 мг эстрадиола перорально; 1 грамм 0,1% геля трансдермально; 1,5 мг 0,06% геля трансдермально; 50 мкг эстрадиола в сутки трансдермально), высокую (1,5 и 2,0 г 0,1% геля трансдермально), а также комбинированные оральные контрацептивы. Анализ качества жизни пациенток с ПНЯ показал: к нормальному 50-балльному порогу приблизились только оценки принимавших высокодозированную, но не наиболее часто назначаемую ЗГТ со стандартной дозой эстрадиола. Качество жизни пациенток с ПНЯ было напрямую связано с дозой эстрадиола в составе ЗГТ: при увеличении дозы эстрадиола повышалась оценка по большинству показателей опросника качества жизни SF-36. Отмеченное улучшение с увеличением дозы эстрадиола в составе ЗГТ соответствует результатам анализа удовлетворенности лечением пациенток с ПНЯ: положительная оценка терапии в 100% случаев была дана только женщинами, которые использовали высокодозированную ЗГТ, тогда как пользователи наиболее часто назначаемой ЗГТ со стандартной дозой эстрадиола были довольны терапией только в 55% случаев. Отечественные эксперты сделали вывод о том, что основная стратегия для улучшения качества жизни женщин с ПНЯ – это адекватное восполнение дефицита эстрогенов путем назначения достаточных доз ЗГТ.
Парентеральный путь введения эстрогенов предпочтителен из-за отсутствия первичного прохождения активного вещества через печень и минимизации протромботических эффектов. Использование микронизированного прогестерона в составе комбинированной ЗГТ имеет преимущества в виде отсутствия тромбогенных эффектов и меньшего риска рака молочной железы (РМЖ). Дозы эстрогенов, назначаемых при ПНЯ, обычно выше, чем при менопаузальной гормональной терапии (МГТ), и стандартных доз прогестерона может не хватить для защиты эндометрия. Женщины с ранней и поздней менопаузой имеют больший риск венозной тромбоэмболии (ВТЭ) по сравнению с женщинами с возрастом наступления менопаузы в 40–49 лет, поэтому важно, чтобы пациентки, имеющие риск ВТЭ, получали трансдермальные формы эстрогенов.
В целом женщины с ПНЯ нуждаются в особом подходе при врачебном консультировании с тщательным анализом жалоб, которые могут свидетельствовать о недостаточной компенсации дефицита эстрогенов на фоне ЗГТ. Результаты отечественного исследования свидетельствуют о необходимости пересмотра подходов к тактике ведения пациенток с ПНЯ. Необходимы оперативное проведение исследований для оптимизации ведения молодых женщин с ПНЯ и ранней менопаузой, оценка и улучшение качества их жизни и долгосрочных показателей заболеваемости и смертности.
О репродуктивных факторах риска развития сердечно-сосудистых заболеваний (ССЗ) у женщин подробно рассказала Вера Ефимовна Балан, профессор, руководитель поликлинического отделения ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии им. акад. В.И. Краснопольского», президент Междисциплинарной ассоциации специалистов по здоровому старению.
К факторам риска ССЗ относят ранний возраст менархе, нарушения менструального цикла, СПКЯ, ФГА, масса тела ребенка при рождении более 4 кг, гестационный сахарный диабет (СД), прибавку массы тела более 12 кг за беременность, преэклампсию, гипертензионные расстройства во время беременности, невынашивание беременностей, возраст наступления первой и последней беременности, возраст наступления менопаузы, длительность постменопаузы.
Выявление аномалий менструального цикла в подростковом возрасте может способствовать раннему обнаружению потенциальных проблем со здоровьем у взрослых. К характеристикам менструального цикла, связанным с сердечно-сосудистым риском, относятся преждевременное, позднее или нерегулярное менархе, СПКЯ, ФГА. Также важно учитывать риски, связанные с гормональной контрацепцией.
Маркером состояния здоровья сосудов является состояние эндотелия. Эндотелиальная дисфункция – это центральный механизм формирования обструктивных и необструктивных форм ишемической болезни сердца, связанных как с традиционными, так и со специфическими факторами риска ССЗ. Женщины с естественной ранней менопаузой имеют более высокую генетическую предрасположенность к ССЗ. Назначение МГТ в период перименопаузы и ранней постменопаузы способствует снижению риска ССЗ за счет протективных механизмов эстрогенов: усиления ангиогенеза и расширения сосудов, уменьшения фиброза и окислительного стресса, защиты эндотелия.
У женщин с приливами МГТ устраняет эндотелиальную дисфункцию и повышает чувствительность к инсулину, снижает частоту заболеваний коронарных артерий. Приливы могут опосредованно влиять на состояние коронарных артерий, при этом, как правило, коронарные артерии хорошо отвечают на терапию экзогенными эстрогенами. Согласно теории «терапевтического окна», МГТ оказывает благоприятный эффект у женщин, недавно вступивших в менопаузу, с приливами и здоровыми коронарными артериями, но не оказывает благоприятного эффекта у женщин более старшего возраста без приливов и с более кальцифицированными и менее реагирующими на эстрогены коронарными артериями (постменопауза более 10 лет и возраст старше 60 лет).
И если ответ на вопрос о необходимости назначения МГТ в раннем менопаузальном периоде представляется однозначным, то вопрос выбора формы МГТ актуален всегда.
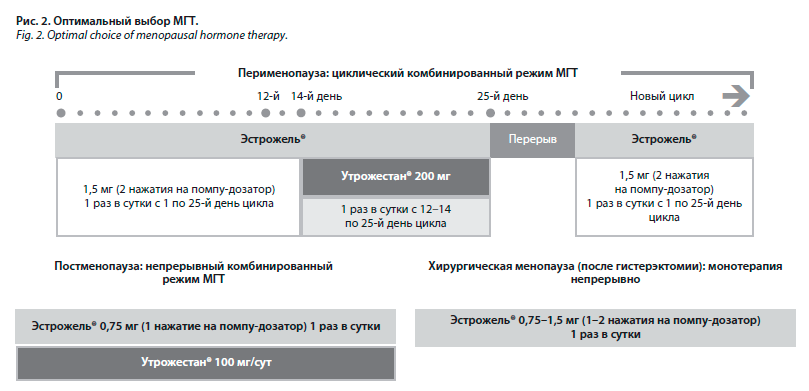
Согласно результатам национального регистрационного исследования, на фоне трансдермального применения МГТ было отмечено статистически значимое снижение риска развития инфаркта миокарда (по сравнению с пероральной эстрогеновой терапией). Показано, что индекс массы тела (ИМТ) не влияет на увеличение рисков при применении трансдермальных эстрогенов, которые вписываются в схемы ведения пациенток как перименопаузального, так и постменопаузального периода, а также с хирургической менопаузой (рис. 2).
Наряду с персонифицированной МГТ и ЗГТ с использованием ТДЭ и микронизирванного прогестерона (Эстрожель®/Утрожестан®) важно помнить о целесообразности саплементарной поддержки. В частности, клинически доказано, что добавление комплекса Фамвиталь® к МГТ улучшает динамику менопаузальных симптомов и симптомов тревожности. Оптимальный курс приема составляет 3 мес, все компоненты разделены на два вида капсул («утро» и «вечер») с учетом их синергии и суточных биоритмов женщины климактерического возраста.
По данным исследований, прием этого комплекса на протяжении 8 нед способствует:
• снижению количества ежедневно выпавших волос на 50%;
• повышению увлажненности кожи на 13%;
• уменьшению глубины и объема морщин (27% и 23% соответственно);
• уменьшению ломкости ногтей;
• уменьшению объема талии на 2 см и бедер на 1,3 см;
• уменьшению выраженности целлюлита;
• снижению выраженности симптомов климактерия.
Тему индивидуализации МГТ – уже у коморбидных пациенток – продолжила Светлана Владимировна Юренева.
Согласно отечественным клиническим рекомендациям по менопаузе, рекомендуется отдавать предпочтение трансдермальному пути введения препаратов эстрогенов у женщин с климактерическими симптомами и наличием коморбидных состояний: болезней печени и поджелудочной железы, нарушенной всасываемости в желудочно-кишечном тракте; расстройств коагуляции, повышенного риска венозного тромбоза; гипертриглицеридемии до и на фоне пероральных препаратов; артериальной гипертензии (>170/100 мм рт. ст.); гиперинсулинемии; повышенного риска образования или наличия камней в желчных путях; мигрени; ожирения. Трансдермальные формы эстрогенов вследствие отсутствия первичной стадии печеночного метаболизма, в отличие от пероральных форм эстрогенов, имеют более благоприятный профиль безопасности – не повышают риск венозных тромбоэмболических осложнений (ВТЭО) и желчнокаменной болезни. Использование трансдермальных форм эстрогенов ассоциировано с меньшим риском больших сердечно-сосудистых событий (инфаркта, инсульта) и ВТЭО, чем использование эквивалентных доз пероральных форм эстрогенов.
ТДЭ благодаря отсутствию первичного печеночного метаболизма не влияет на метаболизм печеночных белков и систему гемостаза и не повышает тромботические риски. Трансдермальные препараты рекомендованы при отклонениях в показателях функции печени, при болезнях печени и поджелудочной железы, приеме препаратов, индуцирующих печеночные ферменты (карбамазепин, ламотриджин и пр.) ввиду отсутствия первичного печеночного метаболизма, при пероральном приеме левотироксина (при гипотиреозе), при нарушенной всасываемости в желудочно-кишечном тракте, заболеваниях, которые могут повлиять на всасываемость перорального препарата (болезнь Крона и пр.), чувствительности к лактозе (большинство пероральных препаратов содержит лактозу). ТДЭ в меньшей степени способен вызвать такой побочный эффект, как тошнота, и показан при стойких неприятных симптомах и/или побочных эффектах при приеме пероральных эстрогенов.
Крайне важен вопрос рисков венозного тромбоза на фоне МГТ. ТДЭ ввиду отсутствия первичного печеночного метаболизма не оказывает влияния на систему гемостаза, артериальное давление (АД), уровень триглицеридов, ассоциированный с риском тромбоза. Показано, что пероральные эстрогены повышают риск ВТЭ в общей популяции в 1,7 раза по сравнению с плацебо, поэтому для женщин с риском ССЗ предпочтительнее трансдермальная терапия эстрадиолом и микронизированным прогестероном, если это необходимо для защиты матки. Препараты ТДЭ в меньшей степени влияют на факторы свертывания крови, АД, уровень триглицеридов, С-реактивного белка и глобулина, связывающего половые гормоны, и в низких дозах предпочтительны для женщин с риском ВТЭ, гипертензией, гипертриглицеридемией, ожирением, метаболическим синдромом, СД и желчнокаменной болезнью в анамнезе. Микронизированный прогестерон считается нейтральным в отношении тромботических рисков.
Гипертрилицеридемия считается независимым фактором риска ССЗ. Развившаяся до и на фоне пероральных препаратов, она становится прямым противопоказанием для приема пероральных эстрогенов. МГТ в целом не рекомендована в качестве терапии первой линии коррекции дислипидемии с целью профилактики рисков ССЗ.
Большое количество клинических рекомендаций показывает, что ТДЭ не повышают уровень триглицеридов. Пероральные эстрогены оказывают благоприятное воздействие на липидный профиль, однако связаны с повышением триглицеридов в сыворотке, поэтому женщинам с гипертриглицеридемией следует предлагать ТДЭ и избегать пероральных форм. При наличии риска ССЗ/ВТЭО и на фоне повышенного уровня триглицеридов предпочтительны ТДЭ в сочетании с нейтральным в отношении метаболизма липидов пероральным микронизированным прогестероном или дидрогестероном. Кроме того, ТДЭ ввиду отсутствия первичного печеночного метаболизма не оказывают стимулирующего влияния на ренин-ангиотензин-альдостероновую систему, благодаря чему не повышают риск артериальной гипертензии, а также не создают дополнительного риска ВТЭ у женщин с повышенным ИМТ.
При наличии симптомов менопаузы у женщин с СД
2-го типа следует рассмотреть назначение МГТ после учета коморбидных состояний. Женщинам с СД 2-го типа, ИМТ>30 кг/м2 и низким или умеренным риском ССЗ рекомендованы ТДЭ; при ИМТ<30 кг/м2 и низком риске ССЗ ТДЭ назначают без возрастных ограничений. В случае необходимости назначения гестагена следует использовать тот, который оказывает нейтральное воздействие на метаболизм глюкозы, например, пероральный микронизированный прогестерон или дидрогестерон.
В своем докладе Виктория Борисовна Мычка, доктор медицинских наук, ведущий научный сотрудник отдела системных гипертензий Института клинической кардиологии им. А.Л. Мясникова ФГБУ «Национальный медицинский исследовательский центр кардиологии им. акад. Е.И. Чазова» Минздрава России, продолжила обсуждение кардиоваскулярных рисков у женщин в менопаузе. Согласно рекомендациям IMS по гормональной терапии в менопаузе, МГТ снижает риск развития ССЗ путем положительного влияния на метаболический синдром, улучшает метаболизм липидов и углеводов, уменьшает объем висцерального жира, снижает риск наступления СД и улучшает чувствительность к инсулину при инсулинорезистентности (ИР), снижает риск коронарного атеросклероза, инфарктов. Использование трансдермальных форм эстрогенов ассоциировано с меньшим риском больших сердечно-сосудистых событий (инфаркта, инсульта) и ВТЭО, чем использование эквивалентных доз пероральных форм эстрогенов. В постменопаузе следует предпочесть трансдермальные пути введения препаратов гормональной терапии, поскольку они оказывают наименьшее влияние на коагуляцию, метаболизм глюкозы и липидов.
Согласно Российским критериям приемлемости назначения менопаузальной гормональной терапии пациенткам с сердечно-сосудистыми и метаболическими заболеваниями, при ожирении нежелательно назначать препараты, содержащие гестагены с остаточной андрогенной и глюкокортикоидной активностью, предпочтение отдается метаболически нейтральным прогестагенам.
Важно учитывать и другие свойства прогестагена в составе МГТ. Микронизированный прогестерон и дидрогестерон оказывают защитное влияние на эндометрий, обладают более благоприятным профилем безопасности в отношении риска ВТЭ в сравнении с норэтистероном и медроксипрогестероном. При комбинированном лечении следует отдавать предпочтение натуральному (микронизированному) прогестерону, поскольку он лишен антиапоптотических свойств других прогестагенов в отношении клеток молочной железы (МЖ) и поэтому в наименьшей степени ассоциирован с повышением риска РМЖ по сравнению с другими гестагенами.
Тему выбора МГТ пациенткам с метаболическими нарушениями затронула Юлия Александровна Тишова, кандидат медицинских наук, доцент кафедры эндокринологии ФГАОУ ВО «Российский университет дружбы народов им. Патриса Лумумбы». Новые критерии Международной федерации диабета определяют метаболический синдром при наличии центрального ожирения (окружность талии >94 см для европеоидов-мужчин и >80 см для женщин с учетом этнической специфики для других групп) в сочетании с любыми двумя из четырех нижеследующих факторов:
• увеличение уровня триглицеридов >150 мг/дл (1,7 ммоль/л) или специфическое лечение этого нарушения;
• снижение содержания липопротеидов высокой плотности <40 мг/дл (1,03 ммоль/л) у мужчин и <50 мг/дл (1,29 ммоль/л) у женщин или специфическое лечение данного нарушения;
• повышение АД: систолическое АД>130 или диастолическое АД>85 мм рт. ст. – или лечение ранее диагностированной артериальной гипертензии;
• повышение глюкозы натощак в плазме >100 мг/дл (5,6 ммоль/л) или ранее диагностированный СД 2-го типа.
Ожирение – это фактор риска ВТЭ и ее осложнений. Применение пероральных форм эстрогенов у женщин с ожирением связано с повышением рисков ВТЭО, в то время как ТДЭ не повышают эти показатели независимо от ИМТ пациентки. ТДЭ следует рассматривать в качестве терапии первой линии и отдавать им предпочтение у женщин с факторами риска сердечно-сосудистых событий (повышенные АД и ИМТ, ожирение). Женщинам с повышенным риском ВТЭО, включая ИМТ>30 кг/м2, следует рекомендовать ТДЭ (в монотерапии или в сочетании с микронизированным прогестероном), а не пероральные формы эстрогенов.
Курение – еще один важный и независимый фактор риска ССЗ и первого инфаркта миокарда. В России курят 10% женщин, и эта цифра, по прогнозам специалистов, к 2028 г. увеличится до 12,91%. У курящих женщин при пероральном приеме концентрация эстрогенов снижается на 50% из-за влияния компонентов сигаретного дыма на печеночный метаболизм, тем самым нивелируется положительное влияние эстрогенов на липидный обмен и даже может возникать гипертриглицеридемия. ТДЭ позволяют избежать негативного влияния курения на сердечно-сосудистые риски.
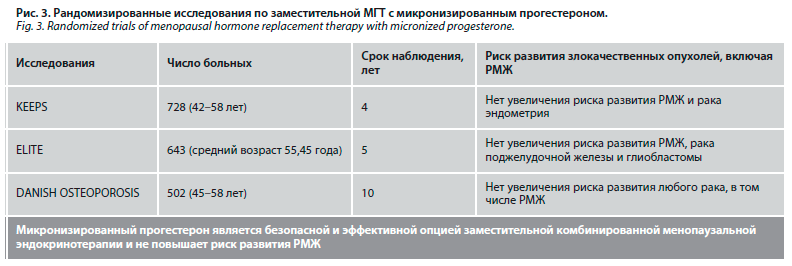
О факторах риска развития РМЖ и возможных реакциях ткани на МГТ рассказала Ирина Владимировна Колядина, доктор медицинских наук, профессор кафедры онкологии, ведущий научный сотрудник Научно-исследовательского центра ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России на базе ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России. Согласно данным литературы, при назначении ЗГТ с синтетическим прогестероном повышается риск развития РМЖ. Однако важно отметить, что пациентки в описанных исследованиях принимали именно синтетический прогестерон. Формула микронизированного прогестерона полностью соответствует формуле эндогенного гормона, что гарантирует идентичность фармакологических эффектов и аналогичное влияние на организм. Микронизация (измельчение) и заключение в жировую оболочку (липосферу) обеспечивает более полное и быстрое растворение и всасывание вещества. Рандомизированные исследования по ЗГТ с микронизированным прогестероном показали отсутствие увеличения риска развития РМЖ и рака эндометрия (рис. 3). Микронизированный прогестерон является безопасной и эффективной опцией заместительной комбинированной менопаузальной эндокринотерапии и не повышает риск развития РМЖ.
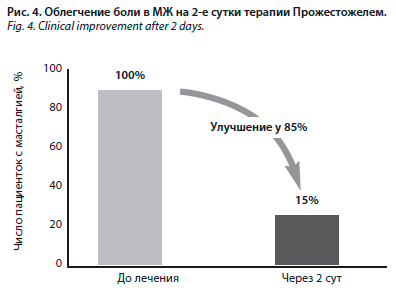 Это подтвердило и другое клиническое исследование, здоровье участниц которого оценивали в течение 12 лет. У пациенток, использовавших Прожестожель (трансдермальный микронизированный прогестерон), частота развития РМЖ не увеличилась. Прожестожель, 1% гель микронизированного прогестерона для трансдермального введения, содержит прогестерон, идентичный эндогенному по химическому строению и молекулярной массе. Препарат значительно не влияет на уровень прогестерона в плазме и действует только местно. В тканях МЖ прогестерон уменьшает проницаемость капилляров и интенсивность циклического отека соединительной стромы. Клиническое улучшение отмечают 85% женщин (рис. 4) уже через 2 сут, максимально стойкий эффект отмечается при ежедневном применении препарата на протяжении 3–6 мес.
Это подтвердило и другое клиническое исследование, здоровье участниц которого оценивали в течение 12 лет. У пациенток, использовавших Прожестожель (трансдермальный микронизированный прогестерон), частота развития РМЖ не увеличилась. Прожестожель, 1% гель микронизированного прогестерона для трансдермального введения, содержит прогестерон, идентичный эндогенному по химическому строению и молекулярной массе. Препарат значительно не влияет на уровень прогестерона в плазме и действует только местно. В тканях МЖ прогестерон уменьшает проницаемость капилляров и интенсивность циклического отека соединительной стромы. Клиническое улучшение отмечают 85% женщин (рис. 4) уже через 2 сут, максимально стойкий эффект отмечается при ежедневном применении препарата на протяжении 3–6 мес.
Особое внимание присутствующих Ирина Владимировна обратила на тот факт, что в делении клеток МЖ участвуют только эстрогены. Так называемой эстрогензависимый сигнальный путь начинается с проникновения эстрогена в клетку: гормон соединяется с рецептором, находящемся на ядре как здоровой, так и опухолевой клетки, и стимулирует его. Передача сигнала инициирует процесс деления клетки. Прогестерон не участвует в делении ни здоровой, ни опухолевой клетки и уравновешивает действие эстрогенов, в достаточном количестве снижая число эстрогеновых рецепторов, подавляя митозы.
Подробно алгоритм обследования МЖ у пациенток разных возрастных групп озвучила Алла Александровна Анисимкова, врач лучевой и интервенционной диагностики МЖ отделения лучевой диагностики ФГБУ «НМИЦ АГП им. В.И. Кулакова». Так, женщины старше 40 лет независимо от наличия или отсутствия жалоб направляются на маммографию, по результатам которой формируются три потока пациенток: без изменений в МЖ, с признаками диффузной мастопатии и с узловыми образованиями. Для женщин в возрастном диапазоне от 20 до 40 лет определяют наличие факторов риска РМЖ:
• при отсутствии изменений и факторов риска пациентке рекомендуется очередной осмотр 1 раз в 2 года;
• при наличии факторов риска, но без изменений в тканях проводится УЗИ МЖ, профилактическая консультация онколога для определения тактики наблюдения (осмотр, магнитно-резонансная томография, УЗИ, маммография);
• во всех остальных ситуациях стоит рекомендовать консультацию онколога и дообследование.
Высокая маммографическая плотность является независимым и сильным фактором риска РМЖ, увеличивающим риск его развития в несколько раз, что существенно больше, чем значимость многих других факторов риска. Для снижения маммографической плотности приемлемо использовать длительное патогенетическое лечение трансдермальным микронизированным прогестероном (Прожестожель): показано, что на фоне его назначения пациенткам с мастопатией в течение
1 года маммографическая плотность уменьшается.
Прожестожель снижает число эстрогеновых рецепторов, активирует ферменты, обеспечивающие переход эстрадиола в менее активные формы, тормозит циклическую секрецию гонадотропинов, оказывает натрийдиуретический эффект, предотвращает задержку жидкости в тканях МЖ, регулирует локальный уровень эстрогенов в тканях, ограничивая их пролиферативное действие, снижает проницаемость капилляров, уменьшая степень отека тканей железы и интенсивность масталгии, блокирует рецепторы пролактина, а также способствует уменьшению маммографической плотности.
Светлана Владимировна Юренева обратила внимание коллег на то, что, согласно клиническим рекомендациям Минздрава России «Доброкачественная дисплазия молочной железы» 2020 года, в основе патогенеза доброкачественной дисплазии МЖ (ДДМЖ) лежит хроническая гиперэстрогения. Эстрогены вызывают пролиферацию протокового альвеолярного эпителия и стромы, что в том числе приводит к обтурации протоков и формированию кист. Прогестерон, напротив, противодействует этим процессам, обеспечивает дифференцировку эпителия и прекращение митотической активности. В патогенезе ДДМЖ имеют значение такие факторы, как овариальная недостаточность (ановуляция, недостаточность лютеиновой фазы цикла, относительное преобладание эстрадиола и недостаток прогестерона), изменение рецепции к половым стероидным гормонам, активность пролиферации и апоптоза эпителия, изменение васкуляризации ткани МЖ.
Согласно приказу №1130н «Об утверждении порядка оказания медицинской помощи по профилю "акушерство и гинекология"» от 20.10.2020 (вступил в силу 01.01.2021, действует до 01.01.2027), при исключении злокачественных новообразований женщины с доброкачественными заболеваниями МЖ должны находиться под диспансерным наблюдением врача акушера-гинеколога, который оказывает медицинскую помощь по диагностике доброкачественной патологии МЖ и лечению доброкачественных диффузных изменений с учетом сопутствующей гинекологической патологии. Пациенткам с фиброзно-кистозной болезнью с целью купирования болевого синдрома рекомендовано использование препаратов на основе микронизированного прогестерона. Клинические исследования трансдермального пути введения микронизированного прогестерона показали уменьшение напряжения и болезненности МЖ, регрессию кист по данным УЗИ на фоне терапии. Наиболее целесообразно назначение препаратов прогестерона при сочетанных гиперпластических процессах.
В случае проведения системного лечения существует необходимость таргетной терапии мастопатии. Концентрация прогестерона в лютеиновой фазе должна быть достаточной для подавления избыточной эстрогеновой стимуляции пролиферации клеток МЖ. Местный способ доставки прогестерона создает намного более высокую концентрацию прогестерона непосредственно в ткани МЖ, чем системный, поэтому целесообразно использовать и Утрожестан®, и Прожестожель. Топическое применение создает высокую концентрацию прогестерона только в тканях МЖ: в системном кровотоке концентрация прогестерона оказывается в 10 раз ниже, чем в ткани.
Одно из крупных многоцентровых исследований BREAST-1 среди гинекологов с участием 1044 женщин подтвердило эффективность монотерапии Прожестожелем (рис. 5).
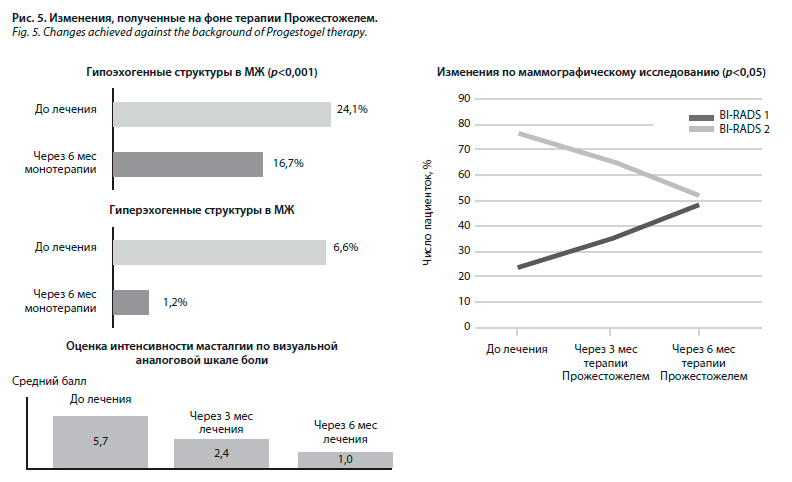
На фоне терапии улучшилась ультразвуковая и маммографическая картина, быстро купировалась масталгия (через 3–6 мес). Клинический результат (снижение интенсивности болевых ощущений) большинство пациенток отмечали уже в первые дни терапии Прожестожелем (см. рис. 4), что повышало комплаенс назначенной терапии.
Результаты другого многоцентрового открытого проспективного когортного исследования BREAST-2 подтвердили эффективность монотерапии Прожестожелем в лечении диффузной фиброзно-кистозной мастопатии: среднее количество образований различной эхогенности снизилось в 2,2 раза через 6 мес лечения. Кроме того, было отмечено достоверное клиническое улучшение признаков заболевания при ультразвуковой оценке образований средних размеров и различной эхогенности через 3 и 6 мес в динамике проводимой терапии. В результате проведения многоцентрового наблюдательного исследования BREAST-2 среди онкологов России были сделаны следующие выводы:
1. Работа подтвердила эффективность и безопасность монотерапии диффузно-фиброзной мастопатии препаратом Прожестожель в условиях рутинной клинической практики онкологов.
2. Эффективность препарата Прожестожель была подтверждена клиническими и лабораторными данными: произошло снижение количества и размеров образований по УЗИ, уменьшение болевых ощущений в МЖ, улучшение состояния МЖ согласно рентгеномаммографическому исследованию.
В конце своего выступления Светлана Владимировна сделала несколько выводов: так, диффузная фиброзно-кистозная мастопатия (ДДМЖ) характеризуется наличием образований различной эхогенности в обеих МЖ, поэтому результатом лечения будет считаться не только устранение клинических симптомов, но и уменьшение количества и размеров образований и снижение маммографической плотности. В связи с дисгормональной природой заболевания в репродуктивном возрасте и в перименопаузе важно устранить и системный дисбаланс половых стероидов (лечение нарушений менструального цикла, недостаточности лютеиновой фазы, назначение МГТ). По данным проведенных ранее исследований (BREAST-1, 2), через 6 мес применения Прожестожеля картина менялась с BI-RADS 2 до BI-RADS 1, образования исчезали или уменьшались в размерах, снижалось их количество.
О связи различных эндокринопатий и доброкачественных заболеваний МЖ во втором своем докладе рассказала Юлия Александровна Тишова. Среди всех органов репродуктивной системы, подверженных риску гормонально-зависимых гиперпластических процессов, МЖ страдают наиболее часто, первыми сигнализируя о расстройствах нейрогуморального гомеостаза всей репродуктивной системы. В основе патогенеза ДДМЖ лежит нарушение баланса между прогестероном и эстрогенами (хроническая относительная гиперэстрогения в сочетании с прогестеронодефицитными состояниями). Эстрогены вызывают пролиферацию соединительной ткани – стромы МЖ и протокового альвеолярного эпителия (что приводит к обтурации протоков и формированию кист), усиливают активность фибробластов, повышают гидратацию соединительной ткани. Прогестерон, напротив, противодействует этим процессам, обеспечивает дифференцировку эпителия, тормозит митотическую активность и влияет на активность ферментов биотрансформации эстрогенов.
Эндогенный прогестерон оказывает антипролиферативный эффект за счет предотвращения избыточной пролиферации, обеспечения дифференцировки эпителия, торможения митотической активности эпителиальных клеток, препятствования увеличению проницаемости капилляров, уменьшения отека соединительнотканной стромы. При ограничении действия прогестерона пролиферация начинает доминировать над процессами апоптоза.
Как действует трансдермальный микронизированный прогестерон на ткани МЖ? Его эффекты весьма значимы: Прожестожель восполняет дефицит прогестерона в ткани МЖ, ограничивает пролиферативное действие эстрогенов на ткани, облегчает боль в МЖ (масталгию/мастодинию), уменьшает степень отека в МЖ, стимулирует продукцию ферментов, способствующих превращению активных эстрогенов в менее активные и неактивные формы, блокирует рецепторы эстрогенов, улучшая всасывание жидкости из ткани МЖ, уменьшает сдавление млечных протоков, блокирует рецепторы пролактина, снижая лактопоэз. Для достижения антипролиферативного эффекта в МЖ гестагены следует назначать в непрерывном режиме: 2,5 мг геля (1 аппликация) наносят на кожу каждой МЖ каждый день в течение минимум 3 мес.
В своем финальном докладе Карина Рустамовна Бондаренко высказала мысль о том, что МЖ – это «лакмусовая бумажка» гинекологической патологии. Состояния, сопровождающиеся дефицитом прогестерона в МЖ и требующие ее защиты, довольно разнообразны: это гиперплазия эндометрия, эндометриоз, синдром предменструального напряжения, бесплодие, хронические воспалительные заболевания органов малого таза, нарушения менструального цикла, а также сопутствующие заболевания – СД 2-го типа, ожирение, гиперпролактинемия, болезни щитовидной железы. Также подтверждена связь СПКЯ с заболеваниями МЖ из-за формирования ИР (рис. 6).
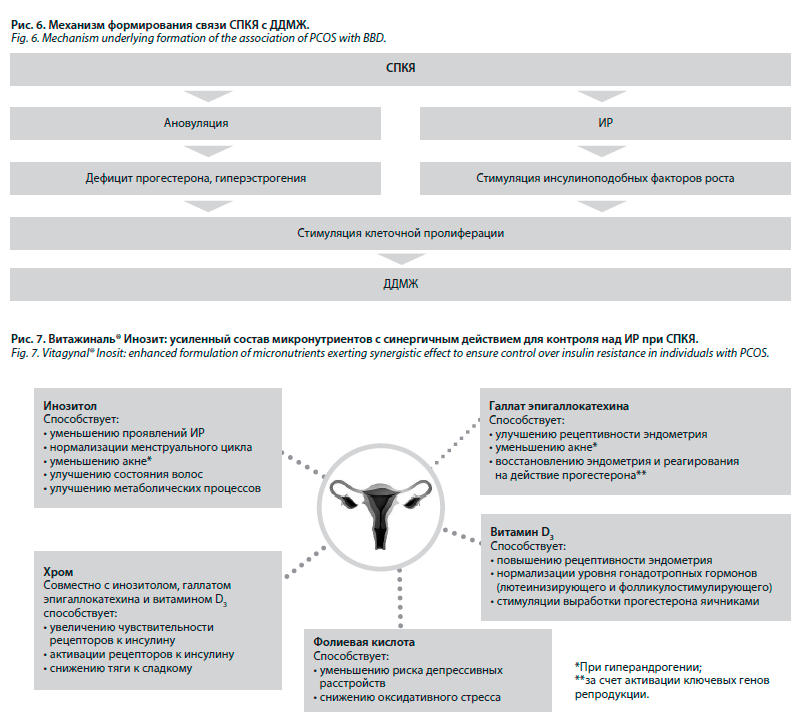
Интересны эффекты мио-инозитола в тканях МЖ в процессе купирования ИР. Он способствует транслокации транспортера глюкозы GLUT4 на плазматическую мембрану, усиливая поглощение глюкозы (расходование энергии) в тканях мозга и сердечной мышцы и одновременно уменьшая высвобождение свободных жирных кислот из жировой ткани. Кроме того, мио-инозитол усиливает активность гликогенсинтазы, а доступность другого изомера D-хироинозитола значительно увеличивается в тканях с большими запасами гликогена, таких как печень или скелетные мышцы. Происходит стимуляция синтеза гликогена (запас энергии) в жировой ткани, печени, мышцах. Таким образом, инозитол, в частности, входящий в состав препарата Витажиналь® Инозит, способствует уменьшению проявлений ИР (рис. 7).
При ДДМЖ прогестагены снижают болевой синдром в МЖ у некоторых женщин. Согласно рандомизированному клиническому исследованию, вагинальное применение микронизированного прогестерона на 19–25-й день цикла в течение 6 циклов уменьшало боль в груди у 65% женщин по сравнению с 22% контрольной группы. Французское когортное исследование по применению прогестерона и оценке риска РМЖ у пациенток с ДДМЖ, в том числе с узловой гиперплазией, фиброаденомой, фиброзно-кистозной болезнью, изолированными кистами, изолированной масталгией и выделениями из сосков, показало, что Прожестожель в циклическом режиме 1–37 мес в сочетании с пероральными прогестагенами значимо снижал риск развития РМЖ, а связь между трансдермальным применением препарата Прожестожель и риском развития РМЖ отсутствовала.
На основании большого эпидемиологического исследования объединенной группы экспертов по изучению гормональных факторов РМЖ (Collaborative Group of Hormonal Factors in Breast Cancer – CGHFBC) специалисты сделали выводы о том, что в целом риск РМЖ при МГТ не стоит интерпретировать изолированно: решение о назначении МГТ следует принимать на индивидуальной основе и рассматривать препараты в контексте общих преимуществ, получаемых от использования МГТ, включая купирование симптомов и улучшение качества жизни, а также сердечно-сосудистые и костные защитные эффекты.
Редакционный материал. Обзор подготовлен по материалам рабочего совещания экспертов «Индивидуализация гормональной терапии: междисциплинарный подход».
Клинический разбор в общей медицине №4 2024
Индивидуализация гормональной терапии: междисциплинарный подход
Номера страниц в выпуске:61-70
Аннотация
Сегодня при назначении менопаузальной или заместительной гормональной терапии у клиницистов возникает немало практических вопросов. Основной целью рабочего совещания экспертов стали обсуждение принципов назначения гормональной терапии пациенткам различного возраста и с различными гинекологическими и соматическими заболеваниями и коморбидными состояниями и определение тактики выбора вида терапии исходя из принципов индивидуализации.
Ключевые слова: эстрогены, прогестерон, трансдермальные формы, гипоэстрогения.
Для цитирования: Индивидуализация гормональной терапии: междисциплинарный подход. Клинический разбор в общей медицине. 2024; 5 (4): 61–70. DOI: 10.47407/kr2024.5.4.00420
Сегодня при назначении менопаузальной или заместительной гормональной терапии у клиницистов возникает немало практических вопросов. Основной целью рабочего совещания экспертов стали обсуждение принципов назначения гормональной терапии пациенткам различного возраста и с различными гинекологическими и соматическими заболеваниями и коморбидными состояниями и определение тактики выбора вида терапии исходя из принципов индивидуализации.
Ключевые слова: эстрогены, прогестерон, трансдермальные формы, гипоэстрогения.
Для цитирования: Индивидуализация гормональной терапии: междисциплинарный подход. Клинический разбор в общей медицине. 2024; 5 (4): 61–70. DOI: 10.47407/kr2024.5.4.00420
Personalization of hormone therapy: interdisciplinary approach
AbstractToday, clinicians deal with many practical issues when prescribing menopausal or hormone replacement therapy. The main goal of the expert workshop was to discuss the principles of prescribing hormone therapy to patients of various age groups with various gynecological and somatic disorders and comorbidities, to determine the tactics for selection of the type of therapy based on the personalization principles.
Keywords: estrogens, progesterone, transdermal forms, hypoestrogenism
For citation: Personalization of hormone therapy: interdisciplinary approach. Clinical review for general practice. 2024; 5 (4): 61–70
(In Russ.). DOI: 10.47407/kr2024.5.4.00420
 Обзор последних данных по эстрогенодефицитным состояниям у пациенток репродуктивного возраста представила Карина Рустамовна Бондаренко, доктор медицинских наук, доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.
Обзор последних данных по эстрогенодефицитным состояниям у пациенток репродуктивного возраста представила Карина Рустамовна Бондаренко, доктор медицинских наук, доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.Факторов гипоэстрогении в репродуктивном возрасте немало: это и физиологические причины (лактационная аменорея), и возможные хирургические вмешательства, такие как двусторонняя овариэктомия, и гиперпролактинемия, и функциональная гипоталамическая аменорея (ФГА), и органические поражения гипоталамо-гипофизарной области (синдром пустого турецкого седла, болезнь Иценко–Кушинга, краниофарингиома, синдром Шихана), и преждевременная недостаточность яичников (ПНЯ), и длительный прием некоторых лекарственных препаратов. Спикер отметила, что синдром поликистозных яичников (СПКЯ) не относится к гипоэстрогенным состояниям и не требует назначения заместительной гормональной терапии (ЗГТ) с эстрогенами.
Что касается ФГА, то это состояние возникает без идентифицируемых органических причин – например, на фоне стрессовых факторов или активных спортивных занятий. На фоне снижения объема адипоцитов запускается каскад патологических реакций, приводящих к гипоэстрогении при ФГА (рис. 1). При стрессе кортикотропин-рилизинг-гормон ингибирует частоту выброса гонатотропин-рилизинг-гормона, а кортизол подавляет репродуктивную функцию на уровне гипоталамуса, гипофиза и матки. Сопутствующий энергетический дисбаланс может повышать чувствительность гипоталамо-гипофизарно-яичниковой оси к стрессу.
К другим факторам развития ФГА относят гиперметаболические состояния, мальабсорбцию (глютеновая энтеропатия, целиакия), ограничение определенных продуктов (жиров), а также генетическую предрасположенность.
Клиническую картину ФГА составляют олиго- и аменорея, задержка полового созревания, бесплодие, сексуальные нарушения, вульвовагинальная атрофия, отсутствие вазомоторных симптомов, а также остеопороз и низкоэнергетические переломы. В целом ФГА – это диагноз исключения, поэтому необходимо проанализировать наличие каких-либо возможных органических заболеваний и тщательно собрать анамнез пациентки (указания на перенесенный стресс, интенсивные занятия спортом, расстройство пищевого поведения). Стоит оценить уровни хорионического гонадотропина человека, тироксина, лютеинизирующего, фолликулостимулирющего гормона, эстрадиола, антимюллерова гормона, пролактина, общего тестостерона, дегидроэпиандростерон-сульфата‚ 17-ОН-прогестерона у пациенток с клинической гиперандрогенией, провести пробу с микронизированным прогестероном (Утрожестан®), ультразвуковое исследование (УЗИ) органов малого таза, магнитно-резонансную томографию головного мозга. После верификации диагноза стоит оценить минеральную плотность костной ткани (МПК) с помощью двухэнергетической рентгеновской абсорбциометрии у женщин с аменореей длительностью более полугода и проанализировать липидный профиль.
Последствия гипоэстрогении в репродуктивном возрасте неблагоприятны для сердечно-сосудистой системы. Исследование женского ишемического синдрома (The Women's Ischemia Syndrome Evaluation – WISE) показало, что гипоэстрогения гипоталамического происхождения связана с повышенным риском ишемической болезни сердца у женщин в репродуктивном возрасте. У спортсменок с ФГА подтверждены формирование эндотелиальной дисфункции, а также изменение липидного профиля в сторону повышения уровня холестерина и липопротеидов низкой плотности.
Модификация образа жизни (увеличение потребления калорий, снижение физической активности) становится важным аспектом терапии ФГА. При отсутствии эффекта от терапии, направленной на модификацию образа жизни, назначают трансдермальный эстрадиол – ТДЭ (например, Эстрожель®) с циклическим гестагеном в течение 12–14 дней ежемесячно (для защиты эндометрия) короткими курсами. Показано, что на фоне использования трансдермальных эстрогенов наблюдается увеличение МПК, в то время как гормональные пероральные контрацептивы не рекомендуется назначать пациенткам с аменореей с целью профилактики потери МПК. Восстановление менструальной функции может произойти в течение 6 мес (до 33 мес) после нормализации массы тела (согласно исследованиям, менструации возобновлялись в среднем при наборе массы тела до значений на 2,05 кг больших, чем масса тела, при которой развивалась аменорея). Достаточное содержание подкожно-жирового слоя в организме является необходимым, но недостаточным условием для возобновления менструаций.
Вопросы эффективности и безопасности назначения ЗГТ при различных клинических формах ПНЯ (см. таблицу) рассмотрела Светлана Владимировна Юренева, доктор медицинских наук, ведущий научный сотрудник отделения гинекологической эндокринологии ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России.

В задачи терапии входят облегчение вазомоторных и урогенитальных симптомов, положительное действие на качество жизни (настроение, когнитивная функция, жизненный тонус, состояние костно-мышечной системы), повышение шансов на наступление беременности естественным путем, минимизация долгосрочных рисков ПНЯ.
После постановки окончательного диагноза важно оценить возраст пациентки. Так, в пубертатном периоде стоит начинать с низких доз эстрогенов в сочетании с микронизированным прогестероном, избегая назначения комбинированных оральных контрацептивов. В репродуктивном возрасте наряду с психологической поддержкой стоит рассмотреть прием ЗГТ до возраста естественной менопаузы. Отечественные работы показывают, что ЗГТ с низкими и, в ряде случаев, стандартными дозами эстрадиола не позволяет полностью купировать симптомы эстрогенодефицита у женщин с ПНЯ и обеспечить высокий уровень качества жизни. Требуются более высокие, чем стандартные, дозы эстрадиола (в рамках инструкции) и более высокие дозы гестагенов для нивелирования симптомов или поддержки состояния МПК (эту позицию поддерживают ЕМАS, IМS и NIСЕ).
Еще в одной российской работе, проведенной на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова», оценивалось качество жизни пациенток с ПНЯ, принимающих ЗГТ. Женщинам назначали разные дозы эстрогенов: низкую (1 мг эстрадиола перорально), стандартную (2 мг эстрадиола перорально; 1 грамм 0,1% геля трансдермально; 1,5 мг 0,06% геля трансдермально; 50 мкг эстрадиола в сутки трансдермально), высокую (1,5 и 2,0 г 0,1% геля трансдермально), а также комбинированные оральные контрацептивы. Анализ качества жизни пациенток с ПНЯ показал: к нормальному 50-балльному порогу приблизились только оценки принимавших высокодозированную, но не наиболее часто назначаемую ЗГТ со стандартной дозой эстрадиола. Качество жизни пациенток с ПНЯ было напрямую связано с дозой эстрадиола в составе ЗГТ: при увеличении дозы эстрадиола повышалась оценка по большинству показателей опросника качества жизни SF-36. Отмеченное улучшение с увеличением дозы эстрадиола в составе ЗГТ соответствует результатам анализа удовлетворенности лечением пациенток с ПНЯ: положительная оценка терапии в 100% случаев была дана только женщинами, которые использовали высокодозированную ЗГТ, тогда как пользователи наиболее часто назначаемой ЗГТ со стандартной дозой эстрадиола были довольны терапией только в 55% случаев. Отечественные эксперты сделали вывод о том, что основная стратегия для улучшения качества жизни женщин с ПНЯ – это адекватное восполнение дефицита эстрогенов путем назначения достаточных доз ЗГТ.
Парентеральный путь введения эстрогенов предпочтителен из-за отсутствия первичного прохождения активного вещества через печень и минимизации протромботических эффектов. Использование микронизированного прогестерона в составе комбинированной ЗГТ имеет преимущества в виде отсутствия тромбогенных эффектов и меньшего риска рака молочной железы (РМЖ). Дозы эстрогенов, назначаемых при ПНЯ, обычно выше, чем при менопаузальной гормональной терапии (МГТ), и стандартных доз прогестерона может не хватить для защиты эндометрия. Женщины с ранней и поздней менопаузой имеют больший риск венозной тромбоэмболии (ВТЭ) по сравнению с женщинами с возрастом наступления менопаузы в 40–49 лет, поэтому важно, чтобы пациентки, имеющие риск ВТЭ, получали трансдермальные формы эстрогенов.
В целом женщины с ПНЯ нуждаются в особом подходе при врачебном консультировании с тщательным анализом жалоб, которые могут свидетельствовать о недостаточной компенсации дефицита эстрогенов на фоне ЗГТ. Результаты отечественного исследования свидетельствуют о необходимости пересмотра подходов к тактике ведения пациенток с ПНЯ. Необходимы оперативное проведение исследований для оптимизации ведения молодых женщин с ПНЯ и ранней менопаузой, оценка и улучшение качества их жизни и долгосрочных показателей заболеваемости и смертности.
О репродуктивных факторах риска развития сердечно-сосудистых заболеваний (ССЗ) у женщин подробно рассказала Вера Ефимовна Балан, профессор, руководитель поликлинического отделения ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии им. акад. В.И. Краснопольского», президент Междисциплинарной ассоциации специалистов по здоровому старению.
К факторам риска ССЗ относят ранний возраст менархе, нарушения менструального цикла, СПКЯ, ФГА, масса тела ребенка при рождении более 4 кг, гестационный сахарный диабет (СД), прибавку массы тела более 12 кг за беременность, преэклампсию, гипертензионные расстройства во время беременности, невынашивание беременностей, возраст наступления первой и последней беременности, возраст наступления менопаузы, длительность постменопаузы.
Выявление аномалий менструального цикла в подростковом возрасте может способствовать раннему обнаружению потенциальных проблем со здоровьем у взрослых. К характеристикам менструального цикла, связанным с сердечно-сосудистым риском, относятся преждевременное, позднее или нерегулярное менархе, СПКЯ, ФГА. Также важно учитывать риски, связанные с гормональной контрацепцией.
Маркером состояния здоровья сосудов является состояние эндотелия. Эндотелиальная дисфункция – это центральный механизм формирования обструктивных и необструктивных форм ишемической болезни сердца, связанных как с традиционными, так и со специфическими факторами риска ССЗ. Женщины с естественной ранней менопаузой имеют более высокую генетическую предрасположенность к ССЗ. Назначение МГТ в период перименопаузы и ранней постменопаузы способствует снижению риска ССЗ за счет протективных механизмов эстрогенов: усиления ангиогенеза и расширения сосудов, уменьшения фиброза и окислительного стресса, защиты эндотелия.
У женщин с приливами МГТ устраняет эндотелиальную дисфункцию и повышает чувствительность к инсулину, снижает частоту заболеваний коронарных артерий. Приливы могут опосредованно влиять на состояние коронарных артерий, при этом, как правило, коронарные артерии хорошо отвечают на терапию экзогенными эстрогенами. Согласно теории «терапевтического окна», МГТ оказывает благоприятный эффект у женщин, недавно вступивших в менопаузу, с приливами и здоровыми коронарными артериями, но не оказывает благоприятного эффекта у женщин более старшего возраста без приливов и с более кальцифицированными и менее реагирующими на эстрогены коронарными артериями (постменопауза более 10 лет и возраст старше 60 лет).
И если ответ на вопрос о необходимости назначения МГТ в раннем менопаузальном периоде представляется однозначным, то вопрос выбора формы МГТ актуален всегда.
Согласно результатам национального регистрационного исследования, на фоне трансдермального применения МГТ было отмечено статистически значимое снижение риска развития инфаркта миокарда (по сравнению с пероральной эстрогеновой терапией). Показано, что индекс массы тела (ИМТ) не влияет на увеличение рисков при применении трансдермальных эстрогенов, которые вписываются в схемы ведения пациенток как перименопаузального, так и постменопаузального периода, а также с хирургической менопаузой (рис. 2).

Наряду с персонифицированной МГТ и ЗГТ с использованием ТДЭ и микронизирванного прогестерона (Эстрожель®/Утрожестан®) важно помнить о целесообразности саплементарной поддержки. В частности, клинически доказано, что добавление комплекса Фамвиталь® к МГТ улучшает динамику менопаузальных симптомов и симптомов тревожности. Оптимальный курс приема составляет 3 мес, все компоненты разделены на два вида капсул («утро» и «вечер») с учетом их синергии и суточных биоритмов женщины климактерического возраста.
По данным исследований, прием этого комплекса на протяжении 8 нед способствует:
• снижению количества ежедневно выпавших волос на 50%;
• повышению увлажненности кожи на 13%;
• уменьшению глубины и объема морщин (27% и 23% соответственно);
• уменьшению ломкости ногтей;
• уменьшению объема талии на 2 см и бедер на 1,3 см;
• уменьшению выраженности целлюлита;
• снижению выраженности симптомов климактерия.
Тему индивидуализации МГТ – уже у коморбидных пациенток – продолжила Светлана Владимировна Юренева.
Согласно отечественным клиническим рекомендациям по менопаузе, рекомендуется отдавать предпочтение трансдермальному пути введения препаратов эстрогенов у женщин с климактерическими симптомами и наличием коморбидных состояний: болезней печени и поджелудочной железы, нарушенной всасываемости в желудочно-кишечном тракте; расстройств коагуляции, повышенного риска венозного тромбоза; гипертриглицеридемии до и на фоне пероральных препаратов; артериальной гипертензии (>170/100 мм рт. ст.); гиперинсулинемии; повышенного риска образования или наличия камней в желчных путях; мигрени; ожирения. Трансдермальные формы эстрогенов вследствие отсутствия первичной стадии печеночного метаболизма, в отличие от пероральных форм эстрогенов, имеют более благоприятный профиль безопасности – не повышают риск венозных тромбоэмболических осложнений (ВТЭО) и желчнокаменной болезни. Использование трансдермальных форм эстрогенов ассоциировано с меньшим риском больших сердечно-сосудистых событий (инфаркта, инсульта) и ВТЭО, чем использование эквивалентных доз пероральных форм эстрогенов.
ТДЭ благодаря отсутствию первичного печеночного метаболизма не влияет на метаболизм печеночных белков и систему гемостаза и не повышает тромботические риски. Трансдермальные препараты рекомендованы при отклонениях в показателях функции печени, при болезнях печени и поджелудочной железы, приеме препаратов, индуцирующих печеночные ферменты (карбамазепин, ламотриджин и пр.) ввиду отсутствия первичного печеночного метаболизма, при пероральном приеме левотироксина (при гипотиреозе), при нарушенной всасываемости в желудочно-кишечном тракте, заболеваниях, которые могут повлиять на всасываемость перорального препарата (болезнь Крона и пр.), чувствительности к лактозе (большинство пероральных препаратов содержит лактозу). ТДЭ в меньшей степени способен вызвать такой побочный эффект, как тошнота, и показан при стойких неприятных симптомах и/или побочных эффектах при приеме пероральных эстрогенов.
Крайне важен вопрос рисков венозного тромбоза на фоне МГТ. ТДЭ ввиду отсутствия первичного печеночного метаболизма не оказывает влияния на систему гемостаза, артериальное давление (АД), уровень триглицеридов, ассоциированный с риском тромбоза. Показано, что пероральные эстрогены повышают риск ВТЭ в общей популяции в 1,7 раза по сравнению с плацебо, поэтому для женщин с риском ССЗ предпочтительнее трансдермальная терапия эстрадиолом и микронизированным прогестероном, если это необходимо для защиты матки. Препараты ТДЭ в меньшей степени влияют на факторы свертывания крови, АД, уровень триглицеридов, С-реактивного белка и глобулина, связывающего половые гормоны, и в низких дозах предпочтительны для женщин с риском ВТЭ, гипертензией, гипертриглицеридемией, ожирением, метаболическим синдромом, СД и желчнокаменной болезнью в анамнезе. Микронизированный прогестерон считается нейтральным в отношении тромботических рисков.
Гипертрилицеридемия считается независимым фактором риска ССЗ. Развившаяся до и на фоне пероральных препаратов, она становится прямым противопоказанием для приема пероральных эстрогенов. МГТ в целом не рекомендована в качестве терапии первой линии коррекции дислипидемии с целью профилактики рисков ССЗ.
Большое количество клинических рекомендаций показывает, что ТДЭ не повышают уровень триглицеридов. Пероральные эстрогены оказывают благоприятное воздействие на липидный профиль, однако связаны с повышением триглицеридов в сыворотке, поэтому женщинам с гипертриглицеридемией следует предлагать ТДЭ и избегать пероральных форм. При наличии риска ССЗ/ВТЭО и на фоне повышенного уровня триглицеридов предпочтительны ТДЭ в сочетании с нейтральным в отношении метаболизма липидов пероральным микронизированным прогестероном или дидрогестероном. Кроме того, ТДЭ ввиду отсутствия первичного печеночного метаболизма не оказывают стимулирующего влияния на ренин-ангиотензин-альдостероновую систему, благодаря чему не повышают риск артериальной гипертензии, а также не создают дополнительного риска ВТЭ у женщин с повышенным ИМТ.
При наличии симптомов менопаузы у женщин с СД
2-го типа следует рассмотреть назначение МГТ после учета коморбидных состояний. Женщинам с СД 2-го типа, ИМТ>30 кг/м2 и низким или умеренным риском ССЗ рекомендованы ТДЭ; при ИМТ<30 кг/м2 и низком риске ССЗ ТДЭ назначают без возрастных ограничений. В случае необходимости назначения гестагена следует использовать тот, который оказывает нейтральное воздействие на метаболизм глюкозы, например, пероральный микронизированный прогестерон или дидрогестерон.
В своем докладе Виктория Борисовна Мычка, доктор медицинских наук, ведущий научный сотрудник отдела системных гипертензий Института клинической кардиологии им. А.Л. Мясникова ФГБУ «Национальный медицинский исследовательский центр кардиологии им. акад. Е.И. Чазова» Минздрава России, продолжила обсуждение кардиоваскулярных рисков у женщин в менопаузе. Согласно рекомендациям IMS по гормональной терапии в менопаузе, МГТ снижает риск развития ССЗ путем положительного влияния на метаболический синдром, улучшает метаболизм липидов и углеводов, уменьшает объем висцерального жира, снижает риск наступления СД и улучшает чувствительность к инсулину при инсулинорезистентности (ИР), снижает риск коронарного атеросклероза, инфарктов. Использование трансдермальных форм эстрогенов ассоциировано с меньшим риском больших сердечно-сосудистых событий (инфаркта, инсульта) и ВТЭО, чем использование эквивалентных доз пероральных форм эстрогенов. В постменопаузе следует предпочесть трансдермальные пути введения препаратов гормональной терапии, поскольку они оказывают наименьшее влияние на коагуляцию, метаболизм глюкозы и липидов.
Согласно Российским критериям приемлемости назначения менопаузальной гормональной терапии пациенткам с сердечно-сосудистыми и метаболическими заболеваниями, при ожирении нежелательно назначать препараты, содержащие гестагены с остаточной андрогенной и глюкокортикоидной активностью, предпочтение отдается метаболически нейтральным прогестагенам.
Важно учитывать и другие свойства прогестагена в составе МГТ. Микронизированный прогестерон и дидрогестерон оказывают защитное влияние на эндометрий, обладают более благоприятным профилем безопасности в отношении риска ВТЭ в сравнении с норэтистероном и медроксипрогестероном. При комбинированном лечении следует отдавать предпочтение натуральному (микронизированному) прогестерону, поскольку он лишен антиапоптотических свойств других прогестагенов в отношении клеток молочной железы (МЖ) и поэтому в наименьшей степени ассоциирован с повышением риска РМЖ по сравнению с другими гестагенами.
Тему выбора МГТ пациенткам с метаболическими нарушениями затронула Юлия Александровна Тишова, кандидат медицинских наук, доцент кафедры эндокринологии ФГАОУ ВО «Российский университет дружбы народов им. Патриса Лумумбы». Новые критерии Международной федерации диабета определяют метаболический синдром при наличии центрального ожирения (окружность талии >94 см для европеоидов-мужчин и >80 см для женщин с учетом этнической специфики для других групп) в сочетании с любыми двумя из четырех нижеследующих факторов:
• увеличение уровня триглицеридов >150 мг/дл (1,7 ммоль/л) или специфическое лечение этого нарушения;
• снижение содержания липопротеидов высокой плотности <40 мг/дл (1,03 ммоль/л) у мужчин и <50 мг/дл (1,29 ммоль/л) у женщин или специфическое лечение данного нарушения;
• повышение АД: систолическое АД>130 или диастолическое АД>85 мм рт. ст. – или лечение ранее диагностированной артериальной гипертензии;
• повышение глюкозы натощак в плазме >100 мг/дл (5,6 ммоль/л) или ранее диагностированный СД 2-го типа.
Ожирение – это фактор риска ВТЭ и ее осложнений. Применение пероральных форм эстрогенов у женщин с ожирением связано с повышением рисков ВТЭО, в то время как ТДЭ не повышают эти показатели независимо от ИМТ пациентки. ТДЭ следует рассматривать в качестве терапии первой линии и отдавать им предпочтение у женщин с факторами риска сердечно-сосудистых событий (повышенные АД и ИМТ, ожирение). Женщинам с повышенным риском ВТЭО, включая ИМТ>30 кг/м2, следует рекомендовать ТДЭ (в монотерапии или в сочетании с микронизированным прогестероном), а не пероральные формы эстрогенов.
Курение – еще один важный и независимый фактор риска ССЗ и первого инфаркта миокарда. В России курят 10% женщин, и эта цифра, по прогнозам специалистов, к 2028 г. увеличится до 12,91%. У курящих женщин при пероральном приеме концентрация эстрогенов снижается на 50% из-за влияния компонентов сигаретного дыма на печеночный метаболизм, тем самым нивелируется положительное влияние эстрогенов на липидный обмен и даже может возникать гипертриглицеридемия. ТДЭ позволяют избежать негативного влияния курения на сердечно-сосудистые риски.
О факторах риска развития РМЖ и возможных реакциях ткани на МГТ рассказала Ирина Владимировна Колядина, доктор медицинских наук, профессор кафедры онкологии, ведущий научный сотрудник Научно-исследовательского центра ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России на базе ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России. Согласно данным литературы, при назначении ЗГТ с синтетическим прогестероном повышается риск развития РМЖ. Однако важно отметить, что пациентки в описанных исследованиях принимали именно синтетический прогестерон. Формула микронизированного прогестерона полностью соответствует формуле эндогенного гормона, что гарантирует идентичность фармакологических эффектов и аналогичное влияние на организм. Микронизация (измельчение) и заключение в жировую оболочку (липосферу) обеспечивает более полное и быстрое растворение и всасывание вещества. Рандомизированные исследования по ЗГТ с микронизированным прогестероном показали отсутствие увеличения риска развития РМЖ и рака эндометрия (рис. 3). Микронизированный прогестерон является безопасной и эффективной опцией заместительной комбинированной менопаузальной эндокринотерапии и не повышает риск развития РМЖ.

 Это подтвердило и другое клиническое исследование, здоровье участниц которого оценивали в течение 12 лет. У пациенток, использовавших Прожестожель (трансдермальный микронизированный прогестерон), частота развития РМЖ не увеличилась. Прожестожель, 1% гель микронизированного прогестерона для трансдермального введения, содержит прогестерон, идентичный эндогенному по химическому строению и молекулярной массе. Препарат значительно не влияет на уровень прогестерона в плазме и действует только местно. В тканях МЖ прогестерон уменьшает проницаемость капилляров и интенсивность циклического отека соединительной стромы. Клиническое улучшение отмечают 85% женщин (рис. 4) уже через 2 сут, максимально стойкий эффект отмечается при ежедневном применении препарата на протяжении 3–6 мес.
Это подтвердило и другое клиническое исследование, здоровье участниц которого оценивали в течение 12 лет. У пациенток, использовавших Прожестожель (трансдермальный микронизированный прогестерон), частота развития РМЖ не увеличилась. Прожестожель, 1% гель микронизированного прогестерона для трансдермального введения, содержит прогестерон, идентичный эндогенному по химическому строению и молекулярной массе. Препарат значительно не влияет на уровень прогестерона в плазме и действует только местно. В тканях МЖ прогестерон уменьшает проницаемость капилляров и интенсивность циклического отека соединительной стромы. Клиническое улучшение отмечают 85% женщин (рис. 4) уже через 2 сут, максимально стойкий эффект отмечается при ежедневном применении препарата на протяжении 3–6 мес.Особое внимание присутствующих Ирина Владимировна обратила на тот факт, что в делении клеток МЖ участвуют только эстрогены. Так называемой эстрогензависимый сигнальный путь начинается с проникновения эстрогена в клетку: гормон соединяется с рецептором, находящемся на ядре как здоровой, так и опухолевой клетки, и стимулирует его. Передача сигнала инициирует процесс деления клетки. Прогестерон не участвует в делении ни здоровой, ни опухолевой клетки и уравновешивает действие эстрогенов, в достаточном количестве снижая число эстрогеновых рецепторов, подавляя митозы.
Подробно алгоритм обследования МЖ у пациенток разных возрастных групп озвучила Алла Александровна Анисимкова, врач лучевой и интервенционной диагностики МЖ отделения лучевой диагностики ФГБУ «НМИЦ АГП им. В.И. Кулакова». Так, женщины старше 40 лет независимо от наличия или отсутствия жалоб направляются на маммографию, по результатам которой формируются три потока пациенток: без изменений в МЖ, с признаками диффузной мастопатии и с узловыми образованиями. Для женщин в возрастном диапазоне от 20 до 40 лет определяют наличие факторов риска РМЖ:
• при отсутствии изменений и факторов риска пациентке рекомендуется очередной осмотр 1 раз в 2 года;
• при наличии факторов риска, но без изменений в тканях проводится УЗИ МЖ, профилактическая консультация онколога для определения тактики наблюдения (осмотр, магнитно-резонансная томография, УЗИ, маммография);
• во всех остальных ситуациях стоит рекомендовать консультацию онколога и дообследование.
Высокая маммографическая плотность является независимым и сильным фактором риска РМЖ, увеличивающим риск его развития в несколько раз, что существенно больше, чем значимость многих других факторов риска. Для снижения маммографической плотности приемлемо использовать длительное патогенетическое лечение трансдермальным микронизированным прогестероном (Прожестожель): показано, что на фоне его назначения пациенткам с мастопатией в течение
1 года маммографическая плотность уменьшается.
Прожестожель снижает число эстрогеновых рецепторов, активирует ферменты, обеспечивающие переход эстрадиола в менее активные формы, тормозит циклическую секрецию гонадотропинов, оказывает натрийдиуретический эффект, предотвращает задержку жидкости в тканях МЖ, регулирует локальный уровень эстрогенов в тканях, ограничивая их пролиферативное действие, снижает проницаемость капилляров, уменьшая степень отека тканей железы и интенсивность масталгии, блокирует рецепторы пролактина, а также способствует уменьшению маммографической плотности.
Светлана Владимировна Юренева обратила внимание коллег на то, что, согласно клиническим рекомендациям Минздрава России «Доброкачественная дисплазия молочной железы» 2020 года, в основе патогенеза доброкачественной дисплазии МЖ (ДДМЖ) лежит хроническая гиперэстрогения. Эстрогены вызывают пролиферацию протокового альвеолярного эпителия и стромы, что в том числе приводит к обтурации протоков и формированию кист. Прогестерон, напротив, противодействует этим процессам, обеспечивает дифференцировку эпителия и прекращение митотической активности. В патогенезе ДДМЖ имеют значение такие факторы, как овариальная недостаточность (ановуляция, недостаточность лютеиновой фазы цикла, относительное преобладание эстрадиола и недостаток прогестерона), изменение рецепции к половым стероидным гормонам, активность пролиферации и апоптоза эпителия, изменение васкуляризации ткани МЖ.
Согласно приказу №1130н «Об утверждении порядка оказания медицинской помощи по профилю "акушерство и гинекология"» от 20.10.2020 (вступил в силу 01.01.2021, действует до 01.01.2027), при исключении злокачественных новообразований женщины с доброкачественными заболеваниями МЖ должны находиться под диспансерным наблюдением врача акушера-гинеколога, который оказывает медицинскую помощь по диагностике доброкачественной патологии МЖ и лечению доброкачественных диффузных изменений с учетом сопутствующей гинекологической патологии. Пациенткам с фиброзно-кистозной болезнью с целью купирования болевого синдрома рекомендовано использование препаратов на основе микронизированного прогестерона. Клинические исследования трансдермального пути введения микронизированного прогестерона показали уменьшение напряжения и болезненности МЖ, регрессию кист по данным УЗИ на фоне терапии. Наиболее целесообразно назначение препаратов прогестерона при сочетанных гиперпластических процессах.
В случае проведения системного лечения существует необходимость таргетной терапии мастопатии. Концентрация прогестерона в лютеиновой фазе должна быть достаточной для подавления избыточной эстрогеновой стимуляции пролиферации клеток МЖ. Местный способ доставки прогестерона создает намного более высокую концентрацию прогестерона непосредственно в ткани МЖ, чем системный, поэтому целесообразно использовать и Утрожестан®, и Прожестожель. Топическое применение создает высокую концентрацию прогестерона только в тканях МЖ: в системном кровотоке концентрация прогестерона оказывается в 10 раз ниже, чем в ткани.
Одно из крупных многоцентровых исследований BREAST-1 среди гинекологов с участием 1044 женщин подтвердило эффективность монотерапии Прожестожелем (рис. 5).

На фоне терапии улучшилась ультразвуковая и маммографическая картина, быстро купировалась масталгия (через 3–6 мес). Клинический результат (снижение интенсивности болевых ощущений) большинство пациенток отмечали уже в первые дни терапии Прожестожелем (см. рис. 4), что повышало комплаенс назначенной терапии.
Результаты другого многоцентрового открытого проспективного когортного исследования BREAST-2 подтвердили эффективность монотерапии Прожестожелем в лечении диффузной фиброзно-кистозной мастопатии: среднее количество образований различной эхогенности снизилось в 2,2 раза через 6 мес лечения. Кроме того, было отмечено достоверное клиническое улучшение признаков заболевания при ультразвуковой оценке образований средних размеров и различной эхогенности через 3 и 6 мес в динамике проводимой терапии. В результате проведения многоцентрового наблюдательного исследования BREAST-2 среди онкологов России были сделаны следующие выводы:
1. Работа подтвердила эффективность и безопасность монотерапии диффузно-фиброзной мастопатии препаратом Прожестожель в условиях рутинной клинической практики онкологов.
2. Эффективность препарата Прожестожель была подтверждена клиническими и лабораторными данными: произошло снижение количества и размеров образований по УЗИ, уменьшение болевых ощущений в МЖ, улучшение состояния МЖ согласно рентгеномаммографическому исследованию.
В конце своего выступления Светлана Владимировна сделала несколько выводов: так, диффузная фиброзно-кистозная мастопатия (ДДМЖ) характеризуется наличием образований различной эхогенности в обеих МЖ, поэтому результатом лечения будет считаться не только устранение клинических симптомов, но и уменьшение количества и размеров образований и снижение маммографической плотности. В связи с дисгормональной природой заболевания в репродуктивном возрасте и в перименопаузе важно устранить и системный дисбаланс половых стероидов (лечение нарушений менструального цикла, недостаточности лютеиновой фазы, назначение МГТ). По данным проведенных ранее исследований (BREAST-1, 2), через 6 мес применения Прожестожеля картина менялась с BI-RADS 2 до BI-RADS 1, образования исчезали или уменьшались в размерах, снижалось их количество.
О связи различных эндокринопатий и доброкачественных заболеваний МЖ во втором своем докладе рассказала Юлия Александровна Тишова. Среди всех органов репродуктивной системы, подверженных риску гормонально-зависимых гиперпластических процессов, МЖ страдают наиболее часто, первыми сигнализируя о расстройствах нейрогуморального гомеостаза всей репродуктивной системы. В основе патогенеза ДДМЖ лежит нарушение баланса между прогестероном и эстрогенами (хроническая относительная гиперэстрогения в сочетании с прогестеронодефицитными состояниями). Эстрогены вызывают пролиферацию соединительной ткани – стромы МЖ и протокового альвеолярного эпителия (что приводит к обтурации протоков и формированию кист), усиливают активность фибробластов, повышают гидратацию соединительной ткани. Прогестерон, напротив, противодействует этим процессам, обеспечивает дифференцировку эпителия, тормозит митотическую активность и влияет на активность ферментов биотрансформации эстрогенов.
Эндогенный прогестерон оказывает антипролиферативный эффект за счет предотвращения избыточной пролиферации, обеспечения дифференцировки эпителия, торможения митотической активности эпителиальных клеток, препятствования увеличению проницаемости капилляров, уменьшения отека соединительнотканной стромы. При ограничении действия прогестерона пролиферация начинает доминировать над процессами апоптоза.
Как действует трансдермальный микронизированный прогестерон на ткани МЖ? Его эффекты весьма значимы: Прожестожель восполняет дефицит прогестерона в ткани МЖ, ограничивает пролиферативное действие эстрогенов на ткани, облегчает боль в МЖ (масталгию/мастодинию), уменьшает степень отека в МЖ, стимулирует продукцию ферментов, способствующих превращению активных эстрогенов в менее активные и неактивные формы, блокирует рецепторы эстрогенов, улучшая всасывание жидкости из ткани МЖ, уменьшает сдавление млечных протоков, блокирует рецепторы пролактина, снижая лактопоэз. Для достижения антипролиферативного эффекта в МЖ гестагены следует назначать в непрерывном режиме: 2,5 мг геля (1 аппликация) наносят на кожу каждой МЖ каждый день в течение минимум 3 мес.
В своем финальном докладе Карина Рустамовна Бондаренко высказала мысль о том, что МЖ – это «лакмусовая бумажка» гинекологической патологии. Состояния, сопровождающиеся дефицитом прогестерона в МЖ и требующие ее защиты, довольно разнообразны: это гиперплазия эндометрия, эндометриоз, синдром предменструального напряжения, бесплодие, хронические воспалительные заболевания органов малого таза, нарушения менструального цикла, а также сопутствующие заболевания – СД 2-го типа, ожирение, гиперпролактинемия, болезни щитовидной железы. Также подтверждена связь СПКЯ с заболеваниями МЖ из-за формирования ИР (рис. 6).

Интересны эффекты мио-инозитола в тканях МЖ в процессе купирования ИР. Он способствует транслокации транспортера глюкозы GLUT4 на плазматическую мембрану, усиливая поглощение глюкозы (расходование энергии) в тканях мозга и сердечной мышцы и одновременно уменьшая высвобождение свободных жирных кислот из жировой ткани. Кроме того, мио-инозитол усиливает активность гликогенсинтазы, а доступность другого изомера D-хироинозитола значительно увеличивается в тканях с большими запасами гликогена, таких как печень или скелетные мышцы. Происходит стимуляция синтеза гликогена (запас энергии) в жировой ткани, печени, мышцах. Таким образом, инозитол, в частности, входящий в состав препарата Витажиналь® Инозит, способствует уменьшению проявлений ИР (рис. 7).
При ДДМЖ прогестагены снижают болевой синдром в МЖ у некоторых женщин. Согласно рандомизированному клиническому исследованию, вагинальное применение микронизированного прогестерона на 19–25-й день цикла в течение 6 циклов уменьшало боль в груди у 65% женщин по сравнению с 22% контрольной группы. Французское когортное исследование по применению прогестерона и оценке риска РМЖ у пациенток с ДДМЖ, в том числе с узловой гиперплазией, фиброаденомой, фиброзно-кистозной болезнью, изолированными кистами, изолированной масталгией и выделениями из сосков, показало, что Прожестожель в циклическом режиме 1–37 мес в сочетании с пероральными прогестагенами значимо снижал риск развития РМЖ, а связь между трансдермальным применением препарата Прожестожель и риском развития РМЖ отсутствовала.
На основании большого эпидемиологического исследования объединенной группы экспертов по изучению гормональных факторов РМЖ (Collaborative Group of Hormonal Factors in Breast Cancer – CGHFBC) специалисты сделали выводы о том, что в целом риск РМЖ при МГТ не стоит интерпретировать изолированно: решение о назначении МГТ следует принимать на индивидуальной основе и рассматривать препараты в контексте общих преимуществ, получаемых от использования МГТ, включая купирование симптомов и улучшение качества жизни, а также сердечно-сосудистые и костные защитные эффекты.
Редакционный материал. Обзор подготовлен по материалам рабочего совещания экспертов «Индивидуализация гормональной терапии: междисциплинарный подход».

