Клинический разбор в общей медицине №4 2024
Клинический разбор в общей медицине №4 2024
Метаболомное профилирование пациентов с ревматоидным артритом (пилотное исследование)
Номера страниц в выпуске:76-82
Аннотация
Актуальность. Ревматоидный артрит (РА) – хроническое системное аутоиммунное заболевание, характеризующееся прогрессирующим поражением суставов и приводящее к ранней инвалидизации больных. Основная цель лечения – облегчить боль, вызванную заболеванием, задержать развитие заболевания, снизить уровень заболеваемости и улучшить качество жизни пациентов. В настоящее время специфичность и чувствительность методов диагностики РА не убедительны. В последние десятилетия исследования были сосредоточены на патогенезе и открытии потенциальных биомаркеров с использованием новых и высокоточных методов, в частности метаболомики. Метаболомика – наука, изучающая низкомолекулярные соединения (метаболиты), участвующие в биохимических процессах и являющиеся конечными продуктами обмена веществ. Метаболиты отражают текущее состояние организма человека, поэтому могут служить перспективными биомаркерами.
Цель. Изучить метаболомный профиль больных ранним РА с целью поиска потенциальных биомаркеров для диагностики и оценки терапии.
Материал и методы. Основную исследуемую группу составили 14 пациентов с впервые установленным диагнозом РА – РА de novo. Группу контроля составили16 здоровых добровольцев. Метаболиты в плазме крови были исследованы с помощью сверхэффективной жидкостной хроматографии в сочетании с тройным квадрупольным анализатором. У пациентов с РА de novo и здоровых людей было проанализировано 93 метаболита. В группе больных РА проанализирована связь этих метаболитов с активностью по DAS28, С-реактивным белком, скоростью оседания эритроцитов, наличием ревматоидного фактора и антител к циклическому цитруллинсодержащему пептиду.
Результаты. При сравнении больных РА и здоровых добровольцев были выявлены наиболее значимые метаболиты, играющие важную роль в патогенезе РА: лейцин/изолейцин, тирозин, лизин, валин, фенилаланин, пролин, орнитин, аспартат, глутамин и длинноцепочные ацилкарнитины (С14, С14-ОН, С16-1, С18). Мы обнаружили взаимосвязь активности РА по DAS28 с уровнями лейцина/изолейцина (р=0,03) и пролина (p=0,05). Установлена обратная корреляция между АЦЦП и глутамином (р=0,041) и прямая корреляция между АЦЦП и пролином (р=0,039), обратная корреляция между РФ и фенилаланином (р=0,0491) и гистидином (р=0,04).
Заключение. Метаболомика открывает новые возможности для дальнейшего изучения РА, поскольку позволяет идентифицировать метаболиты, наиболее связанные с заболеванием, что повышает точность диагностики РА и может способствовать персонификации терапии.
Ключевые слова: ревматоидный артрит, метаболомное профилирование, метаболиты, биомаркеры.
Для цитирования: Мусаева Л.М., Меньшикова И.В., Апполонова С.А., Шестакова К.М. Метаболомное профилирование пациентов с ревматоидным артритом (пилотное исследование). Клинический разбор в общей медицине. 2024; 5 (4): 76–82. DOI: 10.47407/kr2024.5.4.00422
Актуальность. Ревматоидный артрит (РА) – хроническое системное аутоиммунное заболевание, характеризующееся прогрессирующим поражением суставов и приводящее к ранней инвалидизации больных. Основная цель лечения – облегчить боль, вызванную заболеванием, задержать развитие заболевания, снизить уровень заболеваемости и улучшить качество жизни пациентов. В настоящее время специфичность и чувствительность методов диагностики РА не убедительны. В последние десятилетия исследования были сосредоточены на патогенезе и открытии потенциальных биомаркеров с использованием новых и высокоточных методов, в частности метаболомики. Метаболомика – наука, изучающая низкомолекулярные соединения (метаболиты), участвующие в биохимических процессах и являющиеся конечными продуктами обмена веществ. Метаболиты отражают текущее состояние организма человека, поэтому могут служить перспективными биомаркерами.
Цель. Изучить метаболомный профиль больных ранним РА с целью поиска потенциальных биомаркеров для диагностики и оценки терапии.
Материал и методы. Основную исследуемую группу составили 14 пациентов с впервые установленным диагнозом РА – РА de novo. Группу контроля составили16 здоровых добровольцев. Метаболиты в плазме крови были исследованы с помощью сверхэффективной жидкостной хроматографии в сочетании с тройным квадрупольным анализатором. У пациентов с РА de novo и здоровых людей было проанализировано 93 метаболита. В группе больных РА проанализирована связь этих метаболитов с активностью по DAS28, С-реактивным белком, скоростью оседания эритроцитов, наличием ревматоидного фактора и антител к циклическому цитруллинсодержащему пептиду.
Результаты. При сравнении больных РА и здоровых добровольцев были выявлены наиболее значимые метаболиты, играющие важную роль в патогенезе РА: лейцин/изолейцин, тирозин, лизин, валин, фенилаланин, пролин, орнитин, аспартат, глутамин и длинноцепочные ацилкарнитины (С14, С14-ОН, С16-1, С18). Мы обнаружили взаимосвязь активности РА по DAS28 с уровнями лейцина/изолейцина (р=0,03) и пролина (p=0,05). Установлена обратная корреляция между АЦЦП и глутамином (р=0,041) и прямая корреляция между АЦЦП и пролином (р=0,039), обратная корреляция между РФ и фенилаланином (р=0,0491) и гистидином (р=0,04).
Заключение. Метаболомика открывает новые возможности для дальнейшего изучения РА, поскольку позволяет идентифицировать метаболиты, наиболее связанные с заболеванием, что повышает точность диагностики РА и может способствовать персонификации терапии.
Ключевые слова: ревматоидный артрит, метаболомное профилирование, метаболиты, биомаркеры.
Для цитирования: Мусаева Л.М., Меньшикова И.В., Апполонова С.А., Шестакова К.М. Метаболомное профилирование пациентов с ревматоидным артритом (пилотное исследование). Клинический разбор в общей медицине. 2024; 5 (4): 76–82. DOI: 10.47407/kr2024.5.4.00422
Original article
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
musaeva-93@mail.ru
Abstract
Background. Rheumatoid arthritis (RA) is a chronic systemic autoimmune disease characterized by progressive joint damage and leading to early disability in patients. The main purpose of its treatment is to alleviate the pain caused by the disease, delay the development of the disease, reduce the morbidity rate, and improve the quality of life of patients. At present the specificity and sensitivity of RA diagnosis methods are not convincing. In recent decades, research has focused on pathogenesis and the discovery of potential biomarkers using new and high-precision methods, in particular metabolomics. Metabolomics is an science studying low molecular weight compounds (metabolites) involved in biochemical processes and being the end products of metabolism. Metabolites reflect the current state of the humans body and can therefore serve as perspective biomarkers.
Aim. To study the metabolomic profile of patients with RA without therapy in order to search for potential biomarkers for diagnosis and evaluation of therapy.
Material and methods. The main study group consisted of 14 patients with a newly diagnosed RA – de novo RA. 16 healthy volunteers formed the control group. Metabolites in blood plasma were studied using ultra-performance liquid chromatography in combination with a triple quadrupole analyzer. A total of 93 metabolites were analyzed in de novo RA patients and healthy controls. In the group of RA patients the relationship of these metabolites with DAS28 activity, CRP, ESR, the presence of RF and ACCP were analyzed.
Results. The most significant metabolites that play an important role in the pathogenesis of RA were identified: leucine/isoleucine, tyrosine, lysine, valine, phenylalanine, proline, ornithine, glutamine aspartate and long-chain acylcarnitines (C14, C14-OH, C16-1, C18). We found a correlation between DAS28 and leucine (p=0.03) and proline (p=0.05) levels. An inverse correlation was established between ACCP and glutamine (p=0,041) and a direct correlation between ACCP and proline (p=0.039), an inverse correlation between RF and phenylalanine (p=0.0491) and histidine (p=0.04).
Conclusion. Metabolomics provides promising opportunities for further research in RA as it allows to identify metabolites most associated with disease, which can improve the accuracy of RA diagnosis and serve as targets for therapy
Keywords: rheumatoid arthritis, metabolomic profiling, metabolomics, biomarkers.
For citation: Musaeva L.M., Menshikova I.V., Appolonova S.A., Shestakova K.M. Metabolomic profiling in patients with rheumatoid arthritis (a pilot study). Clinical review for general practice. 2024; 5 (4): 76–82 (In Russ.). DOI: 10.47407/kr2024.5.4.00422
В основе патогенеза РА лежит нарушение работы иммунной системы: аномальные клеточные и гуморальные иммунные реакции, приводящие к развитию антител к собственным тканям организма. Патологические изменения при РА начинаются в синовиальной оболочке суставов с образования паннуса – инфильтрации синовии иммунными клетками и развития воспаления [3]. Диагноз РА основывается на наличии клинических, лабораторных и иммунных маркеров, таких как антитела к циклическому цитруллинсодержащему пептиду (АЦЦП) и ревматоидный фактор (РФ) [4]. Однако диагностика РА вызывает ряд трудностей, так как классические биохимические и иммунологические анализы не всегда позволяют выявить явный патологический процесс [5]. На ранней стадии заболевание часто сложно диагностировать и отличить от других аутоиммунных заболеваний [6]. Исследования показали, что в этиологии и патогенезе РА участвуют многочисленные метаболиты, которые возникают в результате нарушений метаболических путей [7, 8], при этом некоторые метаболиты, связанные с прогрессированием заболевания, возникают на ранней стадии заболевания, до появления характерных симптомов, поэтому усилия исследователей направлены на поиск дополнительных маркеров, имеющих диагностическое и прогностическое значение с точки зрения персонификации терапии.
В настоящее время изучением метаболитов и метаболических путей занимается одна из отраслей эпигенетики – метаболомика. Метаболомика – развивающаяся наука, которая следует за развитием геномики, транскриптомики и протеомики и изучает все низкомолекулярные соединения (метаболиты), участвующие в биохимических процессах и являющиеся конечными продуктами метаболизма [9]. Известно, что классические биохимические параметры – это крупные белковые молекулы, которые являются продуктом жизнедеятельности целого органа и системы. Метаболиты, напротив, являются конечным результатом взаимодействий между генами, РНК и белками, которые наиболее точно и всесторонне описывают молекулярный фенотип биологического объекта и могут выступать в качестве потенциальных биомаркеров [10]. Связанные с патологическим состоянием изменения метаболомного профиля описаны при различных заболеваниях, например, при злокачественных новообразованиях [11], воспалительных заболеваниях [12] и РА [13]. Метаболический отпечаток отражает активность воспалительного заболевания, что сопровождается значительными изменениями метаболизма. Таким образом, особенности метаболомного профиля при различной патологии могут дать представление о патогенезе заболевания, быть предикторами ранней диагностики и отражать эффективность проводимой терапии [13, 14].
Метаболомное профилирование было проведено в Центре биофармацевтического анализа и метаболомных исследований Института трансляционной медицины и биотехнологии Сеченовского Университета. Для проведения метаболомного анализа исследовали венозную кровь натощак, количественный анализ выполняли с использованием смеси изотопно-меченных стандартов исследуемых соединений. Инструментальный анализ методом высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии проводили на жидкостном хроматографе Agilent 1200, соединенном с трехквадрупольным масс-спектрометром 6450C (Agilent Technologies, США). Хроматографическое разделение выполняли на колонке Discovery PFP HS F5 2,1×150,3 мкм (Supelco Inc., США) с использованием предколонки Waters WAT084560 (Waters Inc., США).
Статистический анализ проводился с использованием программы StatTech v.4.1.7 (ООО «Статтех», Россия). Данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3) или числа и пропорций (%). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Различия считались статистически значимыми при p<0,05.
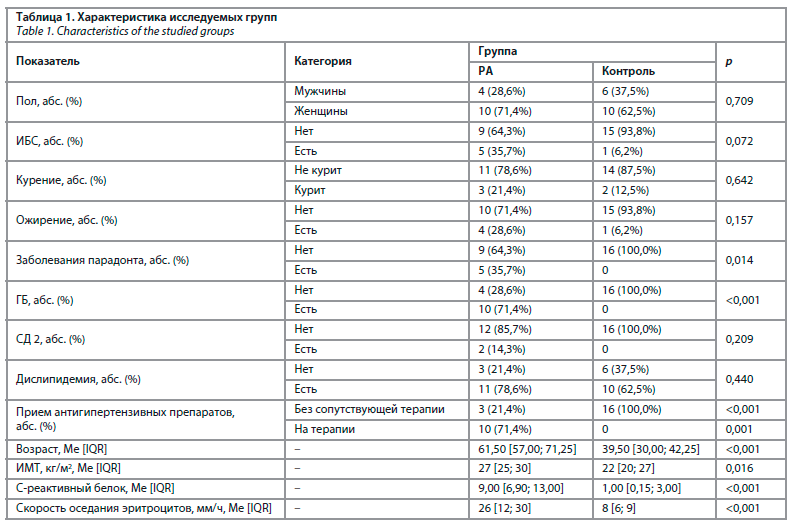
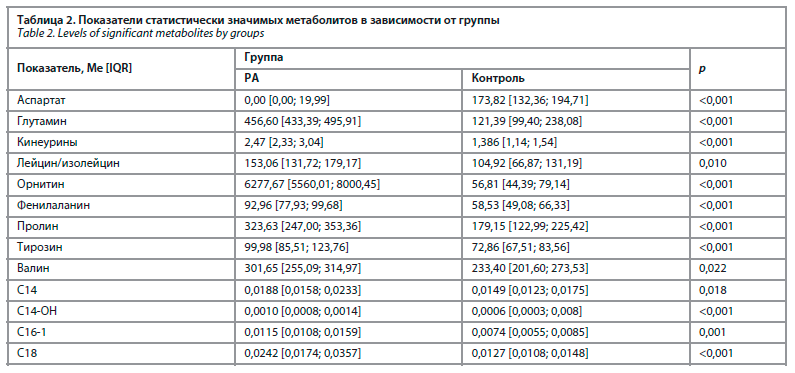
Был проведен количественный анализ 93 метаболитов всем участникам исследования. При сравнении результатов двух групп было выявлено статистически значимое различие следующих метаболитов: лейцина/изолейцина (p=0,010), лизина (p<0,001), метаболитов триптофана – кинеурина (p<0,001), орнитина (p<0,001), фенилаланина (p<0,001), валина (p=0,022), длинноцепочечных ацилкарнитинов С14, С14-ОН, С16-1, С18 (p<0,001), глутамина (p<0,001), пролина (p<0,001), тирозина (p<0,001), аспартата (p<0,001); рис. 1, 2; табл. 2.
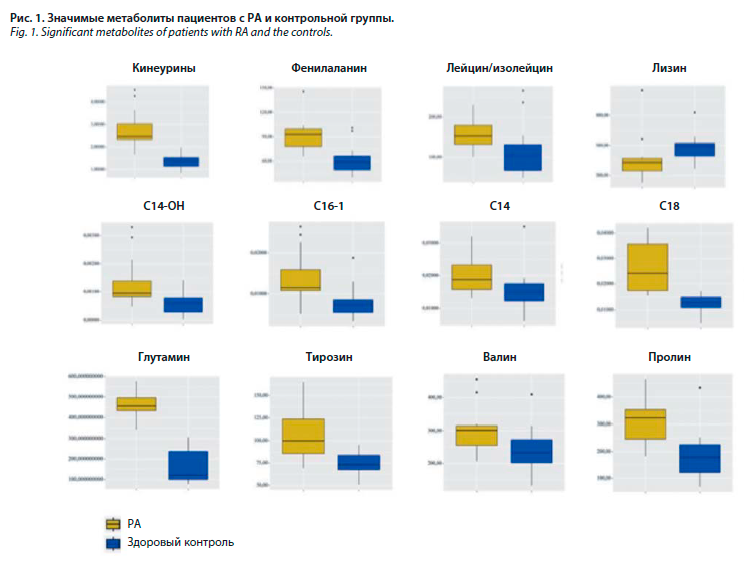
Взаимосвязи между концентрациями метаболитов, активностью РА по DAS28, рентгенологической стадией, функциональными нарушениями, показателями липидного профиля, уровнем С-реактивного белка, сопутствующими заболеваниями (ГБ, СД 2, ИБС) и факторами риска РА были исследованы с помощью корреляционного анализа. Были обнаружены обратная корреляционная связь активности РА (индекса DAS28) с уровнем глутамина (p=0,011) и прямая корреляционная связь с уровнем лейцина/изолейцина (p=0,03) и пролина (p=0,05), а уровень орнитина обратно коррелировал с длительностью заболевания (р=0,011). При проведении регрессионного анализа не было выявлено корреляционной связи между статистически значимыми метаболитами и курением, поражением пародонта, ИБС, ГБ, ИМТ, лишь уровень орнитина был значимо снижен у пациентов с ожирением (p=0,048). Выявлена прямая корреляционная связь с заметной теснотой связи по шкале Чеддока между уровнем метаболита триптофана (кинеурина) и рентгенологической стадией заболевания (p=0,012), уровень кинеурина при остеопорозе был статистически значимо ниже (p=0,036). При оценке взаимосвязи АЦЦП и аминокислот были установлены обратная корреляционная связь с глутамином (p=0,041) и прямая корреляционная связь с пролином (p=0,039), обратная корреляция между РФ и фенилаланином (p=0,0491) и гистидином (p=0,04). Также мы обнаружили прямую корреляционную связь между уровнем холестерина и липопротеинов низкой плотности с уровнями лейцина/изолейцина (p=0,035), тирозина (p=0,030), триптофана (p=0,006), валина (p=0,034). Кроме того, установлена обратная связь между длительностью заболевания и С18 ацилкарнитином (p<0,05). Уровень C14 ацилкарнитина коррелировал с наличием СД 2 у пациентов основной группы (p=0,045). Установлена также обратная связь между активностью по DAS28 и C14-OH (p=0,05).
Выделенные метаболиты в первую очередь связаны с нарушениями гликолитического пути, метаболизма жирных кислот и аминокислот, а также других сопряженных метаболических путей, например, циклом трикарбоновых кислот, циклом мочевины.
Основным источником энергии является глюкоза, метаболизм которой не только обеспечивает энергию для физической активности, но также опосредует множество физиологических функций, образуя сложные сигнальные сети [15]. Уровень глюкозы зависит от аэробного и анаэробного гликолиза [16], при этом основным источником продуктивности организма является аэробный гликолиз. Цитратный цикл является центральным метаболическим путем для всех аэробных метаболических процессов [17]. У больных РА нами выявлен повышенный уровень метаболитов, участвующих в цитратном цикле: лейцина/изолейцина, валина, пролина, фенилаланина, глутамина.
В предыдущих исследованиях показано, что метаболизм пролина тесно связан с РА [18], а его деградация сопряжена с энергетическим потреблением при длительном течении РА [19]. Нарушение метаболизма пролина влияет на цикл лимонной кислоты, тем самым участвуя в энергообеспечении при патологических состояниях, и вызывает повреждение хрящей и костей [18]. Уровень пролина у наших пациентов с РА был повышен при сравнении с группой контроля и продемонстрировал прямую зависимость от уровня АЦЦП, а также коррелировал с активностью заболевания.
В другом исследовании показано, что высокие концентрации орнитина, пролина, аспартата были связаны с дисфункцией скелетных мышц [20]. Таким образом, повышенный уровень пролина у больных с ранней стадией РА отражает высокую воспалительную активность.
J. Li и соавт. показали также, что глутамат может быть новым предиктором ранней эрозии кости при РА [18]. Основным субстратом для глутамата является глутамин, повышение которого выявлено как у пациентов нашей основной группы, так и в исследовании R. Madsen и соавт. [13] у больных РА. Напротив, D. Mason обнаружил повышенный уровень глутамина у АЦЦП-негативных пациентов с РА [21], что подтверждается и нашими данными: высокий уровень глутамина обратно коррелировал с уровнем АЦЦП.
В развитии и прогрессировании РА участвуют различные липидные метаболиты, но наиболее обсуждаемыми являются холестерин и глицерин. В условиях повышенного энергопотребления уровень жирных кислот повышается. Исследования показали, что уровень общего холестерина ниже у больных РА с активным воспалением [13, 17]. И чем дольше длится воспаление, тем больше жирных аминокислот задействованы в обеспечении энергии. Повышенные уровни холестерина и жирных кислот (средне- и длинноцепочечных ацилкарнитинов) и снижение уровня липопротеинов высокой плотности связаны с тяжестью заболевания [22]. Согласно нашим результатам, подтверждены ранее полученные данные: у пациентов в группе с РА уровни длинноцепочечных ацилкарнитинов были статистически выше, чем в контрольной группе.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование не имело спонсорской поддержки.
Financing. The work was done without sponsorship.
Информация об авторах
Information about the authors
Мусаева Лариса Магомедовна – аспирантка каф. госпитальной терапии №1, врач-терапевт Университетской клинической больницы №1 Клинического центра ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет).
E-mail: musaeva-93@mail.ru
Larisa M. Musaeva – Graduate Student, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: musaeva-93@mail.ru
Меньшикова Ирина Вадимовна – д-р мед. наук, проф. каф. госпитальной терапии №1, зав. ревматологическим отд-нием Университетской клинической больницы №1 Клинического центра ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Irina V. Menshikova – Dr. Sci. (Med.), Professor, Sechenov First Moscow State Medical University (Sechenov University)
Апполонова Светлана Александровна – канд. хим. наук, доц. каф. фармакологии, рук. Центра биофармацевтического анализа и метаболомных исследований ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет)
Svetlana A. Appolonova – Cand. Sci. (Chem.), Associate Professor, Sechenov First Moscow State Medical University (Sechenov University)
Шестакова Ксения Михайловна – канд. фарм. наук, зав. лаб. биоинформатики и фармакологического моделирования ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Ksenya M. Shestakova – Cand. Sci. (Pharm.), Sechenov First Moscow State Medical University (Sechenov University)
Поступила в редакцию: 14.05.2024
Поступила после рецензирования: 21.05.2024
Принята к публикации: 23.05.2024
Received: 14.05.2024
Revised: 21.05.2024
Accepted: 23.05.2024
Metabolomic profiling in patients with rheumatoid arthritis (a pilot study)
Larisa M. Musaeva, Irina V. Menshikova, Svetlana A. Appolonova, Ksenya M. ShestakovaSechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
musaeva-93@mail.ru
Abstract
Background. Rheumatoid arthritis (RA) is a chronic systemic autoimmune disease characterized by progressive joint damage and leading to early disability in patients. The main purpose of its treatment is to alleviate the pain caused by the disease, delay the development of the disease, reduce the morbidity rate, and improve the quality of life of patients. At present the specificity and sensitivity of RA diagnosis methods are not convincing. In recent decades, research has focused on pathogenesis and the discovery of potential biomarkers using new and high-precision methods, in particular metabolomics. Metabolomics is an science studying low molecular weight compounds (metabolites) involved in biochemical processes and being the end products of metabolism. Metabolites reflect the current state of the humans body and can therefore serve as perspective biomarkers.
Aim. To study the metabolomic profile of patients with RA without therapy in order to search for potential biomarkers for diagnosis and evaluation of therapy.
Material and methods. The main study group consisted of 14 patients with a newly diagnosed RA – de novo RA. 16 healthy volunteers formed the control group. Metabolites in blood plasma were studied using ultra-performance liquid chromatography in combination with a triple quadrupole analyzer. A total of 93 metabolites were analyzed in de novo RA patients and healthy controls. In the group of RA patients the relationship of these metabolites with DAS28 activity, CRP, ESR, the presence of RF and ACCP were analyzed.
Results. The most significant metabolites that play an important role in the pathogenesis of RA were identified: leucine/isoleucine, tyrosine, lysine, valine, phenylalanine, proline, ornithine, glutamine aspartate and long-chain acylcarnitines (C14, C14-OH, C16-1, C18). We found a correlation between DAS28 and leucine (p=0.03) and proline (p=0.05) levels. An inverse correlation was established between ACCP and glutamine (p=0,041) and a direct correlation between ACCP and proline (p=0.039), an inverse correlation between RF and phenylalanine (p=0.0491) and histidine (p=0.04).
Conclusion. Metabolomics provides promising opportunities for further research in RA as it allows to identify metabolites most associated with disease, which can improve the accuracy of RA diagnosis and serve as targets for therapy
Keywords: rheumatoid arthritis, metabolomic profiling, metabolomics, biomarkers.
For citation: Musaeva L.M., Menshikova I.V., Appolonova S.A., Shestakova K.M. Metabolomic profiling in patients with rheumatoid arthritis (a pilot study). Clinical review for general practice. 2024; 5 (4): 76–82 (In Russ.). DOI: 10.47407/kr2024.5.4.00422
Введение
Ревматоидный артрит (РА) – хроническое системное аутоиммунное заболевание, характеризующееся прогрессирующим поражением суставов и приводящее к ранней инвалидизации пациентов [1]. Этиология РА остается неизвестной, однако большую роль в развитии заболевания играют генетические факторы риска, эпигенетические модификации и окружающая среда [2].В основе патогенеза РА лежит нарушение работы иммунной системы: аномальные клеточные и гуморальные иммунные реакции, приводящие к развитию антител к собственным тканям организма. Патологические изменения при РА начинаются в синовиальной оболочке суставов с образования паннуса – инфильтрации синовии иммунными клетками и развития воспаления [3]. Диагноз РА основывается на наличии клинических, лабораторных и иммунных маркеров, таких как антитела к циклическому цитруллинсодержащему пептиду (АЦЦП) и ревматоидный фактор (РФ) [4]. Однако диагностика РА вызывает ряд трудностей, так как классические биохимические и иммунологические анализы не всегда позволяют выявить явный патологический процесс [5]. На ранней стадии заболевание часто сложно диагностировать и отличить от других аутоиммунных заболеваний [6]. Исследования показали, что в этиологии и патогенезе РА участвуют многочисленные метаболиты, которые возникают в результате нарушений метаболических путей [7, 8], при этом некоторые метаболиты, связанные с прогрессированием заболевания, возникают на ранней стадии заболевания, до появления характерных симптомов, поэтому усилия исследователей направлены на поиск дополнительных маркеров, имеющих диагностическое и прогностическое значение с точки зрения персонификации терапии.
В настоящее время изучением метаболитов и метаболических путей занимается одна из отраслей эпигенетики – метаболомика. Метаболомика – развивающаяся наука, которая следует за развитием геномики, транскриптомики и протеомики и изучает все низкомолекулярные соединения (метаболиты), участвующие в биохимических процессах и являющиеся конечными продуктами метаболизма [9]. Известно, что классические биохимические параметры – это крупные белковые молекулы, которые являются продуктом жизнедеятельности целого органа и системы. Метаболиты, напротив, являются конечным результатом взаимодействий между генами, РНК и белками, которые наиболее точно и всесторонне описывают молекулярный фенотип биологического объекта и могут выступать в качестве потенциальных биомаркеров [10]. Связанные с патологическим состоянием изменения метаболомного профиля описаны при различных заболеваниях, например, при злокачественных новообразованиях [11], воспалительных заболеваниях [12] и РА [13]. Метаболический отпечаток отражает активность воспалительного заболевания, что сопровождается значительными изменениями метаболизма. Таким образом, особенности метаболомного профиля при различной патологии могут дать представление о патогенезе заболевания, быть предикторами ранней диагностики и отражать эффективность проводимой терапии [13, 14].
Материал и методы
В рамках пилотного исследования были обследованы 30 пациентов Университетской клинической больницы №1 Сеченовского Университета. Протокол исследования был одобрен локальным этическим комитетом и соответствовал этическим принципам проведения медицинских исследований с участием людей, изложенным в Хельсинкской декларации. В основную группу были включены пациенты с преимущественно ранней стадией РА (n=14), группу контроля составили лица без ревматологических и сердечно-сосудистых заболеваний (n=16). Диагноз РА устанавливали в соответствии с актуальными клиническими рекомендациями по лечению РА, утвержденными Минздравом России в 2021 г. [4], и классификационными критериями Американского колледжа ревматологов от 2010 г. Для оценки активности заболевания проводился подсчет суставов (число болезненных суставов, число припухших суставов) с последующей оценкой по индексу DAS28-CRP. Также пациентам проводились оценка рентгенологической стадии РА по Штейнброкеру и оценка функциональных нарушений. Всем пациентам проводили оценку антропометрических показателей, общеклиническое обследование, оценку локального статуса, общий и биохимический анализы крови, рентгенографию кистей и стоп. Группы были сопоставимы по полу, однако отличались по возрасту и индексу массы тела (ИМТ). На момент включения в исследование пациенты основной группы принимали антигипертензивную терапию и гиполипидемическую терапию – 71,4% и 36,5% пациентов соответственно.Метаболомное профилирование было проведено в Центре биофармацевтического анализа и метаболомных исследований Института трансляционной медицины и биотехнологии Сеченовского Университета. Для проведения метаболомного анализа исследовали венозную кровь натощак, количественный анализ выполняли с использованием смеси изотопно-меченных стандартов исследуемых соединений. Инструментальный анализ методом высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии проводили на жидкостном хроматографе Agilent 1200, соединенном с трехквадрупольным масс-спектрометром 6450C (Agilent Technologies, США). Хроматографическое разделение выполняли на колонке Discovery PFP HS F5 2,1×150,3 мкм (Supelco Inc., США) с использованием предколонки Waters WAT084560 (Waters Inc., США).
Статистический анализ проводился с использованием программы StatTech v.4.1.7 (ООО «Статтех», Россия). Данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3) или числа и пропорций (%). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Различия считались статистически значимыми при p<0,05.
Результаты
При анализе данных было выявлено, что больные обеих групп были сопоставимы по полу, однако пациенты основной группы были старше: медиана возраста составляла 61,50 [57,00; 71,25] года, а в контрольной группе – 39,50 [30,00; 42,25] года. В обеих группах преобладали женщины: 71,4% (n=10) при 28,6% мужчин (n=4) в основной группе и 62,5% (n=10) при 37,5% мужчин (n=6) в контрольной группе. Коморбидность преобладала в основной группе: гипертоническая болезнь (ГБ) встречалась достоверно чаще – у 71,4% (n=10) пациентов, в группе контроля – у 0% (p<0,001) пациентов; ишемическая болезнь сердца (ИБС) – у 35,7% (n=5) и 6,2% (n=2) пациентов (p=0,072); сахарный диабет 2-го типа (СД 2) – у 14,3% (n=2) и 0% (n=0) пациентов соответственно (p=0,209). У пациентов основной группы и группы контроля имелись следующие факторы риска РА: курение – у 21,4% (n=3) и 12,5% (n=2) пациентов (p=0,642), ожирение – у 28,6% (n=4) и 6,2% (n=1) пациентов (p=0,157), заболевания пародонта у 35,7% в основной группе (p=0,014), дислипидемия – у 78,6% (n=11) и 62,5% (n=10) пациентов (p=0,440) соответственно. Пациенты основной группы, страдающие ГБ (71,4%, n=10), принимали антигипертензивные препараты. В контрольной группе испытуемые не принимали никаких лекарственных препаратов. Средняя активность РА по DAS28 составила 4,60 [4,35; 5,02], средняя длительность – 2 года [1,00; 3,75], при этом серопозитивность по РФ выявлена у 50% (n=7) пациентов. В основной группе пациенты имели преимущественно II [I; II] рентгенологическую стадию и II [II; II] класс функциональных нарушений. Полная характеристика групп представлена в табл. 1.
Был проведен количественный анализ 93 метаболитов всем участникам исследования. При сравнении результатов двух групп было выявлено статистически значимое различие следующих метаболитов: лейцина/изолейцина (p=0,010), лизина (p<0,001), метаболитов триптофана – кинеурина (p<0,001), орнитина (p<0,001), фенилаланина (p<0,001), валина (p=0,022), длинноцепочечных ацилкарнитинов С14, С14-ОН, С16-1, С18 (p<0,001), глутамина (p<0,001), пролина (p<0,001), тирозина (p<0,001), аспартата (p<0,001); рис. 1, 2; табл. 2.



Взаимосвязи между концентрациями метаболитов, активностью РА по DAS28, рентгенологической стадией, функциональными нарушениями, показателями липидного профиля, уровнем С-реактивного белка, сопутствующими заболеваниями (ГБ, СД 2, ИБС) и факторами риска РА были исследованы с помощью корреляционного анализа. Были обнаружены обратная корреляционная связь активности РА (индекса DAS28) с уровнем глутамина (p=0,011) и прямая корреляционная связь с уровнем лейцина/изолейцина (p=0,03) и пролина (p=0,05), а уровень орнитина обратно коррелировал с длительностью заболевания (р=0,011). При проведении регрессионного анализа не было выявлено корреляционной связи между статистически значимыми метаболитами и курением, поражением пародонта, ИБС, ГБ, ИМТ, лишь уровень орнитина был значимо снижен у пациентов с ожирением (p=0,048). Выявлена прямая корреляционная связь с заметной теснотой связи по шкале Чеддока между уровнем метаболита триптофана (кинеурина) и рентгенологической стадией заболевания (p=0,012), уровень кинеурина при остеопорозе был статистически значимо ниже (p=0,036). При оценке взаимосвязи АЦЦП и аминокислот были установлены обратная корреляционная связь с глутамином (p=0,041) и прямая корреляционная связь с пролином (p=0,039), обратная корреляция между РФ и фенилаланином (p=0,0491) и гистидином (p=0,04). Также мы обнаружили прямую корреляционную связь между уровнем холестерина и липопротеинов низкой плотности с уровнями лейцина/изолейцина (p=0,035), тирозина (p=0,030), триптофана (p=0,006), валина (p=0,034). Кроме того, установлена обратная связь между длительностью заболевания и С18 ацилкарнитином (p<0,05). Уровень C14 ацилкарнитина коррелировал с наличием СД 2 у пациентов основной группы (p=0,045). Установлена также обратная связь между активностью по DAS28 и C14-OH (p=0,05).
Обсуждение
В пилотном исследовании впервые в России проведена оценка метаболомного профиля у пациентов с РА ранней стадии, не получавших базисную или генно-инженерную биологическую терапию. Выявлены статистически значимые метаболиты при сравнении с группой контроля. Примененная нами аналитическая процедура позволила провести одновременный качественный и количественный анализ 93 метаболитов в сыворотке крови человека. Показано, что уровни 15 из 93 метаболитов отличались в группе больных РА от контрольной группы. Уровни метаболитов могут зависеть в том числе от возраста человека. Сравниваемые нами группы отличались по возрасту, однако даже после поправки на возраст выявленные различия метаболитов сохранялись между группами, что повышает достоверность их связи с определенной нозологией (в нашем случае с РА).Выделенные метаболиты в первую очередь связаны с нарушениями гликолитического пути, метаболизма жирных кислот и аминокислот, а также других сопряженных метаболических путей, например, циклом трикарбоновых кислот, циклом мочевины.
Основным источником энергии является глюкоза, метаболизм которой не только обеспечивает энергию для физической активности, но также опосредует множество физиологических функций, образуя сложные сигнальные сети [15]. Уровень глюкозы зависит от аэробного и анаэробного гликолиза [16], при этом основным источником продуктивности организма является аэробный гликолиз. Цитратный цикл является центральным метаболическим путем для всех аэробных метаболических процессов [17]. У больных РА нами выявлен повышенный уровень метаболитов, участвующих в цитратном цикле: лейцина/изолейцина, валина, пролина, фенилаланина, глутамина.
В предыдущих исследованиях показано, что метаболизм пролина тесно связан с РА [18], а его деградация сопряжена с энергетическим потреблением при длительном течении РА [19]. Нарушение метаболизма пролина влияет на цикл лимонной кислоты, тем самым участвуя в энергообеспечении при патологических состояниях, и вызывает повреждение хрящей и костей [18]. Уровень пролина у наших пациентов с РА был повышен при сравнении с группой контроля и продемонстрировал прямую зависимость от уровня АЦЦП, а также коррелировал с активностью заболевания.
В другом исследовании показано, что высокие концентрации орнитина, пролина, аспартата были связаны с дисфункцией скелетных мышц [20]. Таким образом, повышенный уровень пролина у больных с ранней стадией РА отражает высокую воспалительную активность.
J. Li и соавт. показали также, что глутамат может быть новым предиктором ранней эрозии кости при РА [18]. Основным субстратом для глутамата является глутамин, повышение которого выявлено как у пациентов нашей основной группы, так и в исследовании R. Madsen и соавт. [13] у больных РА. Напротив, D. Mason обнаружил повышенный уровень глутамина у АЦЦП-негативных пациентов с РА [21], что подтверждается и нашими данными: высокий уровень глутамина обратно коррелировал с уровнем АЦЦП.
В развитии и прогрессировании РА участвуют различные липидные метаболиты, но наиболее обсуждаемыми являются холестерин и глицерин. В условиях повышенного энергопотребления уровень жирных кислот повышается. Исследования показали, что уровень общего холестерина ниже у больных РА с активным воспалением [13, 17]. И чем дольше длится воспаление, тем больше жирных аминокислот задействованы в обеспечении энергии. Повышенные уровни холестерина и жирных кислот (средне- и длинноцепочечных ацилкарнитинов) и снижение уровня липопротеинов высокой плотности связаны с тяжестью заболевания [22]. Согласно нашим результатам, подтверждены ранее полученные данные: у пациентов в группе с РА уровни длинноцепочечных ацилкарнитинов были статистически выше, чем в контрольной группе.
Заключение
РА представляет собой сложный патогенетический процесс, что требует дальнейшего создания новых чувствительных методов клинической диагностики и эффективных программ лечения. Различия в метаболических путях РА и здоровых людей могут помочь понять фундаментальный механизм заболевания. В научной литературе продолжается накопление данных исследований по изучению метаболомного профиля у пациентов с ревматическими заболеваниями в разных популяциях, которые могут быть неоднородны. Для выделения определенных метаболитов как потенциальных биомаркеров ранней диагностики и выбора наиболее эффективной персонифицированной терапии РА необходимы дальнейшие углубленные исследования.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование не имело спонсорской поддержки.
Financing. The work was done without sponsorship.
Информация об авторах
Information about the authors
Мусаева Лариса Магомедовна – аспирантка каф. госпитальной терапии №1, врач-терапевт Университетской клинической больницы №1 Клинического центра ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет).
E-mail: musaeva-93@mail.ru
Larisa M. Musaeva – Graduate Student, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: musaeva-93@mail.ru
Меньшикова Ирина Вадимовна – д-р мед. наук, проф. каф. госпитальной терапии №1, зав. ревматологическим отд-нием Университетской клинической больницы №1 Клинического центра ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Irina V. Menshikova – Dr. Sci. (Med.), Professor, Sechenov First Moscow State Medical University (Sechenov University)
Апполонова Светлана Александровна – канд. хим. наук, доц. каф. фармакологии, рук. Центра биофармацевтического анализа и метаболомных исследований ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет)
Svetlana A. Appolonova – Cand. Sci. (Chem.), Associate Professor, Sechenov First Moscow State Medical University (Sechenov University)
Шестакова Ксения Михайловна – канд. фарм. наук, зав. лаб. биоинформатики и фармакологического моделирования ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Ksenya M. Shestakova – Cand. Sci. (Pharm.), Sechenov First Moscow State Medical University (Sechenov University)
Поступила в редакцию: 14.05.2024
Поступила после рецензирования: 21.05.2024
Принята к публикации: 23.05.2024
Received: 14.05.2024
Revised: 21.05.2024
Accepted: 23.05.2024
Список исп. литературыСкрыть список1. Filipowicz-Sosnowska A. Drug-free remission: the goal of the future in management of patients with rheumatoid arthritis. Reumatologia 2017;55(6):284-9.
2. McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med 2011;365(23):2205-19.
3. Scherer HU, Häupl T, Burmester GR. The etiology of rheumatoid arthritis. J Autoimmun 2020;110:102400.
4. Ревматоидный артрит. Клинические рекомендации. Утверждены Минздравом России. 2021.
Rheumatoid arthritis. Clinical recommendations. Approved by the Russian Ministry of Health. 2021 (in Russian).
5. Martinez-Prat L, Nissen MJ, Lamacchia C et al. Comparison of Serological Biomarkers in Rheumatoid Arthritis and Their Combination to Improve Diagnostic Performance. Front Immunol 2018;9:1113. Published 2018 Jun 6.
6. Riccardi A, Martinroche G, Contin-Bordes C et al. Erosive arthritis autoantibodies in systemic sclerosis. Semin Arthritis Rheum 2022;52:151947.
7. Wang Z, Long H, Chang C et al. Crosstalk between metabolism and epigenetic modifications in autoimmune diseases: a comprehensive overview. Cell Mol Life Sci 2018;75(18):3353-69.
8. Glocker MO, Guthke R, Kekow J, Thiesen HJ. Rheumatoid arthritis, a complex multifactorial disease: on the way toward individualized medicine. Med Res Rev 2006;26(1):63-87.
9. Madsen R, Lundstedt T, Trygg J. Chemometrics in metabolomics – a review in human disease diagnosis. Anal Chim Acta 2010;659(1-2):23-33.
10. Rinschen MM, Ivanisevic J, Giera M, Siuzdak G. Identification of bioactive metabolites using activity metabolomics. Nat Rev Mol Cell Biol 2019;20(6):353-67.
11. Leichtle AB, Nuoffer JM, Ceglarek U et al. Serum amino acid profiles and their alterations in colorectal cancer. Metabolomics 2012;8(4):
643–53.
12. Hisamatsu T, Okamoto S, Hashimoto M et al. Novel, objective, multivariate biomarkers composed of plasma amino acid profiles for the diagnosis and assessment of inflammatory bowel disease. PLoS One 2012;7(1):e31131.
13. Madsen RK, Lundstedt T, Gabrielsson J, et al. Diagnostic properties of metabolic perturbations in rheumatoid arthritis. Arthritis Res Ther 2011;13(1):R19.
14. Semerano L, Roméo PH, Boissier MC. Metabolomics for rheumatic diseases: has the time come? Ann Rheum Dis 2015;74(7):1325-6.
15. Yang XY, Zheng KD, Lin K et al. Energy Metabolism Disorder as a Contributing Factor of Rheumatoid Arthritis: A Comparative Proteomic and Metabolomic Study. PLoS One 2015;10(7):e0132695.
16. Jones RG, Thompson CB. Revving the engine: signal transduction fuels T cell activation. Immunity 2007;27(2):173-8.
17. Ouyang X, Dai Y, Wen JL, Wang LX. ¹H NMR-based metabolomic study of metabolic profiling for systemic lupus erythematosus. Lupus 2011;20(13):1411-20.
18. Li J, Che N, Xu L et al. LC-MS-based serum metabolomics reveals a distinctive signature in patients with rheumatoid arthritis. Clin Rheumatol 2018;37(6):1493-502.
19. Pandhare J, Donald SP, Cooper SK, Phang JM. Regulation and function of proline oxidase under nutrient stress. J Cell Biochem 2009;107(4):759-68.
20. Andonian BJ, Johannemann A, Hubal MJ et al. Altered skeletal muscle metabolic pathways, age, systemic inflammation, and low cardiorespiratory fitness associate with improvements in disease activity following high-intensity interval training in persons with rheumatoid arthritis. Arthritis Res Ther 2021;23(1):187. Published 2021 Jul 10.
21. Mason DJ. The role of glutamate transporters in bone cell signalling.
J Musculoskelet Neuronal Interact 2004;4(2):128-31.
22. Lauridsen MB, Bliddal H, Christensen R et al. 1H NMR spectroscopy-based interventional metabolic phenotyping: a cohort study of rheumatoid arthritis patients. J Proteome Res 2010;9(9):4545-53.

