Клинический разбор в общей медицине №6 2024
Аннотация
В статье описан клинический случай пациентки В., 62 лет, с диагнозом «аутоиммунный атрофический гастрит», которую на протяжении 5 лет беспокоили симптомы диспепсии. В октябре 2019 г. был поставлен диагноз «неатрофический гастрит, ассоциированный с
Helicobacter pylori», проведена антихеликобактерная терапия, однако симптомы заболевания продолжали беспокоить. В данной статье приведены ключевые исследования, позволяющие выявить аутоиммунный атрофический гастрит. Описаны характерные эндоскопические признаки данного заболевания и актуальная тактика лечения. Аутоиммунный гастрит – хроническое аутоиммунное заболевание с недостаточно изученной этиологией. Многие вопросы, касающиеся данной нозологии, остаются открытыми для новых исследований.
Ключевые слова: аутоиммунный гастрит, пернициозная анемия, железодефицитная анемия, нейроэндокринные опухоли, аденокарцинома, эндоскопия.
Для цитирования: Дехнич Н.Н., Кирсов П.П., Сысоева И.А., Гайдайчук А.С. Клинический случай аутоиммунного атрофического гастрита. Клинический разбор в общей медицине. 2024; 5 (6): 6–11. DOI: 10.47407/kr2024.5.6.00427
Клинический разбор в общей медицине №6 2024
Клинический случай аутоиммунного атрофического гастрита
Аннотация
В статье описан клинический случай пациентки В., 62 лет, с диагнозом «аутоиммунный атрофический гастрит», которую на протяжении 5 лет беспокоили симптомы диспепсии. В октябре 2019 г. был поставлен диагноз «неатрофический гастрит, ассоциированный с
Helicobacter pylori», проведена антихеликобактерная терапия, однако симптомы заболевания продолжали беспокоить. В данной статье приведены ключевые исследования, позволяющие выявить аутоиммунный атрофический гастрит. Описаны характерные эндоскопические признаки данного заболевания и актуальная тактика лечения. Аутоиммунный гастрит – хроническое аутоиммунное заболевание с недостаточно изученной этиологией. Многие вопросы, касающиеся данной нозологии, остаются открытыми для новых исследований.
Ключевые слова: аутоиммунный гастрит, пернициозная анемия, железодефицитная анемия, нейроэндокринные опухоли, аденокарцинома, эндоскопия.
Для цитирования: Дехнич Н.Н., Кирсов П.П., Сысоева И.А., Гайдайчук А.С. Клинический случай аутоиммунного атрофического гастрита. Клинический разбор в общей медицине. 2024; 5 (6): 6–11. DOI: 10.47407/kr2024.5.6.00427
Clinical Case
Clinical case of autoimmune atrophic gastritis
Natalya N. Dekhnich1, Pavel Р. Kirsov2, Inna A. Sysoeva1, Anastasiia S. Gaidaichuk1
1 Smolensk State Medical University, Smolensk, Russia;
2 Smolensk Regional Clinical Hospital, Smolensk, Russia
n.dekhnich@mail.ru
Abstract
The article presents a clinical case of a 62-year-old female patient with a diagnosis of autoimmune atrophic gastritis, who has been troubled by symptoms of dyspepsia for 5 years. In October 2019, she was diagnosed non-atrophic gastritis associated with Helicobacter pylori, anti-Helicobacter pylori therapy was performed, but the symptoms of the disease continued to bother. This article presents key studies that identify
autoimmune atrophic gastritis. The characteristic endoscopic signs of this disease and the current treatment tactics are described. Autoimmune gastritis is a chronic autoimmune disease with an insufficiently studied etiology. Many questions concerning of this nosology remain open to new researches.
Keywords: autoimmune gastritis, pernicious anemia, iron deficiency anemia, neuroendocrine tumors, adenocarcinoma, endoscopy.
For citation: Dekhnich N.N., Kirsov P.Р., Sysoeva I.A., Gaidaichuk A.S. Clinical case of autoimmune atrophic gastritis. Clinical review for
general practice. 2024; 5 (6): 6–11 (In Russ.). DOI: 10.47407/kr2024.5.6.00427
Жалобы
Пациентка В., 62 лет, обратилась к гастроэнтерологу с жалобами на дискомфорт в эпигастральной области по срединной линии живота, возникающий после переедания, приема жареной и острой пищи.
Важная особенность клинической картины: пациентка не наблюдала болевых ощущений в эпигастрии. В отличие от других типов гастрита, симптомы, связанные с аутоиммунным гастритом (АИГ), например боль в эпигастральной области, не являются ведущими [1, 2].
Анамнез заболевания
Пациентка считает себя больной около 5 лет (с октября 2019 г.), когда на фоне общего благополучия появился дискомфорт в эпигастрии после переедания, приема жареной и острой пищи. После обращения к участковому терапевту больная была направлена на консультацию к гастроэнтерологу. Назначен комплекс обследований. По результатам эзофагогастродуоденоскопии (ЭГДС) выявлен поверхностный гастрит. Результат анализа крови на антитела класса IgG к H. Pylori был положительный (1,3 Ед/мл, референсные значения
<0,9 Ед/мл). На основании жалоб, анамнеза, данных лабораторного и инструментального обследований был поставлен диагноз «неатрофический (поверхностный) гастрит, ассоциированный с H. Pylori». Проведена эрадикационная терапия первой линии: эзомепразол
20 мг 2 раза в сутки, кларитромицин 500 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки, висмута трикалия дицитрат 240 мг 2 раза в сутки в течение 10 дней, которую больная успешно завершила, однако улучшения клинической симптоматики не последовало.
Симптомы диспепсии продолжали беспокоить пациентку, и через год она повторно обратилась к гастроэнтерологу по месту жительства. Назначено комплексное исследование серологических биомаркеров, применяемое для косвенной неинвазивной оценки состояния слизистой оболочки желудка – ГастроПанель® [3]. По результатам исследования наблюдалась нормализация уровня антител класса IgG к H. pylori – 24 Eд (референсные значения <30 Eд); снижение уровня пепсиногена I – 15 мкг/л (30–160 мкг/л); пепсиноген II в пределах нормы – 8 мкг/л (3–15 мкг/л); снижение показателя соотношения пепсиноген I / пепсиноген II – 1,9
(3–20); резкое повышение уровней гастрина-17b (базальный) – 37,2 пмоль/л (1,00–7,00 пмоль/л) и гастрина-17s (стимулированный) >40 пмоль/л (3–30 пмоль/л). Секреторная деятельность желудка и кислотность были снижены. Полученные данные свидетельствовали об атрофии слизистой оболочки желудка (СОЖ), возможно, вследствие перенесенного инфицирования H. pylori, которое могло быть триггером развития аутоиммунного атрофического гастрита посредством процессов молекулярной мимикрии, повреждения эндотелия клеток, образования суперантигенов и микрохимеризма [4, 5].
Как известно, ГастроПанель® является скрининговым методом для выявления атрофического гастрита до проведения ЭГДС. Результаты данного исследования также заставляют задуматься о гастрите аутоиммунной этиологии. Понимание патогенеза АИГ затруднено по нескольким причинам: 1) распространенность заболевания относительно невелика; 2) во многих случаях имеет место сопутствующий гастрит, вызванный H. pylori; 3) на ранних стадиях заболевания проявления отсутствуют или минимальны [6, 7].
Для уточнения диагноза пациентка была направлена на повторное эндоскопическое исследование, где выявлен атрофический гастрит. В результатах биопсии четырех фрагментов ткани СОЖ описана картина хронического слабо выраженного неактивного гастрита с фокусами дисрегенерации желез, со слабо выраженным диффузно расположенным лимфоцитарно-макрофагальным воспалительным инфильтратом и умеренно выраженным фиброзом собственной пластинки, участками полной кишечной метаплазии, атрофии, H. pylori не обнаружено.
Анамнез жизни
Пациентка имеет высшее образование. Работает ведущим инженером-испытателем, профессиональных вредностей не имеет. Не курит. Алкоголем не злоупотребляет. Травмы, операции отрицает. Аллергологический и наследственный анамнезы не отягощены.
Данные объективного обследования
Общее состояние удовлетворительное. Рост 163 см, масса тела 54 кг, индекс массы тела 20,32 кг/м2. Кожные покровы телесного цвета, чистые. Периферических отеков нет. При аускультации дыхание везикулярное, хрипов нет. Тоны сердца ритмичные, звучные. Частота сердечных сокращений 70 в минуту. Артериальное давление 130/70 мм рт. ст. Живот при пальпации мягкий, безболезненный. Печень не выступает из-под края реберной дуги. Селезенка не пальпируется.
Дополнительные методы исследования
Учитывая жалобы и анамнез заболевания, с целью исключения аутоиммунного атрофического гастрита пациентке было рекомендовано сдать анализ крови на антитела к париетальным клеткам желудка классов IgG+A+M. Напомним, что серологическая диагностика данного заболевания обязательно должна включать в себя исследование антител к париетальным клеткам желудка, коррелирующим с воспалительным процессом в СОЖ. Париетальные клетки расположены исключительно в железах тела и дна желудка. Они вырабатывают соляную кислоту и внутренний фактор Кастла при стимуляции гастрином и гистамином, продуцируемых G-клетками и энтерохромаффиноподобными клетками (ECL) соответственно [8]. По результатам исследования титр антител был повышен и составил 1:10240 при референсных значениях <1:40. Чувствительность данного метода составляет ~80%, специфичность ~72% [4, 9]. При морфологическом исследовании биоптатов СОЖ у пациентов с повышенным титром антител к париетальным клеткам желудка наиболее часто определяется умеренная и средняя степень атрофии слизистой оболочки с развитием кишечной метаплазии [6, 10, 11].
Для уточнения диагноза при обращении за медицинской помощью пациентка была направлена на ЭГДС. Время эндоскопического исследования составило
25 минут. Исследование было выполнено в белом свете (White Light Endoscopy, WLE), в узкоспектральном режиме Narrow Band Imaging (NBI) и с использованием режима Near Focus. Следует отметить, что сейчас в диагностике кишечной метаплазии СОЖ прибегают к использованию узкоспектральной эндоскопии (NBI), разработанной компанией Olympus (Япония). Принцип технологии NBI состоит в исключении из испускаемого эндоскопом света красной составляющей, что позволяет оценивать архитектонику ямок в сине-зеленой части спектра. Такой подход позволяет с достаточной эффективностью выявлять кишечную метаплазию СОЖ при ЭГДС. По данным Р.А. Гагаева и соавт., точность режима NBI в диагностике метапластических изменений эпителия СОЖ составляет 82% [12].
В ходе исследования выявлены следующие изменения: слизистая оболочка в теле желудка диффузно-бледная, истончена, хорошо прослеживаются сосуды подслизистого слоя. Складки сглажены, при минимальной инсуфляции воздухом полностью исчезают. По большой кривизне тела желудка определяются гиперплазированные остаточные области кислотопродуцирующей слизистой оболочки в виде продольных полос (рис. 1, 2).
В узкоспектральном режиме NBI на границе тела и антрального отдела желудка, как и по малой кривизне с переходом на переднюю, заднюю стенки и по большой кривизне, прослеживается зеркальная (реверсивная) линия атрофии – атрофия тела желудка и практически нормальная слизистая антрального отдела (рис. 3). При неатрофическом гастрите, ассоциированном с H. pylori, эндоскопическая картина диаметрально противоположна. В отличие от гастрита, вызванного H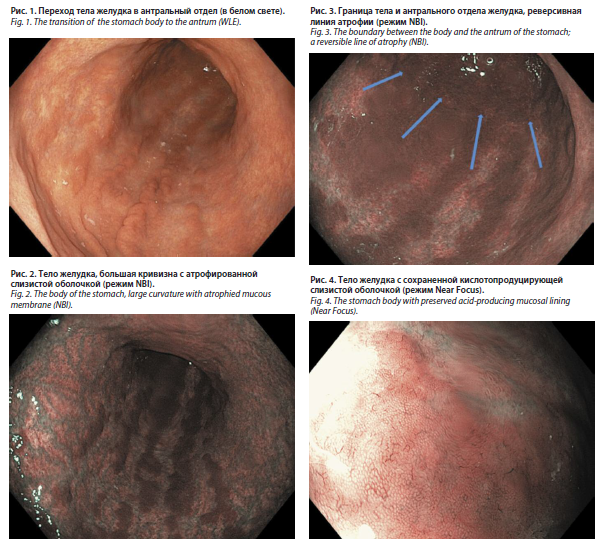
. p
p
ylori, воспаление и атрофия при АИГ ограничены телом и дном желудка. Это связано с тем, что аутоиммунная реакция при АИГ нацелена на париетальные клетки, расположенные именно там [13, 14].
При использовании режима Near Focus структура слизистой изменена вследствие ее истончения. Устья желез визуализируются не в виде кружочков, а в виде вытянутых овальных структур. Собирательные венулы не определяются. Встречаются очаги фовеолярной гиперплазии, вокруг которой участки слизистой с разрушенным рисунком эпителия, измененным микрососудистым рисунком и очагами светло-голубого свечения Light Blue Crests (LBC) – один из патогномоничных признаков кишечной метаплазии (рис. 4).
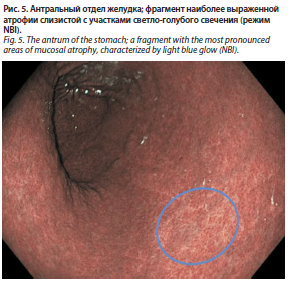
В антральном отделе желудка слизистая незначительно очагово истончена и очагово гиперемирована, отечна, имеет мозаичный рисунок (белесоватые очаги с усиленным сосудистым рисунком, частично лишенные ямок с участками светло-голубого свечения, возможно, кишечной метаплазии), до 3–5% слизистой с атрофированными железами (рис. 5).
Заключение ЭГДС: аутоиммунный гастрит с атрофией слизистой оболочки тела желудка. Пациенты с АИГ, как и лица с хроническим воспалением, имеют более высокий риск развития рака желудка. Согласно каскаду Correa, основным состоянием, предшествующим раку, является кишечная метаплазия, которая определяется как очаговая трансформация нормальных эпителиоцитов СОЖ в абсорбтивные эпителиальные клетки кишечного типа и бокаловидные клетки в момент клеточного обновления [15, 16]. Эндоскопия в процессе исследования СОЖ по малой кривизне с переходом на переднюю и заднюю стенки, большую кривизну предполагает поиск нейроэндокринной опухоли GI (НЭО G1) вследствие закономерных патофизиологических процессов при АИГ, его переходе в хронический атрофический гастрит с гиперплазией энтерохромаффиноподобных клеток и аденокарциному [8, 13, 17]. По данным исследований, аутоиммунный метапластический атрофический гастрит в
3 раза повышает риск развития аденокарциномы, в
13 раз – риск карциноидов, а нейроэндокринные опухоли G1 развиваются в среднем у 1–12% больных [18, 19]. Сама кишечная метаплазия в желудке никогда не малигнизируется, процесс происходит вокруг или рядом с участками светло-голубого свечения (рис. 5) с поэтапным преобразованием дисплазии в аденокарциному. Микрососудистый рисунок, визуализированный с помощью увеличительной эндоскопии Near Focus, – надежный маркер для дифференциации доброкачественных и злокачественных поражений СОЖ. При выявлении нерегулярности или бесструктурности микрососудистого рисунка, рисунка поверхности выполняется биопсия.
У пациентки был выявлен несколько усиленный, утолщенный микрососудистый рисунок, соответствующий воспалительным, а не неопластическим изменениям (регулярный микрососудистый рисунок, бесструктурность отсутствует) (см. рис. 4). Биопсия выполнена в верхней трети тела желудка по малой кривизне и в верхней трети тела желудка по передней стенке. «Золотым стандартом» диагностики АИГ является гастроскопия с биопсией из антрального отдела и тела желудка [9, 20]. Сегодня более широко используется эндоскопическая оценка распространенности атрофии СОЖ по Кимура–Такемото [21–24], по модифицированной шкале EGA [25], а также эндоскопическая оценка выраженности кишечной метаплазии по шкале EGGIM [26]. В данном случае биопсия согласно стандартам классификации системы стадирования OLGA (Operative Link for Gastritis Assessment) [27, 28] не имеет существенного значения, так как во время ЭГДС с использованием NBI, Near Focus выраженная атрофия слизистой оболочки в антральном отделе желудка условно отсутствовала, но была зафиксирована выраженная атрофированная СОЖ в участках, описанных выше. Результаты визуализации в режиме NBI демонстрируют высокое соответствие с результатами гистологического исследования СОЖ, превосходя осмотр в белом свете. Точность диагностики выше 90% предполагает, что рутинное использование NBI позволяет проводить целенаправленную, а не случайную биопсию образцов, а оценка по шкале EGGIM позволяет немедленно определить степень кишечной метаплазии без биопсии [26]. Следовательно, целесообразно взятие биоматериала только из тела желудка и прицельной биопсии из патологических участков.
В результате гистологического исследования двух биопсийных фрагментов ткани СОЖ выявлены атрофия, очаговая гиперплазия покровно-ямочного эпителия со слабо выраженным лимфоцитарно-макрофагальным воспалительным инфильтратом с примесью нейтрофилов, фокусы полной кишечной метаплазии, слабый очаговый фиброз собственной пластинки. Отметим, что данные биопсии могут оказаться неспецифичными и должны быть сопоставлены с клиникой и серологией.
В соответствии с рекомендациями Европейского общества по нейроэндокринным опухолям (ENETS) хромогранин А (ХгА) считают обязательным маркером биохимического обследования больных в целях диагностики, мониторинга и прогноза НЭО [29, 30]. По результату исследования крови пациентки на хромогранин А – незначительное превышение значения до
4,1 нмоль/л (референсные значения лаборатории
<3,0 нмоль/л). Данный показатель станет отправной точкой ежегодного мониторинга уровня хромогранина А для пациентки [31]. Проблема стандартизации метода определения ХгА до сих пор не решена. Это может быть связано с использованием различных тест-систем, разработанных на основе моно- или поликлональных антител с разной аналитической чувствительностью и специфичностью, что приводит к вариабельности получаемых результатов [32].
Хроническое воспаление приводит к атрофии слизистой оболочки с уменьшением и окончательной потерей париетальных клеток во время прогрессирования заболевания, что приводит к повышению рН желудка и потере внутреннего фактора Кастла [14]. Определение повышенного титра антител к внутреннему фактору Кастла, как и антител к париетальным клеткам желудка, – важный критерий серологической диагностики аутоиммунного гастрита, порой предшествующего клиническим проявлениям. Результат анализа крови на антитела класса IgG к внутреннему фактору Кастла составил 0,6 МЕ/мл, не превысив референсные значения
(<6 МЕ/мл). Исследование обладает 99% специфичностью, но низкой чувствительностью ~50–60%, которая повышается по мере прогрессирования АИГ [4, 9, 33].
В связи с тем, что внутренний фактор Кастла необходим для усвоения витамина В12, его дефицит (пернициозная анемия) является следствием АИГ и обычно возникает на более поздних стадиях заболевания [7, 8, 14]. Кроме того, при АИГ часто отмечается недостаток железа. Около 25–50% пациентов страдают микроцитарной гипохромной анемией из-за неэффективной резорбции железа, следовательно, особенно важно при данном диагнозе обращать внимание на уровни ферритина, трансферрина, насыщения трансферрином [6]. Поэтому необходимо исследовать показатели общего клинического анализа и биохимического анализа крови. Результаты обследования пациентки находились в пределах референсных значений на момент последнего обращения за медицинской помощью.
Таким образом, имеются результаты всех необходимых исследований, подтверждающих клинический диагноз «аутоиммунный атрофический гастрит».
Лечение и тактика ведения пациентки
Пациентке рекомендована общепринятая диета при гастритах с пониженной кислотностью желудка, обеспечивающая отсутствие механического раздражения СОЖ, но способствующая стимуляции его секреторной активности. Целесообразно принимать меньшее количество пищи, равномерно распределенное в течение дня, включать в рацион пищу, богатую злаками, овощами и фруктами, и исключить употребление продуктов с высоким содержанием белка. В фазе обострения хронического АИГ рекомендуется диета № 1а, обеспечивающая функциональное, механическое, термическое и химическое щажение СОЖ. По мере ликвидации воспаления больным хроническим АИГ показана постепенно нарастающая стимуляция функциональных желез. Для этого назначают диету № 2 с целью механического щажения желудка с сохранением химических раздражителей [2].
Для купирования симптомов диспепсии и потенцирования защитных свойств слизистой оболочки пациентке был назначен Ребамипид 100 мг 3 раза в сутки курсами по 8 недель 3–4 раза в год. Ребамипид увеличивает содержание слизи в слизистой оболочке желудочно-кишечного тракта, повышает ее барьерную функцию, улучшает кровоснабжение, а также регенерацию эпителиальных клеток. В рандомизированных контролируемых исследованиях на фоне терапии ребамипидом было показано уменьшение воспаления и снижение степени кишечной метаплазии и дисплазии низкой степени, что способствует профилактике рака желудка у пациентов высокого риска [9].
Ингибиторы протонной помпы не были рекомендованы по причине уже существующей гипохлоргидрии [34].
Для повышения кислотности желудочного сока и улучшения пищеварения в желудке назначен Ацидин-пепсин по 2 таблетки (500 мг) 3–4 раза в день во время или после еды, предварительно растворив в 100 мл воды. Пепсин – один из основных протеолитических ферментов пищеварительного тракта. Вырабатываясь в клетках слизистой оболочки желудка в неактивной форме (как профермент пепсиноген), который в желудочном содержимом превращается в активный фермент, пепсин действует на начальном этапе переваривания белков в пищеварительном тракте. В случае повышения рН активность пепсина снижается, а при рН более 6,0 – прекращается.
Пациентке даны рекомендации по необходимому динамическому мониторингу следующих исследований для исключения возможного прогрессирования аутоиммунного атрофического гастрита и появления его осложнений:
1) общий клинический анализ крови и биохимический анализ крови (включая железо, ферритин, витамин B12) каждые полгода;
2) исследование серологических биомаркеров ГастроПанель® 1 раз в год;
3) анализ на хромогранин А 1 раз в год;
4) ЭГДС 1 раз в 3 года с взятием биопсии из тела желудка (при необходимости – и из антрального отдела).
Заключение
Представленный клинический случай показывает, что ведение пациентов с аутоиммунным атрофическим гастритом требует индивидуального подхода. Выявление данного заболевания важно для своевременного предупреждения осложнений АИГ. После лечения пациентка стала наблюдать значительное улучшение самочувствия и исчезновение практически всех клинических проявлений. В связи с возможными рисками развития основных осложнений, таких как нейроэндокринные опухоли G1, аденокарцинома желудка, железодефицитная и В12-дефицитная анемии, больным необходимо пожизненное динамическое наблюдение.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Дехнич Наталья Николаевна – д-р мед. наук, проф. каф. факультетской терапии, проректор по дополнительному профессиональному образованию и развитию регионального здравоохранения, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: n.dekhnich@mail.ru; ORCID: 0000-0002-6144-3919
Natalya N. Dekhnich – D. Sci. (Med.), Prof. Smolensk State Medical University. E-mail: n.dekhnich@mail.ru;
ORCID: 0000-0002-6144-3919
Кирсов Павел Павлович – врач-эндоскопист эндоскопического отделения, ОГБУЗ «Смоленская областная клиническая больница». E-mail: dolphin-67@mail.ru
Pavel Р. Kirsov – Endoscopist, Smolensk Regional Clinical Hospital. E-mail: dolphin-67@mail.ru
Сысоева Инна Александровна – студентка V курса лечебного факультета, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: inna.sysoeva2014@yandex.ru
Inna A. Sysoeva – 5th year student of the Faculty
of Medicine of the Smolensk State Medical University.
E-mail: inna.sysoeva2014@yandex.ru
Гайдайчук Анастасия Сергеевна – студентка V курса лечебного факультета, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: cantabile.note@mail.ru
Anastasiia S. Gaidaichuk – 5th year student of the Faculty
of Medicine of the Smolensk State Medical University.
E-mail: cantabile.note@mail.ru
Поступила в редакцию: 03.06.2024
Поступила после рецензирования: 14.06.2024
Принята к публикации: 20.06.2024
Received: 03.06.2024
Revised: 14.06.2024
Accepted: 20.06.2024
Clinical case of autoimmune atrophic gastritis
Natalya N. Dekhnich1, Pavel Р. Kirsov2, Inna A. Sysoeva1, Anastasiia S. Gaidaichuk1
1 Smolensk State Medical University, Smolensk, Russia;
2 Smolensk Regional Clinical Hospital, Smolensk, Russia
n.dekhnich@mail.ru
Abstract
The article presents a clinical case of a 62-year-old female patient with a diagnosis of autoimmune atrophic gastritis, who has been troubled by symptoms of dyspepsia for 5 years. In October 2019, she was diagnosed non-atrophic gastritis associated with Helicobacter pylori, anti-Helicobacter pylori therapy was performed, but the symptoms of the disease continued to bother. This article presents key studies that identify
autoimmune atrophic gastritis. The characteristic endoscopic signs of this disease and the current treatment tactics are described. Autoimmune gastritis is a chronic autoimmune disease with an insufficiently studied etiology. Many questions concerning of this nosology remain open to new researches.
Keywords: autoimmune gastritis, pernicious anemia, iron deficiency anemia, neuroendocrine tumors, adenocarcinoma, endoscopy.
For citation: Dekhnich N.N., Kirsov P.Р., Sysoeva I.A., Gaidaichuk A.S. Clinical case of autoimmune atrophic gastritis. Clinical review for
general practice. 2024; 5 (6): 6–11 (In Russ.). DOI: 10.47407/kr2024.5.6.00427
Жалобы
Пациентка В., 62 лет, обратилась к гастроэнтерологу с жалобами на дискомфорт в эпигастральной области по срединной линии живота, возникающий после переедания, приема жареной и острой пищи.
Важная особенность клинической картины: пациентка не наблюдала болевых ощущений в эпигастрии. В отличие от других типов гастрита, симптомы, связанные с аутоиммунным гастритом (АИГ), например боль в эпигастральной области, не являются ведущими [1, 2].
Анамнез заболевания
Пациентка считает себя больной около 5 лет (с октября 2019 г.), когда на фоне общего благополучия появился дискомфорт в эпигастрии после переедания, приема жареной и острой пищи. После обращения к участковому терапевту больная была направлена на консультацию к гастроэнтерологу. Назначен комплекс обследований. По результатам эзофагогастродуоденоскопии (ЭГДС) выявлен поверхностный гастрит. Результат анализа крови на антитела класса IgG к H. Pylori был положительный (1,3 Ед/мл, референсные значения
<0,9 Ед/мл). На основании жалоб, анамнеза, данных лабораторного и инструментального обследований был поставлен диагноз «неатрофический (поверхностный) гастрит, ассоциированный с H. Pylori». Проведена эрадикационная терапия первой линии: эзомепразол
20 мг 2 раза в сутки, кларитромицин 500 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки, висмута трикалия дицитрат 240 мг 2 раза в сутки в течение 10 дней, которую больная успешно завершила, однако улучшения клинической симптоматики не последовало.
Симптомы диспепсии продолжали беспокоить пациентку, и через год она повторно обратилась к гастроэнтерологу по месту жительства. Назначено комплексное исследование серологических биомаркеров, применяемое для косвенной неинвазивной оценки состояния слизистой оболочки желудка – ГастроПанель® [3]. По результатам исследования наблюдалась нормализация уровня антител класса IgG к H. pylori – 24 Eд (референсные значения <30 Eд); снижение уровня пепсиногена I – 15 мкг/л (30–160 мкг/л); пепсиноген II в пределах нормы – 8 мкг/л (3–15 мкг/л); снижение показателя соотношения пепсиноген I / пепсиноген II – 1,9
(3–20); резкое повышение уровней гастрина-17b (базальный) – 37,2 пмоль/л (1,00–7,00 пмоль/л) и гастрина-17s (стимулированный) >40 пмоль/л (3–30 пмоль/л). Секреторная деятельность желудка и кислотность были снижены. Полученные данные свидетельствовали об атрофии слизистой оболочки желудка (СОЖ), возможно, вследствие перенесенного инфицирования H. pylori, которое могло быть триггером развития аутоиммунного атрофического гастрита посредством процессов молекулярной мимикрии, повреждения эндотелия клеток, образования суперантигенов и микрохимеризма [4, 5].
Как известно, ГастроПанель® является скрининговым методом для выявления атрофического гастрита до проведения ЭГДС. Результаты данного исследования также заставляют задуматься о гастрите аутоиммунной этиологии. Понимание патогенеза АИГ затруднено по нескольким причинам: 1) распространенность заболевания относительно невелика; 2) во многих случаях имеет место сопутствующий гастрит, вызванный H. pylori; 3) на ранних стадиях заболевания проявления отсутствуют или минимальны [6, 7].
Для уточнения диагноза пациентка была направлена на повторное эндоскопическое исследование, где выявлен атрофический гастрит. В результатах биопсии четырех фрагментов ткани СОЖ описана картина хронического слабо выраженного неактивного гастрита с фокусами дисрегенерации желез, со слабо выраженным диффузно расположенным лимфоцитарно-макрофагальным воспалительным инфильтратом и умеренно выраженным фиброзом собственной пластинки, участками полной кишечной метаплазии, атрофии, H. pylori не обнаружено.
Анамнез жизни
Пациентка имеет высшее образование. Работает ведущим инженером-испытателем, профессиональных вредностей не имеет. Не курит. Алкоголем не злоупотребляет. Травмы, операции отрицает. Аллергологический и наследственный анамнезы не отягощены.
Данные объективного обследования
Общее состояние удовлетворительное. Рост 163 см, масса тела 54 кг, индекс массы тела 20,32 кг/м2. Кожные покровы телесного цвета, чистые. Периферических отеков нет. При аускультации дыхание везикулярное, хрипов нет. Тоны сердца ритмичные, звучные. Частота сердечных сокращений 70 в минуту. Артериальное давление 130/70 мм рт. ст. Живот при пальпации мягкий, безболезненный. Печень не выступает из-под края реберной дуги. Селезенка не пальпируется.
Дополнительные методы исследования
Учитывая жалобы и анамнез заболевания, с целью исключения аутоиммунного атрофического гастрита пациентке было рекомендовано сдать анализ крови на антитела к париетальным клеткам желудка классов IgG+A+M. Напомним, что серологическая диагностика данного заболевания обязательно должна включать в себя исследование антител к париетальным клеткам желудка, коррелирующим с воспалительным процессом в СОЖ. Париетальные клетки расположены исключительно в железах тела и дна желудка. Они вырабатывают соляную кислоту и внутренний фактор Кастла при стимуляции гастрином и гистамином, продуцируемых G-клетками и энтерохромаффиноподобными клетками (ECL) соответственно [8]. По результатам исследования титр антител был повышен и составил 1:10240 при референсных значениях <1:40. Чувствительность данного метода составляет ~80%, специфичность ~72% [4, 9]. При морфологическом исследовании биоптатов СОЖ у пациентов с повышенным титром антител к париетальным клеткам желудка наиболее часто определяется умеренная и средняя степень атрофии слизистой оболочки с развитием кишечной метаплазии [6, 10, 11].
Для уточнения диагноза при обращении за медицинской помощью пациентка была направлена на ЭГДС. Время эндоскопического исследования составило
25 минут. Исследование было выполнено в белом свете (White Light Endoscopy, WLE), в узкоспектральном режиме Narrow Band Imaging (NBI) и с использованием режима Near Focus. Следует отметить, что сейчас в диагностике кишечной метаплазии СОЖ прибегают к использованию узкоспектральной эндоскопии (NBI), разработанной компанией Olympus (Япония). Принцип технологии NBI состоит в исключении из испускаемого эндоскопом света красной составляющей, что позволяет оценивать архитектонику ямок в сине-зеленой части спектра. Такой подход позволяет с достаточной эффективностью выявлять кишечную метаплазию СОЖ при ЭГДС. По данным Р.А. Гагаева и соавт., точность режима NBI в диагностике метапластических изменений эпителия СОЖ составляет 82% [12].
В ходе исследования выявлены следующие изменения: слизистая оболочка в теле желудка диффузно-бледная, истончена, хорошо прослеживаются сосуды подслизистого слоя. Складки сглажены, при минимальной инсуфляции воздухом полностью исчезают. По большой кривизне тела желудка определяются гиперплазированные остаточные области кислотопродуцирующей слизистой оболочки в виде продольных полос (рис. 1, 2).
В узкоспектральном режиме NBI на границе тела и антрального отдела желудка, как и по малой кривизне с переходом на переднюю, заднюю стенки и по большой кривизне, прослеживается зеркальная (реверсивная) линия атрофии – атрофия тела желудка и практически нормальная слизистая антрального отдела (рис. 3). При неатрофическом гастрите, ассоциированном с H. pylori, эндоскопическая картина диаметрально противоположна. В отличие от гастрита, вызванного H

.
 p
pylori, воспаление и атрофия при АИГ ограничены телом и дном желудка. Это связано с тем, что аутоиммунная реакция при АИГ нацелена на париетальные клетки, расположенные именно там [13, 14].
При использовании режима Near Focus структура слизистой изменена вследствие ее истончения. Устья желез визуализируются не в виде кружочков, а в виде вытянутых овальных структур. Собирательные венулы не определяются. Встречаются очаги фовеолярной гиперплазии, вокруг которой участки слизистой с разрушенным рисунком эпителия, измененным микрососудистым рисунком и очагами светло-голубого свечения Light Blue Crests (LBC) – один из патогномоничных признаков кишечной метаплазии (рис. 4).
В антральном отделе желудка слизистая незначительно очагово истончена и очагово гиперемирована, отечна, имеет мозаичный рисунок (белесоватые очаги с усиленным сосудистым рисунком, частично лишенные ямок с участками светло-голубого свечения, возможно, кишечной метаплазии), до 3–5% слизистой с атрофированными железами (рис. 5).
Заключение ЭГДС: аутоиммунный гастрит с атрофией слизистой оболочки тела желудка. Пациенты с АИГ, как и лица с хроническим воспалением, имеют более высокий риск развития рака желудка. Согласно каскаду Correa, основным состоянием, предшествующим раку, является кишечная метаплазия, которая определяется как очаговая трансформация нормальных эпителиоцитов СОЖ в абсорбтивные эпителиальные клетки кишечного типа и бокаловидные клетки в момент клеточного обновления [15, 16]. Эндоскопия в процессе исследования СОЖ по малой кривизне с переходом на переднюю и заднюю стенки, большую кривизну предполагает поиск нейроэндокринной опухоли GI (НЭО G1) вследствие закономерных патофизиологических процессов при АИГ, его переходе в хронический атрофический гастрит с гиперплазией энтерохромаффиноподобных клеток и аденокарциному [8, 13, 17]. По данным исследований, аутоиммунный метапластический атрофический гастрит в
3 раза повышает риск развития аденокарциномы, в
13 раз – риск карциноидов, а нейроэндокринные опухоли G1 развиваются в среднем у 1–12% больных [18, 19]. Сама кишечная метаплазия в желудке никогда не малигнизируется, процесс происходит вокруг или рядом с участками светло-голубого свечения (рис. 5) с поэтапным преобразованием дисплазии в аденокарциному. Микрососудистый рисунок, визуализированный с помощью увеличительной эндоскопии Near Focus, – надежный маркер для дифференциации доброкачественных и злокачественных поражений СОЖ. При выявлении нерегулярности или бесструктурности микрососудистого рисунка, рисунка поверхности выполняется биопсия.
У пациентки был выявлен несколько усиленный, утолщенный микрососудистый рисунок, соответствующий воспалительным, а не неопластическим изменениям (регулярный микрососудистый рисунок, бесструктурность отсутствует) (см. рис. 4). Биопсия выполнена в верхней трети тела желудка по малой кривизне и в верхней трети тела желудка по передней стенке. «Золотым стандартом» диагностики АИГ является гастроскопия с биопсией из антрального отдела и тела желудка [9, 20]. Сегодня более широко используется эндоскопическая оценка распространенности атрофии СОЖ по Кимура–Такемото [21–24], по модифицированной шкале EGA [25], а также эндоскопическая оценка выраженности кишечной метаплазии по шкале EGGIM [26]. В данном случае биопсия согласно стандартам классификации системы стадирования OLGA (Operative Link for Gastritis Assessment) [27, 28] не имеет существенного значения, так как во время ЭГДС с использованием NBI, Near Focus выраженная атрофия слизистой оболочки в антральном отделе желудка условно отсутствовала, но была зафиксирована выраженная атрофированная СОЖ в участках, описанных выше. Результаты визуализации в режиме NBI демонстрируют высокое соответствие с результатами гистологического исследования СОЖ, превосходя осмотр в белом свете. Точность диагностики выше 90% предполагает, что рутинное использование NBI позволяет проводить целенаправленную, а не случайную биопсию образцов, а оценка по шкале EGGIM позволяет немедленно определить степень кишечной метаплазии без биопсии [26]. Следовательно, целесообразно взятие биоматериала только из тела желудка и прицельной биопсии из патологических участков.
В результате гистологического исследования двух биопсийных фрагментов ткани СОЖ выявлены атрофия, очаговая гиперплазия покровно-ямочного эпителия со слабо выраженным лимфоцитарно-макрофагальным воспалительным инфильтратом с примесью нейтрофилов, фокусы полной кишечной метаплазии, слабый очаговый фиброз собственной пластинки. Отметим, что данные биопсии могут оказаться неспецифичными и должны быть сопоставлены с клиникой и серологией.
В соответствии с рекомендациями Европейского общества по нейроэндокринным опухолям (ENETS) хромогранин А (ХгА) считают обязательным маркером биохимического обследования больных в целях диагностики, мониторинга и прогноза НЭО [29, 30]. По результату исследования крови пациентки на хромогранин А – незначительное превышение значения до
4,1 нмоль/л (референсные значения лаборатории
<3,0 нмоль/л). Данный показатель станет отправной точкой ежегодного мониторинга уровня хромогранина А для пациентки [31]. Проблема стандартизации метода определения ХгА до сих пор не решена. Это может быть связано с использованием различных тест-систем, разработанных на основе моно- или поликлональных антител с разной аналитической чувствительностью и специфичностью, что приводит к вариабельности получаемых результатов [32].
Хроническое воспаление приводит к атрофии слизистой оболочки с уменьшением и окончательной потерей париетальных клеток во время прогрессирования заболевания, что приводит к повышению рН желудка и потере внутреннего фактора Кастла [14]. Определение повышенного титра антител к внутреннему фактору Кастла, как и антител к париетальным клеткам желудка, – важный критерий серологической диагностики аутоиммунного гастрита, порой предшествующего клиническим проявлениям. Результат анализа крови на антитела класса IgG к внутреннему фактору Кастла составил 0,6 МЕ/мл, не превысив референсные значения
(<6 МЕ/мл). Исследование обладает 99% специфичностью, но низкой чувствительностью ~50–60%, которая повышается по мере прогрессирования АИГ [4, 9, 33].
В связи с тем, что внутренний фактор Кастла необходим для усвоения витамина В12, его дефицит (пернициозная анемия) является следствием АИГ и обычно возникает на более поздних стадиях заболевания [7, 8, 14]. Кроме того, при АИГ часто отмечается недостаток железа. Около 25–50% пациентов страдают микроцитарной гипохромной анемией из-за неэффективной резорбции железа, следовательно, особенно важно при данном диагнозе обращать внимание на уровни ферритина, трансферрина, насыщения трансферрином [6]. Поэтому необходимо исследовать показатели общего клинического анализа и биохимического анализа крови. Результаты обследования пациентки находились в пределах референсных значений на момент последнего обращения за медицинской помощью.
Таким образом, имеются результаты всех необходимых исследований, подтверждающих клинический диагноз «аутоиммунный атрофический гастрит».
Лечение и тактика ведения пациентки
Пациентке рекомендована общепринятая диета при гастритах с пониженной кислотностью желудка, обеспечивающая отсутствие механического раздражения СОЖ, но способствующая стимуляции его секреторной активности. Целесообразно принимать меньшее количество пищи, равномерно распределенное в течение дня, включать в рацион пищу, богатую злаками, овощами и фруктами, и исключить употребление продуктов с высоким содержанием белка. В фазе обострения хронического АИГ рекомендуется диета № 1а, обеспечивающая функциональное, механическое, термическое и химическое щажение СОЖ. По мере ликвидации воспаления больным хроническим АИГ показана постепенно нарастающая стимуляция функциональных желез. Для этого назначают диету № 2 с целью механического щажения желудка с сохранением химических раздражителей [2].
Для купирования симптомов диспепсии и потенцирования защитных свойств слизистой оболочки пациентке был назначен Ребамипид 100 мг 3 раза в сутки курсами по 8 недель 3–4 раза в год. Ребамипид увеличивает содержание слизи в слизистой оболочке желудочно-кишечного тракта, повышает ее барьерную функцию, улучшает кровоснабжение, а также регенерацию эпителиальных клеток. В рандомизированных контролируемых исследованиях на фоне терапии ребамипидом было показано уменьшение воспаления и снижение степени кишечной метаплазии и дисплазии низкой степени, что способствует профилактике рака желудка у пациентов высокого риска [9].
Ингибиторы протонной помпы не были рекомендованы по причине уже существующей гипохлоргидрии [34].
Для повышения кислотности желудочного сока и улучшения пищеварения в желудке назначен Ацидин-пепсин по 2 таблетки (500 мг) 3–4 раза в день во время или после еды, предварительно растворив в 100 мл воды. Пепсин – один из основных протеолитических ферментов пищеварительного тракта. Вырабатываясь в клетках слизистой оболочки желудка в неактивной форме (как профермент пепсиноген), который в желудочном содержимом превращается в активный фермент, пепсин действует на начальном этапе переваривания белков в пищеварительном тракте. В случае повышения рН активность пепсина снижается, а при рН более 6,0 – прекращается.
Пациентке даны рекомендации по необходимому динамическому мониторингу следующих исследований для исключения возможного прогрессирования аутоиммунного атрофического гастрита и появления его осложнений:
1) общий клинический анализ крови и биохимический анализ крови (включая железо, ферритин, витамин B12) каждые полгода;
2) исследование серологических биомаркеров ГастроПанель® 1 раз в год;
3) анализ на хромогранин А 1 раз в год;
4) ЭГДС 1 раз в 3 года с взятием биопсии из тела желудка (при необходимости – и из антрального отдела).
Заключение
Представленный клинический случай показывает, что ведение пациентов с аутоиммунным атрофическим гастритом требует индивидуального подхода. Выявление данного заболевания важно для своевременного предупреждения осложнений АИГ. После лечения пациентка стала наблюдать значительное улучшение самочувствия и исчезновение практически всех клинических проявлений. В связи с возможными рисками развития основных осложнений, таких как нейроэндокринные опухоли G1, аденокарцинома желудка, железодефицитная и В12-дефицитная анемии, больным необходимо пожизненное динамическое наблюдение.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Дехнич Наталья Николаевна – д-р мед. наук, проф. каф. факультетской терапии, проректор по дополнительному профессиональному образованию и развитию регионального здравоохранения, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: n.dekhnich@mail.ru; ORCID: 0000-0002-6144-3919
Natalya N. Dekhnich – D. Sci. (Med.), Prof. Smolensk State Medical University. E-mail: n.dekhnich@mail.ru;
ORCID: 0000-0002-6144-3919
Кирсов Павел Павлович – врач-эндоскопист эндоскопического отделения, ОГБУЗ «Смоленская областная клиническая больница». E-mail: dolphin-67@mail.ru
Pavel Р. Kirsov – Endoscopist, Smolensk Regional Clinical Hospital. E-mail: dolphin-67@mail.ru
Сысоева Инна Александровна – студентка V курса лечебного факультета, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: inna.sysoeva2014@yandex.ru
Inna A. Sysoeva – 5th year student of the Faculty
of Medicine of the Smolensk State Medical University.
E-mail: inna.sysoeva2014@yandex.ru
Гайдайчук Анастасия Сергеевна – студентка V курса лечебного факультета, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: cantabile.note@mail.ru
Anastasiia S. Gaidaichuk – 5th year student of the Faculty
of Medicine of the Smolensk State Medical University.
E-mail: cantabile.note@mail.ru
Поступила в редакцию: 03.06.2024
Поступила после рецензирования: 14.06.2024
Принята к публикации: 20.06.2024
Received: 03.06.2024
Revised: 14.06.2024
Accepted: 20.06.2024
16 августа 2024
Количество просмотров: 534
