Клинический разбор в общей медицине №6 2024
Аннотация
Актуальность. За последнее десятилетие перкутанная нефролитотрипсия (ПНЛ) стала одним из самых популярных методов лечения мочекаменной болезни по причине высокой эффективности метода в сочетании с низкой частотой осложнений и сокращением сроков госпитализации. Однако влияние ПНЛ на функцию почек изучено недостаточно.
Целью настоящего исследования стала оценка изменений ренальной гемодинамики и функции почек в раннем послеоперационном периоде, вызванных применением ПНЛ.
Материал и методы. Проанализированы клинические данные 18 пациентов, подвергшихся ПНЛ. Всем пациентам до и после ПНЛ проводили определение уровня креатинина в сыворотке крови, ультразвуковое исследование почек с допплерографией почечного кровотока, рассчитывали скорость клубочковой фильтрации. Размеры, плотность конкремента и его локализацию в почке определяли с помощью компьютерной томографии.
Результаты. Средний размер конкрементов составил 224,4±38,5 мм2, средняя плотность – 1152±76 HU. Длительность хирургического вмешательства – 96,1±9,2 мин. У 7 пациентов после ПНЛ уровень креатинина снизился по сравнению с дооперационным, в то время как у остальных 11 уровень креатинина в раннем послеоперационном периоде вырос (p<0,001). Острое повреждение почек развилось у трех пациентов (16,7%): произошло повышение концентрации креатинина на 40,7±11,7 мкмоль/л по сравнению с исходным уровнем. У пациентов с улучшением и ухудшением функции почек в первые сутки после операции были выявлены однотипные изменения. Происходило повышение резистивности сосудистого русла. Это не позволяет использовать показатели допплерографии почечного кровотока в качестве прогностических предикторов нарушения функции почек. В отличие от длительности вмешательства размер камня остается главным предиктором риска острого повреждения почек после ПНЛ.
Ключевые слова: острое повреждение почек, перкутанная нефролитотрипсия, мочекаменная болезнь, креатинин, почечный кровоток.
Для цитирования: Белый Л.Е., Клочков А.В., Клочков В.В., Шмырин А.Г. Состояние ренальной гемодинамики и нарушение функции почек в первые сутки после перкутанной нефролитотрипсии. Клинический разбор в общей медицине. 2024; 5 (6): 63–68. DOI: 10. 47407/kr2024.5.6.00436
Клинический разбор в общей медицине №6 2024
Состояние ренальной гемодинамики и нарушение функции почек в первые сутки после перкутанной нефролитотрипсии
Аннотация
Актуальность. За последнее десятилетие перкутанная нефролитотрипсия (ПНЛ) стала одним из самых популярных методов лечения мочекаменной болезни по причине высокой эффективности метода в сочетании с низкой частотой осложнений и сокращением сроков госпитализации. Однако влияние ПНЛ на функцию почек изучено недостаточно.
Целью настоящего исследования стала оценка изменений ренальной гемодинамики и функции почек в раннем послеоперационном периоде, вызванных применением ПНЛ.
Материал и методы. Проанализированы клинические данные 18 пациентов, подвергшихся ПНЛ. Всем пациентам до и после ПНЛ проводили определение уровня креатинина в сыворотке крови, ультразвуковое исследование почек с допплерографией почечного кровотока, рассчитывали скорость клубочковой фильтрации. Размеры, плотность конкремента и его локализацию в почке определяли с помощью компьютерной томографии.
Результаты. Средний размер конкрементов составил 224,4±38,5 мм2, средняя плотность – 1152±76 HU. Длительность хирургического вмешательства – 96,1±9,2 мин. У 7 пациентов после ПНЛ уровень креатинина снизился по сравнению с дооперационным, в то время как у остальных 11 уровень креатинина в раннем послеоперационном периоде вырос (p<0,001). Острое повреждение почек развилось у трех пациентов (16,7%): произошло повышение концентрации креатинина на 40,7±11,7 мкмоль/л по сравнению с исходным уровнем. У пациентов с улучшением и ухудшением функции почек в первые сутки после операции были выявлены однотипные изменения. Происходило повышение резистивности сосудистого русла. Это не позволяет использовать показатели допплерографии почечного кровотока в качестве прогностических предикторов нарушения функции почек. В отличие от длительности вмешательства размер камня остается главным предиктором риска острого повреждения почек после ПНЛ.
Ключевые слова: острое повреждение почек, перкутанная нефролитотрипсия, мочекаменная болезнь, креатинин, почечный кровоток.
Для цитирования: Белый Л.Е., Клочков А.В., Клочков В.В., Шмырин А.Г. Состояние ренальной гемодинамики и нарушение функции почек в первые сутки после перкутанной нефролитотрипсии. Клинический разбор в общей медицине. 2024; 5 (6): 63–68. DOI: 10. 47407/kr2024.5.6.00436
Renal hemodynamic changes and kidney function in the first day after percutaneous nephrolithotripsy
Lev E. Belyi1, Artem V. Klochkov1,2, Vladimir V. Klochkov1, Alexander G. Shmyrin2
1 Ulyanovsk State University, Ulyanovsk, Russia;
2 Ulyanovsk Regional Clinical Center for Specialized types of Medical Care named after Honored Doctor of Russia E.M. Chuchkalov, Ulyanovsk, Russia
lbely@yandex.ru
Abstract
Background. Over the past decade, percutaneous nephrolithotripsy (PNL) has become one of the most popular treatments for urolithiasis. The reason is the high efficiency of the method in combination with a low incidence of complications and a shorter period of hospitalization. However, the effect of PNL on renal function has not been sufficiently studied.
The aim of this study was to evaluate changes in renal hemodynamics and kidney function in the early postoperative period after PNL.
Patients and Methods. The clinical data of 18 patients who underwent PNL were analyzed. Serum creatinine levels were determined in all patients before and after PNL, glomerular filtration rate was calculated, and ultrasound examination of the kidneys with dopplerography of renal blood flow was performed. The size, density of the stone and its localization in the kidney were determined using computed tomography.
Results. The average size of the stones was 224.4±38.5 mm2, the average density was 1152±76 HU. The duration of surgical intervention is 96.1±9.2 minutes. In 7 patients after PNL, creatinine levels decreased compared to preoperative, while in the remaining 11 patients, creatinine levels increased in the early postoperative period (p<0.001). Acute kidney injury developed in three patients (16.7%): there was an increase in creatinine concentration by 40.7±11.7 mcmol/l compared with the baseline level. In patients with both improved renal function on the first day after surgery and with deterioration of function, the same type of changes were revealed. There was an increase in vascular resistivity. This does not allow the use of dopplerography of renal blood flow as prognostic predictors of impaired renal function. Unlike the duration of the intervention, the size of the stone remains the main predictor of the risk of acute kidney injury after PNL.
Keywords: acute kidney injury, percutaneous nephrolithotripsy, urolithiasis, creatinine, renal blood flow.
For citation: Belyi L.E., Klochkov A.V., Klochkov V.V., Shmyrin A.G. Renal hemodynamic changes and kidney function in the first day after percutaneous nephrolithotripsy. Clinical review for general practice. 2024; 5 (6): 63–68 (In Russ.). DOI: 10.47407/kr2024.5.6.00436
Введение
Не вызывает сомнений, что активное внедрение эндоскопических методов хирургического лечения мочекаменной болезни (МКБ) – одно из величайших и важных достижений в урологической практике за последние 50 лет. Среди обширного арсенала эндоурологических методов лечения нефролитиаза перкутанная нефролитотрипсия (ПНЛ) является одной из наиболее часто используемых эндоскопических процедур [1, 2]. Причины популярности ПНЛ – высокая эффективность метода в сочетании с низкой частотой осложнений и сокращением сроков госпитализации вследствие малоинвазивности [3]. Рецидивирующий характер течения МКБ часто диктует необходимость выполнения повторных вмешательств, поэтому при выборе метода хирургического лечения первостепенное значение имеет обеспечение сохранности функции почек [4]. Известно, что урологические пациенты входят в группу высокого риска развития острого повреждения почек (ОПП) вследствие обструктивных уропатий, уросепсиса, а также нарушения функции почек, возникающего в ряде случаев после хирургических вмешательств [5]. Однако систематические обзоры и метаанализы последних лет, посвященные оценке эффективности и безопасности эндоурологических методов и в том числе ПНЛ, прежде всего были сосредоточены на возможностях достижения stone-free статуса и таких послеоперационных осложнениях, как кровотечение и инфекция [6]. Существуют лишь отдельные сообщения о возможном влиянии тех или иных эндоурологических процедур на функцию почек. Очевидно, это связано с тем, что малоинвазивные эндоурологические операции в большинстве случаев завершаются успешно, пациенты покидают клинику в тот же или в первый послеоперационный день, а функция почек обычно не контролируется даже в течение первой послеоперационной недели [7]. В то же время ОПП, развившееся в послеоперационном периоде, – грозное осложнение, наблюдающееся у 6,7–38,2% урологических пациентов [5].
Целью настоящего исследования стала оценка изменений ренальной гемодинамики и функции почек в раннем послеоперационном периоде, вызванных применением ПНЛ.
Материалы и методы исследования
В исследовании участвовала группа пациентов, страдающих МКБ и проходивших лечение в ГУЗ «Ульяновский областной клинический центр специализированных видов медицинской помощи». Всем пациентам была проведена ПНЛ, включение всех пациентов в исследование осуществлялось случайным образом. Исследование носило проспективный характер. Были проанализированы клинические данные 18 пациентов: 9 мужчин и 9 женщин в возрасте от 31 до 72 лет. Средний возраст пациентов составил 50,7±2,9 года. Конкременты, по поводу которых выполняли ПНЛ, у 4 пациентов располагались в одной из почечных чашечек, у остальных 14 пациентов диагностировали конкременты почечной лоханки. В исследовании не было пациентов с одной почкой, все имели нормальные контралатеральные почки.
Перед операцией всем пациентам провели стандартные лабораторные исследования. Исследование концентрации креатинина выполнено на автоматическом биохимическом анализаторе Beckman Coulter AU480 (США) по стандартной методике с помощью диагностических наборов реагентов фирмы Beckman. Скорость клубочковой фильтрации (СКФ) рассчитывалась с помощью CKD-EPI формулы. Хроническую болезнь почек определяли по расчетной скорости клубочковой фильтрации <60 мл/мин/1,73 м2. ОПП диагностировали, согласно рекомендациям KDIGO [8], по креатинину сыворотки и диурезу: о развитии ОПП в раннем послеоперационном периоде свидетельствовало повышение уровня креатинина в сыворотке крови, превышающее или равное 26,5 мкмоль/л (0,3 мг/дл) в течение 48 ч либо снижение диуреза до уровня, меньшего или равного
0,5 мл/кг/ч в течение 6–12 ч.
Всем пациентам перед и после ПНЛ проводили ультразвуковое исследование почек, мочеточников и мочевого пузыря с использованием ультразвукового сканера Hitachi Aloka Arietta v70. Изучение количественных параметров кровотока в междолевых артериях почек до хирургического вмешательства и в первые сутки послеоперационного периода проводили с помощью спектрального допплеровского режима. Определяли пиковую систолическую скорость кровотока – VPS, конечную диастолическую скорость кровотока – VED, на основании которых рассчитывали индекс резистивности Ri, равный отношению разности пиковой систолической и конечной диастолической скоростей кровотока к пиковой систолической скорости кровотока. Компьютерная томография почек и мочеточников без контрастного усиления выполнялась на томографе GE Lightspeed VCT (США). Плотность конкрементов оценивали по шкале Hounsfield (HU), а размер конкремента рассчитывали как произведение двух максимальных размеров камня на томограммах и выражали в мм2 [9].
Все вмешательства выполнены под эндотрахеальным наркозом в положении на спине после предварительной катетеризации ипсилатерального мочеточника с фиксацией последнего к уретральному катетеру Foley 16–18Ch. Доступ к чашечно-лоханочной системе (ЧЛС) почки осуществляли иглой Shiba 18G под рентгеноскопическим контролем. Дилатацию пункционного хода осуществляли при помощи дилататоров Amplatz 24–28 Ch с установкой кожуха Amplatz 26–30 Ch, а затем нефроскопа Richard Wolf №24–26 Ch. У всех пациентов ПНЛ выполнена с формированием одного перкутанного тракта. Для дезинтеграции конкрементов использовали гольмиевый лазер Auriga XL «Boston Scientific» в режиме литотрипсии 8–12 Гц, 1200–2500 мДж с последующей лапаксией фрагментов камня. Оперативное вмешательство завершали установкой нефростомического дренажа №16-20 Ch. Время выполнения операции измеряли с момента начала цистоскопии и катетеризации почки до момента наложения повязки. Уретральный и мочеточниковый катетеры удаляли в течение первых 24 ч после операции.
Статистическую обработку результатов и математическое моделирование проводили с использованием Microsoft Excel (MS Office`2016) и компьютерной программы Statistica 10.0 (StatSoft USA). Вычисляли средние значения, дисперсии, средние квадратические отклонения и их ошибки. Все данные представлены в виде M±m, где M – среднее арифметическое, а m – cтандартная ошибка средней арифметической. Определение значимости различий двух выборок проводили с использованием t-критерия Стьюдента. При значении р<0,05 различия считали статистически достоверными. Корреляционный анализ для двух переменных выполняли с расчетом коэффициента корреляции Спирмена. Математическое моделирование зависимостей между признаками осуществлялось с использованием методов наименьших квадратов и аппроксимации, при этом качество аппроксимации оценивали по максимуму оценки достоверности.
Результаты
Средний размер конкрементов составил 224,4±38,5 мм2, их плотность варьировала от 461 HU до 1600 HU, средняя плотность – 1152±76 HU. Длительность хирургического вмешательства – 96,1±9,2 мин. Уровень креатинина сыворотки до операции составлял 80,3±3,9 мкмоль/л, а в первые сутки после операции – 87,4±4,4 мкмоль/л (р>0,05). Среднее значение СКФ до операции составляло 91,5±4,3 мл/мин/1,73 м2, а в первые сутки после операции – 84,6±5,2 мл/мин/1,73 м2 (р>0,05). Примечательно, что у 7 пациентов после хирургического вмешательства уровень креатинина снизился по сравнению с дооперационным и составил 71,3±5,2 мкмоль/л, в то время как у остальных 11 уровень креатинина в раннем послеоперационном периоде вырос – 97,7±4,2 мкмоль/л (р<0,001). ОПП развилось у трех пациентов (16,7%): произошло повышение концентрации креатинина на 40,7±11,7 мкмоль/л по сравнению с исходным уровнем.
При исследовании почечной гемодинамики установлено достоверное увеличение VPS в междолевых артериях оперированной почки в раннем послеоперационном периоде: среднее значение VPS до хирургического вмешательства составляло 38,6±1,7 см/с, а после вмешательства – 44,4±2,2 см/с (р<0,05). Кроме этого, зафиксировано недостоверное повышение VED: до вмешательства этот показатель был 14,8±0,6 см/с, в послеоперационном периоде – 15,6±1,0 см/с (р>0,05).
 Среднее значение Ri до ПНЛ составило 0,61±0,01, а в первые сутки послеоперационного периода – 0,65±0,01 (р<0,05). Важно заметить, что в подгруппе пациентов со снижением креатинина в послеоперационном периоде Ri составил 0,65±0,02, достоверно не отличаясь от Ri в подгруппе пациентов с повышением креатинина в сыворотке крови – 0,65±0,01 (р>0,05).
Среднее значение Ri до ПНЛ составило 0,61±0,01, а в первые сутки послеоперационного периода – 0,65±0,01 (р<0,05). Важно заметить, что в подгруппе пациентов со снижением креатинина в послеоперационном периоде Ri составил 0,65±0,02, достоверно не отличаясь от Ri в подгруппе пациентов с повышением креатинина в сыворотке крови – 0,65±0,01 (р>0,05).
Был проведен корреляционный анализ с расчетом коэффициента корреляции Спирмена для определения силы и направления взаимосвязи между длительностью хирургического вмешательства и значениями Ri, уровнем креатинина в сыворотке крови и СКФ после ПНЛ. Коэффициент корреляции Спирмена между длительностью вмешательства и Ri составил 0,15, что свидетельствует о наличии слабой статистически не значимой прямой зависимости между признаками (р>0,05). Коэффициент корреляции Спирмена между длительностью вмешательства и концентрацией креатинина в сыворотке крови был равен 0,27, что также демонстрирует слабую прямую зависимость (р>0,05). Коэффициент корреляции между длительностью вмешательства и СКФ равен -0,15, что указывает на существование между признаками обратной связи слабой силы (р>0,05).
Примечательно, что при определении силы и направления связи между размером конкремента и уровнем креатинина и СКФ были получены иные результаты. Коэффициент корреляции Спирмена между размером конкремента и концентрацией креатинина составил 0,84, что свидетельствует о наличии сильной прямой связи между признаками (р<0,05). Коэффициент корреляции Спирмена между размером конкремента и значением СКФ составил -0,81, что доказывает наличие сильной обратной связи между признаками (р<0,05). Связь между размером камня и значением Ri в междолевых артериях почки после вмешательства оказалась слабой (коэффициент Спирмена был равен 0,1; р>0,05).
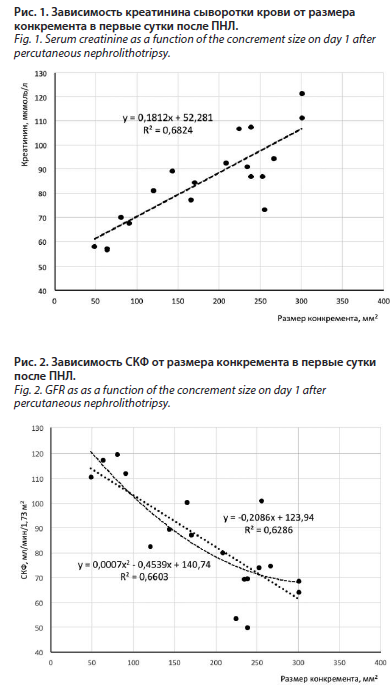
При изучении кривых аппроксимации, отражающих зависимость концентрации креатинина в первые сутки послеоперационного периода от размера камня, установлено, что наибольшую достоверность аппроксимации (R2=0,68) имеет линейная кривая (рис. 1), описываемая уравнением:
y = 0,1812x + 52,281
Решая данное линейное уравнение, легко выяснить, что у пациентов с размерами конкрементов 100 мм2, 200 мм2 и 300 мм2 прогнозируемый уровень креатинина составил 70,4 мкмоль/л, 88,5 мкмоль/л и 106,6 мкмоль/л, соответственно.
По итогам анализа кривых аппроксимации, отражающих зависимость значения СКФ в первые сутки послеоперационного периода от размера конкремента, наибольшую достоверность аппроксимации (R2=0,66) имеет параболическая кривая (рис. 2), описываемая уравнением:
y = 0,0007x2 - 0,4539x + 140,74
Решая данное уравнение, легко выяснить, что у пациентов с размерами конкрементов 100 мм2, 200 мм2 и 300 мм2 прогнозируемый уровень СКФ будет составлять 102,4 мл/мин/1,73 м2, 78 мл/мин/1,73 м2,
67,6 мл/мин/1,73 м2 соответственно. Однако это уравнение можно применить лишь для конкрементов, не превышающих размер 324 мм2, поскольку при этом значении абсциссы (x=324) параболическая кривая достигает своей вершины. Прогнозировать уровень СКФ у пациентов с конкрементами большего размера в этом случае можно с помощью линейной кривой с достоверностью аппроксимации R2=0,63 (рис. 2), описываемой уравнением:
y = -0,2086x + 123,94
Согласно данному уравнению, при размерах камня – 400 мм2 прогнозируемый уровень СКФ будет составлять 40,5 мл/мин/1,73 м2.
При корреляционном анализе с расчетом коэффициента корреляции Спирмена для определения силы и направления взаимосвязи между плотностью конкремента и уровнем креатинина в сыворотке крови и СКФ после ПНЛ показано наличие слабой прямой и слабой обратной связи между признаками соответственно, что, возможно, обусловлено малым объемом выборки.
Обсуждение результатов
Принято считать, что хирургическое лечение МКБ должно в конечном итоге привести к улучшению функционального состояния почек, хотя очевидно, что само по себе оперативное вмешательство может оказать негативный эффект на функцию органа. ПНЛ – не исключение. S. Pillai и соавт. [4] сообщают о развитии ОПП после ПНЛ в 9,2%. Этим данным и другим сообщениям [5] не противоречат результаты нашего исследования. Тем не менее однозначного мнения о влиянии ПНЛ на функцию почек нет. T. Reeves и соавт. [10] выполнили систематический обзор 21 исследования, опубликованного с 1999 по 2019 г. и посвященного влиянию ПНЛ на функцию почек. По результатам трех исследований продемонстрировано значительное улучшение функции почек после ПНЛ. В восьми исследованиях не было выявлено принципиального улучшения функции, но можно было говорить о наметившихся тенденциях к улучшению. В других восьми исследованиях не было отмечено существенных изменений функции почек. R.K. Handa и соавт. [11] указывают на ухудшение функции почек в первые сутки после ПНЛ, в то время как N.J. Hegarty и соавт. [12] отмечают значительное ухудшение функции почек у пациентов после ПНЛ с формированием нескольких перкутанных трактов и отсутствие изменений функции при вмешательстве через один тракт. A.S. Fayad и соавт. [13] сообщают, что у пациентов с изначальным снижением функции почек до выполнения ПНЛ происходит дальнейшее значительное ее ухудшение после вмешательства, в то время как у пациентов с изначально нормальной функцией почек последняя остается стабильной и после операции.
У всех пациентов, включенных в наше исследование, не было изначальных нарушений функции почек, а все вмешательства были выполнены с формированием одного тракта, однако сценарии изменения функции почек в первые сутки после ПНЛ были различными. Снижение уровня креатинина в сыворотке крови в раннем послеоперационном периоде у 39% пациентов в нашем исследовании, возможно, обусловлено удалением конкрементов, в той или иной степени вызывающих обструкцию мочевых путей [9], и указывает на улучшение функции почек. Ухудшение функции почек с развитием ОПП у части пациентов может быть связано непосредственно с механической травмой почечной паренхимы во время создания доступа в ЧЛС. Обеспечение доступа к полостной системе почки приводит к локальному повреждению почечной паренхимы и развитию ишемии вследствие индуцированной вазоконстрикции [11]. Повреждение почечной паренхимы не ограничивается исключительно местом входа иглы, а может расширяться вследствие вазоконстрикции соседних почечных сосудов [7]. Об этом феномене свидетельствуют результаты нашего исследования почечной гемодинамики в первые сутки после ПНЛ: наблюдается достоверное повышение резистивности сосудистого русла почки. В ответ на механическую травму почка инициирует секрецию ренина, происходит увеличение концентрации ангиотензина II, что, возможно, приводит к вазоконстрикции [14]. Тем не менее средние значения Ri были ниже общепринятого патологического уровня, равного 0,70, как до, так и после вмешательства. Сосудистая дисфункция может играть важную роль в патогенезе ОПП [15]. В ряде исследований Ri использовали для оценки почечной перфузии [16], прогнозирования дисфункции почек [17, 18] и восстановления после ОПП. Попытки использования показателей почечной гемодинамики в прогнозировании развития ОПП в первую очередь связаны с тем, что креатинин является слабым индикатором повреждения почек на ранних этапах, поскольку для его повышения должно произойти значительное снижение функции почек [19]. Однако в нашем исследовании Ri у пациентов с повышением креатинина в сыворотке крови достигал тех же значений, что и у пациентов со снижением креатинина в первые сутки после ПНЛ. Иными словами, использовать допплерографию почечного кровотока для прогнозирования нарушений функции почек в послеоперационном периоде не представляется возможным. Очевидно, что помимо механической травмы почки в качестве дополнительных факторов, влияющих на ее функцию, следует указать ирригацию жидкости в ЧЛС под высоким давлением [20], а также тепловое повреждение тканей вследствие применения гольмиевого лазера [21]. Cовокупность всех повреждающих факторов приводит к активации симпатической нервной системы, которая посредством почечного рефлекса участвует в развитии вазоконстрикции в сосудистом русле контралатеральной почки [7].
Поскольку ОПП развивается практически у каждого 7-го пациента после ПНЛ, а нарушение функции почек встречается значительно чаще, необходим поиск предикторов повреждения почек. Прогнозирование нарушения функции почек после ПНЛ в раннем послеоперационном периоде может быть полезным при последующем наблюдении, особенно при ведении пациентов из группы риска и подборе медикаментозной терапии [9]. Все предикторы нарушения функции почек делят на факторы, связанные с пациентом, факторы, обусловленные особенностями хирургического вмешательства, и факторы, связанные со спецификой конкремента [4].
Известно, что к факторам пациента необходимо отнести пожилой возраст, наличие сопутствующих заболеваний, в первую очередь артериальной гипертензии и сахарного диабета [22], а также предоперационное использование ингибиторов ангиотензин-превращающего фермента или ингибиторов ангиотензина II. Изучение этих факторов не входило в задачи настоящего исследования.
В качестве одного их хирургических предикторов нарушения функции почек обсуждается длительность вмешательства. Отсутствие статистически значимой корреляционной зависимости между длительностью вмешательства и значениями Ri, уровнем креатинина в сыворотке крови и СКФ в нашем исследовании можно объяснить следующим. У каждого пациента различные этапы вмешательства имеют разную продолжительность и доли времени, затраченного на обеспечение доступа, непосредственно литотрипсию. Кроме того, продолжительная литотрипсия требует большей по объему ирригации. Иными словами, действие ключевых повреждающих факторов (механическая травма при обеспечении доступа, тепловое повреждение при литотрипсии, повышение внутрилоханочного давления при ирригации) в каждом конкретном случае различно по продолжительности.
Сильная прямая связь между размером конкремента и уровнем креатинина и сильная обратная связь между размером конкремента и СКФ позволяет считать размер конкремента одним из ключевых предикторов развития нарушений функции почек после ПНЛ. О необходимости принятия во внимание размера конкремента при прогнозировании риска ОПП при малоинвазивном лечении МКБ сообщают и другие исследователи [23, 24]. При анализе линейной кривой, описывающей зависимость уровня креатинина от размера конкремента, видно, что при размере камня 500 мм2 ожидаемый уровень креатинина составляет 142,8 мкмоль/л, что может указывать на развитие ОПП I стадии (повышение уровня креатинина в сыворотке крови, превышающее или равное 26,5 мкмоль/л) при базовом уровне креатинина, находящегося на верхней границе диапазона нормальных референсных значений.
Заключение
В нашем исследовании ОПП в первые сутки после ПНЛ развилось у 16,7% пациентов. Это соответствует результатам других аналогичных исследований и заставляет задуматься о необходимости поиска новых предикторов развития ОПП. Наша попытка изучить возможность применения динамики допплерографических показателей ренального кровотока для прогнозирования развития нарушений функции почек не увенчалась успехом, поскольку у пациентов как с улучшением, так и с ухудшением функции почек в первые сутки после операции были выявлены однотипные изменения. Происходило повышение резистивности сосудистого русла, очевидно, обусловленное сочетанным воздействием механической травмы, повышенного внутрилоханочного давления и теплового стресса. Также в нашем исследовании показано, что использовать длительность ПНЛ как прогностический фактор риска развития ОПП не представляется возможным. В то же время размер камня остается главным предиктором риска ОПП после ПНЛ. Согласно итогам математического моделирования зависимостей между признаками, размер камня более 500 мм2 (произведение двух максимальных размеров камня на компьютерных томограммах) является прогностическим фактором риска ОПП в первые сутки после ПНЛ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Белый Лев Евгеньевич – д-р мед. наук, проф. каф. госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии, ортопедии, ФГБОУ ВО «Ульяновский государственный университет». ORCID: 0000-0003-0908-1321
Lev E. Belyi – D. Sci. (Med.), Prof., Ulyanovsk State University. E-mail: lbely@yandex.ru;
ORCID: 0000-0003-0908-1321
Клочков Артем Владимирович – врач-уролог ГУЗ «Ульяновский областной клинический центр специализированных видов медицинской помощи имени заслуженного врача России
Е.М. Чучкалова», аспирант каф. госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии и ортопедии, ФГБОУ ВО «Ульяновский государственный университет». E-mail: klochkov.ul@yandex.ru
Artem V. Klochkov – Urologist, Ulyanovsk regional clinical center of specialized types of medical care Graduate Student, Ulyanovsk State University. E-mail: klochkov.ul@yandex.ru
Клочков Владимир Валерьевич – д-р мед. наук, проф. каф. госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии и ортопедии, ФГБОУ ВО «Ульяновский государственный университет». E-mail: klochkovvv55@yandex.ru
Vladimir V. Klochkov – D. Sci. (Med.), Prof., Ulyanovsk State University. E-mail: klochkovvv55@yandex.ru
Шмырин Александр Геннадьевич – зав. урологическим отделением, ГУЗ «Ульяновский областной клинический центр специализированных видов медицинской помощи имени заслуженного врача России Е.М. Чучкалова».
E-mail: shmyrin@mail.ru
Alexander G. Shmyrin – Head of the urological department, Ulyanovsk regional clinical center of specialized types of medical care. E-mail: shmyrin@mail.ru
Поступила в редакцию: 13.06.2024
Поступила после рецензирования: 19.06.2024
Принята к публикации: 20.06.2024
Received: 13.06.2024
Revised: 19.06.2024
Accepted: 20.06.2024
Lev E. Belyi1, Artem V. Klochkov1,2, Vladimir V. Klochkov1, Alexander G. Shmyrin2
1 Ulyanovsk State University, Ulyanovsk, Russia;
2 Ulyanovsk Regional Clinical Center for Specialized types of Medical Care named after Honored Doctor of Russia E.M. Chuchkalov, Ulyanovsk, Russia
lbely@yandex.ru
Abstract
Background. Over the past decade, percutaneous nephrolithotripsy (PNL) has become one of the most popular treatments for urolithiasis. The reason is the high efficiency of the method in combination with a low incidence of complications and a shorter period of hospitalization. However, the effect of PNL on renal function has not been sufficiently studied.
The aim of this study was to evaluate changes in renal hemodynamics and kidney function in the early postoperative period after PNL.
Patients and Methods. The clinical data of 18 patients who underwent PNL were analyzed. Serum creatinine levels were determined in all patients before and after PNL, glomerular filtration rate was calculated, and ultrasound examination of the kidneys with dopplerography of renal blood flow was performed. The size, density of the stone and its localization in the kidney were determined using computed tomography.
Results. The average size of the stones was 224.4±38.5 mm2, the average density was 1152±76 HU. The duration of surgical intervention is 96.1±9.2 minutes. In 7 patients after PNL, creatinine levels decreased compared to preoperative, while in the remaining 11 patients, creatinine levels increased in the early postoperative period (p<0.001). Acute kidney injury developed in three patients (16.7%): there was an increase in creatinine concentration by 40.7±11.7 mcmol/l compared with the baseline level. In patients with both improved renal function on the first day after surgery and with deterioration of function, the same type of changes were revealed. There was an increase in vascular resistivity. This does not allow the use of dopplerography of renal blood flow as prognostic predictors of impaired renal function. Unlike the duration of the intervention, the size of the stone remains the main predictor of the risk of acute kidney injury after PNL.
Keywords: acute kidney injury, percutaneous nephrolithotripsy, urolithiasis, creatinine, renal blood flow.
For citation: Belyi L.E., Klochkov A.V., Klochkov V.V., Shmyrin A.G. Renal hemodynamic changes and kidney function in the first day after percutaneous nephrolithotripsy. Clinical review for general practice. 2024; 5 (6): 63–68 (In Russ.). DOI: 10.47407/kr2024.5.6.00436
Введение
Не вызывает сомнений, что активное внедрение эндоскопических методов хирургического лечения мочекаменной болезни (МКБ) – одно из величайших и важных достижений в урологической практике за последние 50 лет. Среди обширного арсенала эндоурологических методов лечения нефролитиаза перкутанная нефролитотрипсия (ПНЛ) является одной из наиболее часто используемых эндоскопических процедур [1, 2]. Причины популярности ПНЛ – высокая эффективность метода в сочетании с низкой частотой осложнений и сокращением сроков госпитализации вследствие малоинвазивности [3]. Рецидивирующий характер течения МКБ часто диктует необходимость выполнения повторных вмешательств, поэтому при выборе метода хирургического лечения первостепенное значение имеет обеспечение сохранности функции почек [4]. Известно, что урологические пациенты входят в группу высокого риска развития острого повреждения почек (ОПП) вследствие обструктивных уропатий, уросепсиса, а также нарушения функции почек, возникающего в ряде случаев после хирургических вмешательств [5]. Однако систематические обзоры и метаанализы последних лет, посвященные оценке эффективности и безопасности эндоурологических методов и в том числе ПНЛ, прежде всего были сосредоточены на возможностях достижения stone-free статуса и таких послеоперационных осложнениях, как кровотечение и инфекция [6]. Существуют лишь отдельные сообщения о возможном влиянии тех или иных эндоурологических процедур на функцию почек. Очевидно, это связано с тем, что малоинвазивные эндоурологические операции в большинстве случаев завершаются успешно, пациенты покидают клинику в тот же или в первый послеоперационный день, а функция почек обычно не контролируется даже в течение первой послеоперационной недели [7]. В то же время ОПП, развившееся в послеоперационном периоде, – грозное осложнение, наблюдающееся у 6,7–38,2% урологических пациентов [5].
Целью настоящего исследования стала оценка изменений ренальной гемодинамики и функции почек в раннем послеоперационном периоде, вызванных применением ПНЛ.
Материалы и методы исследования
В исследовании участвовала группа пациентов, страдающих МКБ и проходивших лечение в ГУЗ «Ульяновский областной клинический центр специализированных видов медицинской помощи». Всем пациентам была проведена ПНЛ, включение всех пациентов в исследование осуществлялось случайным образом. Исследование носило проспективный характер. Были проанализированы клинические данные 18 пациентов: 9 мужчин и 9 женщин в возрасте от 31 до 72 лет. Средний возраст пациентов составил 50,7±2,9 года. Конкременты, по поводу которых выполняли ПНЛ, у 4 пациентов располагались в одной из почечных чашечек, у остальных 14 пациентов диагностировали конкременты почечной лоханки. В исследовании не было пациентов с одной почкой, все имели нормальные контралатеральные почки.
Перед операцией всем пациентам провели стандартные лабораторные исследования. Исследование концентрации креатинина выполнено на автоматическом биохимическом анализаторе Beckman Coulter AU480 (США) по стандартной методике с помощью диагностических наборов реагентов фирмы Beckman. Скорость клубочковой фильтрации (СКФ) рассчитывалась с помощью CKD-EPI формулы. Хроническую болезнь почек определяли по расчетной скорости клубочковой фильтрации <60 мл/мин/1,73 м2. ОПП диагностировали, согласно рекомендациям KDIGO [8], по креатинину сыворотки и диурезу: о развитии ОПП в раннем послеоперационном периоде свидетельствовало повышение уровня креатинина в сыворотке крови, превышающее или равное 26,5 мкмоль/л (0,3 мг/дл) в течение 48 ч либо снижение диуреза до уровня, меньшего или равного
0,5 мл/кг/ч в течение 6–12 ч.
Всем пациентам перед и после ПНЛ проводили ультразвуковое исследование почек, мочеточников и мочевого пузыря с использованием ультразвукового сканера Hitachi Aloka Arietta v70. Изучение количественных параметров кровотока в междолевых артериях почек до хирургического вмешательства и в первые сутки послеоперационного периода проводили с помощью спектрального допплеровского режима. Определяли пиковую систолическую скорость кровотока – VPS, конечную диастолическую скорость кровотока – VED, на основании которых рассчитывали индекс резистивности Ri, равный отношению разности пиковой систолической и конечной диастолической скоростей кровотока к пиковой систолической скорости кровотока. Компьютерная томография почек и мочеточников без контрастного усиления выполнялась на томографе GE Lightspeed VCT (США). Плотность конкрементов оценивали по шкале Hounsfield (HU), а размер конкремента рассчитывали как произведение двух максимальных размеров камня на томограммах и выражали в мм2 [9].
Все вмешательства выполнены под эндотрахеальным наркозом в положении на спине после предварительной катетеризации ипсилатерального мочеточника с фиксацией последнего к уретральному катетеру Foley 16–18Ch. Доступ к чашечно-лоханочной системе (ЧЛС) почки осуществляли иглой Shiba 18G под рентгеноскопическим контролем. Дилатацию пункционного хода осуществляли при помощи дилататоров Amplatz 24–28 Ch с установкой кожуха Amplatz 26–30 Ch, а затем нефроскопа Richard Wolf №24–26 Ch. У всех пациентов ПНЛ выполнена с формированием одного перкутанного тракта. Для дезинтеграции конкрементов использовали гольмиевый лазер Auriga XL «Boston Scientific» в режиме литотрипсии 8–12 Гц, 1200–2500 мДж с последующей лапаксией фрагментов камня. Оперативное вмешательство завершали установкой нефростомического дренажа №16-20 Ch. Время выполнения операции измеряли с момента начала цистоскопии и катетеризации почки до момента наложения повязки. Уретральный и мочеточниковый катетеры удаляли в течение первых 24 ч после операции.
Статистическую обработку результатов и математическое моделирование проводили с использованием Microsoft Excel (MS Office`2016) и компьютерной программы Statistica 10.0 (StatSoft USA). Вычисляли средние значения, дисперсии, средние квадратические отклонения и их ошибки. Все данные представлены в виде M±m, где M – среднее арифметическое, а m – cтандартная ошибка средней арифметической. Определение значимости различий двух выборок проводили с использованием t-критерия Стьюдента. При значении р<0,05 различия считали статистически достоверными. Корреляционный анализ для двух переменных выполняли с расчетом коэффициента корреляции Спирмена. Математическое моделирование зависимостей между признаками осуществлялось с использованием методов наименьших квадратов и аппроксимации, при этом качество аппроксимации оценивали по максимуму оценки достоверности.
Результаты
Средний размер конкрементов составил 224,4±38,5 мм2, их плотность варьировала от 461 HU до 1600 HU, средняя плотность – 1152±76 HU. Длительность хирургического вмешательства – 96,1±9,2 мин. Уровень креатинина сыворотки до операции составлял 80,3±3,9 мкмоль/л, а в первые сутки после операции – 87,4±4,4 мкмоль/л (р>0,05). Среднее значение СКФ до операции составляло 91,5±4,3 мл/мин/1,73 м2, а в первые сутки после операции – 84,6±5,2 мл/мин/1,73 м2 (р>0,05). Примечательно, что у 7 пациентов после хирургического вмешательства уровень креатинина снизился по сравнению с дооперационным и составил 71,3±5,2 мкмоль/л, в то время как у остальных 11 уровень креатинина в раннем послеоперационном периоде вырос – 97,7±4,2 мкмоль/л (р<0,001). ОПП развилось у трех пациентов (16,7%): произошло повышение концентрации креатинина на 40,7±11,7 мкмоль/л по сравнению с исходным уровнем.
При исследовании почечной гемодинамики установлено достоверное увеличение VPS в междолевых артериях оперированной почки в раннем послеоперационном периоде: среднее значение VPS до хирургического вмешательства составляло 38,6±1,7 см/с, а после вмешательства – 44,4±2,2 см/с (р<0,05). Кроме этого, зафиксировано недостоверное повышение VED: до вмешательства этот показатель был 14,8±0,6 см/с, в послеоперационном периоде – 15,6±1,0 см/с (р>0,05).
 Среднее значение Ri до ПНЛ составило 0,61±0,01, а в первые сутки послеоперационного периода – 0,65±0,01 (р<0,05). Важно заметить, что в подгруппе пациентов со снижением креатинина в послеоперационном периоде Ri составил 0,65±0,02, достоверно не отличаясь от Ri в подгруппе пациентов с повышением креатинина в сыворотке крови – 0,65±0,01 (р>0,05).
Среднее значение Ri до ПНЛ составило 0,61±0,01, а в первые сутки послеоперационного периода – 0,65±0,01 (р<0,05). Важно заметить, что в подгруппе пациентов со снижением креатинина в послеоперационном периоде Ri составил 0,65±0,02, достоверно не отличаясь от Ri в подгруппе пациентов с повышением креатинина в сыворотке крови – 0,65±0,01 (р>0,05).Был проведен корреляционный анализ с расчетом коэффициента корреляции Спирмена для определения силы и направления взаимосвязи между длительностью хирургического вмешательства и значениями Ri, уровнем креатинина в сыворотке крови и СКФ после ПНЛ. Коэффициент корреляции Спирмена между длительностью вмешательства и Ri составил 0,15, что свидетельствует о наличии слабой статистически не значимой прямой зависимости между признаками (р>0,05). Коэффициент корреляции Спирмена между длительностью вмешательства и концентрацией креатинина в сыворотке крови был равен 0,27, что также демонстрирует слабую прямую зависимость (р>0,05). Коэффициент корреляции между длительностью вмешательства и СКФ равен -0,15, что указывает на существование между признаками обратной связи слабой силы (р>0,05).
Примечательно, что при определении силы и направления связи между размером конкремента и уровнем креатинина и СКФ были получены иные результаты. Коэффициент корреляции Спирмена между размером конкремента и концентрацией креатинина составил 0,84, что свидетельствует о наличии сильной прямой связи между признаками (р<0,05). Коэффициент корреляции Спирмена между размером конкремента и значением СКФ составил -0,81, что доказывает наличие сильной обратной связи между признаками (р<0,05). Связь между размером камня и значением Ri в междолевых артериях почки после вмешательства оказалась слабой (коэффициент Спирмена был равен 0,1; р>0,05).
При изучении кривых аппроксимации, отражающих зависимость концентрации креатинина в первые сутки послеоперационного периода от размера камня, установлено, что наибольшую достоверность аппроксимации (R2=0,68) имеет линейная кривая (рис. 1), описываемая уравнением:
y = 0,1812x + 52,281
Решая данное линейное уравнение, легко выяснить, что у пациентов с размерами конкрементов 100 мм2, 200 мм2 и 300 мм2 прогнозируемый уровень креатинина составил 70,4 мкмоль/л, 88,5 мкмоль/л и 106,6 мкмоль/л, соответственно.
По итогам анализа кривых аппроксимации, отражающих зависимость значения СКФ в первые сутки послеоперационного периода от размера конкремента, наибольшую достоверность аппроксимации (R2=0,66) имеет параболическая кривая (рис. 2), описываемая уравнением:
y = 0,0007x2 - 0,4539x + 140,74
Решая данное уравнение, легко выяснить, что у пациентов с размерами конкрементов 100 мм2, 200 мм2 и 300 мм2 прогнозируемый уровень СКФ будет составлять 102,4 мл/мин/1,73 м2, 78 мл/мин/1,73 м2,
67,6 мл/мин/1,73 м2 соответственно. Однако это уравнение можно применить лишь для конкрементов, не превышающих размер 324 мм2, поскольку при этом значении абсциссы (x=324) параболическая кривая достигает своей вершины. Прогнозировать уровень СКФ у пациентов с конкрементами большего размера в этом случае можно с помощью линейной кривой с достоверностью аппроксимации R2=0,63 (рис. 2), описываемой уравнением:
y = -0,2086x + 123,94
Согласно данному уравнению, при размерах камня – 400 мм2 прогнозируемый уровень СКФ будет составлять 40,5 мл/мин/1,73 м2.
При корреляционном анализе с расчетом коэффициента корреляции Спирмена для определения силы и направления взаимосвязи между плотностью конкремента и уровнем креатинина в сыворотке крови и СКФ после ПНЛ показано наличие слабой прямой и слабой обратной связи между признаками соответственно, что, возможно, обусловлено малым объемом выборки.
Обсуждение результатов
Принято считать, что хирургическое лечение МКБ должно в конечном итоге привести к улучшению функционального состояния почек, хотя очевидно, что само по себе оперативное вмешательство может оказать негативный эффект на функцию органа. ПНЛ – не исключение. S. Pillai и соавт. [4] сообщают о развитии ОПП после ПНЛ в 9,2%. Этим данным и другим сообщениям [5] не противоречат результаты нашего исследования. Тем не менее однозначного мнения о влиянии ПНЛ на функцию почек нет. T. Reeves и соавт. [10] выполнили систематический обзор 21 исследования, опубликованного с 1999 по 2019 г. и посвященного влиянию ПНЛ на функцию почек. По результатам трех исследований продемонстрировано значительное улучшение функции почек после ПНЛ. В восьми исследованиях не было выявлено принципиального улучшения функции, но можно было говорить о наметившихся тенденциях к улучшению. В других восьми исследованиях не было отмечено существенных изменений функции почек. R.K. Handa и соавт. [11] указывают на ухудшение функции почек в первые сутки после ПНЛ, в то время как N.J. Hegarty и соавт. [12] отмечают значительное ухудшение функции почек у пациентов после ПНЛ с формированием нескольких перкутанных трактов и отсутствие изменений функции при вмешательстве через один тракт. A.S. Fayad и соавт. [13] сообщают, что у пациентов с изначальным снижением функции почек до выполнения ПНЛ происходит дальнейшее значительное ее ухудшение после вмешательства, в то время как у пациентов с изначально нормальной функцией почек последняя остается стабильной и после операции.
У всех пациентов, включенных в наше исследование, не было изначальных нарушений функции почек, а все вмешательства были выполнены с формированием одного тракта, однако сценарии изменения функции почек в первые сутки после ПНЛ были различными. Снижение уровня креатинина в сыворотке крови в раннем послеоперационном периоде у 39% пациентов в нашем исследовании, возможно, обусловлено удалением конкрементов, в той или иной степени вызывающих обструкцию мочевых путей [9], и указывает на улучшение функции почек. Ухудшение функции почек с развитием ОПП у части пациентов может быть связано непосредственно с механической травмой почечной паренхимы во время создания доступа в ЧЛС. Обеспечение доступа к полостной системе почки приводит к локальному повреждению почечной паренхимы и развитию ишемии вследствие индуцированной вазоконстрикции [11]. Повреждение почечной паренхимы не ограничивается исключительно местом входа иглы, а может расширяться вследствие вазоконстрикции соседних почечных сосудов [7]. Об этом феномене свидетельствуют результаты нашего исследования почечной гемодинамики в первые сутки после ПНЛ: наблюдается достоверное повышение резистивности сосудистого русла почки. В ответ на механическую травму почка инициирует секрецию ренина, происходит увеличение концентрации ангиотензина II, что, возможно, приводит к вазоконстрикции [14]. Тем не менее средние значения Ri были ниже общепринятого патологического уровня, равного 0,70, как до, так и после вмешательства. Сосудистая дисфункция может играть важную роль в патогенезе ОПП [15]. В ряде исследований Ri использовали для оценки почечной перфузии [16], прогнозирования дисфункции почек [17, 18] и восстановления после ОПП. Попытки использования показателей почечной гемодинамики в прогнозировании развития ОПП в первую очередь связаны с тем, что креатинин является слабым индикатором повреждения почек на ранних этапах, поскольку для его повышения должно произойти значительное снижение функции почек [19]. Однако в нашем исследовании Ri у пациентов с повышением креатинина в сыворотке крови достигал тех же значений, что и у пациентов со снижением креатинина в первые сутки после ПНЛ. Иными словами, использовать допплерографию почечного кровотока для прогнозирования нарушений функции почек в послеоперационном периоде не представляется возможным. Очевидно, что помимо механической травмы почки в качестве дополнительных факторов, влияющих на ее функцию, следует указать ирригацию жидкости в ЧЛС под высоким давлением [20], а также тепловое повреждение тканей вследствие применения гольмиевого лазера [21]. Cовокупность всех повреждающих факторов приводит к активации симпатической нервной системы, которая посредством почечного рефлекса участвует в развитии вазоконстрикции в сосудистом русле контралатеральной почки [7].
Поскольку ОПП развивается практически у каждого 7-го пациента после ПНЛ, а нарушение функции почек встречается значительно чаще, необходим поиск предикторов повреждения почек. Прогнозирование нарушения функции почек после ПНЛ в раннем послеоперационном периоде может быть полезным при последующем наблюдении, особенно при ведении пациентов из группы риска и подборе медикаментозной терапии [9]. Все предикторы нарушения функции почек делят на факторы, связанные с пациентом, факторы, обусловленные особенностями хирургического вмешательства, и факторы, связанные со спецификой конкремента [4].
Известно, что к факторам пациента необходимо отнести пожилой возраст, наличие сопутствующих заболеваний, в первую очередь артериальной гипертензии и сахарного диабета [22], а также предоперационное использование ингибиторов ангиотензин-превращающего фермента или ингибиторов ангиотензина II. Изучение этих факторов не входило в задачи настоящего исследования.
В качестве одного их хирургических предикторов нарушения функции почек обсуждается длительность вмешательства. Отсутствие статистически значимой корреляционной зависимости между длительностью вмешательства и значениями Ri, уровнем креатинина в сыворотке крови и СКФ в нашем исследовании можно объяснить следующим. У каждого пациента различные этапы вмешательства имеют разную продолжительность и доли времени, затраченного на обеспечение доступа, непосредственно литотрипсию. Кроме того, продолжительная литотрипсия требует большей по объему ирригации. Иными словами, действие ключевых повреждающих факторов (механическая травма при обеспечении доступа, тепловое повреждение при литотрипсии, повышение внутрилоханочного давления при ирригации) в каждом конкретном случае различно по продолжительности.
Сильная прямая связь между размером конкремента и уровнем креатинина и сильная обратная связь между размером конкремента и СКФ позволяет считать размер конкремента одним из ключевых предикторов развития нарушений функции почек после ПНЛ. О необходимости принятия во внимание размера конкремента при прогнозировании риска ОПП при малоинвазивном лечении МКБ сообщают и другие исследователи [23, 24]. При анализе линейной кривой, описывающей зависимость уровня креатинина от размера конкремента, видно, что при размере камня 500 мм2 ожидаемый уровень креатинина составляет 142,8 мкмоль/л, что может указывать на развитие ОПП I стадии (повышение уровня креатинина в сыворотке крови, превышающее или равное 26,5 мкмоль/л) при базовом уровне креатинина, находящегося на верхней границе диапазона нормальных референсных значений.
Заключение
В нашем исследовании ОПП в первые сутки после ПНЛ развилось у 16,7% пациентов. Это соответствует результатам других аналогичных исследований и заставляет задуматься о необходимости поиска новых предикторов развития ОПП. Наша попытка изучить возможность применения динамики допплерографических показателей ренального кровотока для прогнозирования развития нарушений функции почек не увенчалась успехом, поскольку у пациентов как с улучшением, так и с ухудшением функции почек в первые сутки после операции были выявлены однотипные изменения. Происходило повышение резистивности сосудистого русла, очевидно, обусловленное сочетанным воздействием механической травмы, повышенного внутрилоханочного давления и теплового стресса. Также в нашем исследовании показано, что использовать длительность ПНЛ как прогностический фактор риска развития ОПП не представляется возможным. В то же время размер камня остается главным предиктором риска ОПП после ПНЛ. Согласно итогам математического моделирования зависимостей между признаками, размер камня более 500 мм2 (произведение двух максимальных размеров камня на компьютерных томограммах) является прогностическим фактором риска ОПП в первые сутки после ПНЛ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Белый Лев Евгеньевич – д-р мед. наук, проф. каф. госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии, ортопедии, ФГБОУ ВО «Ульяновский государственный университет». ORCID: 0000-0003-0908-1321
Lev E. Belyi – D. Sci. (Med.), Prof., Ulyanovsk State University. E-mail: lbely@yandex.ru;
ORCID: 0000-0003-0908-1321
Клочков Артем Владимирович – врач-уролог ГУЗ «Ульяновский областной клинический центр специализированных видов медицинской помощи имени заслуженного врача России
Е.М. Чучкалова», аспирант каф. госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии и ортопедии, ФГБОУ ВО «Ульяновский государственный университет». E-mail: klochkov.ul@yandex.ru
Artem V. Klochkov – Urologist, Ulyanovsk regional clinical center of specialized types of medical care Graduate Student, Ulyanovsk State University. E-mail: klochkov.ul@yandex.ru
Клочков Владимир Валерьевич – д-р мед. наук, проф. каф. госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии и ортопедии, ФГБОУ ВО «Ульяновский государственный университет». E-mail: klochkovvv55@yandex.ru
Vladimir V. Klochkov – D. Sci. (Med.), Prof., Ulyanovsk State University. E-mail: klochkovvv55@yandex.ru
Шмырин Александр Геннадьевич – зав. урологическим отделением, ГУЗ «Ульяновский областной клинический центр специализированных видов медицинской помощи имени заслуженного врача России Е.М. Чучкалова».
E-mail: shmyrin@mail.ru
Alexander G. Shmyrin – Head of the urological department, Ulyanovsk regional clinical center of specialized types of medical care. E-mail: shmyrin@mail.ru
Поступила в редакцию: 13.06.2024
Поступила после рецензирования: 19.06.2024
Принята к публикации: 20.06.2024
Received: 13.06.2024
Revised: 19.06.2024
Accepted: 20.06.2024


