Клинический разбор в общей медицине №6 2024
Аннотация
Генерализованный пустулезный псориаз (ГПП), будучи хроническим воспалительным системным заболеванием, значительно снижает качество жизни пациентов, приводит к инвалидизации и повышает риск летальности. Будучи одним из самых тяжелых вариантов заболевания, ГПП имеет особенности патогенеза, что отличает его от бляшечной и прочих форм дерматоза. Ключевым фактором развития системного процесса при ГПП считается снижение экспрессии или активности антагонистов рецептора IL-36ra вследствие мутации гена IL-36RN и как результат – избыточная активность агонистов IL-36 и накопление нейтрофильных гранулоцитов в эпидермисе. Исходя из особенностей клинических проявлений в виде множественных болезненных пустул, сопровождаемых лихорадкой до 40°С, характерного изменения лабораторных показателей в виде повышения маркеров воспаления (уровня лейкоцитов с нейтрофильным сдвигом в периферической крови, С-реактивного белка), ГПП требуется дифференцировать с рядом заболеваний со сходной симптоматикой: субкорнеальным пустулезом Снеддона–Уилкинсона, синдромом Свита, герпетической инфекцией. Особенности патогенеза ГПП определяют сложности в лечении препаратами, которые с успехом применяют в терапии бляшечного псориаза, включая метотрексат, циклоспорин, ретиноиды, ингибитор ФНО-α, ингибиторы IL-17А и 23, а также их комбинации. Представлен клинический случай тяжелого непрерывно рецидивирующего резистентного к терапии цитостатиками и генно-инженерными препаратами ГПП, диагностика которого была затруднена противоречивой патоморфологической картиной.
Ключевые слова: генерализованный пустулезный псориаз, IL-36, ингибиторы IL-17 и 23, синдром Свита, субкорнеальный пустулез Снеддона–Уилкинсона, метотрексат, дапсон, азатиоприн, ацитретин.
Для цитирования: Ковтунова В.А., Алтухов С.А., Воронина Л.П., Бахмутова Э.Г., Жижимова О.В. Проблемы диагностики и лечения генерализованного пустулезного псориаза. Клинический разбор в общей медицине. 2024; 5 (6): 89–94. DOI: 10.47407/kr2024.5.6.00440
Issues of the diagnostic and treatment of generalized pustular psoriasis
Violetta A. Kovtunova1, Sergey A. Altukhov1, Ludmila P. Voronina1, Elvira G. Bakhmutova1,2,
Olga V. Zhizhimova1,2
1 Astrakhan State Medical University, Astrakhan, Russia;
2 Regional Center of Skin and Sexually Transmitted Diseases, Astrakhan, Russia;
violetta_kovtunova@mai.ru
Abstract
Generalized pustular psoriasis (GPP), being a chronic inflammatory systemic disease, significantly reduces the quality of life of patients, leads to disability and increases the risk of mortality. Representing one of the most severe variants of the disease, GPP has its own features of pathogenesis, which distinguish it from plaque and other forms of dermatosis. Presently, the key factor in the development of the systemic process in GPP is considered to be a decrease in the expression or activity of IL-36ra receptor antagonists due to mutation of the IL-36RN gene, and as a result of this, excessive activity of IL-36 agonists and accumulation of neutrophil granulocytes in the epidermis. Based on the features of clinical manifestations in the form of multiple painful pustules accompanied by fever up to 40° C, characteristic changes in laboratory parameters in the form of increased markers of inflammation (leukocyte levels with neutrophil shift in peripheral blood, C-reactive protein), GPP needs to be differentiated from a number of diseases accompanied by similar symptoms: subcorneal pustular dermatosis Sneddon–Wilkinson, Sweet's syndrome, a herpes infection. The features of the pathogenesis of GPP determine the difficulties in the treatment of medicines that are successfully used in the treatment of plaque psoriasis, including methotrexate, cyclosporine, retinoids, TNF-α inhibitor, interleukin-17 and -23 inhibitors, as well as their combinations. A clinical case of a severe continuously recurrent resistant to therapy with cytostatics and genetically engineered preparations is presented, the diagnosis of which was complicated by a contradictory pathomorphological picture.
Keywords: generalized pustular psoriasis, interleukin-36, interleukin -17 and -23 inhibitors, Sweet’s syndrome, subcorneal pustular dermatosis Sneddon–Wilkinson, methotrexate, dapsone, azathioprine, acitretin.
For citation: Kovtunova V.A., Altukhov S.A., Voronina L.P., Bakhmutova E.G., Zhizhimova O.V. Issues of the diagnostic and treatment of generalized pustular psoriasis. Clinical review for general practice. 2024; 5 (6): 89–94 (In Russ.). DOI: 10.47407/kr2024.5.6.00440
Введение
Псориаз – это хроническое воспалительное заболевание, включающее различные клинические фенотипы, из которых в 80% случаев встречается бляшечный псориаз. Пустулезный псориаз представляет собой гетерогенную группу воспалительных заболеваний, для которых общим является наличие асептических пустул, заполненных нейтрофильными гранулоцитами [1–3].
Будучи одной из самых редких и тяжело протекающих форм псориаза, генерализованный пустулезный псориаз (ГПП) может иметь рецидивирующее или персистирующее течение. Генетически отличаясь от бляшечного псориаза, ГПП связан с мутациями в генах кожной иммунной системы, которые называются IL36RN, CARD14, AP1S3, MPO [2, 3]. ГПП впервые был описан австрийским врачом Леопольдом фон Цумбушем в 1910 г. Появление распространенных болезненных асептических пустул на фоне эритемы разной степени интенсивности может сопровождаться системным воспалением, его признаки – лихорадка выше 38,0° С, увеличение СОЭ и уровня С-реактивного белка, лейкоцитоз более 12×109/л в периферической крови с нейтрофильным сдвигом. Возможно сочетание ГПП с бляшечным и артропатическим фенотипами [2–5].
Ключевым фактором развития системного процесса при ГПП считается снижение экспрессии или активности антагонистов рецептора IL-36ra и, как следствие, избыточная активность агонистов IL-36 с повышением синтеза IL-1α, IL-6, IL-8 и TNFα и накопление нейтрофильных гранулоцитов в эпидермисе. Различием в патогенезе генерализованного пустулезного и бляшечного псориаза является выраженная экспрессия IL-1 и
IL-36, низкая – IL-17A и IFNγ [6].
В современной мировой практике терапию ГПП осуществляют разнообразными группами препаратов и их комбинациями: ретиноидами, цитостатиками, блокаторами IL-17A и IL-23, блокаторами TNFα, дапсоном [7–10]. Между тем эффективность такой терапии при ГПП значительно ниже, чем при бляшечной форме дерматоза. Перспективно лечение ГПП блокатором IL-36 спезолимабом [11, 12]. Однако для окончательного суждения о выраженности и продолжительности его терапевтического эффекта нужны долговременные исследования.
Клинический случай
 Пациентка С., 1970 г. р., замужем, не работает, инвалид III группы. Больна псориазом с 2015 г. Заболевание манифестировало появлением слабо инфильтрированных бляшек на коже волосистой части головы. Через
Пациентка С., 1970 г. р., замужем, не работает, инвалид III группы. Больна псориазом с 2015 г. Заболевание манифестировало появлением слабо инфильтрированных бляшек на коже волосистой части головы. Через
10 месяцев появились единичные бляшки на коже туловища. В ГБУЗ АО ОКВД был выставлен диагноз: псориаз.
Через год от начала заболевания произошла трансформация дерматоза: на фоне поверхностных плоских слабо инфильтрированных бляшек от розового до фиолетового цвета, местами кольцевидных, появились распространенные пустулезные элементы, склонные к группировке и сопровождаемые зудом. Летом 2016 г. с подозрением на герпетическую инфекцию пациентка была госпитализирована в областную инфекционную клиническую больницу, в которой по результатам лабораторного обследования были исключены цитомегаловирусная и герпетическая инфекции.
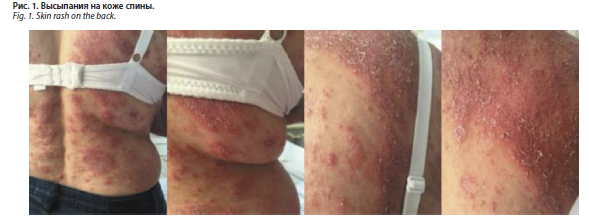
С июля 2016 г. наметилась тенденция к формированию эритродермии, появились новые множественные пустулы, сопровождаемые болезненностью кожи (рис. 1). По итогам гистологического исследования биоптата кожи груди выявлены субкорнеальные пустулы и смешанный инфильтрат в дерме (рис. 2). Был выставлен диагноз: субкорнеальный пустулез. Назначение раствора преднизолона 60 мг внутривенно и 30 мг внутримышечно с дальнейшим снижением до 10–15 мг и дапсона 100 мг в сутки привело к кратковременному улучшению. С сентября 2016 г. наряду с появлением новых болезненных пустул отмечено нарушение общего самочувствия, увеличение шейных и подмышечных лимфатических узлов, повышение температуры тела до 38,5° C. Повторное назначение в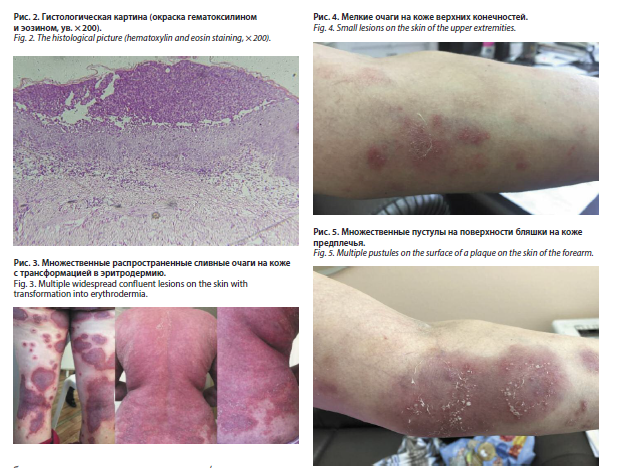 стационаре ГБУЗ АО ОКВД системного преднизолона в дозе 90 мг в сутки и дапсона в дозе 100 мг в сутки не привело к улучшению. В связи с ухудшением состояния, сопровождаемого интоксикацией, появлением на коже множественных очагов ярко-красного цвета с синюшным оттенком и множественными пустулами по периферии (рис. 3), изменением показателей в общем анализе крови (лейкоцитоз до 40,2×109/л, токсическая зернистость), была переведена в отделение токсикологии с диагнозом: синдром Стивенса–Джонсона. После выписки дальнейшее лечение получала в стационаре ГБУЗ АО ОКВД.
стационаре ГБУЗ АО ОКВД системного преднизолона в дозе 90 мг в сутки и дапсона в дозе 100 мг в сутки не привело к улучшению. В связи с ухудшением состояния, сопровождаемого интоксикацией, появлением на коже множественных очагов ярко-красного цвета с синюшным оттенком и множественными пустулами по периферии (рис. 3), изменением показателей в общем анализе крови (лейкоцитоз до 40,2×109/л, токсическая зернистость), была переведена в отделение токсикологии с диагнозом: синдром Стивенса–Джонсона. После выписки дальнейшее лечение получала в стационаре ГБУЗ АО ОКВД.
В ноябре 2016 г. для определения дальнейшей тактики лечения пациентка была направлена в ФГБУ «ГНЦДК» МЗ РФ, где находилась на лечении в отделении клинической дерматологии с диагнозом: генерализованный пустулезный псориаз. К моменту госпитализации в ФГБУ «ГНЦДК» МЗ РФ пустулезные высыпания распространились на кожу волосистой части головы, лица, шеи, конечностей. В ФГБУ «ГНЦДК» МЗ РФ был назначен ацитретин в дозе 0,5 мг/кг массы в сутки. На фоне приема ацитретина высыпания продолжали появляться в небольшом количестве, С-реактивный белок (++++), ревматоидный фактор (++++), мочевина 9,2 ммоль/л, креатинин 196,0 мкмоль/л. Через
6 месяцев прием препарата был прекращен в связи со снижением эффективности и продолжено лечение преднизолоном в дозе 20 мг в сутки.
С декабря 2017 г. произошло обострение заболевания, по поводу чего в ГБУЗ АО ОКВД был назначен цикло-спорин в дозе 200 мг в сутки. Отмечалась стабилизация кожного процесса. Однако в связи с появлением выраженных побочных явлений (тошнота, головная боль, артериальная гипертензия и тахикардия) через 3 месяца препарат был отменен, что привело к быстрому прогрессированию заболевания в виде появления множественных болезненных пустулезных высыпаний, располагающихся на фоне бляшек от ярко-розового до фиолетового цвета, повышению температуры тела до 38,5℃.
С апреля 2018 г. пациентка начала лечение секукинумабом 300 мг подкожно 1 раз в месяц, на фоне которого состояние улучшилось: бляшки разрешились с образованием пятен от бледно-розового до светло-коричневого цвета, пустулы разрешились. Между тем кожный процесс полностью не стабилизировался, периодически появлялись новые пустулы в небольшом количестве, не склонные к слиянию между собой (рис. 4), не доставляющие болезненных ощущений и не сопровождаемые гипертермией. В июле 2018 г. в связи с появлением болей в области суставов кистей, стоп, позвоночника пациентка консультирована ревматологом. Был выставлен диагноз: псориатический артрит, активность 2, асимметричная форма в сочетании с полиостеоартрозом; артралгии, ФК I. С осени 2019 г. было отмечено постепенное «ускользание» эффекта от терапии секукинумабом. Дополнительное назначение метотрексата в дозе 15 мг подкожно еженедельно не повысило эффективности лечения: вновь стали появляться яркие бляшки с болезненными пустулами на поверхности (рис. 5). В мае 2022 г. секукинумаб был отменен.
Больная была переведена на терапию рисанкизумабом в дозе 150 мг 1 раз в 3 месяца, эффекта от которого в первые 9 месяцев лечения не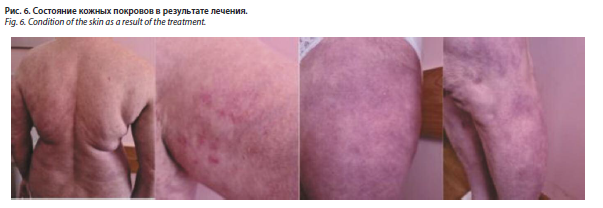 последовало: продолжали появляться новые бляшки ярко-красного цвета с пустулами на поверхности, сохранялись боли в суставах, периодическая гипертермия. В сентябре 2022 г. из-за устойчивости к проводимой терапии и нового обострения заболевания в ГБУЗ АО ОКВД был назначен раствор преднизолона 60 мг внутривенно и 30 мг внутримышечно с последующим постепенным снижением дозы. В связи с особенностями клинической картины и лабораторных показателей – стабильной лихорадкой в течение длительного времени, лейкоцитозом до 13,6×109/л с нейтрофильным сдвигом, увеличением СОЭ до 64 мм/ч в общем анализе крови и высоким уровнем
последовало: продолжали появляться новые бляшки ярко-красного цвета с пустулами на поверхности, сохранялись боли в суставах, периодическая гипертермия. В сентябре 2022 г. из-за устойчивости к проводимой терапии и нового обострения заболевания в ГБУЗ АО ОКВД был назначен раствор преднизолона 60 мг внутривенно и 30 мг внутримышечно с последующим постепенным снижением дозы. В связи с особенностями клинической картины и лабораторных показателей – стабильной лихорадкой в течение длительного времени, лейкоцитозом до 13,6×109/л с нейтрофильным сдвигом, увеличением СОЭ до 64 мм/ч в общем анализе крови и высоким уровнем
С-реактивного белка (++++ ) – было проведено повторное патоморфологическое исследование биоптата кожи для исключения синдрома Свита. Гистологический анализ: эпидермис с инфильтрацией нейтрофилами, субкорнеальными абсцессами, заполненными преимущественно нейтрофилами, легкая реактивная атипия корнеоцитов, минимальный акантоз; в сосочковом слое дермы отек, выраженная инфильтрация нейтрофилами, капилляры расширены, с лейкостазами, некоторые капилляры малокровны; опухолевого роста не обнаружено. Заключение: не исключен синдром Свита.
В связи с клинико-морфологическими признаками синдрома Свита был назначен дапсон в дозе 100 мг в сутки. Через 12 часов после приема первой таблетки дапсона пациентка отметила резкие боли в желудке, повышение температуры тела до 38,0° С, брадикардию, тошноту. Было отмечено появление новых высыпаний с переходом в эритродермию. В общем анализе крови отмечалось нарастание лейкоцитоза до 20,6×109/л за счет увеличения доли сегментоядерных лейкоцитов до 74%. Негативная динамика заболевания после назначения дапсона потребовала его отмены. В октябре 2022 г. решением врачебной комиссии к лечению был добавлен азатиоприн в дозировке 100 мг в сутки. Через 2 недели доза препарата была увеличена до 150 мг в сутки, а суточная доза преднизолона снижена до 20 мг. Отмечено улучшение состояния: нормализовалась температура тела, прекратилось появление новых высыпаний, наметилась тенденция к регрессу пустулезной сыпи. В ноябре 2022 г. была направлена на лечение в отделение клинической дерматологии ФГБУ «ГНЦДК» МЗ РФ для уточнения диагноза и подбора терапии. Диагноз синдрома Свита был снят и продолжено назначенное ранее в ГБУЗ АО ОКВД лечение по поводу генерализованного пустулезного псориаза.
Проведено гистологическое исследование биоптата кожи: эпидермис был незначительно утолщен за счет акантоза со слабо удлиненными гребнями; в центре фрагмента имелась крупная пустула в роговом слое, не распространявшаяся на остальные слои эпидермиса; зернистый слой под пустулой отсутствовал; в толще эпидермиса отмечался умеренный спонгиоз; дерма была отечна, в зоне пустулы наблюдался умеренный лимфогистиоцитарный инфильтрат с примесью единичных нейтрофильных гранулоцитов, плазмоцитов, эозинофилов; выявлен незначительный экзоцитоз клеток воспаления. Заключение: в пределах просмотренного материала данных за генерализованный пустулезный псориаз недостаточно, выявленные изменения более соответствуют субкорнеальному пустулезу.
Для окончательного исключения буллезных дерматозов проведено иммуноморфологическое исследование: при н-РИФ с антителами к IgG, IgA, IgM в биоптате видимо непораженной кожи выявлена очаговая размытая фиксация депозитов IgG во всех слоях эпидермиса по контуру мембран кератиноцитов без формирования «сетки»; на границе сосочкового и сетчатого слоев дермы отмечалась фиксация единичных цитоидных телец IgM и IgA (соответствовало неспецифической воспалительной реакции). Заключение: иммунофлюоресцентные признаки выражены слабо, преобладают признаки неспецифической воспалительной реакции; достоверных признаков буллезных дерматозов не обнаружено. С учетом результатов гистологического исследования и н-РИФ, выполненных на фоне иммуносупрессивной терапии, нельзя было полностью исключить диагноз субкорнеального пустулеза.
Учитывая выраженную положительную динамику на фоне комбинированной терапии, ФГБУ «ГНЦДК» МЗ РФ рекомендовало продолжить прием азатиоприна в дозе 150 мг в сутки с последующим решением о снижении суточной дозы, генно-инженерную биологическую терапию рисанкизумабом, прием преднизолона в дозе 17,5 мг в сутки с последующим снижением.
С февраля 2023 г. на фоне продолжения комбинированной терапии рисанкизумабом и азатиоприном в дозе 150 мг в сутки появилась тенденция к стабилизации кожного процесса: слабо инфильтрированные бляшки побледнели, приобрели бледно-розовый цвет с синюшным оттенком, пустулы разрешились и в дальнейшем, до декабря 2023 г., периодически появлялись в небольшом количестве, не сливаясь между собой и не вызывая болезненности кожи. В августе 2023 г. в связи со стойкой положительной динамикой кожного процесса азатиоприн был отменен.
В декабре 2023 г. через 9 дней после инъекции рисанкизумаба пациентка заболела СOVID-19 (ПЦР-тест положительный). На фоне повышения температуры тела до
39,8° C на коже туловища, конечностей, включая ладони и подошвы, появились множественные болезненные, сливающиеся между собой пустулы. Они располагались на фоне ярко-красных слабо инфильтрированных бляшек. Появлению их предшествовала резкая болезненность кожных покровов. В начале января 2024 г. на фоне улучшения общего самочувствия и нормализации температуры тела высыпания на коже стали разрешаться.
В феврале 2024 г. состояние больной было удовлетворительным, отмечена стабилизация кожного процесса. Пациентка предъявляла жалобы на боли в области спины и плечевых суставов. Согласно МРТ-исследованиям позвоночника, проведенным в декабре 2023 г., выявлены дегенеративные изменения: деформирующий спондиллоз, спондилоартроз, грыжи и протрузии дисков. Показатели общих анализов крови и мочи, биохимического исследования крови находились в пределах референсных значений. При осмотре на коже груди, спины, плеч отмечались единичные слабо инфильтрированные бляшки бледно-розового цвета, на поверхности которых располагались единичные мелкие пустулы, не склонные к группировке и безболезненные при пальпации. На коже нижних конечностей наблюдались пятна синюшно-красного цвета на местах разрешившихся высыпаний (рис. 6).
Обсуждение
Диагностика ГПП может вызывать сложности вследствие схожести клинической картины с другими пустулезными заболеваниями. В клиническом наблюдении дифференциальную диагностику проводили в первую очередь с субкорнеальным пустулезом Снеддона–Уилкинсона, что было связано со сходной клинической симптоматикой: распространенными высыпаниями на коже туловища и конечностей, представленными сгруппированными поверхностными пустулами, расположенными на эритематозном отечном основании. Патоморфологическое подтверждение диагноза ГПП было затруднено в связи с идентичностью его гистологических изменений с субкорнеальным пустулезом.
Появление признаков системного воспаления у пациентки – лихорадка в течение длительного времени, лейкоцитоз более 12,0×109/л с нейтрофильным сдвигом, увеличение СОЭ в общем анализе крови, высокий уровень С-реактивного белка (++++) наряду с острым характером высыпаний, их болезненностью – позволило предположить развитие лекарственной формы синдрома Свита [13, 14]. Данные патоморфологического исследования (диффузный нейтрофильный инфильтрат в эпидермисе и дерме, подроговые пустулы, заполненные нейтрофилами, отек сосочкового слоя дермы, дилатация капилляров) не позволяли исключать данное заболевание.
Несмотря на широкой ряд препаратов, применяемых в терапии ГПП, в описанном клиническом случае демонстрируется низкая эффективность лечения ацитретином, метотрексатом и секукинумабом, плохая переносимость и неэффективность циклоспорина и дапсона. Комбинированное назначение ризанкизумаба и азатиоприна позволило смягчить течение дерматоза, не приведя к его ремиссии. Вероятно, в данном случае следует надеяться на возможность достижения более значимых клинических результатов от терапии блокаторами IL-36.
Заключение
Несмотря на хорошую изученность данной патологии, все чаще встречающейся в клинической практике, имеются серьезные проблемы при постановке клинического диагноза и его патоморфологической верификации. К сожалению, пока отсутствуют высокоэффективные инструменты для лечения этого заболевания.
В связи с отсутствием четких дифференциально-диагностических критериев, базирующихся в основном на труднодоступном иммуноморфологическом исследовании, результаты которого могут быть недостоверными на фоне иммуносупрессивной терапии, до настоящего времени окончательно исключить диагноз субкорнеального дерматоза не представляется возможным.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Ковтунова Виолетта Анатольевна – канд. мед. наук, доцент каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России.
E-mail: violetta_kovtunova@mai.ru; ORCID:0000-0002-8486-7095.
Violetta A. Kovtunova – Cand. Sci. (Med.), Astrakhan State Medical University. E-mail: violetta_kovtunova@mai.ru; ORCID:0000-0002-8486-7095
Алтухов Сергей Анатольевич – канд. мед. наук, доцент каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России.
ORCID: 0000-0003-4831-7018
Sergey A. Altukhov – Cand. Sci. (Med.), Astrakhan State Medical University. ORCID: 0000-0003-4831-7018
Воронина Людмила Петровна – д-р мед. наук, проф., зав. каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России.
ORCID:0000-0002-2395-745Х
Ludmila P. Voronina – Dr. Sci. (Med.), Full Prof., Astrakhan State Medical University. ORCID:0000-0002-2395-745Х
Бахмутова Эльвира Гумеровна – канд. мед. наук, зав. стационарным отделением №1 ГБУЗ АО Областной кожно-венерологический диспансер, ассистент каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России. ORCID: 0000-0002-2668-2228
Elvira G. Bakhmutova – Cand. Sci. (Med.), Astrakhan Regional Center of Skin and Sexually Transmitted Diseases, Аssistant, Astrakhan State Medical University.
ORCID:0000-0002-2668-2228
Жижимова Ольга Викторовна – зам. главного врача по лечебной работе, ГБУЗ АО Областной кожно-венерологический диспансер, ассистент каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России
Olga V. Zhizhimova – Deputy Chief doctor, Astrakhan Regional Center of Skin and Sexually Transmitted Diseases, Аssistant, Astrakhan State Medical University.
Поступила в редакцию: 14.05.2024
Поступила после рецензирования: 28.05.2024
Принята к публикации: 06.06.2024
Received: 14.05.2024
Revised: 28.05.2024
Accepted: 30.05.2024
Клинический разбор в общей медицине №6 2024
Проблемы диагностики и лечения генерализованного пустулезного псориаза
Аннотация
Генерализованный пустулезный псориаз (ГПП), будучи хроническим воспалительным системным заболеванием, значительно снижает качество жизни пациентов, приводит к инвалидизации и повышает риск летальности. Будучи одним из самых тяжелых вариантов заболевания, ГПП имеет особенности патогенеза, что отличает его от бляшечной и прочих форм дерматоза. Ключевым фактором развития системного процесса при ГПП считается снижение экспрессии или активности антагонистов рецептора IL-36ra вследствие мутации гена IL-36RN и как результат – избыточная активность агонистов IL-36 и накопление нейтрофильных гранулоцитов в эпидермисе. Исходя из особенностей клинических проявлений в виде множественных болезненных пустул, сопровождаемых лихорадкой до 40°С, характерного изменения лабораторных показателей в виде повышения маркеров воспаления (уровня лейкоцитов с нейтрофильным сдвигом в периферической крови, С-реактивного белка), ГПП требуется дифференцировать с рядом заболеваний со сходной симптоматикой: субкорнеальным пустулезом Снеддона–Уилкинсона, синдромом Свита, герпетической инфекцией. Особенности патогенеза ГПП определяют сложности в лечении препаратами, которые с успехом применяют в терапии бляшечного псориаза, включая метотрексат, циклоспорин, ретиноиды, ингибитор ФНО-α, ингибиторы IL-17А и 23, а также их комбинации. Представлен клинический случай тяжелого непрерывно рецидивирующего резистентного к терапии цитостатиками и генно-инженерными препаратами ГПП, диагностика которого была затруднена противоречивой патоморфологической картиной.
Ключевые слова: генерализованный пустулезный псориаз, IL-36, ингибиторы IL-17 и 23, синдром Свита, субкорнеальный пустулез Снеддона–Уилкинсона, метотрексат, дапсон, азатиоприн, ацитретин.
Для цитирования: Ковтунова В.А., Алтухов С.А., Воронина Л.П., Бахмутова Э.Г., Жижимова О.В. Проблемы диагностики и лечения генерализованного пустулезного псориаза. Клинический разбор в общей медицине. 2024; 5 (6): 89–94. DOI: 10.47407/kr2024.5.6.00440
Issues of the diagnostic and treatment of generalized pustular psoriasis
Violetta A. Kovtunova1, Sergey A. Altukhov1, Ludmila P. Voronina1, Elvira G. Bakhmutova1,2,
Olga V. Zhizhimova1,2
1 Astrakhan State Medical University, Astrakhan, Russia;
2 Regional Center of Skin and Sexually Transmitted Diseases, Astrakhan, Russia;
violetta_kovtunova@mai.ru
Abstract
Generalized pustular psoriasis (GPP), being a chronic inflammatory systemic disease, significantly reduces the quality of life of patients, leads to disability and increases the risk of mortality. Representing one of the most severe variants of the disease, GPP has its own features of pathogenesis, which distinguish it from plaque and other forms of dermatosis. Presently, the key factor in the development of the systemic process in GPP is considered to be a decrease in the expression or activity of IL-36ra receptor antagonists due to mutation of the IL-36RN gene, and as a result of this, excessive activity of IL-36 agonists and accumulation of neutrophil granulocytes in the epidermis. Based on the features of clinical manifestations in the form of multiple painful pustules accompanied by fever up to 40° C, characteristic changes in laboratory parameters in the form of increased markers of inflammation (leukocyte levels with neutrophil shift in peripheral blood, C-reactive protein), GPP needs to be differentiated from a number of diseases accompanied by similar symptoms: subcorneal pustular dermatosis Sneddon–Wilkinson, Sweet's syndrome, a herpes infection. The features of the pathogenesis of GPP determine the difficulties in the treatment of medicines that are successfully used in the treatment of plaque psoriasis, including methotrexate, cyclosporine, retinoids, TNF-α inhibitor, interleukin-17 and -23 inhibitors, as well as their combinations. A clinical case of a severe continuously recurrent resistant to therapy with cytostatics and genetically engineered preparations is presented, the diagnosis of which was complicated by a contradictory pathomorphological picture.
Keywords: generalized pustular psoriasis, interleukin-36, interleukin -17 and -23 inhibitors, Sweet’s syndrome, subcorneal pustular dermatosis Sneddon–Wilkinson, methotrexate, dapsone, azathioprine, acitretin.
For citation: Kovtunova V.A., Altukhov S.A., Voronina L.P., Bakhmutova E.G., Zhizhimova O.V. Issues of the diagnostic and treatment of generalized pustular psoriasis. Clinical review for general practice. 2024; 5 (6): 89–94 (In Russ.). DOI: 10.47407/kr2024.5.6.00440
Введение
Псориаз – это хроническое воспалительное заболевание, включающее различные клинические фенотипы, из которых в 80% случаев встречается бляшечный псориаз. Пустулезный псориаз представляет собой гетерогенную группу воспалительных заболеваний, для которых общим является наличие асептических пустул, заполненных нейтрофильными гранулоцитами [1–3].
Будучи одной из самых редких и тяжело протекающих форм псориаза, генерализованный пустулезный псориаз (ГПП) может иметь рецидивирующее или персистирующее течение. Генетически отличаясь от бляшечного псориаза, ГПП связан с мутациями в генах кожной иммунной системы, которые называются IL36RN, CARD14, AP1S3, MPO [2, 3]. ГПП впервые был описан австрийским врачом Леопольдом фон Цумбушем в 1910 г. Появление распространенных болезненных асептических пустул на фоне эритемы разной степени интенсивности может сопровождаться системным воспалением, его признаки – лихорадка выше 38,0° С, увеличение СОЭ и уровня С-реактивного белка, лейкоцитоз более 12×109/л в периферической крови с нейтрофильным сдвигом. Возможно сочетание ГПП с бляшечным и артропатическим фенотипами [2–5].
Ключевым фактором развития системного процесса при ГПП считается снижение экспрессии или активности антагонистов рецептора IL-36ra и, как следствие, избыточная активность агонистов IL-36 с повышением синтеза IL-1α, IL-6, IL-8 и TNFα и накопление нейтрофильных гранулоцитов в эпидермисе. Различием в патогенезе генерализованного пустулезного и бляшечного псориаза является выраженная экспрессия IL-1 и
IL-36, низкая – IL-17A и IFNγ [6].
В современной мировой практике терапию ГПП осуществляют разнообразными группами препаратов и их комбинациями: ретиноидами, цитостатиками, блокаторами IL-17A и IL-23, блокаторами TNFα, дапсоном [7–10]. Между тем эффективность такой терапии при ГПП значительно ниже, чем при бляшечной форме дерматоза. Перспективно лечение ГПП блокатором IL-36 спезолимабом [11, 12]. Однако для окончательного суждения о выраженности и продолжительности его терапевтического эффекта нужны долговременные исследования.
Клинический случай
 Пациентка С., 1970 г. р., замужем, не работает, инвалид III группы. Больна псориазом с 2015 г. Заболевание манифестировало появлением слабо инфильтрированных бляшек на коже волосистой части головы. Через
Пациентка С., 1970 г. р., замужем, не работает, инвалид III группы. Больна псориазом с 2015 г. Заболевание манифестировало появлением слабо инфильтрированных бляшек на коже волосистой части головы. Через 10 месяцев появились единичные бляшки на коже туловища. В ГБУЗ АО ОКВД был выставлен диагноз: псориаз.
Через год от начала заболевания произошла трансформация дерматоза: на фоне поверхностных плоских слабо инфильтрированных бляшек от розового до фиолетового цвета, местами кольцевидных, появились распространенные пустулезные элементы, склонные к группировке и сопровождаемые зудом. Летом 2016 г. с подозрением на герпетическую инфекцию пациентка была госпитализирована в областную инфекционную клиническую больницу, в которой по результатам лабораторного обследования были исключены цитомегаловирусная и герпетическая инфекции.
С июля 2016 г. наметилась тенденция к формированию эритродермии, появились новые множественные пустулы, сопровождаемые болезненностью кожи (рис. 1). По итогам гистологического исследования биоптата кожи груди выявлены субкорнеальные пустулы и смешанный инфильтрат в дерме (рис. 2). Был выставлен диагноз: субкорнеальный пустулез. Назначение раствора преднизолона 60 мг внутривенно и 30 мг внутримышечно с дальнейшим снижением до 10–15 мг и дапсона 100 мг в сутки привело к кратковременному улучшению. С сентября 2016 г. наряду с появлением новых болезненных пустул отмечено нарушение общего самочувствия, увеличение шейных и подмышечных лимфатических узлов, повышение температуры тела до 38,5° C. Повторное назначение в
 стационаре ГБУЗ АО ОКВД системного преднизолона в дозе 90 мг в сутки и дапсона в дозе 100 мг в сутки не привело к улучшению. В связи с ухудшением состояния, сопровождаемого интоксикацией, появлением на коже множественных очагов ярко-красного цвета с синюшным оттенком и множественными пустулами по периферии (рис. 3), изменением показателей в общем анализе крови (лейкоцитоз до 40,2×109/л, токсическая зернистость), была переведена в отделение токсикологии с диагнозом: синдром Стивенса–Джонсона. После выписки дальнейшее лечение получала в стационаре ГБУЗ АО ОКВД.
стационаре ГБУЗ АО ОКВД системного преднизолона в дозе 90 мг в сутки и дапсона в дозе 100 мг в сутки не привело к улучшению. В связи с ухудшением состояния, сопровождаемого интоксикацией, появлением на коже множественных очагов ярко-красного цвета с синюшным оттенком и множественными пустулами по периферии (рис. 3), изменением показателей в общем анализе крови (лейкоцитоз до 40,2×109/л, токсическая зернистость), была переведена в отделение токсикологии с диагнозом: синдром Стивенса–Джонсона. После выписки дальнейшее лечение получала в стационаре ГБУЗ АО ОКВД.В ноябре 2016 г. для определения дальнейшей тактики лечения пациентка была направлена в ФГБУ «ГНЦДК» МЗ РФ, где находилась на лечении в отделении клинической дерматологии с диагнозом: генерализованный пустулезный псориаз. К моменту госпитализации в ФГБУ «ГНЦДК» МЗ РФ пустулезные высыпания распространились на кожу волосистой части головы, лица, шеи, конечностей. В ФГБУ «ГНЦДК» МЗ РФ был назначен ацитретин в дозе 0,5 мг/кг массы в сутки. На фоне приема ацитретина высыпания продолжали появляться в небольшом количестве, С-реактивный белок (++++), ревматоидный фактор (++++), мочевина 9,2 ммоль/л, креатинин 196,0 мкмоль/л. Через
6 месяцев прием препарата был прекращен в связи со снижением эффективности и продолжено лечение преднизолоном в дозе 20 мг в сутки.
С декабря 2017 г. произошло обострение заболевания, по поводу чего в ГБУЗ АО ОКВД был назначен цикло-спорин в дозе 200 мг в сутки. Отмечалась стабилизация кожного процесса. Однако в связи с появлением выраженных побочных явлений (тошнота, головная боль, артериальная гипертензия и тахикардия) через 3 месяца препарат был отменен, что привело к быстрому прогрессированию заболевания в виде появления множественных болезненных пустулезных высыпаний, располагающихся на фоне бляшек от ярко-розового до фиолетового цвета, повышению температуры тела до 38,5℃.
С апреля 2018 г. пациентка начала лечение секукинумабом 300 мг подкожно 1 раз в месяц, на фоне которого состояние улучшилось: бляшки разрешились с образованием пятен от бледно-розового до светло-коричневого цвета, пустулы разрешились. Между тем кожный процесс полностью не стабилизировался, периодически появлялись новые пустулы в небольшом количестве, не склонные к слиянию между собой (рис. 4), не доставляющие болезненных ощущений и не сопровождаемые гипертермией. В июле 2018 г. в связи с появлением болей в области суставов кистей, стоп, позвоночника пациентка консультирована ревматологом. Был выставлен диагноз: псориатический артрит, активность 2, асимметричная форма в сочетании с полиостеоартрозом; артралгии, ФК I. С осени 2019 г. было отмечено постепенное «ускользание» эффекта от терапии секукинумабом. Дополнительное назначение метотрексата в дозе 15 мг подкожно еженедельно не повысило эффективности лечения: вновь стали появляться яркие бляшки с болезненными пустулами на поверхности (рис. 5). В мае 2022 г. секукинумаб был отменен.
Больная была переведена на терапию рисанкизумабом в дозе 150 мг 1 раз в 3 месяца, эффекта от которого в первые 9 месяцев лечения не
 последовало: продолжали появляться новые бляшки ярко-красного цвета с пустулами на поверхности, сохранялись боли в суставах, периодическая гипертермия. В сентябре 2022 г. из-за устойчивости к проводимой терапии и нового обострения заболевания в ГБУЗ АО ОКВД был назначен раствор преднизолона 60 мг внутривенно и 30 мг внутримышечно с последующим постепенным снижением дозы. В связи с особенностями клинической картины и лабораторных показателей – стабильной лихорадкой в течение длительного времени, лейкоцитозом до 13,6×109/л с нейтрофильным сдвигом, увеличением СОЭ до 64 мм/ч в общем анализе крови и высоким уровнем
последовало: продолжали появляться новые бляшки ярко-красного цвета с пустулами на поверхности, сохранялись боли в суставах, периодическая гипертермия. В сентябре 2022 г. из-за устойчивости к проводимой терапии и нового обострения заболевания в ГБУЗ АО ОКВД был назначен раствор преднизолона 60 мг внутривенно и 30 мг внутримышечно с последующим постепенным снижением дозы. В связи с особенностями клинической картины и лабораторных показателей – стабильной лихорадкой в течение длительного времени, лейкоцитозом до 13,6×109/л с нейтрофильным сдвигом, увеличением СОЭ до 64 мм/ч в общем анализе крови и высоким уровнем С-реактивного белка (++++ ) – было проведено повторное патоморфологическое исследование биоптата кожи для исключения синдрома Свита. Гистологический анализ: эпидермис с инфильтрацией нейтрофилами, субкорнеальными абсцессами, заполненными преимущественно нейтрофилами, легкая реактивная атипия корнеоцитов, минимальный акантоз; в сосочковом слое дермы отек, выраженная инфильтрация нейтрофилами, капилляры расширены, с лейкостазами, некоторые капилляры малокровны; опухолевого роста не обнаружено. Заключение: не исключен синдром Свита.
В связи с клинико-морфологическими признаками синдрома Свита был назначен дапсон в дозе 100 мг в сутки. Через 12 часов после приема первой таблетки дапсона пациентка отметила резкие боли в желудке, повышение температуры тела до 38,0° С, брадикардию, тошноту. Было отмечено появление новых высыпаний с переходом в эритродермию. В общем анализе крови отмечалось нарастание лейкоцитоза до 20,6×109/л за счет увеличения доли сегментоядерных лейкоцитов до 74%. Негативная динамика заболевания после назначения дапсона потребовала его отмены. В октябре 2022 г. решением врачебной комиссии к лечению был добавлен азатиоприн в дозировке 100 мг в сутки. Через 2 недели доза препарата была увеличена до 150 мг в сутки, а суточная доза преднизолона снижена до 20 мг. Отмечено улучшение состояния: нормализовалась температура тела, прекратилось появление новых высыпаний, наметилась тенденция к регрессу пустулезной сыпи. В ноябре 2022 г. была направлена на лечение в отделение клинической дерматологии ФГБУ «ГНЦДК» МЗ РФ для уточнения диагноза и подбора терапии. Диагноз синдрома Свита был снят и продолжено назначенное ранее в ГБУЗ АО ОКВД лечение по поводу генерализованного пустулезного псориаза.
Проведено гистологическое исследование биоптата кожи: эпидермис был незначительно утолщен за счет акантоза со слабо удлиненными гребнями; в центре фрагмента имелась крупная пустула в роговом слое, не распространявшаяся на остальные слои эпидермиса; зернистый слой под пустулой отсутствовал; в толще эпидермиса отмечался умеренный спонгиоз; дерма была отечна, в зоне пустулы наблюдался умеренный лимфогистиоцитарный инфильтрат с примесью единичных нейтрофильных гранулоцитов, плазмоцитов, эозинофилов; выявлен незначительный экзоцитоз клеток воспаления. Заключение: в пределах просмотренного материала данных за генерализованный пустулезный псориаз недостаточно, выявленные изменения более соответствуют субкорнеальному пустулезу.
Для окончательного исключения буллезных дерматозов проведено иммуноморфологическое исследование: при н-РИФ с антителами к IgG, IgA, IgM в биоптате видимо непораженной кожи выявлена очаговая размытая фиксация депозитов IgG во всех слоях эпидермиса по контуру мембран кератиноцитов без формирования «сетки»; на границе сосочкового и сетчатого слоев дермы отмечалась фиксация единичных цитоидных телец IgM и IgA (соответствовало неспецифической воспалительной реакции). Заключение: иммунофлюоресцентные признаки выражены слабо, преобладают признаки неспецифической воспалительной реакции; достоверных признаков буллезных дерматозов не обнаружено. С учетом результатов гистологического исследования и н-РИФ, выполненных на фоне иммуносупрессивной терапии, нельзя было полностью исключить диагноз субкорнеального пустулеза.
Учитывая выраженную положительную динамику на фоне комбинированной терапии, ФГБУ «ГНЦДК» МЗ РФ рекомендовало продолжить прием азатиоприна в дозе 150 мг в сутки с последующим решением о снижении суточной дозы, генно-инженерную биологическую терапию рисанкизумабом, прием преднизолона в дозе 17,5 мг в сутки с последующим снижением.
С февраля 2023 г. на фоне продолжения комбинированной терапии рисанкизумабом и азатиоприном в дозе 150 мг в сутки появилась тенденция к стабилизации кожного процесса: слабо инфильтрированные бляшки побледнели, приобрели бледно-розовый цвет с синюшным оттенком, пустулы разрешились и в дальнейшем, до декабря 2023 г., периодически появлялись в небольшом количестве, не сливаясь между собой и не вызывая болезненности кожи. В августе 2023 г. в связи со стойкой положительной динамикой кожного процесса азатиоприн был отменен.
В декабре 2023 г. через 9 дней после инъекции рисанкизумаба пациентка заболела СOVID-19 (ПЦР-тест положительный). На фоне повышения температуры тела до
39,8° C на коже туловища, конечностей, включая ладони и подошвы, появились множественные болезненные, сливающиеся между собой пустулы. Они располагались на фоне ярко-красных слабо инфильтрированных бляшек. Появлению их предшествовала резкая болезненность кожных покровов. В начале января 2024 г. на фоне улучшения общего самочувствия и нормализации температуры тела высыпания на коже стали разрешаться.
В феврале 2024 г. состояние больной было удовлетворительным, отмечена стабилизация кожного процесса. Пациентка предъявляла жалобы на боли в области спины и плечевых суставов. Согласно МРТ-исследованиям позвоночника, проведенным в декабре 2023 г., выявлены дегенеративные изменения: деформирующий спондиллоз, спондилоартроз, грыжи и протрузии дисков. Показатели общих анализов крови и мочи, биохимического исследования крови находились в пределах референсных значений. При осмотре на коже груди, спины, плеч отмечались единичные слабо инфильтрированные бляшки бледно-розового цвета, на поверхности которых располагались единичные мелкие пустулы, не склонные к группировке и безболезненные при пальпации. На коже нижних конечностей наблюдались пятна синюшно-красного цвета на местах разрешившихся высыпаний (рис. 6).
Обсуждение
Диагностика ГПП может вызывать сложности вследствие схожести клинической картины с другими пустулезными заболеваниями. В клиническом наблюдении дифференциальную диагностику проводили в первую очередь с субкорнеальным пустулезом Снеддона–Уилкинсона, что было связано со сходной клинической симптоматикой: распространенными высыпаниями на коже туловища и конечностей, представленными сгруппированными поверхностными пустулами, расположенными на эритематозном отечном основании. Патоморфологическое подтверждение диагноза ГПП было затруднено в связи с идентичностью его гистологических изменений с субкорнеальным пустулезом.
Появление признаков системного воспаления у пациентки – лихорадка в течение длительного времени, лейкоцитоз более 12,0×109/л с нейтрофильным сдвигом, увеличение СОЭ в общем анализе крови, высокий уровень С-реактивного белка (++++) наряду с острым характером высыпаний, их болезненностью – позволило предположить развитие лекарственной формы синдрома Свита [13, 14]. Данные патоморфологического исследования (диффузный нейтрофильный инфильтрат в эпидермисе и дерме, подроговые пустулы, заполненные нейтрофилами, отек сосочкового слоя дермы, дилатация капилляров) не позволяли исключать данное заболевание.
Несмотря на широкой ряд препаратов, применяемых в терапии ГПП, в описанном клиническом случае демонстрируется низкая эффективность лечения ацитретином, метотрексатом и секукинумабом, плохая переносимость и неэффективность циклоспорина и дапсона. Комбинированное назначение ризанкизумаба и азатиоприна позволило смягчить течение дерматоза, не приведя к его ремиссии. Вероятно, в данном случае следует надеяться на возможность достижения более значимых клинических результатов от терапии блокаторами IL-36.
Заключение
Несмотря на хорошую изученность данной патологии, все чаще встречающейся в клинической практике, имеются серьезные проблемы при постановке клинического диагноза и его патоморфологической верификации. К сожалению, пока отсутствуют высокоэффективные инструменты для лечения этого заболевания.
В связи с отсутствием четких дифференциально-диагностических критериев, базирующихся в основном на труднодоступном иммуноморфологическом исследовании, результаты которого могут быть недостоверными на фоне иммуносупрессивной терапии, до настоящего времени окончательно исключить диагноз субкорнеального дерматоза не представляется возможным.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Ковтунова Виолетта Анатольевна – канд. мед. наук, доцент каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России.
E-mail: violetta_kovtunova@mai.ru; ORCID:0000-0002-8486-7095.
Violetta A. Kovtunova – Cand. Sci. (Med.), Astrakhan State Medical University. E-mail: violetta_kovtunova@mai.ru; ORCID:0000-0002-8486-7095
Алтухов Сергей Анатольевич – канд. мед. наук, доцент каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России.
ORCID: 0000-0003-4831-7018
Sergey A. Altukhov – Cand. Sci. (Med.), Astrakhan State Medical University. ORCID: 0000-0003-4831-7018
Воронина Людмила Петровна – д-р мед. наук, проф., зав. каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России.
ORCID:0000-0002-2395-745Х
Ludmila P. Voronina – Dr. Sci. (Med.), Full Prof., Astrakhan State Medical University. ORCID:0000-0002-2395-745Х
Бахмутова Эльвира Гумеровна – канд. мед. наук, зав. стационарным отделением №1 ГБУЗ АО Областной кожно-венерологический диспансер, ассистент каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России. ORCID: 0000-0002-2668-2228
Elvira G. Bakhmutova – Cand. Sci. (Med.), Astrakhan Regional Center of Skin and Sexually Transmitted Diseases, Аssistant, Astrakhan State Medical University.
ORCID:0000-0002-2668-2228
Жижимова Ольга Викторовна – зам. главного врача по лечебной работе, ГБУЗ АО Областной кожно-венерологический диспансер, ассистент каф. клинической иммунологии с курсом последипломного образования, ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России
Olga V. Zhizhimova – Deputy Chief doctor, Astrakhan Regional Center of Skin and Sexually Transmitted Diseases, Аssistant, Astrakhan State Medical University.
Поступила в редакцию: 14.05.2024
Поступила после рецензирования: 28.05.2024
Принята к публикации: 06.06.2024
Received: 14.05.2024
Revised: 28.05.2024
Accepted: 30.05.2024
16 августа 2024
Количество просмотров: 492

