Клинический разбор в общей медицине №6 2024
Аннотация
Инсулинорезистентность (ИР) и сахарный диабет типа 2 (СД2) – это серьезные, неуклонно прогрессирующие глобальные эпидемии, затрагивающие миллионы людей по всему миру. ИР связана со множеством сопутствующих заболеваний, включая СД2, который неизбежно усложняет течение и прогноз сердечно-сосудистых заболеваний и является одной из главных причин смертности населения. Хорошо известно, что ИР инициирует гиперинсулинемию, усиление хронического воспаления и окислительного стресса, что в конечном итоге приводит к морфофункциональным изменениям сосудистой стенки и ускоряет процессы атерогенеза и артериосклероза. В этих процессах немаловажную роль играют микроэлементы селен (Se) и цинк (Zn), которые участвуют в антиоксидантной защите и поддержании репаративных свойств эндотелия. Кроме того, селен регулирует иммунную функцию и некоторые процессы метаболизма глюкозы, что вызывает интерес к их роли в патогенезе ИР и СД2. В статье проанализированы данные исследований последних лет о влиянии селена на риск развития СД2.
Ключевые слова: инсулинорезистентность, сахарный диабет, антиоксиданты, селен, цинк.
Для цитирования: Дудинская Е.Н. Роль селена в патогенезе инсулинорезистентности и сахарного диабета. Клинический разбор в общей медицине. 2024; 5 (6): 95–101. DOI: 10.47407/kr2024.5.6.00441
Role of selenium in the pathogenesis of insulin resistance and diabetes mellitus
E.N. Dudinskaya
Russian Gerontological Scientific and Clinical Center, Pirogov Russian National Research Medical University, Moscow, Russia
Katharina.gin@gmail.com
Abstract
Insulin resistance (IR) and type 2 diabetes mellitus (T2D) represent serious, steadily progressing global epidemics involving millions of people all over the world. IR is associated with numerous concomitant disorders, including T2D that inevitably complicates the course and outcomes of cardiovascular disorders and represents one of the leading causes of death in the population [1]. It is well known that IR leads to hyperinsulinemia, increase in chronic inflammation and oxidative stress, which finally result in the vascular wall morphofunctional alterations and accelerate atherogenesis and arteriosclerosis. Micronutrients, such as selenium (Se) and zink (Zn) that are involved in antioxidant defense and maintaining reparative properties of the endothelium, play an important role in these processes. Furthermore, selenium regulates the immune function and some glucose metabolism processes, which causes interest in their role in the pathogenesis of IR and T2D. The paper provides the analysis of current data on the impact of selenium on the risk of T2D based on the recent studies.
Keywords: insulin resistance, diabetes mellitus, antioxidants, selenium, zinc.
For citation: Dudinskaya E.N. Role of selenium in the pathogenesis of insulin resistance and diabetes mellitus. Clinical review for general practice. 2024; 5 (6): 95–101 (In Russ.). DOI: 10.47407/kr2024.5.6.00441
Введение
Селен, ранее считавшийся исключительно токсичным, ныне признан важнейшим эссенциальным микроэлементом. Первые упоминания о селене относятся к XIII в., когда Марко Поло, путешествуя по Тибету, описал случаи отравления лошадей после употребления в пищу местных растений. С тех пор начались сначала осторожные, а потом и интенсивные исследования токсических свойств селена и связанных с его избытком заболеваний [1, 2]. На основе этих ранних исследований селен долгое время считался высокотоксичным элементом, вызывающим «щелочную болезнь» у крупного рогатого скота и врожденные дефекты у людей [3]. Впервые как химический элемент он был открыт в 1817 г. шведским химиком Й.Я. Берцелиусом, а в 1957 г. было впервые сообщено о его гепатопротекторных свойствах [4]. В 60-х годах XX в. были установлены антиоксидантные свойства селена и его роль как эссенциального микроэлемента для человека и животных, основные функции которого – разрушение гидроперекисей и перекисей липидов. Несмотря на свою токсичность, селен выполняет важные биохимические функции и является необходимым элементом для активности ряда ключевых ферментов. Селен относится к группе семи элементов (Fe, Ca, Mg, I, Se, Zn, Cu), дефицит которых наиболее распространен среди жителей планеты [5].
Распространенность дефицита селена
Распространенность дефицита селена варьирует в зависимости от географического расположения, диеты и экологических факторов. В некоторых регионах мира дефицит селена является значимой проблемой для общественного здравоохранения и встречается чаще в районах, где почвы бедны этим микроэлементом, что приводит к низкому его содержанию в продуктах питания.
В некоторых странах Африки и Азии дефицит селена широко распространен. В частности, в Китае, в районе Кешан, дефицит селена был связан с развитием эндемической кардиомиопатии, известной как болезнь Кешана. По итогам эпидемиологических исследований в некоторых районах Китая и Африки до 70% населения может иметь низкий уровень селена в организме [6].
В Европе распространенность дефицита селена также варьирует в зависимости от региона. В некоторых странах, таких как Финляндия, внедрены программы по обогащению почв селеном, что помогло снизить распространенность дефицита. Однако в других странах, таких как Германия и Великобритания, часть населения по-прежнему испытывает недостаток селена из-за низкого содержания его в почвах и, соответственно, в продуктах питания [7].
В США и Канаде уровни потребления селена среди населения считаются адекватными благодаря высокому его содержанию в почвах и широкому потреблению продуктов животного происхождения, богатых им. Однако некоторые группы населения – люди с низким доходом или соблюдающие ограничительные диеты – могут быть подвержены риску дефицита [8].
Дефицит селена – значимая проблема и в некоторых регионах России вследствие низкого содержания его в почвах и, соответственно, в продуктах питания. Наиболее серьезные проблемы с дефицитом селена наблюдаются в Центральной России, Сибири и на Дальнем Востоке. Согласно эпидемиологическому исследованию 2005 г., около 80% населения России испытывает дефицит селена [9]. По итогам другого российского исследования дефицит цинка наблюдается у 20–30% детей и подростков и связан с недостаточным потреблением продуктов, богатых цинком, – мяса, рыбы, яиц и молочных продуктов [10]. В некоторых регионах России предпринимаются усилия по обогащению почв и продуктов питания селеном. Например, в Костромской области была начата программа обогащения хлеба селеном, что позволило значительно уменьшить распространенность его дефицита среди местного населения. А в ряде регионов были внедрены программы обогащения соли и муки цинком, что позволило значительно уменьшить распространенность дефицита среди населения [11].
Особое внимание в отношении дефицита селена привлекают отдельные группы населения. У пожилых людей риск дефицита селена может быть выше из-за распространенной недостаточности питания и ухудшения усвоения микроэлементов. Согласно результатам эпидемиологических исследований, пожилые люди в Европе и Северной Америке часто имеют уровни селена гораздо ниже оптимальных [12]. У лиц с хроническими заболеваниями желудочно-кишечного тракта, почечной недостаточностью или ВИЧ часто имеется дефицит селена. Это связано с нарушением его усвоения и увеличением потребности в этом микроэлементе для поддержания иммунной функции [13].
Известно, что люди, придерживающиеся вегетарианской или веганской диеты, имеют риск дефицита селена, особенно если проживают в регионах с низким содержанием его в почвах. Это связано с тем, что продукты растительного происхождения обычно содержат меньше селена по сравнению с продуктами животного происхождения [14].
Антиоксидантные свойства селена
Основная пищевая форма селена – селенометионин, который эффективно абсорбируется в кишечнике. После всасывания селенометионин либо включается в состав белков вместо метионина, либо метаболизируется до селенида (H2Se), который является ключевым для биологической активности селена. Селенид далее преобразуется в селенофосфат, необходимый для синтеза селенопротеинов. Включение селена в состав этих белков происходит через селеноцистеин, который кодируется UGA-кодоном мРНК, так называемым стоп-кодоном, в связи с чем селеноцистеин называют 21-q аминокислотой.
Селенопротеины играют важную роль в антиоксидантной защите клетки и других метаболических процессах. Среди множества селенопротеинов выделяют основные три семейства: глутатионпероксидазы, тиоредоксинредуктазы и селенопротеин P.
Глутатионпероксидазы (GPX) 1–6-го типов – это основные антиоксидантные ферменты, поддерживающие внутриклеточную концентрацию восстановленного глутатиона. Наиболее изучена цитозольная глутатионпероксидаза (GPX1) [15]. Несмотря на широкое мнение, что GPX1 является основным антиоксидантным ферментом, прямое доказательство этому было получено лишь в конце XX в. Доказано, что GPX1 играет основную протективную роль при развитии окислительного стресса. В экспериментальном исследовании была показана линейная зависимость между активностью GPX1 и выживаемостью трансгенных мышей в условиях выраженного окислительного стресса. При этом активность GPX1 сильно зависит от содержания селена в сравнении с другими ферментами, потому определение активности GPX1 в эритроцитах – простой и чувствительный показатель селенового статуса организма [16]. Внутриклеточный и тканевой уровень GPX1 также влияет на активность апоптоза клеток и на процессы фосфорилирования протеинкиназ, в особенности протеинкиназы С – важнейшего участника сигнального пути инсулина. Вследствие этого механизма гиперактивация и гиперэкспрессия GPX1 приводит к развитию инсулинорезистентности (ИР) и ожирению. Накоплены экспериментальные данные о связи изменения экспрессии GPX1 с этиологией рака, сердечно-сосудистых и аутоиммунных заболеваний, а также СД2 [17].
Тиоредоксинредуктазы (TrxR) относятся к группе пиридиновых оксидоредуктаз и обладают С-концевым селеноцистеиновым остатком, который вместе с соседним цистеином формирует активный селеносульфидный сайт. Эти ферменты отличаются очень широкой субстратной специфичностью, участвуют в восстановлении тиоредоксина и других низкомолекулярных соединений, что делает их ключевыми в метаболизме селена и антиоксидантной защите клетки [15].
Селенопротеин P – это основной внеклеточный источник селена. Именно уровень селенопротеина Р используется как маркер селенового статуса организма. Селенопротеин P – единственный белок, содержащий более одного атома селена (при высокой обеспеченности селеном может содержать вплоть до 10 атомов). Считается, что селенопротеин P выполняет функцию транспорта селена в ткани, главным образом в головной мозг. Снижение активности подтипа селенопротеина Р – Se-BP1 (selenium-binding protein 1) патогномонично для шизофрении и при ее обострении снижается до критических цифр, в то время как при восполнении селена наблюдается улучшение состояния [18]. Основная же функция селенопротеина P также состоит в антиоксидатной защите клетки.
Роль окислительного стресса в формировании инсулинорезистентности
Известно, что при метаболических заболеваниях непрерывное образование свободных радикалов создает условия для окислительных модификаций клеточных компонентов, что, в свою очередь, приводит к дисфункции митохондрий и возможной потере клеточного гомеостаза. В последние годы роль окислительного стресса в метаболическом синдроме (МС) была всесторонне изучена [19]. Несмотря на то что основной патогенный механизм метаболических изменений у лиц с МС связан с ИР, во многих исследованиях показана тесная связь между МС, хроническим воспалением и окислительным стрессом.
Окислительный стресс играет ключевую роль в патогенезе сосудистых изменений, вызывая или усиливая биохимические процессы, сопровождающие МС. Согласно итогам экспериментальных и клинических наблюдений, оксидативный стресс является важным механизмом развития МС, связанного с ожирением, диабетом и их осложнениями [20].
На молекулярном уровне активные формы кислорода (АФК) генерируются фагоцитами в процессе борьбы с инфекционными агентами и являются одним из важнейших компонентов врожденного иммунитета. АФК запускают каскад определенных иммунных процессов и реакций воспаления, включая синтез цитокинов, белков острой фазы, процессы адгезии и апоптоза [21]. В нормальных физиологических условиях клеточный окислительный потенциал уравновешивается системой антиоксидантной защиты, включающей низкомолекулярные антиоксиданты и антиоксидантные ферменты. Однако при чрезмерном накоплении АФК происходит окислительное повреждение макромолекул, мембран и тканей, что стимулирует хроническое воспаление и ИР [22].
В норме АФК способствуют передаче сигналов инсулина и обеспечивают его типичные метаболические действия. Кратковременные высокие концентрации АФК способствуют увеличению поглощения глюкозы адипоцитами и мышцами, стимулируют транслокацию GLUT-4 и синтез липидов в адипоцитах. Однако в условиях окислительного стресса активируются сигнальные каскады серин/треонин киназ (С-концевая и N-концевая киназа, ядерный фактор-kappa B – NF-kB), стимулирующие фосфорилирование молекул IRS-1 и IRS-2 [23]. В результате модифицированные молекулы IRS-1 подвергаются ускоренной деградации, что нарушает сигнальный путь инсулина и препятствует реализации его метаболических эффектов [24].
Эта модель составляет молекулярную основу ИР, вызванной окислительным стрессом, которая характерна не только для лиц с диабетом, но и для страдающих ожирением и МС.
Роль селена в модуляции инсулинорезистентности
β-клетки поджелудочной железы известны своей сниженной антиоксидантной защитой, вероятно, из-за важной роли, которую играют физиологические концентрации активных форм кислорода в сигнальных путях инсулина. В ходе исследований выявлена более низкая экспрессия селенопротеинов GPx и более высокая экспрессия Sepp1 в этих клетках. Эти данные позволяют предположить возможную роль селена в регуляции окислительно-восстановительного состояния β-клеток поджелудочной железы [25].
В целом селен, по-видимому, улучшает резистентность к инсулину посредством трех механизмов.
Во-первых, в β-клетках поджелудочной железы селенопротеины, такие как Sepp1 и Gpx, оказывают антиоксидантное действие, тем самым ингибируя избыточное производство активных форм кислорода, что может нарушать путь передачи сигналов инсулина.
Кроме того, селен способствует транскрипции и синтезу проинсулина, фактора промотора инсулина 1 и GLP-1-активируемой протеинкиназы А.
Во-вторых, селен влияет на выработку глюкозы в печени, регулируя ферментативную активность глюкозо-6-фосфатазы и гликогенфосфорилазы и увеличивая экспрессию GLP-1R.
В-третьих, селен повышает чувствительность к инсулину в периферических тканях за счет своего антиоксидантного действия и активации сигнальных путей инсулина [26].
Селенопротеины также могут взаимодействовать с ключевыми компонентами сигнального пути инсулина, такими как фосфоинозитид-3-киназа (PI3K) и протеинкиназа B (Akt), определяя передачу сигнала от альфа-субъединиц инсулинового рецептора внутрь клетки [27].
Кроме того, селен взаимодействует с цинком и магнием, которые также играют важную роль в регуляции сигнального пути инсулина. Например, цинк является кофактором инсулинового рецептора тирозинкиназы [28], а магний необходим для функционирования инсулиновых рецепторов и ферментов, участвующих в метаболизме глюкозы [29].
В ходе исследований последних лет доказано, что селен может модулировать экспрессию генов, связанных с инсулиновым рецептором. Например, селен влияет на экспрессию гена INSR, кодирующего инсулиновый рецептор, что может изменять количество рецепторов на поверхности клеток и, соответственно, их чувствительность к инсулину. Более того, селенопротеины могут регулировать активность транскрипционных факторов, таких как PPARγ (пероксисомный пролифератор-активированный рецептор гамма), который играет ключевую роль в дифференцировке адипоцитов и регуляции метаболизма глюкозы [30].
По итогам экспериментальных исследований установлено противодиабетическое действие селена на поджелудочную железу трансгенных крыс с диабетом. Было обнаружено увеличение уровней мРНК GLP-1R, IRS-1 и препроинсулина. Более того, введение селена увеличивало количество эндокринных островков с восстановлением пула клеток и жизнеспособности клеток поджелудочной железы [31]. В связи с этим полученные результаты позволяют предположить возможную роль селена в физиологическом действии гормонов инкретинов.
В исследовании Iizuka и соавт. трансгенным крысам с диабетом вводили селенит натрия (Na₂SeO₃) внутрибрушинно в дозе 0,173 мг/кг в течение 14 дней. В итоге наблюдалось увеличение поглощения глюкозы периферическими тканями и адипоцитами [32]. Роль селена в регуляции углеводного метаболизма в печени также была подробно исследована в работе Chen и соавт. [33], где было обнаружено, что введение селена крысам с диабетом (в дозе 1 ppm с питьевой водой) повышает поглощение глюкозы клетками и восстанавливает активность глюкозо-6-фосфатазы и гликогенфосфорилазы, которые участвуют в выработке глюкозы в печени.
Steinbrenner и соавт. [34] доказали, что селенопротеин P (Sepp1) обеспечивает дополнительную антиоксидантную защиту островков Лангерганса, выступая донором селена для функции других антиоксидантных селенопротеинов, таких как GPx, и участвуя в защите клеточных мембран от окислительного повреждения. Sepp1 также обнаружен в клетках, секретирующих глюкагон. Однако повышенные концентрации глюкозы в диапазоне 11–22 ммоль/л нарушают регуляцию экспрессии Sepp1 в β-клетках, что может снижать антиоксидантную функцию и вызывать нарушения углеводного обмена.
Лабунский и соавт. [35] обнаружили, что дефицит Sepp1 и метионинсульфоксидредуктазы 1 (MsrB1) у трансгенных мышей вызывает непереносимость глюкозы и гиперинсулинемию. В исследовании Zou и соавт. [36] выявлено, что введение селена в дозе ppm в питьевой воде трансгенным крысам с диабетом снижает концентрацию глюкозы в сыворотке крови, перекисное окисление липидов и активность ферментов аспартатаминотрансферазы, аланинаминотрансферазы и щелочной фосфатазы. Дополнительно добавки селена повышают активность основных антиоксидантных ферментов, таких как GPx, супероксиддисмутаза и каталаза.
Селен и риск развития СД2
Клинические данные о влиянии селена на риск развития СД неоднозначны. В некоторых исследованиях отмечается, что повышение уровня селена связано с уменьшением риска развития СД2. В частности, в исследовании SELECT (Selenium and Vitamin E Cancer Prevention Trial) было показано, что добавки селена могут снижать риск развития СД2 у мужчин с исходно нормальными уровнями селена в крови [37]. Установлено, что добавки селена могут снижать уровни маркеров окислительного стресса и улучшать чувствительность к инсулину у пациентов с МС. Это подтверждено в систематическом обзоре и метаанализе: добавки селена значительно снижают уровни инсулина и индекс HOMA-IR, а также увеличивают уровни холестерина ЛПВП (липопротеинов высокой плотности). В то же время прием добавок селена не оказал значительного влияния на уровни глюкозы натощак и другие липидные показатели [38].
Есть исследования и с противоположными результатами, с указанием на увеличение риска при высоком уровне селена в организме. Такая неоднозначность может быть обусловлена различиями в методах исследования, популяционных характеристиках и уровнях потребления селена. Так, в рандомизированном контролируемом исследовании Stranges и соавт. (2007) изучали влияние длительного приема добавок селена на частоту развития СД2. У пациентов, получавших добавки селена (200 мкг в день), увеличился риск развития диабета по сравнению с группой плацебо. Авторы предположили, что избыточное потребление селена может приводить к нарушению гомеостаза [39]. В другом популяционном исследовании, проведенном в США, показано, что высокие уровни селена в сыворотке крови были связаны с повышенным риском развития СД2. У участников с самыми высокими уровнями селена риск диабета был значительно выше, чем у тех, чьи уровни селена были на нижнем квартиле [40].
 В работе Gao и соавт. (2014) изучали влияние потребления селена на риск развития СД2 у китайской популяции. Согласно результатам, высокие уровни селена в крови были связаны с увеличенным риском развития диабета, особенно у женщин. Авторы отметили важность индивидуального подхода к потреблению селена и предостережение от его чрезмерного потребления [41]. В когортном исследовании Akbaraly и соавт. (2010), проведенном среди французских мужчин и женщин, было показано, что умеренные уровни селена в крови ассоциированы с наименьшим риском развития СД, тогда как низкие и высокие уровни селена были связаны с повышенным риском. Эти результаты подчеркивают важность поддержания оптимального уровня селена для предотвращения метаболических нарушений [42].
В работе Gao и соавт. (2014) изучали влияние потребления селена на риск развития СД2 у китайской популяции. Согласно результатам, высокие уровни селена в крови были связаны с увеличенным риском развития диабета, особенно у женщин. Авторы отметили важность индивидуального подхода к потреблению селена и предостережение от его чрезмерного потребления [41]. В когортном исследовании Akbaraly и соавт. (2010), проведенном среди французских мужчин и женщин, было показано, что умеренные уровни селена в крови ассоциированы с наименьшим риском развития СД, тогда как низкие и высокие уровни селена были связаны с повышенным риском. Эти результаты подчеркивают важность поддержания оптимального уровня селена для предотвращения метаболических нарушений [42].
Таким образом, адекватное потребление селена очень важно для поддержания гомеостаза глюкозы и липидного обмена. Чрезмерное или недостаточное его потребление ведет к увеличению или уменьшению содержания селенопротеинов в организме, что, в свою очередь, создает высокий риск развития СД2. Считается, что дозы селена в пределах 50–80 мкг в сутки безопасны и потенциально полезны для метаболического здоровья, хотя конкретные данные о снижении риска диабета в этих дозах требуют дальнейших исследований [43].
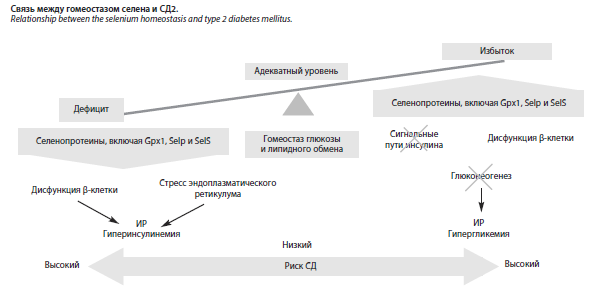
Схематично эта связь представлена на рисунке. Аномально низкое или высокое содержание селенопротеинов, включая Gpx1, SelP и SelS, может вызывать окислительное повреждение β-клеток, нарушение передачи сигналов инсулина, стресс эндоплазматического ретикулума и глюконеогенез, которые индуцируют дефекты секреции инсулина или ИР. Поэтому рекомендуется восполнять дефицит селена в зависимости от его статуса [44].
Следует отметить, что существует несколько разновидностей препаратов селена. Первые применения препаратов селена начались еще в 1970-х годах, когда основными формами селена в пище были селенит и селенат натрия. Сегодня доступно несколько органических селеносодержащих соединений – селеноцистеин, селенопиран, эбселен, наноселен и дрожжи, обогащенных этим элементом.
Биохимический путь метаболизма органических и неорганических форм селена схож: Se-Met, как и натрия селенит, взаимодействует с GPX1, образуя селенид, формируя селенофосфат и селеноцистеил-тРНК. Метилированные формы селена выводятся с мочой, дыханием и желчью. Элементарный селен практически неактивен (нульвалентный), а биодоступность селеносодержащих аминокислот сравнима с селенитом натрия.
При выборе химической формы селена следует учитывать ее эффективность и безопасность. Диселениды, такие как селенопиран (LD50 – 1600 мг/кг) и диметилдипиразолилселенид (8100 мг/кг), обладают очень низкой токсичностью. Несмотря на то что органические формы селена наименее токсичны, неорганические соединения (натрия селенит и натрия селенат) легче выводятся из организма, и их потребление в рекомендуемых фиксированных дозах более безопасно по сравнению с органическими формами, особенно при высоких дозах Se-Met (селенометионина). Однако препараты селена назначают в микрограммах, и ни одно из разрешенных в России соединений селена не достигает токсического порога при рекомендованных дозах.
Одним из зарегистрированных в России препаратов селена является «Селцинк плюс» (производитель PRO.MED.CS Praha a. s.), содержащий комплекс антиоксидантов: селенит натрия (0,05 мг), цинк (7,2 мг),
β-каротин (4,8 мг), витамины Е (31,5 мг) и С (180 мг) (см. рисунок). «Селцинк плюс» обладает рядом значительных преимуществ. Входящий в его состав цинк имеет высокую биодоступность благодаря органической форме лактата. Кроме того, синергическое взаимодействие компонентов, таких как β-каротин и токоферол в сочетании с цинком и оптимальной и безопасной дозой селена, усиливает общий антиоксидантный эффект препарата.
Заключение
Селен оказывает значительное влияние на инсулиночувствительность через различные механизмы, включая антиоксидантную защиту, модуляцию экспрессии генов и взаимодействие с ключевыми компонентами сигнального пути инсулина. По итогам экспериментальных и клинических исследований добавок селена доказано улучшение инсулиновой чувствительности и снижение риска СД2. Однако следует учитывать возможные негативные последствия при потреблении высоких доз селена. Эти данные подчеркивают важность индивидуального подхода к потреблению селена и необходимость дальнейших исследований для определения оптимальных уровней его потребления для профилактики и лечения ИР и СД2.
Ключевые положения:
• Основные механизмы действия селена связаны с регуляцией внутриклеточной концентрации АФК, а также углеводного и липидного обмена.
• При потреблении в достаточных количествах для поддержания концентрации в плазме в диапазоне 80–120 мкг/л селен действует как антиоксидант и питательное вещество, имитирующее инсулин, способствуя синтезу и физиологическому действию инсулина.
• Когда потребление селена приводит к повышению уровня в плазме выше 120 мкг/л, окислительно-восстановительное состояние клеток может нарушаться, что изменяет сигнальный путь инсулина.
• Влияние селена на ИР зависит от химической формы (органической или неорганической), дозы и времени воздействия.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе
Information about the author
Дудинская Екатерина Наильевна – д-р мед. наук, проф. кафедры болезней старения Института непрерывного образования и профессионального развития ФДПО, ФГАОУ ВО «РНИМУ
им. Н.И. Пирогова» Минздрава России.
E-mail: Katharina.gin@gmail.com; ORCID: 0000-0001-7891-6850;
eLibrary SPIN: 4985-6315
Ekaterina N. Dudinskaya – Dr. Sci. (Med.),Prof., Pirogov Russian National Research Medical University.
E-mail: Katharina.gin@gmail.com;
ORCID: 0000-0001-7891-6850; eLibrary SPIN: 4985-6315
Поступила в редакцию: 11.06.2024
Поступила после рецензирования: 21.06.2024
Принята к публикации: 27.06.2024
Received: 11.06.2024
Revised: 21.06.2024
Accepted: 27.06.2024
Клинический разбор в общей медицине №6 2024
Роль селена в патогенезе инсулинорезистентности и сахарного диабета
Аннотация
Инсулинорезистентность (ИР) и сахарный диабет типа 2 (СД2) – это серьезные, неуклонно прогрессирующие глобальные эпидемии, затрагивающие миллионы людей по всему миру. ИР связана со множеством сопутствующих заболеваний, включая СД2, который неизбежно усложняет течение и прогноз сердечно-сосудистых заболеваний и является одной из главных причин смертности населения. Хорошо известно, что ИР инициирует гиперинсулинемию, усиление хронического воспаления и окислительного стресса, что в конечном итоге приводит к морфофункциональным изменениям сосудистой стенки и ускоряет процессы атерогенеза и артериосклероза. В этих процессах немаловажную роль играют микроэлементы селен (Se) и цинк (Zn), которые участвуют в антиоксидантной защите и поддержании репаративных свойств эндотелия. Кроме того, селен регулирует иммунную функцию и некоторые процессы метаболизма глюкозы, что вызывает интерес к их роли в патогенезе ИР и СД2. В статье проанализированы данные исследований последних лет о влиянии селена на риск развития СД2.
Ключевые слова: инсулинорезистентность, сахарный диабет, антиоксиданты, селен, цинк.
Для цитирования: Дудинская Е.Н. Роль селена в патогенезе инсулинорезистентности и сахарного диабета. Клинический разбор в общей медицине. 2024; 5 (6): 95–101. DOI: 10.47407/kr2024.5.6.00441
Role of selenium in the pathogenesis of insulin resistance and diabetes mellitus
E.N. Dudinskaya
Russian Gerontological Scientific and Clinical Center, Pirogov Russian National Research Medical University, Moscow, Russia
Katharina.gin@gmail.com
Abstract
Insulin resistance (IR) and type 2 diabetes mellitus (T2D) represent serious, steadily progressing global epidemics involving millions of people all over the world. IR is associated with numerous concomitant disorders, including T2D that inevitably complicates the course and outcomes of cardiovascular disorders and represents one of the leading causes of death in the population [1]. It is well known that IR leads to hyperinsulinemia, increase in chronic inflammation and oxidative stress, which finally result in the vascular wall morphofunctional alterations and accelerate atherogenesis and arteriosclerosis. Micronutrients, such as selenium (Se) and zink (Zn) that are involved in antioxidant defense and maintaining reparative properties of the endothelium, play an important role in these processes. Furthermore, selenium regulates the immune function and some glucose metabolism processes, which causes interest in their role in the pathogenesis of IR and T2D. The paper provides the analysis of current data on the impact of selenium on the risk of T2D based on the recent studies.
Keywords: insulin resistance, diabetes mellitus, antioxidants, selenium, zinc.
For citation: Dudinskaya E.N. Role of selenium in the pathogenesis of insulin resistance and diabetes mellitus. Clinical review for general practice. 2024; 5 (6): 95–101 (In Russ.). DOI: 10.47407/kr2024.5.6.00441
Введение
Селен, ранее считавшийся исключительно токсичным, ныне признан важнейшим эссенциальным микроэлементом. Первые упоминания о селене относятся к XIII в., когда Марко Поло, путешествуя по Тибету, описал случаи отравления лошадей после употребления в пищу местных растений. С тех пор начались сначала осторожные, а потом и интенсивные исследования токсических свойств селена и связанных с его избытком заболеваний [1, 2]. На основе этих ранних исследований селен долгое время считался высокотоксичным элементом, вызывающим «щелочную болезнь» у крупного рогатого скота и врожденные дефекты у людей [3]. Впервые как химический элемент он был открыт в 1817 г. шведским химиком Й.Я. Берцелиусом, а в 1957 г. было впервые сообщено о его гепатопротекторных свойствах [4]. В 60-х годах XX в. были установлены антиоксидантные свойства селена и его роль как эссенциального микроэлемента для человека и животных, основные функции которого – разрушение гидроперекисей и перекисей липидов. Несмотря на свою токсичность, селен выполняет важные биохимические функции и является необходимым элементом для активности ряда ключевых ферментов. Селен относится к группе семи элементов (Fe, Ca, Mg, I, Se, Zn, Cu), дефицит которых наиболее распространен среди жителей планеты [5].
Распространенность дефицита селена
Распространенность дефицита селена варьирует в зависимости от географического расположения, диеты и экологических факторов. В некоторых регионах мира дефицит селена является значимой проблемой для общественного здравоохранения и встречается чаще в районах, где почвы бедны этим микроэлементом, что приводит к низкому его содержанию в продуктах питания.
В некоторых странах Африки и Азии дефицит селена широко распространен. В частности, в Китае, в районе Кешан, дефицит селена был связан с развитием эндемической кардиомиопатии, известной как болезнь Кешана. По итогам эпидемиологических исследований в некоторых районах Китая и Африки до 70% населения может иметь низкий уровень селена в организме [6].
В Европе распространенность дефицита селена также варьирует в зависимости от региона. В некоторых странах, таких как Финляндия, внедрены программы по обогащению почв селеном, что помогло снизить распространенность дефицита. Однако в других странах, таких как Германия и Великобритания, часть населения по-прежнему испытывает недостаток селена из-за низкого содержания его в почвах и, соответственно, в продуктах питания [7].
В США и Канаде уровни потребления селена среди населения считаются адекватными благодаря высокому его содержанию в почвах и широкому потреблению продуктов животного происхождения, богатых им. Однако некоторые группы населения – люди с низким доходом или соблюдающие ограничительные диеты – могут быть подвержены риску дефицита [8].
Дефицит селена – значимая проблема и в некоторых регионах России вследствие низкого содержания его в почвах и, соответственно, в продуктах питания. Наиболее серьезные проблемы с дефицитом селена наблюдаются в Центральной России, Сибири и на Дальнем Востоке. Согласно эпидемиологическому исследованию 2005 г., около 80% населения России испытывает дефицит селена [9]. По итогам другого российского исследования дефицит цинка наблюдается у 20–30% детей и подростков и связан с недостаточным потреблением продуктов, богатых цинком, – мяса, рыбы, яиц и молочных продуктов [10]. В некоторых регионах России предпринимаются усилия по обогащению почв и продуктов питания селеном. Например, в Костромской области была начата программа обогащения хлеба селеном, что позволило значительно уменьшить распространенность его дефицита среди местного населения. А в ряде регионов были внедрены программы обогащения соли и муки цинком, что позволило значительно уменьшить распространенность дефицита среди населения [11].
Особое внимание в отношении дефицита селена привлекают отдельные группы населения. У пожилых людей риск дефицита селена может быть выше из-за распространенной недостаточности питания и ухудшения усвоения микроэлементов. Согласно результатам эпидемиологических исследований, пожилые люди в Европе и Северной Америке часто имеют уровни селена гораздо ниже оптимальных [12]. У лиц с хроническими заболеваниями желудочно-кишечного тракта, почечной недостаточностью или ВИЧ часто имеется дефицит селена. Это связано с нарушением его усвоения и увеличением потребности в этом микроэлементе для поддержания иммунной функции [13].
Известно, что люди, придерживающиеся вегетарианской или веганской диеты, имеют риск дефицита селена, особенно если проживают в регионах с низким содержанием его в почвах. Это связано с тем, что продукты растительного происхождения обычно содержат меньше селена по сравнению с продуктами животного происхождения [14].
Антиоксидантные свойства селена
Основная пищевая форма селена – селенометионин, который эффективно абсорбируется в кишечнике. После всасывания селенометионин либо включается в состав белков вместо метионина, либо метаболизируется до селенида (H2Se), который является ключевым для биологической активности селена. Селенид далее преобразуется в селенофосфат, необходимый для синтеза селенопротеинов. Включение селена в состав этих белков происходит через селеноцистеин, который кодируется UGA-кодоном мРНК, так называемым стоп-кодоном, в связи с чем селеноцистеин называют 21-q аминокислотой.
Селенопротеины играют важную роль в антиоксидантной защите клетки и других метаболических процессах. Среди множества селенопротеинов выделяют основные три семейства: глутатионпероксидазы, тиоредоксинредуктазы и селенопротеин P.
Глутатионпероксидазы (GPX) 1–6-го типов – это основные антиоксидантные ферменты, поддерживающие внутриклеточную концентрацию восстановленного глутатиона. Наиболее изучена цитозольная глутатионпероксидаза (GPX1) [15]. Несмотря на широкое мнение, что GPX1 является основным антиоксидантным ферментом, прямое доказательство этому было получено лишь в конце XX в. Доказано, что GPX1 играет основную протективную роль при развитии окислительного стресса. В экспериментальном исследовании была показана линейная зависимость между активностью GPX1 и выживаемостью трансгенных мышей в условиях выраженного окислительного стресса. При этом активность GPX1 сильно зависит от содержания селена в сравнении с другими ферментами, потому определение активности GPX1 в эритроцитах – простой и чувствительный показатель селенового статуса организма [16]. Внутриклеточный и тканевой уровень GPX1 также влияет на активность апоптоза клеток и на процессы фосфорилирования протеинкиназ, в особенности протеинкиназы С – важнейшего участника сигнального пути инсулина. Вследствие этого механизма гиперактивация и гиперэкспрессия GPX1 приводит к развитию инсулинорезистентности (ИР) и ожирению. Накоплены экспериментальные данные о связи изменения экспрессии GPX1 с этиологией рака, сердечно-сосудистых и аутоиммунных заболеваний, а также СД2 [17].
Тиоредоксинредуктазы (TrxR) относятся к группе пиридиновых оксидоредуктаз и обладают С-концевым селеноцистеиновым остатком, который вместе с соседним цистеином формирует активный селеносульфидный сайт. Эти ферменты отличаются очень широкой субстратной специфичностью, участвуют в восстановлении тиоредоксина и других низкомолекулярных соединений, что делает их ключевыми в метаболизме селена и антиоксидантной защите клетки [15].
Селенопротеин P – это основной внеклеточный источник селена. Именно уровень селенопротеина Р используется как маркер селенового статуса организма. Селенопротеин P – единственный белок, содержащий более одного атома селена (при высокой обеспеченности селеном может содержать вплоть до 10 атомов). Считается, что селенопротеин P выполняет функцию транспорта селена в ткани, главным образом в головной мозг. Снижение активности подтипа селенопротеина Р – Se-BP1 (selenium-binding protein 1) патогномонично для шизофрении и при ее обострении снижается до критических цифр, в то время как при восполнении селена наблюдается улучшение состояния [18]. Основная же функция селенопротеина P также состоит в антиоксидатной защите клетки.
Роль окислительного стресса в формировании инсулинорезистентности
Известно, что при метаболических заболеваниях непрерывное образование свободных радикалов создает условия для окислительных модификаций клеточных компонентов, что, в свою очередь, приводит к дисфункции митохондрий и возможной потере клеточного гомеостаза. В последние годы роль окислительного стресса в метаболическом синдроме (МС) была всесторонне изучена [19]. Несмотря на то что основной патогенный механизм метаболических изменений у лиц с МС связан с ИР, во многих исследованиях показана тесная связь между МС, хроническим воспалением и окислительным стрессом.
Окислительный стресс играет ключевую роль в патогенезе сосудистых изменений, вызывая или усиливая биохимические процессы, сопровождающие МС. Согласно итогам экспериментальных и клинических наблюдений, оксидативный стресс является важным механизмом развития МС, связанного с ожирением, диабетом и их осложнениями [20].
На молекулярном уровне активные формы кислорода (АФК) генерируются фагоцитами в процессе борьбы с инфекционными агентами и являются одним из важнейших компонентов врожденного иммунитета. АФК запускают каскад определенных иммунных процессов и реакций воспаления, включая синтез цитокинов, белков острой фазы, процессы адгезии и апоптоза [21]. В нормальных физиологических условиях клеточный окислительный потенциал уравновешивается системой антиоксидантной защиты, включающей низкомолекулярные антиоксиданты и антиоксидантные ферменты. Однако при чрезмерном накоплении АФК происходит окислительное повреждение макромолекул, мембран и тканей, что стимулирует хроническое воспаление и ИР [22].
В норме АФК способствуют передаче сигналов инсулина и обеспечивают его типичные метаболические действия. Кратковременные высокие концентрации АФК способствуют увеличению поглощения глюкозы адипоцитами и мышцами, стимулируют транслокацию GLUT-4 и синтез липидов в адипоцитах. Однако в условиях окислительного стресса активируются сигнальные каскады серин/треонин киназ (С-концевая и N-концевая киназа, ядерный фактор-kappa B – NF-kB), стимулирующие фосфорилирование молекул IRS-1 и IRS-2 [23]. В результате модифицированные молекулы IRS-1 подвергаются ускоренной деградации, что нарушает сигнальный путь инсулина и препятствует реализации его метаболических эффектов [24].
Эта модель составляет молекулярную основу ИР, вызванной окислительным стрессом, которая характерна не только для лиц с диабетом, но и для страдающих ожирением и МС.
Роль селена в модуляции инсулинорезистентности
β-клетки поджелудочной железы известны своей сниженной антиоксидантной защитой, вероятно, из-за важной роли, которую играют физиологические концентрации активных форм кислорода в сигнальных путях инсулина. В ходе исследований выявлена более низкая экспрессия селенопротеинов GPx и более высокая экспрессия Sepp1 в этих клетках. Эти данные позволяют предположить возможную роль селена в регуляции окислительно-восстановительного состояния β-клеток поджелудочной железы [25].
В целом селен, по-видимому, улучшает резистентность к инсулину посредством трех механизмов.
Во-первых, в β-клетках поджелудочной железы селенопротеины, такие как Sepp1 и Gpx, оказывают антиоксидантное действие, тем самым ингибируя избыточное производство активных форм кислорода, что может нарушать путь передачи сигналов инсулина.
Кроме того, селен способствует транскрипции и синтезу проинсулина, фактора промотора инсулина 1 и GLP-1-активируемой протеинкиназы А.
Во-вторых, селен влияет на выработку глюкозы в печени, регулируя ферментативную активность глюкозо-6-фосфатазы и гликогенфосфорилазы и увеличивая экспрессию GLP-1R.
В-третьих, селен повышает чувствительность к инсулину в периферических тканях за счет своего антиоксидантного действия и активации сигнальных путей инсулина [26].
Селенопротеины также могут взаимодействовать с ключевыми компонентами сигнального пути инсулина, такими как фосфоинозитид-3-киназа (PI3K) и протеинкиназа B (Akt), определяя передачу сигнала от альфа-субъединиц инсулинового рецептора внутрь клетки [27].
Кроме того, селен взаимодействует с цинком и магнием, которые также играют важную роль в регуляции сигнального пути инсулина. Например, цинк является кофактором инсулинового рецептора тирозинкиназы [28], а магний необходим для функционирования инсулиновых рецепторов и ферментов, участвующих в метаболизме глюкозы [29].
В ходе исследований последних лет доказано, что селен может модулировать экспрессию генов, связанных с инсулиновым рецептором. Например, селен влияет на экспрессию гена INSR, кодирующего инсулиновый рецептор, что может изменять количество рецепторов на поверхности клеток и, соответственно, их чувствительность к инсулину. Более того, селенопротеины могут регулировать активность транскрипционных факторов, таких как PPARγ (пероксисомный пролифератор-активированный рецептор гамма), который играет ключевую роль в дифференцировке адипоцитов и регуляции метаболизма глюкозы [30].
По итогам экспериментальных исследований установлено противодиабетическое действие селена на поджелудочную железу трансгенных крыс с диабетом. Было обнаружено увеличение уровней мРНК GLP-1R, IRS-1 и препроинсулина. Более того, введение селена увеличивало количество эндокринных островков с восстановлением пула клеток и жизнеспособности клеток поджелудочной железы [31]. В связи с этим полученные результаты позволяют предположить возможную роль селена в физиологическом действии гормонов инкретинов.
В исследовании Iizuka и соавт. трансгенным крысам с диабетом вводили селенит натрия (Na₂SeO₃) внутрибрушинно в дозе 0,173 мг/кг в течение 14 дней. В итоге наблюдалось увеличение поглощения глюкозы периферическими тканями и адипоцитами [32]. Роль селена в регуляции углеводного метаболизма в печени также была подробно исследована в работе Chen и соавт. [33], где было обнаружено, что введение селена крысам с диабетом (в дозе 1 ppm с питьевой водой) повышает поглощение глюкозы клетками и восстанавливает активность глюкозо-6-фосфатазы и гликогенфосфорилазы, которые участвуют в выработке глюкозы в печени.
Steinbrenner и соавт. [34] доказали, что селенопротеин P (Sepp1) обеспечивает дополнительную антиоксидантную защиту островков Лангерганса, выступая донором селена для функции других антиоксидантных селенопротеинов, таких как GPx, и участвуя в защите клеточных мембран от окислительного повреждения. Sepp1 также обнаружен в клетках, секретирующих глюкагон. Однако повышенные концентрации глюкозы в диапазоне 11–22 ммоль/л нарушают регуляцию экспрессии Sepp1 в β-клетках, что может снижать антиоксидантную функцию и вызывать нарушения углеводного обмена.
Лабунский и соавт. [35] обнаружили, что дефицит Sepp1 и метионинсульфоксидредуктазы 1 (MsrB1) у трансгенных мышей вызывает непереносимость глюкозы и гиперинсулинемию. В исследовании Zou и соавт. [36] выявлено, что введение селена в дозе ppm в питьевой воде трансгенным крысам с диабетом снижает концентрацию глюкозы в сыворотке крови, перекисное окисление липидов и активность ферментов аспартатаминотрансферазы, аланинаминотрансферазы и щелочной фосфатазы. Дополнительно добавки селена повышают активность основных антиоксидантных ферментов, таких как GPx, супероксиддисмутаза и каталаза.
Селен и риск развития СД2
Клинические данные о влиянии селена на риск развития СД неоднозначны. В некоторых исследованиях отмечается, что повышение уровня селена связано с уменьшением риска развития СД2. В частности, в исследовании SELECT (Selenium and Vitamin E Cancer Prevention Trial) было показано, что добавки селена могут снижать риск развития СД2 у мужчин с исходно нормальными уровнями селена в крови [37]. Установлено, что добавки селена могут снижать уровни маркеров окислительного стресса и улучшать чувствительность к инсулину у пациентов с МС. Это подтверждено в систематическом обзоре и метаанализе: добавки селена значительно снижают уровни инсулина и индекс HOMA-IR, а также увеличивают уровни холестерина ЛПВП (липопротеинов высокой плотности). В то же время прием добавок селена не оказал значительного влияния на уровни глюкозы натощак и другие липидные показатели [38].
Есть исследования и с противоположными результатами, с указанием на увеличение риска при высоком уровне селена в организме. Такая неоднозначность может быть обусловлена различиями в методах исследования, популяционных характеристиках и уровнях потребления селена. Так, в рандомизированном контролируемом исследовании Stranges и соавт. (2007) изучали влияние длительного приема добавок селена на частоту развития СД2. У пациентов, получавших добавки селена (200 мкг в день), увеличился риск развития диабета по сравнению с группой плацебо. Авторы предположили, что избыточное потребление селена может приводить к нарушению гомеостаза [39]. В другом популяционном исследовании, проведенном в США, показано, что высокие уровни селена в сыворотке крови были связаны с повышенным риском развития СД2. У участников с самыми высокими уровнями селена риск диабета был значительно выше, чем у тех, чьи уровни селена были на нижнем квартиле [40].
 В работе Gao и соавт. (2014) изучали влияние потребления селена на риск развития СД2 у китайской популяции. Согласно результатам, высокие уровни селена в крови были связаны с увеличенным риском развития диабета, особенно у женщин. Авторы отметили важность индивидуального подхода к потреблению селена и предостережение от его чрезмерного потребления [41]. В когортном исследовании Akbaraly и соавт. (2010), проведенном среди французских мужчин и женщин, было показано, что умеренные уровни селена в крови ассоциированы с наименьшим риском развития СД, тогда как низкие и высокие уровни селена были связаны с повышенным риском. Эти результаты подчеркивают важность поддержания оптимального уровня селена для предотвращения метаболических нарушений [42].
В работе Gao и соавт. (2014) изучали влияние потребления селена на риск развития СД2 у китайской популяции. Согласно результатам, высокие уровни селена в крови были связаны с увеличенным риском развития диабета, особенно у женщин. Авторы отметили важность индивидуального подхода к потреблению селена и предостережение от его чрезмерного потребления [41]. В когортном исследовании Akbaraly и соавт. (2010), проведенном среди французских мужчин и женщин, было показано, что умеренные уровни селена в крови ассоциированы с наименьшим риском развития СД, тогда как низкие и высокие уровни селена были связаны с повышенным риском. Эти результаты подчеркивают важность поддержания оптимального уровня селена для предотвращения метаболических нарушений [42].Таким образом, адекватное потребление селена очень важно для поддержания гомеостаза глюкозы и липидного обмена. Чрезмерное или недостаточное его потребление ведет к увеличению или уменьшению содержания селенопротеинов в организме, что, в свою очередь, создает высокий риск развития СД2. Считается, что дозы селена в пределах 50–80 мкг в сутки безопасны и потенциально полезны для метаболического здоровья, хотя конкретные данные о снижении риска диабета в этих дозах требуют дальнейших исследований [43].
Схематично эта связь представлена на рисунке. Аномально низкое или высокое содержание селенопротеинов, включая Gpx1, SelP и SelS, может вызывать окислительное повреждение β-клеток, нарушение передачи сигналов инсулина, стресс эндоплазматического ретикулума и глюконеогенез, которые индуцируют дефекты секреции инсулина или ИР. Поэтому рекомендуется восполнять дефицит селена в зависимости от его статуса [44].
Следует отметить, что существует несколько разновидностей препаратов селена. Первые применения препаратов селена начались еще в 1970-х годах, когда основными формами селена в пище были селенит и селенат натрия. Сегодня доступно несколько органических селеносодержащих соединений – селеноцистеин, селенопиран, эбселен, наноселен и дрожжи, обогащенных этим элементом.
Биохимический путь метаболизма органических и неорганических форм селена схож: Se-Met, как и натрия селенит, взаимодействует с GPX1, образуя селенид, формируя селенофосфат и селеноцистеил-тРНК. Метилированные формы селена выводятся с мочой, дыханием и желчью. Элементарный селен практически неактивен (нульвалентный), а биодоступность селеносодержащих аминокислот сравнима с селенитом натрия.
При выборе химической формы селена следует учитывать ее эффективность и безопасность. Диселениды, такие как селенопиран (LD50 – 1600 мг/кг) и диметилдипиразолилселенид (8100 мг/кг), обладают очень низкой токсичностью. Несмотря на то что органические формы селена наименее токсичны, неорганические соединения (натрия селенит и натрия селенат) легче выводятся из организма, и их потребление в рекомендуемых фиксированных дозах более безопасно по сравнению с органическими формами, особенно при высоких дозах Se-Met (селенометионина). Однако препараты селена назначают в микрограммах, и ни одно из разрешенных в России соединений селена не достигает токсического порога при рекомендованных дозах.
Одним из зарегистрированных в России препаратов селена является «Селцинк плюс» (производитель PRO.MED.CS Praha a. s.), содержащий комплекс антиоксидантов: селенит натрия (0,05 мг), цинк (7,2 мг),
β-каротин (4,8 мг), витамины Е (31,5 мг) и С (180 мг) (см. рисунок). «Селцинк плюс» обладает рядом значительных преимуществ. Входящий в его состав цинк имеет высокую биодоступность благодаря органической форме лактата. Кроме того, синергическое взаимодействие компонентов, таких как β-каротин и токоферол в сочетании с цинком и оптимальной и безопасной дозой селена, усиливает общий антиоксидантный эффект препарата.
Заключение
Селен оказывает значительное влияние на инсулиночувствительность через различные механизмы, включая антиоксидантную защиту, модуляцию экспрессии генов и взаимодействие с ключевыми компонентами сигнального пути инсулина. По итогам экспериментальных и клинических исследований добавок селена доказано улучшение инсулиновой чувствительности и снижение риска СД2. Однако следует учитывать возможные негативные последствия при потреблении высоких доз селена. Эти данные подчеркивают важность индивидуального подхода к потреблению селена и необходимость дальнейших исследований для определения оптимальных уровней его потребления для профилактики и лечения ИР и СД2.
Ключевые положения:
• Основные механизмы действия селена связаны с регуляцией внутриклеточной концентрации АФК, а также углеводного и липидного обмена.
• При потреблении в достаточных количествах для поддержания концентрации в плазме в диапазоне 80–120 мкг/л селен действует как антиоксидант и питательное вещество, имитирующее инсулин, способствуя синтезу и физиологическому действию инсулина.
• Когда потребление селена приводит к повышению уровня в плазме выше 120 мкг/л, окислительно-восстановительное состояние клеток может нарушаться, что изменяет сигнальный путь инсулина.
• Влияние селена на ИР зависит от химической формы (органической или неорганической), дозы и времени воздействия.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе
Information about the author
Дудинская Екатерина Наильевна – д-р мед. наук, проф. кафедры болезней старения Института непрерывного образования и профессионального развития ФДПО, ФГАОУ ВО «РНИМУ
им. Н.И. Пирогова» Минздрава России.
E-mail: Katharina.gin@gmail.com; ORCID: 0000-0001-7891-6850;
eLibrary SPIN: 4985-6315
Ekaterina N. Dudinskaya – Dr. Sci. (Med.),Prof., Pirogov Russian National Research Medical University.
E-mail: Katharina.gin@gmail.com;
ORCID: 0000-0001-7891-6850; eLibrary SPIN: 4985-6315
Поступила в редакцию: 11.06.2024
Поступила после рецензирования: 21.06.2024
Принята к публикации: 27.06.2024
Received: 11.06.2024
Revised: 21.06.2024
Accepted: 27.06.2024
16 августа 2024
Количество просмотров: 747
