Клинический разбор в общей медицине №7 2024
Аннотация
Актуальность. Внедрение в практику ингибиторов контрольных точек (ИКТ) иммунного ответа является шагом к формированию инновационной парадигмы лечения, но вместе с повышением противоопухолевой эффективности может возникнуть потенциальное увеличение кардиотоксичности.
Цель. Изучить частоту клинических проявлений ранней кардиоваскулярной токсичности при применении ингибиторов контрольных точек у больных со злокачественными новообразованиями.
Материалы и методы. В проспективное исследование включено 47 пациентов (27 мужчин, 20 женщин), средний возраст 59,5±7,38 года. Анализировались клинические сердечно-сосудистые симптомы, динамика артериального давления, лабораторные показатели (С-реактивный белок, тропонин I, N-концевой фрагмент предшественника мозгового натрийуретического пептида – NT-proBNP), данные электрокардиограммы и эхокардиографии исходно и в динамике противоопухолевой лекарственной терапии через 3 мес или ранее, при возникновении сердечно-сосудистых симптомов.
Результаты. За период наблюдения частота неблагоприятных клинических сердечно-сосудистых событий составила 17,6% (n=6). Фибрилляция предсердий впервые манифестировала у 5,8% (n=2), симптомы сердечной недостаточности – у 8,8% (n=3), у 2,9% (n=1) развилось острое нарушение мозгового кровообращения. У 3 (8,8%) пациентов сердечно-сосудистые проявления сочетались с отсутствием контроля артериальной гипертензии, потребовавшей коррекции гипотензивной терапии. У 5,9% (n=2) пациентов развилась умеренная дисфункция сердца, у 2,9% (n=1) – легкая дисфункция миокарда по ЭхоКГ-критериям и изменению уровня биомаркеров. Выявлена тенденция к повышению уровней NT-proBNP (р=0,051) и С-реактивного белка (р=0,05). Отмечено статистически-значимое снижение показателя фракции выброса левого желудочка (р=0,02). Манифестация сердечно-сосудистых осложнений у пациентов со злокачественными новообразованиями на фоне терапии ингибиторами контрольных точек была ассоциирована с возрастом (β=0,32; R2 =0,20; р=0,07) и уровнем С-реактивного белка (β=0,46; R2=0,22; р=0,005) (модель – множественная линейная регрессия).
Выводы. Впервые возникшие кардиоваскулярные осложнения на фоне терапии злокачественных новообразований ингибиторами контрольных точек иммунного ответа выявляются с высокой частотой (17,6%), характеризуются снижением фракции выброса левого желудочка, ассоциируются с уровнем С-реактивного белка и возрастом пациентов.
Ключевые слова: ингибиторы контрольных точек, злокачественные новообразования, кардиоваскулярная токсичность.
Для цитирования: Харламова У.В., Важенин А.В., Курченкова О.В, Бросалина А.А., Троян К.Н. Профиль кардиоваскулярной токсичности ингибиторов контрольных точек иммунного ответа. Клинический разбор в общей медицине. 2024; 5 (7): 18–22. DOI: 10.47407/kr2024.5.7.00444
Клинический разбор в общей медицине №7 2024
Профиль кардиоваскулярной токсичности ингибиторов контрольных точек иммунного ответа
Аннотация
Актуальность. Внедрение в практику ингибиторов контрольных точек (ИКТ) иммунного ответа является шагом к формированию инновационной парадигмы лечения, но вместе с повышением противоопухолевой эффективности может возникнуть потенциальное увеличение кардиотоксичности.
Цель. Изучить частоту клинических проявлений ранней кардиоваскулярной токсичности при применении ингибиторов контрольных точек у больных со злокачественными новообразованиями.
Материалы и методы. В проспективное исследование включено 47 пациентов (27 мужчин, 20 женщин), средний возраст 59,5±7,38 года. Анализировались клинические сердечно-сосудистые симптомы, динамика артериального давления, лабораторные показатели (С-реактивный белок, тропонин I, N-концевой фрагмент предшественника мозгового натрийуретического пептида – NT-proBNP), данные электрокардиограммы и эхокардиографии исходно и в динамике противоопухолевой лекарственной терапии через 3 мес или ранее, при возникновении сердечно-сосудистых симптомов.
Результаты. За период наблюдения частота неблагоприятных клинических сердечно-сосудистых событий составила 17,6% (n=6). Фибрилляция предсердий впервые манифестировала у 5,8% (n=2), симптомы сердечной недостаточности – у 8,8% (n=3), у 2,9% (n=1) развилось острое нарушение мозгового кровообращения. У 3 (8,8%) пациентов сердечно-сосудистые проявления сочетались с отсутствием контроля артериальной гипертензии, потребовавшей коррекции гипотензивной терапии. У 5,9% (n=2) пациентов развилась умеренная дисфункция сердца, у 2,9% (n=1) – легкая дисфункция миокарда по ЭхоКГ-критериям и изменению уровня биомаркеров. Выявлена тенденция к повышению уровней NT-proBNP (р=0,051) и С-реактивного белка (р=0,05). Отмечено статистически-значимое снижение показателя фракции выброса левого желудочка (р=0,02). Манифестация сердечно-сосудистых осложнений у пациентов со злокачественными новообразованиями на фоне терапии ингибиторами контрольных точек была ассоциирована с возрастом (β=0,32; R2 =0,20; р=0,07) и уровнем С-реактивного белка (β=0,46; R2=0,22; р=0,005) (модель – множественная линейная регрессия).
Выводы. Впервые возникшие кардиоваскулярные осложнения на фоне терапии злокачественных новообразований ингибиторами контрольных точек иммунного ответа выявляются с высокой частотой (17,6%), характеризуются снижением фракции выброса левого желудочка, ассоциируются с уровнем С-реактивного белка и возрастом пациентов.
Ключевые слова: ингибиторы контрольных точек, злокачественные новообразования, кардиоваскулярная токсичность.
Для цитирования: Харламова У.В., Важенин А.В., Курченкова О.В, Бросалина А.А., Троян К.Н. Профиль кардиоваскулярной токсичности ингибиторов контрольных точек иммунного ответа. Клинический разбор в общей медицине. 2024; 5 (7): 18–22. DOI: 10.47407/kr2024.5.7.00444
Cardiovascular toxicity profile of immune response checkpoint inhibitors
Ulyana V. Kharlamova, Andrei V. Vazhenin, Olga V. Kurchenkova, Alina A. Brosalina,
Ksenia N. Troyan
South Ural State Medical University, Chelyabinsk, Russia
top120@yandex.ru
Abstract
The introduction of immune response checkpoint inhibitors is a step toward an innovative treatment paradigm, but along with increased antitumor efficacy may come a potential increase in cardiotoxicity.
Objective. To study the frequency of clinical manifestations of early cardiovascular toxicity during ICT administration in patients with malignant neoplasms.
Materials and methods. 47 patients (27 men, 20 women), mean age 59,5±7,38 years were included in the prospective study. Clinical cardiovascular symptoms, dynamics of blood pressure, laboratory parameters (C-reactive protein (CRP), troponin I, N-terminal fragment of brain natriuretic peptide precursor (NT-proBNP), electrocardiogram and echocardiography data initially and in the dynamics of antitumor drug treatment in 3 months or earlier, at the onset of cardiovascular symptoms, were analyzed.
Results. During the follow-up period, the incidence of adverse clinical cardiovascular events was 17.6% (n=6). Atrial fibrillation first manifested in 5.8% (n=2), symptoms of heart failure – in 8.8% (n=3), 2.9% (n=1) developed acute cerebral circulatory failure. In 3 patients (8.8%) cardiovascular manifestations were combined with lack of arterial hypertension control, which required correction of hypotensive therapy. Moderate cardiac dysfunction developed in 5.9% (n=2) of patients, in 2.9% (n=1) – mild myocardial dysfunction according to ECHOCG-criteria and changes in the level of biomarkers. There was a tendency to increase NT-proBNP level (p=0.051), CRP level (p=0.05). There was a statistically significant decrease in LVEF (p=0.02). Manifestation of cardiovascular complications in patients with malignant neoplasms against the background of ICT therapy was associated with age (β=0.32; p=0.07), CRP level (β=0.46; R2=0.22; p=0.005) (model – multiple linear regression).
Conclusions. First-time cardiovascular complications on the background of therapy of malignant neoplasms with checkpoint inhibitors are detected with high frequency (17.6%), characterized by a decrease in left ventricular ejection fraction, associated with the level of C-reactive protein and age of patients.
Keywords: checkpoint inhibitors, malignant neoplasms, cardiovascular toxicity.
For citation: Kharlamova U.V., Vazhenin A.V., Kurchenkova O.V., Brosalina A.A., Troyan K.N. Cardiovascular toxicity profile of immune response checkpoint inhibitors. Clinical review for general practice. 2024; 5 (7): 18–22. (In Russ.). DOI: 10.47407/kr2024.5.7.00444
Актуальность
В настоящее время злокачественные новообразования остаются важнейшей медицинской и социальной проблемой, занимая лидирующие позиции в структуре заболеваемости, инвалидизации и смертности населения [1, 2].
Ингибиторы контрольных точек иммунитета (ИКТ) – новый класс противоопухолевых лекарственных препаратов, которые произвели революцию в области лечения онкологических заболеваний. ИКТ представляют собой моноклональные антитела, которые блокируют иммунные контрольные точки и стимулируют активность Т-клеток, активируя иммунную систему для выработки противоопухолевого ответа. Их эффективность зависит от способности реактивировать иммунную систему хозяина для борьбы с раковыми клетками [3, 4].
Многочисленные клинические исследования подтвердили, что ИКТ могут улучшить показатели выживаемости и качество жизни пациентов [5].
Однако побочные реакции на ИКТ встречаются часто и затрагивают несколько органов, что ограничивает их применение в клинической практике. Хотя частота сердечно-сосудистой токсичности относительно низка, она связана с серьезными последствиями и высокой смертностью. С широким распространением в клинической практике ИКТ все большее внимание привлекают иммуноопосредованные нежелательные явления, в частности сердечно-сосудистая токсичность [6, 7].
Патологические механизмы сердечно-сосудистых токсических реакций, связанных с ИКТ, остаются неясными и требуют дальнейшего подтверждения в ходе доклинических и клинических исследований. Частота развития сердечно-сосудистых осложнений на фоне терапии ИКТ иммунного ответа варьирует по данным разных авторов в широком диапазоне, что может быть обусловлено неспецифичностью клинических признаков и синдромосходностью, низкой клинической осведомленностью, отсутствием стандартизированных методов диагностики, рутинных исследований сердечно-сосудистой системы, таких как электрокардиография, анализы крови на биомаркеры повреждения кардиомиоцитов, эхокардиография [8, 9].
Цель. Изучить частоту клинических проявлений ранней кардиоваскулярной токсичности при применении ИКТ у больных со злокачественными новообразованиями.
Материалы и методы. В проспективное исследование включено 47 пациентов (27 мужчин, 20 женщин), средний возраст 59,5±7,38 года.
Критерии включения в исследование: пациенты старше 18 лет с верифицированным диагнозом злокачественного новообразования, требующим, согласно действующим клиническим рекомендациям, терапии ИКТ иммунитета, с общим состоянием пациента по шкале Карновского (ECOG) 0–2, давших информированное согласие на участие в исследовании.
Критерии отказа от включения: наличие сопутствующей патологии (системные аутоиммунные заболевания; текущая неконтролируемая инфекция; перенесенные оперативные вмешательства в течение последних
2 мес; хроническое легочное сердце; активные заболевания печени; врожденные и приобретенные гемодинамически значимые пороки сердца); применение до включения в исследование лекарственных средств и манипуляций с доказанным кардиотоксическим эффектом; отсутствие адекватной визуализации при проведении эхокардиографического исследования миокарда левого желудочка; коматозные состояние, делириозные состояния, алкоголизм/наркомания; психические заболевания; отсутствие возможности выполнения регулярных визитов к кардиологу; отказ пациента от обследования.
Исследование одобрено этическим комитетом ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, протокол №4 от 10.05.2024.
Все привлекаемые лица включались в исследование после ознакомления с информационной картой (протоколом исследования) и подписания информированного согласия.
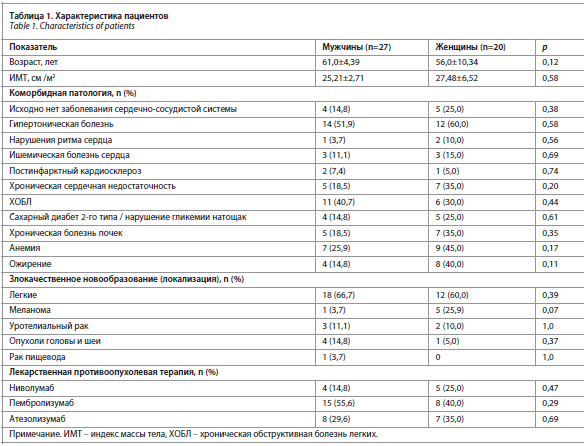 Клиническая характеристика пациентов представлена в табл. 1.
Клиническая характеристика пациентов представлена в табл. 1.
Все пациенты наблюдались, обследовались, получали противоопухолевую лекарственную терапию ИКТ на базе ГАУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», г. Челябинск.
Согласно рекомендациям Европейского общества кардиологов – ESC (совместно с Европейской гематологической ассоциацией – EHA, Европейским обществом терапевтической радиологии и онкологии – ESTRO, Международным обществом кардиоонкологии – IC-OS) 2022 г. в качестве сердечно-сосудистых осложнений лекарственной противоопухолевой терапии рассматривается сердечная недостаточность (или систолическая дисфункция), миокардит, васкулотоксичность, артериальная гипертензия, аритмии (в том числе фибрилляция предсердия), удлинение интервала QT [10].
Все пациенты прошли лабораторно-инструментальное обследование в рамках утвержденных стандартов оказания специализированной медицинской помощи.
Анализировались клинические сердечно-сосудистые симптомы, динамика артериального давления, лабораторные показатели (С-реактивный белок – СРБ, тропонин I, N-концевой фрагмент предшественника мозгового натрийуретического пептида – NT-proBNP), данные электрокардиограммы и эхокардиографии исходно и в динамике противоопухолевой лекарственной терапии через 3 мес или ранее, при возникновении сердечно-сосудистых симптомов [10–12].
Определение уровня высокочувствительного СРБ
(hs-СРБ) производилось твердофазным иммуноферментным методом на анализаторе Hitachi-912 фирмы Hoffmann-LaRocheLtd, Швейцария. Уровень фибриногена определяли с использованием реактивов фирмы «Технология – Стандарт» (Россия) на 4-канальном полуавтоматическом коагулометре DiaMed-CD-4 (Швейцария).
Исследование N-терминального мозгового натрий-уретического пропептида (NT-proBNP) проводилось на автоматическом иммуноферментном анализаторе «Cobas e 411» (Roshe, Швейцария) с помощью набора реагентов Elecsys proBNP II фирмы Roche Diagnostics GmbH (Германия). Референсными значениями NTproBNP считали в диапазоне 0–125 пг/мл. Значения более 125 пг/мл расценивали как вероятную хроническую сердечную недостаточность.
Уровень тропонина I определяли методом иммуноферментного анализа с помощь набора реагентов Cloud-Clone, КНР.
Электрокардиография проводилась на 6-канальном электрокардиографе «Siemens» (ФРГ) в 12 стандартных отведениях с последующей оценкой ЭКГ-категорий по Миннесотскому коду.
Трансторакальная эхокардиография (ЭхоКГ) и допплер-эхокардиография (допплер-ЭхоКГ) проводились на ультразвуковом сканере премиум класса для кардиоваскулярных исследований Philips iE 33 матричным датчиком X5-1 в положении больного лежа на спине и на левом боку под углом 45° по стандартным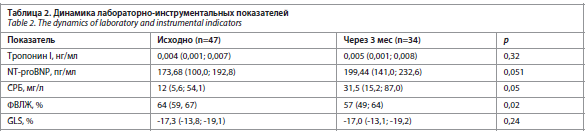 методикам. Тяжелая дисфункция сердца определялась как снижение показателя фракции выброса левого желудочка (ФВЛЖ) de novo менее 40%; умеренная дисфункция сердца – как снижение ФВЛЖ ≥ 10% ФВЛЖ
методикам. Тяжелая дисфункция сердца определялась как снижение показателя фракции выброса левого желудочка (ФВЛЖ) de novo менее 40%; умеренная дисфункция сердца – как снижение ФВЛЖ ≥ 10% ФВЛЖ
40–49% или de novo снижение ФВЛЖ<10% до ФВЛЖ 40–49% и de novo относительное снижение GLS>15% от исходного, либо de novo повышение биомаркеров; легкая – как значение ФВЛЖ≥50% и de novo относительное снижение GLS>15% от исходного и/или de novo повышение биомаркеров [13].
Поскольку в настоящее время валидированных шкал для оценки исходного сердечно-сосудистого риска пациентов, получающих ИКТ-терапию, нет, у пациентов проводилось выявление традиционных факторов риска сердечно-сосудистых заболеваний и использовались невалидированные для онкологических больных калькуляторы: шкала SMART (Second manifestations of arterial disease), шкала ADVANCE (Action in Diabetes and Vascular Disease), SCORE2 (Systematic Coronary Risk Estimation) [13].
Статистическая обработка материала проводилась при помощи лицензионного пакета программ IBM SPSS Statistics19.0. При законе распределения признака в выборке, близком к нормальному, количественные значения представлялись в виде средней арифметической и ее среднеквадратичного отклонения (M±σ). При законе распределения признака, отличающегося от нормального, рассчитывались медиана и интерквартильный размах (Ме; 25–75%). Для оценки различий между двумя группами в количественных признаках при нормальном распределении и равенстве дисперсий применяли t-критерий Стьюдента, в остальных случаях – непараметрический U-критерий Манна–Уитни. Для сравнения средних в более чем двух независимых группах применяли критерий Краскелла–Уоллиса. При уровне значимости р<0,05 проводилось попарное сравнение групп с использованием непараметрического теста Манна–Уитни с поправкой Бонферрони. Качественные признаки описаны абсолютными и относительными частотами с оценкой межгрупповых различий с использованием критерия χ2 Пирсона, а при ожидаемых частотах менее 5 – с помощью точного двустороннего теста Фишера. Для поиска взаимосвязей между факторами данных использован метод регрессионного анализа. Во всех процедурах статистического анализа уровень значимости p принимался равным 0,05.
Результаты
Исходно низкий сердечно-сосудистый риск определен у 9 (19,1%) пациентов, умеренный риск – у 10 (21,3%) больных, высокий или очень высокий кардиоваскулярный риск – у 28 (59,6 %) пациентов.
В процессе наблюдения из исследования выбыли
13 пациентов: 2 пациента из-за развития неприемлемой токсичности противоопухолевой лекарственной терапии, 7 – летального исхода, 1 – смены места жительства, 3 – прогрессирования основного заболевания. Продолжили лечение и наблюдение 34 больных.
За период наблюдения частота неблагоприятных клинических сердечно-сосудистых событий составила 17,6% (n=6). Фибрилляция предсердий впервые манифестировала у 5,8% (n=2), симптомы сердечной недостаточности – у 8,8 % (n=3), у 2,9% (n=1) развилось острое нарушение мозгового кровообращения. У 3 (8,8%) пациентов сердечно-сосудистые проявления сочетались с отсутствием контроля артериальной гипертензии, потребовавшей коррекции гипотензивной терапии. У 5,9% (n=2) пациентов развилась умеренная дисфункция сердца, у 2,9% (n=1) – легкая дисфункция миокарда по ЭхоКГ-критериям и изменению уровня биомаркеров.
Достоверных различий уровня тропонина I в группах в динамике не получено (р=0,32), вместе с тем выявлена тенденция к повышению уровня NT-proBNP (р=0,051) и уровня СРБ (р=0,05), что требует увеличения размера выборки и длительности наблюдения.
Отмечено статистически-значимое снижение показателя ФВЛЖ (табл. 2).
Манифестация сердечно-сосудистых осложнений у пациентов со злокачественными новообразованиями на фоне терапии ИКТ была ассоциирована с возрастом (β=0,32; R2=0,20; р=0,07), уровнем СРБ (β=0,46; R2=0,22; р=0,005) (модель – множественная линейная регрессия).
Обсуждение
Использование ИКТ может вызывать разнообразные нежелательные явления со стороны сердечно-сосудистой системы [14]. Наши данные согласуются с немногочисленными клиническими исследованиями, демонстрируют важность проблемы и требуют увеличения размера выборки для оценки частоты развития сердечно-сосудистых осложнений на фоне терапии ИКТ, изучения механизмов развития и выделения групп риска кардиоваскулярной токсичности.
Внедрение в практику ИКТ является шагом к формированию инновационной парадигмы лечения, но вместе с повышением противоопухолевой эффективности может возникнуть потенциальное увеличение токсичности [15]. Иммунотерапия может вызывать структурные или функциональные изменения в тканях сердца и кровеносных сосудах через прямые или косвенные механизмы, может увеличить выброс антигена опухолевых клеток, тем самым усиливая противоопухолевый иммунный ответ. Но такая чрезмерная активация иммунной системы может также усилить атаку на ткань миокарда, при этом кардиотоксические эффекты, вызванные ИКТ, при клиническом проявлении могут быть серьезными и потенциально смертельными [16–18]. Большинство кардиотоксических эффектов, по-видимому, имеют воспалительную природу. В нашем исследовании выявлена ассоциация манифестации кардиоваскулярных осложнений и уровня СРБ. С увеличением средней продолжительности жизни пациентов и сроков наблюдения за ними повышается и количество регистрируемых осложнений специальных методов лечения злокачественных новообразований. Возраст является независимым фактором риска сердечно-сосудистых заболеваний. Выявленная ассоциация развития кардиотоксичности и возраста отражает его значимость как фактора риска.
Таким образом, прогноз у пациента часто определяется не столько основным заболеванием, сколько сопутствующей патологией – в первую очередь болезнями сердца и сосудов. Высокая прогностическая значимость сердечно-сосудистых осложнений противоопухолевой лекарственной терапии требует разработки новых эффективных средств диагностики, лечения и профилактики, поскольку повреждения сердца, связанные с иммунотерапией, могут частично нивелировать преимущества лечения ИКТ в плане выживаемости, а использование комбинированной иммунотерапии может еще больше повысить риск сердечной токсичности, связанной с лечением [19].
Выводы
Впервые возникшие кардиоваскулярные осложнения на фоне терапии злокачественных новообразований ИКТ выявляются с высокой частотой (17,6%), характеризуются снижением фракции выброса левого желудочка, ассоциируются с уровнем С-реактивного белка и возрастом пациентов.
Конфликт интересов. Исследование выполнено при финансовой поддержке Российского научного фонда (соглашение № 24-25-20035). Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The study was financially supported by the Russian Science Foundation (Agreement No. 24-25-20035). The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Харламова Ульяна Владимировна – д-р мед. наук, доцент, проф. каф. Безопасности жизнедеятельности, медицины катастроф, скорой и неотложной медицинской помощи, ФГБОУ ВО ЮУГМУ.
E-mail: top120@yandex.ru; ORCID: 0000-0003-2421-5797
Ulyana V. Kharlamova – Dr. Sci. (Med.), Assoc. Prof., South Ural State Medical University (Chelyabinsk).
ORCID: 0000-0003-2421-5797
Важенин Андрей Владимирович – академик РАН, д-р мед. наук, проф., Заслуженный врач РФ, зав. каф. онкологии, лучевой диагностики и лучевой терапии, ФГБОУ ВО ЮУГМУ.
ORCID: 0000-0002-7807-8479
Andrei V. Vazhenin – Acad. RAS, Dr. Sci. (Med.), Full Prof., South Ural State Medical University (Chelyabinsk).
ORCID: 0000-0002-7807-8479
Курченкова Ольга Валерьевна – врач-онколог, старший лаборант каф. онкологии, лучевой диагностики и лучевой терапии, ФГБОУ ВО ЮУГМУ. ORCID: 0000-0002-4570-1404
Olga V. Kurchenkova – Oncologist, Senior Laboratory Assistant, South Ural State Medical University (Chelyabinsk). ORCID: https://orcid.org/0000-0002-4570-1404
Бросалина Алина Андреевна – врач-онколог, лаборант, ФГБОУ ВО ЮУГМУ
Alina A. Brosalina – Oncologist, Laboratory technician, South Ural State Medical University (Chelyabinsk)
Троян Ксения Николаевна – врач-кардиолог, ассистент каф. Безопасности жизнедеятельности, медицины катастроф, скорой
и неотложной медицинской помощи, ФГБОУ ВО ЮУГМУ
Ksenia N. Troyan – Cardiologist, Assistant, South Ural State Medical University (Chelyabinsk)
Поступила в редакцию: 30.05.2024
Поступила после рецензирования: 31.05.2024
Принята к публикации: 13.06.2024
Received: 30.05.2024
Revised: 31.05.2024
Accepted: 13.06.2024
Ulyana V. Kharlamova, Andrei V. Vazhenin, Olga V. Kurchenkova, Alina A. Brosalina,
Ksenia N. Troyan
South Ural State Medical University, Chelyabinsk, Russia
top120@yandex.ru
Abstract
The introduction of immune response checkpoint inhibitors is a step toward an innovative treatment paradigm, but along with increased antitumor efficacy may come a potential increase in cardiotoxicity.
Objective. To study the frequency of clinical manifestations of early cardiovascular toxicity during ICT administration in patients with malignant neoplasms.
Materials and methods. 47 patients (27 men, 20 women), mean age 59,5±7,38 years were included in the prospective study. Clinical cardiovascular symptoms, dynamics of blood pressure, laboratory parameters (C-reactive protein (CRP), troponin I, N-terminal fragment of brain natriuretic peptide precursor (NT-proBNP), electrocardiogram and echocardiography data initially and in the dynamics of antitumor drug treatment in 3 months or earlier, at the onset of cardiovascular symptoms, were analyzed.
Results. During the follow-up period, the incidence of adverse clinical cardiovascular events was 17.6% (n=6). Atrial fibrillation first manifested in 5.8% (n=2), symptoms of heart failure – in 8.8% (n=3), 2.9% (n=1) developed acute cerebral circulatory failure. In 3 patients (8.8%) cardiovascular manifestations were combined with lack of arterial hypertension control, which required correction of hypotensive therapy. Moderate cardiac dysfunction developed in 5.9% (n=2) of patients, in 2.9% (n=1) – mild myocardial dysfunction according to ECHOCG-criteria and changes in the level of biomarkers. There was a tendency to increase NT-proBNP level (p=0.051), CRP level (p=0.05). There was a statistically significant decrease in LVEF (p=0.02). Manifestation of cardiovascular complications in patients with malignant neoplasms against the background of ICT therapy was associated with age (β=0.32; p=0.07), CRP level (β=0.46; R2=0.22; p=0.005) (model – multiple linear regression).
Conclusions. First-time cardiovascular complications on the background of therapy of malignant neoplasms with checkpoint inhibitors are detected with high frequency (17.6%), characterized by a decrease in left ventricular ejection fraction, associated with the level of C-reactive protein and age of patients.
Keywords: checkpoint inhibitors, malignant neoplasms, cardiovascular toxicity.
For citation: Kharlamova U.V., Vazhenin A.V., Kurchenkova O.V., Brosalina A.A., Troyan K.N. Cardiovascular toxicity profile of immune response checkpoint inhibitors. Clinical review for general practice. 2024; 5 (7): 18–22. (In Russ.). DOI: 10.47407/kr2024.5.7.00444
Актуальность
В настоящее время злокачественные новообразования остаются важнейшей медицинской и социальной проблемой, занимая лидирующие позиции в структуре заболеваемости, инвалидизации и смертности населения [1, 2].
Ингибиторы контрольных точек иммунитета (ИКТ) – новый класс противоопухолевых лекарственных препаратов, которые произвели революцию в области лечения онкологических заболеваний. ИКТ представляют собой моноклональные антитела, которые блокируют иммунные контрольные точки и стимулируют активность Т-клеток, активируя иммунную систему для выработки противоопухолевого ответа. Их эффективность зависит от способности реактивировать иммунную систему хозяина для борьбы с раковыми клетками [3, 4].
Многочисленные клинические исследования подтвердили, что ИКТ могут улучшить показатели выживаемости и качество жизни пациентов [5].
Однако побочные реакции на ИКТ встречаются часто и затрагивают несколько органов, что ограничивает их применение в клинической практике. Хотя частота сердечно-сосудистой токсичности относительно низка, она связана с серьезными последствиями и высокой смертностью. С широким распространением в клинической практике ИКТ все большее внимание привлекают иммуноопосредованные нежелательные явления, в частности сердечно-сосудистая токсичность [6, 7].
Патологические механизмы сердечно-сосудистых токсических реакций, связанных с ИКТ, остаются неясными и требуют дальнейшего подтверждения в ходе доклинических и клинических исследований. Частота развития сердечно-сосудистых осложнений на фоне терапии ИКТ иммунного ответа варьирует по данным разных авторов в широком диапазоне, что может быть обусловлено неспецифичностью клинических признаков и синдромосходностью, низкой клинической осведомленностью, отсутствием стандартизированных методов диагностики, рутинных исследований сердечно-сосудистой системы, таких как электрокардиография, анализы крови на биомаркеры повреждения кардиомиоцитов, эхокардиография [8, 9].
Цель. Изучить частоту клинических проявлений ранней кардиоваскулярной токсичности при применении ИКТ у больных со злокачественными новообразованиями.
Материалы и методы. В проспективное исследование включено 47 пациентов (27 мужчин, 20 женщин), средний возраст 59,5±7,38 года.
Критерии включения в исследование: пациенты старше 18 лет с верифицированным диагнозом злокачественного новообразования, требующим, согласно действующим клиническим рекомендациям, терапии ИКТ иммунитета, с общим состоянием пациента по шкале Карновского (ECOG) 0–2, давших информированное согласие на участие в исследовании.
Критерии отказа от включения: наличие сопутствующей патологии (системные аутоиммунные заболевания; текущая неконтролируемая инфекция; перенесенные оперативные вмешательства в течение последних
2 мес; хроническое легочное сердце; активные заболевания печени; врожденные и приобретенные гемодинамически значимые пороки сердца); применение до включения в исследование лекарственных средств и манипуляций с доказанным кардиотоксическим эффектом; отсутствие адекватной визуализации при проведении эхокардиографического исследования миокарда левого желудочка; коматозные состояние, делириозные состояния, алкоголизм/наркомания; психические заболевания; отсутствие возможности выполнения регулярных визитов к кардиологу; отказ пациента от обследования.
Исследование одобрено этическим комитетом ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, протокол №4 от 10.05.2024.
Все привлекаемые лица включались в исследование после ознакомления с информационной картой (протоколом исследования) и подписания информированного согласия.
 Клиническая характеристика пациентов представлена в табл. 1.
Клиническая характеристика пациентов представлена в табл. 1.Все пациенты наблюдались, обследовались, получали противоопухолевую лекарственную терапию ИКТ на базе ГАУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», г. Челябинск.
Согласно рекомендациям Европейского общества кардиологов – ESC (совместно с Европейской гематологической ассоциацией – EHA, Европейским обществом терапевтической радиологии и онкологии – ESTRO, Международным обществом кардиоонкологии – IC-OS) 2022 г. в качестве сердечно-сосудистых осложнений лекарственной противоопухолевой терапии рассматривается сердечная недостаточность (или систолическая дисфункция), миокардит, васкулотоксичность, артериальная гипертензия, аритмии (в том числе фибрилляция предсердия), удлинение интервала QT [10].
Все пациенты прошли лабораторно-инструментальное обследование в рамках утвержденных стандартов оказания специализированной медицинской помощи.
Анализировались клинические сердечно-сосудистые симптомы, динамика артериального давления, лабораторные показатели (С-реактивный белок – СРБ, тропонин I, N-концевой фрагмент предшественника мозгового натрийуретического пептида – NT-proBNP), данные электрокардиограммы и эхокардиографии исходно и в динамике противоопухолевой лекарственной терапии через 3 мес или ранее, при возникновении сердечно-сосудистых симптомов [10–12].
Определение уровня высокочувствительного СРБ
(hs-СРБ) производилось твердофазным иммуноферментным методом на анализаторе Hitachi-912 фирмы Hoffmann-LaRocheLtd, Швейцария. Уровень фибриногена определяли с использованием реактивов фирмы «Технология – Стандарт» (Россия) на 4-канальном полуавтоматическом коагулометре DiaMed-CD-4 (Швейцария).
Исследование N-терминального мозгового натрий-уретического пропептида (NT-proBNP) проводилось на автоматическом иммуноферментном анализаторе «Cobas e 411» (Roshe, Швейцария) с помощью набора реагентов Elecsys proBNP II фирмы Roche Diagnostics GmbH (Германия). Референсными значениями NTproBNP считали в диапазоне 0–125 пг/мл. Значения более 125 пг/мл расценивали как вероятную хроническую сердечную недостаточность.
Уровень тропонина I определяли методом иммуноферментного анализа с помощь набора реагентов Cloud-Clone, КНР.
Электрокардиография проводилась на 6-канальном электрокардиографе «Siemens» (ФРГ) в 12 стандартных отведениях с последующей оценкой ЭКГ-категорий по Миннесотскому коду.
Трансторакальная эхокардиография (ЭхоКГ) и допплер-эхокардиография (допплер-ЭхоКГ) проводились на ультразвуковом сканере премиум класса для кардиоваскулярных исследований Philips iE 33 матричным датчиком X5-1 в положении больного лежа на спине и на левом боку под углом 45° по стандартным
 методикам. Тяжелая дисфункция сердца определялась как снижение показателя фракции выброса левого желудочка (ФВЛЖ) de novo менее 40%; умеренная дисфункция сердца – как снижение ФВЛЖ ≥ 10% ФВЛЖ
методикам. Тяжелая дисфункция сердца определялась как снижение показателя фракции выброса левого желудочка (ФВЛЖ) de novo менее 40%; умеренная дисфункция сердца – как снижение ФВЛЖ ≥ 10% ФВЛЖ 40–49% или de novo снижение ФВЛЖ<10% до ФВЛЖ 40–49% и de novo относительное снижение GLS>15% от исходного, либо de novo повышение биомаркеров; легкая – как значение ФВЛЖ≥50% и de novo относительное снижение GLS>15% от исходного и/или de novo повышение биомаркеров [13].
Поскольку в настоящее время валидированных шкал для оценки исходного сердечно-сосудистого риска пациентов, получающих ИКТ-терапию, нет, у пациентов проводилось выявление традиционных факторов риска сердечно-сосудистых заболеваний и использовались невалидированные для онкологических больных калькуляторы: шкала SMART (Second manifestations of arterial disease), шкала ADVANCE (Action in Diabetes and Vascular Disease), SCORE2 (Systematic Coronary Risk Estimation) [13].
Статистическая обработка материала проводилась при помощи лицензионного пакета программ IBM SPSS Statistics19.0. При законе распределения признака в выборке, близком к нормальному, количественные значения представлялись в виде средней арифметической и ее среднеквадратичного отклонения (M±σ). При законе распределения признака, отличающегося от нормального, рассчитывались медиана и интерквартильный размах (Ме; 25–75%). Для оценки различий между двумя группами в количественных признаках при нормальном распределении и равенстве дисперсий применяли t-критерий Стьюдента, в остальных случаях – непараметрический U-критерий Манна–Уитни. Для сравнения средних в более чем двух независимых группах применяли критерий Краскелла–Уоллиса. При уровне значимости р<0,05 проводилось попарное сравнение групп с использованием непараметрического теста Манна–Уитни с поправкой Бонферрони. Качественные признаки описаны абсолютными и относительными частотами с оценкой межгрупповых различий с использованием критерия χ2 Пирсона, а при ожидаемых частотах менее 5 – с помощью точного двустороннего теста Фишера. Для поиска взаимосвязей между факторами данных использован метод регрессионного анализа. Во всех процедурах статистического анализа уровень значимости p принимался равным 0,05.
Результаты
Исходно низкий сердечно-сосудистый риск определен у 9 (19,1%) пациентов, умеренный риск – у 10 (21,3%) больных, высокий или очень высокий кардиоваскулярный риск – у 28 (59,6 %) пациентов.
В процессе наблюдения из исследования выбыли
13 пациентов: 2 пациента из-за развития неприемлемой токсичности противоопухолевой лекарственной терапии, 7 – летального исхода, 1 – смены места жительства, 3 – прогрессирования основного заболевания. Продолжили лечение и наблюдение 34 больных.
За период наблюдения частота неблагоприятных клинических сердечно-сосудистых событий составила 17,6% (n=6). Фибрилляция предсердий впервые манифестировала у 5,8% (n=2), симптомы сердечной недостаточности – у 8,8 % (n=3), у 2,9% (n=1) развилось острое нарушение мозгового кровообращения. У 3 (8,8%) пациентов сердечно-сосудистые проявления сочетались с отсутствием контроля артериальной гипертензии, потребовавшей коррекции гипотензивной терапии. У 5,9% (n=2) пациентов развилась умеренная дисфункция сердца, у 2,9% (n=1) – легкая дисфункция миокарда по ЭхоКГ-критериям и изменению уровня биомаркеров.
Достоверных различий уровня тропонина I в группах в динамике не получено (р=0,32), вместе с тем выявлена тенденция к повышению уровня NT-proBNP (р=0,051) и уровня СРБ (р=0,05), что требует увеличения размера выборки и длительности наблюдения.
Отмечено статистически-значимое снижение показателя ФВЛЖ (табл. 2).
Манифестация сердечно-сосудистых осложнений у пациентов со злокачественными новообразованиями на фоне терапии ИКТ была ассоциирована с возрастом (β=0,32; R2=0,20; р=0,07), уровнем СРБ (β=0,46; R2=0,22; р=0,005) (модель – множественная линейная регрессия).
Обсуждение
Использование ИКТ может вызывать разнообразные нежелательные явления со стороны сердечно-сосудистой системы [14]. Наши данные согласуются с немногочисленными клиническими исследованиями, демонстрируют важность проблемы и требуют увеличения размера выборки для оценки частоты развития сердечно-сосудистых осложнений на фоне терапии ИКТ, изучения механизмов развития и выделения групп риска кардиоваскулярной токсичности.
Внедрение в практику ИКТ является шагом к формированию инновационной парадигмы лечения, но вместе с повышением противоопухолевой эффективности может возникнуть потенциальное увеличение токсичности [15]. Иммунотерапия может вызывать структурные или функциональные изменения в тканях сердца и кровеносных сосудах через прямые или косвенные механизмы, может увеличить выброс антигена опухолевых клеток, тем самым усиливая противоопухолевый иммунный ответ. Но такая чрезмерная активация иммунной системы может также усилить атаку на ткань миокарда, при этом кардиотоксические эффекты, вызванные ИКТ, при клиническом проявлении могут быть серьезными и потенциально смертельными [16–18]. Большинство кардиотоксических эффектов, по-видимому, имеют воспалительную природу. В нашем исследовании выявлена ассоциация манифестации кардиоваскулярных осложнений и уровня СРБ. С увеличением средней продолжительности жизни пациентов и сроков наблюдения за ними повышается и количество регистрируемых осложнений специальных методов лечения злокачественных новообразований. Возраст является независимым фактором риска сердечно-сосудистых заболеваний. Выявленная ассоциация развития кардиотоксичности и возраста отражает его значимость как фактора риска.
Таким образом, прогноз у пациента часто определяется не столько основным заболеванием, сколько сопутствующей патологией – в первую очередь болезнями сердца и сосудов. Высокая прогностическая значимость сердечно-сосудистых осложнений противоопухолевой лекарственной терапии требует разработки новых эффективных средств диагностики, лечения и профилактики, поскольку повреждения сердца, связанные с иммунотерапией, могут частично нивелировать преимущества лечения ИКТ в плане выживаемости, а использование комбинированной иммунотерапии может еще больше повысить риск сердечной токсичности, связанной с лечением [19].
Выводы
Впервые возникшие кардиоваскулярные осложнения на фоне терапии злокачественных новообразований ИКТ выявляются с высокой частотой (17,6%), характеризуются снижением фракции выброса левого желудочка, ассоциируются с уровнем С-реактивного белка и возрастом пациентов.
Конфликт интересов. Исследование выполнено при финансовой поддержке Российского научного фонда (соглашение № 24-25-20035). Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The study was financially supported by the Russian Science Foundation (Agreement No. 24-25-20035). The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Харламова Ульяна Владимировна – д-р мед. наук, доцент, проф. каф. Безопасности жизнедеятельности, медицины катастроф, скорой и неотложной медицинской помощи, ФГБОУ ВО ЮУГМУ.
E-mail: top120@yandex.ru; ORCID: 0000-0003-2421-5797
Ulyana V. Kharlamova – Dr. Sci. (Med.), Assoc. Prof., South Ural State Medical University (Chelyabinsk).
ORCID: 0000-0003-2421-5797
Важенин Андрей Владимирович – академик РАН, д-р мед. наук, проф., Заслуженный врач РФ, зав. каф. онкологии, лучевой диагностики и лучевой терапии, ФГБОУ ВО ЮУГМУ.
ORCID: 0000-0002-7807-8479
Andrei V. Vazhenin – Acad. RAS, Dr. Sci. (Med.), Full Prof., South Ural State Medical University (Chelyabinsk).
ORCID: 0000-0002-7807-8479
Курченкова Ольга Валерьевна – врач-онколог, старший лаборант каф. онкологии, лучевой диагностики и лучевой терапии, ФГБОУ ВО ЮУГМУ. ORCID: 0000-0002-4570-1404
Olga V. Kurchenkova – Oncologist, Senior Laboratory Assistant, South Ural State Medical University (Chelyabinsk). ORCID: https://orcid.org/0000-0002-4570-1404
Бросалина Алина Андреевна – врач-онколог, лаборант, ФГБОУ ВО ЮУГМУ
Alina A. Brosalina – Oncologist, Laboratory technician, South Ural State Medical University (Chelyabinsk)
Троян Ксения Николаевна – врач-кардиолог, ассистент каф. Безопасности жизнедеятельности, медицины катастроф, скорой
и неотложной медицинской помощи, ФГБОУ ВО ЮУГМУ
Ksenia N. Troyan – Cardiologist, Assistant, South Ural State Medical University (Chelyabinsk)
Поступила в редакцию: 30.05.2024
Поступила после рецензирования: 31.05.2024
Принята к публикации: 13.06.2024
Received: 30.05.2024
Revised: 31.05.2024
Accepted: 13.06.2024

