Клинический разбор в общей медицине №7 2024
Аннотация
Появление мультикиназных ингибиторов (МКИ) и ингибиторов иммунных контрольных точек (ИИКТ) изменило перспективы лечения гепатоцеллюлярного рака (ГЦР). Комбинированная терапия, включающая в себя ИИКТ, пришла на смену сорафенибу как препарату 1-й линии для лечения распространенного ГЦР по причине лучших показателей эффективности и выживаемости по результатам недавно опубликованных клинических исследований III фазы. Однако роль ленватиниба при применении в качестве терапии 1-й линии все еще не ясна, поскольку ни в одном из проспективных исследований не было выполнено сравнение его эффективности с эффективностью ИИКТ при распространенном ГЦР. Несколько ретроспективных исследований показали, что ленватиниб, применяемый в качестве терапии 1-й линии, может не уступать комбинации c ИИКТ. Более того, появляется все больше доказательств того, что лечение ИИКТ связано с худшими исходами у пациентов с ГЦР невирусной этиологии. Это ставит под вопрос превосходство лечения ИИКТ у всех пациентов и выдвигает применение ленватиниба в качестве терапии 1-й линии на первый план как потенциально предпочтительный вариант лечения. Кроме того, накопленные данные подтверждают, что при распространенном ГЦР промежуточной стадии с высокой опухолевой нагрузкой применение ленватиниба в 1-й линии или в комбинации с трансартериальной химиоэмболизацией (ТАХЭ) является предпочтительным вариантом лечения по сравнению с самостоятельным применением ТАХЭ. В настоящем обзоре представлены новейшие данные, подтверждающие растущую роль ленватиниба в 1-й линии терапии при ГЦР. (Clin Mol Hepatol. 2023; 29: 909–923)
Ключевые слова: гепатоцеллюлярный рак; антинеопластические препараты; ингибитор иммунной контрольной точки.
Для цитирования: Чан Л.Л., Чан С.Л. Эволюционная роль ленватиниба в 1-й линии лечения гепатоцеллюлярного рака в новую эру лекарственной терапии. Клинический разбор в общей медицине. 2024; 5 (7): 24–36. DOI: 10.47407/kr2024.5.7.00445
The evolving role of lenvatinib at the new era of first-line hepatocellular carcinoma treatment
Landon L. Chan1, Stephen L. Chan1,2
1 Department of Clinical Oncology, Prince of Wales Hospital, The Chinese University of Hong Kong;
2 State Key Laboratory of Translational Oncology, Sir YK Pao Centre for Cancer, Hong Kong Cancer Institute, The Chinese University of Hong Kong, Hong Kong SAR, China
chanlam_stephen@cuhk.edu.hk
Abstract
Emergence of multi-targeted kinase inhibitors (MTIs) and immune checkpoint inhibitors (ICI) have changed the landscape of management in hepatocellular carcinoma (HCC). Combination therapy involving ICI has superseded sorafenib as the first-line treatment option for advanced HCC due to their superior response rates and survival benefits based on recently published phase III trials. However, the role of first-line lenvatinib remains uncertain as no prospective trials have compared its efficacy with ICI in advanced HCC. Several retrospective studies have shown that first-line lenvatinib may not be inferior to ICI combination. Indeed, a growing body of evidence suggests that ICI treatment is associated with inferior treatment outcome in non-viral HCC patients, questioning the supremacy of ICI treatment in all patients and rendering first-line lenvatinib as a potential preferred treatment option. Furthermore, in high-burden intermediate-stage HCC, accumulating evidence supports first-line lenvatinib, or in combination with transarterial chemoembolization (TACE), as a preferred treatment option over TACE alone. In this Review, we describe the latest evidence surrounding the evolving role of first-line lenvatinib in HCC. (Clin Mol Hepatol. 2023; 29: 909–923)
Keywords: hepatocellular carcinoma; antineoplastic agents; immune checkpoint inhibitor.
For citation: Chan L.L., Chan S.L. The evolving role of lenvatinib at the new era of first-line hepatocellular carcinoma treatment. Clinical review for general practice. 2024; 5 (7): 24–36. (In Russ.). DOI: 10.47407/kr2024.5.7.00445
Введение
Согласно последним статистическим данным
GLOBOCAN [1], гепатоцеллюлярный рак (ГЦР) создает огромную нагрузку на здравоохранение по всему миру. В 2020 г. первичный рак печени (доля ГЦР в структуре которого составляет около 75–85% случаев) занял шестое место среди наиболее часто диагностируемых видов рака с примерно 906 тыс. новых случаев и третье место среди основных причин смертности от рака по всему миру, став причиной 830 тыс. смертей [1]. Несмотря на совершенствование стратегий наблюдения, многие пациенты с ГЦР обращаются к врачу на поздних стадиях заболевания, когда системная терапия становится центральным компонентом лечения.
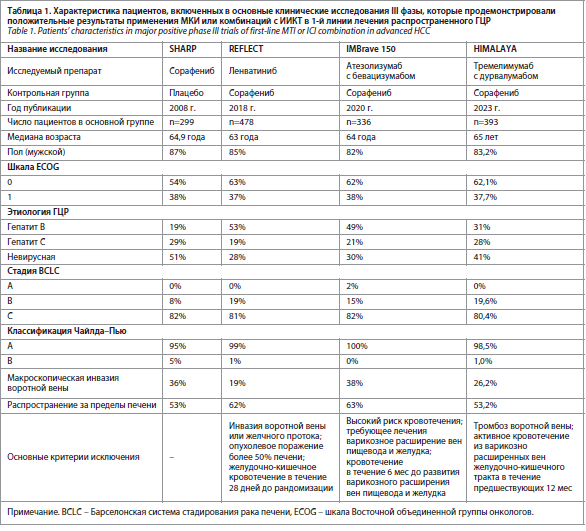
 Возможности системного лечения ГЦР ограничены. Сорафениб стал первым мультикиназным ингибитором (МКИ), зарегистрированным для лечения распространенного ГЦР. Препарат был одобрен в 2007 г. по результатам исследования SHARP, в рамках которого применение сорафениба позволило увеличить показатель выживаемости без прогрессирования (ВБП) с
Возможности системного лечения ГЦР ограничены. Сорафениб стал первым мультикиназным ингибитором (МКИ), зарегистрированным для лечения распространенного ГЦР. Препарат был одобрен в 2007 г. по результатам исследования SHARP, в рамках которого применение сорафениба позволило увеличить показатель выживаемости без прогрессирования (ВБП) с
2,8 мес до 5,5 мес (относительный риск – ОР 0,58; р<0,001), а показатель общей выживаемости (ОВ) –
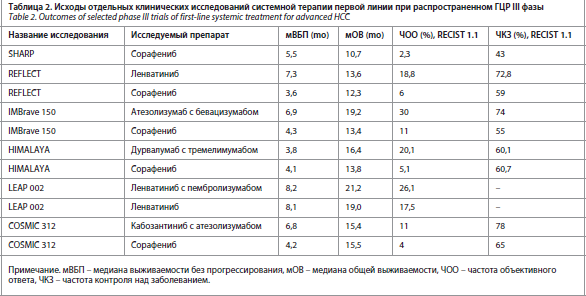
с 7,9 мес до 10,7 мес (ОР 0,69; р<0,001) [2]. Несмотря на то что разница по показателям выше достигла статистической значимости, частота объективного ответа (ЧОО) при применении сорафениба составила лишь 2%, для большинства пациентов из группы сорафениба удалось добиться лишь стабилизации заболевания (табл. 1 и 2). К сожалению, в ходе ряда дальнейших исследований не удалось продемонстрировать преимущества других МКИ перед сорафенибом [3–6], и сорафениб оставался единственным вариантом для системной терапии распространенного ГЦР еще на протяжении 10 лет.
За последние 5 лет возможности системной терапии ГЦР расширились за счет применения МКИ [7–10] и ингибиторов иммунных контрольных точек (ИИКТ) [11, 12]. Регистрация ленватиниба для использования в 1-й линии терапии при ГЦР в 2018 г. на основании исследования REFLECT, подтвердившего не меньшую эффективность препарата, стало поворотным моментом в лечении распространенного ГЦР (см. табл. 1 и 2) [7]. В настоящее время ОВ пациентов с ГЦР увеличилась более чем вдвое – с нескольких месяцев в рамках исследования SHARP до более полутора лет в эру иммунотерапии [2, 13, 14]. Внедрение ИИКТ в качестве терапевтической стратегии привело к революционным изменениям парадигмы лечения многих видов рака, включая ГЦР. Применение атезолизумаба (антитело к PD-L1) в комбинации с бевацизумабом (антитело к VEGF) или дурвалимаба (антитело к PD-L1) в комбинации с тремелимумабом (антитело к CTLA4) продемонстрировало беспрецедентно высокую ЧОО на уровне 20–30% и ОВ на уровне 16–9 мес, результаты невиданные прежде в истории ГЦР (см. табл. 1
и 2). Указанные комбинации с ИИКТ в настоящее время рекомендованы в качестве режимов 1-й линии терапии при ГЦР.
За счет такого стремительного развития системной терапии ГЦР возникает неясность в отношении роли ленватиниба в качестве режима 1-й линии. В частности, принимая во внимание выдающиеся клинические результаты, полученные при применении комбинаций с ИИКТ, следует ли нам отказаться от ленватиниба в 1-й линии терапии при распространенном заболевании? С другой стороны, существуют ли ситуации, когда применение ленватиниба в 1-й линии лечения ГЦР целесообразно или, возможно, является даже более подходящим?
В настоящем обзоре мы разрешим данные противоречия и обсудим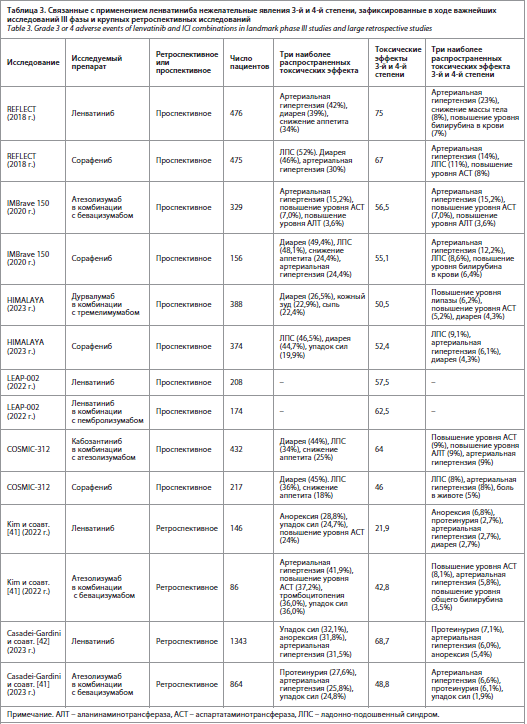 растущую роль ленватиниба в терапии 1-й линии при ГЦР.
растущую роль ленватиниба в терапии 1-й линии при ГЦР.
Ленватиниб в 1-й линии терапии распространенного ГЦР
Пациенты, которым не подходит лечение ИИКТ
Ленватиниб представляет собой оральный МКИ, воздействующий на рецепторы VEGF 1–3, рецепторы FGF 1–4, рецептор PDGF альфа, рецепторы RET и KIT [15]. Монотерапия ленватинибом была одобрена для лечения распространенного ГЦР на основании результатов исследования REFLECT, продемонстрировавшего не меньшую эффективность данного препарата по сравнению с сорафенибом. В этом исследовании медиана ОВ пациентов, получавших ленватиниб, составила 13,6 мес против 12,3 мес у пациентов, получавших сорафениб (ОР 0,92, 95% доверительный интервал – ДИ 0,79–1,06). Пациенты, которые получали лечение ленватинибом, также имели более высокие ВБП (7,4 против 3,7 мес; ОР 0,66; 95% ДИ 0,57–0,77) и ЧОО (24,1% против 9,2%; ОШ 3,13, 95% ДИ 2,15–4,56) по сравнению с получавшими сорафениб. Нежелательные явления во время лечения были схожими для обоих препаратов. Апостериорный (post-hoc) анализ исходов, сообщаемых пациентами (PRO), проведенный в рамках исследования REFLECT, показал, что большинство шкал PRO в целом отдавали предпочтение группе ленватиниба. У пациентов, получавших ленватиниб, значимо позже появлялись усталость, боль и диарея, по сравнению с пациентами, получавшими сорафениб [16]. Метаанализ, в который были включены 15 исследований (n=3908), также продемонстрировал схожие показатели ОВ для сорафениба и ленватиниба с закономерно более высокими показателями ЧОО и ВБП при применении ленватиниба по сравнению с сорафенибом [17]. Помимо этого, применение ленватиниба было связано с более высокой частотой бессимптомных нежелательных явлений, таких как артериальная гипертензия, протеинурия и гипотиреоз, в то время как применение сорафениба было связано с более высокой частотой симптоматических нежелательных явлений, в том числе ладонно-подошвенного синдрома и диареи (табл. 3) [17]. По этой причине ленватиниб может быть более предпочтительным вариантом для применения в клинической практике, нежели сорафениб, если монотерапию МКИ назначают в качестве системного лечения. Однако роль монотерапии МКИ в 1-й линии лечения при распространенном ГЦР стала менее значимой в момент внедрения комбинаций с ИИКТ. На текущий момент для 1-й линии распространенного ГЦР рекомендованы атезолизумаб в комбинации с бевацизумабом (по результатам исследования IMBrave 150 [11, 14]) или дурвалумаб в комбинации с тремелимумабом (по результатам исследования HIMALAYA [18]). Указанные комбинации с ИИКТ продемонстрировали лучшие показатели ЧОО и ОВ в равнении с сорафенибом. Уточненный анализ данных исследования IMBrave 150 продемонстрировал, что атезолизумаб в комбинации с бевацизумабом увеличивал ВБП на 2,6 мес (с 4,3 мес до 6,9 мес), а ОВ – на 5,8 мес (с 13,4 мес до 19,2 мес) по сравнению с сорафенибом. Более высокую ЧОО наблюдали в группе, получавшей атезолизумаб в комбинации с бевацизумабом (30% и 11%); см. табл. 2. Частота связанных с лечением нежелательных явлений 3–4-й степени тяжести в двух экспериментальных группах была схожей (см. табл. 3). Исследование HIMALAYA показало, что применение дурвалумаба в комбинации с тремелимумабом было ассоциировано с увеличением ОВ (16,4 мес против 13,8 мес для сорафениба) и более высокой ЧОО (20,1% в группе дурвалумаба в комбинации с тремелимумабом против 5,1% в группе сорафениба) [12]. Однако показатели ВБП при применении дурвалумаба в комбинации с тремелимумабом и сорафениба были одинаковыми (3,8 мес против 4,1 мес); см. табл. 2. Примечательно, что плато кривой выживаемости пациентов, получавших дурвалумаб и тремелимумаб, примерно соответствует 30% – это говорит о том, что значительная часть пациентов выжила в долгосрочной перспективе.
Несмотря на более высокие ЧОО и выживаемость, обеспечиваемые применением комбинаций с ИИКТ, существуют сценарии, при которых клиницисты могут отдать предпочтение ленватинибу вместо комбинаций с ИИКТ, учитывая сопутствующие заболевания, физическое состояние и предпочтения пациентов. Например, пациентам требующим лечения или с недолеченным варикозным расширением вен пищевода и желудка, у которых есть признаки портальной гипертензии, следует отказаться от применения атезолизумаба в комбинации с бевацизумабом из-за высокого риска кровотечений, связанного с использованием высоких доз бевацизумаба (15 мг/кг). При применении ИИКТ у пациентов с фоновым заболеванием иммунной системы существует риск обострения (до 50%) или развития других иммуноопосредованных нежелательных явлений.
В действительности эту категорию пациентов обычно исключают из клинических исследований ИИКТ [19, 20]. Кроме того, назначение клиницистами иммуносупрессивных препаратов пациентам с аутоиммунными заболеваниями в начале терапии ИИКТ остается под вопросом [21].
Важно отметить, что у небольшого числа пациентов с ГЦР (~10–16%) имели место рецидивы после трансплантации печени [22]. Трансплантация печени – вариант радикального лечения для определенной группы пациентов с ГЦР, которые соответствуют миланским критериям [23]. Пациентам, перенесшим трансплантацию печени, требуется длительное лечение иммуносупрессивными препаратами для профилактики острого или хронического отторжения трансплантата. Применение ИИКТ при рецидиве ГЦР является спорным из-за риска усиления аллоиммунитета и индукции отторжения, а также из-за сомнений в эффективности применения ИИКТ на фоне терапии иммуносупрессорами [24]. На самом деле данных по этой теме мало. Согласно недавнему обзору литературы, в который были включены 27 случаев трансплантации печени с рецидивом ГЦР и назначением ИИКТ: у 8 (29,6%) пациентов был достигнут контроль над заболеванием, но у 6 (22,2%) пациентов произошло острое отторжение трансплантата [25]. Из этого следует, что наиболее подходящим вариантом системной терапии при рецидиве ГЦР после трансплантации печени по-прежнему являются МКИ. Для сорафениба, представляющего собой МКИ с самой долгой историей использования для лечения ГЦР, в этой группе пациентов накоплено наибольшее количество данных [26–28]. В последнее время также появилось больше информации о применении ленватиниба. В ходе проведенного на Тайване ретроспективного исследования «случай–контроль» были описаны 10 пациентов, которые получали ленватиниб при рецидиве заболевания после трансплантации печени. Медианы ВБП и ОВ составили 3,7 и 16,4 мес соответственно [29]. В этой небольшой когорте пациентов у 20% был достигнут частичный ответ, в 50% случаев – стабилизация болезни. Нежелательные явления в основном относились к 1-й и 2-й степени, развитие артериальной гипертензии 3-й степени отмечено только у 1 пациента. Сравнение с контрольной группой, состоявшей из 25 пациентов с ГЦР без трансплантации печени, получавших ленватиниб в качестве терапии 2-й линии, показало отсутствие различий в ВБП, ОВ и характере наблюдаемых нежелательных явлений [29]. В другом многонациональном многоцентровом ретроспективном исследовании, в ходе которого было проведено обследование 45 пациентов с рецидивом ГЦР после трансплантации печени, при применении ленватиниба были достигнуты медианные ВБП и ОВ, составившие 7,6 мес и 14,5 мес соответственно [30]. Наиболее частым нежелательным явлением 3-й степени была артериальная гипертензия, развитие которой наблюдалось у 20% пациентов. Нежелательных явлений 4-й степени не отмечалось. В другой представленной в Милане серии из 9 случаев с рецидивом ГЦК после трансплантации печени применение ленватиниба было ассоциировано с медианой ВБП, равной 321 дню, у одного пациента было зарегистрировано нежелательное явление 3-й степени (нефротический синдром), потребовавшее отмены препарата. Сравнение с подобранной когортой пациентов, получавших терапию сорафенибом, показало, что применение ленватиниба было связано с лучшими медианами ВБП и ОВ [31]. В целом ленватиниб также представляет собой эффективный вариант лечения при рецидиве ГЦР после трансплантации печени, без каких-либо новых проявлений токсичности.
Пациенты с тяжелой портальной гипертензией или тромбозом воротной вены Пациенты с тяжелой портальной гипертензией или тромбозом воротной вены (Vp4) представляют собой группу с особенно неблагоприятным прогнозом, имеющую высокий риск развития связанных с лечением нежелательных явлений. При выборе системной терапии для таких пациентов необходимо учитывать дополнительные факторы. Тяжелая портальная гипертензия связана с высоким риском варикозного кровотечения. В последнем консенсусе Baveno VII рекомендованы контроль с применением эндоскопических методов или профилактическое назначение β-адреноблокаторов [32]. Применение анти-VEGF препаратов, таких как ленватиниб и бевацизумаб, у пациентов с тяжелой портальной гипертензией, вызвало опасения по поводу повышения риска варикозных кровотечений и вторичной смертности вследствие обострения портальной гипертензии [33]. В проспективном когортном исследовании влияния ленватиниба на портальную гемодинамику у 28 пациентов с распространенным ГЦР данный препарат снижал кровоток в воротной вене, повышал коэффициент полнокровия и усугублял портальную гипертензию через 2 нед приема [34]. Однако во всех недавно опубликованных отчетах по исследованиям III фазы указано, что при использовании МКИ (включая ленватиниб) частота случаев кровотечения, связанных с портальной гипертензией, составила менее 2% [33, 35].
В проспективном многоцентровом исследовании с участием 93 пациентов, получавших ленватиниб, из которых у 37 отмечалась тяжелая портальная гипертензия, показатель ОВ, по-видимому, не снижался по причине последней [36]. Исследование IMBrave 150, напротив, продемонстрировало повышение риска развития варикозных кровотечений в группе пациентов, получавших атезолизумаб в комбинации с бевацизумабом на 2,4% (в сравнении с 0,6% в группе сорафениба). Следует отметить, что это была группа тщательно подобранных пациентов, которым обеспечили оптимальную профилактику портальной гипертензии, а пациенты с кровотечениями из варикозно расширенных вен пищевода и желудка уже были исключены из исследования [11, 33].
По данным систематического обзора исследований
II фазы, у не прошедших скрининг пациентов применение бевацизумаба было связано с 10% риском развития кровотечений из варикозно расширенных вен [37]. Пациенты с тромбозом воротной вены (Vp4) были исключены из исследований REFLECT и HIMALAYA. Ретроспективное исследование с участием 20 пациентов с Vp4 при распространенном ГЦР продемонстрировало эффективность и безопасность ленватиниба, при этом ЧОО составила 20% (по критериям mRECIST), а медиана ОВ составила 6,7 мес [38]. Варикозные кровотечения наблюдались у двух пациентов (10%). В другом ретроспективном исследовании, в которое был включен 41 пациент с ГЦР и опухолевым тромбозом воротной вены (Vp3/4), получавший лечение сорафенибом или ленватинибом, лечение ленватинибом было единственным значимым предиктором более высоких показателей ОВ (ОР 0,19, 95% ДИ 0,06–0,68; р=0,0106) и времени до прогрессирования опухоли (ОР 0,16, 95% ДИ 0,05–0,56; р=0,004) [39]. Ухудшение функции печени в первые две недели отмечалось в группе ленватиниба, однако впоследствии имело место ее восстановление. В ходе исследования варикозные кровотечения не были отмечены среди нежелательных явлений. Анализ результатов исследования IMBrave 150 по оценке эффективности и безопасности применения атезолизумаба в комбинации с бевацизумабом у пациентов с инвазией воротной вены Vp4, напротив, показал, что ОВ в группе, получавшей атезолизумаб в комбинации с бевацизумабом, была гораздо выше, чем в группе, получавшей сорафениб (7,6 против 5,5 мес; ОР 0,62; 95% ДИ 0,34–1,11), однако в группе, получавшей атезолизумаб в комбинации с бевацизумабом, была выше частота варикозных кровотечений (13,6% против 0%) [40].
Таким образом, у пациентов с тяжелой портальной гипертензией применение дурвалумаба в комбинации с тремелимумабом можно рассмотреть в качестве терапии 1-й линии, так как оно связано с более низким риском кровотечений, чем применение атезолизумаба в комбинации с бевацизумабом и ленватиниба. К сожалению, несмотря на то, что тремелимумаб был одобрен для использования в комбинации с дурвалумабом Управлением по контролю качества пищевых продуктов и лекарственных средств (FDA), а недавно и Европейским агентством лекарственных средств (EMA), он по-прежнему проходит экспертизу регулирующих органов во многих странах мира (например, в Великобритании, Австралии, Гонконге). Помимо этого, крайне высокая стоимость тремелимумаба делает данный режим недоступным для многих пациентов. Выбирая между атезолизумабом, бевацизумабом и ленватинибом, предпочтение отдают ленватинибу, если нет возможности своевременно провести скрининг на варикозные кровотечения перед началом лечения. Аналогичным образом, если нет возможности своевременно провести скрининг на наличие варикозно расширенных вен пищевода/желудка, ленватиниб можно считать более безопасным для пациентов с тромбозом воротной вены, учитывая тот факт, что, согласно анализу результатов исследования IMBrave 150, варикозные кровотечения имели место у 13,4% пациентов, получавших атезолизумаб в комбинации с бевацизумабом.
Уступает ли ленватиниб комбинации с ИИКТ?
Действующие рекомендации по применению комбинаций с ИИКТ в качестве терапии 1-й линии при распространенном ГЦР основаны на более высоких показателях частоты ответа и выживаемости по сравнению с применением сорафениба. Данные проспективных исследований, которые бы позволили сравнить ленватиниб с комбинациями с ИИКТ, отсутствуют. На самом деле было бы логично ожидать, что ленватиниб будет уступать комбинации с ИИКТ, поскольку в рамках исследования REFLECT была продемонстрирована неменьшая эффективность ленватиниба в сравнении с сорафенибом [7]. Недавно появились данные, позволяющие предположить, что назначение ленватиниба в 1-й линии терапии может не уступать комбинации с ИИКТ. В ретроспективном исследовании с участием трех университетских клиник Кореи и включением 232 пациентов с распространенным ГЦР, получавших ленватиниб или атезолизумаб в комбинации с бевацизумабом, не было продемонстрировано статистически значимых различий между режимами по показателям ЧОО (32,6% против 31,5%, р=0,868), ВБП (5,7 против 6,0 мес; р=0,738) и ОВ (не достигнута против 12,8 мес; р=0,357) [41]. Подгрупповой анализ показал, что показатели ОВ пациентов, получавших атезолизумаб в комбинации с бевацизумабом были сопоставимы по всем стратам c аналогичными для пациентов, получавших ленватиниб (возраст, пол, общее состояние, этиология и т.д.), за исключением уровня альфа-фетопротеина (АФП) – при применении ленватиниба уровень АФП более 200 коррелировал с благоприятным исходом. Что касается токсичности, в группе, получавшей атезолизумаб в комбинации с бевацизумабом, зафиксировано больше нежелательных явлений 3-й и 4-й степени, чем в группе, получавшей ленватиниб, однако различия не были статистически достоверны (42,8 против 21,9%; р=0,141) [41]. В другом крупном международном ретроспективном исследовании, в которое были включены 2 205 пациентов с распространенным ГЦР, после того как клинические данные были уравновешены с применением метода взвешивания по обратной вероятности лечения, не были обнаружены различия во времени до прогрессирования (ОР 0,82; р=0,117) и ОВ (ОР 0,97; р=0,739) при сравнении атезолизумаба в комбинации с бевацизумабом и ленватиниба [42]. Однако нежелательные явления 3-й и 4-й степени чаще встречались в группе, получавшей ленватиниб, чем в группе, получавшей атезолизумаб в комбинации с бевацизумабом (84,9 против 69,8%; р=0,009).
Такие результаты ретроспективных исследований могут в некотором смысле привести в замешательство, поскольку можно было бы ожидать, что ленватиниб будет уступать комбинации с ИИКТ. Для интерпретации этих результатов необходимо учитывать несколько моментов. Во-первых, несмотря на то, что первичной конечной точкой в исследовании REFLECT являлась не меньшая ОВ, была продемонстрирована тенденция к улучшению исходов при применении ленватиниба по сравнению с сорафенибом в отношении ОВ, ВБП и ЧОО [7]. Фактически в нескольких исследованиях реальной клинической практики ленватиниб продемонстрировал результаты лучше, чем в рандомизированных клинических исследованиях. Было последовательно показано, что ленватиниб обеспечивает не только более высокую ЧОО, но и лучшие показатели выживаемости по сравнению с сорафенибом [43–45]. Во-вторых, полученные данные свидетельствуют о том, что более высокие результаты для сорафениба связаны с более длительным опытом управления нежелательными явлениями для данного препарата [46, 47]. Учитывая, что сорафениб и ленватиниб принадлежат к одному классу лекарственных препаратов и имеют много схожих характеристик, вполне возможно, что предыдущий опыт использования сорафениба сократил время на обучение управлению нежелательными явлениями при применении ленватиниба, что привело к улучшению клинических исходов. В-третьих, было отмечено, что в обоих перечисленных выше исследованиях в группах, получавших в 1-й линии ленватиниб, большее число пациентов в ходе дальнейшего лечения получили локорегионарную терапию [41, 42]. Однако, как отмечают авторы, такое несоответствие может быть связано с тем, что ленватиниб был одобрен раньше, чем атезолизумаб в комбинации с бевацизумабом, и это стало причиной отсутствия эффективной терапии 2-й линии (т.е. иммунотерапии) для применения после ленватиниба [41].
В целом, хотя и существует множество правдоподобных гипотез, объясняющих одинаковую ОВ у пациентов, которые получали лечение ленватинибом и атезолизумабом в комбинации с бевацизумабом в ходе исследований клинической практики, следует иметь в виду ограничения этих ретроспективных исследований, а именно то, что исследования отличались предвзятостью, а популяция, изученная в составе различных экспериментальных групп, могла быть несбалансированной. Для того чтобы понять, действительно ли эти режимы имеют схожую эффективность, необходимо провести дальнейшие проспективные исследования сбалансированных популяций, предполагающие сравнение эффективности ленватиниба и атезолизумаба в комбинации с бевацизумабом или другой комбинации с ИИКТ.
В проспективных исследованиях монотерапию ленватинибом также сравнивали с терапией комбинацией с ИИКТ. В ходе исследования LEAP 002, представлявшего собой глобальное рандомизированное двойное слепое исследование III фазы, оценивались эффективность и безопасность ленватиниба в комбинации с пембролизумабом и ленватиниба в терапии 1-й линии при распространенном ГЦР. Это первое исследование ленватиниба III фазы после исследования REFLECT. При установленном уровне значимости комбинация ленватиниба и пембролизумаба не продемонстрировала увеличения показателей ВБП и ОВ [48]. Ленватиниб в комбинации с пембролизумабом обеспечил ВБП и ОР, равные 8,2 мес и 21,2 мес соответственно, в сравнении
с 8,1 мес (ОР для ВБП: 0,87, 95% ДИ 0,73–1,02; p=0,047) и 19,0 мес (ОР для ОВ: 0,84, 95% ДИ 0,71–1,00; p=0,0227) соответственно при монотерапии ленватинибом. Следует отметить, что группа, получавшая ленватиниб, показала исключительно хорошие результаты по сравнению с результатами, полученными в исследовании REFLECT (где медиана ОВ составила 13,6 мес), в которое были включены пациенты со схожими характеристиками. При применении комбинации ленватиниб + пембролизумаб ЧОО увеличилась до 26,1% в сравнении с 17,5% в группе, получавшей ленватиниб, что соответствует данным, полученными в рамках исследования REFLECT. Важной причиной исключительных результатов в группе ленватиниба была доступность 2-й линии лечения. В исследовании LEAP 002 52,1% пациентов группы ленватиниба получали последующую терапию; этот процент был выше, чем в исследовании
REFLECT, где составлял лишь 33%. Из этих 52% пациентов, 22,8% получали иммунотерапию (в частности, атезолизумаб в комбинации с бевацизумабом), которая рассматривается как высоко активная при ГЦР [49]. Что касается токсичности, применение ИИКТ характеризовалось более высокой частотой нежелательных явлений: частота связанных с лечением нежелательных явлений 3–5-й степени в группе, получавшей комбинацию ленватиниб + пембролизумаб, составила 62,5% в сравнении с 57,5% в группе, получавшей ленватиниб.
В целом, похоже, что при применении в 1-й линии ленватиниб может быть не менее эффективным, чем комбинации с ИИКТ. Что касается токсичности, в опубликованных исследованиях частота нежелательных явлений 3-й степени и выше при применении ленватиниба варьировала, составив от 20 до 75% (см. табл. 3). Для сравнения: при применении ИИКТ частота нежелательных явлений 3-й степени и выше чаще всего соответствовала 40–50% (см. табл. 3). Наиболее частым нежелательным явлением 3-й степени или выше, связанным с применением ленватиниба, была артериальная гипертензия, которую обычно можно было контролировать с помощью гипотензивных препаратов, перерывов в лечении и снижения дозы. При применении ИИКТ нежелательные явления 3-й степени и выше были более вариабельными в зависимости от ИИКТ [7, 11, 12, 41, 42, 48]. Тем не менее применение ленватиниба в 1-й линии в монорежиме допускает титрование дозы в соответствии с общим состоянием пациента и переносимостью лечения, поэтому данный препарат может быть более универсальным в ситуациях, когда назначение системной терапии находится под вопросом. Следует отметить, что недавнее ретроспективное исследование с участием 176 пациентов с распространенным ГЦР, получавших ленватиниб, показало, что снижение дозы ленватиниба в начале не было связано с худшими показателями выживаемости [50].
Влияет ли этиология ГЦР на результаты терапии?
Раньше, когда для лечения распространенного ГЦР в основном использовались МКИ [2, 7–10], считалось, что этиология ГЦР не влияет на течение болезни. Однако после того как для лечения распространенного ГЦР стали применять ИИКТ, появились данные, что этиология ГЦР может влиять на исход лечения [14, 51]. Например, уточненный анализ данных, проведенный в рамках исследования IMBrave 150, показал, что применение атезолизумаба в комбинации с бевацизумабом обеспечивало увеличение ВБП и ОВ по сравнению с сорафенибом у пациентов с ГЦР вследствие гепатита В (ОР для ОВ: 0,58, 95% ДИ 0,40–0,83; ОР для ВБП: 0,51, 95% ДИ 0,37–0,70), в отличие от ГЦР невирусной этиологии (ОР для ОВ: 1,05, 95% ДИ 0,68–1,63; ОР для ВБП: 0,51, 95% ДИ 0,55–1,17) [14]. Исследование COSMIC
312 – многоцентровое рандомизированное исследование III фазы, в ходе которого было проведено сравнение применения кабозантиниба в комбинации с атезолизумабом и сорафениба при распространенном ГЦР [51]. Хотя в отношении первичной конечной точки исследования (ОВ) были получены отрицательные результаты, запланированный подгрупповой анализ продемонстрировал, что показатели ВБП и ОВ были выше при назначении комбинации в сравнении с сорафенибом у пациентов с ГЦР и гепатитом В (ВБП: ОР 0,46, 95% ДИ 0,29–0,73; ОВ: ОР 0,53, 95% ДИ 0,33–0,87), но не в подгруппе ГЦР невирусной этиологии (ВБП: ОР 0,92, 95% ДИ 0,60–1,41; ОВ: ОР 1,18, 95% ДИ 0,78–1,79) [51]. Недавнее трансляционное исследование показало, что применение анти-PD-1 препаратов может парадоксальным образом индуцировать и ускорять процессы канцерогенеза у пациентов с ГЦР и неалкогольным стеатогепатитом (НАСГ) в качестве фонового заболевания [52]. Группа исследователей обнаружила, что при ГЦР и НАСГ как в мышиной модели, так и в человеческих опухолях имело место специфическое повышение уровня CD8+PD1+ Т-лимфоцитов. Примечательно, что анти-PD-1 терапия способствовала повреждению тканей, приводила к озлокачествлению и обеспечивала большую агрессивность уже имеющихся НАСГ и ГЦР. Кроме того, метаанализ трех опубликованных исследований III фазы (CheckMate 459, Keynote 240 и IMBrave 150), проведенный той же группой ученых, показал, что показатели выживаемости пациентов с ГЦР невирусной этиологии не улучшались при применении иммунотерапии (ОР 0,92, 95% ДИ 0,77–1,11). И напротив, иммунотерапия улучшала показатели ОВ у пациентов с ГЦР вирусной этиологии (ОР 0,64, 95% ДИ 0,48–0,94) [52].
В свете получения таких интересных данных увеличилось число исследований, призванных проверить, что принесет больше пользы пациентам с ГЦР невирусной этиологии – иммунотерапия или терапия МКИ. Недавно опубликованное многонациональное ретроспективное исследование с проспективным набором пациентов, и включением 759 случаев распространенного ГЦР невирусной этиологии, показало, что терапия ленватинибом увеличивала показатели ОВ (ОР: 0,65, 95% ДИ 0,44–0,95; р=0,0268) и ВБП (ОР: 0,67, 95% ДИ 0,51–0,86; р=0,002) в сравнении с терапией комбинацией атезолизумаб + бевацизумабом [53]. В частности, многофакторный анализ показал, что применение ленватиниба в популяции пациентов с неалкогольной жировой болезнью печени (НАЖБП)/НАСГ приводило к увеличению ОВ (ОР: 0,46, 95% ДИ 0,26–0,84; р=0,011) и ВБП (ОР: 0,55, 95% ДИ 0,38–0,82; р=0,031) по сравнению с применением атезолизумаба в комбинации с бевацизумабом, чего не наблюдалось в подгруппе пациентов без НАЖБП/НАСГ [53].
Прежде чем использовать этиологию ГЦР в качестве критерия выбора режима для 1-й линии терапии, необходимо учесть несколько факторов. Во-первых, очевидно, что подгруппа пациентов с ГЦР невирусной этиологии представляет собой неоднородную популяцию, в которой есть пациенты с НАЖБП, хроническим алкоголизмом, скрытым гепатитом В (положительный результат теста на анти-HBс и отрицательный – на HBsAg), а также пациенты, у которых имеет место сочетание перечисленных выше причин. Анализ преимуществ различных режимов системной терапии в каждой из указанных подгрупп необходим для понимания преимуществ каждого варианта лечения. Во-вторых, имеющиеся на данный момент данные получены посредством подгрупповых анализов в ходе клинических исследований или ретроспективного анализа серий клинических случаев, который мог отличаться предвзятостью. Гипотезу необходимо проверить путем проведения проспективных исследований, предполагающих сравнение терапии ленватинибом и ИИКТ в подгруппах с ГЦР определенной этиологии. В-третьих, необходимо точнее сформулировать определение ГЦР невирусной этиологии, поскольку в представленных анализах такие подгруппы не были четко определены [14, 51, 53]. Например, золотым стандартом диагностики НАЖБП является наличие гистологических признаков стеатоза более чем в 5% гепатоцитов, что предполагает использование инвазивных методов, таких как биопсия печени. Несмотря на возможность неинвазивной диагностики посредством проведения компьютерной томографии и ультразвуковых исследований, представление рентгенографических данных связано с рядом ограничений, причинами которых являются несоответствия в заключениях одних и тех же специалистов и чувствительность используемых методов визуализации [54]. Кроме того, в условиях наблюдаемой пандемии метаболических заболеваний печени у значительной части пациентов с вирусным гепатитом может встречаться сочетание вирусного гепатита с жировой болезнью печени. Например, в ходе ретроспективного когортного исследования, проведенного в Гонконге, в которое были включены 270 инфицированных вирусом гепатита B пациентов, гистологически подтвержденное сопутствующее заболевание печени было обнаружено у 107 (39,6%) пациентов [55]. По этой причине при проведении дальнейших исследований необходимо дать четкое определение ГЦР различной этиологии и учесть возможность наличия разных этиологических факторов у одного и того же пациента.
Применение ленватиниба в 1-й линии терапии и трансартериальной химиоэмболизации
Помимо изучения ленватиниба в режиме монотерапии в 1-й линии распространенного ГЦР, также было проведено исследование ленватиниба в комбинации с трансартериальной химиоэмболизацией (ТАХЭ) у пациентов с распространенным ГЦР, с целью улучшить клинические исходы [56]. Недостаточный ответ внутрипеченочных опухолевых очагов по-прежнему представляет собой серьезную проблему для повторных ТАХЭ [57]. Повышение экспрессии VEGF и других проангиогенных факторов после ТАХЭ, индуцированное появлением ишемических изменений в опухолевом окружении, считается основным механизмом, лежащим в основе резистентности к лечению [58, 59]. Ленватиниб как мощный антиангиогенный агент теоретически может обеспечить синергизм с ТАХЭ посредством ингибирования и ангиогенеза, и роста опухоли после проведения ТАХЭ.
В ходе исследования LAUNCH 338 пациентов-китайцев с распространенным ГЦР, ранее не получавших терапию, или с рецидивом распространенного первичного ГЦР после хирургического лечения рандомизировали для получения ленватиниба или ленватиниба в комбинации с ТАХЭ по необходимости (ЛЕН-ТАХЭ) [56]. У большинства пациентов (более 85%) был гепатит В. ТАХЭ выполняли через сутки после перорального приема ленватиниба, а затем повторяли, если имел место неполный некроз или возобновление роста опухоли. Наблюдение (в среднем в течение 17 мес) показало, что показатель ОВ был значимо выше в группе ЛЕН-ТАХЭ – 17,8 мес против 11,8 мес в группе, получавшей монотерапию ленватинибом (ОР 0,45; р=0,001). Медианная ВБП в группе ЛЕН-ТАХЭ также была выше – 10,6 мес против 6,4 мес в группе, получавшей монотерапию ленватинибом (ОР 0,43; р=0,001). ЧОО по критериям mRECIST была выше в группе ЛЕН-ТАХЭ (54,1%), чем в группе, получавшей монотерапию ленватинибом (25,0%) (р=0,001) [56]. Что касается безопасности, в группе ЛЕН-ТАХЭ чаще наблюдали отклонения от нормы уровней печеночных ферментов (3–4-й степени), чем в группе монотерапии ленватинибом (~20% против 2%), однако частота других нежелательных явлений 3–4-й степени, таких как ладонно-подошвенный синдром, диарея, боль в животе и т.д., в двух группах была схожей [56]. Несмотря на то что это исследование позволило получить многообещающие данные о применении ленватиниба в комбинации с ТАХЭ у пациентов-китайцев с ГЦР вследствие гепатита В, необходимы дальнейшие исследования, чтобы экстраполировать полученные данные на пациентов с ГЦР иной этиологии, принадлежащих к иным этническим группам.
Применение ленватиниба в качестве терапии
1-й линии при ГЦР промежуточной стадии
Пациенты с ГЦР промежуточной стадии представляют собой наиболее неоднородную группу. До 2018 г. единственным рекомендованным методом лечения ГЦР промежуточной стадии (по системе Barcelona Clinic Liver Cancer [BCLC]-B) являлась ТАХЭ [60]. В обновленной версии классификации от 2022 г. ГЦР промежуточной стадии разделен на три подгруппы в зависимости от опухолевой нагрузки и функционального состояния печени для лучшей стратификации и управления лечением [61]. Для подгруппы пациентов с обширным диффузным инфильтративным билобарным поражением печени рекомендованным вариантом лечения уже является не ТАХЭ, а системная терапия. Применение ТАХЭ не является эффективной стратегией лечения ГЦР промежуточной стадии с высокой опухолевой нагрузкой, оно может привести к нарушению функции печени на ранних этапах [61, 62].
Безусловно, системная терапия ГЦР промежуточной стадии не является чем-то новым. В ходе трех крупных исследований клинической практики была продемонстрирована эффективность сорафениба у пациентов с ГЦР промежуточной стадии [63–65]. Исследование
GIDEON – глобальное проспективное наблюдательное исследование, проходившее с 2009 по 2012 г., предполагало оценку безопасности и эффективности сорафениба у пациентов с ГЦР разных стадий по системе BCLC. Было установлено, что медиана ОВ была выше у пациентов с опухолями BCLC-B в сравнении с BCLC-С (ОВ 29,5 против 11,1 мес) [63]. SOFIA и INSIGHT, два похожих исследования, проведенных в Европе в один и тот же период, также продемонстрировали лучшую медиану ОВ для пациентов с ГЦР стадии BCLC-B по сравнению с BCLC-С при лечении сорафенибом (SOFIA, ОВ 20,6 против 8,4 мес; INSIGHT, ОВ 19,6 против
13,6 мес) [64, 65].
Однако для какой группы пациентов системная терапия принесет больше пользы, чем ТАХЭ, было все еще неясно. Чтобы сформулировать характеристики для такой группы пациентов, которая в большей степени подходит для системной терапии, эффективность ленватиниба в сравнении с ТАХЭ оценивалась при ГЦР промежуточной стадии у пациентов без ТАХЭ в анамнезе, с опухолевой нагрузкой, выходящей за рамки критериев «до 7» («up-to-7»), и с функциональным классом А по Чайлд–Пью [66]. Ленватиниб был выбран вместо сорафениба из-за более высокого показателя ЧОО, который был достигнут в рамках исследования REFLECT [7, 67]. Критерии «до 7» предполагают то, что количество опухолевых очагов и диаметр этих очагов равны семи или менее. Эти критерии были впервые предложены как дополнение к Миланским для прогнозирования исхода трансплантации печени [68]. Ретроспективное исследование, проведенное методом псевдорандомизации для экспериментального подтверждения концепции, показало, что применение ленватиниба обеспечило увеличение ОВ (37,9 мес против 21,3 мес; р<0,01), ВБП (16,0 мес против 3,0 мес; р=0,001) и ЧОО (73,3% против 33,3%; р=0,001). Исследование также продемонстрировало, что функция печени ухудшалась после повторной ТАХЭ (исходный показатель по шкале ALBI от –2,66 до –2,09; р<0,001) и не менялась в группе, получавшей ленватиниб (исходный показатель по шкале ALBI от –2,61 до –2,61; р=0,254). Следует отметить, что прием ленватиниба обеспечил значимое уменьшение распространенности опухолевого процесса у двух пациентов; это сделало возможными проведение абляции и удаление опухоли. Такие обнадеживающие результаты подтверждают место ленватиниба в лечении ГЦР промежуточной стадии у пациентов с распространением опухолевого процесса за рамки критериев «до 7» и сохранной функцией печени в ходе крупного рандомизированного контролируемого исследования. Тем не менее также следует заранее рассмотреть возможность назначения ленватиниба пациентам, чей ответ на ТАХЭ был признан слабым.
Проведенное в Японии исследование TACTICS-L – неконтролируемое исследование II фазы по оценке эффективности и безопасности применения ленватиниба в комбинации с ТАХЭ при неоперабельном ГЦР промежуточной стадии [69]. В исследование были включены 62 пациента, в основном пожилые (старше 65 лет: 79%), со стадией BCLC-В (59,7%). У 64,5% пациентов опухолевая нагрузка определялась в рамках критериев «до 7». Пациенты получали ленватиниб в течение 14–21 дня, с последующим перерывом на 2 дня перед ТАХЭ, далее возобновляли лечение через 2 дня после ТАХЭ, до прогрессирования заболевания. При медиане наблюдения 20,3 мес медиана ВБП составила 28,3 мес, а двухлетняя ВБП превысила 60%. Наилучший показатель ЧОО составил 88,7%, при этом полный ответ имел место у 66,1% пациентов. Около половины (50,5%) ответивших на лечение (n=55) продемонстрировали устойчивый ответ на терапию через год. Этот метод лечения показал хорошую переносимость, а наиболее частыми нежелательными явлениями были гипотиреоз (58,1%), артериальная гипертензия (53,2%) и снижение аппетита (50,0%). Никакие другие настораживающие нежелательные явления выявлены не были [69]. Таким образом, ленватиниб в комбинации с ТАХЭ представляет собой еще один многообещающий режим терапии 1-й линии для пациентов с неоперабельным ГЦР промежуточной стадии – несмотря на то, что в исследование было включено большое число пациентов с более ранней стадией ГЦР (BCLC-A). Для валидации данного комбинированного метода лечения необходимы дальнейшие исследования III фазы.
С другой стороны, в настоящий момент проходят несколько исследований III фазы по оценке эффективности атезолизумаба в комбинации с бевацизумабом (или в комбинации с ТАХЭ) по сравнению с ТАХЭ при ГЦР промежуточной стадии (NCT04803994, NCG04712643) [70, 71]. Поскольку характер ответа у пациентов, которых лечили атезолизумабом в комбинации с бевацизумабом (способствует уменьшению размеров опухоли), и пациентов, которые получали ленватиниб (способствует некрозу опухоли за счет прекращения кровоснабжения), различен [72], в дальнейшем было бы интересно сравнить атезолизумаб в комбинации с бевацизумабом и ТАХЭ и ленватиниб в комбинации с ТАХЭ.
Заключение
В эпоху эффективной комбинированной терапии ИИКТ, демонстрирующей потрясающие показатели частоты ответа и выживаемости, роль ленватиниба в первой линии терапии распространенного ГЦР стала менее значительной. Однако терапия ИИКТ подходит не всем пациентам по причине наличия фоновых состояний, таких как аутоиммунные заболевания и длительный прием иммуносупрессоров (см. табл. 2). В таких условиях ленватиниб играет важную роль – он представляется безопасным и таким же эффективным. Тем не менее клиницистам следует обращать внимание на частые нежелательные явления, такие как артериальная гипертензия, протеинурия и гипотиреоз, возникающие вследствие длительного приема ленватиниба. Важно тщательно контролировать эти нежелательные явления. Кроме того, с увеличением числа доступных препаратов для лечения распространенного ГЦР предметом изучения стала правильная последовательность лечения (например, сначала ИИКТ или сначала ИТК). Несколько ретроспективных исследований продемонстрировали эффективность и безопасность ленватиниба при применении в качестве терапии 2-й линии после ИИКТ, однако данных проспективных исследований по-прежнему не хватает [73, 74].
С другой стороны, сейчас мы начали понимать, что пациенты с ГЦР различной этиологии могут по-разному отвечать на лечение ИИКТ, применение которых позволяет добиться лучшего ответа у некоторых пациентов, чем применение ленватиниба. Например, многочисленные ретроспективные исследования показали, что применение ленватиниба у пациентов с ГЦР невирусной этиологии может быть более эффективным, чем применение комбинаций с ИИКТ [14, 51, 53]. Такие различия в ответе были объяснены различиями опухолевого микроокружения и состояния иммунной системы, связанными с наличием фоновых заболеваний [52]. Тем не менее пациенты с ГЦР невирусной этиологии представляют собой неоднородную группу пациентов, и для подтверждения этих постулатов потребуются дальнейшие исследования, специально предназначенные для пациентов с ГЦР с конкретной этиологией (см. табл. 2).
Кроме того, в настоящее время производится оценка применения ленватиниба в качестве терапии 1-й линии при промежуточной стадии ГЦР, в том числе у пациентов с высокой опухолевой нагрузкой – например, выходящей за рамки критериев «до 7» (см. табл. 2). Известно, что данная группа пациентов рефрактерна к таким методам терапии как ТАХЭ. Несколько исследований с участием небольшого числа пациентов показали, что монотерапия ленватинибом или терапия ленватинибом в комбинации с ТАХЭ эффективна и безопасна в этой группе пациентов, при этом дополнительным преимуществом является отсутствие нарушения функции печени [66, 69]. Что касается неоадъювантной и адъювантной терапии, продолжается ряд исследований, изучающих применение ленватиниба в комбинации с иммунотерапией и/или локорегионарной терапией (например, ТАХЭ, радиочастотная абляция), результаты которых, как ожидается, будут опубликованы в ближайшие годы (NCT05185739, NCT04227808, NCT05113186). Применение комбинации ленватиниба, пембролизумаба и ТАХЭ в настоящее время изучают в ходе исследования III фазы LEAP 012 [75]. Таким образом, роль ленватиниба в терапии ГЦР продолжает развиваться, и препарат останется важным для лечения данного заболевания на годы вперед.
Вклад авторов. Авторы внесли равный вклад в разработку концепции, анализ литературных данных, подготовку черновика и финальную проверку рукописи.
Authors’ contribution. Both authors contribute equally to the conceptualization, literature review, drafting and final review of this manuscript.
Конфликт интересов. С.Л. Чан является консультантом Astra-Zeneca, MSD, Eisai, BMS и Roche. Его исследования финансировали компании MSD, Bayer, Eisai, Ipsen и SIRTEX. С.Л. Чан получил вознаграждение от компаний Bayer, Astra-Zeneca, Eisai, Roche и MSD. Он выступает с докладами от имени MSD, BMC, Astra-Zeneca, Eisai, Roche, Ipsen, SIRTEX и Hutchmed. Л.Л. Чан получил поддержку в виде оплаты путевых расходов от компании Roche.
Conflicts of Interest. S.L. Chan is the advisory for Astra-Zeneca, MSD, Eisai, BMS and Roche. S.L. Chan received research fund from MSD, Bayer, Eisai, Ipsen and SIRTEX. S.L. Chan received Honoraria from Bayer, Astra-Zeneca, Eisai, Roche and MSD. S.L. Chan is the speaker for MSD, BMC, Astra-Zeneca, Eisai, Roche, Ipsen, SIRTEX and Hutchmed. L.L. Chan has received travel support from Roche.
Источник: Chan L.L., Chan S.L. The evolving role of lenvatinib at the new era of first-line hepatocellular carcinoma treatment. Clin Mol Hepatol. 2023; 29: 909-923. DOI: 10.3350/cmh.2023.0114
Перевод статьи выполнен на условиях лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by-nc/3.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
The translation of the article has been completed under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by-nc/3.0/), which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Информация об авторах
Information about the authors
Лэндон Л. Чан – отд-ние клин. онкологии, Больница принца Уэльского, Китайский университет Гонконга; Государственная лаборатория трансляционной онкологии, Онкологический центр сэра Юэ Конг Пао, Гонконгский институт рака, специальный административный район Гонконг, Китай
Landon L. Chan – Department of Clinical Oncology, Prince of Wales Hospital, The Chinese University of Hong Kong; State Key Laboratory of Translational Oncology, Sir YK Pao Centre for Cancer, Hong Kong Cancer Institute, Hong Kong SAR, China
Стивен Л. Чан – отд-ние клин. онкологии, Больница принца Уэльского, Китайский университет Гонконга, специальный административный район Гонконг, Китай.
E-mail: chanlam_stephen@cuhk.edu.hk; ORCID: 0000-0001-8998-5480
Stephen L. Chan – Department of Clinical Oncology, Prince of Wales Hospital, The Chinese University of Hong Kong, Hong Kong SAR, China. E-mail: chanlam_stephen@cuhk.edu.hk; ORCID: 0000-0001-8998-5480
Поступила в редакцию: 03.06.2024
Поступила после рецензирования: 14.06.2024
Принята к публикации: 20.06.2024
Received: 03.06.2024
Revised: 14.06.2024
Accepted: 20.06.2024
Клинический разбор в общей медицине №7 2024
Эволюционная роль ленватиниба в 1-й линии лечения гепатоцеллюлярного рака в новую эру лекарственной терапии
Аннотация
Появление мультикиназных ингибиторов (МКИ) и ингибиторов иммунных контрольных точек (ИИКТ) изменило перспективы лечения гепатоцеллюлярного рака (ГЦР). Комбинированная терапия, включающая в себя ИИКТ, пришла на смену сорафенибу как препарату 1-й линии для лечения распространенного ГЦР по причине лучших показателей эффективности и выживаемости по результатам недавно опубликованных клинических исследований III фазы. Однако роль ленватиниба при применении в качестве терапии 1-й линии все еще не ясна, поскольку ни в одном из проспективных исследований не было выполнено сравнение его эффективности с эффективностью ИИКТ при распространенном ГЦР. Несколько ретроспективных исследований показали, что ленватиниб, применяемый в качестве терапии 1-й линии, может не уступать комбинации c ИИКТ. Более того, появляется все больше доказательств того, что лечение ИИКТ связано с худшими исходами у пациентов с ГЦР невирусной этиологии. Это ставит под вопрос превосходство лечения ИИКТ у всех пациентов и выдвигает применение ленватиниба в качестве терапии 1-й линии на первый план как потенциально предпочтительный вариант лечения. Кроме того, накопленные данные подтверждают, что при распространенном ГЦР промежуточной стадии с высокой опухолевой нагрузкой применение ленватиниба в 1-й линии или в комбинации с трансартериальной химиоэмболизацией (ТАХЭ) является предпочтительным вариантом лечения по сравнению с самостоятельным применением ТАХЭ. В настоящем обзоре представлены новейшие данные, подтверждающие растущую роль ленватиниба в 1-й линии терапии при ГЦР. (Clin Mol Hepatol. 2023; 29: 909–923)
Ключевые слова: гепатоцеллюлярный рак; антинеопластические препараты; ингибитор иммунной контрольной точки.
Для цитирования: Чан Л.Л., Чан С.Л. Эволюционная роль ленватиниба в 1-й линии лечения гепатоцеллюлярного рака в новую эру лекарственной терапии. Клинический разбор в общей медицине. 2024; 5 (7): 24–36. DOI: 10.47407/kr2024.5.7.00445
The evolving role of lenvatinib at the new era of first-line hepatocellular carcinoma treatment
Landon L. Chan1, Stephen L. Chan1,2
1 Department of Clinical Oncology, Prince of Wales Hospital, The Chinese University of Hong Kong;
2 State Key Laboratory of Translational Oncology, Sir YK Pao Centre for Cancer, Hong Kong Cancer Institute, The Chinese University of Hong Kong, Hong Kong SAR, China
chanlam_stephen@cuhk.edu.hk
Abstract
Emergence of multi-targeted kinase inhibitors (MTIs) and immune checkpoint inhibitors (ICI) have changed the landscape of management in hepatocellular carcinoma (HCC). Combination therapy involving ICI has superseded sorafenib as the first-line treatment option for advanced HCC due to their superior response rates and survival benefits based on recently published phase III trials. However, the role of first-line lenvatinib remains uncertain as no prospective trials have compared its efficacy with ICI in advanced HCC. Several retrospective studies have shown that first-line lenvatinib may not be inferior to ICI combination. Indeed, a growing body of evidence suggests that ICI treatment is associated with inferior treatment outcome in non-viral HCC patients, questioning the supremacy of ICI treatment in all patients and rendering first-line lenvatinib as a potential preferred treatment option. Furthermore, in high-burden intermediate-stage HCC, accumulating evidence supports first-line lenvatinib, or in combination with transarterial chemoembolization (TACE), as a preferred treatment option over TACE alone. In this Review, we describe the latest evidence surrounding the evolving role of first-line lenvatinib in HCC. (Clin Mol Hepatol. 2023; 29: 909–923)
Keywords: hepatocellular carcinoma; antineoplastic agents; immune checkpoint inhibitor.
For citation: Chan L.L., Chan S.L. The evolving role of lenvatinib at the new era of first-line hepatocellular carcinoma treatment. Clinical review for general practice. 2024; 5 (7): 24–36. (In Russ.). DOI: 10.47407/kr2024.5.7.00445
Введение
Согласно последним статистическим данным
GLOBOCAN [1], гепатоцеллюлярный рак (ГЦР) создает огромную нагрузку на здравоохранение по всему миру. В 2020 г. первичный рак печени (доля ГЦР в структуре которого составляет около 75–85% случаев) занял шестое место среди наиболее часто диагностируемых видов рака с примерно 906 тыс. новых случаев и третье место среди основных причин смертности от рака по всему миру, став причиной 830 тыс. смертей [1]. Несмотря на совершенствование стратегий наблюдения, многие пациенты с ГЦР обращаются к врачу на поздних стадиях заболевания, когда системная терапия становится центральным компонентом лечения.

 Возможности системного лечения ГЦР ограничены. Сорафениб стал первым мультикиназным ингибитором (МКИ), зарегистрированным для лечения распространенного ГЦР. Препарат был одобрен в 2007 г. по результатам исследования SHARP, в рамках которого применение сорафениба позволило увеличить показатель выживаемости без прогрессирования (ВБП) с
Возможности системного лечения ГЦР ограничены. Сорафениб стал первым мультикиназным ингибитором (МКИ), зарегистрированным для лечения распространенного ГЦР. Препарат был одобрен в 2007 г. по результатам исследования SHARP, в рамках которого применение сорафениба позволило увеличить показатель выживаемости без прогрессирования (ВБП) с 2,8 мес до 5,5 мес (относительный риск – ОР 0,58; р<0,001), а показатель общей выживаемости (ОВ) –
с 7,9 мес до 10,7 мес (ОР 0,69; р<0,001) [2]. Несмотря на то что разница по показателям выше достигла статистической значимости, частота объективного ответа (ЧОО) при применении сорафениба составила лишь 2%, для большинства пациентов из группы сорафениба удалось добиться лишь стабилизации заболевания (табл. 1 и 2). К сожалению, в ходе ряда дальнейших исследований не удалось продемонстрировать преимущества других МКИ перед сорафенибом [3–6], и сорафениб оставался единственным вариантом для системной терапии распространенного ГЦР еще на протяжении 10 лет.
За последние 5 лет возможности системной терапии ГЦР расширились за счет применения МКИ [7–10] и ингибиторов иммунных контрольных точек (ИИКТ) [11, 12]. Регистрация ленватиниба для использования в 1-й линии терапии при ГЦР в 2018 г. на основании исследования REFLECT, подтвердившего не меньшую эффективность препарата, стало поворотным моментом в лечении распространенного ГЦР (см. табл. 1 и 2) [7]. В настоящее время ОВ пациентов с ГЦР увеличилась более чем вдвое – с нескольких месяцев в рамках исследования SHARP до более полутора лет в эру иммунотерапии [2, 13, 14]. Внедрение ИИКТ в качестве терапевтической стратегии привело к революционным изменениям парадигмы лечения многих видов рака, включая ГЦР. Применение атезолизумаба (антитело к PD-L1) в комбинации с бевацизумабом (антитело к VEGF) или дурвалимаба (антитело к PD-L1) в комбинации с тремелимумабом (антитело к CTLA4) продемонстрировало беспрецедентно высокую ЧОО на уровне 20–30% и ОВ на уровне 16–9 мес, результаты невиданные прежде в истории ГЦР (см. табл. 1
и 2). Указанные комбинации с ИИКТ в настоящее время рекомендованы в качестве режимов 1-й линии терапии при ГЦР.
За счет такого стремительного развития системной терапии ГЦР возникает неясность в отношении роли ленватиниба в качестве режима 1-й линии. В частности, принимая во внимание выдающиеся клинические результаты, полученные при применении комбинаций с ИИКТ, следует ли нам отказаться от ленватиниба в 1-й линии терапии при распространенном заболевании? С другой стороны, существуют ли ситуации, когда применение ленватиниба в 1-й линии лечения ГЦР целесообразно или, возможно, является даже более подходящим?
В настоящем обзоре мы разрешим данные противоречия и обсудим
 растущую роль ленватиниба в терапии 1-й линии при ГЦР.
растущую роль ленватиниба в терапии 1-й линии при ГЦР. Ленватиниб в 1-й линии терапии распространенного ГЦР
Пациенты, которым не подходит лечение ИИКТ
Ленватиниб представляет собой оральный МКИ, воздействующий на рецепторы VEGF 1–3, рецепторы FGF 1–4, рецептор PDGF альфа, рецепторы RET и KIT [15]. Монотерапия ленватинибом была одобрена для лечения распространенного ГЦР на основании результатов исследования REFLECT, продемонстрировавшего не меньшую эффективность данного препарата по сравнению с сорафенибом. В этом исследовании медиана ОВ пациентов, получавших ленватиниб, составила 13,6 мес против 12,3 мес у пациентов, получавших сорафениб (ОР 0,92, 95% доверительный интервал – ДИ 0,79–1,06). Пациенты, которые получали лечение ленватинибом, также имели более высокие ВБП (7,4 против 3,7 мес; ОР 0,66; 95% ДИ 0,57–0,77) и ЧОО (24,1% против 9,2%; ОШ 3,13, 95% ДИ 2,15–4,56) по сравнению с получавшими сорафениб. Нежелательные явления во время лечения были схожими для обоих препаратов. Апостериорный (post-hoc) анализ исходов, сообщаемых пациентами (PRO), проведенный в рамках исследования REFLECT, показал, что большинство шкал PRO в целом отдавали предпочтение группе ленватиниба. У пациентов, получавших ленватиниб, значимо позже появлялись усталость, боль и диарея, по сравнению с пациентами, получавшими сорафениб [16]. Метаанализ, в который были включены 15 исследований (n=3908), также продемонстрировал схожие показатели ОВ для сорафениба и ленватиниба с закономерно более высокими показателями ЧОО и ВБП при применении ленватиниба по сравнению с сорафенибом [17]. Помимо этого, применение ленватиниба было связано с более высокой частотой бессимптомных нежелательных явлений, таких как артериальная гипертензия, протеинурия и гипотиреоз, в то время как применение сорафениба было связано с более высокой частотой симптоматических нежелательных явлений, в том числе ладонно-подошвенного синдрома и диареи (табл. 3) [17]. По этой причине ленватиниб может быть более предпочтительным вариантом для применения в клинической практике, нежели сорафениб, если монотерапию МКИ назначают в качестве системного лечения. Однако роль монотерапии МКИ в 1-й линии лечения при распространенном ГЦР стала менее значимой в момент внедрения комбинаций с ИИКТ. На текущий момент для 1-й линии распространенного ГЦР рекомендованы атезолизумаб в комбинации с бевацизумабом (по результатам исследования IMBrave 150 [11, 14]) или дурвалумаб в комбинации с тремелимумабом (по результатам исследования HIMALAYA [18]). Указанные комбинации с ИИКТ продемонстрировали лучшие показатели ЧОО и ОВ в равнении с сорафенибом. Уточненный анализ данных исследования IMBrave 150 продемонстрировал, что атезолизумаб в комбинации с бевацизумабом увеличивал ВБП на 2,6 мес (с 4,3 мес до 6,9 мес), а ОВ – на 5,8 мес (с 13,4 мес до 19,2 мес) по сравнению с сорафенибом. Более высокую ЧОО наблюдали в группе, получавшей атезолизумаб в комбинации с бевацизумабом (30% и 11%); см. табл. 2. Частота связанных с лечением нежелательных явлений 3–4-й степени тяжести в двух экспериментальных группах была схожей (см. табл. 3). Исследование HIMALAYA показало, что применение дурвалумаба в комбинации с тремелимумабом было ассоциировано с увеличением ОВ (16,4 мес против 13,8 мес для сорафениба) и более высокой ЧОО (20,1% в группе дурвалумаба в комбинации с тремелимумабом против 5,1% в группе сорафениба) [12]. Однако показатели ВБП при применении дурвалумаба в комбинации с тремелимумабом и сорафениба были одинаковыми (3,8 мес против 4,1 мес); см. табл. 2. Примечательно, что плато кривой выживаемости пациентов, получавших дурвалумаб и тремелимумаб, примерно соответствует 30% – это говорит о том, что значительная часть пациентов выжила в долгосрочной перспективе.
Несмотря на более высокие ЧОО и выживаемость, обеспечиваемые применением комбинаций с ИИКТ, существуют сценарии, при которых клиницисты могут отдать предпочтение ленватинибу вместо комбинаций с ИИКТ, учитывая сопутствующие заболевания, физическое состояние и предпочтения пациентов. Например, пациентам требующим лечения или с недолеченным варикозным расширением вен пищевода и желудка, у которых есть признаки портальной гипертензии, следует отказаться от применения атезолизумаба в комбинации с бевацизумабом из-за высокого риска кровотечений, связанного с использованием высоких доз бевацизумаба (15 мг/кг). При применении ИИКТ у пациентов с фоновым заболеванием иммунной системы существует риск обострения (до 50%) или развития других иммуноопосредованных нежелательных явлений.
В действительности эту категорию пациентов обычно исключают из клинических исследований ИИКТ [19, 20]. Кроме того, назначение клиницистами иммуносупрессивных препаратов пациентам с аутоиммунными заболеваниями в начале терапии ИИКТ остается под вопросом [21].
Важно отметить, что у небольшого числа пациентов с ГЦР (~10–16%) имели место рецидивы после трансплантации печени [22]. Трансплантация печени – вариант радикального лечения для определенной группы пациентов с ГЦР, которые соответствуют миланским критериям [23]. Пациентам, перенесшим трансплантацию печени, требуется длительное лечение иммуносупрессивными препаратами для профилактики острого или хронического отторжения трансплантата. Применение ИИКТ при рецидиве ГЦР является спорным из-за риска усиления аллоиммунитета и индукции отторжения, а также из-за сомнений в эффективности применения ИИКТ на фоне терапии иммуносупрессорами [24]. На самом деле данных по этой теме мало. Согласно недавнему обзору литературы, в который были включены 27 случаев трансплантации печени с рецидивом ГЦР и назначением ИИКТ: у 8 (29,6%) пациентов был достигнут контроль над заболеванием, но у 6 (22,2%) пациентов произошло острое отторжение трансплантата [25]. Из этого следует, что наиболее подходящим вариантом системной терапии при рецидиве ГЦР после трансплантации печени по-прежнему являются МКИ. Для сорафениба, представляющего собой МКИ с самой долгой историей использования для лечения ГЦР, в этой группе пациентов накоплено наибольшее количество данных [26–28]. В последнее время также появилось больше информации о применении ленватиниба. В ходе проведенного на Тайване ретроспективного исследования «случай–контроль» были описаны 10 пациентов, которые получали ленватиниб при рецидиве заболевания после трансплантации печени. Медианы ВБП и ОВ составили 3,7 и 16,4 мес соответственно [29]. В этой небольшой когорте пациентов у 20% был достигнут частичный ответ, в 50% случаев – стабилизация болезни. Нежелательные явления в основном относились к 1-й и 2-й степени, развитие артериальной гипертензии 3-й степени отмечено только у 1 пациента. Сравнение с контрольной группой, состоявшей из 25 пациентов с ГЦР без трансплантации печени, получавших ленватиниб в качестве терапии 2-й линии, показало отсутствие различий в ВБП, ОВ и характере наблюдаемых нежелательных явлений [29]. В другом многонациональном многоцентровом ретроспективном исследовании, в ходе которого было проведено обследование 45 пациентов с рецидивом ГЦР после трансплантации печени, при применении ленватиниба были достигнуты медианные ВБП и ОВ, составившие 7,6 мес и 14,5 мес соответственно [30]. Наиболее частым нежелательным явлением 3-й степени была артериальная гипертензия, развитие которой наблюдалось у 20% пациентов. Нежелательных явлений 4-й степени не отмечалось. В другой представленной в Милане серии из 9 случаев с рецидивом ГЦК после трансплантации печени применение ленватиниба было ассоциировано с медианой ВБП, равной 321 дню, у одного пациента было зарегистрировано нежелательное явление 3-й степени (нефротический синдром), потребовавшее отмены препарата. Сравнение с подобранной когортой пациентов, получавших терапию сорафенибом, показало, что применение ленватиниба было связано с лучшими медианами ВБП и ОВ [31]. В целом ленватиниб также представляет собой эффективный вариант лечения при рецидиве ГЦР после трансплантации печени, без каких-либо новых проявлений токсичности.
Пациенты с тяжелой портальной гипертензией или тромбозом воротной вены Пациенты с тяжелой портальной гипертензией или тромбозом воротной вены (Vp4) представляют собой группу с особенно неблагоприятным прогнозом, имеющую высокий риск развития связанных с лечением нежелательных явлений. При выборе системной терапии для таких пациентов необходимо учитывать дополнительные факторы. Тяжелая портальная гипертензия связана с высоким риском варикозного кровотечения. В последнем консенсусе Baveno VII рекомендованы контроль с применением эндоскопических методов или профилактическое назначение β-адреноблокаторов [32]. Применение анти-VEGF препаратов, таких как ленватиниб и бевацизумаб, у пациентов с тяжелой портальной гипертензией, вызвало опасения по поводу повышения риска варикозных кровотечений и вторичной смертности вследствие обострения портальной гипертензии [33]. В проспективном когортном исследовании влияния ленватиниба на портальную гемодинамику у 28 пациентов с распространенным ГЦР данный препарат снижал кровоток в воротной вене, повышал коэффициент полнокровия и усугублял портальную гипертензию через 2 нед приема [34]. Однако во всех недавно опубликованных отчетах по исследованиям III фазы указано, что при использовании МКИ (включая ленватиниб) частота случаев кровотечения, связанных с портальной гипертензией, составила менее 2% [33, 35].
В проспективном многоцентровом исследовании с участием 93 пациентов, получавших ленватиниб, из которых у 37 отмечалась тяжелая портальная гипертензия, показатель ОВ, по-видимому, не снижался по причине последней [36]. Исследование IMBrave 150, напротив, продемонстрировало повышение риска развития варикозных кровотечений в группе пациентов, получавших атезолизумаб в комбинации с бевацизумабом на 2,4% (в сравнении с 0,6% в группе сорафениба). Следует отметить, что это была группа тщательно подобранных пациентов, которым обеспечили оптимальную профилактику портальной гипертензии, а пациенты с кровотечениями из варикозно расширенных вен пищевода и желудка уже были исключены из исследования [11, 33].
По данным систематического обзора исследований
II фазы, у не прошедших скрининг пациентов применение бевацизумаба было связано с 10% риском развития кровотечений из варикозно расширенных вен [37]. Пациенты с тромбозом воротной вены (Vp4) были исключены из исследований REFLECT и HIMALAYA. Ретроспективное исследование с участием 20 пациентов с Vp4 при распространенном ГЦР продемонстрировало эффективность и безопасность ленватиниба, при этом ЧОО составила 20% (по критериям mRECIST), а медиана ОВ составила 6,7 мес [38]. Варикозные кровотечения наблюдались у двух пациентов (10%). В другом ретроспективном исследовании, в которое был включен 41 пациент с ГЦР и опухолевым тромбозом воротной вены (Vp3/4), получавший лечение сорафенибом или ленватинибом, лечение ленватинибом было единственным значимым предиктором более высоких показателей ОВ (ОР 0,19, 95% ДИ 0,06–0,68; р=0,0106) и времени до прогрессирования опухоли (ОР 0,16, 95% ДИ 0,05–0,56; р=0,004) [39]. Ухудшение функции печени в первые две недели отмечалось в группе ленватиниба, однако впоследствии имело место ее восстановление. В ходе исследования варикозные кровотечения не были отмечены среди нежелательных явлений. Анализ результатов исследования IMBrave 150 по оценке эффективности и безопасности применения атезолизумаба в комбинации с бевацизумабом у пациентов с инвазией воротной вены Vp4, напротив, показал, что ОВ в группе, получавшей атезолизумаб в комбинации с бевацизумабом, была гораздо выше, чем в группе, получавшей сорафениб (7,6 против 5,5 мес; ОР 0,62; 95% ДИ 0,34–1,11), однако в группе, получавшей атезолизумаб в комбинации с бевацизумабом, была выше частота варикозных кровотечений (13,6% против 0%) [40].
Таким образом, у пациентов с тяжелой портальной гипертензией применение дурвалумаба в комбинации с тремелимумабом можно рассмотреть в качестве терапии 1-й линии, так как оно связано с более низким риском кровотечений, чем применение атезолизумаба в комбинации с бевацизумабом и ленватиниба. К сожалению, несмотря на то, что тремелимумаб был одобрен для использования в комбинации с дурвалумабом Управлением по контролю качества пищевых продуктов и лекарственных средств (FDA), а недавно и Европейским агентством лекарственных средств (EMA), он по-прежнему проходит экспертизу регулирующих органов во многих странах мира (например, в Великобритании, Австралии, Гонконге). Помимо этого, крайне высокая стоимость тремелимумаба делает данный режим недоступным для многих пациентов. Выбирая между атезолизумабом, бевацизумабом и ленватинибом, предпочтение отдают ленватинибу, если нет возможности своевременно провести скрининг на варикозные кровотечения перед началом лечения. Аналогичным образом, если нет возможности своевременно провести скрининг на наличие варикозно расширенных вен пищевода/желудка, ленватиниб можно считать более безопасным для пациентов с тромбозом воротной вены, учитывая тот факт, что, согласно анализу результатов исследования IMBrave 150, варикозные кровотечения имели место у 13,4% пациентов, получавших атезолизумаб в комбинации с бевацизумабом.
Уступает ли ленватиниб комбинации с ИИКТ?
Действующие рекомендации по применению комбинаций с ИИКТ в качестве терапии 1-й линии при распространенном ГЦР основаны на более высоких показателях частоты ответа и выживаемости по сравнению с применением сорафениба. Данные проспективных исследований, которые бы позволили сравнить ленватиниб с комбинациями с ИИКТ, отсутствуют. На самом деле было бы логично ожидать, что ленватиниб будет уступать комбинации с ИИКТ, поскольку в рамках исследования REFLECT была продемонстрирована неменьшая эффективность ленватиниба в сравнении с сорафенибом [7]. Недавно появились данные, позволяющие предположить, что назначение ленватиниба в 1-й линии терапии может не уступать комбинации с ИИКТ. В ретроспективном исследовании с участием трех университетских клиник Кореи и включением 232 пациентов с распространенным ГЦР, получавших ленватиниб или атезолизумаб в комбинации с бевацизумабом, не было продемонстрировано статистически значимых различий между режимами по показателям ЧОО (32,6% против 31,5%, р=0,868), ВБП (5,7 против 6,0 мес; р=0,738) и ОВ (не достигнута против 12,8 мес; р=0,357) [41]. Подгрупповой анализ показал, что показатели ОВ пациентов, получавших атезолизумаб в комбинации с бевацизумабом были сопоставимы по всем стратам c аналогичными для пациентов, получавших ленватиниб (возраст, пол, общее состояние, этиология и т.д.), за исключением уровня альфа-фетопротеина (АФП) – при применении ленватиниба уровень АФП более 200 коррелировал с благоприятным исходом. Что касается токсичности, в группе, получавшей атезолизумаб в комбинации с бевацизумабом, зафиксировано больше нежелательных явлений 3-й и 4-й степени, чем в группе, получавшей ленватиниб, однако различия не были статистически достоверны (42,8 против 21,9%; р=0,141) [41]. В другом крупном международном ретроспективном исследовании, в которое были включены 2 205 пациентов с распространенным ГЦР, после того как клинические данные были уравновешены с применением метода взвешивания по обратной вероятности лечения, не были обнаружены различия во времени до прогрессирования (ОР 0,82; р=0,117) и ОВ (ОР 0,97; р=0,739) при сравнении атезолизумаба в комбинации с бевацизумабом и ленватиниба [42]. Однако нежелательные явления 3-й и 4-й степени чаще встречались в группе, получавшей ленватиниб, чем в группе, получавшей атезолизумаб в комбинации с бевацизумабом (84,9 против 69,8%; р=0,009).
Такие результаты ретроспективных исследований могут в некотором смысле привести в замешательство, поскольку можно было бы ожидать, что ленватиниб будет уступать комбинации с ИИКТ. Для интерпретации этих результатов необходимо учитывать несколько моментов. Во-первых, несмотря на то, что первичной конечной точкой в исследовании REFLECT являлась не меньшая ОВ, была продемонстрирована тенденция к улучшению исходов при применении ленватиниба по сравнению с сорафенибом в отношении ОВ, ВБП и ЧОО [7]. Фактически в нескольких исследованиях реальной клинической практики ленватиниб продемонстрировал результаты лучше, чем в рандомизированных клинических исследованиях. Было последовательно показано, что ленватиниб обеспечивает не только более высокую ЧОО, но и лучшие показатели выживаемости по сравнению с сорафенибом [43–45]. Во-вторых, полученные данные свидетельствуют о том, что более высокие результаты для сорафениба связаны с более длительным опытом управления нежелательными явлениями для данного препарата [46, 47]. Учитывая, что сорафениб и ленватиниб принадлежат к одному классу лекарственных препаратов и имеют много схожих характеристик, вполне возможно, что предыдущий опыт использования сорафениба сократил время на обучение управлению нежелательными явлениями при применении ленватиниба, что привело к улучшению клинических исходов. В-третьих, было отмечено, что в обоих перечисленных выше исследованиях в группах, получавших в 1-й линии ленватиниб, большее число пациентов в ходе дальнейшего лечения получили локорегионарную терапию [41, 42]. Однако, как отмечают авторы, такое несоответствие может быть связано с тем, что ленватиниб был одобрен раньше, чем атезолизумаб в комбинации с бевацизумабом, и это стало причиной отсутствия эффективной терапии 2-й линии (т.е. иммунотерапии) для применения после ленватиниба [41].
В целом, хотя и существует множество правдоподобных гипотез, объясняющих одинаковую ОВ у пациентов, которые получали лечение ленватинибом и атезолизумабом в комбинации с бевацизумабом в ходе исследований клинической практики, следует иметь в виду ограничения этих ретроспективных исследований, а именно то, что исследования отличались предвзятостью, а популяция, изученная в составе различных экспериментальных групп, могла быть несбалансированной. Для того чтобы понять, действительно ли эти режимы имеют схожую эффективность, необходимо провести дальнейшие проспективные исследования сбалансированных популяций, предполагающие сравнение эффективности ленватиниба и атезолизумаба в комбинации с бевацизумабом или другой комбинации с ИИКТ.
В проспективных исследованиях монотерапию ленватинибом также сравнивали с терапией комбинацией с ИИКТ. В ходе исследования LEAP 002, представлявшего собой глобальное рандомизированное двойное слепое исследование III фазы, оценивались эффективность и безопасность ленватиниба в комбинации с пембролизумабом и ленватиниба в терапии 1-й линии при распространенном ГЦР. Это первое исследование ленватиниба III фазы после исследования REFLECT. При установленном уровне значимости комбинация ленватиниба и пембролизумаба не продемонстрировала увеличения показателей ВБП и ОВ [48]. Ленватиниб в комбинации с пембролизумабом обеспечил ВБП и ОР, равные 8,2 мес и 21,2 мес соответственно, в сравнении
с 8,1 мес (ОР для ВБП: 0,87, 95% ДИ 0,73–1,02; p=0,047) и 19,0 мес (ОР для ОВ: 0,84, 95% ДИ 0,71–1,00; p=0,0227) соответственно при монотерапии ленватинибом. Следует отметить, что группа, получавшая ленватиниб, показала исключительно хорошие результаты по сравнению с результатами, полученными в исследовании REFLECT (где медиана ОВ составила 13,6 мес), в которое были включены пациенты со схожими характеристиками. При применении комбинации ленватиниб + пембролизумаб ЧОО увеличилась до 26,1% в сравнении с 17,5% в группе, получавшей ленватиниб, что соответствует данным, полученными в рамках исследования REFLECT. Важной причиной исключительных результатов в группе ленватиниба была доступность 2-й линии лечения. В исследовании LEAP 002 52,1% пациентов группы ленватиниба получали последующую терапию; этот процент был выше, чем в исследовании
REFLECT, где составлял лишь 33%. Из этих 52% пациентов, 22,8% получали иммунотерапию (в частности, атезолизумаб в комбинации с бевацизумабом), которая рассматривается как высоко активная при ГЦР [49]. Что касается токсичности, применение ИИКТ характеризовалось более высокой частотой нежелательных явлений: частота связанных с лечением нежелательных явлений 3–5-й степени в группе, получавшей комбинацию ленватиниб + пембролизумаб, составила 62,5% в сравнении с 57,5% в группе, получавшей ленватиниб.
В целом, похоже, что при применении в 1-й линии ленватиниб может быть не менее эффективным, чем комбинации с ИИКТ. Что касается токсичности, в опубликованных исследованиях частота нежелательных явлений 3-й степени и выше при применении ленватиниба варьировала, составив от 20 до 75% (см. табл. 3). Для сравнения: при применении ИИКТ частота нежелательных явлений 3-й степени и выше чаще всего соответствовала 40–50% (см. табл. 3). Наиболее частым нежелательным явлением 3-й степени или выше, связанным с применением ленватиниба, была артериальная гипертензия, которую обычно можно было контролировать с помощью гипотензивных препаратов, перерывов в лечении и снижения дозы. При применении ИИКТ нежелательные явления 3-й степени и выше были более вариабельными в зависимости от ИИКТ [7, 11, 12, 41, 42, 48]. Тем не менее применение ленватиниба в 1-й линии в монорежиме допускает титрование дозы в соответствии с общим состоянием пациента и переносимостью лечения, поэтому данный препарат может быть более универсальным в ситуациях, когда назначение системной терапии находится под вопросом. Следует отметить, что недавнее ретроспективное исследование с участием 176 пациентов с распространенным ГЦР, получавших ленватиниб, показало, что снижение дозы ленватиниба в начале не было связано с худшими показателями выживаемости [50].
Влияет ли этиология ГЦР на результаты терапии?
Раньше, когда для лечения распространенного ГЦР в основном использовались МКИ [2, 7–10], считалось, что этиология ГЦР не влияет на течение болезни. Однако после того как для лечения распространенного ГЦР стали применять ИИКТ, появились данные, что этиология ГЦР может влиять на исход лечения [14, 51]. Например, уточненный анализ данных, проведенный в рамках исследования IMBrave 150, показал, что применение атезолизумаба в комбинации с бевацизумабом обеспечивало увеличение ВБП и ОВ по сравнению с сорафенибом у пациентов с ГЦР вследствие гепатита В (ОР для ОВ: 0,58, 95% ДИ 0,40–0,83; ОР для ВБП: 0,51, 95% ДИ 0,37–0,70), в отличие от ГЦР невирусной этиологии (ОР для ОВ: 1,05, 95% ДИ 0,68–1,63; ОР для ВБП: 0,51, 95% ДИ 0,55–1,17) [14]. Исследование COSMIC
312 – многоцентровое рандомизированное исследование III фазы, в ходе которого было проведено сравнение применения кабозантиниба в комбинации с атезолизумабом и сорафениба при распространенном ГЦР [51]. Хотя в отношении первичной конечной точки исследования (ОВ) были получены отрицательные результаты, запланированный подгрупповой анализ продемонстрировал, что показатели ВБП и ОВ были выше при назначении комбинации в сравнении с сорафенибом у пациентов с ГЦР и гепатитом В (ВБП: ОР 0,46, 95% ДИ 0,29–0,73; ОВ: ОР 0,53, 95% ДИ 0,33–0,87), но не в подгруппе ГЦР невирусной этиологии (ВБП: ОР 0,92, 95% ДИ 0,60–1,41; ОВ: ОР 1,18, 95% ДИ 0,78–1,79) [51]. Недавнее трансляционное исследование показало, что применение анти-PD-1 препаратов может парадоксальным образом индуцировать и ускорять процессы канцерогенеза у пациентов с ГЦР и неалкогольным стеатогепатитом (НАСГ) в качестве фонового заболевания [52]. Группа исследователей обнаружила, что при ГЦР и НАСГ как в мышиной модели, так и в человеческих опухолях имело место специфическое повышение уровня CD8+PD1+ Т-лимфоцитов. Примечательно, что анти-PD-1 терапия способствовала повреждению тканей, приводила к озлокачествлению и обеспечивала большую агрессивность уже имеющихся НАСГ и ГЦР. Кроме того, метаанализ трех опубликованных исследований III фазы (CheckMate 459, Keynote 240 и IMBrave 150), проведенный той же группой ученых, показал, что показатели выживаемости пациентов с ГЦР невирусной этиологии не улучшались при применении иммунотерапии (ОР 0,92, 95% ДИ 0,77–1,11). И напротив, иммунотерапия улучшала показатели ОВ у пациентов с ГЦР вирусной этиологии (ОР 0,64, 95% ДИ 0,48–0,94) [52].
В свете получения таких интересных данных увеличилось число исследований, призванных проверить, что принесет больше пользы пациентам с ГЦР невирусной этиологии – иммунотерапия или терапия МКИ. Недавно опубликованное многонациональное ретроспективное исследование с проспективным набором пациентов, и включением 759 случаев распространенного ГЦР невирусной этиологии, показало, что терапия ленватинибом увеличивала показатели ОВ (ОР: 0,65, 95% ДИ 0,44–0,95; р=0,0268) и ВБП (ОР: 0,67, 95% ДИ 0,51–0,86; р=0,002) в сравнении с терапией комбинацией атезолизумаб + бевацизумабом [53]. В частности, многофакторный анализ показал, что применение ленватиниба в популяции пациентов с неалкогольной жировой болезнью печени (НАЖБП)/НАСГ приводило к увеличению ОВ (ОР: 0,46, 95% ДИ 0,26–0,84; р=0,011) и ВБП (ОР: 0,55, 95% ДИ 0,38–0,82; р=0,031) по сравнению с применением атезолизумаба в комбинации с бевацизумабом, чего не наблюдалось в подгруппе пациентов без НАЖБП/НАСГ [53].
Прежде чем использовать этиологию ГЦР в качестве критерия выбора режима для 1-й линии терапии, необходимо учесть несколько факторов. Во-первых, очевидно, что подгруппа пациентов с ГЦР невирусной этиологии представляет собой неоднородную популяцию, в которой есть пациенты с НАЖБП, хроническим алкоголизмом, скрытым гепатитом В (положительный результат теста на анти-HBс и отрицательный – на HBsAg), а также пациенты, у которых имеет место сочетание перечисленных выше причин. Анализ преимуществ различных режимов системной терапии в каждой из указанных подгрупп необходим для понимания преимуществ каждого варианта лечения. Во-вторых, имеющиеся на данный момент данные получены посредством подгрупповых анализов в ходе клинических исследований или ретроспективного анализа серий клинических случаев, который мог отличаться предвзятостью. Гипотезу необходимо проверить путем проведения проспективных исследований, предполагающих сравнение терапии ленватинибом и ИИКТ в подгруппах с ГЦР определенной этиологии. В-третьих, необходимо точнее сформулировать определение ГЦР невирусной этиологии, поскольку в представленных анализах такие подгруппы не были четко определены [14, 51, 53]. Например, золотым стандартом диагностики НАЖБП является наличие гистологических признаков стеатоза более чем в 5% гепатоцитов, что предполагает использование инвазивных методов, таких как биопсия печени. Несмотря на возможность неинвазивной диагностики посредством проведения компьютерной томографии и ультразвуковых исследований, представление рентгенографических данных связано с рядом ограничений, причинами которых являются несоответствия в заключениях одних и тех же специалистов и чувствительность используемых методов визуализации [54]. Кроме того, в условиях наблюдаемой пандемии метаболических заболеваний печени у значительной части пациентов с вирусным гепатитом может встречаться сочетание вирусного гепатита с жировой болезнью печени. Например, в ходе ретроспективного когортного исследования, проведенного в Гонконге, в которое были включены 270 инфицированных вирусом гепатита B пациентов, гистологически подтвержденное сопутствующее заболевание печени было обнаружено у 107 (39,6%) пациентов [55]. По этой причине при проведении дальнейших исследований необходимо дать четкое определение ГЦР различной этиологии и учесть возможность наличия разных этиологических факторов у одного и того же пациента.
Применение ленватиниба в 1-й линии терапии и трансартериальной химиоэмболизации
Помимо изучения ленватиниба в режиме монотерапии в 1-й линии распространенного ГЦР, также было проведено исследование ленватиниба в комбинации с трансартериальной химиоэмболизацией (ТАХЭ) у пациентов с распространенным ГЦР, с целью улучшить клинические исходы [56]. Недостаточный ответ внутрипеченочных опухолевых очагов по-прежнему представляет собой серьезную проблему для повторных ТАХЭ [57]. Повышение экспрессии VEGF и других проангиогенных факторов после ТАХЭ, индуцированное появлением ишемических изменений в опухолевом окружении, считается основным механизмом, лежащим в основе резистентности к лечению [58, 59]. Ленватиниб как мощный антиангиогенный агент теоретически может обеспечить синергизм с ТАХЭ посредством ингибирования и ангиогенеза, и роста опухоли после проведения ТАХЭ.
В ходе исследования LAUNCH 338 пациентов-китайцев с распространенным ГЦР, ранее не получавших терапию, или с рецидивом распространенного первичного ГЦР после хирургического лечения рандомизировали для получения ленватиниба или ленватиниба в комбинации с ТАХЭ по необходимости (ЛЕН-ТАХЭ) [56]. У большинства пациентов (более 85%) был гепатит В. ТАХЭ выполняли через сутки после перорального приема ленватиниба, а затем повторяли, если имел место неполный некроз или возобновление роста опухоли. Наблюдение (в среднем в течение 17 мес) показало, что показатель ОВ был значимо выше в группе ЛЕН-ТАХЭ – 17,8 мес против 11,8 мес в группе, получавшей монотерапию ленватинибом (ОР 0,45; р=0,001). Медианная ВБП в группе ЛЕН-ТАХЭ также была выше – 10,6 мес против 6,4 мес в группе, получавшей монотерапию ленватинибом (ОР 0,43; р=0,001). ЧОО по критериям mRECIST была выше в группе ЛЕН-ТАХЭ (54,1%), чем в группе, получавшей монотерапию ленватинибом (25,0%) (р=0,001) [56]. Что касается безопасности, в группе ЛЕН-ТАХЭ чаще наблюдали отклонения от нормы уровней печеночных ферментов (3–4-й степени), чем в группе монотерапии ленватинибом (~20% против 2%), однако частота других нежелательных явлений 3–4-й степени, таких как ладонно-подошвенный синдром, диарея, боль в животе и т.д., в двух группах была схожей [56]. Несмотря на то что это исследование позволило получить многообещающие данные о применении ленватиниба в комбинации с ТАХЭ у пациентов-китайцев с ГЦР вследствие гепатита В, необходимы дальнейшие исследования, чтобы экстраполировать полученные данные на пациентов с ГЦР иной этиологии, принадлежащих к иным этническим группам.
Применение ленватиниба в качестве терапии
1-й линии при ГЦР промежуточной стадии
Пациенты с ГЦР промежуточной стадии представляют собой наиболее неоднородную группу. До 2018 г. единственным рекомендованным методом лечения ГЦР промежуточной стадии (по системе Barcelona Clinic Liver Cancer [BCLC]-B) являлась ТАХЭ [60]. В обновленной версии классификации от 2022 г. ГЦР промежуточной стадии разделен на три подгруппы в зависимости от опухолевой нагрузки и функционального состояния печени для лучшей стратификации и управления лечением [61]. Для подгруппы пациентов с обширным диффузным инфильтративным билобарным поражением печени рекомендованным вариантом лечения уже является не ТАХЭ, а системная терапия. Применение ТАХЭ не является эффективной стратегией лечения ГЦР промежуточной стадии с высокой опухолевой нагрузкой, оно может привести к нарушению функции печени на ранних этапах [61, 62].
Безусловно, системная терапия ГЦР промежуточной стадии не является чем-то новым. В ходе трех крупных исследований клинической практики была продемонстрирована эффективность сорафениба у пациентов с ГЦР промежуточной стадии [63–65]. Исследование
GIDEON – глобальное проспективное наблюдательное исследование, проходившее с 2009 по 2012 г., предполагало оценку безопасности и эффективности сорафениба у пациентов с ГЦР разных стадий по системе BCLC. Было установлено, что медиана ОВ была выше у пациентов с опухолями BCLC-B в сравнении с BCLC-С (ОВ 29,5 против 11,1 мес) [63]. SOFIA и INSIGHT, два похожих исследования, проведенных в Европе в один и тот же период, также продемонстрировали лучшую медиану ОВ для пациентов с ГЦР стадии BCLC-B по сравнению с BCLC-С при лечении сорафенибом (SOFIA, ОВ 20,6 против 8,4 мес; INSIGHT, ОВ 19,6 против
13,6 мес) [64, 65].
Однако для какой группы пациентов системная терапия принесет больше пользы, чем ТАХЭ, было все еще неясно. Чтобы сформулировать характеристики для такой группы пациентов, которая в большей степени подходит для системной терапии, эффективность ленватиниба в сравнении с ТАХЭ оценивалась при ГЦР промежуточной стадии у пациентов без ТАХЭ в анамнезе, с опухолевой нагрузкой, выходящей за рамки критериев «до 7» («up-to-7»), и с функциональным классом А по Чайлд–Пью [66]. Ленватиниб был выбран вместо сорафениба из-за более высокого показателя ЧОО, который был достигнут в рамках исследования REFLECT [7, 67]. Критерии «до 7» предполагают то, что количество опухолевых очагов и диаметр этих очагов равны семи или менее. Эти критерии были впервые предложены как дополнение к Миланским для прогнозирования исхода трансплантации печени [68]. Ретроспективное исследование, проведенное методом псевдорандомизации для экспериментального подтверждения концепции, показало, что применение ленватиниба обеспечило увеличение ОВ (37,9 мес против 21,3 мес; р<0,01), ВБП (16,0 мес против 3,0 мес; р=0,001) и ЧОО (73,3% против 33,3%; р=0,001). Исследование также продемонстрировало, что функция печени ухудшалась после повторной ТАХЭ (исходный показатель по шкале ALBI от –2,66 до –2,09; р<0,001) и не менялась в группе, получавшей ленватиниб (исходный показатель по шкале ALBI от –2,61 до –2,61; р=0,254). Следует отметить, что прием ленватиниба обеспечил значимое уменьшение распространенности опухолевого процесса у двух пациентов; это сделало возможными проведение абляции и удаление опухоли. Такие обнадеживающие результаты подтверждают место ленватиниба в лечении ГЦР промежуточной стадии у пациентов с распространением опухолевого процесса за рамки критериев «до 7» и сохранной функцией печени в ходе крупного рандомизированного контролируемого исследования. Тем не менее также следует заранее рассмотреть возможность назначения ленватиниба пациентам, чей ответ на ТАХЭ был признан слабым.
Проведенное в Японии исследование TACTICS-L – неконтролируемое исследование II фазы по оценке эффективности и безопасности применения ленватиниба в комбинации с ТАХЭ при неоперабельном ГЦР промежуточной стадии [69]. В исследование были включены 62 пациента, в основном пожилые (старше 65 лет: 79%), со стадией BCLC-В (59,7%). У 64,5% пациентов опухолевая нагрузка определялась в рамках критериев «до 7». Пациенты получали ленватиниб в течение 14–21 дня, с последующим перерывом на 2 дня перед ТАХЭ, далее возобновляли лечение через 2 дня после ТАХЭ, до прогрессирования заболевания. При медиане наблюдения 20,3 мес медиана ВБП составила 28,3 мес, а двухлетняя ВБП превысила 60%. Наилучший показатель ЧОО составил 88,7%, при этом полный ответ имел место у 66,1% пациентов. Около половины (50,5%) ответивших на лечение (n=55) продемонстрировали устойчивый ответ на терапию через год. Этот метод лечения показал хорошую переносимость, а наиболее частыми нежелательными явлениями были гипотиреоз (58,1%), артериальная гипертензия (53,2%) и снижение аппетита (50,0%). Никакие другие настораживающие нежелательные явления выявлены не были [69]. Таким образом, ленватиниб в комбинации с ТАХЭ представляет собой еще один многообещающий режим терапии 1-й линии для пациентов с неоперабельным ГЦР промежуточной стадии – несмотря на то, что в исследование было включено большое число пациентов с более ранней стадией ГЦР (BCLC-A). Для валидации данного комбинированного метода лечения необходимы дальнейшие исследования III фазы.
С другой стороны, в настоящий момент проходят несколько исследований III фазы по оценке эффективности атезолизумаба в комбинации с бевацизумабом (или в комбинации с ТАХЭ) по сравнению с ТАХЭ при ГЦР промежуточной стадии (NCT04803994, NCG04712643) [70, 71]. Поскольку характер ответа у пациентов, которых лечили атезолизумабом в комбинации с бевацизумабом (способствует уменьшению размеров опухоли), и пациентов, которые получали ленватиниб (способствует некрозу опухоли за счет прекращения кровоснабжения), различен [72], в дальнейшем было бы интересно сравнить атезолизумаб в комбинации с бевацизумабом и ТАХЭ и ленватиниб в комбинации с ТАХЭ.
Заключение
В эпоху эффективной комбинированной терапии ИИКТ, демонстрирующей потрясающие показатели частоты ответа и выживаемости, роль ленватиниба в первой линии терапии распространенного ГЦР стала менее значительной. Однако терапия ИИКТ подходит не всем пациентам по причине наличия фоновых состояний, таких как аутоиммунные заболевания и длительный прием иммуносупрессоров (см. табл. 2). В таких условиях ленватиниб играет важную роль – он представляется безопасным и таким же эффективным. Тем не менее клиницистам следует обращать внимание на частые нежелательные явления, такие как артериальная гипертензия, протеинурия и гипотиреоз, возникающие вследствие длительного приема ленватиниба. Важно тщательно контролировать эти нежелательные явления. Кроме того, с увеличением числа доступных препаратов для лечения распространенного ГЦР предметом изучения стала правильная последовательность лечения (например, сначала ИИКТ или сначала ИТК). Несколько ретроспективных исследований продемонстрировали эффективность и безопасность ленватиниба при применении в качестве терапии 2-й линии после ИИКТ, однако данных проспективных исследований по-прежнему не хватает [73, 74].
С другой стороны, сейчас мы начали понимать, что пациенты с ГЦР различной этиологии могут по-разному отвечать на лечение ИИКТ, применение которых позволяет добиться лучшего ответа у некоторых пациентов, чем применение ленватиниба. Например, многочисленные ретроспективные исследования показали, что применение ленватиниба у пациентов с ГЦР невирусной этиологии может быть более эффективным, чем применение комбинаций с ИИКТ [14, 51, 53]. Такие различия в ответе были объяснены различиями опухолевого микроокружения и состояния иммунной системы, связанными с наличием фоновых заболеваний [52]. Тем не менее пациенты с ГЦР невирусной этиологии представляют собой неоднородную группу пациентов, и для подтверждения этих постулатов потребуются дальнейшие исследования, специально предназначенные для пациентов с ГЦР с конкретной этиологией (см. табл. 2).
Кроме того, в настоящее время производится оценка применения ленватиниба в качестве терапии 1-й линии при промежуточной стадии ГЦР, в том числе у пациентов с высокой опухолевой нагрузкой – например, выходящей за рамки критериев «до 7» (см. табл. 2). Известно, что данная группа пациентов рефрактерна к таким методам терапии как ТАХЭ. Несколько исследований с участием небольшого числа пациентов показали, что монотерапия ленватинибом или терапия ленватинибом в комбинации с ТАХЭ эффективна и безопасна в этой группе пациентов, при этом дополнительным преимуществом является отсутствие нарушения функции печени [66, 69]. Что касается неоадъювантной и адъювантной терапии, продолжается ряд исследований, изучающих применение ленватиниба в комбинации с иммунотерапией и/или локорегионарной терапией (например, ТАХЭ, радиочастотная абляция), результаты которых, как ожидается, будут опубликованы в ближайшие годы (NCT05185739, NCT04227808, NCT05113186). Применение комбинации ленватиниба, пембролизумаба и ТАХЭ в настоящее время изучают в ходе исследования III фазы LEAP 012 [75]. Таким образом, роль ленватиниба в терапии ГЦР продолжает развиваться, и препарат останется важным для лечения данного заболевания на годы вперед.
Вклад авторов. Авторы внесли равный вклад в разработку концепции, анализ литературных данных, подготовку черновика и финальную проверку рукописи.
Authors’ contribution. Both authors contribute equally to the conceptualization, literature review, drafting and final review of this manuscript.
Конфликт интересов. С.Л. Чан является консультантом Astra-Zeneca, MSD, Eisai, BMS и Roche. Его исследования финансировали компании MSD, Bayer, Eisai, Ipsen и SIRTEX. С.Л. Чан получил вознаграждение от компаний Bayer, Astra-Zeneca, Eisai, Roche и MSD. Он выступает с докладами от имени MSD, BMC, Astra-Zeneca, Eisai, Roche, Ipsen, SIRTEX и Hutchmed. Л.Л. Чан получил поддержку в виде оплаты путевых расходов от компании Roche.
Conflicts of Interest. S.L. Chan is the advisory for Astra-Zeneca, MSD, Eisai, BMS and Roche. S.L. Chan received research fund from MSD, Bayer, Eisai, Ipsen and SIRTEX. S.L. Chan received Honoraria from Bayer, Astra-Zeneca, Eisai, Roche and MSD. S.L. Chan is the speaker for MSD, BMC, Astra-Zeneca, Eisai, Roche, Ipsen, SIRTEX and Hutchmed. L.L. Chan has received travel support from Roche.
Источник: Chan L.L., Chan S.L. The evolving role of lenvatinib at the new era of first-line hepatocellular carcinoma treatment. Clin Mol Hepatol. 2023; 29: 909-923. DOI: 10.3350/cmh.2023.0114
Перевод статьи выполнен на условиях лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by-nc/3.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
The translation of the article has been completed under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by-nc/3.0/), which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Информация об авторах
Information about the authors
Лэндон Л. Чан – отд-ние клин. онкологии, Больница принца Уэльского, Китайский университет Гонконга; Государственная лаборатория трансляционной онкологии, Онкологический центр сэра Юэ Конг Пао, Гонконгский институт рака, специальный административный район Гонконг, Китай
Landon L. Chan – Department of Clinical Oncology, Prince of Wales Hospital, The Chinese University of Hong Kong; State Key Laboratory of Translational Oncology, Sir YK Pao Centre for Cancer, Hong Kong Cancer Institute, Hong Kong SAR, China
Стивен Л. Чан – отд-ние клин. онкологии, Больница принца Уэльского, Китайский университет Гонконга, специальный административный район Гонконг, Китай.
E-mail: chanlam_stephen@cuhk.edu.hk; ORCID: 0000-0001-8998-5480
Stephen L. Chan – Department of Clinical Oncology, Prince of Wales Hospital, The Chinese University of Hong Kong, Hong Kong SAR, China. E-mail: chanlam_stephen@cuhk.edu.hk; ORCID: 0000-0001-8998-5480
Поступила в редакцию: 03.06.2024
Поступила после рецензирования: 14.06.2024
Принята к публикации: 20.06.2024
Received: 03.06.2024
Revised: 14.06.2024
Accepted: 20.06.2024