Клинический разбор в общей медицине №7 2024
Аннотация
В Российской Федерации заболеваемость раком тела матки остается на первом месте среди злокачественных новообразований женских половых органов. Хирургическое лечение является основным методом лечения начальных форм заболевания, однако вопрос о предикции метастатического поражения лимфоузлов на дооперационном этапе для выполнения лимфаденэктомии остается дискутабельным. Потенциальная прогностическая значимость опухолевого поражения нижнего сегмента матки в отношении метастазов в лимфатических узлах может обосновывать целесообразность оценки локализации опухоли до начала лечения. Магнитно-резонансная томография органов малого таза позволяет определить вовлеченность нижнего сегмента матки в опухолевый процесс, тем самым создавая основу для расширения объема хирургического вмешательства.
Ключевые слова: рак тела матки, эндометриоидная аденокарцинома, нижний сегмент тела матки, фактор риска, магнитно-резонансная томография, сторожевой лифмоузел, индоцианин зеленый.
Для цитирования: Ткаченко Б.Э., Мкртчян Л.С., Левицкая Н.В., Агабабян Т.А., Шеберова Е.В., Ушакова Д.А., Петров В.А., Иванов С.А., Каприн А.Д. Персонализированный подход к хирургическому лечению начального рака тела матки при опухолевом поражении нижнего сегмента. Клиническое наблюдение. Клинический разбор в общей медицине. 2024; 5 (7): 69–73. DOI: 10.47407/kr2024.5.7.00449
A personalized approach to the surgical treatment of early-stage uterine body cancer with tumor involvement in the lower uterine segment. Clinical observation
Borislav E. Tkachenko1, Liana S. Mkrtchyan1, Natalya V. Levickaya1, Tatev A. Agababyan1,
Elizaveta V. Sheberova1, Darya A. Ushakova1, Vladimir A. Petrov1, Sergey A. Ivanov1,2,
Andrey D. Kaprin2,3,4
1Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
3Hertsen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, Moscow, Russia;
4National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation, Moscow, Russia
bar31.05.96@gmail.com
Abstract
In the Russian Federation, the incidence of uterine body cancer remains the highest among malignant neoplasms of the female genital organs. Surgical treatment is the primary method for treating early stages of the disease; however, the issue of predicting metastatic lymph node involvement at the preoperative stage for performing lymphadenectomy remains debatable. The potential prognostic significance of tumor involvement in the lower uterine segment regarding lymph node metastases may justify the need to assess tumor localization before starting treatment. Magnetic resonance imaging (MRI) of the pelvic organs can help determine the involvement of the lower uterine segment in the tumor process, thereby creating a basis for expanding the scope of surgical intervention.
Keywords: uterine body cancer, endometrioid adenocarcinoma, lower uterine segment, risk factor, magnetic resonance imaging, sentinel lymph node, indocyanine green.
For citation: Tkachenko B.E., Mkrtchyan L.S., Levickaya N.V., Agababyan T.A., Sheberova E.V., Ushakova D.A., Petrov V.A., Ivanov S.A., Kaprin A.D. A personalized approach to the surgical treatment of early-stage uterine body cancer with tumor involvement in the lower uterine segment. Clinical observation. Clinical review for general practice. 2024; 5 (7): 69–73. (In Russ.). DOI: 10.47407/kr2024.5.7.00449
Введение
Рак тела матки (РТМ) в Российской Федерации занимает первое место среди злокачественных новообразований женских половых органов с увеличением показателей заболеваемости на 21,9% за последнее десятилетие [1]. В подавляющем большинстве случаев (70,8%) диагностируются начальные формы заболевания (I стадия), однако, несмотря на внедрение современных лечебно-диагностических технологий, отмечается неуклонный рост показателей смертности, что может быть связано в том числе с реализацией нерадикальных программ вследствие игнорирования потенциальных факторов неблагоприятного прогноза [2].
Стратификация больных по группам риска в соответствии с традиционными факторами (степень дифференцировки опухоли, глубина инвазии в миометрий, лимфоваскулярная инвазия) на дооперационном этапе является основой для определения объема хирургического лечения, на послеоперационном – необходимости адъювантной терапии. Высокий риск лимфогенных метастазов, идентифицированный с учетом клинико-морфологических предикторов, служит показанием для тазовой и поясничной лимфаденэктомии; при промежуточном риске лимфодиссекция может быть выполнена лишь для уточнения стадии заболевания, а при низком риске – не является стандартной процедурой [3].
Локализация опухоли – с/без поражения нижнего сегмента (НС) не входит в систему стадирования FIGO [4] и не рассматривается в качестве критерия для определения групп риска [5]. В то же время целый ряд исследований демонстрирует, что опухолевое поражение НС, особенно при эндометриоидной аденокарциноме тела матки, ассоциируется с более низкой степенью дифференцировки опухоли [6] и ее глубокой инвазией в миометрий [7], с наличием лимфоваскулярной инвазии [8] и метастазов в регионарных лимфоузлах [9, 10]. Расположение опухоли в области НС за счет анатомических особенностей последнего (тонкий миометрий, выраженный лимфо-венозный отток и др.) [11] повышает риск метастазирования в лимфоузлы, влияя негативно на общую и безрецидивную выживаемости [12], что может использоваться в качестве дополнительной информации для принятия решения относительно объема хирургического вмешательства – с/без лимфаденэктомии.
Однако у более чем 80% пациентов, у которых лимфаденэктомия выполнена с профилактической целью, при морфологическом исследовании метастатическое поражение лимфатических узлов не подтверждается [13]. Кроме того, в 30–50% случаев после хирургического вмешательства возникают осложнения (лимфоррея, лимфокисты и/или лимфедема нижних конечностей), которые снижают качество жизни больных и могут увеличивать сроки начала адъювантной лучевой терапии (ЛТ) при ее необходимости [14].
Концепция определения первого лимфатического узла на пути лимфооттока из пораженного опухолью органа, известного как сторожевой лимфоузел, может служить альтернативой стадирующей и/или профилактической лимфаденэктомии у больных эндометриоидным РТМ I стадии, особенно при низком и промежуточном рисках лимфогенного метастазирования [15]. В настоящее время биопсия сторожевого лимфоузла с использованием препарата ICG (индоцианин зеленый) относится к основным методам диагностики поражения регионарных лимфатических узлов [16]. Применение данной технологии у больных с потенциальным предиктором неблагоприятного клинического исхода – опухолевым поражением НС при низком и промежуточном рисках позволит диагностировать метастатическое поражение регионарных лимфоузлов, что имеет ключевое значение для выполнения адекватного объема хирургического вмешательства и планирования послеоперационного лечения.
Магнитно-резонансная томография (МРТ) органов малого таза является неотъемлемой частью предоперационного обследования пациенток с РТМ. МРТ позволяет оценить ключевые прогностические факторы – размер опухоли и глубину ее инвазии в миометрий, переход на цервикальный канал и прорастание стромы шейки матки, опухолевое поражение лимфатических узлов, и оптимально стратифицировать риск перед выбором лечения [17]. Кроме того, возможности мультипланарной визуализации при МРТ позволяют точно оценить локально-региональное распространение опухоли тела матки, являясь по сути основным инструментом для определения зоны возникновения опухолевого процесса в матке [18]. Ключевой последовательностью для оценки точной локализации опухоли в полости матки, заинтересованности миометрия и шейки матки является Т2ВИ высокого разрешения в трех плоскостях, ориентируемые по отношению к полости матки, а для точного измерения расстояния от края опухоли до внутреннего зева – получение изображения полости матки и цервикального канала на одном срезе в сагиттальной плоскости [19]. При определении статуса лимфатических узлов основными параметрами являются размер по короткой оси, конфигурация, контуры, текстура и т.д. Однако эти критерии имеют относительно высокую специфичность (Sp 69–96%) при крайне низкой чувствительности (Se 24–73%), снижая AUC до 0,706, по сравнению с позитронно-эмиссионной компьютерной томографией [20–22]. В этих условиях высокое контрастное разрешение мягких тканей при МРТ, позволяющее проводить детальное анатомическое очертание опухоли с определением ее расположения наряду с пониманием анатомических особенностей матки и путей лимфооттока, может иметь решающее значение для определения тактики лечения пациенток с РТМ с поражением НС.
Клинический пример
Случай 1. Пациентка Я., 56 лет. Обратилась в МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России (г. Обнинск) с жалобами на кровянистые выделения из половых путей на фоне 6-летней постменопаузы.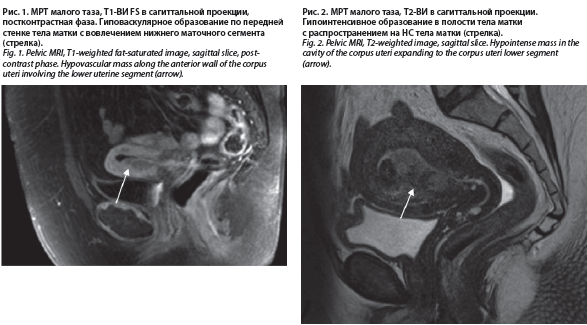
 Выполнено комплексное обследование, в том числе включающее раздельное диагностическое выскабливание полости матки и цервикального канала, МРТ органов малого таза. По данным морфологического исследования верифицирована высокодифференцированная (Grade 1) эндометриоидная аденокарцинома тела матки. По данным МРТ в теле матки по передней стенке до области внутреннего зева и в области трубных углов визуализируется гиповаскулярное образование со средним МР-сигналом, истинным ограничением диффузии. Отмечается распространение процесса до 1/2 толщины миометрия. Увеличенных лимфоузлов в полости таза нет (рис. 1).
Выполнено комплексное обследование, в том числе включающее раздельное диагностическое выскабливание полости матки и цервикального канала, МРТ органов малого таза. По данным морфологического исследования верифицирована высокодифференцированная (Grade 1) эндометриоидная аденокарцинома тела матки. По данным МРТ в теле матки по передней стенке до области внутреннего зева и в области трубных углов визуализируется гиповаскулярное образование со средним МР-сигналом, истинным ограничением диффузии. Отмечается распространение процесса до 1/2 толщины миометрия. Увеличенных лимфоузлов в полости таза нет (рис. 1).
По данным обследования пациентке сформулирован предварительный диагноз – Рак тела матки IB стадия (cT1bN0M0), и, согласно клиническим рекомендациям, было запланировано хирургическое лечение, при определении объема которого руководствовались действующими стандартами [3]. Несмотря на промежуточный риск лимфогенных метастазов, при котором лимфа-
денэктомия является лишь возможной опцией для стадирования, пациентке на онкологическом консилиуме был сформирован индивидуальный план лечения с учетом опухолевого поражения НС: лапароскопическая экстирпация матки с придатками с определением сторожевых лимфоузлов при помощи ICG, что и было реализовано. Интраоперационно сторожевые лимфоузлы были выявлены с обеих сторон в области обтураторных ямок и удалены. При плановом гистологическом исследовании операционного материала в матке диагностирована высокодифференцированная (Grade 1) эндометриоидная аденокарцинома с глубиной инвазии в миометрий 10 мм (более 1/2 толщины миометрия) с распространением на НС матки, отмечается лимфоваскулярная инвазия опухоли, метастатическое поражение всех удаленных лимфоузлов. С учетом данных морфологического исследования операционного материала заключительный диагноз – Рак тела матки IIIС стадия (рT1bN1M0). Пациентка отнесена к высокому риску прогрессирования заболевания и, принимая во внимание объем выполненного хирургического вмешательства, в послеоперационном периоде выполнялась «сэндвич-терапия»: 3 курса полихимиотерапии (ПХТ) по схеме карбоплатин AUC 5-6, паклитаксел 175 мг/м2 в 1 день, с интервалом в 21 день (TC), курс сочетанной лучевой терапии (СЛТ) – дистанционная лучевая терапия (ДЛТ) до суммарной очаговой дозы (СОД) 46 Гр, брахитерапия до СОД 20 Гр, 3 курса ПХТ по аналогичной схеме. Продолжительность наблюдения составила 14 мес, на данном сроке отмечается ремиссия.
Случай 2. Пациентка М., 44 лет. В МРНЦ им.
А.Ф. Цыба выполнено дообследование с морфологически верифицированной по месту жительства высокодифференцированной (Grade 1) эндометриоидной аденокарциномой тела матки. На МРТ малого таза с внутривенным контрастированием полость матки расширена до 3 см, выполнена гиповаскулярным образованием с истинным ограничением диффузии, распространяющимся до 1/2 толщины миометрия в области нижнего отдела тела матки (рис. 2).
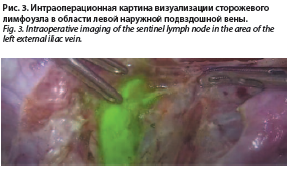
Учитывая данные клинико-морфологических и радиологических исследований, пациентка была отнесена к низкому риску лимфогенного метастазирования с предварительным диагнозом – Рак тела матки IА стадия (cT1аNоM0), при котором, согласно клиническим рекомендациям, тазовая и поясничная лимфаденэктомия не показана [3]. Принимая во внимание опухолевое поражение НС, диагностированное по данным МРТ органов малого таза, пациентке был реализован индивидуальный план в виде лапароскопической экстирпации матки с придатками с определением сторожевых лимфоузлов при помощи ICG. Интраоперационно были выявлены сторожевые лимфоузлы на уровне наружной подвздошной вены слева (рис. 3), в связи с чем выполнено их удаление и
ипсилатеральная лимфодиссекция.
При плановом гистологическом исследовании операционного материала в матке диагностирована умереннодифференцированная (Grade 2) эндометриоидная аденокарцинома, глубина инвазии в миометрий 16 мм (более 1/2 толщины миометрия) и распространением на НС (глубина инвазии 15 мм) и внутренний зев (глубина инвазии в строму 3 мм); в сосудах миометрия выявлены многочисленные опухолевые эмболы, в двух из пяти сторожевых лимфатических узлах – макрометастазы умереннодифференцированной эндометриоидной аденокарциномы; остальные лимфатические узлы без признаков опухолевого роста. С учетом данных морфологического исследования операционного материала заключительный диагноз – Рак тела матки IIIС стадии (рT1bN1M0). С учетом группы риска (высокий) и объема хирургического вмешательства пациентке было проведено адъювантное лечение: 3 курса ПХТ (ТС), курс СЛТ – ДЛТ до СОД 46 Гр, брахитерапия до СОД
20 Гр, 3 курса ПХТ (ТС). Продолжительность наблюдения составила 8 мес, по результатам лабораторно-инструментальных методов обследования данных, подтверждающих прогрессирование, не выявлено.
Заключение
Руководствуясь данными современных публикаций о неблагоприятном прогностическом значении опухолевого поражения НС матки – наличии значимой корреляционной взаимосвязи с метастазами в лимфатических узлах и низкими показателями выживаемости, сформирована тактика лечения больных эндометриодным РТМ I стадии. Проведенная на дооперационном этапе МРТ органов малого таза позволила выявить локализацию опухоли в области НС, что и послужило основанием для индикации сторожевых лимфоузлов и последующего расширения объема хирургического вмешательства в виде лимфаденэктомии. Персонализированный подход к лечению начального эндометриоидного РТМ позволил оценить реальный риск прогрессирования (высокий) у больных низкого и промежуточного рисков с опухолевым поражением НС матки и реализовать адекватную адьювантную терапию, тем самым повышая шанс безрецидивного течения заболевания. Однако для окончательных выводов о предиктивной значимости локализации опухоли в НС матки необходимы дальнейшие исследования в однородных группах больных, в том числе с проведением многофакторного анализа.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Ткаченко Борислав Эдуардович – аспирант, врач-онколог отделения лучевых и комбинированных методов лечения гинекологических заболеваний с группой восстановительной и эстетической медицины, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ Радиологии». E-mail: bar31.05.96@gmail.com; ORCID: 0009-0008-4434-3079
Borislav E. Tkachenko – Graduate Student, Tsyb Medical Radiological Research Center – branch of the National Medical Research Radiological Center. E-mail: bar31.05.96@gmail.com; ORCID: 0009-0008-4434-3079
Мкртчян Лиана Сирекановна – д-р мед. наук, вед. науч. сотр. отд-ния лучевых и комбинированных методов лечения гинекологических заболеваний с группой восстановительной и эстетической медицины, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ Радиологии». E-mail: liana6969@mail.ru; ORCID: 0000-0002-5027-5331
Liana S. Mkrtchyan – Dr. Sci. (Med.), Tsyb Medical Radiological Research Center – branch of the National Medical Research Radiological Center. E-mail: liana6969@mail.ru; ORCID: 0000-0002-5027-5331
Левицкая Наталья Вячеславовна – канд. мед. наук, зав. отд-нием лучевых и комбинированных методов лечения гинекологических заболеваний с группой восстановительной и эстетической медицины, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ Радиологии». E-mail: natalevicka@gmail.com; ORCID: 0000-0002-3445-8488
Natalya V. Levickaya – Cand. Sci. (Med.), Tsyb Medical Radiological Research Center – branch of the National Medical Research Center of Radiology. E-mail: natalevicka@gmail.com; ORCID: 0000-0002-3445-8488
Агабабян Татев Артаковна – канд. мед. наук, зав. отд-нием лучевой диагностики, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-9971-3451
Tatev A. Agababyan – Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-9971-3451
Шеберова Елизавета Викторовна – врач-рентгенолог, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: lisa_iroshnikova@mail.ru; ORCID: 0000-0001-7827-2741
Elizaveta V. Sheberova – Radiologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: lisa_iroshnikova@mail.ru; ORCID: 0000-0001-7827-2741
Ушакова Дарья Александровна – клин. ординатор отделения радиотерапии МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: darya.ushakova.97@bk.ru; ORCID: 0009-0008-7910-6743
Darya A. Ushakova – Clinical Resident, Tsyb Medical Radiological Research Center – branch of the National Medical Research Radiological Center. E-mail: darya.ushakova.97@bk.ru; ORCID: 0009-0008-7910-6743
Петров Владимир Александрович – д-р мед. наук, проф., зав. научно-образовательным отделом, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ Радиологии».
E-mail: vapetrov1959@mail.ru; ORCID: 0000-0002-8580-933X
Vladimir A. Petrov – Dr. Sci. (Med.), Full Prof., Tsyb Medical Radiological Research Center – branch of the National Medical Research Radiological Centre. E-mail: vapetrov1959@mail.ru; ORCID: 0000-0002-8580-933X
Иванов Сергей Анатольевич – чл.-корр. РАН, д-р мед. наук, проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Director of
Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
ORCID: 0000-0001-7689-6032
Каприн Андрей Дмитриевич – академик РАН, д-р мед. наук, проф., зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, дир. МНИОИ им. П.А. Герцена (филиал ФГБУ «НМИЦ радиологии»), ген. дир. ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University), Director Hertsen Moscow Oncology Research Institute, General Director National Medical Research Radiological Centre.
ORCID: 0000-0001-8784-8415
Поступила в редакцию: 04.07.2024
Поступила после рецензирования: 09.07.2024
Принята к публикации: 11.07.2024
Received: 04.07.2024
Revised: 09.07.2024
Accepted: 11.07.2024
Клинический разбор в общей медицине №7 2024
Персонализированный подход к хирургическому лечению начального рака тела матки при опухолевом поражении нижнего сегмента. Клиническое наблюдение
Аннотация
В Российской Федерации заболеваемость раком тела матки остается на первом месте среди злокачественных новообразований женских половых органов. Хирургическое лечение является основным методом лечения начальных форм заболевания, однако вопрос о предикции метастатического поражения лимфоузлов на дооперационном этапе для выполнения лимфаденэктомии остается дискутабельным. Потенциальная прогностическая значимость опухолевого поражения нижнего сегмента матки в отношении метастазов в лимфатических узлах может обосновывать целесообразность оценки локализации опухоли до начала лечения. Магнитно-резонансная томография органов малого таза позволяет определить вовлеченность нижнего сегмента матки в опухолевый процесс, тем самым создавая основу для расширения объема хирургического вмешательства.
Ключевые слова: рак тела матки, эндометриоидная аденокарцинома, нижний сегмент тела матки, фактор риска, магнитно-резонансная томография, сторожевой лифмоузел, индоцианин зеленый.
Для цитирования: Ткаченко Б.Э., Мкртчян Л.С., Левицкая Н.В., Агабабян Т.А., Шеберова Е.В., Ушакова Д.А., Петров В.А., Иванов С.А., Каприн А.Д. Персонализированный подход к хирургическому лечению начального рака тела матки при опухолевом поражении нижнего сегмента. Клиническое наблюдение. Клинический разбор в общей медицине. 2024; 5 (7): 69–73. DOI: 10.47407/kr2024.5.7.00449
A personalized approach to the surgical treatment of early-stage uterine body cancer with tumor involvement in the lower uterine segment. Clinical observation
Borislav E. Tkachenko1, Liana S. Mkrtchyan1, Natalya V. Levickaya1, Tatev A. Agababyan1,
Elizaveta V. Sheberova1, Darya A. Ushakova1, Vladimir A. Petrov1, Sergey A. Ivanov1,2,
Andrey D. Kaprin2,3,4
1Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
3Hertsen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, Moscow, Russia;
4National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation, Moscow, Russia
bar31.05.96@gmail.com
Abstract
In the Russian Federation, the incidence of uterine body cancer remains the highest among malignant neoplasms of the female genital organs. Surgical treatment is the primary method for treating early stages of the disease; however, the issue of predicting metastatic lymph node involvement at the preoperative stage for performing lymphadenectomy remains debatable. The potential prognostic significance of tumor involvement in the lower uterine segment regarding lymph node metastases may justify the need to assess tumor localization before starting treatment. Magnetic resonance imaging (MRI) of the pelvic organs can help determine the involvement of the lower uterine segment in the tumor process, thereby creating a basis for expanding the scope of surgical intervention.
Keywords: uterine body cancer, endometrioid adenocarcinoma, lower uterine segment, risk factor, magnetic resonance imaging, sentinel lymph node, indocyanine green.
For citation: Tkachenko B.E., Mkrtchyan L.S., Levickaya N.V., Agababyan T.A., Sheberova E.V., Ushakova D.A., Petrov V.A., Ivanov S.A., Kaprin A.D. A personalized approach to the surgical treatment of early-stage uterine body cancer with tumor involvement in the lower uterine segment. Clinical observation. Clinical review for general practice. 2024; 5 (7): 69–73. (In Russ.). DOI: 10.47407/kr2024.5.7.00449
Введение
Рак тела матки (РТМ) в Российской Федерации занимает первое место среди злокачественных новообразований женских половых органов с увеличением показателей заболеваемости на 21,9% за последнее десятилетие [1]. В подавляющем большинстве случаев (70,8%) диагностируются начальные формы заболевания (I стадия), однако, несмотря на внедрение современных лечебно-диагностических технологий, отмечается неуклонный рост показателей смертности, что может быть связано в том числе с реализацией нерадикальных программ вследствие игнорирования потенциальных факторов неблагоприятного прогноза [2].
Стратификация больных по группам риска в соответствии с традиционными факторами (степень дифференцировки опухоли, глубина инвазии в миометрий, лимфоваскулярная инвазия) на дооперационном этапе является основой для определения объема хирургического лечения, на послеоперационном – необходимости адъювантной терапии. Высокий риск лимфогенных метастазов, идентифицированный с учетом клинико-морфологических предикторов, служит показанием для тазовой и поясничной лимфаденэктомии; при промежуточном риске лимфодиссекция может быть выполнена лишь для уточнения стадии заболевания, а при низком риске – не является стандартной процедурой [3].
Локализация опухоли – с/без поражения нижнего сегмента (НС) не входит в систему стадирования FIGO [4] и не рассматривается в качестве критерия для определения групп риска [5]. В то же время целый ряд исследований демонстрирует, что опухолевое поражение НС, особенно при эндометриоидной аденокарциноме тела матки, ассоциируется с более низкой степенью дифференцировки опухоли [6] и ее глубокой инвазией в миометрий [7], с наличием лимфоваскулярной инвазии [8] и метастазов в регионарных лимфоузлах [9, 10]. Расположение опухоли в области НС за счет анатомических особенностей последнего (тонкий миометрий, выраженный лимфо-венозный отток и др.) [11] повышает риск метастазирования в лимфоузлы, влияя негативно на общую и безрецидивную выживаемости [12], что может использоваться в качестве дополнительной информации для принятия решения относительно объема хирургического вмешательства – с/без лимфаденэктомии.
Однако у более чем 80% пациентов, у которых лимфаденэктомия выполнена с профилактической целью, при морфологическом исследовании метастатическое поражение лимфатических узлов не подтверждается [13]. Кроме того, в 30–50% случаев после хирургического вмешательства возникают осложнения (лимфоррея, лимфокисты и/или лимфедема нижних конечностей), которые снижают качество жизни больных и могут увеличивать сроки начала адъювантной лучевой терапии (ЛТ) при ее необходимости [14].
Концепция определения первого лимфатического узла на пути лимфооттока из пораженного опухолью органа, известного как сторожевой лимфоузел, может служить альтернативой стадирующей и/или профилактической лимфаденэктомии у больных эндометриоидным РТМ I стадии, особенно при низком и промежуточном рисках лимфогенного метастазирования [15]. В настоящее время биопсия сторожевого лимфоузла с использованием препарата ICG (индоцианин зеленый) относится к основным методам диагностики поражения регионарных лимфатических узлов [16]. Применение данной технологии у больных с потенциальным предиктором неблагоприятного клинического исхода – опухолевым поражением НС при низком и промежуточном рисках позволит диагностировать метастатическое поражение регионарных лимфоузлов, что имеет ключевое значение для выполнения адекватного объема хирургического вмешательства и планирования послеоперационного лечения.
Магнитно-резонансная томография (МРТ) органов малого таза является неотъемлемой частью предоперационного обследования пациенток с РТМ. МРТ позволяет оценить ключевые прогностические факторы – размер опухоли и глубину ее инвазии в миометрий, переход на цервикальный канал и прорастание стромы шейки матки, опухолевое поражение лимфатических узлов, и оптимально стратифицировать риск перед выбором лечения [17]. Кроме того, возможности мультипланарной визуализации при МРТ позволяют точно оценить локально-региональное распространение опухоли тела матки, являясь по сути основным инструментом для определения зоны возникновения опухолевого процесса в матке [18]. Ключевой последовательностью для оценки точной локализации опухоли в полости матки, заинтересованности миометрия и шейки матки является Т2ВИ высокого разрешения в трех плоскостях, ориентируемые по отношению к полости матки, а для точного измерения расстояния от края опухоли до внутреннего зева – получение изображения полости матки и цервикального канала на одном срезе в сагиттальной плоскости [19]. При определении статуса лимфатических узлов основными параметрами являются размер по короткой оси, конфигурация, контуры, текстура и т.д. Однако эти критерии имеют относительно высокую специфичность (Sp 69–96%) при крайне низкой чувствительности (Se 24–73%), снижая AUC до 0,706, по сравнению с позитронно-эмиссионной компьютерной томографией [20–22]. В этих условиях высокое контрастное разрешение мягких тканей при МРТ, позволяющее проводить детальное анатомическое очертание опухоли с определением ее расположения наряду с пониманием анатомических особенностей матки и путей лимфооттока, может иметь решающее значение для определения тактики лечения пациенток с РТМ с поражением НС.
Клинический пример
Случай 1. Пациентка Я., 56 лет. Обратилась в МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России (г. Обнинск) с жалобами на кровянистые выделения из половых путей на фоне 6-летней постменопаузы.

 Выполнено комплексное обследование, в том числе включающее раздельное диагностическое выскабливание полости матки и цервикального канала, МРТ органов малого таза. По данным морфологического исследования верифицирована высокодифференцированная (Grade 1) эндометриоидная аденокарцинома тела матки. По данным МРТ в теле матки по передней стенке до области внутреннего зева и в области трубных углов визуализируется гиповаскулярное образование со средним МР-сигналом, истинным ограничением диффузии. Отмечается распространение процесса до 1/2 толщины миометрия. Увеличенных лимфоузлов в полости таза нет (рис. 1).
Выполнено комплексное обследование, в том числе включающее раздельное диагностическое выскабливание полости матки и цервикального канала, МРТ органов малого таза. По данным морфологического исследования верифицирована высокодифференцированная (Grade 1) эндометриоидная аденокарцинома тела матки. По данным МРТ в теле матки по передней стенке до области внутреннего зева и в области трубных углов визуализируется гиповаскулярное образование со средним МР-сигналом, истинным ограничением диффузии. Отмечается распространение процесса до 1/2 толщины миометрия. Увеличенных лимфоузлов в полости таза нет (рис. 1).По данным обследования пациентке сформулирован предварительный диагноз – Рак тела матки IB стадия (cT1bN0M0), и, согласно клиническим рекомендациям, было запланировано хирургическое лечение, при определении объема которого руководствовались действующими стандартами [3]. Несмотря на промежуточный риск лимфогенных метастазов, при котором лимфа-
денэктомия является лишь возможной опцией для стадирования, пациентке на онкологическом консилиуме был сформирован индивидуальный план лечения с учетом опухолевого поражения НС: лапароскопическая экстирпация матки с придатками с определением сторожевых лимфоузлов при помощи ICG, что и было реализовано. Интраоперационно сторожевые лимфоузлы были выявлены с обеих сторон в области обтураторных ямок и удалены. При плановом гистологическом исследовании операционного материала в матке диагностирована высокодифференцированная (Grade 1) эндометриоидная аденокарцинома с глубиной инвазии в миометрий 10 мм (более 1/2 толщины миометрия) с распространением на НС матки, отмечается лимфоваскулярная инвазия опухоли, метастатическое поражение всех удаленных лимфоузлов. С учетом данных морфологического исследования операционного материала заключительный диагноз – Рак тела матки IIIС стадия (рT1bN1M0). Пациентка отнесена к высокому риску прогрессирования заболевания и, принимая во внимание объем выполненного хирургического вмешательства, в послеоперационном периоде выполнялась «сэндвич-терапия»: 3 курса полихимиотерапии (ПХТ) по схеме карбоплатин AUC 5-6, паклитаксел 175 мг/м2 в 1 день, с интервалом в 21 день (TC), курс сочетанной лучевой терапии (СЛТ) – дистанционная лучевая терапия (ДЛТ) до суммарной очаговой дозы (СОД) 46 Гр, брахитерапия до СОД 20 Гр, 3 курса ПХТ по аналогичной схеме. Продолжительность наблюдения составила 14 мес, на данном сроке отмечается ремиссия.
Случай 2. Пациентка М., 44 лет. В МРНЦ им.
А.Ф. Цыба выполнено дообследование с морфологически верифицированной по месту жительства высокодифференцированной (Grade 1) эндометриоидной аденокарциномой тела матки. На МРТ малого таза с внутривенным контрастированием полость матки расширена до 3 см, выполнена гиповаскулярным образованием с истинным ограничением диффузии, распространяющимся до 1/2 толщины миометрия в области нижнего отдела тела матки (рис. 2).
Учитывая данные клинико-морфологических и радиологических исследований, пациентка была отнесена к низкому риску лимфогенного метастазирования с предварительным диагнозом – Рак тела матки IА стадия (cT1аNоM0), при котором, согласно клиническим рекомендациям, тазовая и поясничная лимфаденэктомия не показана [3]. Принимая во внимание опухолевое поражение НС, диагностированное по данным МРТ органов малого таза, пациентке был реализован индивидуальный план в виде лапароскопической экстирпации матки с придатками с определением сторожевых лимфоузлов при помощи ICG. Интраоперационно были выявлены сторожевые лимфоузлы на уровне наружной подвздошной вены слева (рис. 3), в связи с чем выполнено их удаление и
ипсилатеральная лимфодиссекция.
При плановом гистологическом исследовании операционного материала в матке диагностирована умереннодифференцированная (Grade 2) эндометриоидная аденокарцинома, глубина инвазии в миометрий 16 мм (более 1/2 толщины миометрия) и распространением на НС (глубина инвазии 15 мм) и внутренний зев (глубина инвазии в строму 3 мм); в сосудах миометрия выявлены многочисленные опухолевые эмболы, в двух из пяти сторожевых лимфатических узлах – макрометастазы умереннодифференцированной эндометриоидной аденокарциномы; остальные лимфатические узлы без признаков опухолевого роста. С учетом данных морфологического исследования операционного материала заключительный диагноз – Рак тела матки IIIС стадии (рT1bN1M0). С учетом группы риска (высокий) и объема хирургического вмешательства пациентке было проведено адъювантное лечение: 3 курса ПХТ (ТС), курс СЛТ – ДЛТ до СОД 46 Гр, брахитерапия до СОД
20 Гр, 3 курса ПХТ (ТС). Продолжительность наблюдения составила 8 мес, по результатам лабораторно-инструментальных методов обследования данных, подтверждающих прогрессирование, не выявлено.
Заключение
Руководствуясь данными современных публикаций о неблагоприятном прогностическом значении опухолевого поражения НС матки – наличии значимой корреляционной взаимосвязи с метастазами в лимфатических узлах и низкими показателями выживаемости, сформирована тактика лечения больных эндометриодным РТМ I стадии. Проведенная на дооперационном этапе МРТ органов малого таза позволила выявить локализацию опухоли в области НС, что и послужило основанием для индикации сторожевых лимфоузлов и последующего расширения объема хирургического вмешательства в виде лимфаденэктомии. Персонализированный подход к лечению начального эндометриоидного РТМ позволил оценить реальный риск прогрессирования (высокий) у больных низкого и промежуточного рисков с опухолевым поражением НС матки и реализовать адекватную адьювантную терапию, тем самым повышая шанс безрецидивного течения заболевания. Однако для окончательных выводов о предиктивной значимости локализации опухоли в НС матки необходимы дальнейшие исследования в однородных группах больных, в том числе с проведением многофакторного анализа.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Ткаченко Борислав Эдуардович – аспирант, врач-онколог отделения лучевых и комбинированных методов лечения гинекологических заболеваний с группой восстановительной и эстетической медицины, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ Радиологии». E-mail: bar31.05.96@gmail.com; ORCID: 0009-0008-4434-3079
Borislav E. Tkachenko – Graduate Student, Tsyb Medical Radiological Research Center – branch of the National Medical Research Radiological Center. E-mail: bar31.05.96@gmail.com; ORCID: 0009-0008-4434-3079
Мкртчян Лиана Сирекановна – д-р мед. наук, вед. науч. сотр. отд-ния лучевых и комбинированных методов лечения гинекологических заболеваний с группой восстановительной и эстетической медицины, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ Радиологии». E-mail: liana6969@mail.ru; ORCID: 0000-0002-5027-5331
Liana S. Mkrtchyan – Dr. Sci. (Med.), Tsyb Medical Radiological Research Center – branch of the National Medical Research Radiological Center. E-mail: liana6969@mail.ru; ORCID: 0000-0002-5027-5331
Левицкая Наталья Вячеславовна – канд. мед. наук, зав. отд-нием лучевых и комбинированных методов лечения гинекологических заболеваний с группой восстановительной и эстетической медицины, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ Радиологии». E-mail: natalevicka@gmail.com; ORCID: 0000-0002-3445-8488
Natalya V. Levickaya – Cand. Sci. (Med.), Tsyb Medical Radiological Research Center – branch of the National Medical Research Center of Radiology. E-mail: natalevicka@gmail.com; ORCID: 0000-0002-3445-8488
Агабабян Татев Артаковна – канд. мед. наук, зав. отд-нием лучевой диагностики, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-9971-3451
Tatev A. Agababyan – Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-9971-3451
Шеберова Елизавета Викторовна – врач-рентгенолог, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: lisa_iroshnikova@mail.ru; ORCID: 0000-0001-7827-2741
Elizaveta V. Sheberova – Radiologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: lisa_iroshnikova@mail.ru; ORCID: 0000-0001-7827-2741
Ушакова Дарья Александровна – клин. ординатор отделения радиотерапии МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: darya.ushakova.97@bk.ru; ORCID: 0009-0008-7910-6743
Darya A. Ushakova – Clinical Resident, Tsyb Medical Radiological Research Center – branch of the National Medical Research Radiological Center. E-mail: darya.ushakova.97@bk.ru; ORCID: 0009-0008-7910-6743
Петров Владимир Александрович – д-р мед. наук, проф., зав. научно-образовательным отделом, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ Радиологии».
E-mail: vapetrov1959@mail.ru; ORCID: 0000-0002-8580-933X
Vladimir A. Petrov – Dr. Sci. (Med.), Full Prof., Tsyb Medical Radiological Research Center – branch of the National Medical Research Radiological Centre. E-mail: vapetrov1959@mail.ru; ORCID: 0000-0002-8580-933X
Иванов Сергей Анатольевич – чл.-корр. РАН, д-р мед. наук, проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Director of
Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
ORCID: 0000-0001-7689-6032
Каприн Андрей Дмитриевич – академик РАН, д-р мед. наук, проф., зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, дир. МНИОИ им. П.А. Герцена (филиал ФГБУ «НМИЦ радиологии»), ген. дир. ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University), Director Hertsen Moscow Oncology Research Institute, General Director National Medical Research Radiological Centre.
ORCID: 0000-0001-8784-8415
Поступила в редакцию: 04.07.2024
Поступила после рецензирования: 09.07.2024
Принята к публикации: 11.07.2024
Received: 04.07.2024
Revised: 09.07.2024
Accepted: 11.07.2024
20 августа 2024
Количество просмотров: 327