Клинический разбор в общей медицине №7 2024
Аннотация
Инсулинома – это редкая нейроэндокринная опухоль поджелудочной железы, которая вырабатывает избыточное количество инсулина. Основными клиническими проявлениями инсулиномы являются эпизоды гипогликемии. Низкая распространенность заболевания, сложность клинической и лабораторной диагностики, а также трудность топической диагностики, малая осведомленность врачей смежных специальностей обусловливают зачастую несвоевременную диагностику заболевания, что ухудшает качество жизни пациентов и прогноз. В данной статье представлен клинический случай диагностики и лечения инсулиномы в неспециализированном стационаре. В статье описаны методы лабораторной и топической диагностики, а также тактика лечения пациентов с данным заболеванием.
Ключевые слова: инсулинома, гипогликемия, гипогликемический синдром, гиперинсулинизм, нейроэндокринные опухоли поджелудочной железы.
Для цитирования: Н.А. Никитина, А.В. Сницарь, М.В. Куандыкова, К.А. Покровский, С.А. Ерин, В.А. Шибитов, Н.В. Бревнова,
Н.А. Петунина. Клинический случай диагностики и лечения инсулиномы. Клинический разбор в общей медицине. 2024; 5 (7): 97–102. DOI: 10.47407/kr2024.5.7.00p423
Clinical case of diagnosis and treatment of insulinoma
Natalia A. Nikitina1, Artyom V. Snitsar1, Marina V. Kuandykova1, Konstantin A. Pokrovsky2,
Sergey A. Yerin1, Vyacheslav A. Shibitov1, Natalia V. Brevnova1, Nina A. Petunina3
1 City Clinical Hospital named after M.E. Zhadkevic, Moscow Health Department, Moscow, Russia;
2 Moscow Heath Department, Moscow, Russia;
3 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
nktnn0911@gmail.com
Abstract
Insulinoma is a rare neuroendocrine pancreatic tumor that typically produces excessive amout of hormone insulin. The main clinical manifestations of insulinoma are episodes of hypoglycemia. The low prevalence of the disease, the complexity of clinical and laboratory diagnosis, as well as the difficulty of topical diagnosis, low awareness physicians of related specialties, often cause untimely diagnosis of the disease, which worsens patients life-quality and prognosis. This article presents a clinical case of diagnosis and treatment of insulinoma in a non-specialized hospital. The article describes the methods of laboratory and topical diagnostics, as well as treatment tactics of patients with this disease.
Keywords: insulinoma, hypoglycemia, hypoglycemis syndrome, hyperinsulinism, neuroendocrine pancreatic tumor.
For citation: Nikitina N.A., Snitsar’ A.V., Kuandykova M.V., Pokrovsky K.A., Yerin S.A., Shibitov B.A., Brevnova N.B., Petunina N.A. Clinical case of diagnosis and treatment of insulinoma. Clinical analysis in general medicine. 2024; 5 (7): 97–102 (In Russ.). DOI: 10.47407/kr2024. 5.7.00p423
Инсулинома представляет собой редкую нейроэндокринную опухоль поджелудочной железы, которая характеризуется избыточной секрецией инсулина, гиперинсулинемической гипогликемией, возникающей в первую очередь натощак и реже – постпрандиально [1]. Инсулинома встречается во всех этнических группах, в любом возрасте (средний возраст на момент постановки диагноза составляет 47 лет) и несколько чаще у женщин. Имеют множественные опухоли 8% пациентов [1, 2]. Эпидемиологические данные свидетельствуют, что за последние годы распространенность инсулиномы увеличивается и составляет 4 случая на 1 млн человек в год [2]. До 95% инсулином являются доброкачественными, имеют размеры до 2 см, однако около 5,8% пациентов имеют «злокачественную инсулиному» – с низкой степенью дифференцировки и/или экстрапанкреатическим распространением, метастазами в лимфатические узлы или отдаленными метастазами [2]. Низкодифференцированная инсулинома может быть множественной и редко является проявлением наследственных синдромов [1]. Около 8% инсулином встречаются в рамках синдрома МЭН-1 (синдром Вермера), основными компонентами которого, помимо панкреато-дуоденальных нейроэндокринных опухолей (инсулинома и др. функционирующие или нефункционирующие опухоли), являются первичный гиперпаратиреоз и опухоли гипофиза. Первичный гиперпаратиреоз выявляется почти в 100% случаев, тогда как встречаемость нейроэндокринных опухолей и опухолей аденогипофиза составляет 30–90% и 30–40% соответственно [1].
Клиническая картина инсулиномы обусловлена избыточной секрецией инсулина и проинсулина клетками опухоли, что проявляется гипогликемическим синдромом. Проявления гипогликемического синдрома неспецифичны и включают в себя вегетативные и нейрогликопенические симптомы. Вегетативные симптомы связаны с активацией симпатической (сердцебиение, тремор, возбуждение) и парасимпатической (потливость, чувство голода, парестезии) нервных систем. Нейрогликопенические симптомы обусловлены поражением головного мозга и могут варьировать от умеренных обратимых нарушений (слабость, нарушение концентрации, внимания, зрительные и чувствительные нарушения) до тяжелых необратимых изменений (когнитивные нарушения, поведенческие нарушения, фокальные и генерализованные судороги) при хронической гипогликемии, вплоть до летального исхода [3].
Порог гликемии, при котором возникают симптомы гипогликемии, у здоровых людей составляет менее
3,0 ммоль/л. Диагноз гипогликемии обычно подтверждается триадой Уиппла: симптомы, соответствующие гипогликемии, низкая концентрация глюкозы и купирование симптомов после повышения концентрации глюкозы [4].
Для уточнения причины гипогликемии, а также при отсутствии зафиксированной манифестной гипогликемии у пациентов с подозрением на гипогликемический синдром и в других сомнительных случаях методом выбора является проба с 72-часовым голоданием, в ходе которого пациенту разрешается только питье чистой воды [1]. Данная проба позволяет воссоздать условия для развития гипогликемии, а также провести дифференциальную диагностику различных причин гипогликемии. У подавляющего большинства пациентов с инсулиномой гипогликемия развивается в первые часы после голодания, у 65–85% – в течение первых 24 ч, а в течение 48 ч 90–94% пациентов достигают гипогликемии, однако у небольшой части пациентов гипогликемия развивается только на третьи сутки [1]. Большинством исследователей считается, что концентрация глюкозы в крови в ходе пробы менее 3 ммоль/л подтверждает наличие гипогликемии, уровень инсулина более или равен 3 Ед/мл и С-пептида более 0,6 нг/мл (0,2 нмоль/л) подтверждает гиперинсулинемический вариант гипогликемии [3]. Также для дифференциальной диагностики необходим тщательный сбор анамнеза (в том числе лекарственного), оценка уровней проинсулина, бета-гидроксибутирата в крови, концентрации гипогликемических препаратов (в первую очередь препаратов сульфонилмочевины), антител к инсулину, общего белка, креатинина, общего кортизола, адренокортикотропного гормона, инсулиноподобного фактора роста 1 (ИФР-1) в крови, определение активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) в крови для исключения других причин гипогликемии [3]. Сочетание низкого уровня глюкозы на фоне повышенных уровней инсулина и С-пептида в крови, отсутствие в крови следов препаратов сульфонилмочевины, циркулирующих антител к инсулину, признаков других заболеваний, вызывающих гипогликемию, позволяет заподозрить у пациента инсулиному. В редких случаях уровень инсулина остается пониженным при подтвержденной гипогликемии, однако уровни проинсулина и С-пептида сохраняются высокими [4, 6].
Для топической диагностики инсулиномы в качестве методов 1-й линии используются такие визуализирующие методы, как компьютерная томография (КТ) с контрастным усилением, магнитно-резонансная томография (МРТ), трансабдомильное ультразвуковое исследование (УЗИ). УЗИ органов брюшной полости является простым и безопасным методом диагностики, однако его чувствительность при обнаружении инсулиномы низкая и составляет от 9% до 64%, возрастает при размерах опухоли более 3 см в диаметре и уменьшается при размерах опухоли менее 1 см [5, 7].
Большинство инсулином имеют такую же плотность, как и окружающие ткани поджелудочной железы, и на КТ без контрастного усиления не могут быть визуализированы без введения внутривенного контраста [5]. Так как инсулиномы обычно являются гиперваскулярными образованиями, это приводит к более высокому накоплению контраста по сравнению с нормальной паренхимой поджелудочной железы в артериальную фазу, что является характерным признаков и позволяет провести дифференциальную диагностику образования. Чувствительность КТ с применением контраста составляет по разным данным от 33% до 92%, а специфичность достигает 96% [5, 8, 9].
МРТ сопоставима с КТ по чувствительности, а согласно некоторым исследованиям превосходит КТ и составляет до 94% [9]. МРТ позволяет лучше визуализировать экстрапанкреатическое распространение опухоли и возможное метастазирование (в первую очередь в печень и кости) [7, 9]. С учетом отсутствия лучевой нагрузки, более высокой чувствительности, чем КТ, МРТ является более предпочтительным методом обследования пациентов [1]. Наличие идентичной локализации опухоли должно быть подтверждено минимум двумя инструментальными методами [1].
У пациентов с документированной гипогликемией при отсутствии визуализации или идентичной локализации опухоли применяются методы диагностики 2-й линии: эндосонография панкреатобилиарной зоны или эндоскопическое УЗИ с возможностью тонкоигольной биопсии, сцинтиграфия с однофотонной эмиссионной компьютерной томографией (ОФЭКТ)/КТ или позитронно-эмиссионная томография (ПЭТ)-КТ с радиофармпрепаратами для диагностики новообразований («соматостатин и аналоги») в режиме «все тело», УЗИ поджелудочной железы с контрастированием [1]. Эндоскопическое УЗИ является инвазивной процедурой с применением анестезии, при использовании в специализированный центрах чувствительность достигает 90% [4, 7]. Применение сцинтиграфии рецепторов соматостатина, принцип которой основан на связывании молекулы октреотида, меченной радиоизотопом 111In, с рецепторами соматостатина опухоли, ограничено в РФ в связи с труднодоступностью лиофилизата для приготовления препарата. К тому же метод обладает сравнительно низкой чувствительностью по сравнению с другими методами – до 50% [1, 4]. После сцинтиграфии в режиме «все тело» при выявлении участков повышенного накопления радиофармпрепарата применяется более детальное изучение при помощи ОФЭКТ с рентгеновской КТ (ОФЭКТ/КТ). Успешно применяется в качестве радиофармпрепарата 99mTc-гидразинникотинамид-октреотид [1]. В отдельных случаях возможно применение ПЭТ-КТ с 68Ga-октреотидом (DOTA-октреотат), метод обладает более высокой чувствительностью по сравнению с сцинтиграфией с 111In-октреотидом, однако также нешироко распространен в РФ [1, 8].
Еще одним инвазивным методом, позволяющим определить локализацию опухоли с высокой точностью, является суперселективная ангиография с артериально-стимулированным забором крови. Забор крови осуществляется после селективной катетеризации правой печеночной вены и стимуляции секреции инсулина препаратом кальция. Прирост инсулина в 2 и более раза после стимуляции позволяет определить локализацию инсулиномы, определить инсулин-продуцирующую опухоль при множественном поражении (часто при синдроме МЭН-1), а также выявить зону гиперпродукции инсулина при неопухолевой форме гиперинсулинизма (незидиобластоз) [4, 8]. Метод обладает крайне высокой чувствительностью и позволяет обнаружить источник секреции инсулина практически в 100% случаев [5, 7], однако требует высокой квалификации специалистов и наличия высокотехнологичного оборудования.
Всем пациентам с инсулиномой рекомендовано исследование паратиреоидного гормона, ИФР-1 и пролактина в крови для выявления первичного гиперпаратиреоза, соматотропиномы и пролактиномы, а также МРТ головного мозга для выявления новообразований гипофиза в рамках МЭН [1]. Также при наличии критериев, подозрительных в отношении наследственной причины заболевания (семейный анамнез МЭН-1, наличие других МЭН-ассоциированных опухолей, ранняя манифестация заболевания, множественная инсулинома), рекомендовано генетическое тестирование мутаций в гене MEN1 [1].
Лечение инсулиномы в первую очередь хирургическое, направленное с одной стороны на максимальную резекцию опухоли, а с другой – на максимальное сохранение окружающих тканей поджелудочной железы. Выбор тактики оперативного вмешательства зависит от размера опухоли, расположения, степени биологической активности. Используются лапароскопические и открытые методики, а также интраоперационное УЗИ для уточнения локализации опухоли. В случае небольших доброкачественных инсулином, расположенных не мене 2–3 мм от главного панкреатического протока, предпочтительным методом лечения является энуклеация опухоли [10, 11]. Резекционные методики предпочтительны в случае, когда опухоль прилежит к протоку поджелудочной железы или крупным сосудам, или подозрительна в отношении злокачественности (плотная консистенция, инфильтрация в прилежащие ткани, метастазы в регионарные лимфоузлы). Среди этих методик выделяют дистальную панкреатэктомию с сохранением или резекцией селезенки, панкреатодуоденэктомию (операция Уиппла) [10, 11]. Исход оперативного лечения благоприятный, послеоперационная смертность варьирует от 0 до 6% в зависимости от объема оперативного вмешательства и опыта хирургической бригады [11]. Частота рецидива после оперативного лечения у пациентов без синдрома МЭН-1 составляет 7% и 20% при синдроме МЭН-1 [10]. Обязательно выполнение патологоанатомического исследования операционного материала с применением иммуногистохимических методов с целью подтверждения диагноза и определения степени дифференцировки опухоли [1].
В случае невозможности проведения оперативного вмешательства или радикального удаления опухоли (при метастатической инсулиноме), а также при подготовке к операции возможно медикаментозное лечение препаратами аналогов соматостатина (октреотид, ланреотид), применение пероральных глюкокортикоидов в краткосрочный период с целью контроля гипогликемии, назначение диазоксида для поддержания нормогликемии [1, 4].
В данной статье представлен клинический случай инсулиномы поджелудочной железы, который иллюстрирует сложности диагностики данного заболевания.
Клиническое наблюдение. Пациент А., 49 лет, поступил в приемное отделение ГБУЗ «ГКБ им. М.Е. Жадкевича» после серии судорожных приступов с направительным диагнозом «Эпилепсия неуточненная. Состояние после судорожных приступов».
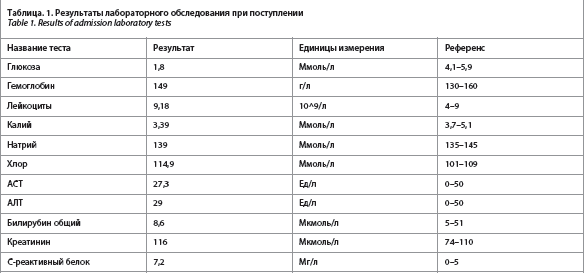
 При поступлении состояние пациент тяжелое, пациент заторможен, в физикальном осмотре, неврологическом осмотре отклонений не выявлено, артериальное давление при поступлении – 140/90 мм рт. ст., частота сердечных сокращений – 78 уд/мин, частота дыхательных движений – 18/мин. Пациент госпитализирован в отделение нейрореанимации. Результаты лабораторного обследования при поступлении представлены в табл. 1.
При поступлении состояние пациент тяжелое, пациент заторможен, в физикальном осмотре, неврологическом осмотре отклонений не выявлено, артериальное давление при поступлении – 140/90 мм рт. ст., частота сердечных сокращений – 78 уд/мин, частота дыхательных движений – 18/мин. Пациент госпитализирован в отделение нейрореанимации. Результаты лабораторного обследования при поступлении представлены в табл. 1.
Из анамнеза известно, что в течение 6 мес родственники пациента отмечают изменение поведения пациента, раздражительность, эпизоды дезориентации, нарушения сознания, выраженную общую слабость, невозможность встать, продолжающиеся около 1–2 ч и проходящие самостоятельно. Уровень глюкозы на фоне приступов не измерялись. Пациент приступы потери сознания амнезирует, изменения в поведении отрицает. Прием гипогликемических, психотропных препаратов, наркотических препаратов и алкоголя отрицает. В течение 2 нед до госпитализации отмечает ухудшение общего самочувствия, увеличение частоты и продолжительности приступов, появление генерализованных судорог. Амбулаторно было выполнено КТ головного мозга, брахиоцефальных артерий, МРТ шейного отдела позвоночника и головного мозга – патологии не обнаружено.
При обследовании в стационаре при проведении рентгенографии органов грудной клетки, электрокардиографии, эхокардиографии клинически значимой патологии не выявлено.
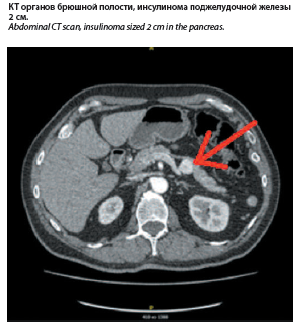
С учетом клинической картины и лабораторно подтвержденной гипогликемии заподозрена инсулинома поджелудочной железы. Выполнено УЗИ органов брюшной полости – диффузные изменения печени, поджелудочной железы. Выполнена мультиспиральная компьютерная томография (МСКТ) органов брюшной полости – поджелудочная железа не увеличена, контур четкий, дольчатость сохранена. В артериальную фазу по заднему контуру тела поджелудочной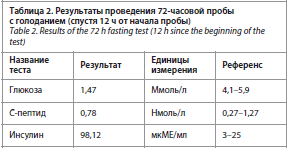 железы образование округлой формы, с четкими ровными контурами, диаметром около 20 мм, активно накапливающее контрастное вещество, с последующим вымыванием в венозную и отсроченную фазу.
железы образование округлой формы, с четкими ровными контурами, диаметром около 20 мм, активно накапливающее контрастное вещество, с последующим вымыванием в венозную и отсроченную фазу.
Также на МСКТ выявлены конкременты обеих почек без признаков нарушения выделительной функции почек, периневральные кисты S 2,3 позвонка, грыжи Шморля Th 11,12, добавочная долька селезенки.
Пациенту начата терапия внутривенным раствором декстрозы с положительным эффектом, восстановлением уровня сознания.
Для уточнения диагноза переведен в отделение эндокринологии. С учетом неопределенных клинико-лабораторных данных была проведена проба с голоданием. Симптомы гипогликемии зафиксированы у пациента в течение первых шести часов от начала пробы: снижение глюкозы до уровня 1,78 ммоль/л, уровень С-пептида оставался пониженным – 0,23 нмоль/л (0,27–
1,27 нмоль/л). Был проведен диагностический поиск других причин гипогликемии: осмотр пациента на предмет следов от инъекций инсулина, исключение самостоятельного приема лекарственных препаратов, была исключена надпочечниковая недостаточность (кортизол венозной крови утром 433 нмоль/л), выполнена эзофагогастродуоденоскопия: рефлюкс-эзофагит, признаки аксиальной грыжи пищеводного отверстия диафрагмы, эритематозная гастропатия, эрозивный бульбит, деформация луковицы двенадцатиперстной кишки, рекомендовано определение антител к эндогенному инсулину, исключены почечная, печеночная недостаточность, сердечная недостаточность.
В связи с сохранением гипогликемического синдрома, дискордантными результатами пробы с голоданием, в сочетании с данными МСКТ, отсутствием других причин гипогликемии, решено провести пробу с голоданием повторно с определением свободного инсулина. На фоне пробы максимальное снижение глюкозы достигло
1,47 ммоль/л, на фоне чего уровень С-пептида –
0,78 нмоль/л (0,27–1,27), инсулин – 98,12 мкМЕ/мл
(3–25). Таким образом, уровень С-пептида и инсулина при повторном проведении пробы соответствовал критериям гиперинсулинемической гипогликемии, с учетом данных МСКТ подтвержден диагноз инсулиномы, принято решение о дальнейшем обследовании с целью предоперационной локализации опухоли.
Результаты проведения 72-часовой пробы с голоданием (спустя 12 ч от начала пробы) представлены в табл. 2.
С учетом наличия у пациента, по данным МСКТ, конкрементов обеих почек, для исключения гиперпаратиреоза была проведена оценка состояния фосфорно-кальциевого обмена: кальций ионизированный –
1,31 ммоль/л, кальций общий – 2,34 ммоль/л (2,2–2,65), паратгормон – 4,21 пмоль/л (1,3–6,8), 25(ОН)D – 34 нг/мл. По результатам УЗИ щитовидной железы и паращитовидных желез: в проекции паращитовидных желез дополнительных образований не выявлено. Исключена гиперпролактинемия – пролактин 5,39 мкг/л (9,7–208). Уровень ИФР-1 и тестостерона не оценивался. Пациенту амбулаторно было выполнено МРТ головного мозга – признаков аденомы гипофиза не выявлено. Таким образом, были исключены компоненты синдрома МЭН-1.
Пациенту было выполнено эндоскопическое УЗИ поджелудочной железы: в теле определяется гиповаскулярное образование овальной формы, интимно прилежащее к селезеночным сосудам, с четкими ровными контурами, размером 24×20 мм, с неоднородной структурой, включающей гипер-, гипо- и анэхогенные участки. Выполнена тонкоигольная биопсия образования. Морфологическое заключение: в материале слизь с малыми элементами ткани, построенной из относительно мономорфных округлых клеток с крупными гиперхромными базофильными, местами полиморфными ядрами и выраженной эозинофильной цитоплазмой, отмечается тенденция к формированию трабекулы в единичном участке, отмечается лейкоцитарная, плазмоцитарная и нейтрофильная инфильтрация. Заключение: при наличии клинической картины морфологическая картина может соответствовать инсулиноме.
Было принято решение об оперативном лечении.
В рамках предоперационной подготовки выполнена ультразвуковая допплерография вен нижних конечностей, выявлен тромбоз глубоких вен нижних конечностей неизвестной давности (неокклюзивный тромбоз задней большеберцовой вены с обеих сторон), признаки варикозного расширения вен нижних конечностей, отек подкожно-жировой клетчатки голеней с признаками лимфостаза. На контрольном УЗИ органов брюшной полости – признаки неокклюзивного тромбоза воротной вены. В предоперационном периоде проводилась терапия эноксапарином натрия.
Пациенту выполнена операция – лапароскопическая энуклеация инсулиномы тела поджелудочной железы. Интраоперационно выполнена мобилизация задней поверхности тела поджелудочной железы до границы селезеночной вены, в проекции тела поджелудочной железы определяется образование плотной консистенции, размерами 2,5×2,5 см, выполнена энуклеация опухоли. По результатам послеоперационного гистологического исследования – узел диаметром 2,1 см в соединительнотканной капсуле, опухоль построена из светлых округлых клеток с зернистой цитоплазмой, округлыми ядрами с ядрышками, местами также зернистого вида с картиной «соль и перец», местами отмечаются митозы (2 в 10 полях зрения). Опухолевые клетки разделены стромой с признаками гиалиноза, ткань узла имеет очаговое солидное строение и очагово трабекулярное строение. Признаков инвазивного роста в сосудистую стенку нет. Таким образом, гистологическая картина может соответствовать функционально активной инсулиноме поджелудочной железы (R0). Выполнено иммуногистохимическое исследование операционного материала (ИГХ): в опухолевых клетках выявляется положительная реакция с синаптофизином, хромогранином А, CD56, инсулином, индекс
Ki-67 составляет 2%. ИГХ-картина соответствует высокодифференцированной нейроэндокринной опухоли поджелудочной железы – инсулиноме.
В послеоперационном периоде уровень глюкозы крови находился в диапазоне от 5,96 до 9,79 ммоль/л.
С целью профилактики послеоперационного панкреатита проводилась терапия октреотидом 100 мкг подкожно 3 раза в сутки, профилактика септических осложнений (антибиотикотерапия), продолжена антикоагулянтная терапия. Пациент выписан в удовлетворительном состоянии на 8-е сутки после оперативного вмешательства.
Данный клинический случай демонстрирует сложность первичной диагностики инсулиномы, несовершенство лабораторных методов диагностики и обусловливает необходимость ведения пациентов с подозрением на гипогликемический синдром в условиях специализированных стационаров, повышение информированности медицинских специалистов различных специальностей о данной редкой патологии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Никитина Наталья Андреевна – врач-эндокринолог, ГБУЗ «ГКБ им. М.Е. Жадкевича».
E-mail: nktnn0911@gmail.com; ORCID: 0009-0007-6866-8233
Natalia A. Nikitina – Endocrinologist, City Clinical Hospital named after M.E. Zhadkevic. E-mail: nktnn0911@gmail.com; ORCID: 0009-0007-6866-8233
Сницарь Артем Владимирович – глав. врач, ГБУЗ
«ГКБ им. М.Е. Жадкевича». ORCID: 0000-0001-6053-4651
Artyom V. Snitsar – Chief doctor, City Clinical Hospital named after M.E. Zhadkevic. ORCID: 0000-0001-6053-4651
Куандыкова Марина Викторовна – канд. мед. наук, зам. глав. врача по медицинской части, ГБУЗ «ГКБ им.
М.Е. Жадкевича». ORCID: 0000-0001-6634-2984
Marina V. Kuandykova – Cand. Sci. (Med.), Deputy Chief doctor, City Clinical Hospital named after M.E. Zhadkevic.
ORCID: 0000-0001-6634-2984
Покровский Константин Александрович – д-р мед. наук, врач-хирург, Департамент здравоохранения г. Москвы
Konstantin A. Pokrovsky – Dr. Sci. (Med.), Surgeon, Moscow Heath Department
Ерин Сергей Александрович – канд. мед. наук, заместитель глав. врача по хирургической помощи, ГБУЗ «ГКБ им. М.Е. Жадкевича». ORCID: 0000-0003-1083-8678
Sergey A. Yerin – Cand. Sci. (Med.), Deputy Chief doctor, City Clinical Hospital named after M.E. Zhadkevic.
ORCID: 0000-0003-1083-8678
Шибитов Вячеслав Александрович – д-р мед. наук,
врач-хирург, заведующий хирургическим отделением, ГБУЗ
«ГКБ им. М.Е. Жадкевича»
Vyacheslav A. Shibitov – Dr. Sci. (Med.), Surgeon, City Clinical Hospital named after M.E. Zhadkevic
Бревнова Наталья Владимировна – врач-эндокринолог, зав. эндокринологическим отделением, ГБУЗ «ГКБ им.
М.Е. Жадкевича»
Natalia V. Brevnova – Endocrinologist, City Clinical Hospital named after M.E. Zhadkevic
Петунина Нина Александровна – академик РАН, проф.,
д-р мед. наук, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Nina A. Petunina – Acad. RAS, Full Prof., Dr. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University)
Поступила в редакцию: 27.06.2024
Поступила после рецензирования: 12.07.2024
Принята к публикации: 18.07.2024
Received: 27.06.2024
Revised: 12.07.2024
Accepted: 18.07.2024
Клинический разбор в общей медицине №7 2024
Клинический случай диагностики и лечения инсулиномы
Аннотация
Инсулинома – это редкая нейроэндокринная опухоль поджелудочной железы, которая вырабатывает избыточное количество инсулина. Основными клиническими проявлениями инсулиномы являются эпизоды гипогликемии. Низкая распространенность заболевания, сложность клинической и лабораторной диагностики, а также трудность топической диагностики, малая осведомленность врачей смежных специальностей обусловливают зачастую несвоевременную диагностику заболевания, что ухудшает качество жизни пациентов и прогноз. В данной статье представлен клинический случай диагностики и лечения инсулиномы в неспециализированном стационаре. В статье описаны методы лабораторной и топической диагностики, а также тактика лечения пациентов с данным заболеванием.
Ключевые слова: инсулинома, гипогликемия, гипогликемический синдром, гиперинсулинизм, нейроэндокринные опухоли поджелудочной железы.
Для цитирования: Н.А. Никитина, А.В. Сницарь, М.В. Куандыкова, К.А. Покровский, С.А. Ерин, В.А. Шибитов, Н.В. Бревнова,
Н.А. Петунина. Клинический случай диагностики и лечения инсулиномы. Клинический разбор в общей медицине. 2024; 5 (7): 97–102. DOI: 10.47407/kr2024.5.7.00p423
Clinical case of diagnosis and treatment of insulinoma
Natalia A. Nikitina1, Artyom V. Snitsar1, Marina V. Kuandykova1, Konstantin A. Pokrovsky2,
Sergey A. Yerin1, Vyacheslav A. Shibitov1, Natalia V. Brevnova1, Nina A. Petunina3
1 City Clinical Hospital named after M.E. Zhadkevic, Moscow Health Department, Moscow, Russia;
2 Moscow Heath Department, Moscow, Russia;
3 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
nktnn0911@gmail.com
Abstract
Insulinoma is a rare neuroendocrine pancreatic tumor that typically produces excessive amout of hormone insulin. The main clinical manifestations of insulinoma are episodes of hypoglycemia. The low prevalence of the disease, the complexity of clinical and laboratory diagnosis, as well as the difficulty of topical diagnosis, low awareness physicians of related specialties, often cause untimely diagnosis of the disease, which worsens patients life-quality and prognosis. This article presents a clinical case of diagnosis and treatment of insulinoma in a non-specialized hospital. The article describes the methods of laboratory and topical diagnostics, as well as treatment tactics of patients with this disease.
Keywords: insulinoma, hypoglycemia, hypoglycemis syndrome, hyperinsulinism, neuroendocrine pancreatic tumor.
For citation: Nikitina N.A., Snitsar’ A.V., Kuandykova M.V., Pokrovsky K.A., Yerin S.A., Shibitov B.A., Brevnova N.B., Petunina N.A. Clinical case of diagnosis and treatment of insulinoma. Clinical analysis in general medicine. 2024; 5 (7): 97–102 (In Russ.). DOI: 10.47407/kr2024. 5.7.00p423
Инсулинома представляет собой редкую нейроэндокринную опухоль поджелудочной железы, которая характеризуется избыточной секрецией инсулина, гиперинсулинемической гипогликемией, возникающей в первую очередь натощак и реже – постпрандиально [1]. Инсулинома встречается во всех этнических группах, в любом возрасте (средний возраст на момент постановки диагноза составляет 47 лет) и несколько чаще у женщин. Имеют множественные опухоли 8% пациентов [1, 2]. Эпидемиологические данные свидетельствуют, что за последние годы распространенность инсулиномы увеличивается и составляет 4 случая на 1 млн человек в год [2]. До 95% инсулином являются доброкачественными, имеют размеры до 2 см, однако около 5,8% пациентов имеют «злокачественную инсулиному» – с низкой степенью дифференцировки и/или экстрапанкреатическим распространением, метастазами в лимфатические узлы или отдаленными метастазами [2]. Низкодифференцированная инсулинома может быть множественной и редко является проявлением наследственных синдромов [1]. Около 8% инсулином встречаются в рамках синдрома МЭН-1 (синдром Вермера), основными компонентами которого, помимо панкреато-дуоденальных нейроэндокринных опухолей (инсулинома и др. функционирующие или нефункционирующие опухоли), являются первичный гиперпаратиреоз и опухоли гипофиза. Первичный гиперпаратиреоз выявляется почти в 100% случаев, тогда как встречаемость нейроэндокринных опухолей и опухолей аденогипофиза составляет 30–90% и 30–40% соответственно [1].
Клиническая картина инсулиномы обусловлена избыточной секрецией инсулина и проинсулина клетками опухоли, что проявляется гипогликемическим синдромом. Проявления гипогликемического синдрома неспецифичны и включают в себя вегетативные и нейрогликопенические симптомы. Вегетативные симптомы связаны с активацией симпатической (сердцебиение, тремор, возбуждение) и парасимпатической (потливость, чувство голода, парестезии) нервных систем. Нейрогликопенические симптомы обусловлены поражением головного мозга и могут варьировать от умеренных обратимых нарушений (слабость, нарушение концентрации, внимания, зрительные и чувствительные нарушения) до тяжелых необратимых изменений (когнитивные нарушения, поведенческие нарушения, фокальные и генерализованные судороги) при хронической гипогликемии, вплоть до летального исхода [3].
Порог гликемии, при котором возникают симптомы гипогликемии, у здоровых людей составляет менее
3,0 ммоль/л. Диагноз гипогликемии обычно подтверждается триадой Уиппла: симптомы, соответствующие гипогликемии, низкая концентрация глюкозы и купирование симптомов после повышения концентрации глюкозы [4].
Для уточнения причины гипогликемии, а также при отсутствии зафиксированной манифестной гипогликемии у пациентов с подозрением на гипогликемический синдром и в других сомнительных случаях методом выбора является проба с 72-часовым голоданием, в ходе которого пациенту разрешается только питье чистой воды [1]. Данная проба позволяет воссоздать условия для развития гипогликемии, а также провести дифференциальную диагностику различных причин гипогликемии. У подавляющего большинства пациентов с инсулиномой гипогликемия развивается в первые часы после голодания, у 65–85% – в течение первых 24 ч, а в течение 48 ч 90–94% пациентов достигают гипогликемии, однако у небольшой части пациентов гипогликемия развивается только на третьи сутки [1]. Большинством исследователей считается, что концентрация глюкозы в крови в ходе пробы менее 3 ммоль/л подтверждает наличие гипогликемии, уровень инсулина более или равен 3 Ед/мл и С-пептида более 0,6 нг/мл (0,2 нмоль/л) подтверждает гиперинсулинемический вариант гипогликемии [3]. Также для дифференциальной диагностики необходим тщательный сбор анамнеза (в том числе лекарственного), оценка уровней проинсулина, бета-гидроксибутирата в крови, концентрации гипогликемических препаратов (в первую очередь препаратов сульфонилмочевины), антител к инсулину, общего белка, креатинина, общего кортизола, адренокортикотропного гормона, инсулиноподобного фактора роста 1 (ИФР-1) в крови, определение активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) в крови для исключения других причин гипогликемии [3]. Сочетание низкого уровня глюкозы на фоне повышенных уровней инсулина и С-пептида в крови, отсутствие в крови следов препаратов сульфонилмочевины, циркулирующих антител к инсулину, признаков других заболеваний, вызывающих гипогликемию, позволяет заподозрить у пациента инсулиному. В редких случаях уровень инсулина остается пониженным при подтвержденной гипогликемии, однако уровни проинсулина и С-пептида сохраняются высокими [4, 6].
Для топической диагностики инсулиномы в качестве методов 1-й линии используются такие визуализирующие методы, как компьютерная томография (КТ) с контрастным усилением, магнитно-резонансная томография (МРТ), трансабдомильное ультразвуковое исследование (УЗИ). УЗИ органов брюшной полости является простым и безопасным методом диагностики, однако его чувствительность при обнаружении инсулиномы низкая и составляет от 9% до 64%, возрастает при размерах опухоли более 3 см в диаметре и уменьшается при размерах опухоли менее 1 см [5, 7].
Большинство инсулином имеют такую же плотность, как и окружающие ткани поджелудочной железы, и на КТ без контрастного усиления не могут быть визуализированы без введения внутривенного контраста [5]. Так как инсулиномы обычно являются гиперваскулярными образованиями, это приводит к более высокому накоплению контраста по сравнению с нормальной паренхимой поджелудочной железы в артериальную фазу, что является характерным признаков и позволяет провести дифференциальную диагностику образования. Чувствительность КТ с применением контраста составляет по разным данным от 33% до 92%, а специфичность достигает 96% [5, 8, 9].
МРТ сопоставима с КТ по чувствительности, а согласно некоторым исследованиям превосходит КТ и составляет до 94% [9]. МРТ позволяет лучше визуализировать экстрапанкреатическое распространение опухоли и возможное метастазирование (в первую очередь в печень и кости) [7, 9]. С учетом отсутствия лучевой нагрузки, более высокой чувствительности, чем КТ, МРТ является более предпочтительным методом обследования пациентов [1]. Наличие идентичной локализации опухоли должно быть подтверждено минимум двумя инструментальными методами [1].
У пациентов с документированной гипогликемией при отсутствии визуализации или идентичной локализации опухоли применяются методы диагностики 2-й линии: эндосонография панкреатобилиарной зоны или эндоскопическое УЗИ с возможностью тонкоигольной биопсии, сцинтиграфия с однофотонной эмиссионной компьютерной томографией (ОФЭКТ)/КТ или позитронно-эмиссионная томография (ПЭТ)-КТ с радиофармпрепаратами для диагностики новообразований («соматостатин и аналоги») в режиме «все тело», УЗИ поджелудочной железы с контрастированием [1]. Эндоскопическое УЗИ является инвазивной процедурой с применением анестезии, при использовании в специализированный центрах чувствительность достигает 90% [4, 7]. Применение сцинтиграфии рецепторов соматостатина, принцип которой основан на связывании молекулы октреотида, меченной радиоизотопом 111In, с рецепторами соматостатина опухоли, ограничено в РФ в связи с труднодоступностью лиофилизата для приготовления препарата. К тому же метод обладает сравнительно низкой чувствительностью по сравнению с другими методами – до 50% [1, 4]. После сцинтиграфии в режиме «все тело» при выявлении участков повышенного накопления радиофармпрепарата применяется более детальное изучение при помощи ОФЭКТ с рентгеновской КТ (ОФЭКТ/КТ). Успешно применяется в качестве радиофармпрепарата 99mTc-гидразинникотинамид-октреотид [1]. В отдельных случаях возможно применение ПЭТ-КТ с 68Ga-октреотидом (DOTA-октреотат), метод обладает более высокой чувствительностью по сравнению с сцинтиграфией с 111In-октреотидом, однако также нешироко распространен в РФ [1, 8].
Еще одним инвазивным методом, позволяющим определить локализацию опухоли с высокой точностью, является суперселективная ангиография с артериально-стимулированным забором крови. Забор крови осуществляется после селективной катетеризации правой печеночной вены и стимуляции секреции инсулина препаратом кальция. Прирост инсулина в 2 и более раза после стимуляции позволяет определить локализацию инсулиномы, определить инсулин-продуцирующую опухоль при множественном поражении (часто при синдроме МЭН-1), а также выявить зону гиперпродукции инсулина при неопухолевой форме гиперинсулинизма (незидиобластоз) [4, 8]. Метод обладает крайне высокой чувствительностью и позволяет обнаружить источник секреции инсулина практически в 100% случаев [5, 7], однако требует высокой квалификации специалистов и наличия высокотехнологичного оборудования.
Всем пациентам с инсулиномой рекомендовано исследование паратиреоидного гормона, ИФР-1 и пролактина в крови для выявления первичного гиперпаратиреоза, соматотропиномы и пролактиномы, а также МРТ головного мозга для выявления новообразований гипофиза в рамках МЭН [1]. Также при наличии критериев, подозрительных в отношении наследственной причины заболевания (семейный анамнез МЭН-1, наличие других МЭН-ассоциированных опухолей, ранняя манифестация заболевания, множественная инсулинома), рекомендовано генетическое тестирование мутаций в гене MEN1 [1].
Лечение инсулиномы в первую очередь хирургическое, направленное с одной стороны на максимальную резекцию опухоли, а с другой – на максимальное сохранение окружающих тканей поджелудочной железы. Выбор тактики оперативного вмешательства зависит от размера опухоли, расположения, степени биологической активности. Используются лапароскопические и открытые методики, а также интраоперационное УЗИ для уточнения локализации опухоли. В случае небольших доброкачественных инсулином, расположенных не мене 2–3 мм от главного панкреатического протока, предпочтительным методом лечения является энуклеация опухоли [10, 11]. Резекционные методики предпочтительны в случае, когда опухоль прилежит к протоку поджелудочной железы или крупным сосудам, или подозрительна в отношении злокачественности (плотная консистенция, инфильтрация в прилежащие ткани, метастазы в регионарные лимфоузлы). Среди этих методик выделяют дистальную панкреатэктомию с сохранением или резекцией селезенки, панкреатодуоденэктомию (операция Уиппла) [10, 11]. Исход оперативного лечения благоприятный, послеоперационная смертность варьирует от 0 до 6% в зависимости от объема оперативного вмешательства и опыта хирургической бригады [11]. Частота рецидива после оперативного лечения у пациентов без синдрома МЭН-1 составляет 7% и 20% при синдроме МЭН-1 [10]. Обязательно выполнение патологоанатомического исследования операционного материала с применением иммуногистохимических методов с целью подтверждения диагноза и определения степени дифференцировки опухоли [1].
В случае невозможности проведения оперативного вмешательства или радикального удаления опухоли (при метастатической инсулиноме), а также при подготовке к операции возможно медикаментозное лечение препаратами аналогов соматостатина (октреотид, ланреотид), применение пероральных глюкокортикоидов в краткосрочный период с целью контроля гипогликемии, назначение диазоксида для поддержания нормогликемии [1, 4].
В данной статье представлен клинический случай инсулиномы поджелудочной железы, который иллюстрирует сложности диагностики данного заболевания.
Клиническое наблюдение. Пациент А., 49 лет, поступил в приемное отделение ГБУЗ «ГКБ им. М.Е. Жадкевича» после серии судорожных приступов с направительным диагнозом «Эпилепсия неуточненная. Состояние после судорожных приступов».

 При поступлении состояние пациент тяжелое, пациент заторможен, в физикальном осмотре, неврологическом осмотре отклонений не выявлено, артериальное давление при поступлении – 140/90 мм рт. ст., частота сердечных сокращений – 78 уд/мин, частота дыхательных движений – 18/мин. Пациент госпитализирован в отделение нейрореанимации. Результаты лабораторного обследования при поступлении представлены в табл. 1.
При поступлении состояние пациент тяжелое, пациент заторможен, в физикальном осмотре, неврологическом осмотре отклонений не выявлено, артериальное давление при поступлении – 140/90 мм рт. ст., частота сердечных сокращений – 78 уд/мин, частота дыхательных движений – 18/мин. Пациент госпитализирован в отделение нейрореанимации. Результаты лабораторного обследования при поступлении представлены в табл. 1.Из анамнеза известно, что в течение 6 мес родственники пациента отмечают изменение поведения пациента, раздражительность, эпизоды дезориентации, нарушения сознания, выраженную общую слабость, невозможность встать, продолжающиеся около 1–2 ч и проходящие самостоятельно. Уровень глюкозы на фоне приступов не измерялись. Пациент приступы потери сознания амнезирует, изменения в поведении отрицает. Прием гипогликемических, психотропных препаратов, наркотических препаратов и алкоголя отрицает. В течение 2 нед до госпитализации отмечает ухудшение общего самочувствия, увеличение частоты и продолжительности приступов, появление генерализованных судорог. Амбулаторно было выполнено КТ головного мозга, брахиоцефальных артерий, МРТ шейного отдела позвоночника и головного мозга – патологии не обнаружено.
При обследовании в стационаре при проведении рентгенографии органов грудной клетки, электрокардиографии, эхокардиографии клинически значимой патологии не выявлено.
С учетом клинической картины и лабораторно подтвержденной гипогликемии заподозрена инсулинома поджелудочной железы. Выполнено УЗИ органов брюшной полости – диффузные изменения печени, поджелудочной железы. Выполнена мультиспиральная компьютерная томография (МСКТ) органов брюшной полости – поджелудочная железа не увеличена, контур четкий, дольчатость сохранена. В артериальную фазу по заднему контуру тела поджелудочной
 железы образование округлой формы, с четкими ровными контурами, диаметром около 20 мм, активно накапливающее контрастное вещество, с последующим вымыванием в венозную и отсроченную фазу.
железы образование округлой формы, с четкими ровными контурами, диаметром около 20 мм, активно накапливающее контрастное вещество, с последующим вымыванием в венозную и отсроченную фазу.Также на МСКТ выявлены конкременты обеих почек без признаков нарушения выделительной функции почек, периневральные кисты S 2,3 позвонка, грыжи Шморля Th 11,12, добавочная долька селезенки.
Пациенту начата терапия внутривенным раствором декстрозы с положительным эффектом, восстановлением уровня сознания.
Для уточнения диагноза переведен в отделение эндокринологии. С учетом неопределенных клинико-лабораторных данных была проведена проба с голоданием. Симптомы гипогликемии зафиксированы у пациента в течение первых шести часов от начала пробы: снижение глюкозы до уровня 1,78 ммоль/л, уровень С-пептида оставался пониженным – 0,23 нмоль/л (0,27–
1,27 нмоль/л). Был проведен диагностический поиск других причин гипогликемии: осмотр пациента на предмет следов от инъекций инсулина, исключение самостоятельного приема лекарственных препаратов, была исключена надпочечниковая недостаточность (кортизол венозной крови утром 433 нмоль/л), выполнена эзофагогастродуоденоскопия: рефлюкс-эзофагит, признаки аксиальной грыжи пищеводного отверстия диафрагмы, эритематозная гастропатия, эрозивный бульбит, деформация луковицы двенадцатиперстной кишки, рекомендовано определение антител к эндогенному инсулину, исключены почечная, печеночная недостаточность, сердечная недостаточность.
В связи с сохранением гипогликемического синдрома, дискордантными результатами пробы с голоданием, в сочетании с данными МСКТ, отсутствием других причин гипогликемии, решено провести пробу с голоданием повторно с определением свободного инсулина. На фоне пробы максимальное снижение глюкозы достигло
1,47 ммоль/л, на фоне чего уровень С-пептида –
0,78 нмоль/л (0,27–1,27), инсулин – 98,12 мкМЕ/мл
(3–25). Таким образом, уровень С-пептида и инсулина при повторном проведении пробы соответствовал критериям гиперинсулинемической гипогликемии, с учетом данных МСКТ подтвержден диагноз инсулиномы, принято решение о дальнейшем обследовании с целью предоперационной локализации опухоли.
Результаты проведения 72-часовой пробы с голоданием (спустя 12 ч от начала пробы) представлены в табл. 2.
С учетом наличия у пациента, по данным МСКТ, конкрементов обеих почек, для исключения гиперпаратиреоза была проведена оценка состояния фосфорно-кальциевого обмена: кальций ионизированный –
1,31 ммоль/л, кальций общий – 2,34 ммоль/л (2,2–2,65), паратгормон – 4,21 пмоль/л (1,3–6,8), 25(ОН)D – 34 нг/мл. По результатам УЗИ щитовидной железы и паращитовидных желез: в проекции паращитовидных желез дополнительных образований не выявлено. Исключена гиперпролактинемия – пролактин 5,39 мкг/л (9,7–208). Уровень ИФР-1 и тестостерона не оценивался. Пациенту амбулаторно было выполнено МРТ головного мозга – признаков аденомы гипофиза не выявлено. Таким образом, были исключены компоненты синдрома МЭН-1.
Пациенту было выполнено эндоскопическое УЗИ поджелудочной железы: в теле определяется гиповаскулярное образование овальной формы, интимно прилежащее к селезеночным сосудам, с четкими ровными контурами, размером 24×20 мм, с неоднородной структурой, включающей гипер-, гипо- и анэхогенные участки. Выполнена тонкоигольная биопсия образования. Морфологическое заключение: в материале слизь с малыми элементами ткани, построенной из относительно мономорфных округлых клеток с крупными гиперхромными базофильными, местами полиморфными ядрами и выраженной эозинофильной цитоплазмой, отмечается тенденция к формированию трабекулы в единичном участке, отмечается лейкоцитарная, плазмоцитарная и нейтрофильная инфильтрация. Заключение: при наличии клинической картины морфологическая картина может соответствовать инсулиноме.
Было принято решение об оперативном лечении.
В рамках предоперационной подготовки выполнена ультразвуковая допплерография вен нижних конечностей, выявлен тромбоз глубоких вен нижних конечностей неизвестной давности (неокклюзивный тромбоз задней большеберцовой вены с обеих сторон), признаки варикозного расширения вен нижних конечностей, отек подкожно-жировой клетчатки голеней с признаками лимфостаза. На контрольном УЗИ органов брюшной полости – признаки неокклюзивного тромбоза воротной вены. В предоперационном периоде проводилась терапия эноксапарином натрия.
Пациенту выполнена операция – лапароскопическая энуклеация инсулиномы тела поджелудочной железы. Интраоперационно выполнена мобилизация задней поверхности тела поджелудочной железы до границы селезеночной вены, в проекции тела поджелудочной железы определяется образование плотной консистенции, размерами 2,5×2,5 см, выполнена энуклеация опухоли. По результатам послеоперационного гистологического исследования – узел диаметром 2,1 см в соединительнотканной капсуле, опухоль построена из светлых округлых клеток с зернистой цитоплазмой, округлыми ядрами с ядрышками, местами также зернистого вида с картиной «соль и перец», местами отмечаются митозы (2 в 10 полях зрения). Опухолевые клетки разделены стромой с признаками гиалиноза, ткань узла имеет очаговое солидное строение и очагово трабекулярное строение. Признаков инвазивного роста в сосудистую стенку нет. Таким образом, гистологическая картина может соответствовать функционально активной инсулиноме поджелудочной железы (R0). Выполнено иммуногистохимическое исследование операционного материала (ИГХ): в опухолевых клетках выявляется положительная реакция с синаптофизином, хромогранином А, CD56, инсулином, индекс
Ki-67 составляет 2%. ИГХ-картина соответствует высокодифференцированной нейроэндокринной опухоли поджелудочной железы – инсулиноме.
В послеоперационном периоде уровень глюкозы крови находился в диапазоне от 5,96 до 9,79 ммоль/л.
С целью профилактики послеоперационного панкреатита проводилась терапия октреотидом 100 мкг подкожно 3 раза в сутки, профилактика септических осложнений (антибиотикотерапия), продолжена антикоагулянтная терапия. Пациент выписан в удовлетворительном состоянии на 8-е сутки после оперативного вмешательства.
Данный клинический случай демонстрирует сложность первичной диагностики инсулиномы, несовершенство лабораторных методов диагностики и обусловливает необходимость ведения пациентов с подозрением на гипогликемический синдром в условиях специализированных стационаров, повышение информированности медицинских специалистов различных специальностей о данной редкой патологии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Никитина Наталья Андреевна – врач-эндокринолог, ГБУЗ «ГКБ им. М.Е. Жадкевича».
E-mail: nktnn0911@gmail.com; ORCID: 0009-0007-6866-8233
Natalia A. Nikitina – Endocrinologist, City Clinical Hospital named after M.E. Zhadkevic. E-mail: nktnn0911@gmail.com; ORCID: 0009-0007-6866-8233
Сницарь Артем Владимирович – глав. врач, ГБУЗ
«ГКБ им. М.Е. Жадкевича». ORCID: 0000-0001-6053-4651
Artyom V. Snitsar – Chief doctor, City Clinical Hospital named after M.E. Zhadkevic. ORCID: 0000-0001-6053-4651
Куандыкова Марина Викторовна – канд. мед. наук, зам. глав. врача по медицинской части, ГБУЗ «ГКБ им.
М.Е. Жадкевича». ORCID: 0000-0001-6634-2984
Marina V. Kuandykova – Cand. Sci. (Med.), Deputy Chief doctor, City Clinical Hospital named after M.E. Zhadkevic.
ORCID: 0000-0001-6634-2984
Покровский Константин Александрович – д-р мед. наук, врач-хирург, Департамент здравоохранения г. Москвы
Konstantin A. Pokrovsky – Dr. Sci. (Med.), Surgeon, Moscow Heath Department
Ерин Сергей Александрович – канд. мед. наук, заместитель глав. врача по хирургической помощи, ГБУЗ «ГКБ им. М.Е. Жадкевича». ORCID: 0000-0003-1083-8678
Sergey A. Yerin – Cand. Sci. (Med.), Deputy Chief doctor, City Clinical Hospital named after M.E. Zhadkevic.
ORCID: 0000-0003-1083-8678
Шибитов Вячеслав Александрович – д-р мед. наук,
врач-хирург, заведующий хирургическим отделением, ГБУЗ
«ГКБ им. М.Е. Жадкевича»
Vyacheslav A. Shibitov – Dr. Sci. (Med.), Surgeon, City Clinical Hospital named after M.E. Zhadkevic
Бревнова Наталья Владимировна – врач-эндокринолог, зав. эндокринологическим отделением, ГБУЗ «ГКБ им.
М.Е. Жадкевича»
Natalia V. Brevnova – Endocrinologist, City Clinical Hospital named after M.E. Zhadkevic
Петунина Нина Александровна – академик РАН, проф.,
д-р мед. наук, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Nina A. Petunina – Acad. RAS, Full Prof., Dr. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University)
Поступила в редакцию: 27.06.2024
Поступила после рецензирования: 12.07.2024
Принята к публикации: 18.07.2024
Received: 27.06.2024
Revised: 12.07.2024
Accepted: 18.07.2024
20 августа 2024
Количество просмотров: 313


