Клинический разбор в общей медицине №8 2024
Клинический разбор в общей медицине №8 2024
Рациональность применения многокомпонентных фитопрепаратов для лечения кашля у детей на примере сиропа с десятью растительными экстрактами
Номера страниц в выпуске:125-138
Аннотация
В педиатрической практике при возникновении респираторных инфекций, когда кашель малопродуктивный ввиду скудного количества вязкой мокроты, предпочтительными могут быть природные лекарственные средства, которые обладают не только отхаркивающим, но и другими позитивными эффектами – противовоспалительным, бронхолитическим, противомикробным и т.д. К таким лекарственным препаратам относятся комбинированные фитопрепараты, в частности сироп Доктор Мом®. В обзоре рассматриваются полезные и нежелательные эффекты входящих в состав препарата растительных экстрактов, обсуждаются известные механизмы их действия, анализируется рациональность комбинации в целом и приводятся результаты клинических исследований у детей.
Ключевые слова: кашель, фитопрепараты.
Для цитирования: Сидоров А.В., Лилеева Е.Г. Рациональность применения многокомпонентных фитопрепаратов для лечения кашля у детей на примере сиропа с десятью растительными экстрактами. Клинический разбор в общей медицине. 2024; 5 (8): 125–138.
DOI: 10.47407/kr2024.5.8.00470
В педиатрической практике при возникновении респираторных инфекций, когда кашель малопродуктивный ввиду скудного количества вязкой мокроты, предпочтительными могут быть природные лекарственные средства, которые обладают не только отхаркивающим, но и другими позитивными эффектами – противовоспалительным, бронхолитическим, противомикробным и т.д. К таким лекарственным препаратам относятся комбинированные фитопрепараты, в частности сироп Доктор Мом®. В обзоре рассматриваются полезные и нежелательные эффекты входящих в состав препарата растительных экстрактов, обсуждаются известные механизмы их действия, анализируется рациональность комбинации в целом и приводятся результаты клинических исследований у детей.
Ключевые слова: кашель, фитопрепараты.
Для цитирования: Сидоров А.В., Лилеева Е.Г. Рациональность применения многокомпонентных фитопрепаратов для лечения кашля у детей на примере сиропа с десятью растительными экстрактами. Клинический разбор в общей медицине. 2024; 5 (8): 125–138.
DOI: 10.47407/kr2024.5.8.00470
Review
1 Yaroslavl State Medical University, Yaroslavl, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
alekssidorov@yandex.ru
Abstract
In pediatric practice, when respiratory infections occur if cough is non-productive due to small amount of viscous sputum, it may be preferable to use natural medicines that are not only expectorants, but also have other positive effects such as anti-inflammatory, broncholytic, antimicrobial etc. These medicines include multi-component herbal medicines, such as Doctor Mom® syrup. The review highlights the beneficial and side effects of the herbal extracts in the preparation, discusses the mechanisms of their action, analyses the rationality of their combination and provides the results of clinical trials in children.
Keywords: cough, herbal medicines.
For citation: Sidorov A.V., Lileeva E.G. Multi-component herbal medicines rationality for cough treatment in children using the example of a syrup with ten medicinal plant extracts. Clinical review for general practice. 2024; 5 (8): 125–138 (In Russ.). DOI: 10.47407/kr2024.5.8.00470
Пожалуй, найдется не много фармакотерапевтических групп, столь же богатых фитопрепаратами, как группа противокашлевых и отхаркивающих средств. Несмотря на тысячелетнюю проверку временем, использование лекарственных растений для лечения кашля не всегда имеет надежную научную основу и убедительную клиническую доказательность [2]. Проблема осложняется тем, что современная фитотерапия, выросшая из народной медицины, вобрала в себя западные и восточные практики врачевания травами, различающиеся традициями использования одних и тех же лекарственных растений и принципами их сочетания. С другой стороны, изучение фитотерапии, и тем более специальных фармацевтических дисциплин, по большей части остается за рамками основной программы подготовки врачей, обусловливая недостаток знаний и неуверенность в вопросах эффективности и безопасности растительных препаратов. Это, в свою очередь, порождает неприятие и необоснованный скепсис в отношении фитопрепаратов как таковых. Между тем растения остаются богатейшим источником фармакологически активных веществ, многие из которых уже применяются в качестве самостоятельных препаратов или явились прообразом для синтеза усовершенствованных молекул, но потенциал этого источника с точки зрения создания новых лекарств далеко не раскрыт.
Одним из популярных средств для лечения кашля является растительный сироп Доктор Мом®. Он содержит сухие экстракты из 10 лекарственных растений и левоментол в качестве активных компонентов. Многокомпонентность состава, определяющая спектр терапевтических эффектов, обусловливает показания к применению препарата: у взрослых и детей в возрасте от 3 лет для симптоматической терапии острых и хронических заболеваний дыхательных путей, сопровождающихся сухим кашлем или кашлем с трудноотделяемой мокротой (фарингит, ларингит, в том числе «лекторский», трахеит, бронхит).
Фармакологическая активность растительных экстрактов сиропа
У каждого входящего в состав препарата лекарственного растения известно несколько фармакологических эффектов, используемых в различных терапевтических областях, в том числе в народной медицине с древнейших времен. Для целей данной публикации ограничимся только эффектами, имеющими отношение к терапии кашля инфекционного генеза, с точки зрения подтверждения их наличия в исследованиях, раскрытия возможных механизмов и безопасности.
Солодка оказывает отхаркивающее действие и слабый противокашлевый эффект (как результат смягчающего действия на слизистую оболочку респираторного тракта). Данные эффекты связаны главным образом с глицирризиновой кислотой, образующейся из глицирризовой под влиянием кишечной микробиоты. Глицирризиновая кислота действует как прямой мукоретик, стимулируя выработку жидкой части мокроты; кроме того, она усиливает сокращение мышц бронхов и облегчает выведение мокроты; попутно уменьшается раздражение слизистой бронхов, что способствует ослаблению кашля [4].
В терапии инфекционного кашля могут быть также актуальны противовоспалительный, антиоксидантный, иммуномодулирующий и противомикробный эффекты солодки. Противовоспалительные свойства связывают с кортикостероидоподобным действием глицирризиновой кислоты, проявляющимся в том числе ингибированием активации ядерного фактора каппа-би (NF-κB) и экспрессии провоспалительных генов, блокадой образования индуцибельной NO-синтазы (iNOS) и циклооксигеназы-2 (ЦОГ-2) [5, 6]. Помимо этого, у флавоноида изоликвиритигенина также показана способность подавлять образование провоспалительных факторов iNOS, ЦОГ-2, фактора некроза опухоли α (ФНО-α), интерлейкина 6 (ИЛ-6) и ИЛ-1β за счет ингибирования активации сигнальных путей Notch1/NF-κB и MAPK (митоген-активированной протеинкиназы) [7]. Антиоксидантная активность солодки обусловливает ингибирование перекисного окисления липидов и образования активных форм кислорода нейтрофилами в очаге воспаления [8]. Значимую антиоксидантную активность обеспечивают многочисленные полифенольные соединения, среди которых ликохалконы B и D, изофлавоны глабридин, гиспаглабридин A и др.
Иммуномодулирующее действие солодки проявляется в стимуляции фагоцитоза и синтеза интерферонов макрофагами [3], усилении лейкопоэза, подавлении реакции гиперчувствительности замедленного типа [9]. На модели овальбумининдуцированной бронхиальной астмы у мышей показано, что глицирризин ингибировал экспрессию воспалительных цитокинов ИЛ-4, ИЛ-5 и ИЛ-13, стимулировал продукцию интерферона гамма, регулируя баланс Th1/Th2-цитокинов, и, кроме того, способствовал увеличению количества Treg, подавлению рекрутинга эозинофилов и избыточной продукции моноцитов, уменьшая интенсивность воспаления дыхательных путей и гиперреактивность бронхов [10].
Противомикробные эффекты экстрактов различных частей солодки установлены in vitro в отношении некоторых грамположительных бактерий и грибков Candida [11, 12]. Кроме того, глицирризин эффективнее рибавирина, 6-азоуридина и других синтетических агентов ингибировал пролиферацию клинических изолятов коронавируса, выделенных от пациентов с тяжелым острым респираторным синдромом (SARS) [13], а также подавлял гиперэкспрессию провоспалительных хемокинов CXCL10 и CCL5 и цитокина ИЛ-6, индуцированную высокопатогенным штаммом H5N1 гриппа А в макрофагах человека наряду с ингибированием апоптоза клеток, но не влиял на репликацию самого вируса [14].
Применение препаратов солодки в терапевтических дозах считается безопасным, но рекомендуется избегать употребления солодки во время беременности. Согласно финскому эпидемиологическому исследованию [15], у детей, чьи матери во время беременности употребляли более 500 мг глицирризина в неделю, в подростковом возрасте были хуже результаты IQ-тестов, память и в 3,3 раза выше вероятность наличия синдрома дефицита внимания с гиперактивностью, а у девочек, кроме того, отмечалось более раннее половое созревание по сравнению с детьми, матери которых во время беременности употребляли ≤249 мг глицирризина в неделю.
Фиксируемые случаи побочных эффектов связаны не с экстрактом солодки, а с приемом избыточных доз чистой глицирризиновой кислоты, например, со сладостями и напитками, а также при курении курительных смесей [16]. Нежелательные эффекты лекарственных препаратов глицирризиновой кислоты также могут вносить вклад в общую статистику. Максимальная доза глицирризиновой кислоты, согласно рекомендациям Всемирной организации здравоохранения, не должна превышать 100 мг/сут [17]. Патогенез клинических проявлений интоксикации глицирризиновой кислотой связан с ингибированием 11β-гидроксистероиддегидрогеназы 2-го типа и избыточной продукцией минералокортикоидов – развитием синдрома псевдогиперальдостеронизма [18]. Наиболее часто возникают повышение артериального давления, задержка натрия и воды, гипокалиемия и метаболический алкалоз [19]. Жизнеугрожающие симптомы в виде аритмий, паралича скелетной мускулатуры, рабдомиолиза и нарушения сознания возникают редко [20]. Кроме того, глицирризиновая кислота способна в незначительной степени ингибировать продукцию андрогенов, а флавоноиды и изофлавоноиды солодки проявляют эстрогеновую активность. Флавоноид изоликвиритигенин может замедлять моторику кишечника [18].
На протяжении тысячелетий адатода васика использовалась в качестве главного лекарственного средства практически при всех заболеваниях дыхательных путей благодаря разнообразию эффектов: бронхолитическому, противокашлевому, мукоактивному, противовоспалительному, антиоксидантному, противомикробному [22].
Бронхолитический эффект адатоды васики, неоднократно продемонстрированный в экспериментах с аллергениндуцированной бронхообструкцией, обусловлен активностью алкалоидов вазицина и вазицинона [23]. Отхаркивающее действие также оказалось связано с вазицином, ставшим прототипом для создания бромгексина и амброксола [24]. Противокашлевая активность спиртового экстракта адатоды васики в модельных экспериментах на мышах была сопоставима с таковой у кодеина и, по мнению авторов, вторична по отношению к мукоретическому действию (т.е. эффекту, опосредуемому вазицином) [25]. В другом исследовании изучался противокашлевой эффект водных извлечений полисахаридных фракций (арабиногалактана) адатоды, солодки и ашваганды на морских свинках [26]. Эффективность арабиногалактанов также не уступала кодеину, но в этом случае авторы связывают противокашлевое действие не столько со стимуляцией секреции мокроты, сколько с мукоадгезивными свойствами полисахаридов, формированием защитного слоя на слизистой дыхательных путей (по крайней мере, верхних отделов), а также со стимуляцией саливации, что в итоге снижает чувствительность кашлевых рецепторов и подавляет кашель.
Противовоспалительный эффект адатоды васики может быть связан с двойным ингибированием метаболизма арахидоновой кислоты по циклооксигеназному (ЦОГ) и липооксигеназному (ЛОГ) пути, как было установлено при исследовании водного экстракта растения [27]. Умеренная антиоксидантная активность установлена в дифенилпикрилгидразиловом тесте у этанольного экстракта листьев адатоды васики [28] и вазицина ацетата [29], а также на модели астмы у вазицина [30].
В нескольких in vitro исследованиях показана антимикробная активность разных извлечений из листьев адатоды васики в отношении Staphylococcus aureus, Staphylococcus epidermidis, Klebsiella pneumoniae и ряда других грамотрицательных бактерий, а также Candida albicans [29, 31, 32]. Кроме того, обнаружена выраженная способность спиртового экстракта листьев адатоды васики, наряду с экстрактами пяти других восточных растений, препятствовать образованию биопленок Chromobacterium violaceum (anti-quorum sensing-эффект) [33].
Фитопрепараты адатоты васики, как правило, хорошо переносятся; об истинной частоте связанных с ее применением нежелательных реакций судить сложно ввиду многокомпонентности состава препаратов. В трех клинических исследованиях комбинированных препаратов, содержащих адатоду васику, с общим числом участников 130 человек серьезных нежелательных эффектов зафиксировано не было [34].
Применение препаратов адатоды васики во время беременности противопоказано. Вазицин обладает утеротонической активностью, по некоторым данным, сопоставимой с эффектом окситоцина и связанной с высвобождением простагландинов [24]. Наличие 100% абортивного эффекта экстрактов адатоды васики подтверждено не только в экспериментальных исследованиях, но и практикой использования листьев растения в индийской провинции для прерывания беременности [35, 36].
В олеосмоле накапливаются фенольные соединения (гингеролы и шогаолы), жирные кислоты и некоторые компоненты эфирного масла [37].
Имбирь обладает сильными противокашлевым и отхаркивающим эффектами, за развитие которых отвечают гингеролы и шогаолы. Кроме того, оказывает противовоспалительное, антиоксидантное и иммуномодулирующее действие [38]. Считается, что противовоспалительное действие имбиря, как и у адатоды васики, обусловлено двойной блокадой ЦОГ-2 и 5-ЛОГ. Также было показано антицитокиновое действие экстрактов имбиря и отдельных компонентов in vitro и in vivo [39]. Кроме того, определенное значение имеет антиоксидантное действие, обусловленное высоким содержанием фенольных соединений; при этом наибольшим антиоксидантным и противовоспалительным эффектом обладал 6-шогаол благодаря наличию α-, β-ненасышенной кетоновой связи [40]. Моно- и сесквитерпены (в особенности куркумены) и фенольные соединения обеспечивают проявление у экстрактов имбиря (различные растворители) антимикробной активности в отношении S. aureus и более слабой – против грамотрицательной флоры (Klebsiella spp., Enterococcus spp. и др.) [41, 42].
Из результатов клинических исследований известно о безопасности употребления внутрь 500–1000 мг имбиря в сутки; в этих количествах нежелательные эффекты возникают редко и в основном проявляются желудочно-кишечным дискомфортом [43]. Отдельные компоненты (6-, 8- и 10-гингеролы и 6-шогаол) были безопасны при приеме здоровыми добровольцами в дозе до 2000 мг/сут [44]. В случае употребления более 4–6 г имбиря в день могут появляться симптомы раздражения слизистой оболочки рта, желудка, изжога, диарея; при длительном приеме больших доз имбиря возможны повышение чувствительности глаз к яркому свету, высыпания на коже лица [37]. Применение препаратов имбиря при беременности и лактации возможно после консультации с врачом (имбирь часто используется как противорвотное средство при токсикозе беременности). В доклинических исследованиях тератогенного действия экстрактов имбиря не выявлено [45].
В недавнем исследовании [46] была установлена ингибирующая активность экстракта имбиря и отдельных его компонентов (в частности, 6-гингерола и 6-шогаола) в отношении изоферментов цитохрома Р450 CYP3A4, 2C9, 1A2, и 2B6, а также АТФ-связывающих транспортных белков – гликопротеина Р (ABCB1/P-gp) и белка резистентности рака молочной железы (ABCG2/BCRP). Это требует внимания при прогнозировании взаимодействий имбиря (в том числе как пищевого продукта) с лекарствами-субстратами CYP, P-gp и BCRP.
В восточной медицине девясил обычно используется как отхаркивающее средство и бронхолитик [48, 49]. Бронхолитические (противоастматические) свойства экстрактов девясила продемонстрированы в экспериментальных и клинических исследованиях [50]. Противокашлевое действие алантолактона и изоалантолактона в экспериментах на морских свинках оказалось слабее, чем у кодеина, примерно в 2 раза [51].
Кроме того, представляет интерес противовоспалительное, антиоксидантное, и противомикробное действие девясила [52, 53]. Спиртовой и водный экстракты корневищ с корнями девясила проявляли противовоспалительный эффект, не уступающий в модельных экспериментах препаратам сравнения ацетилсалициловой кислоте и индометацину в эквивалентных дозах [54, 55]. Показано, что противовоспалительная активность алантолактона опосредована ингибированием продукции хемокинов за счет нарушения фосфорилирования STAT1 (трансдуктора сигнала и активатора транскрипции 1-го типа) [56, 57]. Кроме того, алантолактон блокирует iNOS и ЦОГ-2 и индуцированную ФНО-α активацию внутриклеточных провоспалительных путей
NF-κB и MAPK [58]. Антиоксидантные свойства экстрактов девясила подтверждались разными авторами, причем у сесквитерпеновых лактонов они даже более выражены, чем у α-токоферола и убихинона [51, 59, 60].
Водный экстракт корневищ с корнями девясила подавлял рост S. aureus и Escherichia coli в минимальной подавляющей концентрации (МПК) соответственно 6,25 мг/мл и 12,5 мг/мл в диско-диффузионном методе; спиртовой экстракт продемонстрировал меньшую активность [61]. Методом диффузии в агар также определялось умеренное подавляющее действие алантолактона на рост S. aureus, K. pneumoniae, E. coli и некоторых других грамотрицательных бактерий [62].
Девясил признан нетоксичным для медицинского применения, хотя необходимы дополнительные исследования его компонентов, сесквитерпеновых лактонов, на предмет хронической токсичности, в особенности генотоксичности и эмбриотоксичности [63]. Девясилу, как представителю астровых (сложноцветных), свойственно вызывать аллергический контактный дерматит. Роль гаптена выполняют, по-видимому, сесквитерпеновые лактоны, причем изоалантолактон выступает в качестве сенсибилизатора [64]. Необходимо также учитывать свойства алантолактона и изоалантолактона как фитоэстрогенов [65].
В терапии кашля полезными могут быть противовоспалительный, антиоксидантный, противомикробный, бронхолитический и иммуномодулирующий эффекты куркумы [67].
В экспериментальных исследованиях установлен комплексный механизм противовоспалительного действия куркумина: ингибирование фосфолипазы, 5-ЛОГ, ЦОГ-2, iNOS и, соответственно, подавление продукции провоспалительных медиаторов – лейкотриенов и простагландинов, оксида азота, ограничивающее альтеративную и экссудативную фазы воспаления. Помимо этого куркумин способен ингибировать коллагеназу, эластазу, гиалуронидазу, уменьшать образование моноцитарного хемоаттрактантного протеина 1-го типа (MCP-1), ФНО-α, ИЛ-12, ограничивая хроническое воспаление [68].
Антиоксидантные свойства куркумы и отдельно полифенольного соединения куркумина, ослабляющие интенсивность оксидативного стресса в патогенезе воспалительных заболеваний, подтверждены в многочисленных экспериментальных исследованиях и обобщены в обзорах [69].
Иммуномодулирующий защитный эффект куркумина показан в экспериментальных исследованиях с острым поражением легких бактериальным липолисахаридом [70], S. aureus [71] и K. pneumoniae [72]: отмечались уменьшение повреждения легочной ткани и накопления в ней нейтрофилов и провоспалительных цитокинов, снижение продукции малонового диальгедида, активности миелопероксидазы, а также усиление эффекта антибиотиков.
Куркумин в составе композитных частиц с оксидом графена препятствовал заражению культуры ткани респираторно-синцитиальным вирусом посредством прямой инактивации и нарушения адгезии вируса к клеткам, оказывая профилактический и терапевтический эффект при респираторно-синцитиальной инфекции [73]. Показана также активность куркумина против вируса гриппа А in vitro (ингибирование репликации вируса на клеточной линии рака легкого человека A549) и in vivo (уменьшение тяжести инфекции на мышиной модели, в том числе за счет индукции синтеза гемоксигеназы-1 и ингибирования продукции провоспалительных цитокинов в макрофагах вследствие прерывания сигнального пути NF-κB) [74].
Эффективность куркумина в дополнение к рекомендованной терапии инфекции COVID-19 легкой и средней тяжести у госпитализированных пациентов (n=76, средний возраст 54 года) оценивалась в иранском двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании [75]. Модифицированный куркумин в биодеградируемых наномицеллах (нанокуркумин) с улучшенной растворимостью, стабильностью и биодоступностью назначался в капсулах по 40 мг 4 раза в день в течение 2 нед. По сравнению с плацебо куркумин способствовал статистически значимому уменьшению частоты кашля, астении, миалгии, потребности к кислородной поддержке и одышки; кроме того, средний прирост SpO2 на фоне терапии куркумином был выше, чем в группе плацебо. Авторы пришли к выводу о том, что противовоспалительная активность нанокуркумина потенцирует эффект стандартной терапии COVID-19, способствуя восстановлению после острой воспалительной фазы заболевания у госпитализированных пациентов с легкой и средней степенью тяжести заболевания. В другом плацебо-контролируемом исследовании нанокуркумин, назначавшийся пациентам с COVID-19 в капсулах по 40 мг 4 раза в день в течение 2 нед, способствовал уменьшению экспрессии (копий мРНК из мононуклеаров крови) и секреции (концентрации в крови) ИЛ-6 и ИЛ-1β, что среди прочего может объяснять положительное влияние куркумина на течение заболевания [76].
Бронхолитический эффект водно-спиртового экстракта куркумы, сопоставимый с теофиллином, продемонстрирован в эксперименте с индуцированной метахолином и калием хлоридом констрикцией гладких мышц трахеи у крыс; причем на развитие релаксирующего эффекта не влияли пропранолол, дилтиазем,
L-NAME (ингибитор NO-синтазы), глибенкламид и атропин, хлорфенирамин, индометацин, папаверин [77]. Отдельно куркумин показал ингибирующее действие на развитие воспаления дыхательных путей и бронхоконстрикцию на модели бронхиальной астмы у мышей [78].
В нескольких небольших клинических исследованиях оценивали эффект добавления куркумина к стандартной терапии на течение бронхиальной астмы. Так, в одном из исследований (n=60) дополнительный прием 500 мг куркумина в капсулах дважды в день на протяжении 30 дней у пациентов с легкой и среднетяжелой астмой способствовал значимо большему приросту объема форсированного выдоха за 1-ю секунду (ОФВ1) по сравнению с группой стандартной терапии [79]. Аналогичный результат отмечался в исследовании у пациентов с бронхиальной астмой и ожирением (n=40), принимавших куркумин в капсулах по 750 мг дважды в день в течение 2 мес, достигших более выраженного улучшения функциональных показателей ОФВ1 и ОФВ1/форсированная жизненная емкость легких по сравнению с группой стандартной терапии [80]. Терапевтический эффект куркумина у пациентов с бронхиальной астмой можно объяснить проявлением противовоспалительной и иммуномодулирующей активности вещества.
На основании экспериментальных и клинических данных куркумин считается безопасным в дозе до
8 г/сут [81]. Куркума и куркумин не вызывали тератогенных и мутагенных эффектов у беременных самок животных, однако для окончательных выводов необходимы дополнительные исследования у человека [82].
В чрезмерных количествах куркумин может вызывать желудочно-кишечные расстройства, стимулировать сокращение матки при беременности, нарушать усвоение железа, снижать свертываемость крови, уменьшать продукцию тестостерона у мужчин и подвижность сперматозоидов [81].
Алоэ оказывает противовоспалительное, антиоксидантное, иммуномодулирующее и противомикробное действие [84]. В ранних работах показана способность водного экстракта алоэ ингибировать ЦОГ и синтез простагландина Е2, оказывая противовоспалительное действие на модели каррагинанового отека лапы у крыс [85], что впоследствии было подтверждено на биоптатах воспаленной слизистой оболочки ободочной и толстой кишки [86]. Установлено также, что лупеол модулирует активность глюкокортикоидных рецепторов, что дополнительно способствует уменьшению воспаления. Кроме того, водный экстракт алоэ снижал продукцию металлопротеиназы-9 в мононуклеарах периферической крови in vitro [87]. Антиоксидантная активность экстрактов алоэ и отдельных компонентов продемонстрирована в многочисленных исследованиях in vitro и in vivo [88]. Иммуномодулирующий эффект проявляется в повышении активности макрофагов и стимуляции лейкопоэза и связан с полисахаридами алоэ (в частности, ацеманнаном) [89]. Антибактериальное действие препаратов алоэ обнаружено in vitro в отношении бактерий
S. aureus, Streptococcus pyogenes, Pseudomonas aeruginosa, E. coli и др. [90, 91]. Отдельные компоненты алоэ проявляли противовирусные свойства, например, лектины ингибировали пролиферацию цитомегаловирусов в клеточной культуре, алоэ эмодин инактивировал вирусы простого герпеса 1 и 2-го типов, варицелла-зостер и гриппа [84]. Установлена также противогрибковая эффективность водных экстрактов алоэ в отношении C. albicans [91].
Системное действие препаратов алоэ в терапевтических дозах может сопровождаться индивидуальными реакциями повышенной чувствительности, раздражением слизистой желудка, спазмами желудка, повышением моторики желудочно-кишечного тракта, слабительным эффектом и электролитными нарушениями. Стимуляция моторики желудочно-кишечного тракта и слабительное действие связано в основном с алоином (барбалоином) [92]. Не рекомендуется системное применение препаратов алоэ во время беременности ввиду риска сокращений матки [90].
Перец кубеба обладает противовоспалительным, антиоксидантным, антибактериальным действием [94]. Аналогично другим рассмотренным растениям противовоспалительный эффект кубебы обусловлен комплексным механизмом. Спиртовой экстракт ингибировал активность ЦОГ-1 и ЦОГ-2, 5-ЛОГ, а также уменьшал образование ИЛ-6 (как показано на моноцитах линии THP-1, стимулированных бактериальным липополисахаридом) [95]. Противовоспалительная активность перца кубебы связана как с лигнанами, так и с алкалоидами [96, 97].
Мощную антиоксидантную активность проявляют лигнаны [98] и компоненты эфирного масла плодов кубебы эвгенол и метилэвгенол [99].
Экстракты плодов перца кубебы проявляли высокую антибактериальную активность in vitro в отношении мультирезистентных Enterococcus spp. и умеренную – против E. coli и P. aeruginosa [100]. В исследовании
P. Ahirrao и соавт. полученные с помощью метанольной экстракции из плодов перца кубебы соединения пеллиторин, сезамин, пипериновая кислота и тетрагидропиперин снижали МПК эритромицина для S. aureus (штамм RN4220) в 2–8 раз за счет ингибирования эффлюксной помпы MsrA [101]. В другом исследовании эфирное масло из плодов перца кубебы ингибировало рост метициллинорезистентных штаммов S. aureus – MRSA (штамм ATCC 43300) в МПК 50 мкг/мл, причем с помощью трансмиссионного электронного микроскопа подтверждались серьезные повреждения бактериальных клеток [102]. В то же время в концентрации 25 мкг/мл (0,5 МПК) не возникало различимых на микроскопическом уровне изменений клеток MRSA, однако при рассмотрении в атомно-силовой микроскоп (наноуровень) определялись нарушения клеточной стенки и цитоплазматической мембраны бактерий, что говорит о возможном механизме антимикробного действия активных компонентов эфирного масла перца.
Установлено, что спиртовой экстракт перца кубебы обладает антиэстрогеновым действием: он значимо ингибировал стимулируемый β-эстрадиолом рост клеток рака молочной железы человека in vitro. Данный эффект был обусловлен как блокадой эстрогеновых рецепторов (рекомбинантных человеческих типа α и β), так и ингибированием ароматазы (отвечает за метаболизм андрогенов в эстрогены) [95].
T. Usia и соавт. было показано, что 5 лигнанов, выделенных из перца кубебы, оказывают очень сильное ингибирующее действие на CYP3A4: значения IC50 составили 0,44–1,0 мкмоль и были сопоставимы с IC50 контрольного ингибитора кетоконазола – 0,72 мкмоль [103].
Обладает бронхолитическим, антибактериальным, иммуномодулирующим, противовоспалительным, антиоксидантным эффектами [105].
Бронхолитический эффект экстрактов терминалии обусловлен антихолинергической и антикальциевой активностью [106].
Водный и метанольный экстракты плодов терминалии подавляли рост S. aureus, демонстрируя высокую активность in vitro [107]. Была установлена способность метанольного экстракта терминалии беллирийской наряду с экстрактами имбиря, чеснока и других растений ингибировать β-лактамазу in vitro [108]. Более того, водные и метанольные экстракты плодов терминалии беллирийской проявляли антибактериальную активность (МПК 0,25–4 мг/мл) против MRSA, мультирезистентных Acinetobacter spp., P. aeruginosa и E. coli, продуцирующих β-лактамазы расширенного спектра [109]. В этом же исследовании, сравнивая антиоксидантную активность различных извлечений, авторы обнаружили, что наибольшим антиоксидантным и антибактериальным потенциалом обладал метанольный экстракт плодов терминалии. Выраженная антиоксидантная активность экстрактов плодов терминалии объясняется высоким содержанием фенольных соединений, в особенности галловой и феруловой кислот [110]. Показана их способность стимулировать экспрессию антиоксидантных ферментов, в том числе гемоксигеназы, каталазы, НАДФ-хинон-оксидоредуктазы 1 [111].
Противовоспалительная активность терминалии беллирийской связана с подавлением экспрессии генов NF-κB, ФНО-α, ИЛ-6, ЦОГ-2, а также с прямым ингибированием активности ЦОГ-2, 5-ЛОГ, iNOS, миелопероксидазы и снижением продукции провоспалительных цитокинов, метаболитов арахидоновой кислоты, активных форм кислорода и оксида азота (II) [112].
Иммуномодулирующее действие метанольного экстракта терминалии in vitro проявлялось в стимуляции фагоцитарной активности и пролиферации Т- и B-лимфоцитов и продукции лимфоцитарных цитокинов [113].
В исследованиях острой, подострой и хронической токсичности различных экстрактов плодов терминалии беллирийской негативного действия не выявлено [114, 115].
В исследованиях in vivo изучена противовоспалительная активность различных извлечений корня базилика, обладавших также дозозависимым анальгетическим и жаропонижающим действием без каких-либо проявлений токсичности в дозах до 2000 мг/кг массы тела при пероральном введении [119]. За реализацию антиоксидантного и противовоспалительного действия базилика отвечают фенольные соединения (эвгенол, галловая, кофеиновая, хлорогеновая, розмариновая кислоты и их производные, флавоноиды). Показано, что антиоксидантная активность ряда фенольных компонентов базилика проявляется в микромолярных концентрациях и не уступает или даже превосходит активность витамина Е и синтетических антиоксидантов трет-бутилгидрохинона и бутилгидрокситолуол на различных моделях [120, 121]. В то же время в миллимолярных концентрациях фенольные соединения продемонстрировали ингибирование ЦОГ-1 и ЦОГ-2 на 37–97% (максимально – эвгенол), сопоставимое с эффектом микромолярных концентраций ибупрофена, напроксена, ацетилсалициловой кислоты [120]. Помимо фенольных соединений, способность нейтрализовывать свободные радикалы кислорода и хелатировать ионы железа обнаруживалась у полисахаридов из листьев базилика [122].
Флавоноид ориентин (400 мг/мл) подавлял рост S. aureus и K. pneumonia – максимальная зона ингибирования составляла соответственно 18,04 и 16,11 мм; при этом его активность усиливалась виценином (400 мг/мл) [123]. Эфирное масло базилика (основной компонент – эвгенол, 74,83%) проявляло антимикробную активность in vitro в отношении мультирезистентных S. aureus и E. coli: отмечалась задержка лаг-фазы для обоих патогенов, в особенности S. aureus, и сокращение вдвое роста E. coli; МПК для большинства штаммов составляла 1 мг/мл [124]. Кроме того, авторы сообщили о значимой редукции массы биопленок S. aureus и E. coli и снижении жизнеспособности бактериальных клеток под воздействием эфирного масла базилика.
На модели куриных эмбрионов установлена высокая противовирусная активность экстракта листьев базилика и терпеноидной фракции в отношении вируса гриппа А H9N2 [125].
In vivo исследования иммуномодулирующего эффекта водного и спиртового экстрактов листьев базилика свидетельствуют о стимуляции реакций адаптивного (продукция антител, гиперчувствительность замедленного типа) и врожденного (функция фагоцитов, активность лизоцима) иммунитета [126–128].
Несколько клинических исследований подтверждают иммуномодулирующее действие экстракта базилика священного. В частности, в рандомизированном двойном слепом плацебо-контролируемом перекрестном исследовании с участием 24 здоровых добровольцев усиление иммунного ответа на фоне 4-недельного ежедневного приема 300 мг спиртового экстракта листьев базилика в капсулах в сравнении с плацебо проявлялось значимым увеличением концентрации интерферона-γ, ИЛ-4, относительного количества Т-хелперов и NK-клеток [129].
Систематический обзор 24 клинических исследований не выявил серьезных нежелательных явлений при приеме экстрактов базилика взрослыми пациентами с различными хроническими заболеваниями; лишь в одном исследовании (n=16) фиксировалось несколько случаев тошноты при употреблении экстракта листьев базилика в капсулах по 250 мг дважды в день [130].
Среди эффектов паслена индийского интерес представляют противовоспалительный, антиоксидантный и антибактериальный [133].
Метанольный экстракт плодов паслена индийского (250 и 500 мг/кг массы тела перорально) проявлял анальгетическое (несколько превосходящее эффект ацетилсалициловой кислоты 100 мг/кг массы тела перорально), противовоспалительное (сопоставимое с эффектом диклофенака натрия 1 мг/кг массы тела перорально) и жаропонижающее (сопоставимое с эффектом парацетамола 150 мг/кг массы тела перорально) действие в модельных экспериментах in vivo [134].
Метанольный экстракт плодов паслена индийского продемонстрировал сопоставимый с бутилгидрокситолуолом антиоксидантный эффект при применении в одинаковых концентрациях in vitro [135].
Спиртовые экстракты листьев паслена индийского показали умеренную антибактериальную активность in vitro против S. aureus [136], Corynebacterium diphtheriae, Streptococcus spp., Bacillus spp., Pseudomonas spp. [137].
Исследования острой токсичности спиртового экстракта плодов паслена индийского продемонстрировали безопасность его высоких доз [135].
В отличие от синтетических лекарственных препаратов, фитопрепараты невозможно четко отнести к противокашлевым или отхаркивающим из-за наличия в одном растении нескольких активных компонентов, обладающих различными фармакологическими эффектами. Например, популярная солодка обладает как противокашлевым, так и отхаркивающим эффектом [145]. Это является определенным преимуществом фитопрепаратов на ранних стадиях лечения кашля с трудноотделяемой мокротой. Кроме того, помимо противокашлевого и отхаркивающего действия, на эффективность фитопрепарата влияют дополнительные полезные эффекты – противовоспалительный, антиоксидантный, бронхолитический, иммуномодулирующий, антибактериальный, противовирусный и т.д. [2]. В случае многокомпонентного фитопрепарата отдельные экстракты, действующие однонаправленно, усиливают действие друг друга [146, 147]. Возникает феномен потенцирования – достижения выраженного итогового эффекта лекарственной комбинации от небольших доз каждого ее компонента.
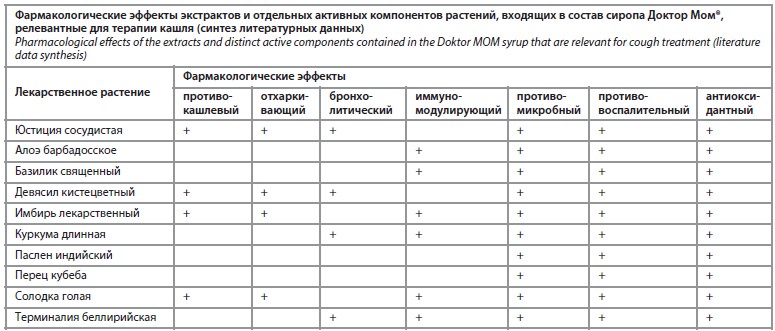
Изложенные эффекты лекарственных растений обобщены в таблице. Как видно из таблицы, противомикробная, противовоспалительная и антиоксидантная активность обнаружена у всех десяти растений. Авторы не претендуют на полноту изложения всех терапевтических эффектов рассматриваемых растений. Вполне вероятно, можно найти экспериментальные исследования, подтверждающие наличие у каждого из растений более широкого спектра свойств, полезных в терапии кашля.
Другой аспект фитотерапии – безопасность. Распространенное мнение об абсолютной безопасности фитопрепаратов ошибочно: возможны нежелательные эффекты, лекарственные взаимодействия фармакокинетического и фармакодинамического типа [148]. Выше были рассмотрены вопросы безопасности применения фитопрепаратов отдельных растений и необходимые меры предосторожности.
В целом сироп Доктор Мом® является безопасным лекарственным средством, однако наличие в составе экстрактов имбиря и перца кубебы не исключает риска потенциальных взаимодействий с лекарствами-субстратами цитохрома P450 (CYP3A4, 2C9, 1A2, 2B6), а также гликопротеина Р и белка BCRP. Особую осторожность следует соблюдать у детей, получающих противоопухолевую терапию: от применения сиропа у них в большинстве случаев следует воздержаться.
Вместе с тем преимуществом фитопрепаратов с точки зрения безопасности может являться нейтрализация потенциального побочного действия за счет своих же дополнительных эффектов [149]. Например, противовоспалительный механизм всех рассмотренных выше растений опосредован ингибированием ЦОГ-1 и/или ЦОГ-2. Известно, что этот механизм ассоциируется с нежелательными реакциями со стороны желудочно-кишечного тракта, сердечно-сосудистой системы, почек при приеме нестероидных противовоспалительных препаратов. По-видимому, избегать развития данных осложнений позволяет наличие у обсуждаемых растений экспериментально подтвержденных дополнительных эффектов:
• гастроэнтеропротективного (солодка [150], алоэ [151], имбирь [152], куркума [81], терминалия беллирийская [153], базилик [118], паслен индийский [133]);
• кардиопротективного (солодка [150], алоэ [154], имбирь [155], девясил кистецветный [156], куркума [81], терминалия беллирийская [153], базилик [118], паслен индийский [133]);
• нефропротективного (алоэ [157], имбирь [158], перец кубеба [159], куркума [81], терминалия беллирийская [153]).
Считается, что в большой мере органопротективные свойства растений обусловлены антиоксидантной активностью флавоноидов и других фенольных соединений [160].
Другой пример нейтрализации нежелательных явлений в рамках многокомпонентного препарата – компенсация эстрогеновой активности солодки и девясила антиэстрогеновым эффектом перца кубебы.
Как обсуждалось выше, изучение токсичности, немногочисленные клинические исследования и опыт практического применения свидетельствуют о низкой токсичности каждого из растительных экстрактов в составе препарата. О потенциальном негативном взаимодействии между компонентами на данный момент не известно.
В другом клиническом исследовании [146] сравнивались эффективность и безопасность трех сиропов – многокомпонентного (Доктор Мом®) и монокомпонентного (экстракт листьев плюща обыкновенного) растительных и синтетического (лазолван), назначавшихся соответственно в 1, 2 и 3-й группах терапии. В исследование включены 90 детей в возрасте 3–7 лет с острым трахеобронхитом в первые 1–3 сут заболевания с симптомами кашля. Длительность терапии составляла 10 дней, дозировка препаратов соответствовала возрасту. Исследование закончили 84 ребенка. Заметное улучшение состояния пациентов отмечалось уже на 7-е сутки болезни: балльная оценка тяжести состояния снизилась примерно на треть у детей 2 и 3-й групп и почти у половины детей 1-й группы. На 14-й день от начала заболевания во всех группах наблюдалось снижение балльной оценки тяжести более чем на 70% от стартовой, что позволяет говорить об эффективности всех препаратов в исследовании. Тем не менее улучшение состояния в динамике от 1–3-го к 14-му дню болезни у детей в 1-й группе достигалось быстрее, чем во 2 и 3-й группах. Более высокая эффективность сиропа Доктор Мом® сопровождалась сопоставимой с сиропами на основе экстракта плюща и лазолвана безопасностью. Переносимость сиропа Доктор Мом® отмечена как хорошая и очень хорошая в 85% случаев врачами и в 97% – родителями больных детей. Аналогичные показатели для сиропа на основе экстракта плюща составили 80 и 87%, а для лазолвана – 80 и 71%. Анализ оценки проведенного лечения, данной родителями пациентов, показал, что они отдают предпочтение растительным препаратам по сравнению с синтетическими. При этом эффективность (97 и 71%, р=0,022) и безопасность (93 и 71%, р=0,028) сиропа Доктор Мом® была статистически значимо выше, чем у сиропа лазолвана.
Также было проведено открытое рандомизированное сравнительное клиническое исследование [161] терапевтической эффективности и переносимости сиропа Доктор Мом® и сиропа корня солодки у 59 детей в возрасте 3–15 лет с острыми инфекционно-воспалительными заболеваниями дыхательных путей, сопровождающимися кашлем. В исследование включены 59 детей (в основной группе 35 пациентов). Препараты принимались в возрастных дозах в составе комплексной терапии. В обеих группах преобладали пациенты с острыми инфекционно-воспалительными заболеваниями верхних дыхательных путей. Так, острая респираторная вирусная инфекция выявлялась у 83,3% детей основной группы и 90,5% детей группы сравнения. Оба исследуемых препарата способствовали купированию кашля у подавляющего большинства пациентов к 8–12 дням наблюдения: у 84,4% в основной группе и у 80,0% в группе сравнения. При этом у детей 3–6-летнего возраста сироп Доктор Мом® значительно эффективнее и быстрее снижал интенсивность кашля по сравнению с сиропом корня солодки (р<0,05). Выявлена также тенденция к более быстрому снижению частоты кашля у детей в возрасте 3–6 лет при использовании сиропа Доктор Мом® по сравнению с сиропом корня солодки. Эффективное снижение частоты и интенсивности кашля при использовании сиропа Доктор Мом® сопровождалось более быстрой нормализацией ночного сна у детей. У 80,0% детей, получавших сироп Доктор Мом®, и у 75,1% детей, лечившихся сиропом корня солодки, выраженный отхаркивающий эффект наступал уже к 4-му дню от начала терапии. При этом у детей в возрасте 3–6 лет наблюдалась тенденция к более раннему наступлению отхаркивающего эффекта при использовании сиропа Доктор Мом® по сравнению с сиропом корня солодки. У детей в возрасте 7–15 лет статистически значимых различий в снижении частоты и интенсивности кашля и темпах проявления отхаркивающего эффекта между изучаемыми лекарственными препаратами выявлено не было. Переносимость терапии в обеих группах была хорошей, однако на фоне приема сиропа корня солодки у 2 (9,5%) детей возникли побочные эффекты (в одном случае – макуло-папулезная сыпь на коже лица и туловища, в другом – тошнота и рвота), потребовавшие отмены препарата.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Сидоров Александр Вячеславович – д-р мед. наук, зав. каф. фармакогнозии и фармацевтической технологии ФГБОУ ВО
ЯГМУ, гл. науч. сотр. Федерального научно-практического центра паллиативной медицинской помощи ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: alekssidorov@yandex.ru; ORCID: 0000-0002-1111-2441;
SPIN-код: 5258-9555
Aleksandr V. Sidorov – Dr. Sci. (Med.), Yaroslavl State Medical University, Sechenov First Moscow State Medical University (Sechenov University). E-mail: alekssidorov@yandex.ru;
ORCID: 0000-0002-1111-2441; SPIN code: 5258-9555
Лилеева Елена Георгиевна – канд. мед. наук, доц., зав. базовой каф. инновационной фармации ФГБОУ ВО ЯГМУ.
E-mail: elileeva2006@yandex.ru
Elena G. Lileeva – Cand. Sci. (Med.), Yaroslavl State Medical University. E-mail: elileeva2006@yandex.ru
Поступила в редакцию: 22.08.2024
Поступила после рецензирования: 27.08.2024
Принята к публикации: 29.08.2024
Received: 22.08.2024
Revised: 27.08.2024
Accepted: 29.08.2024
Multi-component herbal medicines rationality for cough treatment in children using the example of a syrup with ten medicinal plant extracts
Aleksandr V. Sidorov1,2, Elena G. Lileeva11 Yaroslavl State Medical University, Yaroslavl, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
alekssidorov@yandex.ru
Abstract
In pediatric practice, when respiratory infections occur if cough is non-productive due to small amount of viscous sputum, it may be preferable to use natural medicines that are not only expectorants, but also have other positive effects such as anti-inflammatory, broncholytic, antimicrobial etc. These medicines include multi-component herbal medicines, such as Doctor Mom® syrup. The review highlights the beneficial and side effects of the herbal extracts in the preparation, discusses the mechanisms of their action, analyses the rationality of their combination and provides the results of clinical trials in children.
Keywords: cough, herbal medicines.
For citation: Sidorov A.V., Lileeva E.G. Multi-component herbal medicines rationality for cough treatment in children using the example of a syrup with ten medicinal plant extracts. Clinical review for general practice. 2024; 5 (8): 125–138 (In Russ.). DOI: 10.47407/kr2024.5.8.00470
Введение
Лидирующей причиной острого кашля у детей остается острая респираторная инфекция [1]. Фармакологические подходы к управлению кашлем включают применение смягчающих средств (ингаляции, эфирные масла) и противокашлевых препаратов при сухом кашле и отхаркивающих (мукоактивных) средств – при влажном, в том числе малопродуктивном кашле. Вместе с тем на ранних стадиях инфекционного процесса выбор подходящего средства не всегда очевиден, в особенности если речь идет о самолечении с помощью препаратов безрецептурного отпуска. В подобной ситуации комбинированные фитопрепараты, обладающие несколькими эффектами, призваны облегчить подбор терапии и оказать комплексное воздействие на патологический процесс.Пожалуй, найдется не много фармакотерапевтических групп, столь же богатых фитопрепаратами, как группа противокашлевых и отхаркивающих средств. Несмотря на тысячелетнюю проверку временем, использование лекарственных растений для лечения кашля не всегда имеет надежную научную основу и убедительную клиническую доказательность [2]. Проблема осложняется тем, что современная фитотерапия, выросшая из народной медицины, вобрала в себя западные и восточные практики врачевания травами, различающиеся традициями использования одних и тех же лекарственных растений и принципами их сочетания. С другой стороны, изучение фитотерапии, и тем более специальных фармацевтических дисциплин, по большей части остается за рамками основной программы подготовки врачей, обусловливая недостаток знаний и неуверенность в вопросах эффективности и безопасности растительных препаратов. Это, в свою очередь, порождает неприятие и необоснованный скепсис в отношении фитопрепаратов как таковых. Между тем растения остаются богатейшим источником фармакологически активных веществ, многие из которых уже применяются в качестве самостоятельных препаратов или явились прообразом для синтеза усовершенствованных молекул, но потенциал этого источника с точки зрения создания новых лекарств далеко не раскрыт.
Одним из популярных средств для лечения кашля является растительный сироп Доктор Мом®. Он содержит сухие экстракты из 10 лекарственных растений и левоментол в качестве активных компонентов. Многокомпонентность состава, определяющая спектр терапевтических эффектов, обусловливает показания к применению препарата: у взрослых и детей в возрасте от 3 лет для симптоматической терапии острых и хронических заболеваний дыхательных путей, сопровождающихся сухим кашлем или кашлем с трудноотделяемой мокротой (фарингит, ларингит, в том числе «лекторский», трахеит, бронхит).
Фармакологическая активность растительных экстрактов сиропа
У каждого входящего в состав препарата лекарственного растения известно несколько фармакологических эффектов, используемых в различных терапевтических областях, в том числе в народной медицине с древнейших времен. Для целей данной публикации ограничимся только эффектами, имеющими отношение к терапии кашля инфекционного генеза, с точки зрения подтверждения их наличия в исследованиях, раскрытия возможных механизмов и безопасности.
Солодка голая (Glycyrrhiza glabra)
Солодка голая известна также под названием лакрица или лакричник. В качестве растительного сырья используют корни растения, богатые активными компонентами: тритерпеновыми сапонинами, в том числе обладающим сладким вкусом глицирризином – калиевой или кальциевой соли глицирризовой (глицирризиновой) кислоты; флавоноидами, представленными преимущественно производными ликвиритигенина и изоликвиритигенина и пр. [3].Солодка оказывает отхаркивающее действие и слабый противокашлевый эффект (как результат смягчающего действия на слизистую оболочку респираторного тракта). Данные эффекты связаны главным образом с глицирризиновой кислотой, образующейся из глицирризовой под влиянием кишечной микробиоты. Глицирризиновая кислота действует как прямой мукоретик, стимулируя выработку жидкой части мокроты; кроме того, она усиливает сокращение мышц бронхов и облегчает выведение мокроты; попутно уменьшается раздражение слизистой бронхов, что способствует ослаблению кашля [4].
В терапии инфекционного кашля могут быть также актуальны противовоспалительный, антиоксидантный, иммуномодулирующий и противомикробный эффекты солодки. Противовоспалительные свойства связывают с кортикостероидоподобным действием глицирризиновой кислоты, проявляющимся в том числе ингибированием активации ядерного фактора каппа-би (NF-κB) и экспрессии провоспалительных генов, блокадой образования индуцибельной NO-синтазы (iNOS) и циклооксигеназы-2 (ЦОГ-2) [5, 6]. Помимо этого, у флавоноида изоликвиритигенина также показана способность подавлять образование провоспалительных факторов iNOS, ЦОГ-2, фактора некроза опухоли α (ФНО-α), интерлейкина 6 (ИЛ-6) и ИЛ-1β за счет ингибирования активации сигнальных путей Notch1/NF-κB и MAPK (митоген-активированной протеинкиназы) [7]. Антиоксидантная активность солодки обусловливает ингибирование перекисного окисления липидов и образования активных форм кислорода нейтрофилами в очаге воспаления [8]. Значимую антиоксидантную активность обеспечивают многочисленные полифенольные соединения, среди которых ликохалконы B и D, изофлавоны глабридин, гиспаглабридин A и др.
Иммуномодулирующее действие солодки проявляется в стимуляции фагоцитоза и синтеза интерферонов макрофагами [3], усилении лейкопоэза, подавлении реакции гиперчувствительности замедленного типа [9]. На модели овальбумининдуцированной бронхиальной астмы у мышей показано, что глицирризин ингибировал экспрессию воспалительных цитокинов ИЛ-4, ИЛ-5 и ИЛ-13, стимулировал продукцию интерферона гамма, регулируя баланс Th1/Th2-цитокинов, и, кроме того, способствовал увеличению количества Treg, подавлению рекрутинга эозинофилов и избыточной продукции моноцитов, уменьшая интенсивность воспаления дыхательных путей и гиперреактивность бронхов [10].
Противомикробные эффекты экстрактов различных частей солодки установлены in vitro в отношении некоторых грамположительных бактерий и грибков Candida [11, 12]. Кроме того, глицирризин эффективнее рибавирина, 6-азоуридина и других синтетических агентов ингибировал пролиферацию клинических изолятов коронавируса, выделенных от пациентов с тяжелым острым респираторным синдромом (SARS) [13], а также подавлял гиперэкспрессию провоспалительных хемокинов CXCL10 и CCL5 и цитокина ИЛ-6, индуцированную высокопатогенным штаммом H5N1 гриппа А в макрофагах человека наряду с ингибированием апоптоза клеток, но не влиял на репликацию самого вируса [14].
Применение препаратов солодки в терапевтических дозах считается безопасным, но рекомендуется избегать употребления солодки во время беременности. Согласно финскому эпидемиологическому исследованию [15], у детей, чьи матери во время беременности употребляли более 500 мг глицирризина в неделю, в подростковом возрасте были хуже результаты IQ-тестов, память и в 3,3 раза выше вероятность наличия синдрома дефицита внимания с гиперактивностью, а у девочек, кроме того, отмечалось более раннее половое созревание по сравнению с детьми, матери которых во время беременности употребляли ≤249 мг глицирризина в неделю.
Фиксируемые случаи побочных эффектов связаны не с экстрактом солодки, а с приемом избыточных доз чистой глицирризиновой кислоты, например, со сладостями и напитками, а также при курении курительных смесей [16]. Нежелательные эффекты лекарственных препаратов глицирризиновой кислоты также могут вносить вклад в общую статистику. Максимальная доза глицирризиновой кислоты, согласно рекомендациям Всемирной организации здравоохранения, не должна превышать 100 мг/сут [17]. Патогенез клинических проявлений интоксикации глицирризиновой кислотой связан с ингибированием 11β-гидроксистероиддегидрогеназы 2-го типа и избыточной продукцией минералокортикоидов – развитием синдрома псевдогиперальдостеронизма [18]. Наиболее часто возникают повышение артериального давления, задержка натрия и воды, гипокалиемия и метаболический алкалоз [19]. Жизнеугрожающие симптомы в виде аритмий, паралича скелетной мускулатуры, рабдомиолиза и нарушения сознания возникают редко [20]. Кроме того, глицирризиновая кислота способна в незначительной степени ингибировать продукцию андрогенов, а флавоноиды и изофлавоноиды солодки проявляют эстрогеновую активность. Флавоноид изоликвиритигенин может замедлять моторику кишечника [18].
Юстиция сосудистая (Adhatoda vasiсa)
В качестве растительного сырья используют листья, корни, цветки, кору. Основными активными компонентами являются алкалоиды хиназолинового ряда: вазицин, вазицинол, вазицинон, адатонин, пеганин и пр. [21].На протяжении тысячелетий адатода васика использовалась в качестве главного лекарственного средства практически при всех заболеваниях дыхательных путей благодаря разнообразию эффектов: бронхолитическому, противокашлевому, мукоактивному, противовоспалительному, антиоксидантному, противомикробному [22].
Бронхолитический эффект адатоды васики, неоднократно продемонстрированный в экспериментах с аллергениндуцированной бронхообструкцией, обусловлен активностью алкалоидов вазицина и вазицинона [23]. Отхаркивающее действие также оказалось связано с вазицином, ставшим прототипом для создания бромгексина и амброксола [24]. Противокашлевая активность спиртового экстракта адатоды васики в модельных экспериментах на мышах была сопоставима с таковой у кодеина и, по мнению авторов, вторична по отношению к мукоретическому действию (т.е. эффекту, опосредуемому вазицином) [25]. В другом исследовании изучался противокашлевой эффект водных извлечений полисахаридных фракций (арабиногалактана) адатоды, солодки и ашваганды на морских свинках [26]. Эффективность арабиногалактанов также не уступала кодеину, но в этом случае авторы связывают противокашлевое действие не столько со стимуляцией секреции мокроты, сколько с мукоадгезивными свойствами полисахаридов, формированием защитного слоя на слизистой дыхательных путей (по крайней мере, верхних отделов), а также со стимуляцией саливации, что в итоге снижает чувствительность кашлевых рецепторов и подавляет кашель.
Противовоспалительный эффект адатоды васики может быть связан с двойным ингибированием метаболизма арахидоновой кислоты по циклооксигеназному (ЦОГ) и липооксигеназному (ЛОГ) пути, как было установлено при исследовании водного экстракта растения [27]. Умеренная антиоксидантная активность установлена в дифенилпикрилгидразиловом тесте у этанольного экстракта листьев адатоды васики [28] и вазицина ацетата [29], а также на модели астмы у вазицина [30].
В нескольких in vitro исследованиях показана антимикробная активность разных извлечений из листьев адатоды васики в отношении Staphylococcus aureus, Staphylococcus epidermidis, Klebsiella pneumoniae и ряда других грамотрицательных бактерий, а также Candida albicans [29, 31, 32]. Кроме того, обнаружена выраженная способность спиртового экстракта листьев адатоды васики, наряду с экстрактами пяти других восточных растений, препятствовать образованию биопленок Chromobacterium violaceum (anti-quorum sensing-эффект) [33].
Фитопрепараты адатоты васики, как правило, хорошо переносятся; об истинной частоте связанных с ее применением нежелательных реакций судить сложно ввиду многокомпонентности состава препаратов. В трех клинических исследованиях комбинированных препаратов, содержащих адатоду васику, с общим числом участников 130 человек серьезных нежелательных эффектов зафиксировано не было [34].
Применение препаратов адатоды васики во время беременности противопоказано. Вазицин обладает утеротонической активностью, по некоторым данным, сопоставимой с эффектом окситоцина и связанной с высвобождением простагландинов [24]. Наличие 100% абортивного эффекта экстрактов адатоды васики подтверждено не только в экспериментальных исследованиях, но и практикой использования листьев растения в индийской провинции для прерывания беременности [35, 36].
Имбирь лекарственный (Zingiber officinale)
Используют корневища растения, из которых получают эфирное масло (1–4% массы) и олеосмолу (3–11% массы). Эфирное масло имбиря богато сесквитерпенами (α- и β-зингиберены, куркумены, β-сесквифеландрен, β-бисаболен, α- и β-фарнезены, зингиберол и др.) и, в меньшей степени, монотерпенами (гераниол, линалоол, борнеол, гераниаль, гераниацетат, изоборнеол), придающими корневищу характерный запах.В олеосмоле накапливаются фенольные соединения (гингеролы и шогаолы), жирные кислоты и некоторые компоненты эфирного масла [37].
Имбирь обладает сильными противокашлевым и отхаркивающим эффектами, за развитие которых отвечают гингеролы и шогаолы. Кроме того, оказывает противовоспалительное, антиоксидантное и иммуномодулирующее действие [38]. Считается, что противовоспалительное действие имбиря, как и у адатоды васики, обусловлено двойной блокадой ЦОГ-2 и 5-ЛОГ. Также было показано антицитокиновое действие экстрактов имбиря и отдельных компонентов in vitro и in vivo [39]. Кроме того, определенное значение имеет антиоксидантное действие, обусловленное высоким содержанием фенольных соединений; при этом наибольшим антиоксидантным и противовоспалительным эффектом обладал 6-шогаол благодаря наличию α-, β-ненасышенной кетоновой связи [40]. Моно- и сесквитерпены (в особенности куркумены) и фенольные соединения обеспечивают проявление у экстрактов имбиря (различные растворители) антимикробной активности в отношении S. aureus и более слабой – против грамотрицательной флоры (Klebsiella spp., Enterococcus spp. и др.) [41, 42].
Из результатов клинических исследований известно о безопасности употребления внутрь 500–1000 мг имбиря в сутки; в этих количествах нежелательные эффекты возникают редко и в основном проявляются желудочно-кишечным дискомфортом [43]. Отдельные компоненты (6-, 8- и 10-гингеролы и 6-шогаол) были безопасны при приеме здоровыми добровольцами в дозе до 2000 мг/сут [44]. В случае употребления более 4–6 г имбиря в день могут появляться симптомы раздражения слизистой оболочки рта, желудка, изжога, диарея; при длительном приеме больших доз имбиря возможны повышение чувствительности глаз к яркому свету, высыпания на коже лица [37]. Применение препаратов имбиря при беременности и лактации возможно после консультации с врачом (имбирь часто используется как противорвотное средство при токсикозе беременности). В доклинических исследованиях тератогенного действия экстрактов имбиря не выявлено [45].
В недавнем исследовании [46] была установлена ингибирующая активность экстракта имбиря и отдельных его компонентов (в частности, 6-гингерола и 6-шогаола) в отношении изоферментов цитохрома Р450 CYP3A4, 2C9, 1A2, и 2B6, а также АТФ-связывающих транспортных белков – гликопротеина Р (ABCB1/P-gp) и белка резистентности рака молочной железы (ABCG2/BCRP). Это требует внимания при прогнозировании взаимодействий имбиря (в том числе как пищевого продукта) с лекарствами-субстратами CYP, P-gp и BCRP.
Девясил кистецветный (Inula racemosa)
Используют корневища и корни растения. Основными активными компонентами являются бициклические сесквитерпеновые лактоны с преобладанием алантолактона и изоалантолактона (всего известно более 20), инулин, фенольные соединения, в том числе флавоноиды и пр. [47].В восточной медицине девясил обычно используется как отхаркивающее средство и бронхолитик [48, 49]. Бронхолитические (противоастматические) свойства экстрактов девясила продемонстрированы в экспериментальных и клинических исследованиях [50]. Противокашлевое действие алантолактона и изоалантолактона в экспериментах на морских свинках оказалось слабее, чем у кодеина, примерно в 2 раза [51].
Кроме того, представляет интерес противовоспалительное, антиоксидантное, и противомикробное действие девясила [52, 53]. Спиртовой и водный экстракты корневищ с корнями девясила проявляли противовоспалительный эффект, не уступающий в модельных экспериментах препаратам сравнения ацетилсалициловой кислоте и индометацину в эквивалентных дозах [54, 55]. Показано, что противовоспалительная активность алантолактона опосредована ингибированием продукции хемокинов за счет нарушения фосфорилирования STAT1 (трансдуктора сигнала и активатора транскрипции 1-го типа) [56, 57]. Кроме того, алантолактон блокирует iNOS и ЦОГ-2 и индуцированную ФНО-α активацию внутриклеточных провоспалительных путей
NF-κB и MAPK [58]. Антиоксидантные свойства экстрактов девясила подтверждались разными авторами, причем у сесквитерпеновых лактонов они даже более выражены, чем у α-токоферола и убихинона [51, 59, 60].
Водный экстракт корневищ с корнями девясила подавлял рост S. aureus и Escherichia coli в минимальной подавляющей концентрации (МПК) соответственно 6,25 мг/мл и 12,5 мг/мл в диско-диффузионном методе; спиртовой экстракт продемонстрировал меньшую активность [61]. Методом диффузии в агар также определялось умеренное подавляющее действие алантолактона на рост S. aureus, K. pneumoniae, E. coli и некоторых других грамотрицательных бактерий [62].
Девясил признан нетоксичным для медицинского применения, хотя необходимы дополнительные исследования его компонентов, сесквитерпеновых лактонов, на предмет хронической токсичности, в особенности генотоксичности и эмбриотоксичности [63]. Девясилу, как представителю астровых (сложноцветных), свойственно вызывать аллергический контактный дерматит. Роль гаптена выполняют, по-видимому, сесквитерпеновые лактоны, причем изоалантолактон выступает в качестве сенсибилизатора [64]. Необходимо также учитывать свойства алантолактона и изоалантолактона как фитоэстрогенов [65].
Куркума длинная (Curcuma longa)
В качестве растительного сырья используют корневища растения. В них накапливаются основные активные компоненты: полифенольные куркуминоиды (преобладающий – куркумин – обусловливает привычный желтый цвет куркумы), эфирное масло (доминируют сесквитерпены, в том числе тумерон, атлантон, зингиберон и др.) и пр. [66].В терапии кашля полезными могут быть противовоспалительный, антиоксидантный, противомикробный, бронхолитический и иммуномодулирующий эффекты куркумы [67].
В экспериментальных исследованиях установлен комплексный механизм противовоспалительного действия куркумина: ингибирование фосфолипазы, 5-ЛОГ, ЦОГ-2, iNOS и, соответственно, подавление продукции провоспалительных медиаторов – лейкотриенов и простагландинов, оксида азота, ограничивающее альтеративную и экссудативную фазы воспаления. Помимо этого куркумин способен ингибировать коллагеназу, эластазу, гиалуронидазу, уменьшать образование моноцитарного хемоаттрактантного протеина 1-го типа (MCP-1), ФНО-α, ИЛ-12, ограничивая хроническое воспаление [68].
Антиоксидантные свойства куркумы и отдельно полифенольного соединения куркумина, ослабляющие интенсивность оксидативного стресса в патогенезе воспалительных заболеваний, подтверждены в многочисленных экспериментальных исследованиях и обобщены в обзорах [69].
Иммуномодулирующий защитный эффект куркумина показан в экспериментальных исследованиях с острым поражением легких бактериальным липолисахаридом [70], S. aureus [71] и K. pneumoniae [72]: отмечались уменьшение повреждения легочной ткани и накопления в ней нейтрофилов и провоспалительных цитокинов, снижение продукции малонового диальгедида, активности миелопероксидазы, а также усиление эффекта антибиотиков.
Куркумин в составе композитных частиц с оксидом графена препятствовал заражению культуры ткани респираторно-синцитиальным вирусом посредством прямой инактивации и нарушения адгезии вируса к клеткам, оказывая профилактический и терапевтический эффект при респираторно-синцитиальной инфекции [73]. Показана также активность куркумина против вируса гриппа А in vitro (ингибирование репликации вируса на клеточной линии рака легкого человека A549) и in vivo (уменьшение тяжести инфекции на мышиной модели, в том числе за счет индукции синтеза гемоксигеназы-1 и ингибирования продукции провоспалительных цитокинов в макрофагах вследствие прерывания сигнального пути NF-κB) [74].
Эффективность куркумина в дополнение к рекомендованной терапии инфекции COVID-19 легкой и средней тяжести у госпитализированных пациентов (n=76, средний возраст 54 года) оценивалась в иранском двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании [75]. Модифицированный куркумин в биодеградируемых наномицеллах (нанокуркумин) с улучшенной растворимостью, стабильностью и биодоступностью назначался в капсулах по 40 мг 4 раза в день в течение 2 нед. По сравнению с плацебо куркумин способствовал статистически значимому уменьшению частоты кашля, астении, миалгии, потребности к кислородной поддержке и одышки; кроме того, средний прирост SpO2 на фоне терапии куркумином был выше, чем в группе плацебо. Авторы пришли к выводу о том, что противовоспалительная активность нанокуркумина потенцирует эффект стандартной терапии COVID-19, способствуя восстановлению после острой воспалительной фазы заболевания у госпитализированных пациентов с легкой и средней степенью тяжести заболевания. В другом плацебо-контролируемом исследовании нанокуркумин, назначавшийся пациентам с COVID-19 в капсулах по 40 мг 4 раза в день в течение 2 нед, способствовал уменьшению экспрессии (копий мРНК из мононуклеаров крови) и секреции (концентрации в крови) ИЛ-6 и ИЛ-1β, что среди прочего может объяснять положительное влияние куркумина на течение заболевания [76].
Бронхолитический эффект водно-спиртового экстракта куркумы, сопоставимый с теофиллином, продемонстрирован в эксперименте с индуцированной метахолином и калием хлоридом констрикцией гладких мышц трахеи у крыс; причем на развитие релаксирующего эффекта не влияли пропранолол, дилтиазем,
L-NAME (ингибитор NO-синтазы), глибенкламид и атропин, хлорфенирамин, индометацин, папаверин [77]. Отдельно куркумин показал ингибирующее действие на развитие воспаления дыхательных путей и бронхоконстрикцию на модели бронхиальной астмы у мышей [78].
В нескольких небольших клинических исследованиях оценивали эффект добавления куркумина к стандартной терапии на течение бронхиальной астмы. Так, в одном из исследований (n=60) дополнительный прием 500 мг куркумина в капсулах дважды в день на протяжении 30 дней у пациентов с легкой и среднетяжелой астмой способствовал значимо большему приросту объема форсированного выдоха за 1-ю секунду (ОФВ1) по сравнению с группой стандартной терапии [79]. Аналогичный результат отмечался в исследовании у пациентов с бронхиальной астмой и ожирением (n=40), принимавших куркумин в капсулах по 750 мг дважды в день в течение 2 мес, достигших более выраженного улучшения функциональных показателей ОФВ1 и ОФВ1/форсированная жизненная емкость легких по сравнению с группой стандартной терапии [80]. Терапевтический эффект куркумина у пациентов с бронхиальной астмой можно объяснить проявлением противовоспалительной и иммуномодулирующей активности вещества.
На основании экспериментальных и клинических данных куркумин считается безопасным в дозе до
8 г/сут [81]. Куркума и куркумин не вызывали тератогенных и мутагенных эффектов у беременных самок животных, однако для окончательных выводов необходимы дополнительные исследования у человека [82].
В чрезмерных количествах куркумин может вызывать желудочно-кишечные расстройства, стимулировать сокращение матки при беременности, нарушать усвоение железа, снижать свертываемость крови, уменьшать продукцию тестостерона у мужчин и подвижность сперматозоидов [81].
Алоэ настоящее (Aloë vera), или алоэ барбадосское
В качестве растительного сырья используют листья, сок и мякоть. Основными активными компонентами являются антрахиноны, в основном алоины А и B, барбалоин (15–40%), алоэ эмодин; фитогормоны, такие как гиббереллины и ауксины; сапонины – лупеол и пр. [83].Алоэ оказывает противовоспалительное, антиоксидантное, иммуномодулирующее и противомикробное действие [84]. В ранних работах показана способность водного экстракта алоэ ингибировать ЦОГ и синтез простагландина Е2, оказывая противовоспалительное действие на модели каррагинанового отека лапы у крыс [85], что впоследствии было подтверждено на биоптатах воспаленной слизистой оболочки ободочной и толстой кишки [86]. Установлено также, что лупеол модулирует активность глюкокортикоидных рецепторов, что дополнительно способствует уменьшению воспаления. Кроме того, водный экстракт алоэ снижал продукцию металлопротеиназы-9 в мононуклеарах периферической крови in vitro [87]. Антиоксидантная активность экстрактов алоэ и отдельных компонентов продемонстрирована в многочисленных исследованиях in vitro и in vivo [88]. Иммуномодулирующий эффект проявляется в повышении активности макрофагов и стимуляции лейкопоэза и связан с полисахаридами алоэ (в частности, ацеманнаном) [89]. Антибактериальное действие препаратов алоэ обнаружено in vitro в отношении бактерий
S. aureus, Streptococcus pyogenes, Pseudomonas aeruginosa, E. coli и др. [90, 91]. Отдельные компоненты алоэ проявляли противовирусные свойства, например, лектины ингибировали пролиферацию цитомегаловирусов в клеточной культуре, алоэ эмодин инактивировал вирусы простого герпеса 1 и 2-го типов, варицелла-зостер и гриппа [84]. Установлена также противогрибковая эффективность водных экстрактов алоэ в отношении C. albicans [91].
Системное действие препаратов алоэ в терапевтических дозах может сопровождаться индивидуальными реакциями повышенной чувствительности, раздражением слизистой желудка, спазмами желудка, повышением моторики желудочно-кишечного тракта, слабительным эффектом и электролитными нарушениями. Стимуляция моторики желудочно-кишечного тракта и слабительное действие связано в основном с алоином (барбалоином) [92]. Не рекомендуется системное применение препаратов алоэ во время беременности ввиду риска сокращений матки [90].
Перец кубеба (Piper cubeba), или хвостатый перец
В качестве растительного сырья используют плоды. Основными активными компонентами являются лигнаны (в том числе кубебин, хинокинин), алкалоиды (в том числе пиперин), эфирное масло [93]. Как пряность перец кубеба играет важную роль в кухне разных культур. Он имеет своеобразный аромат, напоминающий камфору и перечную мяту.Перец кубеба обладает противовоспалительным, антиоксидантным, антибактериальным действием [94]. Аналогично другим рассмотренным растениям противовоспалительный эффект кубебы обусловлен комплексным механизмом. Спиртовой экстракт ингибировал активность ЦОГ-1 и ЦОГ-2, 5-ЛОГ, а также уменьшал образование ИЛ-6 (как показано на моноцитах линии THP-1, стимулированных бактериальным липополисахаридом) [95]. Противовоспалительная активность перца кубебы связана как с лигнанами, так и с алкалоидами [96, 97].
Мощную антиоксидантную активность проявляют лигнаны [98] и компоненты эфирного масла плодов кубебы эвгенол и метилэвгенол [99].
Экстракты плодов перца кубебы проявляли высокую антибактериальную активность in vitro в отношении мультирезистентных Enterococcus spp. и умеренную – против E. coli и P. aeruginosa [100]. В исследовании
P. Ahirrao и соавт. полученные с помощью метанольной экстракции из плодов перца кубебы соединения пеллиторин, сезамин, пипериновая кислота и тетрагидропиперин снижали МПК эритромицина для S. aureus (штамм RN4220) в 2–8 раз за счет ингибирования эффлюксной помпы MsrA [101]. В другом исследовании эфирное масло из плодов перца кубебы ингибировало рост метициллинорезистентных штаммов S. aureus – MRSA (штамм ATCC 43300) в МПК 50 мкг/мл, причем с помощью трансмиссионного электронного микроскопа подтверждались серьезные повреждения бактериальных клеток [102]. В то же время в концентрации 25 мкг/мл (0,5 МПК) не возникало различимых на микроскопическом уровне изменений клеток MRSA, однако при рассмотрении в атомно-силовой микроскоп (наноуровень) определялись нарушения клеточной стенки и цитоплазматической мембраны бактерий, что говорит о возможном механизме антимикробного действия активных компонентов эфирного масла перца.
Установлено, что спиртовой экстракт перца кубебы обладает антиэстрогеновым действием: он значимо ингибировал стимулируемый β-эстрадиолом рост клеток рака молочной железы человека in vitro. Данный эффект был обусловлен как блокадой эстрогеновых рецепторов (рекомбинантных человеческих типа α и β), так и ингибированием ароматазы (отвечает за метаболизм андрогенов в эстрогены) [95].
T. Usia и соавт. было показано, что 5 лигнанов, выделенных из перца кубебы, оказывают очень сильное ингибирующее действие на CYP3A4: значения IC50 составили 0,44–1,0 мкмоль и были сопоставимы с IC50 контрольного ингибитора кетоконазола – 0,72 мкмоль [103].
Терминалия беллирийская (Terminalia bellirica)
В медицинских целях используют плоды растения, содержащие активные компоненты: гликозиды (преимущественно беллериканин), таннины, флавоноиды, терпеноиды, а также стеролы, лигнаны, сапонины и пр. [104].Обладает бронхолитическим, антибактериальным, иммуномодулирующим, противовоспалительным, антиоксидантным эффектами [105].
Бронхолитический эффект экстрактов терминалии обусловлен антихолинергической и антикальциевой активностью [106].
Водный и метанольный экстракты плодов терминалии подавляли рост S. aureus, демонстрируя высокую активность in vitro [107]. Была установлена способность метанольного экстракта терминалии беллирийской наряду с экстрактами имбиря, чеснока и других растений ингибировать β-лактамазу in vitro [108]. Более того, водные и метанольные экстракты плодов терминалии беллирийской проявляли антибактериальную активность (МПК 0,25–4 мг/мл) против MRSA, мультирезистентных Acinetobacter spp., P. aeruginosa и E. coli, продуцирующих β-лактамазы расширенного спектра [109]. В этом же исследовании, сравнивая антиоксидантную активность различных извлечений, авторы обнаружили, что наибольшим антиоксидантным и антибактериальным потенциалом обладал метанольный экстракт плодов терминалии. Выраженная антиоксидантная активность экстрактов плодов терминалии объясняется высоким содержанием фенольных соединений, в особенности галловой и феруловой кислот [110]. Показана их способность стимулировать экспрессию антиоксидантных ферментов, в том числе гемоксигеназы, каталазы, НАДФ-хинон-оксидоредуктазы 1 [111].
Противовоспалительная активность терминалии беллирийской связана с подавлением экспрессии генов NF-κB, ФНО-α, ИЛ-6, ЦОГ-2, а также с прямым ингибированием активности ЦОГ-2, 5-ЛОГ, iNOS, миелопероксидазы и снижением продукции провоспалительных цитокинов, метаболитов арахидоновой кислоты, активных форм кислорода и оксида азота (II) [112].
Иммуномодулирующее действие метанольного экстракта терминалии in vitro проявлялось в стимуляции фагоцитарной активности и пролиферации Т- и B-лимфоцитов и продукции лимфоцитарных цитокинов [113].
В исследованиях острой, подострой и хронической токсичности различных экстрактов плодов терминалии беллирийской негативного действия не выявлено [114, 115].
Базилик cвященный (Ocimum sanctum)
В качестве растительного сырья используют листья, семена и целое растение [116]. Листья богаты эфирным маслом с терпеноидами, фенолами, флавоноидами и пр. Семена содержат жирное масло с триглицеридами, в которых преобладает линоленовая кислота, а также стероиды, полисахариды, слизи и пр. [117]. В терапии кашля актуально антимикробное, иммуномодулирующее, противовоспалительное и антиоксидантное действие компонентов базилика [118].В исследованиях in vivo изучена противовоспалительная активность различных извлечений корня базилика, обладавших также дозозависимым анальгетическим и жаропонижающим действием без каких-либо проявлений токсичности в дозах до 2000 мг/кг массы тела при пероральном введении [119]. За реализацию антиоксидантного и противовоспалительного действия базилика отвечают фенольные соединения (эвгенол, галловая, кофеиновая, хлорогеновая, розмариновая кислоты и их производные, флавоноиды). Показано, что антиоксидантная активность ряда фенольных компонентов базилика проявляется в микромолярных концентрациях и не уступает или даже превосходит активность витамина Е и синтетических антиоксидантов трет-бутилгидрохинона и бутилгидрокситолуол на различных моделях [120, 121]. В то же время в миллимолярных концентрациях фенольные соединения продемонстрировали ингибирование ЦОГ-1 и ЦОГ-2 на 37–97% (максимально – эвгенол), сопоставимое с эффектом микромолярных концентраций ибупрофена, напроксена, ацетилсалициловой кислоты [120]. Помимо фенольных соединений, способность нейтрализовывать свободные радикалы кислорода и хелатировать ионы железа обнаруживалась у полисахаридов из листьев базилика [122].
Флавоноид ориентин (400 мг/мл) подавлял рост S. aureus и K. pneumonia – максимальная зона ингибирования составляла соответственно 18,04 и 16,11 мм; при этом его активность усиливалась виценином (400 мг/мл) [123]. Эфирное масло базилика (основной компонент – эвгенол, 74,83%) проявляло антимикробную активность in vitro в отношении мультирезистентных S. aureus и E. coli: отмечалась задержка лаг-фазы для обоих патогенов, в особенности S. aureus, и сокращение вдвое роста E. coli; МПК для большинства штаммов составляла 1 мг/мл [124]. Кроме того, авторы сообщили о значимой редукции массы биопленок S. aureus и E. coli и снижении жизнеспособности бактериальных клеток под воздействием эфирного масла базилика.
На модели куриных эмбрионов установлена высокая противовирусная активность экстракта листьев базилика и терпеноидной фракции в отношении вируса гриппа А H9N2 [125].
In vivo исследования иммуномодулирующего эффекта водного и спиртового экстрактов листьев базилика свидетельствуют о стимуляции реакций адаптивного (продукция антител, гиперчувствительность замедленного типа) и врожденного (функция фагоцитов, активность лизоцима) иммунитета [126–128].
Несколько клинических исследований подтверждают иммуномодулирующее действие экстракта базилика священного. В частности, в рандомизированном двойном слепом плацебо-контролируемом перекрестном исследовании с участием 24 здоровых добровольцев усиление иммунного ответа на фоне 4-недельного ежедневного приема 300 мг спиртового экстракта листьев базилика в капсулах в сравнении с плацебо проявлялось значимым увеличением концентрации интерферона-γ, ИЛ-4, относительного количества Т-хелперов и NK-клеток [129].
Систематический обзор 24 клинических исследований не выявил серьезных нежелательных явлений при приеме экстрактов базилика взрослыми пациентами с различными хроническими заболеваниями; лишь в одном исследовании (n=16) фиксировалось несколько случаев тошноты при употреблении экстракта листьев базилика в капсулах по 250 мг дважды в день [130].
Паслен индийский (Solanum indicum)
В качестве сырья используют плоды, семена и корни растения [131]. Основными активными компонентами являются стероидные алкалоиды/гликоалкалоиды (соласодин, соланидин, соласонин, соламаргин, соланин), фитостеролы и пр. [132].Среди эффектов паслена индийского интерес представляют противовоспалительный, антиоксидантный и антибактериальный [133].
Метанольный экстракт плодов паслена индийского (250 и 500 мг/кг массы тела перорально) проявлял анальгетическое (несколько превосходящее эффект ацетилсалициловой кислоты 100 мг/кг массы тела перорально), противовоспалительное (сопоставимое с эффектом диклофенака натрия 1 мг/кг массы тела перорально) и жаропонижающее (сопоставимое с эффектом парацетамола 150 мг/кг массы тела перорально) действие в модельных экспериментах in vivo [134].
Метанольный экстракт плодов паслена индийского продемонстрировал сопоставимый с бутилгидрокситолуолом антиоксидантный эффект при применении в одинаковых концентрациях in vitro [135].
Спиртовые экстракты листьев паслена индийского показали умеренную антибактериальную активность in vitro против S. aureus [136], Corynebacterium diphtheriae, Streptococcus spp., Bacillus spp., Pseudomonas spp. [137].
Исследования острой токсичности спиртового экстракта плодов паслена индийского продемонстрировали безопасность его высоких доз [135].
Левоментол
Еще одним активным компонентом сиропа является левоментол. Он представляет собой L-изомер ментола – наиболее стабильного и распространенного в природе изомера ментола. Его получают из эфирного масла различных видов мяты (перечной, канадской, полевой и пр.) либо синтетическим путем [138]. Ментол относится к монотерпенам и обладает противокашлевым, противовоспалительным, антиоксидантным, противомикробным (антибактериальным, противовирусным и противогрибковым) эффектами [139]. Охлаждающий эффект ментола при топическом применении и связанное с ним анальгетическое (анестезирующее) действие развивается в результате активации «холодовых рецепторов» – ионных каналов с транзиторным рецепторным потенциалом (TRP) меластатинового типа (TRPM8) [140]. Однако биологическая функция TRPM8 каналов не ограничивается лишь термочувствительностью. TRPM8 обнаружены в клетках разных тканей, включая респираторный тракт, иммунную систему, где они участвуют в регуляции секреции муцина, цитокинов, металлопротеиназ и пр. [141, 142]. Системные эффекты ментола могут также опосредоваться активацией анкириновых (TRPA1) и ваниллоидных (TRPV3) каналов, каппа-опиоидных рецепторов и блокадой потенциалзависимых кальциевых каналов L-типа [140, 143].Анализ композиции лекарственных растений в препарате в целом
Сироп Доктор Мом® является примером препарата, приготовленного в традициях аюрведической медицины, известной холистическим принципом к лечению и сохранению здорового долголетия [144]. Данный подход сам по себе предопределяет многокомпонентность состава лекарственного средства. В традиционных медицинских системах Востока все рассмотренные лекарственные растения с глубокой древности считаются полезными при кашле благодаря набору присущих им эффектов.В отличие от синтетических лекарственных препаратов, фитопрепараты невозможно четко отнести к противокашлевым или отхаркивающим из-за наличия в одном растении нескольких активных компонентов, обладающих различными фармакологическими эффектами. Например, популярная солодка обладает как противокашлевым, так и отхаркивающим эффектом [145]. Это является определенным преимуществом фитопрепаратов на ранних стадиях лечения кашля с трудноотделяемой мокротой. Кроме того, помимо противокашлевого и отхаркивающего действия, на эффективность фитопрепарата влияют дополнительные полезные эффекты – противовоспалительный, антиоксидантный, бронхолитический, иммуномодулирующий, антибактериальный, противовирусный и т.д. [2]. В случае многокомпонентного фитопрепарата отдельные экстракты, действующие однонаправленно, усиливают действие друг друга [146, 147]. Возникает феномен потенцирования – достижения выраженного итогового эффекта лекарственной комбинации от небольших доз каждого ее компонента.
Изложенные эффекты лекарственных растений обобщены в таблице. Как видно из таблицы, противомикробная, противовоспалительная и антиоксидантная активность обнаружена у всех десяти растений. Авторы не претендуют на полноту изложения всех терапевтических эффектов рассматриваемых растений. Вполне вероятно, можно найти экспериментальные исследования, подтверждающие наличие у каждого из растений более широкого спектра свойств, полезных в терапии кашля.
Другой аспект фитотерапии – безопасность. Распространенное мнение об абсолютной безопасности фитопрепаратов ошибочно: возможны нежелательные эффекты, лекарственные взаимодействия фармакокинетического и фармакодинамического типа [148]. Выше были рассмотрены вопросы безопасности применения фитопрепаратов отдельных растений и необходимые меры предосторожности.

В целом сироп Доктор Мом® является безопасным лекарственным средством, однако наличие в составе экстрактов имбиря и перца кубебы не исключает риска потенциальных взаимодействий с лекарствами-субстратами цитохрома P450 (CYP3A4, 2C9, 1A2, 2B6), а также гликопротеина Р и белка BCRP. Особую осторожность следует соблюдать у детей, получающих противоопухолевую терапию: от применения сиропа у них в большинстве случаев следует воздержаться.
Вместе с тем преимуществом фитопрепаратов с точки зрения безопасности может являться нейтрализация потенциального побочного действия за счет своих же дополнительных эффектов [149]. Например, противовоспалительный механизм всех рассмотренных выше растений опосредован ингибированием ЦОГ-1 и/или ЦОГ-2. Известно, что этот механизм ассоциируется с нежелательными реакциями со стороны желудочно-кишечного тракта, сердечно-сосудистой системы, почек при приеме нестероидных противовоспалительных препаратов. По-видимому, избегать развития данных осложнений позволяет наличие у обсуждаемых растений экспериментально подтвержденных дополнительных эффектов:
• гастроэнтеропротективного (солодка [150], алоэ [151], имбирь [152], куркума [81], терминалия беллирийская [153], базилик [118], паслен индийский [133]);
• кардиопротективного (солодка [150], алоэ [154], имбирь [155], девясил кистецветный [156], куркума [81], терминалия беллирийская [153], базилик [118], паслен индийский [133]);
• нефропротективного (алоэ [157], имбирь [158], перец кубеба [159], куркума [81], терминалия беллирийская [153]).
Считается, что в большой мере органопротективные свойства растений обусловлены антиоксидантной активностью флавоноидов и других фенольных соединений [160].
Другой пример нейтрализации нежелательных явлений в рамках многокомпонентного препарата – компенсация эстрогеновой активности солодки и девясила антиэстрогеновым эффектом перца кубебы.
Как обсуждалось выше, изучение токсичности, немногочисленные клинические исследования и опыт практического применения свидетельствуют о низкой токсичности каждого из растительных экстрактов в составе препарата. О потенциальном негативном взаимодействии между компонентами на данный момент не известно.
Результаты клинических исследований сиропа Доктор Мом®
В исследовании В.А. Иванова и соавт. [147] терапевтическую эффективность сиропа Доктор Мом® у детей с кашлем на фоне острой респираторной инфекции сравнивали с сиропом корня солодки. Интерес авторов заключался в том, насколько многокомпонентный фитопрепарат эффективнее одного из своих активных компонентов. В исследование были включены 23 ребенка 3–6 лет (в основной группе 13 детей). Режим дозирования соответствовал инструкциям по применению препаратов (по 1/2 чайной ложке 3 раза в день). Исходно у 93,3% пациентов основной группы и у 90,5% детей из группы сравнения кашель был сухой или с трудноотделяемой мокротой. Умеренное нарушение ночного сна, связанное с кашлем, отмечалось в 23,3–33,3% случаев. Установлено, что сироп Доктор Мом® способствовал более быстрой регрессии интенсивности кашля. Так, к 4-му дню терапии снижение интенсивности кашля отмечалось у 9 (69%) из 13 пациентов основной группы и только у 3 (30%) из 10 в группе сравнения (p<0,05). При этом выявлялись значимые межгрупповые различия в балльной оценке средней интенсивности кашля: 0,86±0,15 в основной группе и 0,20±0,19 в группе сравнения (p<0,05). Следует отметить, что у всех детей, продолжавших кашлять к 8-му дню лечения, интенсивность кашля была минимальной. На фоне уменьшения частоты и интенсивности кашля к 4-му дню терапии происходила нормализация ночного сна у 63,3% пациентов в основной группе и у 47,6% – в группе сравнения (p>0,05). К 8-му дню терапии нарушения ночного сна, связанные с кашлем, отмечались только у 10% детей основной группы и 9,5% детей группы сравнения, причем во всех случаях нарушения сна были минимально выражены. Отмечалась хорошая переносимость терапии; нежелательных явлений, связанных с лечением, зафиксировано не было.В другом клиническом исследовании [146] сравнивались эффективность и безопасность трех сиропов – многокомпонентного (Доктор Мом®) и монокомпонентного (экстракт листьев плюща обыкновенного) растительных и синтетического (лазолван), назначавшихся соответственно в 1, 2 и 3-й группах терапии. В исследование включены 90 детей в возрасте 3–7 лет с острым трахеобронхитом в первые 1–3 сут заболевания с симптомами кашля. Длительность терапии составляла 10 дней, дозировка препаратов соответствовала возрасту. Исследование закончили 84 ребенка. Заметное улучшение состояния пациентов отмечалось уже на 7-е сутки болезни: балльная оценка тяжести состояния снизилась примерно на треть у детей 2 и 3-й групп и почти у половины детей 1-й группы. На 14-й день от начала заболевания во всех группах наблюдалось снижение балльной оценки тяжести более чем на 70% от стартовой, что позволяет говорить об эффективности всех препаратов в исследовании. Тем не менее улучшение состояния в динамике от 1–3-го к 14-му дню болезни у детей в 1-й группе достигалось быстрее, чем во 2 и 3-й группах. Более высокая эффективность сиропа Доктор Мом® сопровождалась сопоставимой с сиропами на основе экстракта плюща и лазолвана безопасностью. Переносимость сиропа Доктор Мом® отмечена как хорошая и очень хорошая в 85% случаев врачами и в 97% – родителями больных детей. Аналогичные показатели для сиропа на основе экстракта плюща составили 80 и 87%, а для лазолвана – 80 и 71%. Анализ оценки проведенного лечения, данной родителями пациентов, показал, что они отдают предпочтение растительным препаратам по сравнению с синтетическими. При этом эффективность (97 и 71%, р=0,022) и безопасность (93 и 71%, р=0,028) сиропа Доктор Мом® была статистически значимо выше, чем у сиропа лазолвана.
Также было проведено открытое рандомизированное сравнительное клиническое исследование [161] терапевтической эффективности и переносимости сиропа Доктор Мом® и сиропа корня солодки у 59 детей в возрасте 3–15 лет с острыми инфекционно-воспалительными заболеваниями дыхательных путей, сопровождающимися кашлем. В исследование включены 59 детей (в основной группе 35 пациентов). Препараты принимались в возрастных дозах в составе комплексной терапии. В обеих группах преобладали пациенты с острыми инфекционно-воспалительными заболеваниями верхних дыхательных путей. Так, острая респираторная вирусная инфекция выявлялась у 83,3% детей основной группы и 90,5% детей группы сравнения. Оба исследуемых препарата способствовали купированию кашля у подавляющего большинства пациентов к 8–12 дням наблюдения: у 84,4% в основной группе и у 80,0% в группе сравнения. При этом у детей 3–6-летнего возраста сироп Доктор Мом® значительно эффективнее и быстрее снижал интенсивность кашля по сравнению с сиропом корня солодки (р<0,05). Выявлена также тенденция к более быстрому снижению частоты кашля у детей в возрасте 3–6 лет при использовании сиропа Доктор Мом® по сравнению с сиропом корня солодки. Эффективное снижение частоты и интенсивности кашля при использовании сиропа Доктор Мом® сопровождалось более быстрой нормализацией ночного сна у детей. У 80,0% детей, получавших сироп Доктор Мом®, и у 75,1% детей, лечившихся сиропом корня солодки, выраженный отхаркивающий эффект наступал уже к 4-му дню от начала терапии. При этом у детей в возрасте 3–6 лет наблюдалась тенденция к более раннему наступлению отхаркивающего эффекта при использовании сиропа Доктор Мом® по сравнению с сиропом корня солодки. У детей в возрасте 7–15 лет статистически значимых различий в снижении частоты и интенсивности кашля и темпах проявления отхаркивающего эффекта между изучаемыми лекарственными препаратами выявлено не было. Переносимость терапии в обеих группах была хорошей, однако на фоне приема сиропа корня солодки у 2 (9,5%) детей возникли побочные эффекты (в одном случае – макуло-папулезная сыпь на коже лица и туловища, в другом – тошнота и рвота), потребовавшие отмены препарата.
Заключение
Препараты растительного происхождения характеризуются рядом преимуществ. К ним относятся мягкое терапевтическое действие, низкая токсичность, способность влиять на различные звенья патологического процесса, возможность длительного приема у больных различных возрастных групп, в том числе у детей. Сочетание нескольких компонентов в фитопрепарате расширяет спектр его фармакологической активности, позволяет достигать потенцирования полезных эффектов и нацелено на более быстрое достижение результата лечения в сравнении с монотерапией. Нежелательные эффекты, наблюдаемые при применении препаратов растительного происхождения, как правило, относятся к категории легких по степени тяжести и преходящих. Проведенные исследования свидетельствует о том, что растительный сироп от кашля Доктор Мом® является терапевтически эффективным, хорошо переносимым лекарственным средством, сочетающим в себе отхаркивающее и противокашлевое действие, обладающим дополнительными полезными эффектами, и может быть рекомендовано для лечения детей с острыми инфекционно-воспалительными заболеваниями респираторного тракта, сопровождающимися кашлем.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Сидоров Александр Вячеславович – д-р мед. наук, зав. каф. фармакогнозии и фармацевтической технологии ФГБОУ ВО
ЯГМУ, гл. науч. сотр. Федерального научно-практического центра паллиативной медицинской помощи ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: alekssidorov@yandex.ru; ORCID: 0000-0002-1111-2441;
SPIN-код: 5258-9555
Aleksandr V. Sidorov – Dr. Sci. (Med.), Yaroslavl State Medical University, Sechenov First Moscow State Medical University (Sechenov University). E-mail: alekssidorov@yandex.ru;
ORCID: 0000-0002-1111-2441; SPIN code: 5258-9555
Лилеева Елена Георгиевна – канд. мед. наук, доц., зав. базовой каф. инновационной фармации ФГБОУ ВО ЯГМУ.
E-mail: elileeva2006@yandex.ru
Elena G. Lileeva – Cand. Sci. (Med.), Yaroslavl State Medical University. E-mail: elileeva2006@yandex.ru
Поступила в редакцию: 22.08.2024
Поступила после рецензирования: 27.08.2024
Принята к публикации: 29.08.2024
Received: 22.08.2024
Revised: 27.08.2024
Accepted: 29.08.2024
Список исп. литературыСкрыть список
3 октября 2024
Количество просмотров: 453


