Клинический разбор в общей медицине №9 2024
In late March 2024, the global expert workshop on ART took place. Russian and international experts presented the most recent data and answered the critical questions arising in the practice of fertility doctors. The meeting was attended by the following experts: obstetrician-gynecologist, fertility doctor at the Next Generation Clinic network, Nikolay V. Kornilov, Head of the Reproductive Medicine Department at the Dexeus University Hospital (Grupo Dexeus, Barcelona, Spain), invited scholar at the Reproductive Medicine Department of the Ghent University (Belgium), member of the Executive Committee of the European Society of Human Reproduction and Embryology (ЕSHRE), Professor Nikolaos P. Polyzos, obstetrician-gynecologist, fertility doctor, leading researcher at the Paulsen ART Research and Clinical Department of the Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology, D Sci (Med.), Professor Irina E. Korneeva, as well as Victoria A. Popandopulo, Head of the Department of Obstetrics and Gynecology of the Maikop State Technological University, Professor at the Department of Obstetrics and Gynecology of the Faculty of General Medicine, Astrakhan State Medical University, Chief External Obstetrician-Gynecologist of the Southern Federal District, D Sci (Med.), Professor.
Keywords: transdermal estrogens, micronized progesterone, pregnancy, frozen embryo transfer.
For citation: Role of estrogens and progesterone in the assisted reproductive technology programs. Clinical review for general practice. 2024; 5 (9): 50–56. DOI: 10.47407/kr2024.5.9.00478
Сегодня криоконсервация гамет и эмбрионов значительно расширила клинические возможности и преимущества в лечении бесплодия в циклах вспомогательных репродуктивных технологий (ВРТ). Николай Валерьевич Корнилов отметил, что в последнее десятилетие резко увеличилось количество криопереносов: это связано с тем, что специалисты стараются избежать синдрома гиперстимуляции яичников, неблагоприятных неонатальных исходов, а также хотят иметь возможность проводить преимплантационное генетическое тестирование на определение анеуплоидий эмбрионов. Современные криопрограммы высокоэффективны и довольно успешны.
Как не ошибиться при криопереносе? Некоторые клиницисты назначают заместительную гормональную терапию (ЗГТ) вместо естественного цикла с сохраненной овуляцией. Современное медицинское сообщество склоняется к натуральному циклу в тех случаях, когда без ЗГТ можно обойтись. Показано, что клинические исходы беременности сходны как на ЗГТ, так и при естественном цикле, поэтому многие врачи используют ЗГТ для создания управляемой и прогнозируемой ситуации.
ЗГТ включает назначение эстрогенов и прогестерона. Дискуссионным остается применение агонистов гонадотропин-рилизинг-гормона (ГнРГ). Представители этой группы препаратов «утяжеляют» схему, повышают стоимость протоколов, способствуют возникновению функциональных кист, развитию менопаузальных симптомов, не увеличивая при этом вероятность наступления беременности. Справедливости ради стоит отметить, что у назначения агонистов ГнРГ есть сторонники (например, иногда целесообразно их введение при аденомиозе, поликистозе яичников или при проблемах с имплантацией эмбрионов), поэтому включение агонистов ГнРГ в схемы терапии остается на усмотрение клинициста.
Одной из самых главных проблем при криопереносе становится созревание собственного фолликула на фоне применения ЗГТ, направленной на увеличение толщины эндометрия. В практике применяются протоколы как с постоянной дозой эстрадиола (4,5 или 6 мг/сут), так и с повышением дозы эстрогенов (протокола step up), и чаще овуляция случается на фоне использования именно протокола step up, имитирующего естественный цикл. При сниженном овариальном резерве раннее назначение эстрогенов в адекватной дозировке (не менее 4,5 мг/сут) позволяет избежать созревания фолликулов, блокируя их. Если все же овуляция случилась, необходимо контролировать уровень прогестерона, чтобы не ошибиться с днем криопереноса.
Стоит ли добиваться толщины эндометрия более 7 мм? Вероятность положительного исхода при толщине менее 7 мм действительно ниже, однако далее цифра (9 мм, 11 мм и т.д. – до 14 мм) не так уж важна: главное – преодолеть порог в 7 мм, а затем можно назначать прогестерон и планировать перенос эмбрионов. Эстрогены целесообразно назначать в течение 7–20 дней.
Сегодня у клинициста в распоряжении имеется несколько форм эстрогенов: пероральные, вагинальные, трансдермальные, для внутримышечного введения. «Хорошим тоном» считается назначение именно трансдермальных препаратов, поскольку они позволяют избегать пиковых уровней эстрогенов в крови и позволяют поддерживать их на уровне, близком к физиологическому. К другим преимуществам относят меньшую частоту побочных эффектов (тошнота и рвота), более низкий риск венозного тромбоза, чем при пероральном приеме, что обусловлено отсутствием первичного метаболизма в печени при трансдермальном пути введения эстрадиола.
Еще одним важным вопросом становится срок отмены прогестерона и эстрогена в рамках цикла ЗГТ. При самопроизвольной беременности переход синтеза прогестерона от желтого тела к плаценте, так называемый «лютеоплацентарный шифт», наблюдается на 4–5-й неделе гестации. При индуцированной беременности этот переход происходит позже, в сроке около 8 нед беременности. Именно этот срок подходит для отмены как эстрогенов, так и прогестерона.
Как отметил профессор Nikolaos P. Polyzos, прогестерон считают «золотым гормоном» репродукции человека. Он приводит к трансформации эндометрия, подавляет сократимость миометрия, обладает иммуномодулирующим свойством. При переносах «свежих» эмбрионов в стимулированных циклах желтое тело может функционировать недостаточно хорошо: возникает недостаточность лютеиновой фазы. Для поддержания уровня прогестерона большинство врачей и пациенток предпочитают использовать вагинальный прогестерон. Благодаря «эффекту первичного прохождения через матку» вводимый вагинально прогестерон обеспечивает высокую концентрацию гормона в матке (локально в 5–7 раз выше, чем при внутримышечном введении). При сравнении результатов в «свежих» циклах становится понятно, что вагинальный прогестерон приводит к схожему показателю частоты наступления беременности по сравнению с использованием ректальных, подкожных или внутримышечных форм. В естественном цикле при криопереносе зачастую не используется никаких препаратов, прогестерон вырабатывается желтым телом. Нужна ли дотация прогестерона в этом случае? В исследованиях показано, что на фоне применения вагинального прогестерона частота наступления беременности повышается. Если в естественном цикле без прогестероновой поддержки уровень гормона в сыворотке крови меньше 10 пг/мл, то вероятность наступления беременности составляет 33% – значительно более низкий показатель, чем при уровне прогестерона выше 10 пг/мл. Дополнительный прием прогестерона обеспечивает высокий уровень частоты наступления беременности.
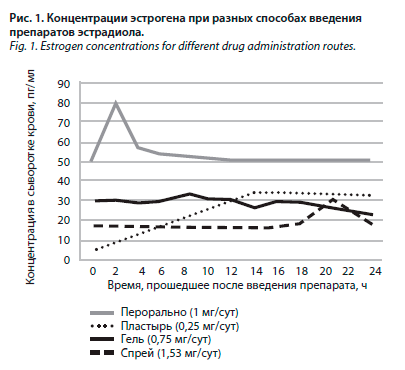 При криопереносе в искусственном цикле используют не только прогестерон, но и эстроген. Какая форма считается предпочтительнее? Пероральные препараты подвергаются печеночному метаболизму, что приводит к пиковому повышению уровня эстрогена, который затем резко падает (рис. 1). Гель эстрадиола, в свою очередь, обеспечивает стабильную концентрацию эстрадиола на одном уровне практически постоянно в течение 24 ч. Согласно данным одного из исследований, гель эстрадиола (Эстрожель®) по сравнению с эстрадиола валератом (пероральная форма) обеспечивает более высокую концентрацию вещества в сыворотке. Другая работа продемонстрировала, что Эстрожель® обеспечивал более высокую вероятность наступления беременности, чем пероральные формы эстрадиола.
При криопереносе в искусственном цикле используют не только прогестерон, но и эстроген. Какая форма считается предпочтительнее? Пероральные препараты подвергаются печеночному метаболизму, что приводит к пиковому повышению уровня эстрогена, который затем резко падает (рис. 1). Гель эстрадиола, в свою очередь, обеспечивает стабильную концентрацию эстрадиола на одном уровне практически постоянно в течение 24 ч. Согласно данным одного из исследований, гель эстрадиола (Эстрожель®) по сравнению с эстрадиола валератом (пероральная форма) обеспечивает более высокую концентрацию вещества в сыворотке. Другая работа продемонстрировала, что Эстрожель® обеспечивал более высокую вероятность наступления беременности, чем пероральные формы эстрадиола.
При пероральном приеме эстрогены метаболизируются в печени, оказывая влияние на обмен глюкозы и липидов, систему гемостаза, белковый синтез и т.д. Трансдермальные эстрогены минуют первичный печеночный метаболизм, не взаимодействуя с печеночными энзимами. Трансдермальные формы эстрогенов способствуют поддержанию постоянной концентрации эстрадиола в крови и легко дозируются. Кроме того, трансдермальный эстроген, в отличие от перорального, не повышает уровень С-реактивного белка, индикатора процессов воспаления, не увеличивает риск развития сердечно-сосудистых заболеваний.
Интересен тот факт, что в 40–50% циклах на фоне дотации вагинального прогестерона его уровень в сыворотке крови может быть низким. В такой ситуации можно увеличить дозировку препарата, однако перед этим важно проанализировать причины этого обстоятельства. Например, у пациентки может быть снижена абсорбция препарата – в этом случае стоит поменять путь введения препарата. Важно также правильно выбирать и молекулу гестагена. В 2023 г. вышло сообщение Европейского общества репродукции человека и эмбриологии о том, что назначение перорального синтетического аналога прогестерона – дидрогестерона – в 5,5 раза увеличивает риск появления пороков развития плода по сравнению с другими препаратами.
Вагинальный путь введения микронизированного прогестерона используется во всем мире. Клиницист может нередко задаваться вопросом, какую дозировку прогестерона стоит использовать при криопереносе.
В настоящее время в Европе проводится крупная научная работа – Micronized PROgesterone in Frozen embryo transfer cycles, рандомизированное контролируемое исследование (РКИ) III фазы, в котором сравниваются эффективность, безопасность и переносимость двух препаратов вагинального микронизированного прогестерона (Утрожестан®) 400 и 200 мг. Результаты представляются весьма полезными для медицинской общественности и будут получены позднее. В целом, если у пациентки развивается умеренная недостаточность лютеиновой фазы, стоит использовать 400 мг Утрожестана. В циклах ВРТ со значительной недостаточностью лютеиновой фазы к дозировке Утрожестана 400 мг можно подключить пероральный прогестерон в случае низкой его концентрации в сыворотке крови.
В естественном цикле, когда недостаточность лютеиновой фазы под сомнением, можно применять 200 мг
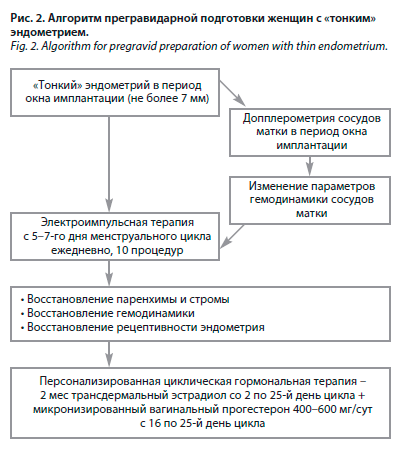 Ирина Евгеньевна Корнеева сообщила, что обязательным условием гормональной поддержки в тех циклах, где проводится перенос эмбрионов, являются препараты прогестерона, обеспечивающие функциональную активность желтого тела, секреторную трансформацию эндометрия и тем самым создающие условия для имплантации эмбриона. Залогом адекватной секреторной трансформации эндометрия является его пролиферация, которую обеспечивают эстрогены в фолликулярную фазу менструального цикла. Именно стимуляция пролиферации эндометрия является наиболее частой целью применения эстрогенов в программах ВРТ при переносе размороженных эмбрионов в криоциклах у пациенток с ановуляцией и снижением овариального резерва, в циклах с переносом донорских ооцитов или эмбрионов, при «тонком» эндометрии (рис. 2).
Ирина Евгеньевна Корнеева сообщила, что обязательным условием гормональной поддержки в тех циклах, где проводится перенос эмбрионов, являются препараты прогестерона, обеспечивающие функциональную активность желтого тела, секреторную трансформацию эндометрия и тем самым создающие условия для имплантации эмбриона. Залогом адекватной секреторной трансформации эндометрия является его пролиферация, которую обеспечивают эстрогены в фолликулярную фазу менструального цикла. Именно стимуляция пролиферации эндометрия является наиболее частой целью применения эстрогенов в программах ВРТ при переносе размороженных эмбрионов в криоциклах у пациенток с ановуляцией и снижением овариального резерва, в циклах с переносом донорских ооцитов или эмбрионов, при «тонком» эндометрии (рис. 2).
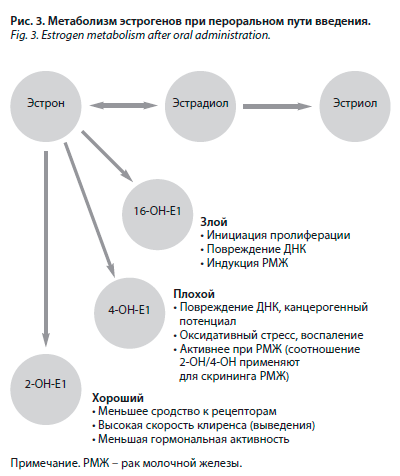
Опыт применения пероральных эстрогенов в гинекологии составляет более 60 лет: эти препараты, как и любая пероральная форма, удобны для приема. Однако биодоступность эстрадиола при пероральном введении крайне невелика. Так, при приеме эстрадиола валерата до 97% действующего вещества при первичном пассаже через печень подвергается метаболизму до эстрона, эстриола и эстрона сульфата. Интенсивный метаболизм приводит к превращению большой части дозы в эстрон и его конъюгаты (рис. 3), которые обладают меньшей эстрогенной активностью, чем эстрадиол. Чтобы преодолеть эти процессы метаболизма, пероральные эстрогены необходимо назначать в относительно высоких дозах. Низкая биодоступность перорального эстрадиола и его неблагоприятное влияние на липидный, углеводный обмен и коагуляционное звено гемостаза послужили предпосылкой для разработки новых путей введения эстрогенов.
Трансдермальные лекарственные формы доставляют эстрадиол непосредственно в системный кровоток через кожу, что помогает поддерживать соотношение эстрадиола и эстрона, аналогичное тому, которое наблюдается в естественной ситуации, и пациенткам требуется более низкая эффективная доза. При нанесении на кожу эстрогены проникают в роговой слой эпидермиса в течение нескольких минут, диффузия происходит через капилляры дермы в общий кровоток, где препарат накапливается в течение нескольких часов. Уровень эстрадиола в сыворотке крови повышается в течение 3–5 дней, после чего образуется плато (с индивидуальными колебаниями, зависящими от различных факторов: возраст, индекс массы тела, место и площадь нанесения, климат).
Преимуществами трансдермальных форм (см. таблицу) являются постоянная скорость высвобождения и всасывания действующего вещества, обеспечивающая минимальную вариабельность его концентраций в системном кровотоке, большая биодоступность, а также отсутствие влияния на желудочно-кишечный тракт и метаболический профиль.
Для сравнения трансдермального и перорального эстрадиола при переносах размороженных эмбрионов в циклах ЗГТ было проведено проспективное РКИ с участием 100 пациенток, опубликованное в 2021 г. Женщин наблюдали в течение 1 года (с 01.01.2020 по 31.12.2020). Первая группа получала трансдермальный гель эстрадиола в дозировке 1,25 мг геля или 0,75 мг эстрадиола 3 раза в сутки со 2-го дня цикла для подготовки эндометрия, а вторая – эстрадиола валерат перорально 2 мг 3 раза в сутки. Максимальная доза составила 7,5 г геля (4,5 мг эстрадиола) в сутки или 12 мг перорального эстрадиола в сутки. На 14-е сутки при толщине эндометрия более 7 мм назначался прогестерон (100 мг внутримышечно), через 4 дня проводили перенос 2 эмбрионов (8 клеток). Согласно полученным результатам, трансдермальный эстрадиол приводил к статистически более значимому повышению толщины эндометрия при переносах размороженных эмбрионов в циклах ЗГТ, чем пероральный. В группе, получавшей гель, по сравнению с группой перорального приема оценка удовлетворенности пациенток была значительно выше (8,02±1,07 против 6,96±0,99), а побочные эффекты были значительно ниже (18,1% против 55,1%).
 Еще одно исследование – открытое многоцентровое неинтервенционное – применения препарата эстрадиола гемигидрата в форме трансдермального геля у пациенток в программах ВРТ в криопротоколах с использованием собственных или донорских эмбрионов проводилось в 18 центрах 12 городов России. Были включены 207 пациенток со средней толщиной эндометрия во время первого визита 2,8±1,1 мм, заинтересованных в беременности с применением ВРТ – криопротоколы с использованием собственных или донорских эмбрионов. Всем пациенткам назначали эстрадиола гемигидрат в лекарственной форме трансдермального геля в индивидуальной стартовой дозе: рекомендуемый диапазон терапевтических доз препарата эстрадиола гемигидрата от 2,5 г (1,5 мг эстрадиола) до 5 г (3 мг эстрадиола) в сутки. Первично исследователи оценивали динамику толщины эндометрия, вторично – продолжительность терапии трансдермальным гелем по стандартной схеме для достижения толщины эндометрия 8 мм и профиль безопасности препарата (частоту, тяжесть и связь нежелательных явлений с приемом препарата). Было показано, что применение эстрадиола гемигидрата в форме трансдермального геля позволило обеспечить адекватную прегравидарную толщину эндометрия (8 мм и более) 98% пациенткам, легкие нежелательные явления были отмечены только у 1,4% пациенток, а тяжелых нежелательных явлений не наблюдалось.
Еще одно исследование – открытое многоцентровое неинтервенционное – применения препарата эстрадиола гемигидрата в форме трансдермального геля у пациенток в программах ВРТ в криопротоколах с использованием собственных или донорских эмбрионов проводилось в 18 центрах 12 городов России. Были включены 207 пациенток со средней толщиной эндометрия во время первого визита 2,8±1,1 мм, заинтересованных в беременности с применением ВРТ – криопротоколы с использованием собственных или донорских эмбрионов. Всем пациенткам назначали эстрадиола гемигидрат в лекарственной форме трансдермального геля в индивидуальной стартовой дозе: рекомендуемый диапазон терапевтических доз препарата эстрадиола гемигидрата от 2,5 г (1,5 мг эстрадиола) до 5 г (3 мг эстрадиола) в сутки. Первично исследователи оценивали динамику толщины эндометрия, вторично – продолжительность терапии трансдермальным гелем по стандартной схеме для достижения толщины эндометрия 8 мм и профиль безопасности препарата (частоту, тяжесть и связь нежелательных явлений с приемом препарата). Было показано, что применение эстрадиола гемигидрата в форме трансдермального геля позволило обеспечить адекватную прегравидарную толщину эндометрия (8 мм и более) 98% пациенткам, легкие нежелательные явления были отмечены только у 1,4% пациенток, а тяжелых нежелательных явлений не наблюдалось.
В другом многоцентровом проспективном сравнительном исследовании под руководством члена-корреспондента РАН, доктора медицинских наук, профессора К.В. Краснопольской продемонстрирована сопоставимая эффективность препаратов трансдермального эстрадиола гемигидрата и перорального эстрадиола валерата на фоне назначения существенно меньшей суммарной дозы именно трансдермального эстрадиола к моменту криопереноса. При оценке безопасности не было выявлено различий в общем количестве нежелательных явлений, но у женщин, принимавших эстроген перорально, отмечены более выраженные изменения свертывающей системы крови.
Согласно отечественным клиническим рекомендациям по ведению пациентов с бесплодием 2021 г., на этапе завершения гонадотропной стимуляции при толщине эндометрия менее 8 мм возможно применение препаратов эстрадиола до и после переноса эмбрионов. Эстрадиол может назначаться в виде трансдермального геля по 1–3 мг/сут (согласно инструкции к лекарственному препарату), длительность назначения и режим дозирования определяется индивидуально.
Решение проблем, связанных с различными формами яичниковой недостаточности, является одной из частых задач для врачей, работающих в области ВРТ. Попытки преодоления «бедного ответа» путем увеличения доз индукторов суперовуляции, различных сценариев назначения агонистов и антагонистов в схемах стимуляции яичников иногда не приводят к желаемому результату. В программах ВРТ перед овариальной стимуляцией с целью синхронизации роста фолликулов пациентке рекомендовано индивидуально по показаниям назначать гормональные препараты для системного применения, содержащие прогестагены и эстрогены. Использование естественной отрицательной обратной связи оси гипоталамус-гипофиз-яичник, вызванной предварительным праймингом с применением эстрадиола, может эффективно предотвращать межциклические увеличения уровня фолликулостимулируюшего гормона, приводить к более скоординированному фолликулярному росту и получению большего числа зрелых ооцитов. Ретроспективное неинтервенционное когортное исследование, проведенное с мая 2017 по июнь 2018 г., показало, что прайминг с применением трансдермального эстрадиола (эстрадиола гемигидрат, гель трансдермальный Эстрожель®) улучшает ответ яичников на гонадотропины по сравнению со стандартным протоколом, включающим применение только антагонистов ГнРГ. У пациенток, получавших Эстрожель®, наблюдались большее количество ооцитов, полученных при пункции, тенденция к лучшему качеству перенесенных эмбрионов, к более высокой имплантационной способности, фиксировалась большая частота наступления клинической и прогрессирующей беременности.
Что необходимо учитывать клиницисту при использовании препаратов с трансдермальной системой доставки? Существенное влияние на доставку лекарственного вещества через кожу и на его терапевтическую активность оказывает состав носителя, в котором содержится лекарственное вещество. Терапевтическая доза обеспечивается площадью нанесения геля и областью кожи, рекомендуемой каждым производителем. Стандартное применение геля – это покрытие кожи
2–5 мг/см2. Более толстое нанесение лимитирует диффузию активного вещества, а более тонкое способствует быстрому испарению компонентного состава. Кроме того, анатомические различия скорости всасывания зависят от размера корнеоцитов, а не от толщины кожи.
Трансдермальные системы переносят биоактивный гормон непосредственно в подкожную микроциркуляцию, где доставка стероидов является точной имитацией естественной секреции эстрадиола, обеспечивают терапевтический уровень циркулирующего эстрадиола в сыворотке крови и лучше имитируют профили эстрогенов, наблюдаемые в фолликулярной фазе цикла. Трансдермальный эстрадиол можно считать лучшей стратегией для достижения стандарта «наименьшей возможной дозы».
На протяжении последних лет возрастает доля женщин старше 39 лет, обращающихся в клиники репродукции. Беременности после программы ЭКО/ИКСИ у женщин старшего возраста с отягощенным анамнезом связаны с повышенным риском таких осложнений, как угрожающий выкидыш, преэклампсия, задержка роста плода, малый для гестационного возраста плод, преждевременные роды, предлежание плаценты, послеродовые кровотечения. В криоциклах повышен риск преэклампсии, в том числе с тяжелым течением. При беременности после переноса размороженных эмбрионов с собственными ооцитами возможны следующие механизмы формирования преэклампсии: влияние витрификации и размораживания на трофобласт, отсутствие собственного желтого тела (недостаточная адаптация сердечно-сосудистой системы матери к беременности). Желтое тело обусловливает адекватный уровень вазоактивных гормонов, участвующих в сосудистой адаптации в I триместре беременности, изменении почечной и осморегуляторной адаптации к беременности.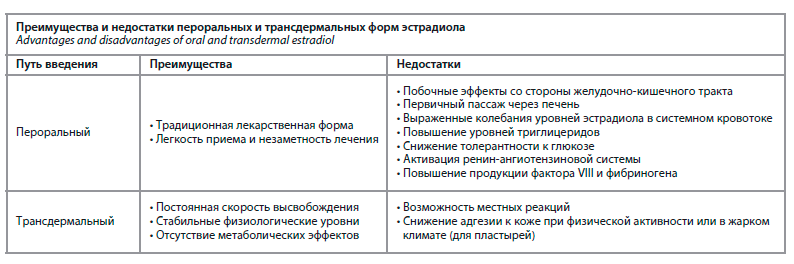 Недостаток релаксина, продуцируемого желтым телом ранней беременности, заменить невозможно. Уровни релаксина не определяются на протяжении всей беременности у женщин с наступившей беременностью на фоне циклической гормональной терапии. К механизмам формирования осложнений относят неадекватную иммунопротекцию фетоплацентарной системы у женщин, нефизиологическую иммунную связь между донорским оплодотворенным ооцитом и материнской децидуальной оболочкой, что может привести к аномальной плацентации и послеродовому кровотечению. Во время беременности вероятными протективными механизмами действия прогестерона на риск развития гипертензивных расстройств и преэклампсии считаются его противовоспалительное действие, переход от иммунных ответов, опосредованных Т-хелперами 1-го типа, на иммунные ответы, опосредованные Т-хелперами 2-го типа, ремоделирование спиральных артерий, обеспечивающее полноценную имплантацию и нормальную плацентацию, адаптация сердечно-сосудистой системы матери во время беременности. Прослежена взаимосвязь между высоким уровнем прогестерона на ранних сроках беременности и более низким артериальным давлением на поздних сроках беременности. Сосудорасширяющее действие прогестерона опосредовано механизмами влияния на оксид азота и простагландин I2.
Недостаток релаксина, продуцируемого желтым телом ранней беременности, заменить невозможно. Уровни релаксина не определяются на протяжении всей беременности у женщин с наступившей беременностью на фоне циклической гормональной терапии. К механизмам формирования осложнений относят неадекватную иммунопротекцию фетоплацентарной системы у женщин, нефизиологическую иммунную связь между донорским оплодотворенным ооцитом и материнской децидуальной оболочкой, что может привести к аномальной плацентации и послеродовому кровотечению. Во время беременности вероятными протективными механизмами действия прогестерона на риск развития гипертензивных расстройств и преэклампсии считаются его противовоспалительное действие, переход от иммунных ответов, опосредованных Т-хелперами 1-го типа, на иммунные ответы, опосредованные Т-хелперами 2-го типа, ремоделирование спиральных артерий, обеспечивающее полноценную имплантацию и нормальную плацентацию, адаптация сердечно-сосудистой системы матери во время беременности. Прослежена взаимосвязь между высоким уровнем прогестерона на ранних сроках беременности и более низким артериальным давлением на поздних сроках беременности. Сосудорасширяющее действие прогестерона опосредовано механизмами влияния на оксид азота и простагландин I2.
Состояние иммунной толерантности, которое характеризует беременность, предполагает воздействие прогестерона на костный мозг, печень и надпочечники и зависит не от концентрации прогестерона в матке, а от его уровня в сыворотке крови. Вводимый в микронизированной форме прогестерон абсорбируется в слизистую оболочку влагалища и высвобождается в течение 8 ч без чрезмерных колебаний уровня гормона в сыворотке крови. Примерно у 25% женщин отмечают низкие уровни прогестерона в сыворотке крови на фоне использования только вагинального пути. Добавление других путей введения прогестерона может способствовать улучшению репродуктивных исходов, усилению маточных и внематочных эффектов прогестерона, в частности токолитического и иммунного.
Зависит ли уровень прогестерона от ИМТ? Согласно научным работам, в I триместре – скорее всего да, а во II или в III взаимосвязь не прослеживается. К возможным механизмам снижения прогестерона в такой ситуации относят вторичное центральное снижение выработки лютеинизирующего гормона, что приводит к преждевременому лютеолизу, негативное воздействие адипоцитокинов на функцию желтого тела (снижение уровня прогестерона в сыворотке крови вторично по отношению к фармакокинетическому эффекту повышенного распределения прогестерона в жировых тканях из-за высокой растворимости половых стероидов в липидах).
Безопасность микронизированного прогестерона подтверждена крупными РКИ: PROMISE, двойным слепым многоцентровым рандомизированным плацебо-контролируемым исследованием терапии прогестероном в I триместре для снижения числа выкидышей у женщин, имеющих в анамнезе необъясненное привычное невынашивание, и PRISM, масштабным исследованием высокого методологического качества с оценкой эффективности вагинального микронизированного прогестерона у пациенток с угрозой выкидыша при наличии кровотечения в ранние сроки беременности. Согласно мнению специалистов Кокрановского сообщества относительно применения гестагенов для предот-вращения выкидыша (2021 г.), вагинальный микронизированный прогестерон увеличивает частоту живорождений при спонтанном выкидыше у пациенток с анамнезом предыдущих потерь без увеличения риска нежелательных явлений от применяемой терапии.
Эксперты рекомендуют очень скрупулезно проверять уровень прогестерона после переноса эмбрионов, делая это в день подсадки, а затем на 3, 5, 7, 9 и 14-й дни. Анализ важно повторять многократно, ведь даже если первые 2–3 проверки показали хороший результат, еще не значит, что имплантация уже состоялась (это может произойти в течение 10 сут). Чтобы получить максимально правдивые результаты, сдавать кровь нужно утром натощак, после 8–10 ч голодания.
Важным для клиницистов становится вопрос об отмене препаратов прогестерона. При «свежем» протоколе ЭКО при отсутствии жалоб это стоит делать на 12-й неделе беременности (после 1-го скрининга). При переносе в криоцикле на фоне ЗГТ это должно происходить к 15–16 нед беременности (из-за отсутствия собственного желтого тела). А когда и как отменять назначенные эстрогены? При «свежем» протоколе ЭКО это стоит делать постепенно с 5–6-й недели беременности при визуализации сердцебиения на ультразвуковом исследовании, в течение 2–5 дней снижая дозу. При переносе в криоцикле на фоне ЗГТ эстрогены отменяют после 10 нед, постепенно снижая дозу в течение 7–10 дней (в 12 нед эстрогены должны быть уже отменены). В случае сочетанного приема пероральных и трансдермальных препаратов отмену начинают с пероральных лекарственных препаратов.
Поступила в редакцию: 22.07.2024
Поступила после рецензирования: 26.07.2024
Принята к публикации: 01.08.2024
Received: 22.07.2024
Revised: 26.07.2024
Accepted: 01.08.2024
Клинический разбор в общей медицине №9 2024
Место эстрогенов и прогестерона в программах вспомогательных репродуктивных технологий
Номера страниц в выпуске:50-56
Аннотация
В конце марта 2024 г. состоялось рабочее совещание мировых экспертов в области вспомогательных репродуктивных технологий (ВРТ). Российские и международные специалисты представили самые актуальные данные и ответили на острые вопросы, возникающие в практике врачей-репродуктологов. В заседании приняли участие акушер-гинеколог, репродуктолог сети клиник Next Generation Clinic Николай Валерьевич Корнилов, заведующий отделением репродуктивной медицины Dexeus University Hospital, Grupo Dexeus (Барселона, Испания), приглашенный профессор кафедры репродуктивной медицины в Гентском университете (Бельгия), член исполнительного комитета Европейского общества репродукции человека и эмбриологии профессор Nikolaos P. Polyzos, доктор медицинских наук, профессор, акушер-гинеколог, репродуктолог, ведущий научный сотрудник научно-клинического отделения ВРТ им. Ф. Паулсена ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России Ирина Евгеньевна Корнеева, а также доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии ФГБОУ ВО «Майкопский государственный технологический университет», профессор кафедры акушерства и гинекологии лечебного факультета ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России, главный внештатный специалист по акушерству и гинекологии Южного федерального округа Виктория Александровна Попандопуло.
Ключевые слова: трансдермальные эстрогены, микронизированный прогестерон, беременность, криоперенос.
Для цитирования: Место эстрогенов и прогестерона в программах вспомогательных репродуктивных технологий. Клинический разбор в общей медицине. 2024; 5 (9): 50–56. DOI: 10.47407/kr2024.5.9.00478
В конце марта 2024 г. состоялось рабочее совещание мировых экспертов в области вспомогательных репродуктивных технологий (ВРТ). Российские и международные специалисты представили самые актуальные данные и ответили на острые вопросы, возникающие в практике врачей-репродуктологов. В заседании приняли участие акушер-гинеколог, репродуктолог сети клиник Next Generation Clinic Николай Валерьевич Корнилов, заведующий отделением репродуктивной медицины Dexeus University Hospital, Grupo Dexeus (Барселона, Испания), приглашенный профессор кафедры репродуктивной медицины в Гентском университете (Бельгия), член исполнительного комитета Европейского общества репродукции человека и эмбриологии профессор Nikolaos P. Polyzos, доктор медицинских наук, профессор, акушер-гинеколог, репродуктолог, ведущий научный сотрудник научно-клинического отделения ВРТ им. Ф. Паулсена ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России Ирина Евгеньевна Корнеева, а также доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии ФГБОУ ВО «Майкопский государственный технологический университет», профессор кафедры акушерства и гинекологии лечебного факультета ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России, главный внештатный специалист по акушерству и гинекологии Южного федерального округа Виктория Александровна Попандопуло.
Ключевые слова: трансдермальные эстрогены, микронизированный прогестерон, беременность, криоперенос.
Для цитирования: Место эстрогенов и прогестерона в программах вспомогательных репродуктивных технологий. Клинический разбор в общей медицине. 2024; 5 (9): 50–56. DOI: 10.47407/kr2024.5.9.00478
Role of estrogens and progesterone in the assisted reproductive technology programs
AbstractIn late March 2024, the global expert workshop on ART took place. Russian and international experts presented the most recent data and answered the critical questions arising in the practice of fertility doctors. The meeting was attended by the following experts: obstetrician-gynecologist, fertility doctor at the Next Generation Clinic network, Nikolay V. Kornilov, Head of the Reproductive Medicine Department at the Dexeus University Hospital (Grupo Dexeus, Barcelona, Spain), invited scholar at the Reproductive Medicine Department of the Ghent University (Belgium), member of the Executive Committee of the European Society of Human Reproduction and Embryology (ЕSHRE), Professor Nikolaos P. Polyzos, obstetrician-gynecologist, fertility doctor, leading researcher at the Paulsen ART Research and Clinical Department of the Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology, D Sci (Med.), Professor Irina E. Korneeva, as well as Victoria A. Popandopulo, Head of the Department of Obstetrics and Gynecology of the Maikop State Technological University, Professor at the Department of Obstetrics and Gynecology of the Faculty of General Medicine, Astrakhan State Medical University, Chief External Obstetrician-Gynecologist of the Southern Federal District, D Sci (Med.), Professor.
Keywords: transdermal estrogens, micronized progesterone, pregnancy, frozen embryo transfer.
For citation: Role of estrogens and progesterone in the assisted reproductive technology programs. Clinical review for general practice. 2024; 5 (9): 50–56. DOI: 10.47407/kr2024.5.9.00478
Сегодня криоконсервация гамет и эмбрионов значительно расширила клинические возможности и преимущества в лечении бесплодия в циклах вспомогательных репродуктивных технологий (ВРТ). Николай Валерьевич Корнилов отметил, что в последнее десятилетие резко увеличилось количество криопереносов: это связано с тем, что специалисты стараются избежать синдрома гиперстимуляции яичников, неблагоприятных неонатальных исходов, а также хотят иметь возможность проводить преимплантационное генетическое тестирование на определение анеуплоидий эмбрионов. Современные криопрограммы высокоэффективны и довольно успешны.
Как не ошибиться при криопереносе? Некоторые клиницисты назначают заместительную гормональную терапию (ЗГТ) вместо естественного цикла с сохраненной овуляцией. Современное медицинское сообщество склоняется к натуральному циклу в тех случаях, когда без ЗГТ можно обойтись. Показано, что клинические исходы беременности сходны как на ЗГТ, так и при естественном цикле, поэтому многие врачи используют ЗГТ для создания управляемой и прогнозируемой ситуации.
ЗГТ включает назначение эстрогенов и прогестерона. Дискуссионным остается применение агонистов гонадотропин-рилизинг-гормона (ГнРГ). Представители этой группы препаратов «утяжеляют» схему, повышают стоимость протоколов, способствуют возникновению функциональных кист, развитию менопаузальных симптомов, не увеличивая при этом вероятность наступления беременности. Справедливости ради стоит отметить, что у назначения агонистов ГнРГ есть сторонники (например, иногда целесообразно их введение при аденомиозе, поликистозе яичников или при проблемах с имплантацией эмбрионов), поэтому включение агонистов ГнРГ в схемы терапии остается на усмотрение клинициста.
Одной из самых главных проблем при криопереносе становится созревание собственного фолликула на фоне применения ЗГТ, направленной на увеличение толщины эндометрия. В практике применяются протоколы как с постоянной дозой эстрадиола (4,5 или 6 мг/сут), так и с повышением дозы эстрогенов (протокола step up), и чаще овуляция случается на фоне использования именно протокола step up, имитирующего естественный цикл. При сниженном овариальном резерве раннее назначение эстрогенов в адекватной дозировке (не менее 4,5 мг/сут) позволяет избежать созревания фолликулов, блокируя их. Если все же овуляция случилась, необходимо контролировать уровень прогестерона, чтобы не ошибиться с днем криопереноса.
Стоит ли добиваться толщины эндометрия более 7 мм? Вероятность положительного исхода при толщине менее 7 мм действительно ниже, однако далее цифра (9 мм, 11 мм и т.д. – до 14 мм) не так уж важна: главное – преодолеть порог в 7 мм, а затем можно назначать прогестерон и планировать перенос эмбрионов. Эстрогены целесообразно назначать в течение 7–20 дней.
Сегодня у клинициста в распоряжении имеется несколько форм эстрогенов: пероральные, вагинальные, трансдермальные, для внутримышечного введения. «Хорошим тоном» считается назначение именно трансдермальных препаратов, поскольку они позволяют избегать пиковых уровней эстрогенов в крови и позволяют поддерживать их на уровне, близком к физиологическому. К другим преимуществам относят меньшую частоту побочных эффектов (тошнота и рвота), более низкий риск венозного тромбоза, чем при пероральном приеме, что обусловлено отсутствием первичного метаболизма в печени при трансдермальном пути введения эстрадиола.
Еще одним важным вопросом становится срок отмены прогестерона и эстрогена в рамках цикла ЗГТ. При самопроизвольной беременности переход синтеза прогестерона от желтого тела к плаценте, так называемый «лютеоплацентарный шифт», наблюдается на 4–5-й неделе гестации. При индуцированной беременности этот переход происходит позже, в сроке около 8 нед беременности. Именно этот срок подходит для отмены как эстрогенов, так и прогестерона.
Как отметил профессор Nikolaos P. Polyzos, прогестерон считают «золотым гормоном» репродукции человека. Он приводит к трансформации эндометрия, подавляет сократимость миометрия, обладает иммуномодулирующим свойством. При переносах «свежих» эмбрионов в стимулированных циклах желтое тело может функционировать недостаточно хорошо: возникает недостаточность лютеиновой фазы. Для поддержания уровня прогестерона большинство врачей и пациенток предпочитают использовать вагинальный прогестерон. Благодаря «эффекту первичного прохождения через матку» вводимый вагинально прогестерон обеспечивает высокую концентрацию гормона в матке (локально в 5–7 раз выше, чем при внутримышечном введении). При сравнении результатов в «свежих» циклах становится понятно, что вагинальный прогестерон приводит к схожему показателю частоты наступления беременности по сравнению с использованием ректальных, подкожных или внутримышечных форм. В естественном цикле при криопереносе зачастую не используется никаких препаратов, прогестерон вырабатывается желтым телом. Нужна ли дотация прогестерона в этом случае? В исследованиях показано, что на фоне применения вагинального прогестерона частота наступления беременности повышается. Если в естественном цикле без прогестероновой поддержки уровень гормона в сыворотке крови меньше 10 пг/мл, то вероятность наступления беременности составляет 33% – значительно более низкий показатель, чем при уровне прогестерона выше 10 пг/мл. Дополнительный прием прогестерона обеспечивает высокий уровень частоты наступления беременности.
 При криопереносе в искусственном цикле используют не только прогестерон, но и эстроген. Какая форма считается предпочтительнее? Пероральные препараты подвергаются печеночному метаболизму, что приводит к пиковому повышению уровня эстрогена, который затем резко падает (рис. 1). Гель эстрадиола, в свою очередь, обеспечивает стабильную концентрацию эстрадиола на одном уровне практически постоянно в течение 24 ч. Согласно данным одного из исследований, гель эстрадиола (Эстрожель®) по сравнению с эстрадиола валератом (пероральная форма) обеспечивает более высокую концентрацию вещества в сыворотке. Другая работа продемонстрировала, что Эстрожель® обеспечивал более высокую вероятность наступления беременности, чем пероральные формы эстрадиола.
При криопереносе в искусственном цикле используют не только прогестерон, но и эстроген. Какая форма считается предпочтительнее? Пероральные препараты подвергаются печеночному метаболизму, что приводит к пиковому повышению уровня эстрогена, который затем резко падает (рис. 1). Гель эстрадиола, в свою очередь, обеспечивает стабильную концентрацию эстрадиола на одном уровне практически постоянно в течение 24 ч. Согласно данным одного из исследований, гель эстрадиола (Эстрожель®) по сравнению с эстрадиола валератом (пероральная форма) обеспечивает более высокую концентрацию вещества в сыворотке. Другая работа продемонстрировала, что Эстрожель® обеспечивал более высокую вероятность наступления беременности, чем пероральные формы эстрадиола.При пероральном приеме эстрогены метаболизируются в печени, оказывая влияние на обмен глюкозы и липидов, систему гемостаза, белковый синтез и т.д. Трансдермальные эстрогены минуют первичный печеночный метаболизм, не взаимодействуя с печеночными энзимами. Трансдермальные формы эстрогенов способствуют поддержанию постоянной концентрации эстрадиола в крови и легко дозируются. Кроме того, трансдермальный эстроген, в отличие от перорального, не повышает уровень С-реактивного белка, индикатора процессов воспаления, не увеличивает риск развития сердечно-сосудистых заболеваний.
Интересен тот факт, что в 40–50% циклах на фоне дотации вагинального прогестерона его уровень в сыворотке крови может быть низким. В такой ситуации можно увеличить дозировку препарата, однако перед этим важно проанализировать причины этого обстоятельства. Например, у пациентки может быть снижена абсорбция препарата – в этом случае стоит поменять путь введения препарата. Важно также правильно выбирать и молекулу гестагена. В 2023 г. вышло сообщение Европейского общества репродукции человека и эмбриологии о том, что назначение перорального синтетического аналога прогестерона – дидрогестерона – в 5,5 раза увеличивает риск появления пороков развития плода по сравнению с другими препаратами.
Вагинальный путь введения микронизированного прогестерона используется во всем мире. Клиницист может нередко задаваться вопросом, какую дозировку прогестерона стоит использовать при криопереносе.
В настоящее время в Европе проводится крупная научная работа – Micronized PROgesterone in Frozen embryo transfer cycles, рандомизированное контролируемое исследование (РКИ) III фазы, в котором сравниваются эффективность, безопасность и переносимость двух препаратов вагинального микронизированного прогестерона (Утрожестан®) 400 и 200 мг. Результаты представляются весьма полезными для медицинской общественности и будут получены позднее. В целом, если у пациентки развивается умеренная недостаточность лютеиновой фазы, стоит использовать 400 мг Утрожестана. В циклах ВРТ со значительной недостаточностью лютеиновой фазы к дозировке Утрожестана 400 мг можно подключить пероральный прогестерон в случае низкой его концентрации в сыворотке крови.
В естественном цикле, когда недостаточность лютеиновой фазы под сомнением, можно применять 200 мг
Утрожестана.
Таким образом, подготовка эндометрия с помощью трансдермального эстрогена (Эстрожель®) и поддержка лютеиновой фазы идентичным натуральному микронизированным прогестероном (Утрожестан®) представляют собой оптимальные как по эффективности, так и по безопасности подходы. Ирина Евгеньевна Корнеева сообщила, что обязательным условием гормональной поддержки в тех циклах, где проводится перенос эмбрионов, являются препараты прогестерона, обеспечивающие функциональную активность желтого тела, секреторную трансформацию эндометрия и тем самым создающие условия для имплантации эмбриона. Залогом адекватной секреторной трансформации эндометрия является его пролиферация, которую обеспечивают эстрогены в фолликулярную фазу менструального цикла. Именно стимуляция пролиферации эндометрия является наиболее частой целью применения эстрогенов в программах ВРТ при переносе размороженных эмбрионов в криоциклах у пациенток с ановуляцией и снижением овариального резерва, в циклах с переносом донорских ооцитов или эмбрионов, при «тонком» эндометрии (рис. 2).
Ирина Евгеньевна Корнеева сообщила, что обязательным условием гормональной поддержки в тех циклах, где проводится перенос эмбрионов, являются препараты прогестерона, обеспечивающие функциональную активность желтого тела, секреторную трансформацию эндометрия и тем самым создающие условия для имплантации эмбриона. Залогом адекватной секреторной трансформации эндометрия является его пролиферация, которую обеспечивают эстрогены в фолликулярную фазу менструального цикла. Именно стимуляция пролиферации эндометрия является наиболее частой целью применения эстрогенов в программах ВРТ при переносе размороженных эмбрионов в криоциклах у пациенток с ановуляцией и снижением овариального резерва, в циклах с переносом донорских ооцитов или эмбрионов, при «тонком» эндометрии (рис. 2).Опыт применения пероральных эстрогенов в гинекологии составляет более 60 лет: эти препараты, как и любая пероральная форма, удобны для приема. Однако биодоступность эстрадиола при пероральном введении крайне невелика. Так, при приеме эстрадиола валерата до 97% действующего вещества при первичном пассаже через печень подвергается метаболизму до эстрона, эстриола и эстрона сульфата. Интенсивный метаболизм приводит к превращению большой части дозы в эстрон и его конъюгаты (рис. 3), которые обладают меньшей эстрогенной активностью, чем эстрадиол. Чтобы преодолеть эти процессы метаболизма, пероральные эстрогены необходимо назначать в относительно высоких дозах. Низкая биодоступность перорального эстрадиола и его неблагоприятное влияние на липидный, углеводный обмен и коагуляционное звено гемостаза послужили предпосылкой для разработки новых путей введения эстрогенов.
Трансдермальные лекарственные формы доставляют эстрадиол непосредственно в системный кровоток через кожу, что помогает поддерживать соотношение эстрадиола и эстрона, аналогичное тому, которое наблюдается в естественной ситуации, и пациенткам требуется более низкая эффективная доза. При нанесении на кожу эстрогены проникают в роговой слой эпидермиса в течение нескольких минут, диффузия происходит через капилляры дермы в общий кровоток, где препарат накапливается в течение нескольких часов. Уровень эстрадиола в сыворотке крови повышается в течение 3–5 дней, после чего образуется плато (с индивидуальными колебаниями, зависящими от различных факторов: возраст, индекс массы тела, место и площадь нанесения, климат).
Преимуществами трансдермальных форм (см. таблицу) являются постоянная скорость высвобождения и всасывания действующего вещества, обеспечивающая минимальную вариабельность его концентраций в системном кровотоке, большая биодоступность, а также отсутствие влияния на желудочно-кишечный тракт и метаболический профиль.
Для сравнения трансдермального и перорального эстрадиола при переносах размороженных эмбрионов в циклах ЗГТ было проведено проспективное РКИ с участием 100 пациенток, опубликованное в 2021 г. Женщин наблюдали в течение 1 года (с 01.01.2020 по 31.12.2020). Первая группа получала трансдермальный гель эстрадиола в дозировке 1,25 мг геля или 0,75 мг эстрадиола 3 раза в сутки со 2-го дня цикла для подготовки эндометрия, а вторая – эстрадиола валерат перорально 2 мг 3 раза в сутки. Максимальная доза составила 7,5 г геля (4,5 мг эстрадиола) в сутки или 12 мг перорального эстрадиола в сутки. На 14-е сутки при толщине эндометрия более 7 мм назначался прогестерон (100 мг внутримышечно), через 4 дня проводили перенос 2 эмбрионов (8 клеток). Согласно полученным результатам, трансдермальный эстрадиол приводил к статистически более значимому повышению толщины эндометрия при переносах размороженных эмбрионов в циклах ЗГТ, чем пероральный. В группе, получавшей гель, по сравнению с группой перорального приема оценка удовлетворенности пациенток была значительно выше (8,02±1,07 против 6,96±0,99), а побочные эффекты были значительно ниже (18,1% против 55,1%).
 Еще одно исследование – открытое многоцентровое неинтервенционное – применения препарата эстрадиола гемигидрата в форме трансдермального геля у пациенток в программах ВРТ в криопротоколах с использованием собственных или донорских эмбрионов проводилось в 18 центрах 12 городов России. Были включены 207 пациенток со средней толщиной эндометрия во время первого визита 2,8±1,1 мм, заинтересованных в беременности с применением ВРТ – криопротоколы с использованием собственных или донорских эмбрионов. Всем пациенткам назначали эстрадиола гемигидрат в лекарственной форме трансдермального геля в индивидуальной стартовой дозе: рекомендуемый диапазон терапевтических доз препарата эстрадиола гемигидрата от 2,5 г (1,5 мг эстрадиола) до 5 г (3 мг эстрадиола) в сутки. Первично исследователи оценивали динамику толщины эндометрия, вторично – продолжительность терапии трансдермальным гелем по стандартной схеме для достижения толщины эндометрия 8 мм и профиль безопасности препарата (частоту, тяжесть и связь нежелательных явлений с приемом препарата). Было показано, что применение эстрадиола гемигидрата в форме трансдермального геля позволило обеспечить адекватную прегравидарную толщину эндометрия (8 мм и более) 98% пациенткам, легкие нежелательные явления были отмечены только у 1,4% пациенток, а тяжелых нежелательных явлений не наблюдалось.
Еще одно исследование – открытое многоцентровое неинтервенционное – применения препарата эстрадиола гемигидрата в форме трансдермального геля у пациенток в программах ВРТ в криопротоколах с использованием собственных или донорских эмбрионов проводилось в 18 центрах 12 городов России. Были включены 207 пациенток со средней толщиной эндометрия во время первого визита 2,8±1,1 мм, заинтересованных в беременности с применением ВРТ – криопротоколы с использованием собственных или донорских эмбрионов. Всем пациенткам назначали эстрадиола гемигидрат в лекарственной форме трансдермального геля в индивидуальной стартовой дозе: рекомендуемый диапазон терапевтических доз препарата эстрадиола гемигидрата от 2,5 г (1,5 мг эстрадиола) до 5 г (3 мг эстрадиола) в сутки. Первично исследователи оценивали динамику толщины эндометрия, вторично – продолжительность терапии трансдермальным гелем по стандартной схеме для достижения толщины эндометрия 8 мм и профиль безопасности препарата (частоту, тяжесть и связь нежелательных явлений с приемом препарата). Было показано, что применение эстрадиола гемигидрата в форме трансдермального геля позволило обеспечить адекватную прегравидарную толщину эндометрия (8 мм и более) 98% пациенткам, легкие нежелательные явления были отмечены только у 1,4% пациенток, а тяжелых нежелательных явлений не наблюдалось.В другом многоцентровом проспективном сравнительном исследовании под руководством члена-корреспондента РАН, доктора медицинских наук, профессора К.В. Краснопольской продемонстрирована сопоставимая эффективность препаратов трансдермального эстрадиола гемигидрата и перорального эстрадиола валерата на фоне назначения существенно меньшей суммарной дозы именно трансдермального эстрадиола к моменту криопереноса. При оценке безопасности не было выявлено различий в общем количестве нежелательных явлений, но у женщин, принимавших эстроген перорально, отмечены более выраженные изменения свертывающей системы крови.
Согласно отечественным клиническим рекомендациям по ведению пациентов с бесплодием 2021 г., на этапе завершения гонадотропной стимуляции при толщине эндометрия менее 8 мм возможно применение препаратов эстрадиола до и после переноса эмбрионов. Эстрадиол может назначаться в виде трансдермального геля по 1–3 мг/сут (согласно инструкции к лекарственному препарату), длительность назначения и режим дозирования определяется индивидуально.
Решение проблем, связанных с различными формами яичниковой недостаточности, является одной из частых задач для врачей, работающих в области ВРТ. Попытки преодоления «бедного ответа» путем увеличения доз индукторов суперовуляции, различных сценариев назначения агонистов и антагонистов в схемах стимуляции яичников иногда не приводят к желаемому результату. В программах ВРТ перед овариальной стимуляцией с целью синхронизации роста фолликулов пациентке рекомендовано индивидуально по показаниям назначать гормональные препараты для системного применения, содержащие прогестагены и эстрогены. Использование естественной отрицательной обратной связи оси гипоталамус-гипофиз-яичник, вызванной предварительным праймингом с применением эстрадиола, может эффективно предотвращать межциклические увеличения уровня фолликулостимулируюшего гормона, приводить к более скоординированному фолликулярному росту и получению большего числа зрелых ооцитов. Ретроспективное неинтервенционное когортное исследование, проведенное с мая 2017 по июнь 2018 г., показало, что прайминг с применением трансдермального эстрадиола (эстрадиола гемигидрат, гель трансдермальный Эстрожель®) улучшает ответ яичников на гонадотропины по сравнению со стандартным протоколом, включающим применение только антагонистов ГнРГ. У пациенток, получавших Эстрожель®, наблюдались большее количество ооцитов, полученных при пункции, тенденция к лучшему качеству перенесенных эмбрионов, к более высокой имплантационной способности, фиксировалась большая частота наступления клинической и прогрессирующей беременности.
Что необходимо учитывать клиницисту при использовании препаратов с трансдермальной системой доставки? Существенное влияние на доставку лекарственного вещества через кожу и на его терапевтическую активность оказывает состав носителя, в котором содержится лекарственное вещество. Терапевтическая доза обеспечивается площадью нанесения геля и областью кожи, рекомендуемой каждым производителем. Стандартное применение геля – это покрытие кожи
2–5 мг/см2. Более толстое нанесение лимитирует диффузию активного вещества, а более тонкое способствует быстрому испарению компонентного состава. Кроме того, анатомические различия скорости всасывания зависят от размера корнеоцитов, а не от толщины кожи.
Трансдермальные системы переносят биоактивный гормон непосредственно в подкожную микроциркуляцию, где доставка стероидов является точной имитацией естественной секреции эстрадиола, обеспечивают терапевтический уровень циркулирующего эстрадиола в сыворотке крови и лучше имитируют профили эстрогенов, наблюдаемые в фолликулярной фазе цикла. Трансдермальный эстрадиол можно считать лучшей стратегией для достижения стандарта «наименьшей возможной дозы».
На протяжении последних лет возрастает доля женщин старше 39 лет, обращающихся в клиники репродукции. Беременности после программы ЭКО/ИКСИ у женщин старшего возраста с отягощенным анамнезом связаны с повышенным риском таких осложнений, как угрожающий выкидыш, преэклампсия, задержка роста плода, малый для гестационного возраста плод, преждевременные роды, предлежание плаценты, послеродовые кровотечения. В криоциклах повышен риск преэклампсии, в том числе с тяжелым течением. При беременности после переноса размороженных эмбрионов с собственными ооцитами возможны следующие механизмы формирования преэклампсии: влияние витрификации и размораживания на трофобласт, отсутствие собственного желтого тела (недостаточная адаптация сердечно-сосудистой системы матери к беременности). Желтое тело обусловливает адекватный уровень вазоактивных гормонов, участвующих в сосудистой адаптации в I триместре беременности, изменении почечной и осморегуляторной адаптации к беременности.
 Недостаток релаксина, продуцируемого желтым телом ранней беременности, заменить невозможно. Уровни релаксина не определяются на протяжении всей беременности у женщин с наступившей беременностью на фоне циклической гормональной терапии. К механизмам формирования осложнений относят неадекватную иммунопротекцию фетоплацентарной системы у женщин, нефизиологическую иммунную связь между донорским оплодотворенным ооцитом и материнской децидуальной оболочкой, что может привести к аномальной плацентации и послеродовому кровотечению. Во время беременности вероятными протективными механизмами действия прогестерона на риск развития гипертензивных расстройств и преэклампсии считаются его противовоспалительное действие, переход от иммунных ответов, опосредованных Т-хелперами 1-го типа, на иммунные ответы, опосредованные Т-хелперами 2-го типа, ремоделирование спиральных артерий, обеспечивающее полноценную имплантацию и нормальную плацентацию, адаптация сердечно-сосудистой системы матери во время беременности. Прослежена взаимосвязь между высоким уровнем прогестерона на ранних сроках беременности и более низким артериальным давлением на поздних сроках беременности. Сосудорасширяющее действие прогестерона опосредовано механизмами влияния на оксид азота и простагландин I2.
Недостаток релаксина, продуцируемого желтым телом ранней беременности, заменить невозможно. Уровни релаксина не определяются на протяжении всей беременности у женщин с наступившей беременностью на фоне циклической гормональной терапии. К механизмам формирования осложнений относят неадекватную иммунопротекцию фетоплацентарной системы у женщин, нефизиологическую иммунную связь между донорским оплодотворенным ооцитом и материнской децидуальной оболочкой, что может привести к аномальной плацентации и послеродовому кровотечению. Во время беременности вероятными протективными механизмами действия прогестерона на риск развития гипертензивных расстройств и преэклампсии считаются его противовоспалительное действие, переход от иммунных ответов, опосредованных Т-хелперами 1-го типа, на иммунные ответы, опосредованные Т-хелперами 2-го типа, ремоделирование спиральных артерий, обеспечивающее полноценную имплантацию и нормальную плацентацию, адаптация сердечно-сосудистой системы матери во время беременности. Прослежена взаимосвязь между высоким уровнем прогестерона на ранних сроках беременности и более низким артериальным давлением на поздних сроках беременности. Сосудорасширяющее действие прогестерона опосредовано механизмами влияния на оксид азота и простагландин I2.Состояние иммунной толерантности, которое характеризует беременность, предполагает воздействие прогестерона на костный мозг, печень и надпочечники и зависит не от концентрации прогестерона в матке, а от его уровня в сыворотке крови. Вводимый в микронизированной форме прогестерон абсорбируется в слизистую оболочку влагалища и высвобождается в течение 8 ч без чрезмерных колебаний уровня гормона в сыворотке крови. Примерно у 25% женщин отмечают низкие уровни прогестерона в сыворотке крови на фоне использования только вагинального пути. Добавление других путей введения прогестерона может способствовать улучшению репродуктивных исходов, усилению маточных и внематочных эффектов прогестерона, в частности токолитического и иммунного.
Зависит ли уровень прогестерона от ИМТ? Согласно научным работам, в I триместре – скорее всего да, а во II или в III взаимосвязь не прослеживается. К возможным механизмам снижения прогестерона в такой ситуации относят вторичное центральное снижение выработки лютеинизирующего гормона, что приводит к преждевременому лютеолизу, негативное воздействие адипоцитокинов на функцию желтого тела (снижение уровня прогестерона в сыворотке крови вторично по отношению к фармакокинетическому эффекту повышенного распределения прогестерона в жировых тканях из-за высокой растворимости половых стероидов в липидах).
Безопасность микронизированного прогестерона подтверждена крупными РКИ: PROMISE, двойным слепым многоцентровым рандомизированным плацебо-контролируемым исследованием терапии прогестероном в I триместре для снижения числа выкидышей у женщин, имеющих в анамнезе необъясненное привычное невынашивание, и PRISM, масштабным исследованием высокого методологического качества с оценкой эффективности вагинального микронизированного прогестерона у пациенток с угрозой выкидыша при наличии кровотечения в ранние сроки беременности. Согласно мнению специалистов Кокрановского сообщества относительно применения гестагенов для предот-вращения выкидыша (2021 г.), вагинальный микронизированный прогестерон увеличивает частоту живорождений при спонтанном выкидыше у пациенток с анамнезом предыдущих потерь без увеличения риска нежелательных явлений от применяемой терапии.
Эксперты рекомендуют очень скрупулезно проверять уровень прогестерона после переноса эмбрионов, делая это в день подсадки, а затем на 3, 5, 7, 9 и 14-й дни. Анализ важно повторять многократно, ведь даже если первые 2–3 проверки показали хороший результат, еще не значит, что имплантация уже состоялась (это может произойти в течение 10 сут). Чтобы получить максимально правдивые результаты, сдавать кровь нужно утром натощак, после 8–10 ч голодания.
Важным для клиницистов становится вопрос об отмене препаратов прогестерона. При «свежем» протоколе ЭКО при отсутствии жалоб это стоит делать на 12-й неделе беременности (после 1-го скрининга). При переносе в криоцикле на фоне ЗГТ это должно происходить к 15–16 нед беременности (из-за отсутствия собственного желтого тела). А когда и как отменять назначенные эстрогены? При «свежем» протоколе ЭКО это стоит делать постепенно с 5–6-й недели беременности при визуализации сердцебиения на ультразвуковом исследовании, в течение 2–5 дней снижая дозу. При переносе в криоцикле на фоне ЗГТ эстрогены отменяют после 10 нед, постепенно снижая дозу в течение 7–10 дней (в 12 нед эстрогены должны быть уже отменены). В случае сочетанного приема пероральных и трансдермальных препаратов отмену начинают с пероральных лекарственных препаратов.
Поступила в редакцию: 22.07.2024
Поступила после рецензирования: 26.07.2024
Принята к публикации: 01.08.2024
Received: 22.07.2024
Revised: 26.07.2024
Accepted: 01.08.2024
1 ноября 2024
Количество просмотров: 513

