Клинический разбор в общей медицине №10 2024
1 Ulyanov Chuvash State University, Cheboksary, Russia;
2 Republic Clinical Hospital, Cheboksary, Russia;
3 Republic Cardiology Dispensary; Cheboksary, Russia
tlarisagast18@mail.ru
Annotation
The article describes a clinical case and the importance of selecting pathogenetic therapy in an elderly comorbid patient with inflammatory bowel disease – Crohn's disease.
Keywords: inflammatory bowel diseases, Crohn's disease, glucocorticoids, nonsteroidal anti-inflammatory drugs, cytostatics, monoclonal antibodies.
For citation: Tarasova L.V., Kucherova N.Yu., Ivanova D.A., Tsyganova Yu.V. Features of the selection of pathogenetic therapy in an elderly comorbid patient with Crohn's disease. Clinical review for general practice. 2024; 5 (10): 19–22 (In Russ.). DOI: 10.47407/kr2024.5.10.00490
Кроме того, полипрагмазия, которая определяется как одновременное назначение большого количества лекарств, в том числе необоснованно, возникает в случае несоблюдения клинических рекомендаций, стандартов и при игнорировании коллегиального решения о подборе терапии, проводимого в ходе мультидисциплинарного консилиума специалистов. С увеличением полипрагмазии возрастает вероятность нежелательных лекарственных взаимодействий. Эта концепция уже получила большее признание как потенциальная клиническая проблема среди многих медицинских направлений [3]. По данным публикаций последний лет [4] полипрагмазия связана с ухудшением клинических исходов хронических заболеваний, вследствие увеличения нагрузки на терапию на печень и почки коморбидного пациента. Так, было показано, что у пациентов с болезнью Крона (БК), принимающих большое количество препаратов, повышалась активность колитического синдрома и снижалось качество жизни [5].
Наличие коморбидности у пациентов с ВЗК вызывает серьезную тревогу, поскольку сопутствующие заболевания могут отрицательно влиять как на самого пациента, так и вызвать сложности в подборе правильной лекарственной терапии во избежание полипрагмазии [6].
Далее в статье будет продемонстрирован клинический случай коморбидного пациента с БК с акцентом на подбор лекарственной терапии с позиции минимизации явления полипрагмазии, а также с применением подходов доказательной медицины.
 Пациент И., 74 года, ИМТ – 29 кг/м2, страдающий болезнью Крона с поражением терминального отдела подвздошной кишки, фаза язв, активное течение. Болезнь Крона была верифицирована в возрасте 73 лет, когда появились жалобы на боли в верхней части живота и правой подвздошной области, учащение стула до 6 раз в сутки, вздутие и урчание в животе независимо от приема пищи, снижение массы тела до 15 кг за последний год, выраженная общая слабость, снижение аппетита и повышенная утомляемость.
Пациент И., 74 года, ИМТ – 29 кг/м2, страдающий болезнью Крона с поражением терминального отдела подвздошной кишки, фаза язв, активное течение. Болезнь Крона была верифицирована в возрасте 73 лет, когда появились жалобы на боли в верхней части живота и правой подвздошной области, учащение стула до 6 раз в сутки, вздутие и урчание в животе независимо от приема пищи, снижение массы тела до 15 кг за последний год, выраженная общая слабость, снижение аппетита и повышенная утомляемость.
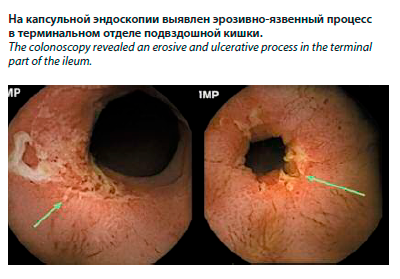
Из анамнеза болезни: с 2020 г. пациент отмечал неустойчивый стул без примесей до 2–3 раз в сутки, но врачам об этом не говорил, обследование кишечника соответственно не назначалось. В январе 2023 г. пациент стал отмечать периодический подъем температуры до 38°С и кожные высыпания в виде язвенных образований на коже предплечий, спины, груди, боковых поверхностях живота, достигавшие 1–2 см в диаметре, в последующем с тенденцией к слиянию и образованию огромных участков поражения с полигональными контурами, «подрытыми» краями, глубоким дном, с серозно-гнойным отделяемым, имеющим неприятный запах. Дерматолог рекомендовал пациенту мазь «Такролимус» в связи с подозрением на гангренозную пиодермию. Также пациент был направлен к гастроэнтерологу в региональный центр по диагностике и лечению ВЗК с подозрением на болезнь Крона. Пациент готов был проигнорировать назначение дерматолога, но в связи с появлением болевого синдрома в околопупочной области и диареи согласился на проведение капсульной эндоскопии, в ходе которой и были выявлены полуциркулярные изъязвления под фибрином в тонкой и подвздошной кишке, сужение просвета кишки в местах изъязвления, гиперемия окружающей слизистой, отечность терминального отдела подвздошной кишки (см. рисунок).
Результаты лабораторных исследований (фекальный кальпротектин 1700 мкг/г, СРБ 11 мг/л, гемоглобин 93 г/л, уровень лейкоцитов в сыворотке крови 10,5×109/л) помогли верифицировать диагноз болезни Крона с поражением терминального отдела подвздошной кишки, фаза язв, тяжелая атака. Гангренозная пиодермия была расценена как аутоиммунное поражение кожи, связанное с активностью БК.
При назначении патогенетической терапии возникли вопросы, связанные с коморбидным профилем: пациент более 10 лет страдал сахарным диабетом 2-го типа (СД2) и получал Метформин 2000 мг в сутки, а также хронической ишемической болезнью сердца (ХИБС) и гипертонической болезнью, принимал индапамид 2,5 мг в сутки, периндоприл 4 мг в сутки, бисопролол 5 мг в сутки и аспирин 75 мг в сутки. Необходимо отметить, что у пациента имеется избыточная масса тела (ИМТ – 29 кг/м2), что наряду с наличием гипертонической болезни и СД2 свидетельствует о наличии метаболического синдрома и требует дополнительного изучения показателей липидного спектра, функционального состояния печени, а также уровня мочевой кислоты в сыворотке крови. В ходе дообследования выявлена гиперхолестеринемия до 6,7 ммоль/л, гипертриглицеридемия до 2,1 ммоль/л, низкие показатели липопротеидов высокой плотности 0,9 ммоль/л. Показатели уровня мочевой кислоты в сыворотке крови находились по верхней границе нормы для мужчин – 419 мкмоль/л.
Необходимо отметить, что в связи с перенесенным ранее двухлодыжечным переломом правого голеностопного сустава перенес репозицию и остеосинтез, но по поводу развившейся посттравматической артропатии, сопровождаемой хроническим болевым синдромом, был вынужден не реже 4–5 раз в неделю принимать нестероидные противовоспалительные препараты (НПВП) (нимесулид, кеторолак) 5 мг в сутки, аспирин 75 мг в сутки.
С учетом пожилого возраста пациента, наличия компонентов метаболического синдрома, коморбидного профиля и тяжести течения БК с внекишечным проявлением в виде гангренозной пиодермии во избежание риска полипрагмазии происходил тщательный подбор схемы лекарственной терапии по двум направлениям: влияние на иммуноопосредованный механизм коморбидной патологии и подбор патогенетической и симптоматической терапии сопутствующих состояний и заболеваний.
Использование глюкокортикостероидов (ГКС) у пациентов с иммуноопосредованными заболеваниями, в том числе с БК, включено в клинические рекомендации и стандарты и имеет высокую доказательную базу в связи с выраженным противовоспалительным эффектом. Также доказано, что ГКС обладают выраженным негативным влиянием на углеводный обмен, провоцируя стероид-индуцированные нарушения функции поджелудочной железы. Так, ГКС способствуют развитию инсулинорезистентности в скелетных мышцах путем регуляции ряда генов-мишеней GR, участвующих в каскаде передачи сигналов инсулина, что приводит к очевидному пострецепторному дефекту [7]. В эндокринной системе поджелудочной железы in vivo лечение ГКС приводит к вторичной гиперплазии β-клеток в попытке выработать достаточное количество инсулина для поддержания нормогликемии на фоне периферической инсулинорезистентности в различных тканях-мишенях [8]. ГКС способны регулировать аспекты гомеостаза глюкозы в каждом органе-мишени, противодействуя прямому или косвенному действию инсулина, снижая при этом эффективность метформина и других сахароснижающих препаратов [9]. Исходя из перечисленных фактов назначение ГКС по поводу активного течения БК пациенту с СД 2 типа крайне нежелательно и требует коррекции иммуносупрессивной терапии с учетом особенностей обмена глюкозы.
Терапия цитостатиками (азатиоприн, меркаптопурин и др.) при СД также может спровоцировать нарушение гликемического профиля, вызвать неблагоприятные изменения со стороны печени и почек. В исследованиях последних лет доказано, что гепатотоксическое действие иммуносупрессорных препаратов, в частности азатиоприна, может усиливаться при СД2. Сахарный диабет может изменять метаболизм и выведение препарата, потенциально увеличивая риск токсичности и повреждения печени и почек. Так, у пациентов с СД при приеме азатиоприна наблюдались более значительные изменения показателей ферментов печени, демонстрирующие синергическую взаимосвязь между приемом цитостатического препарата и нарушенным обменом глюкозы [10].
НПВП ассоциируются с желудочно-кишечной токсичностью в виде повреждения слизистых оболочек желудочно-кишечного тракта, вызывая энтеропатию и гастропатию, повышая риск рецидива ВЗК, особенно при длительном использовании и в высоких дозах [11]. При иммунной дисрегуляции, связанной с ВЗК, в слизистой оболочке кишки происходит повышение провоспалительных и снижение ингибирующих цитокинов [12]. Этот дисбаланс приводит к дальнейшему прогрессированию повреждения слизистой оболочки кишки. Одна из теорий предполагает, что прямое негативное воздействие на функцию слизистой оболочки, вызванное НПВП, усиливает уже существующую генетически детерминированную иммунную дисрегуляцию у пациентов с ВЗК [13]. Также усиление желудочно-кишечной токсичности связано со снижением продукции простагландинов (через оба пути циклооксигеназы (ЦОГ) 1 и ЦОГ-2) и местное действие через взаимодействие фосфолипидов поверхностной мембраны и влияние на активность митохондрий [14]. Возможно, НПВП играют роль в активации воспалительных путей при ВЗК через аналогичные механизмы [15]. Препаратом выбора из группы НПВП для пациентов с ВЗК являются селективные ингибиторы ЦОГ-2-коксибы – эторикоксиб, целекоксиб. Они считаются наиболее безопасными, с более низким риском рецидивирования заболевания по сравнению с неселективными НПВП [16]. Лечение эторикоксибом не было связано с появлением осложнений, связанных с ВЗК и другими заболеваниями ЖКТ [17].
Учитывая возраст пациента, иммуноопосредованный кожный процесс в виде гангренозной пиодермии, СД2, ХИБС, ГБ для помощи в определении дальнейшей тактики ведения и исключения риска полипрагмазии был осуществлен мультидисциплинарный консилиум специалистов регионального центра по диагностике и лечению ВЗК Чувашской Республики совместно со специалистами ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих» (телемедицинская консультация). С учетом имеющихся данных и сопутствующего коморбидного фона в качестве иммуносупрессивной патогенетической терапии была рекомендована схема лечения top down с использованием полностью человеческого моноклонального антитела IgG, специфически ингибирующего интерлейкины 12 и 23 в дозе 390 мг внутривенно капельно однократно с последующим поддерживающим введением препарата по 90 мг подкожно раз в 8 недель. Устекинумаб был выбран в связи с подтвержденным благоприятным профилем безопасности, хорошей переносимостью и быстрым противовоспалительным эффектом, долгосрочной эффективностью, что оптимально для пожилых коморбидных пациентов с иммуноопосредованными заболеваниями [18]. В ходе проведенных клинических исследований подтверждено, что профиль безопасности устекинумаба остается благоприятным в течение 4 лет долгосрочного периода наблюдений у пациентов с язвенным колитом и 5 лет у пациентов с болезнью Крона [19]. Эффективность и безопасность устекинумаба при БК были оценены в клинических испытаниях UNITI-1, UNITI-2, IM-UNITI, UNITI LTE [2, 3] и подтверждены в реальной клинической практике в многочисленных ретроспективных и проспективных исследованиях.
На фоне терапии моноклональным антителом устекинумабом было проведено контрольное обследование пациента через 3 месяца после начала терапии, которое показало эффективность проводимого лечения. Помимо уменьшения частоты стула до 1–2 раз в сутки, происходило полное купирование абдоминального болевого синдрома и лихорадки, приостановилось снижение массы тела, а также наблюдалось значительное улучшение со стороны кожных покровов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Тарасова Лариса Владимировна – д-р мед. наук, доц., зав. каф. госпитальной терапии, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»; зав. отд. гастроэнтерологии, БУ «Республиканская клиническая больница». E-mail: tlarisagast18@mail.ru; ORCID: 0000-0003-1496-0689
Larisa V. Tarasova – Dr. Sci. (Med.), Assoc. Prof., Ulyanov Chuvash State University; Republic Clinical Hospital.
E-mail: tlarisagast18@mail.ru; ORCID: 0000-0003-1496-0689
Кучерова Надежда Юрьевна – аспирант каф. госпитальной терапии, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»; врач-кардиолог консультативной поликлиники БУ «Республиканский кардиологический диспансер».
E-mail: nadezda_kan@mail.ru; ORCID: 0000-0002-9500-3719
Nadezhda Yu. Kucherova – Graduate Student, Ulyanov Chuvash State University; cardiologist, Republic Cardiology Dispensary.
E-mail: nadezda_kan@mail.ru; ORCID: 0000-0002-9500-3719
Иванова Дарья Альбертовна – ординатор, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова».
E-mail: dashken690@yandex.ru; ORCID: 0000-0001-7516-776X
Daria A. Ivanova – Resident, Ulyanov Chuvash State University.
E-mail: dashken690@yandex.ru ORCID: 0000-0001-7516-776X
Цыганова Юлия Вадимовна – канд. мед. наук, доцент каф. госпитальной терапии ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова». E-mail: j.v.tsyganova@mail.ru
Julia V. Tsyganova – Cand. Sci. (Med.), Ulyanov Chuvash State University. E-mail: j.v.tsyganova@mail.ru; ORCID: 0000-0002-8339-9496
Поступила в редакцию: 25.09.2024
Поступила после рецензирования: 04.10.2024
Принята к публикации: 10.10.2024
Received: 25.09.2024
Revised: 04.10.2024
Accepted: 10.10.2024
Клинический разбор в общей медицине №10 2024
Особенности подбора патогенетической терапии у пожилого коморбидного пациента с болезнью Крона
Номера страниц в выпуске:19-22
Аннотация
В статье представлено описание клинического случая и обоснована значимость подбора патогенетической терапии у пожилого коморбидного пациента с воспалительным заболеванием кишечника – болезнью Крона.
Ключевые слова: воспалительные заболевания кишечника, болезнь Крона, глюкокортикоиды, нестероидные противовоспалительные препараты, цитостатики, моноклональные антитела.
Для цитирования: Тарасова Л.В., Кучерова Н.Ю., Иванова Д.А., Цыганова Ю.В. Особенности подбора патогенетической терапии у пожилого коморбидного пациента с болезнью Крона. Клинический разбор в общей медицине. 2024; 5 (10): 19–22. DOI: 10.47407/kr2024.5.10.00490
В статье представлено описание клинического случая и обоснована значимость подбора патогенетической терапии у пожилого коморбидного пациента с воспалительным заболеванием кишечника – болезнью Крона.
Ключевые слова: воспалительные заболевания кишечника, болезнь Крона, глюкокортикоиды, нестероидные противовоспалительные препараты, цитостатики, моноклональные антитела.
Для цитирования: Тарасова Л.В., Кучерова Н.Ю., Иванова Д.А., Цыганова Ю.В. Особенности подбора патогенетической терапии у пожилого коморбидного пациента с болезнью Крона. Клинический разбор в общей медицине. 2024; 5 (10): 19–22. DOI: 10.47407/kr2024.5.10.00490
Features of the selection of pathogenetic therapy in an elderly, comorbid patient with Crohn's disease
Larisa V. Tarasova1,2, Nadezhda Yu. Kucherova1,3, Daria A. Ivanova1, Julia V. Tsyganova11 Ulyanov Chuvash State University, Cheboksary, Russia;
2 Republic Clinical Hospital, Cheboksary, Russia;
3 Republic Cardiology Dispensary; Cheboksary, Russia
tlarisagast18@mail.ru
Annotation
The article describes a clinical case and the importance of selecting pathogenetic therapy in an elderly comorbid patient with inflammatory bowel disease – Crohn's disease.
Keywords: inflammatory bowel diseases, Crohn's disease, glucocorticoids, nonsteroidal anti-inflammatory drugs, cytostatics, monoclonal antibodies.
For citation: Tarasova L.V., Kucherova N.Yu., Ivanova D.A., Tsyganova Yu.V. Features of the selection of pathogenetic therapy in an elderly comorbid patient with Crohn's disease. Clinical review for general practice. 2024; 5 (10): 19–22 (In Russ.). DOI: 10.47407/kr2024.5.10.00490
Введение
В последнее время наблюдается неуклонный рост числа пациентов с воспалительными заболеваниями кишечника (ВЗК) среди всех возрастных групп, включая множество пожилых и коморбидных пациентов [1]. Из-за хронического характера заболевания пациентам часто требуются ежедневная патогенетическая терапия основного заболевания для достижения клинико-эндоскопической ремиссии и предотвращения рецидива, а также терапия сопутствующих заболеваний, лечение которых бывает жизненно необходимо. Побочные лекарственные реакции в таких случаях ожидаемы и могут возникнуть при применении любого из классов препаратов, используемых для лечения ВЗК, включая аминосалицилаты, стероиды, иммуносупрессоры, а также ингибиторы фактора некроза опухоли-α [2].Кроме того, полипрагмазия, которая определяется как одновременное назначение большого количества лекарств, в том числе необоснованно, возникает в случае несоблюдения клинических рекомендаций, стандартов и при игнорировании коллегиального решения о подборе терапии, проводимого в ходе мультидисциплинарного консилиума специалистов. С увеличением полипрагмазии возрастает вероятность нежелательных лекарственных взаимодействий. Эта концепция уже получила большее признание как потенциальная клиническая проблема среди многих медицинских направлений [3]. По данным публикаций последний лет [4] полипрагмазия связана с ухудшением клинических исходов хронических заболеваний, вследствие увеличения нагрузки на терапию на печень и почки коморбидного пациента. Так, было показано, что у пациентов с болезнью Крона (БК), принимающих большое количество препаратов, повышалась активность колитического синдрома и снижалось качество жизни [5].
Наличие коморбидности у пациентов с ВЗК вызывает серьезную тревогу, поскольку сопутствующие заболевания могут отрицательно влиять как на самого пациента, так и вызвать сложности в подборе правильной лекарственной терапии во избежание полипрагмазии [6].
Далее в статье будет продемонстрирован клинический случай коморбидного пациента с БК с акцентом на подбор лекарственной терапии с позиции минимизации явления полипрагмазии, а также с применением подходов доказательной медицины.
Клинический случай
 Пациент И., 74 года, ИМТ – 29 кг/м2, страдающий болезнью Крона с поражением терминального отдела подвздошной кишки, фаза язв, активное течение. Болезнь Крона была верифицирована в возрасте 73 лет, когда появились жалобы на боли в верхней части живота и правой подвздошной области, учащение стула до 6 раз в сутки, вздутие и урчание в животе независимо от приема пищи, снижение массы тела до 15 кг за последний год, выраженная общая слабость, снижение аппетита и повышенная утомляемость.
Пациент И., 74 года, ИМТ – 29 кг/м2, страдающий болезнью Крона с поражением терминального отдела подвздошной кишки, фаза язв, активное течение. Болезнь Крона была верифицирована в возрасте 73 лет, когда появились жалобы на боли в верхней части живота и правой подвздошной области, учащение стула до 6 раз в сутки, вздутие и урчание в животе независимо от приема пищи, снижение массы тела до 15 кг за последний год, выраженная общая слабость, снижение аппетита и повышенная утомляемость.Из анамнеза болезни: с 2020 г. пациент отмечал неустойчивый стул без примесей до 2–3 раз в сутки, но врачам об этом не говорил, обследование кишечника соответственно не назначалось. В январе 2023 г. пациент стал отмечать периодический подъем температуры до 38°С и кожные высыпания в виде язвенных образований на коже предплечий, спины, груди, боковых поверхностях живота, достигавшие 1–2 см в диаметре, в последующем с тенденцией к слиянию и образованию огромных участков поражения с полигональными контурами, «подрытыми» краями, глубоким дном, с серозно-гнойным отделяемым, имеющим неприятный запах. Дерматолог рекомендовал пациенту мазь «Такролимус» в связи с подозрением на гангренозную пиодермию. Также пациент был направлен к гастроэнтерологу в региональный центр по диагностике и лечению ВЗК с подозрением на болезнь Крона. Пациент готов был проигнорировать назначение дерматолога, но в связи с появлением болевого синдрома в околопупочной области и диареи согласился на проведение капсульной эндоскопии, в ходе которой и были выявлены полуциркулярные изъязвления под фибрином в тонкой и подвздошной кишке, сужение просвета кишки в местах изъязвления, гиперемия окружающей слизистой, отечность терминального отдела подвздошной кишки (см. рисунок).
Результаты лабораторных исследований (фекальный кальпротектин 1700 мкг/г, СРБ 11 мг/л, гемоглобин 93 г/л, уровень лейкоцитов в сыворотке крови 10,5×109/л) помогли верифицировать диагноз болезни Крона с поражением терминального отдела подвздошной кишки, фаза язв, тяжелая атака. Гангренозная пиодермия была расценена как аутоиммунное поражение кожи, связанное с активностью БК.
При назначении патогенетической терапии возникли вопросы, связанные с коморбидным профилем: пациент более 10 лет страдал сахарным диабетом 2-го типа (СД2) и получал Метформин 2000 мг в сутки, а также хронической ишемической болезнью сердца (ХИБС) и гипертонической болезнью, принимал индапамид 2,5 мг в сутки, периндоприл 4 мг в сутки, бисопролол 5 мг в сутки и аспирин 75 мг в сутки. Необходимо отметить, что у пациента имеется избыточная масса тела (ИМТ – 29 кг/м2), что наряду с наличием гипертонической болезни и СД2 свидетельствует о наличии метаболического синдрома и требует дополнительного изучения показателей липидного спектра, функционального состояния печени, а также уровня мочевой кислоты в сыворотке крови. В ходе дообследования выявлена гиперхолестеринемия до 6,7 ммоль/л, гипертриглицеридемия до 2,1 ммоль/л, низкие показатели липопротеидов высокой плотности 0,9 ммоль/л. Показатели уровня мочевой кислоты в сыворотке крови находились по верхней границе нормы для мужчин – 419 мкмоль/л.
Необходимо отметить, что в связи с перенесенным ранее двухлодыжечным переломом правого голеностопного сустава перенес репозицию и остеосинтез, но по поводу развившейся посттравматической артропатии, сопровождаемой хроническим болевым синдромом, был вынужден не реже 4–5 раз в неделю принимать нестероидные противовоспалительные препараты (НПВП) (нимесулид, кеторолак) 5 мг в сутки, аспирин 75 мг в сутки.
С учетом пожилого возраста пациента, наличия компонентов метаболического синдрома, коморбидного профиля и тяжести течения БК с внекишечным проявлением в виде гангренозной пиодермии во избежание риска полипрагмазии происходил тщательный подбор схемы лекарственной терапии по двум направлениям: влияние на иммуноопосредованный механизм коморбидной патологии и подбор патогенетической и симптоматической терапии сопутствующих состояний и заболеваний.
Использование глюкокортикостероидов (ГКС) у пациентов с иммуноопосредованными заболеваниями, в том числе с БК, включено в клинические рекомендации и стандарты и имеет высокую доказательную базу в связи с выраженным противовоспалительным эффектом. Также доказано, что ГКС обладают выраженным негативным влиянием на углеводный обмен, провоцируя стероид-индуцированные нарушения функции поджелудочной железы. Так, ГКС способствуют развитию инсулинорезистентности в скелетных мышцах путем регуляции ряда генов-мишеней GR, участвующих в каскаде передачи сигналов инсулина, что приводит к очевидному пострецепторному дефекту [7]. В эндокринной системе поджелудочной железы in vivo лечение ГКС приводит к вторичной гиперплазии β-клеток в попытке выработать достаточное количество инсулина для поддержания нормогликемии на фоне периферической инсулинорезистентности в различных тканях-мишенях [8]. ГКС способны регулировать аспекты гомеостаза глюкозы в каждом органе-мишени, противодействуя прямому или косвенному действию инсулина, снижая при этом эффективность метформина и других сахароснижающих препаратов [9]. Исходя из перечисленных фактов назначение ГКС по поводу активного течения БК пациенту с СД 2 типа крайне нежелательно и требует коррекции иммуносупрессивной терапии с учетом особенностей обмена глюкозы.
Терапия цитостатиками (азатиоприн, меркаптопурин и др.) при СД также может спровоцировать нарушение гликемического профиля, вызвать неблагоприятные изменения со стороны печени и почек. В исследованиях последних лет доказано, что гепатотоксическое действие иммуносупрессорных препаратов, в частности азатиоприна, может усиливаться при СД2. Сахарный диабет может изменять метаболизм и выведение препарата, потенциально увеличивая риск токсичности и повреждения печени и почек. Так, у пациентов с СД при приеме азатиоприна наблюдались более значительные изменения показателей ферментов печени, демонстрирующие синергическую взаимосвязь между приемом цитостатического препарата и нарушенным обменом глюкозы [10].
НПВП ассоциируются с желудочно-кишечной токсичностью в виде повреждения слизистых оболочек желудочно-кишечного тракта, вызывая энтеропатию и гастропатию, повышая риск рецидива ВЗК, особенно при длительном использовании и в высоких дозах [11]. При иммунной дисрегуляции, связанной с ВЗК, в слизистой оболочке кишки происходит повышение провоспалительных и снижение ингибирующих цитокинов [12]. Этот дисбаланс приводит к дальнейшему прогрессированию повреждения слизистой оболочки кишки. Одна из теорий предполагает, что прямое негативное воздействие на функцию слизистой оболочки, вызванное НПВП, усиливает уже существующую генетически детерминированную иммунную дисрегуляцию у пациентов с ВЗК [13]. Также усиление желудочно-кишечной токсичности связано со снижением продукции простагландинов (через оба пути циклооксигеназы (ЦОГ) 1 и ЦОГ-2) и местное действие через взаимодействие фосфолипидов поверхностной мембраны и влияние на активность митохондрий [14]. Возможно, НПВП играют роль в активации воспалительных путей при ВЗК через аналогичные механизмы [15]. Препаратом выбора из группы НПВП для пациентов с ВЗК являются селективные ингибиторы ЦОГ-2-коксибы – эторикоксиб, целекоксиб. Они считаются наиболее безопасными, с более низким риском рецидивирования заболевания по сравнению с неселективными НПВП [16]. Лечение эторикоксибом не было связано с появлением осложнений, связанных с ВЗК и другими заболеваниями ЖКТ [17].
Учитывая возраст пациента, иммуноопосредованный кожный процесс в виде гангренозной пиодермии, СД2, ХИБС, ГБ для помощи в определении дальнейшей тактики ведения и исключения риска полипрагмазии был осуществлен мультидисциплинарный консилиум специалистов регионального центра по диагностике и лечению ВЗК Чувашской Республики совместно со специалистами ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих» (телемедицинская консультация). С учетом имеющихся данных и сопутствующего коморбидного фона в качестве иммуносупрессивной патогенетической терапии была рекомендована схема лечения top down с использованием полностью человеческого моноклонального антитела IgG, специфически ингибирующего интерлейкины 12 и 23 в дозе 390 мг внутривенно капельно однократно с последующим поддерживающим введением препарата по 90 мг подкожно раз в 8 недель. Устекинумаб был выбран в связи с подтвержденным благоприятным профилем безопасности, хорошей переносимостью и быстрым противовоспалительным эффектом, долгосрочной эффективностью, что оптимально для пожилых коморбидных пациентов с иммуноопосредованными заболеваниями [18]. В ходе проведенных клинических исследований подтверждено, что профиль безопасности устекинумаба остается благоприятным в течение 4 лет долгосрочного периода наблюдений у пациентов с язвенным колитом и 5 лет у пациентов с болезнью Крона [19]. Эффективность и безопасность устекинумаба при БК были оценены в клинических испытаниях UNITI-1, UNITI-2, IM-UNITI, UNITI LTE [2, 3] и подтверждены в реальной клинической практике в многочисленных ретроспективных и проспективных исследованиях.
На фоне терапии моноклональным антителом устекинумабом было проведено контрольное обследование пациента через 3 месяца после начала терапии, которое показало эффективность проводимого лечения. Помимо уменьшения частоты стула до 1–2 раз в сутки, происходило полное купирование абдоминального болевого синдрома и лихорадки, приостановилось снижение массы тела, а также наблюдалось значительное улучшение со стороны кожных покровов.
Заключение
Представленный клинический случай демонстрирует подходы к оптимальному выбору лекарственных препаратов у коморбидных пациентов с ВЗК во избежание полипрагмазии. Эти результаты указывают на то, что больше не означает лучше, и подчеркивают важность усовершенствованных алгоритмов лечения для оптимизации ведения пациентов с ВЗК. Имеющиеся на сегодняшний день данные позволяют отнести ингибиторы интерлейкина 12/23 (устекинумаб) к препарату выбора у коморбидных пациентов с воспалительными заболеваниями кишечника.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Тарасова Лариса Владимировна – д-р мед. наук, доц., зав. каф. госпитальной терапии, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»; зав. отд. гастроэнтерологии, БУ «Республиканская клиническая больница». E-mail: tlarisagast18@mail.ru; ORCID: 0000-0003-1496-0689
Larisa V. Tarasova – Dr. Sci. (Med.), Assoc. Prof., Ulyanov Chuvash State University; Republic Clinical Hospital.
E-mail: tlarisagast18@mail.ru; ORCID: 0000-0003-1496-0689
Кучерова Надежда Юрьевна – аспирант каф. госпитальной терапии, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»; врач-кардиолог консультативной поликлиники БУ «Республиканский кардиологический диспансер».
E-mail: nadezda_kan@mail.ru; ORCID: 0000-0002-9500-3719
Nadezhda Yu. Kucherova – Graduate Student, Ulyanov Chuvash State University; cardiologist, Republic Cardiology Dispensary.
E-mail: nadezda_kan@mail.ru; ORCID: 0000-0002-9500-3719
Иванова Дарья Альбертовна – ординатор, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова».
E-mail: dashken690@yandex.ru; ORCID: 0000-0001-7516-776X
Daria A. Ivanova – Resident, Ulyanov Chuvash State University.
E-mail: dashken690@yandex.ru ORCID: 0000-0001-7516-776X
Цыганова Юлия Вадимовна – канд. мед. наук, доцент каф. госпитальной терапии ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова». E-mail: j.v.tsyganova@mail.ru
Julia V. Tsyganova – Cand. Sci. (Med.), Ulyanov Chuvash State University. E-mail: j.v.tsyganova@mail.ru; ORCID: 0000-0002-8339-9496
Поступила в редакцию: 25.09.2024
Поступила после рецензирования: 04.10.2024
Принята к публикации: 10.10.2024
Received: 25.09.2024
Revised: 04.10.2024
Accepted: 10.10.2024
Список исп. литературыСкрыть список1. Zhao M, Gonczi L, Lakatos PL, Burisch J. The durden of inflammatory dowel disease in europe in 2020. J Crohns Colitis. 2021;15(9):1573-87. DOI: 10.1093/ecco-jcc/jjab029
2. Cross RK, Wilson KT and Binion DG. Polypharmacy and Crohn’s disease. Alimentary Pharmacol & Therapeutics. 2005;21:1211-1216. DOI: 10.1111/j.1365-2036.2005.02429.x
3. Sheikh-Taha M, Asmar M. Polypharmacy and severe potential drug-drug interactions among older adults with cardiovascular disease in the United States. BMC Geriatr 2021; 233. DOI: 10.1186/s12877-021-02183-0
4. Sergi G, De Rui M, Sarti S, Manzato E. Polypharmacy in the elderly: can comprehensive geriatric assessment reduce inappropriate medication use? Drugs Aging 2011;28(7):509-18. DOI: 10.2165/11592010-000000000-00000.
5. Wang J, Nakamura TI, Tuskey AG, Behm BW. Polypharmacy is a risk factor for disease flare in adult patients with ulcerative colitis: a retrospective cohort study. Intest Res 2019;17(4):496-503. DOI: 10.5217/ir.2019.00050
6. Mosli MH, Alsahafi M, Alsanea MN et al. Multimorbidity among inflammatory bowel disease patients in a tertiary care center: a retrospective study. BMC Gastroenterol 2022:487. DOI: 10.1186/s12876-022-02578-2
7. Bauerle KT, Harris C. Glucocorticoids and Diabetes. Mo Med 2016 Sep-Oct;113(5):378-83.
8. Kuo T, McQueen A, Chen TC, Wang JC. Regulation of Glucose Homeostasis by Glucocorticoids. Adv Exp Med Biol 2015;872:99-126. DOI: 10.1007/978-1-4939-2895-8_5
9. Селимов А.Ю., Елисеева Л.Н., Куринная В.П., Оранский С.П. Нарушения обмена глюкозы у пациентов, принимающих глюкокортикостероиды: особенности клинических проявлений и коррекции. Кубанский научный медицинский вестник. 2019;26(1):209-218.
Selimov A.Yu., Eliseeva L.N., Kurinnaya V.P., Oransky S.P. Glucose metabolism disorders in patients taking glucocorticosteroids: features of clinical manifestations and correction. Kuban Scientific Medical Bulletin. 2019;26(1):209-218 (in Russian).
10. Ghassemi F, Ardeshir RA, Ahmadi G, Hoshmandi A. Azathioprine effects on kidney and liver in diabetic rats. World J Pharmaceutical research 2014;3(2):1559-67.
11. Ananthakrishnan AN, Higuchi LM, Huang ES et al. Aspirin, nonsteroidal anti-inflammatory drug use, and risk for Crohn disease and ulcerative colitis: a cohort study. Ann Intern Med 2012 Mar 6;156(5):350-359. DOI: 10.7326/0003-4819-156-5-201203060-00007
12. Xu XR, Liu CQ, Feng BS, Liu ZJ. Dysregulation of mucosal immune response in pathogenesis of inflammatory bowel disease. World J Gastroenterol 2014 Mar 28;20(12):3255-64. DOI: 10.3748/wjg.v20.i12.3255
13. Meyer AM, Ramzan NN, Heigh RI, Leighton JA. Relapse of inflammatory bowel disease associated with use of nonsteroidal anti-inflammatory drugs. Dig Dis Sci 2006;51(1):168-72. DOI: 10.1007/s10620-006-3103-5
14. Takeuchi K, Smale S, Premchand P et al. Prevalence and mechanism of nonsteroidal anti-inflammatory drug-induced clinical relapse in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2006;4(2):196-202. DOI: 10.1016/s1542-3565(05)00980-8
15. Why NSAIDs Are Bad for Crohn’s and Ulcerative Colitis [Электронный ресурс]. – Режим доступа: https://www.verywellhealth.com/nsaids-non-steroidal-anti-inflammatories-and-ibd-1941656. Дата доступа: 16.09.2024.
16. Садыгова Г.Г. Внекишечные проявления воспалительных заболеваний кишечника: артропатии и артриты. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016;26(6): 101-105. DOI: 10.22416/1382-4376-2016-6-101-105
Sadygova G.G. Extra-intestinal manifestations of inflammatory bowel diseases: arthropathies and arthritis. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2016;26(6):101-105. DOI: 10.22416/1382-4376-2016-6-101-105 (in Russian).
17. El Miedany Y, Youssef S, Ahmed I, El Gaafary M. The gastrointestinal safety and effect on disease activity of etoricoxib, a selective cox-2 inhibitor in inflammatory bowel diseases. Am J Gastroenterol 2006;101(2):311-7. DOI: 10.1111/j.1572-0241.2006.00384.x
18. Mocci G, Tursi A, Onidi FM et al. Ustekinumab in the Treatment of Inflammatory Bowel Diseases: Evolving Paradigms. J Clin Med 2024; 13(5):1519. DOI: 10.3390/jcm13051519
19. Gisbert JP, Chaparro M. Ustekinumab to treat Crohn’s disease. Gastroenterol y Hepatolog (English Edition) 2017;40(10):688-98. DOI: 10.1016/j.gastre.2017.08.003

