Клинический разбор в общей медицине №10 2024
Olga V. Zamachina1, Elena A. Temereva1, Irina Yu. Botvinko3
1 Omsk State Medical University, Omsk, Russia;
2 Budget-Financed Healthcare Institution of the Omsk Region "Clinical Cardiology Dispensary", Omsk, Russia;
3 Budgetary Healthcare Institution of the Omsk Region "Clinical medical and sanitary unit No. 7", Omsk, Russia
ElenaV.Usacheva@yandex.ru
Abstract
Currently, there is an increase in the frequency of comorbid conditions, which are accompanied by a change in the clinical picture of the course of diseases, insufficient effectiveness of standard therapy, and an increased risk of progression and development of complications of existing diseases. The article presents a clinical case of diagnosis of pulmonary hypertension in a patient with comorbid pathology. This case demonstrates the identification of systemic connective tissue disease and pulmonary hypertension in a patient who already has pathology of the cardiovascular, nervous and endocrine systems and metabolic disorders requiring complex therapy with justified polypharmacy in this case and mutually exclusive requirements for the control of various diseases. Only a joint discussion of the tactics of patient management by doctors of different specialties allows therapist to develop an optimal treatment plan, prevent adverse drug interactions, contributing to improving the quality and increasing the life expectancy of patients with comorbid pathology.
Keywords: pulmonary hypertension, multiple sclerosis, scleroderma, systemic connective tissue diseases, interferon, comorbid pathology, Raynaud's syndrome, angina pectoris, pain due to the dilation of the pulmonary artery.
For citation: Usacheva E.V., Nadey E.V., Shkirinets A.V., Nakonechnaia E.E., Zamahina O.V., Temereva E.A., Botvinko I.U. A clinical case of diagnosis of pulmonary hypertension in a patient with comorbid pathology. Clinical review for general practice. 2024; 5 (10): 39–45 (In Russ.). DOI: 10.47407/kr2024.5.10.00494
При диагностике и выборе тактики ведения пациента с коморбидной патологией врачу первичного звена необходимо рассмотреть несколько возможных направлений:
1) сочетание отдельных заболеваний;
2) случаи, когда одно из имеющихся патологических состояний является синдромом в клинической картине второго сочетанного патологического состояния, например АГ у пациента с почечной или эндокринной патологией; легочная гипертензия (ЛГ) у пациента с бронхолегочной патологией или системным заболеванием соединительной ткани;
3) лекарственные эффекты при лечении хронической патологии. Например, развитие АГ лекарственного генеза у пациентов со злокачественными новообразованиями, получающих рекомбинантные гиперхимерные моноклональные IgG1 антитела, которые селективно связываются и ингибируют биологическую активность фактора роста эндотелия сосудов (VEGF); развитие эрозивно-язвенного поражения желудочно-кишечного тракта у пациентов с патологией костно-мышечной системы, принимающих нестероидные противовоспалительные препараты; развитие ЛГ у пациентов с рассеянным склерозом (РС), получающих интерферон бета-1а.
В качестве примера патологического состояния, которое может выступать как в роли самостоятельного заболевания (первичная/идиопатическая ЛГ), так и быть синдромом в клинической картине заболеваний бронхолегочной системы и соединительной ткани, а также быть лекарственно-индуцированным патологическим состоянием, следует рассмотреть ЛГ [5]. ЛГ – патологическое состояние, которое встречается у 1% населения и характеризуется высоким уровнем смертности [3]. В зависимости от происхождения выделяют 5 клинических подгрупп ЛГ: идиопатическая легочная артериальная гипертензия (ИЛАГ), ЛГ вследствие заболеваний левых отделов сердца, ЛГ вследствие хронического заболевания легких, хроническая тромбоэмболическая ЛГ (ХТЭЛГ) и ЛГ с неясными и многофакторными механизмами заболеваний [4]. Наиболее раннее выявление ЛГ и установление ее причины является значимым для улучшения прогноза у данной категории пациентов. Поэтому внедрение доступных на уровне первичного звена здравоохранения диагностических инструментов и критериев ЛГ имеет решающее значение для точного и раннего распознавания этого патологического состояния, направления пациентов к специалистам с целью своевременного начала терапии [6, 7]. В данной статье представлен клинический случай поздней диагностики ЛГ высокой степени сочетанного генеза у пациентки с коморбидной патологией.
Анамнез заболевания: считает себя больной с ноября 2020 г., когда после перенесенной новой коронавирусной инфекции с тяжелой пневмонией (55% поражения легочной ткани) появилась легкая инспираторная одышка. После выписки из стационара одышка сохранялась, но пациентка к врачам длительное время не обращалась, поскольку толерантность к физическим нагрузкам была удовлетворительной.
В апреле 2023 г. в связи с усилением одышки пациентка обратилась к участковому терапевту. Было рекомендовано лабораторно-инструментальное обследование для установления причины одышки. Выполнена компьютерная томография (КТ) органов грудной клетки, где обнаружены КТ-признаки микронодулярных очагов обоих легких, признаки ЛГ (расширение ствола легочной артерии до 36 мм). По результатам лабораторного обследования выявлена анемия (гемоглобин 75 г/л). 29.05.2023 пациентка консультирована гематологом, выставлен диагноз «В12-дефицитная анемия тяжелой степени». Проведено лечение цианокобаломином парентерально с положительным эффектом. Однако одышка сохранялась, в связи с чем пациентку осмотрел кардиолог. По результатам осмотра установлен диагноз «Хроническая ишемическая болезнь сердца неуточненная. АГ II стадии, риск 3 (высокий)», назначена гипотензивная терапия сартанами. По данным дуплексного сканирования брахиоцефальных артерий было выявлено атеросклеротическое поражение со стенозом сонных артерий 35–55% с обеих сторон, назначены статины.
Поскольку, несмотря на лечение, одышка сохранялась, в сентябре 2023 г. пациентка обратилась к пульмонологу, предоставив КТ органов грудной клетки от 06.04.2023. Пульмонолог выставил диагноз «Очаговые образования S9 правого легкого», дал рекомендации по динамическому наблюдению за размером очагов. С учетом низкой приверженности рекомендациям врача с сентября 2023 г. до января 2024 г. пациентка за медицинской помощью не обращалась.
Во второй половине января 2024 г. пациентка стала отмечать появление загрудинных болей в ответ на привычную физическую нагрузку, появился страх выходить из дома. 29.01.2024 приступ загрудинных болей развился на улице во время умеренной физической нагрузки, сопровождался головокружением, чувством страха, в связи с чем по неотложной помощи пациентка была госпитализирована в кардиологическое отделение.
По результатам обследования в стационаре: гемоглобин 164 г/л; общий белок 60 г/л, мочевая кислота 902 ммоль/л, мочевина 10,5 ммоль/л, железо 8,36 ммоль/л, креатинин 144–124 мкмоль/л, СКФ по формуле CKD-EPI 39 мл/мин/1,73м2; тиреотропный гормон 4,4 мЕД/л, Д-димер 1816 нг/мл 1347 нг/мл (от 30.01.2024). Проведена коронарография, по результатам которой патологии коронарных артерий не выявлено. По данным эхокардиографии (29.01.2024) выявлены диффузные склерогенные изменения сердца с дилатацией полости левого предсердия и правых отделов сердца, концентрическая гипертрофия левого желудочка (ЛЖ) с нарушением его диастолической функции, признаки аортального порока сердца – умеренная недостаточность аортального клапана, признаки ЛГ (70 мм рт. ст.). Проведена повторно КТ органов грудной клетки (29.01.2024), выявлены КТ-признаки одиночного очагового образования в правом легком (S9), признаки хронического бронхита, внутригрудной лимфаденопатии, атеросклеротических изменений грудной аорты и ЛГ (ствол легочной артерии расширен до 39 мм). Пациентка выписана из стационара 07.02.2024 с диагнозом «Атеросклеротическая болезнь сердца. Недостаточность аортального клапана. Гипертоническая болезнь III стадии, риск очень высокий. Гипертрофия ЛЖ, экссудативно-адгезивный перикардит. Вторичная ЛГ. Диастолическая дисфункция ЛЖ. ХСН стадия IIА с сохранной ФВ, ФК III. Атеросклероз БЦА 35–55%. Рассеянный склероз, ремитирующее течение, длительная ремиссия». Рекомендовано наблюдение терапевта, невролога, консультации пульмонолога, онколога, гематолога, прием спиронолактона, дапаглифлозина, аторвастатина, ивабрадина, ацетилсалициловой кислоты, периндоприла. Согласно рекомендациям выписного эпикриза, в связи с наличием очагового образования в правом легком (S9) и сохраняющейся одышкой на фоне назначенного лечения участковый терапевт направил пациентку к пульмонологу.
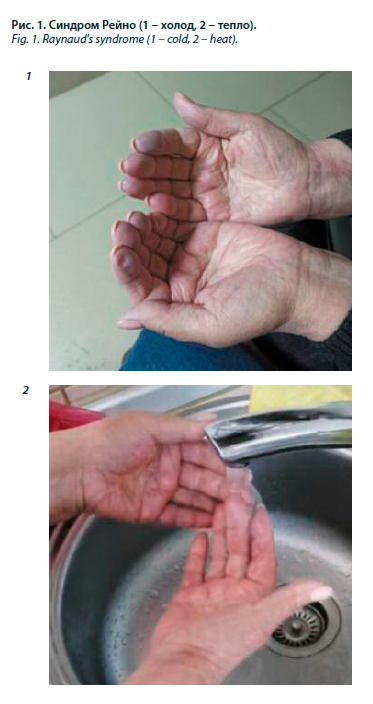 Анамнез жизни: туберкулез, гепатит В и С, венерические заболевания, ВИЧ отрицает. Вредных привычек нет. Пенсионер, профессиональный анамнез отягощен – работа в течение 20 лет в химической лаборатории. Инвалид 2-й группы по РС с 2019 г. Аллергологический анамнез отягощен – крапивница на никотиновую кислоту, пирацетам. Не переносит нитроглицерин (гипотензия), гепарин. Наследственный анамнез отягощен по ССЗ – у мамы инфаркт в 51 год, ТЭЛА, у папы ОНМК, у братьев и сестер ССЗ. Сопутствующая патология: АГ, РС, АИТ. Гинекологически здорова. По поводу РС получает на регулярной основе 1 раз в 2 недели в течение более чем 10 лет пэгинтерферон бета-1а. В 2018 г. выявлен атеросклероз брахиоцефальных артерий с гемодинамически незначимым стенозом сонных артерий. Бытовые условия удовлетворительные.
Анамнез жизни: туберкулез, гепатит В и С, венерические заболевания, ВИЧ отрицает. Вредных привычек нет. Пенсионер, профессиональный анамнез отягощен – работа в течение 20 лет в химической лаборатории. Инвалид 2-й группы по РС с 2019 г. Аллергологический анамнез отягощен – крапивница на никотиновую кислоту, пирацетам. Не переносит нитроглицерин (гипотензия), гепарин. Наследственный анамнез отягощен по ССЗ – у мамы инфаркт в 51 год, ТЭЛА, у папы ОНМК, у братьев и сестер ССЗ. Сопутствующая патология: АГ, РС, АИТ. Гинекологически здорова. По поводу РС получает на регулярной основе 1 раз в 2 недели в течение более чем 10 лет пэгинтерферон бета-1а. В 2018 г. выявлен атеросклероз брахиоцефальных артерий с гемодинамически незначимым стенозом сонных артерий. Бытовые условия удовлетворительные.
Объективный осмотр (по заключению пульмонолога в феврале 2024 г.): состояние удовлетворительное, сознание ясное, положение активное, телосложение правильное, нормостеник. Рост 165 см, вес 70 кг. Кожные покровы бледно-розовые, влажность умеренная, высыпаний нет, тургор сохранен. Отеков нет. Слизистые оболочки розовые, влажные, высыпаний нет. Видимого увеличения периферических лимфоузлов нет, пальпаторно лимфоузлы не увеличены. Щитовидная железа не изменена. Молочные железы не изменены. Температура тела в норме. Суставы не деформированы, кожа над ними не изменена, подвижность сохранена. Позвоночник с сохраненными изгибами, подвижность во всех отделах сохранена, при пальпации безболезненный. Кончики пальцев обеих рук синюшные, меняют цвет на бледный при надавливании и в тепле, при контакте с холодом снова становятся синюшными (рис. 1). Грудная клетка правильной формы, симметричная, обе половины одинаково участвуют в акте дыхания. Пальпаторно грудная клетка безболезненная, эластичная. Перкуторно звук легочный, одинаковый на симметричных участках. Аускультативно дыхание везикулярное, побочные дыхательные шумы не выслушиваются. ЧДД 22 в минуту. Сатурация 93%. Прекардиальная область визуально не изменена. Пальпаторно патологические пульсации не выявлены, дрожание отсутствует. Аускультативно тоны сердца приглушены, акцент и расщепление 2-го тона на легочной артерии, тоны ритмичные, шумов не выслушивается. ЧСС 102 в минуту. Пульс ритмичный, одинаковый, равномерный, умеренного наполнения и напряжения, 102 в минуту, сосудистая стенка гладкая, эластичная. АД 134/80 мм рт. ст. Варикозное расширение вен нижних конечностей отсутствует. Язык розовый, влажный, налета нет. Живот не увеличен. Передняя брюшная стенка мягкая, безболезненная. Нижний край печени не выходит за край реберной дуги, безболезненный, эластичный. Селезенка, поджелудочная железа, почки не пальпируются. Симптом поколачивания отрицательный с обеих сторон.
Диагноз пульмонолога:
ЛГ, требующая уточнения по генезу и степени выраженности, вероятно, сочетанного генеза. Дыхательная недостаточность перфузионного генеза 1-й степени, требующая уточнения степени тяжести по газам крови.
Кардиалгии неуточненного генеза (микроваскулярная стенокардия? стенокардия Кача? коронарная недостаточность на фоне механического сдавления коронарной артерии стволом легочной артерии?).
Хроническая правожелудочковая сердечная недостаточность I стадии по Василенко–Стражеско, II ФК, ДДЛЖ 1-го типа с ФВ 55%.
Очаговое образование S9 правого легкого стабильное (Volume Doubling Time:585 day(s): 9 мм 29.01.20204, 8 мм от 06.04.2023), с низким риском – Brock Model Probability: 4.7%.
Аутоиммунный тиреоидит, гипотиреоз, компенсированный 100 мкг эутирокса.
Гиперурикемия неуточненная.
Рассеянный склероз, ремиттирующее течение, ремиссия; вестибулоатаксический синдром, парапарез нижний спастический умеренный.
Склерогенные изменения клапанного аппарата сердца, требующие уточнения их степени выраженности.
Cтадия АГ требует уточнения (гипертрофия ЛЖ), риск 4.
С целью верификации диагноза рекомендовано:
1) повторно эходопплеркардиография, в том числе с определением параметров, отражающих гемодинамику правых отделов сердца и позволяющих оценить тип ЛГ (прекапиллярная/посткапиллярная);
2) КТ органов грудной клетки с контрастированием сосудов малого круга кровообращения для исключения посттромбоэмболического генеза ЛГ (с контролем уровня креатинина крови);
3) дуплексное сканирование вен нижних конечностей.
При дуплексном сканировании вен нижних конечностей выявлены признаки клапанной венозной недостаточности в малоберцовых венах левой голени, в притоке правой большой подкожной вены на голени, рекомендована консультация сердечно-сосудистого хирурга. По результатам КТ-ангиографии легочных сосудов, проведенной в апреле 2024 г., КТ-признаков тромбоза ветвей легочной артерии не выявлено, выявлены косвенные признаки ЛГ (легочный ствол 38 мм, диаметр аорты 34 мм), признаки единичных очагов локального фиброза легких с обеих сторон, по сравнению с КТ от 06.04.2023 – без динамики.
По результатам эходопплеркардиографии (март 2024 г.) обнаружены признаки высокой ЛГ (градиент давления в ЛА по потоку трикуспидальной регургитации 78 мм рт. ст. при относительно сохранных левых отделах сердца). При расчете показателей давления заклинивания легочной артерии и легочного сосудистого сопротивления установлен прекапиллярный генез ЛГ, что в совокупности с наличием признаков синдрома Рейно позволило заподозрить системное заболевание соединительной ткани. Пациентка направлена на исследование уровня «IgG антинуклеарный фактор на HEp-2 клетках» (АНФ) в крови с последующей консультацией ревматолога. По итогам анализа крови на АНФ установлен повышенный титр – 1:5120 (при норме до 1:160), и по результатам обследования ревматолога был установлен диагноз «Системная склеродермия (СС), лимитированная форма, хроническое течение с поражением кожи (плотный отек кожи пальцев кистей, ограничение аппертуры рта), сосудов (телеангиоэктазии, синдром Рейно), легочная АГ высокой степени, иммунологические нарушения (позитивность по АНФ – 1:5120 с типом свечения АС21 и АС 3, антитела к центромере, антинуклеарные антитела)». Ревматолог назначил комплексное лечение, эффективность и безопасность которого планируется оценить в динамике.
С учетом того, что пациентка С. в течение многих лет наблюдалась у невролога с диагнозом РС и длительно получала препараты интерферона, ее направили к неврологу с целью коррекции лечения с отменой интерферона, терапия скорректирована. Пациентка продолжает наблюдение и лечение, эффективность которого планируется оценить через 3 месяца. В данном клиническом случае интерес представляет обоснованная полипрагмазия (полифармация) при медикаментозной терапии коморбидной патологии (сердечно-сосудистой патологии, РС, СС, ЛГ), которая в данном случае сопровождалась развитием нежелательных явлений.
Рассуждая о происхождении ЛГ в данном клиническом случае, можно говорить о нескольких возможных причинах ее развития:
1) системное заболевание соединительной ткани (СС);
2) отягощенный профессиональный анамнез;
3) лекарственно-индуцированная легочная гипертензия (ЛИЛГ).
Известно, что системные заболевания соединительной ткани (СЗСТ) могу быть связаны с различными формами ЛГ, включая легочную АГ, легочную веноокклюзионную болезнь, легочную венозную гипертензию; ЛГ, связанную с интерстициальным заболеванием легких; ХТЭЛГ и иногда сочетание нескольких вариантов [8]. Из всех СЗСТ наиболее распространена ЛГ у пациентов с СС, далее идут пациенты с системной красной волчанкой, смешанными заболеваниями соединительной ткани, реже ЛГ встречается при синдроме Шегрена, ревматоидном артрите и дерматомиозите [9, 10].
СС составляет 75% случаев ЛГ, связанной с СЗСТ. Прогноз ЛГ, ассоциированной с СЗСТ, хуже, чем при других формах ЛГ. Хотя, как и при ИЛАГ, механизм ЛГ, ассоциированной с СЗСТ, связан с увеличением количества вазоконстрикторов, таких как эндотелин-1, и снижением выработки вазодилататоров, таких как простациклин и оксид азота. Воспалительные и аутоиммунные механизмы также играют роль в развитии и прогрессировании ЛГ. Чаще всего в формировании ЛГ,
ассоциированной с СЗСТ, имеется несколько патофизиологических механизмов, а понимание того, какой механизм является доминирующим, очень важно при определении тактики ведения пациента [20].
ЛГ обычно становится более поздним проявлением СС и чаще всего возникает через 10–15 лет после постановки диагноза [11]. У пациентов с системной склеродермией ЛГ имеет сложный сочетанный генез и на практике определить вклад каждого фактора в ее развитие не представляется возможным. В частности, ЛГ, развивающаяся при СС, возникает за счет ремоделирования легочных сосудов, которое определяет формирование прекапиллярного ее компонента. В ряде случаев у пациентов с СС развивается диффузный интерстициальный пневмофиброз, который при выраженной его степени приводит к развитию или усугубляет уже имеющуюся прекапиллярную ЛГ. У пациентов с СС имеется более высокий риск легочной тромбоэмболии, что может привести к развитию хронической тромбоэмболической ЛГ, которая также является прекапиллярной. Фиброз миокарда и склерогенные изменения клапанного аппарата левых отделов сердца, характерные для пациентов с СС, предрасполагают к систолической и диастолической дисфункции ЛЖ, что формирует посткапиллярный компонент в происхождении ЛГ [12]. Именно сочетанный генез ЛГ при СС определяет низкую эффективность медикаментозной терапии и плохой прогноз.
У нашей пациентки имеется отягощенный профессиональный анамнез – работа в течение 20 лет в химической лаборатории. К сожалению, она не может предоставить санитарно-гигиеническую характеристику своего рабочего места, поэтому можно судить о ее работе лишь опираясь на данные литературы. К группе опасных веществ, с которыми контактирует работник химической лаборатории, можно отнести свинец, окись углерода, сероводород, бензол, трихлорэтилен. Особое внимание стоит обратить на трихлорэтилен: этот органический растворитель тесно связан с развитием ЛГ, ХТЭЛГ и легочной веноокклюзионной болезни (ЛВОБ) – редкой, но тяжелой формы ЛГ, характеризующейся прогрессирующей обструкцией легочных вен и артерий, связанной с пролиферацией легочных капилляров. По сравнению с ЛАГ клиническое течение ЛВОБ обычно более агрессивное и характеризуется слабым ответом на ЛАГ-специфическую терапию [15].
ЛИЛГ патофизиологически является артериальной, поэтому очень схожа с ИЛАГ. К наиболее известным причинам ЛИЛГ может привести использование таких препаратов и веществ, как аминорекс, бенфлюорекс, метамфетамины. Эти препараты являются факторами риска ЛГ и поэтому были сняты с производства. Интерферон-β (ИФН), используемый в лечении РС, считается препаратом с возможным риском индукции ЛИЛГ [16]. РС – воспалительное заболевание центральной нервной системы, которое приводит к прогрессирующей нейродегенерации у большинства больных и становится частой причиной утраты трудоспособности у молодых лиц [3]. Заболевание в 2 раза чаще развивается у женщин, чем у мужчин, а первые признаки болезни проявляются в возрасте от 20 до
40 лет. Симптомы РС усиливаются с течением времени, при этом методов лечения, позволяющих достичь полного выздоровления, нет, но для поддержания ремиссии пациентам на длительное время назначают препараты, изменяющие течение РС, такие как ИФН. Хотя преимущества терапии ИФН доказаны, данные препараты имеют несколько побочных эффектов: чаще это гриппоподобное состояние, реже – нейропсихические эффекты (депрессия) и миелосупрессия (панцитопения). ЛГ – редкий, но серьезный побочный эффект терапии ИФН. По мере расширения показаний к применению ИФН, включающих хронический гепатит и РС, увеличилась частота зарегистрированных случаев ЛГ [17, 18]. Таким образом, консенсусная группа экспертов классифицировала интерфероны α и β как лекарственные препараты, которые являются возможным фактором развития ЛГ [19].
В данном случае у пациентки С. диагностирована прекапиллярная ЛГ, и диагностический поиск при наличии отягощенного наследственного анамнеза по ТЭЛА, перенесенного тяжелого COVID-19 и патологии вен нижних конечностей был начат с исключения ХТЭЛГ.
В то же время были получены лабораторные данные, подтверждающие наличие системной склеродермии. Таким образом, анализируя катамнез пациентки С., можно обозначить несколько причин для развития у нее ЛГ: основным патологическим процессом, приведшим к развитию ЛГ, была признана системная склеродермия, в то же время нельзя отрицать влияние производственных факторов химической лаборатории и индуцированную ИФН ЛГ. Следует отметить, что наличие недостаточности аортального клапана не исключает и посткапиллярный компонент в генезе ЛГ, однако с учетом сохранной систолической функции миокарда ЛЖ данный компонент выражен минимально и не определяет течение и прогноз ЛГ при условии стабильности порока.
Пациентка продолжает наблюдаться, и мы планируем в следующей публикации обсудить эффективность и безопасность скорректированной медикаментозной терапии коморбидной патологии (сердечно-сосудистой патологии, РС, СС, ЛГ), а также динамику клинических проявлений имеющихся заболеваний.
Конфликт интересов. Конфликт интересов отсутствует.
Conflict of interests. There is no conflict of interest.
Информация о спонсорстве. Спонсор отсутствует.
Sponsorship information. There is no sponsor.
Информация об авторах
Information about the authors
Усачева Елена Владимировна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: elenav.usacheva@yandex.ru; ORCID: 0000-0002-6134-1533
Elena V. Usacheva – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: elenav.usacheva@yandex.ru; ORCID: 0000-0002-6134-1533
Надей Елена Витальевна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: nadeyelena@yandex.ru; ORCID: 0000-0003-0440-7118
Elena V. Nadey – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: nadeyelena@yandex.ru; ORCID: 0000-0003-0440-7118
Шкиринец (Нелидова) Анастасия Владимировна – канд. мед. наук, доц., доц. каф. пропедевтики внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: avnelidova@mail.ru, ORCID: 0000-0003-0149-6119
Anastasiya V. Shkirinets (Nelidova) – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: avnelidova@mail.ru; ORCID: 0000-0003-0149-6119
Наконечная Екатерина Эдуардовна – врач-ревматолог, зав. ревматологическим отделением, БУЗОО «Клинический кардиологический диспансер». E-mail: eka_giz@mail.ru
Ekaterina E. Nakonechnaya – Rheumatologist, Head of the rheumatology department, Clinical Cardiological Dispensary. E-mail: eka_giz@mail.ru
Замахина Ольга Владимировна – канд. мед. наук, доц., доц. каф. пропедевтики внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: ozamakhina@yandex.ru; ORCID: 0000-0003-0748-2324
Olga V. Zamachina – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: ozamakhina@yandex.ru; ORCID: 0000-0003-0748-2324
Темерева Елена Александровна – врач-ординатор по специальности «терапия» каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: lenatemereva@mail.ru.
Elena A. Temereva – Medical Resident, Omsk State Medical University. E-mail: lenatemereva@mail.ru
Ботвинко Ирина Юрьевна – врач функциональной диагностики, БУЗОО «КМСЧ №7». E-mail: irinabotvinko@mail.ru
Irina Yu. Botvinko – Functional diagnostics doctor, Clinical Medical and Sanitary Unit No. 7. E-mail: irinabotvinko@mail.ru
Поступила в редакцию: 23.09.2024
Поступила после рецензирования: 01.10.2024
Принята к публикации: 03.10.2024
Received: 23.09.2024
Revised: 01.10.2024
Accepted: 03.10.2024
Клинический разбор в общей медицине №10 2024
Клинический случай диагностики легочной гипертензии у пациента с коморбидной патологией
Номера страниц в выпуске:39-45
Аннотация
В настоящее время наблюдается увеличение частоты коморбидных состояний, которые характеризуются изменением клинической картины течения заболеваний, недостаточной эффективностью лечения, увеличением риска прогрессирования и развития осложнений.
В статье представлен клинический случай диагностики легочной гипертензии у пациента с коморбидной патологией. Продемонстрировано выявление системного заболевания соединительной ткани и легочной гипертензии у пациента, уже имеющего патологию сердечно-сосудистой, нервной и эндокринной систем и метаболические расстройства, требующие комплексной терапии с обоснованной в данном случае полифармацией и взаимоисключающими требованиями к контролю разных заболеваний. Только совместное обсуждение тактики ведения пациента врачами разных специальностей позволяет выработать оптимальный план лечения, предотвратить неблагоприятные лекарственные взаимодействия, способствуя улучшению качества и увеличению продолжительности жизни пациентов с коморбидной патологией.
Ключевые слова: легочная гипертензия, рассеянный склероз, склеродермия, системные заболевания соединительной ткани, интерферон, коморбидная патология, синдром Рейно, стенокардия Кача.
Для цитирования: Усачева Е.В., Надей Е.В., Шкиринец А.В., Наконечная Е.Э., Замахина О.В., Темерева Е.А., Ботвинко И.Ю. Клинический случай диагностики легочной гипертензии у пациента с коморбидной патологией. Клинический разбор в общей медицине. 2024; 5 (10): 39–45. DOI: 10.47407/kr2024.5.10.00494
В настоящее время наблюдается увеличение частоты коморбидных состояний, которые характеризуются изменением клинической картины течения заболеваний, недостаточной эффективностью лечения, увеличением риска прогрессирования и развития осложнений.
В статье представлен клинический случай диагностики легочной гипертензии у пациента с коморбидной патологией. Продемонстрировано выявление системного заболевания соединительной ткани и легочной гипертензии у пациента, уже имеющего патологию сердечно-сосудистой, нервной и эндокринной систем и метаболические расстройства, требующие комплексной терапии с обоснованной в данном случае полифармацией и взаимоисключающими требованиями к контролю разных заболеваний. Только совместное обсуждение тактики ведения пациента врачами разных специальностей позволяет выработать оптимальный план лечения, предотвратить неблагоприятные лекарственные взаимодействия, способствуя улучшению качества и увеличению продолжительности жизни пациентов с коморбидной патологией.
Ключевые слова: легочная гипертензия, рассеянный склероз, склеродермия, системные заболевания соединительной ткани, интерферон, коморбидная патология, синдром Рейно, стенокардия Кача.
Для цитирования: Усачева Е.В., Надей Е.В., Шкиринец А.В., Наконечная Е.Э., Замахина О.В., Темерева Е.А., Ботвинко И.Ю. Клинический случай диагностики легочной гипертензии у пациента с коморбидной патологией. Клинический разбор в общей медицине. 2024; 5 (10): 39–45. DOI: 10.47407/kr2024.5.10.00494
A clinical case of diagnosis of pulmonary hypertension in a patient with comorbid pathology
Elena V. Usacheva1, Elena V. Nadey1, Anastasiya V. Shkirinets1,2, Ekaterina E. Nakonechnaya2,Olga V. Zamachina1, Elena A. Temereva1, Irina Yu. Botvinko3
1 Omsk State Medical University, Omsk, Russia;
2 Budget-Financed Healthcare Institution of the Omsk Region "Clinical Cardiology Dispensary", Omsk, Russia;
3 Budgetary Healthcare Institution of the Omsk Region "Clinical medical and sanitary unit No. 7", Omsk, Russia
ElenaV.Usacheva@yandex.ru
Abstract
Currently, there is an increase in the frequency of comorbid conditions, which are accompanied by a change in the clinical picture of the course of diseases, insufficient effectiveness of standard therapy, and an increased risk of progression and development of complications of existing diseases. The article presents a clinical case of diagnosis of pulmonary hypertension in a patient with comorbid pathology. This case demonstrates the identification of systemic connective tissue disease and pulmonary hypertension in a patient who already has pathology of the cardiovascular, nervous and endocrine systems and metabolic disorders requiring complex therapy with justified polypharmacy in this case and mutually exclusive requirements for the control of various diseases. Only a joint discussion of the tactics of patient management by doctors of different specialties allows therapist to develop an optimal treatment plan, prevent adverse drug interactions, contributing to improving the quality and increasing the life expectancy of patients with comorbid pathology.
Keywords: pulmonary hypertension, multiple sclerosis, scleroderma, systemic connective tissue diseases, interferon, comorbid pathology, Raynaud's syndrome, angina pectoris, pain due to the dilation of the pulmonary artery.
For citation: Usacheva E.V., Nadey E.V., Shkirinets A.V., Nakonechnaia E.E., Zamahina O.V., Temereva E.A., Botvinko I.U. A clinical case of diagnosis of pulmonary hypertension in a patient with comorbid pathology. Clinical review for general practice. 2024; 5 (10): 39–45 (In Russ.). DOI: 10.47407/kr2024.5.10.00494
Введение
В течение последних десятилетий наблюдается увеличение выявляемости коморбидных состояний, сопровождаемых изменением клинической картины заболеваний, недостаточной эффективностью лечения, увеличением риска прогрессирования заболеваний и развития осложнений [1]. Наибольшая нагрузка в части диагностики и наблюдения пациентов с сочетанной патологией ложится на плечи участкового терапевта и врача общей практики (семейного врача), которые должны учитывать мнение узких специалистов и принимать оптимальные решения по ведению больного [2]. Наиболее частое коморбидное состояние – внутрисистемная сердечно-сосудистая коморбидность (артериальная гипертензия – АГ – и ишемическая болезнь сердца – ИБС), на втором месте по распространенности – межсистемная коморбидность: сочетание АГ/ИБС с сахарным диабетом 2-го типа. Реже встречается сочетание АГ/ИБС с бронхолегочными заболеваниями (хроническая обструктивная болезнь легких, бронхиальная астма), сочетание аутоиммунного тиреоидита и бронхиальной астмы [1]. Есть и относительно редкие сочетания, например сердечно-сосудистые заболевания (ССЗ) и неврологическая патология [3].При диагностике и выборе тактики ведения пациента с коморбидной патологией врачу первичного звена необходимо рассмотреть несколько возможных направлений:
1) сочетание отдельных заболеваний;
2) случаи, когда одно из имеющихся патологических состояний является синдромом в клинической картине второго сочетанного патологического состояния, например АГ у пациента с почечной или эндокринной патологией; легочная гипертензия (ЛГ) у пациента с бронхолегочной патологией или системным заболеванием соединительной ткани;
3) лекарственные эффекты при лечении хронической патологии. Например, развитие АГ лекарственного генеза у пациентов со злокачественными новообразованиями, получающих рекомбинантные гиперхимерные моноклональные IgG1 антитела, которые селективно связываются и ингибируют биологическую активность фактора роста эндотелия сосудов (VEGF); развитие эрозивно-язвенного поражения желудочно-кишечного тракта у пациентов с патологией костно-мышечной системы, принимающих нестероидные противовоспалительные препараты; развитие ЛГ у пациентов с рассеянным склерозом (РС), получающих интерферон бета-1а.
В качестве примера патологического состояния, которое может выступать как в роли самостоятельного заболевания (первичная/идиопатическая ЛГ), так и быть синдромом в клинической картине заболеваний бронхолегочной системы и соединительной ткани, а также быть лекарственно-индуцированным патологическим состоянием, следует рассмотреть ЛГ [5]. ЛГ – патологическое состояние, которое встречается у 1% населения и характеризуется высоким уровнем смертности [3]. В зависимости от происхождения выделяют 5 клинических подгрупп ЛГ: идиопатическая легочная артериальная гипертензия (ИЛАГ), ЛГ вследствие заболеваний левых отделов сердца, ЛГ вследствие хронического заболевания легких, хроническая тромбоэмболическая ЛГ (ХТЭЛГ) и ЛГ с неясными и многофакторными механизмами заболеваний [4]. Наиболее раннее выявление ЛГ и установление ее причины является значимым для улучшения прогноза у данной категории пациентов. Поэтому внедрение доступных на уровне первичного звена здравоохранения диагностических инструментов и критериев ЛГ имеет решающее значение для точного и раннего распознавания этого патологического состояния, направления пациентов к специалистам с целью своевременного начала терапии [6, 7]. В данной статье представлен клинический случай поздней диагностики ЛГ высокой степени сочетанного генеза у пациентки с коморбидной патологией.
Клинический случай
Пациентка С., 65 лет, в феврале 2024 г. обратилась к пульмонологу с жалобами на одышку, боль за грудиной, слабость, утомляемость и плохую переносимость физических нагрузок. При детализации жалоб установлено, что одышка возникает во время физической нагрузки по интенсивности несколько выше бытового уровня; боль за грудиной давящая, жгучая, приступообразная с плавным нарастанием интенсивности при отсутствии эффекта от нитроглицерина. При приеме нитроглицерина возникает предобморочное состояние, боль и одышка не купируются.Анамнез заболевания: считает себя больной с ноября 2020 г., когда после перенесенной новой коронавирусной инфекции с тяжелой пневмонией (55% поражения легочной ткани) появилась легкая инспираторная одышка. После выписки из стационара одышка сохранялась, но пациентка к врачам длительное время не обращалась, поскольку толерантность к физическим нагрузкам была удовлетворительной.
В апреле 2023 г. в связи с усилением одышки пациентка обратилась к участковому терапевту. Было рекомендовано лабораторно-инструментальное обследование для установления причины одышки. Выполнена компьютерная томография (КТ) органов грудной клетки, где обнаружены КТ-признаки микронодулярных очагов обоих легких, признаки ЛГ (расширение ствола легочной артерии до 36 мм). По результатам лабораторного обследования выявлена анемия (гемоглобин 75 г/л). 29.05.2023 пациентка консультирована гематологом, выставлен диагноз «В12-дефицитная анемия тяжелой степени». Проведено лечение цианокобаломином парентерально с положительным эффектом. Однако одышка сохранялась, в связи с чем пациентку осмотрел кардиолог. По результатам осмотра установлен диагноз «Хроническая ишемическая болезнь сердца неуточненная. АГ II стадии, риск 3 (высокий)», назначена гипотензивная терапия сартанами. По данным дуплексного сканирования брахиоцефальных артерий было выявлено атеросклеротическое поражение со стенозом сонных артерий 35–55% с обеих сторон, назначены статины.
Поскольку, несмотря на лечение, одышка сохранялась, в сентябре 2023 г. пациентка обратилась к пульмонологу, предоставив КТ органов грудной клетки от 06.04.2023. Пульмонолог выставил диагноз «Очаговые образования S9 правого легкого», дал рекомендации по динамическому наблюдению за размером очагов. С учетом низкой приверженности рекомендациям врача с сентября 2023 г. до января 2024 г. пациентка за медицинской помощью не обращалась.
Во второй половине января 2024 г. пациентка стала отмечать появление загрудинных болей в ответ на привычную физическую нагрузку, появился страх выходить из дома. 29.01.2024 приступ загрудинных болей развился на улице во время умеренной физической нагрузки, сопровождался головокружением, чувством страха, в связи с чем по неотложной помощи пациентка была госпитализирована в кардиологическое отделение.
По результатам обследования в стационаре: гемоглобин 164 г/л; общий белок 60 г/л, мочевая кислота 902 ммоль/л, мочевина 10,5 ммоль/л, железо 8,36 ммоль/л, креатинин 144–124 мкмоль/л, СКФ по формуле CKD-EPI 39 мл/мин/1,73м2; тиреотропный гормон 4,4 мЕД/л, Д-димер 1816 нг/мл 1347 нг/мл (от 30.01.2024). Проведена коронарография, по результатам которой патологии коронарных артерий не выявлено. По данным эхокардиографии (29.01.2024) выявлены диффузные склерогенные изменения сердца с дилатацией полости левого предсердия и правых отделов сердца, концентрическая гипертрофия левого желудочка (ЛЖ) с нарушением его диастолической функции, признаки аортального порока сердца – умеренная недостаточность аортального клапана, признаки ЛГ (70 мм рт. ст.). Проведена повторно КТ органов грудной клетки (29.01.2024), выявлены КТ-признаки одиночного очагового образования в правом легком (S9), признаки хронического бронхита, внутригрудной лимфаденопатии, атеросклеротических изменений грудной аорты и ЛГ (ствол легочной артерии расширен до 39 мм). Пациентка выписана из стационара 07.02.2024 с диагнозом «Атеросклеротическая болезнь сердца. Недостаточность аортального клапана. Гипертоническая болезнь III стадии, риск очень высокий. Гипертрофия ЛЖ, экссудативно-адгезивный перикардит. Вторичная ЛГ. Диастолическая дисфункция ЛЖ. ХСН стадия IIА с сохранной ФВ, ФК III. Атеросклероз БЦА 35–55%. Рассеянный склероз, ремитирующее течение, длительная ремиссия». Рекомендовано наблюдение терапевта, невролога, консультации пульмонолога, онколога, гематолога, прием спиронолактона, дапаглифлозина, аторвастатина, ивабрадина, ацетилсалициловой кислоты, периндоприла. Согласно рекомендациям выписного эпикриза, в связи с наличием очагового образования в правом легком (S9) и сохраняющейся одышкой на фоне назначенного лечения участковый терапевт направил пациентку к пульмонологу.
 Анамнез жизни: туберкулез, гепатит В и С, венерические заболевания, ВИЧ отрицает. Вредных привычек нет. Пенсионер, профессиональный анамнез отягощен – работа в течение 20 лет в химической лаборатории. Инвалид 2-й группы по РС с 2019 г. Аллергологический анамнез отягощен – крапивница на никотиновую кислоту, пирацетам. Не переносит нитроглицерин (гипотензия), гепарин. Наследственный анамнез отягощен по ССЗ – у мамы инфаркт в 51 год, ТЭЛА, у папы ОНМК, у братьев и сестер ССЗ. Сопутствующая патология: АГ, РС, АИТ. Гинекологически здорова. По поводу РС получает на регулярной основе 1 раз в 2 недели в течение более чем 10 лет пэгинтерферон бета-1а. В 2018 г. выявлен атеросклероз брахиоцефальных артерий с гемодинамически незначимым стенозом сонных артерий. Бытовые условия удовлетворительные.
Анамнез жизни: туберкулез, гепатит В и С, венерические заболевания, ВИЧ отрицает. Вредных привычек нет. Пенсионер, профессиональный анамнез отягощен – работа в течение 20 лет в химической лаборатории. Инвалид 2-й группы по РС с 2019 г. Аллергологический анамнез отягощен – крапивница на никотиновую кислоту, пирацетам. Не переносит нитроглицерин (гипотензия), гепарин. Наследственный анамнез отягощен по ССЗ – у мамы инфаркт в 51 год, ТЭЛА, у папы ОНМК, у братьев и сестер ССЗ. Сопутствующая патология: АГ, РС, АИТ. Гинекологически здорова. По поводу РС получает на регулярной основе 1 раз в 2 недели в течение более чем 10 лет пэгинтерферон бета-1а. В 2018 г. выявлен атеросклероз брахиоцефальных артерий с гемодинамически незначимым стенозом сонных артерий. Бытовые условия удовлетворительные.Объективный осмотр (по заключению пульмонолога в феврале 2024 г.): состояние удовлетворительное, сознание ясное, положение активное, телосложение правильное, нормостеник. Рост 165 см, вес 70 кг. Кожные покровы бледно-розовые, влажность умеренная, высыпаний нет, тургор сохранен. Отеков нет. Слизистые оболочки розовые, влажные, высыпаний нет. Видимого увеличения периферических лимфоузлов нет, пальпаторно лимфоузлы не увеличены. Щитовидная железа не изменена. Молочные железы не изменены. Температура тела в норме. Суставы не деформированы, кожа над ними не изменена, подвижность сохранена. Позвоночник с сохраненными изгибами, подвижность во всех отделах сохранена, при пальпации безболезненный. Кончики пальцев обеих рук синюшные, меняют цвет на бледный при надавливании и в тепле, при контакте с холодом снова становятся синюшными (рис. 1). Грудная клетка правильной формы, симметричная, обе половины одинаково участвуют в акте дыхания. Пальпаторно грудная клетка безболезненная, эластичная. Перкуторно звук легочный, одинаковый на симметричных участках. Аускультативно дыхание везикулярное, побочные дыхательные шумы не выслушиваются. ЧДД 22 в минуту. Сатурация 93%. Прекардиальная область визуально не изменена. Пальпаторно патологические пульсации не выявлены, дрожание отсутствует. Аускультативно тоны сердца приглушены, акцент и расщепление 2-го тона на легочной артерии, тоны ритмичные, шумов не выслушивается. ЧСС 102 в минуту. Пульс ритмичный, одинаковый, равномерный, умеренного наполнения и напряжения, 102 в минуту, сосудистая стенка гладкая, эластичная. АД 134/80 мм рт. ст. Варикозное расширение вен нижних конечностей отсутствует. Язык розовый, влажный, налета нет. Живот не увеличен. Передняя брюшная стенка мягкая, безболезненная. Нижний край печени не выходит за край реберной дуги, безболезненный, эластичный. Селезенка, поджелудочная железа, почки не пальпируются. Симптом поколачивания отрицательный с обеих сторон.
Диагноз пульмонолога:
ЛГ, требующая уточнения по генезу и степени выраженности, вероятно, сочетанного генеза. Дыхательная недостаточность перфузионного генеза 1-й степени, требующая уточнения степени тяжести по газам крови.
Кардиалгии неуточненного генеза (микроваскулярная стенокардия? стенокардия Кача? коронарная недостаточность на фоне механического сдавления коронарной артерии стволом легочной артерии?).
Хроническая правожелудочковая сердечная недостаточность I стадии по Василенко–Стражеско, II ФК, ДДЛЖ 1-го типа с ФВ 55%.
Очаговое образование S9 правого легкого стабильное (Volume Doubling Time:585 day(s): 9 мм 29.01.20204, 8 мм от 06.04.2023), с низким риском – Brock Model Probability: 4.7%.
Аутоиммунный тиреоидит, гипотиреоз, компенсированный 100 мкг эутирокса.
Гиперурикемия неуточненная.
Рассеянный склероз, ремиттирующее течение, ремиссия; вестибулоатаксический синдром, парапарез нижний спастический умеренный.
Склерогенные изменения клапанного аппарата сердца, требующие уточнения их степени выраженности.
Cтадия АГ требует уточнения (гипертрофия ЛЖ), риск 4.
С целью верификации диагноза рекомендовано:
1) повторно эходопплеркардиография, в том числе с определением параметров, отражающих гемодинамику правых отделов сердца и позволяющих оценить тип ЛГ (прекапиллярная/посткапиллярная);
2) КТ органов грудной клетки с контрастированием сосудов малого круга кровообращения для исключения посттромбоэмболического генеза ЛГ (с контролем уровня креатинина крови);
3) дуплексное сканирование вен нижних конечностей.
При дуплексном сканировании вен нижних конечностей выявлены признаки клапанной венозной недостаточности в малоберцовых венах левой голени, в притоке правой большой подкожной вены на голени, рекомендована консультация сердечно-сосудистого хирурга. По результатам КТ-ангиографии легочных сосудов, проведенной в апреле 2024 г., КТ-признаков тромбоза ветвей легочной артерии не выявлено, выявлены косвенные признаки ЛГ (легочный ствол 38 мм, диаметр аорты 34 мм), признаки единичных очагов локального фиброза легких с обеих сторон, по сравнению с КТ от 06.04.2023 – без динамики.
По результатам эходопплеркардиографии (март 2024 г.) обнаружены признаки высокой ЛГ (градиент давления в ЛА по потоку трикуспидальной регургитации 78 мм рт. ст. при относительно сохранных левых отделах сердца). При расчете показателей давления заклинивания легочной артерии и легочного сосудистого сопротивления установлен прекапиллярный генез ЛГ, что в совокупности с наличием признаков синдрома Рейно позволило заподозрить системное заболевание соединительной ткани. Пациентка направлена на исследование уровня «IgG антинуклеарный фактор на HEp-2 клетках» (АНФ) в крови с последующей консультацией ревматолога. По итогам анализа крови на АНФ установлен повышенный титр – 1:5120 (при норме до 1:160), и по результатам обследования ревматолога был установлен диагноз «Системная склеродермия (СС), лимитированная форма, хроническое течение с поражением кожи (плотный отек кожи пальцев кистей, ограничение аппертуры рта), сосудов (телеангиоэктазии, синдром Рейно), легочная АГ высокой степени, иммунологические нарушения (позитивность по АНФ – 1:5120 с типом свечения АС21 и АС 3, антитела к центромере, антинуклеарные антитела)». Ревматолог назначил комплексное лечение, эффективность и безопасность которого планируется оценить в динамике.
С учетом того, что пациентка С. в течение многих лет наблюдалась у невролога с диагнозом РС и длительно получала препараты интерферона, ее направили к неврологу с целью коррекции лечения с отменой интерферона, терапия скорректирована. Пациентка продолжает наблюдение и лечение, эффективность которого планируется оценить через 3 месяца. В данном клиническом случае интерес представляет обоснованная полипрагмазия (полифармация) при медикаментозной терапии коморбидной патологии (сердечно-сосудистой патологии, РС, СС, ЛГ), которая в данном случае сопровождалась развитием нежелательных явлений.
Обсуждение
В данном клиническом случае от момента выявления первых признаков ЛГ до установления диагноза прошло около 12 месяцев. В качестве причин поздней диагностики следует отметить как отсутствие внимания врачей к этой проблеме, так и отношение самой пациентки к выполнению рекомендованного дообследования, в силу непонимания значимости проблемы. В данном клиническом случае в связи с наличием РС для пациентки были характерны быстрое физическое утомление и эмоциональное истощение, каждое посещение амбулатории ей давалось с трудом. В ряде ситуаций приходилось неоднократно убеждать пациентку в необходимости дообследования, мы привлекали родственников для ее сопровождения, поясняя срочность и необходимость диагностических мероприятий.Рассуждая о происхождении ЛГ в данном клиническом случае, можно говорить о нескольких возможных причинах ее развития:
1) системное заболевание соединительной ткани (СС);
2) отягощенный профессиональный анамнез;
3) лекарственно-индуцированная легочная гипертензия (ЛИЛГ).
Известно, что системные заболевания соединительной ткани (СЗСТ) могу быть связаны с различными формами ЛГ, включая легочную АГ, легочную веноокклюзионную болезнь, легочную венозную гипертензию; ЛГ, связанную с интерстициальным заболеванием легких; ХТЭЛГ и иногда сочетание нескольких вариантов [8]. Из всех СЗСТ наиболее распространена ЛГ у пациентов с СС, далее идут пациенты с системной красной волчанкой, смешанными заболеваниями соединительной ткани, реже ЛГ встречается при синдроме Шегрена, ревматоидном артрите и дерматомиозите [9, 10].
СС составляет 75% случаев ЛГ, связанной с СЗСТ. Прогноз ЛГ, ассоциированной с СЗСТ, хуже, чем при других формах ЛГ. Хотя, как и при ИЛАГ, механизм ЛГ, ассоциированной с СЗСТ, связан с увеличением количества вазоконстрикторов, таких как эндотелин-1, и снижением выработки вазодилататоров, таких как простациклин и оксид азота. Воспалительные и аутоиммунные механизмы также играют роль в развитии и прогрессировании ЛГ. Чаще всего в формировании ЛГ,
ассоциированной с СЗСТ, имеется несколько патофизиологических механизмов, а понимание того, какой механизм является доминирующим, очень важно при определении тактики ведения пациента [20].
ЛГ обычно становится более поздним проявлением СС и чаще всего возникает через 10–15 лет после постановки диагноза [11]. У пациентов с системной склеродермией ЛГ имеет сложный сочетанный генез и на практике определить вклад каждого фактора в ее развитие не представляется возможным. В частности, ЛГ, развивающаяся при СС, возникает за счет ремоделирования легочных сосудов, которое определяет формирование прекапиллярного ее компонента. В ряде случаев у пациентов с СС развивается диффузный интерстициальный пневмофиброз, который при выраженной его степени приводит к развитию или усугубляет уже имеющуюся прекапиллярную ЛГ. У пациентов с СС имеется более высокий риск легочной тромбоэмболии, что может привести к развитию хронической тромбоэмболической ЛГ, которая также является прекапиллярной. Фиброз миокарда и склерогенные изменения клапанного аппарата левых отделов сердца, характерные для пациентов с СС, предрасполагают к систолической и диастолической дисфункции ЛЖ, что формирует посткапиллярный компонент в происхождении ЛГ [12]. Именно сочетанный генез ЛГ при СС определяет низкую эффективность медикаментозной терапии и плохой прогноз.
У нашей пациентки имеется отягощенный профессиональный анамнез – работа в течение 20 лет в химической лаборатории. К сожалению, она не может предоставить санитарно-гигиеническую характеристику своего рабочего места, поэтому можно судить о ее работе лишь опираясь на данные литературы. К группе опасных веществ, с которыми контактирует работник химической лаборатории, можно отнести свинец, окись углерода, сероводород, бензол, трихлорэтилен. Особое внимание стоит обратить на трихлорэтилен: этот органический растворитель тесно связан с развитием ЛГ, ХТЭЛГ и легочной веноокклюзионной болезни (ЛВОБ) – редкой, но тяжелой формы ЛГ, характеризующейся прогрессирующей обструкцией легочных вен и артерий, связанной с пролиферацией легочных капилляров. По сравнению с ЛАГ клиническое течение ЛВОБ обычно более агрессивное и характеризуется слабым ответом на ЛАГ-специфическую терапию [15].
ЛИЛГ патофизиологически является артериальной, поэтому очень схожа с ИЛАГ. К наиболее известным причинам ЛИЛГ может привести использование таких препаратов и веществ, как аминорекс, бенфлюорекс, метамфетамины. Эти препараты являются факторами риска ЛГ и поэтому были сняты с производства. Интерферон-β (ИФН), используемый в лечении РС, считается препаратом с возможным риском индукции ЛИЛГ [16]. РС – воспалительное заболевание центральной нервной системы, которое приводит к прогрессирующей нейродегенерации у большинства больных и становится частой причиной утраты трудоспособности у молодых лиц [3]. Заболевание в 2 раза чаще развивается у женщин, чем у мужчин, а первые признаки болезни проявляются в возрасте от 20 до
40 лет. Симптомы РС усиливаются с течением времени, при этом методов лечения, позволяющих достичь полного выздоровления, нет, но для поддержания ремиссии пациентам на длительное время назначают препараты, изменяющие течение РС, такие как ИФН. Хотя преимущества терапии ИФН доказаны, данные препараты имеют несколько побочных эффектов: чаще это гриппоподобное состояние, реже – нейропсихические эффекты (депрессия) и миелосупрессия (панцитопения). ЛГ – редкий, но серьезный побочный эффект терапии ИФН. По мере расширения показаний к применению ИФН, включающих хронический гепатит и РС, увеличилась частота зарегистрированных случаев ЛГ [17, 18]. Таким образом, консенсусная группа экспертов классифицировала интерфероны α и β как лекарственные препараты, которые являются возможным фактором развития ЛГ [19].
В данном случае у пациентки С. диагностирована прекапиллярная ЛГ, и диагностический поиск при наличии отягощенного наследственного анамнеза по ТЭЛА, перенесенного тяжелого COVID-19 и патологии вен нижних конечностей был начат с исключения ХТЭЛГ.
В то же время были получены лабораторные данные, подтверждающие наличие системной склеродермии. Таким образом, анализируя катамнез пациентки С., можно обозначить несколько причин для развития у нее ЛГ: основным патологическим процессом, приведшим к развитию ЛГ, была признана системная склеродермия, в то же время нельзя отрицать влияние производственных факторов химической лаборатории и индуцированную ИФН ЛГ. Следует отметить, что наличие недостаточности аортального клапана не исключает и посткапиллярный компонент в генезе ЛГ, однако с учетом сохранной систолической функции миокарда ЛЖ данный компонент выражен минимально и не определяет течение и прогноз ЛГ при условии стабильности порока.
Заключение
Данный клинический случай показывает значимость расспроса пациента, в том числе сбора анамнеза, для выявления всех возможных триггеров с оценкой вклада каждого из них в формирование ЛГ. Детальный расспрос и тщательное физикальное исследование также позволяют сформировать оптимальный план лабораторно-инструментальной диагностики. В данном случае имелось коморбидное состояние с одновременным наличием у пациентки С. нескольких заболеваний и метаболических расстройств, требующих комплексной терапии с обоснованной в данном случае полифармацией и взаимоисключающими требованиями к контролю разных заболеваний. В таких сложных клинических ситуациях только совместное обсуждение тактики ведения пациента врачами разных специальностей (в данном случае неврологом, пульмонологом, ревматологом, кардиологом, клиническим фармакологом) позволяет лечащему врачу выработать оптимальный план лечения, предотвратить неблагоприятные лекарственные взаимодействия, способствуя улучшению качества и увеличению продолжительности жизни пациентов с коморбидной патологией.Пациентка продолжает наблюдаться, и мы планируем в следующей публикации обсудить эффективность и безопасность скорректированной медикаментозной терапии коморбидной патологии (сердечно-сосудистой патологии, РС, СС, ЛГ), а также динамику клинических проявлений имеющихся заболеваний.
Конфликт интересов. Конфликт интересов отсутствует.
Conflict of interests. There is no conflict of interest.
Информация о спонсорстве. Спонсор отсутствует.
Sponsorship information. There is no sponsor.
Информация об авторах
Information about the authors
Усачева Елена Владимировна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: elenav.usacheva@yandex.ru; ORCID: 0000-0002-6134-1533
Elena V. Usacheva – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: elenav.usacheva@yandex.ru; ORCID: 0000-0002-6134-1533
Надей Елена Витальевна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: nadeyelena@yandex.ru; ORCID: 0000-0003-0440-7118
Elena V. Nadey – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: nadeyelena@yandex.ru; ORCID: 0000-0003-0440-7118
Шкиринец (Нелидова) Анастасия Владимировна – канд. мед. наук, доц., доц. каф. пропедевтики внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: avnelidova@mail.ru, ORCID: 0000-0003-0149-6119
Anastasiya V. Shkirinets (Nelidova) – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: avnelidova@mail.ru; ORCID: 0000-0003-0149-6119
Наконечная Екатерина Эдуардовна – врач-ревматолог, зав. ревматологическим отделением, БУЗОО «Клинический кардиологический диспансер». E-mail: eka_giz@mail.ru
Ekaterina E. Nakonechnaya – Rheumatologist, Head of the rheumatology department, Clinical Cardiological Dispensary. E-mail: eka_giz@mail.ru
Замахина Ольга Владимировна – канд. мед. наук, доц., доц. каф. пропедевтики внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: ozamakhina@yandex.ru; ORCID: 0000-0003-0748-2324
Olga V. Zamachina – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: ozamakhina@yandex.ru; ORCID: 0000-0003-0748-2324
Темерева Елена Александровна – врач-ординатор по специальности «терапия» каф. внутренних болезней и семейной медицины ДПО, ФГБОУ ВО ОмГМУ. E-mail: lenatemereva@mail.ru.
Elena A. Temereva – Medical Resident, Omsk State Medical University. E-mail: lenatemereva@mail.ru
Ботвинко Ирина Юрьевна – врач функциональной диагностики, БУЗОО «КМСЧ №7». E-mail: irinabotvinko@mail.ru
Irina Yu. Botvinko – Functional diagnostics doctor, Clinical Medical and Sanitary Unit No. 7. E-mail: irinabotvinko@mail.ru
Поступила в редакцию: 23.09.2024
Поступила после рецензирования: 01.10.2024
Принята к публикации: 03.10.2024
Received: 23.09.2024
Revised: 01.10.2024
Accepted: 03.10.2024
Список исп. литературыСкрыть список1. Драпкина О.М., Концевая А.В., Калинина А.М. и др. Коморбидность пациентов с хроническими неинфекционными заболеваниями в практике врача-терапевта. Евразийское руководство. Кардиоваскулярная терапия и профилактика. 2024;23(3):3696.
Drapkina O.M., Kontsevaya A.V., Kalinina A.M. et al. Comorbidity of patients with chronic non-communicable diseases in the practice of a general practitioner. The Eurasian leadership. Cardiovascular therapy and prevention. 2024;23(3):3696 (in Russian).
2. Оганов Р.Г., Денисов И.Н., Симаненков В.И. и др. Коморбидная патология в клинической практике. Клинические рекомендации. Кардиоваскулярная терапия и профилактика. 2017;16(6):5-56.
Oganov R.G., Denisov I.N., Simanenkov V.I. et al. Comorbid pathology in clinical practice. Clinical recommendations. Cardiovascular therapy and prevention. 2017;16(6):5-56 (in Russian).
3. Трактирская О.А., Попова Е.В., Лащ Н.Ю. и др. Коморбидная патология сердечно-сосудистой системы у молодых пациентов с ремиттирующим течением рассеянного склероза. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019;119(10, вып. 2):72-80.
Traktirskaya O.A., Popova E.V., Lasch N.Yu. et al. Comorbid pathology of the cardiovascular system in young patients with a remitting course of multiple sclerosis. Journal of Neurology and Psychiatry named after S.S. Korsakov. 2019;119(10, issue 2):72-80 (in Russian).
4. International Multiple Sclerosis Genetics Consortium; MultipleMS Consortium. Locus for severity implicates CNS resilience in progression of multiple sclerosis. Nature 2023;619(7969):323-31.
5. Haque A, Kiely DG, Kovacs G et al. Condliffe R. Pulmonary hypertension phenotypes in patients with systemic sclerosis. Eur Respir Rev 2021;30(161):210053.
6. McGee M, Whitehead N, Martin J, Collins N. Drug-associated pulmonary arterial hypertension. Clin Toxicol (Phila) 2018 Sep;56(9):
801-9.
7. Mandras SA, Mehta HS, Vaidya A. Pulmonary Hypertension: A Brief Guide for Clinicians. Mayo Clin Proc 2020;95(9):1978-1988.
8. Anand S, Sadek A, Vaidya A, Oliveros E. Diagnostic Evaluation of Pulmonary Hypertension: A Comprehensive Approach for Primary Care Physicians. J Clin Med 2023;12(23):7309.
9. Khangoora V, Bernstein EJ, King CS, Shlobin OA. Connective tissue disease-associated pulmonary hypertension: A comprehensive review. Pulm Circ. 2023;13(4):e12276.
10. Волков А.В. Легочная артериальная гипертензия при системных заболеваниях соединительной ткани. Научно-практическая ревматология. 2015;53(1):69-77.
Volkov AV. Pulmonary arterial hypertension in systemic connective tissue diseases. Scientific and practical rheumatology. 2015;53(1):
69-77 (in Russian).
11. Khangoora V, Bernstein EJ, King CS, Shlobin OA. Connective tissue disease-associated pulmonary hypertension: A comprehensive review. Pulm Circ 2023;13(4):e12276.
12. Bahi M, Li C, Wang G, Korman BD. Systemic Sclerosis-Associated Pulmonary Arterial Hypertension: From Bedside to Bench and Back Again. Int J Mol Sci 2024;25(9):4728.
13. Tuhy T, Hassoun PM. Clinical features of pulmonary arterial hypertension associated with systemic sclerosis. Front Med (Lausanne) 2023;10:1264906.
14. Charkiewicz AE, Backstrand JR. Lead Toxicity and Pollution in Poland. Int J Environ Res Public Health. 2020;17(12):4385.
15. Цепкова Г., Власенко А.Хронические профессиональные заболевания, обусловленные воздействием наиболее распространенных органических растворителей. Врач. 2018;29(7):19-26.
Tsepkova G, Vlasenko A. Chronic occupational diseases caused by exposure to the most common organic solvents. Doctor. 2018;29(7):19-26.
16. Caliez J, Riou M, Manaud G et al. Trichloroethylene increases pulmonary endothelial permeability: implication for pulmonary veno-occlusive disease. Pulm Circ 2020;10(4):2045894020907884.
17. Voudris V. Pulmonary arterial hypertension associated with interferon-beta treatment for multiple sclerosis. Case report and literature review. Mult Scler Relat Disord 2019;28:273-275.
18. Fok A, Williams T, McLean CA. et al. Interferon beta-1a long-term therapy related to pulmonary arterial hypertension in multiple sclerosis patients. Mult Scler Epub 2016;22(11):1495-8.
19. Papani R, Duarte AG, Lin YL, Kuo YF, Sharma G. Pulmonary arterial hypertension associated with interferon therapy: a population-based study. Multidiscip Respir Med 2017 Jan 17;12:1.
20. Cansu DÜ, Korkmaz C. Pulmonary hypertension in connective tissue diseases: epidemiology, pathogenesis, and treatment. Clin Rheumatol 2023 Oct;42(10):2601-2610. DOI: 10.1007/s10067-022-06446-y. Epub 2022 Nov 17. PMID: 36396789.

