Клинический разбор в общей медицине №10 2024
1 Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
ostroumova.olga@mail.ru
Abstract
A clinical case of a 65-year-old man with newly diagnosed AF is presented. The patient consulted a cardiologist because of a first-time paroxysm of atrial fibrillation (AF), which was stopped with medication in hospital (propafenone at a dose of 1.5 mg/kg intravenously for 10 minutes). It is known from the anamnesis that the patient suffers from arterial hypertension and stage I obesity, and previously suffered from gastric bleeding. According to esophagogastroduodenoscopy, chronic Helicobacter erosive active severe gastritis was detected. During the consultation, the patient was recommended anticoagulant therapy (apixaban 5 mg × 2 times a day), gastroenteroprotective therapy (rebamipide 100 mg × 3 times a day + rabeprazole 20 mg 2 times a day), antiarrhythmic therapy (propafenone 150 mg × 3 times) and H. pylori eradication therapy (clarithromycin 500 mg × 2 times a day, amoxicillin 1000 mg × 2 times a day). Using a specific clinical case as an example, the article discusses modern approaches to improving the safety of anticoagulant therapy and choosing a rhythm control strategy in patients with AF.
Keywords: atrial fibrillation, direct oral anticoagulants, gastroprotective therapy, gastrointestinal bleeding, proton pump inhibitors, rebamipide, antiarrhythmic therapy, antiarrhythmic drugs, propafenone.
For citation: Ostroumova O.D., Kochetkov A.I., Litvinova S.V., Filippova T.V. Personalization of therapy in patients with atrial fibrillation: a case report. Clinical review for general practice. 2024; 5 (10): 70–77 (In Russ.). DOI: 10.47407/kr2024.5.10.00498
Пациентам с ФП для профилактики тромбоэмболических осложнений в абсолютном большинстве случаев необходим прием антикоагулянтов [1]. Однако данная терапия сопровождается повышенным риском кровотечений, среди которых наиболее опасны желудочно-кишечные кровотечения (ЖКК) [4]. Поэтому важная составляющая в ведении данных пациентов – назначение эффективной гастроэнтеропротективной терапии. Однако выбор оптимального лекарственного средства/оптимальной схемы фармакотерапии для надежной защиты желудочно-кишечного тракта (ЖКТ) требует уточнения.
Еще один активно изучаемый вопрос – персонализация антиаритмической терапии, поскольку пароксизмы ФП существенно снижают трудоспособность и качество жизни пациентов [5, 6].
Из анамнеза заболевания известно, что 1 сентября 2023 г. у пациента внезапно во время работы возникло ощущение очень частого и неровного биения сердца, сопровождаемое слабостью и потливостью. Данный приступ продолжался около 15–20 мин и закончился самостоятельно. За медицинской помощью не обращался. Однако уже 3 сентября 2023 г. у пациента вновь внезапно появилось ощущение выраженного сердцебиения, которое самостоятельно не купировалось на протяжении часа, в связи с чем была вызвана бригада скорой медицинской помощи. На догоспитальном этапе при регистрации электрокардиограммы (ЭКГ) была диагностирована тахисистолическая форма ФП с частотой сердечных сокращений (ЧСС) 93–134 в минуту без электрокардиографических и клинических признаков нестабильности гемодинамики. Бригада скорой медицинской помощи провела пульсурежающую (бисопролол 5 мг) и антикоагулянтную (гепарин натрия п/к) терапию с последующей госпитализацией в стационар.
В приемном отделении стационара пациенту выполнена эхокардиография: фракция выброса левого желудочка (ЛЖ) 61%, незначительная концентрическая гипертрофия миокарда ЛЖ (индекс массы миокарда ЛЖ – иММЛЖ) – 50,2 г/м2, толщина межжелудочковой перегородки 1,2 см, толщина задней стенки ЛЖ 1,0 см, полости сердца не расширены, митральная регургитация 1-й степени, трикуспидальная регургитация 1–2-й степени, зон нарушения локальной сократимости не выявлено, систолическое давление в легочной артерии (СДЛА) 27 мм рт. ст.
В отделении интенсивной терапии стационара посредством медикаментозной кардиоверсии пропафеноном (Пропанорм® в дозе 1,5 мг/кг внутривенно в течение 10 мин) восстановлен синусовый ритм. В дальнейшем пациент находился под наблюдением кардиолога в стационаре – срывов синусового ритма и нежелательных лекарственных реакций не возникало. От дальнейшего пребывания в стационаре пациент отказался. Направлен к кардиологу в поликлинику по месту жительства для продолжения терапии с рекомендациями в виде приема апиксабана 5 мг 2 раза в сутки и пропафенона 150 мг 3 раза в сутки.
Сопутствующие заболевания: артериальная гипертония III стадии, контролируемая артериальная гипертензия, очень высокий риск ССО (риск 4). Пациент принимает телмисартан 80 мг и индапамид (Индап®) 2,5 мг, при самоизмерении артериальное давление (АД) на уровне 125–128/75 мм рт. ст. Ожирение I степени.
В возрасте 39 лет перенес желудочное кровотечение. Согласно представленной документации, по данным эзофагогастродуоденоскопии (ЭГДС), источником стала эрозия в области малой кривизны желудка, а вероятной причиной – бесконтрольный прием нестероидных противовоспалительных препаратов (НПВП) в связи с головными болями. В последующем был консультирован неврологом с подбором терапии мигрени с положительным эффектом. Вместе с тем в настоящее время изредка принимает НПВП при выраженных головных болях. Хронический гастрит в анамнезе; курсами принимает омепразол.
Анамнез жизни: работает водителем такси. Курит около 40 лет, по 1 пачке в день, два-три раза в месяц по выходным употребляет алкоголь (со слов пациента, пиво, не более 1 бутылки). Питается несбалансированно, часто фастфудом. Аллергоанамнез: не отягощен.
Результаты физикального осмотра: состояние удовлетворительное. Индекс массы тела – 31,2 кг/м2, окружность талии – 113 см. Кожные покровы обычной окраски, чистые. Отеков нет. Над всей поверхностью легких ясный легочный звук. Дыхание везикулярное, хрипов нет. Частота дыханий – 16 в минуту. Пульс
76 уд/мин, ритмичный. Офисное АД 127/78 мм рт. ст. Живот мягкий, безболезненный. Печень по краю реберной дуги. Симптом поколачивания отрицательный с обеих сторон.
Результаты лабораторных исследований: клинический анализ крови и мочи – без патологии. Биохимическое исследование крови: креатинин –
98 мкмоль/л, глюкоза натощак – 5,7 ммоль/л, общий холестерин – 5,8 ммоль/л, триглицериды –
1,7 ммоль/л, липопротеины низкой плотности –
2,7 ммоль/л, липопротеины высокой плотности –
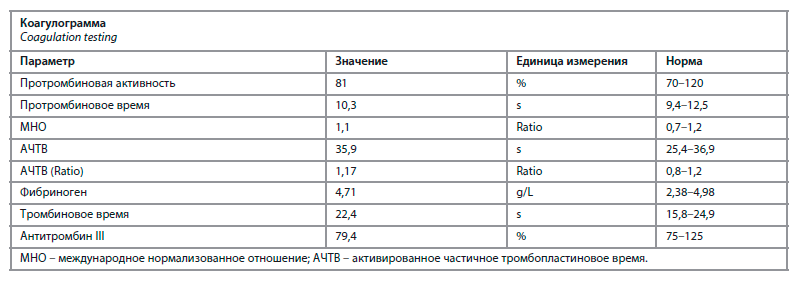
1,0 ммоль/л, мочевая кислота – 389 мкмоль/л, натрий – 138 ммоль/л, калий – 4,7 ммоль/л, аланинаминотрансфераза (АЛТ) – 29 Ед/л, аспартатаминотрансфераза (АСТ) – 26 Ед/л, скорость клубочковой фильтрации (СКФ) 69 мл/мин/1,73 м2. Клиренс креатинина 94 мл/мин. Коагулограмма – без особенностей (таблица).
Результаты инструментальных методов исследования
Электрокардиография: синусовый ритм с ЧСС 77 в минуту. Отклонение электрической оси сердца влево. Неспецифические изменения в миокарде.
Холтеровское мониторирование ЭКГ: ритм синусовый. Пароксизмов фибрилляции/трепетания предсердий не зарегистрировано. Выявлено 129 одиночных суправентрикулярных экстрасистол и 94 мономорфных одиночных желудочковых экстрасистол. Диагностически значимых пауз не обнаружено. Отклонений сегмента ST не зафиксировано. Продолжительность интервалов PQ и QT в пределах нормальных значений.
Суточное мониторирование АД: артериальная гипертензия не выявлена.
Эзофагогастродуоденоскопия с биопсией. Заключение: хронический гастрит с очаговой атрофией слизистой и наличием единичных эрозий, бульбит, дуоденогастральный рефлюкс. Косвенные признаки заболевания панкреатобилиарной зоны. Данные исследования биоптатов: фрагменты слизистой оболочки желудка из краев хронической эрозии с фовеолярной гиперплазией, хроническим воспалением умеренной активности. Helicobacter pylori +. Заключение: хронический хеликобактерный эрозивный активный выраженный гастрит.
При стратификации риска тромбоэмболических осложнений по шкале CHA2DS2VASc сумма баллов = 2, при оценке геморрагических осложнений по шкале HAS-BLED сумма баллов = 2.
Гастропротективная терапия
В качестве профилактики тромбоэмболических осложнении (сумма баллов по шкале CHA2DS2VASc =2) пациенту был назначен постоянный прием оральных антикоагулянтов (апиксабана 5 мг 2 раза всутки). Риск по шкале HAS-BLED составил 2 балла, что подтверждает умеренный риск геморрагических осложнений в ходе антикоагулянтной терапии.
Однако необходимо помнить, что прием антитромботической терапии (антикоагулянтной и/или антиагрегантной) ассоциирован с повышенным риском геморрагических осложнений, в том числе ЖКК [7–9]. Так, например, увеличение риска ЖКК отмечалось на фоне приема ацетилсалициловой кислоты в дозе до 100 мг в сутки (относительный риск – ОР – 2,7; 95% доверительный интервал – ДИ – 2,0–3,6), клопидогреля/тиклопидина (ОР 2,8; 95% ДИ 1,9–4,2) и антикоагулянтов (ОР 2,8; 95% ДИ 2,1–3,7) [8, 10]. Согласно результатам метаанализа, включавшего 43 рандомизированных контролируемых исследования (151 578 пациентов), в течение периода наблюдения (от 3 нед до 31 мес) назначение прямых оральных антикоагулянтов сопровождалось ЖКК в 1,5% случаев: для апиксабана ОР составил 23 (95% ДИ 0,56–2,73), для дабигатрана – 1,58 (95% ДИ 1,29–1,93), для эдоксабана – 0,31 (95% ДИ 0,01–7,69), для ривароксабана – 1,48 (95% ДИ 1,21–1,82) [11]. Причем большая часть (89%) от всех случаев ЖКК являлись большими ЖКК, т.е. вели к снижению уровня гемоглобина на 20 г/л и более в течение 24 ч, требовали гемотрансфузии ≥2 единиц эритроцитарной массы, хирургического вмешательства или приводили к смертельному исходу [11].
В Российской Федерации в 2021–2022 гг. проведено фармакоэпидемиологическое многоцентровое кросс-секционное клиническое исследование [12], посвященное оценке частоты и структуры назначения лекарственных препаратов гастропротективного действия у пациентов, получающих прямые оральные коагулянты (ПОАК). В исследовании ретроспективно проанализированы данные 662 пациентов, находившихся на терапии ПОАК и проходивших обследование в различных научных центрах и лечебно-профилактических учреждениях России (26 научных центров в 15 городах, 13 амбулаторных центров и 13 стационаров). Среди них 408 (61,6%) имели различные заболевания ЖКТ. Наиболее распространены были заболевания желудка (54,8%), пищевода (33,8%), кишечника (32,2%), желчного пузыря и желчевыводящих путей (21,6%). Заболевания печени отмечались у 10,7% больных, а патология поджелудочной железы – у 8,0%. ЖКК в анамнезе отмечались у 1,2% пациентов, при этом высокий риск кровотечений из ЖКТ имели 38,4% пациентов [12]. Гастропротективная терапия была назначена 378 (57,1%) пациентам, включенным в исследование: монотерапия – 50,9%, комбинированная терапия – 6,2%. Самыми часто назначаемыми гастропротективными препаратами были ингибиторы протонной помпы (ИПП) – в назначениях они встречались в 80,2% случаев, на втором месте по частоте встречаемости был ребамипид – 27,8%. [13]. Среди пациентов с высоким риском кровотечений из ЖКТ только 47,6% больных получали гастропротективную терапию, им наиболее часто назначали ИПП (85,9%), из них омепразол встречался чаще всего (69,2%), на втором месте находился ребамипид (25,6%). Среди пациентов с ЖКК в анамнезе гастропротективная терапия также была назначена не всем – 37,5% пациентов не получали гастропротекторы [13].
Согласно результатам исследования, основной стратегией гастропротекции среди пациентов, принимающих ПОАК, является назначение ИПП в монотерапии. Роль терапии ИПП для первичной гастропротекции у пациентов, принимающих антикоагулянты, изучали лишь в единичных исследованиях. Так, в ретроспективном когортном исследовании среди 1 643 123 пациентов, находящихся на терапии оральными антикоагулянтами (ОАК, апиксабан, дабигатран, ривароксабан, варфарин), авторы изучили частоту госпитализаций по поводу кровотечений из верхних отделов ЖКТ [14]. Результаты данного исследования свидетельствуют, что для каждого антикоагулянта частота госпитализаций по поводу кровотечения из верхних отделов ЖКТ была ниже среди пациентов, получавших сопутствующую терапию ИПП (коэффициент заболеваемости 0,66; 95% ДИ: 0,62–0,69) [14].
Однако необходимо учитывать, что ИПП оказывают действие лишь на уровне верхних отделов ЖКТ и не защищают его нижние отделы. Так, например, терапия ИПП среди пациентов, принимающих НПВП, снижает риски нежелательных явлений в верхних отделах ЖКТ и ассоциирована с увеличением частоты поражений нижних отделов ЖКТ [15, 16]. Следовательно, применение ИПП считается независимым фактором риска развития НПВП-индуцированных энтеропатий [16].
По итогам обследования больных с применением капсульной эндоскопии, повреждающее воздействие антитромботических препаратов не ограничивается слизистой оболочкой верхних отделов ЖКТ, а затрагивает и слизистую оболочку тонкой и толстой кишки и приводит к увеличению риска ЖКК, в том числе из нижних отделов [17–20].
Помимо этого, есть данные, что длительное применение ИПП ассоциировано с множеством нежелательных лекарственных реакций, к ним относятся повышенный риск заболевания почек (10–20%), деменции (4–80%), переломов костей (30–400%), инфекций (до 600%), дисбиоза (200–800%) дефицита микроэлементов (60–70%) и злокачественных новообразований ЖКТ [21, 22].
Таким образом, пациентам с высоким риском развития ЖКК, принимающим ПОАК в качестве гастропротекции, необходим препарат, обладающий протекцией на всем протяжении ЖКТ. На российском рынке доступно лекарственное средство ребамипид (препарат Ребагит, «ПРО. МЕД.ЦС Прага а.о.», Чехия), обладающее комплексными протективными эффектами на всем протяжении ЖКТ. Ребамипид оказывает защитный эффект на слизистую оболочку ЖКТ за счет регуляции уровня простагландинов, восстановления физиологической продукции слизи и плотных контактов, а также ингибирования продуктов окислительного стресса, провоспалительных цитокинов и хемокинов, что в комплексе ведет к устранению синдрома повышенной проницаемости слизистых оболочек, благодаря чему он поддерживает нормальную барьерную функцию стенки кишечника [23].
В 2021 г. опубликован Российский междисциплинарный Консенсус экспертов по снижению риска ЖКК у пациентов, получающих ПОАК, разработанный Российским научным медицинским обществом терапевтов (РНМОТ), Научным обществом гастроэнтерологов России (НОГР), Национальным обществом профилактической кардиологии [7]. В документе подчеркивается необходимость назначения гастропротективной терапии пациентам, принимающим антикоагулянты, включая ПОАК, в особенности с наличием ЖКК в анамнезе, язвенного поражения ЖКТ и с высоким риском ЖКК [7].
В настоящее время нет единого понятия «высокий риск ЖКК», однако эксперты понимают под этим наличие у пациента ряда факторов, увеличивающих риск развития ЖКК. К ним относятся язвенная болезнь или ЖКК в анамнезе; хроническое использование НПВП или глюкокортикостероидов и минимум два из следующих признаков: возраст ≥65 лет, диспепсия, желудочно-пищеводный рефлюкс, инфицирование Helicobacter pylori
(H. pylori), хроническое употребление алкоголя [7]. Таким образом, пациент из представленного клинического случая имел высокий риск ЖКК (ЖКК в анамнезе, возраст ≥65 лет, желудочно-пищеводный рефлюкс, инфицирование H. Pylori), что подчеркивает необходимость назначения эффективной гастропротективной терапии.
В качестве медикаментозной терапии эксперты рекомендуют назначение ИПП в сочетании с ребамипидом (препарат Ребагит®, Промед Прага ЦС, Чехия) как минимум в течение 3 месяцев [7]. Далее ИПП можно с течением времени переводить в режим поддерживающей дозы и далее по требованию. При этом подчеркивается необходимость назначения ребамипида на всем протяжении приема ПОАК терапии [7]. Также эксперты отмечают, что апиксабан является препаратом выбора среди ОАК с точки зрения минимизации риска кровотечений [7].
С другой стороны, пациенту необходима модификация факторов риска ЖКК, а именно назначение эффективной эрадикационной терапии H. Pylori. Стандартная эрадикационная терапия включает назначение ИПП (в стандартной дозе 2 раза в сутки), кларитромицин (500 мг 2 раза в сутки) и амоксициллин (1000 мг 2 раза в сутки внутрь) в течение 14 дней [24]. Однако последние данные крупных исследований и метаанализов свидетельствуют о прогрессивном снижении эффективности стандартных схем эрадикации вследствие роста антибиотикорезистентности [25–28]. В среднем частота неэффективного лечения при использовании стандартной комбинации составляет примерно 20–30% [29].
И в клинических рекомендациях по лечению гастрита и дуоденита в качестве меры повышения эффективности антигеликобактерного лечения рекомендовано добавление ребамипида в дозе 100 мг 3 раза в сутки в схемы эрадикации [24].
Терапия, направленная на профилактику рецидивов ФП
Для лечения пациентов с ФП рекомендованы две альтернативные терапевтические стратегии: 1) снижение частоты сокращений желудочков на фоне сохраняющейся ФП, так называемый контроль ЧСС, предполагающий применение ритмурежающих лекарственных средств и воздержание от собственно противоаритмического лечения; 2) восстановление (при необходимости) и как можно более длительное сохранение синусового ритма средствами лекарственного противоаритмического лечения (антиаритмические препараты), так называемый контроль ритма сердца [1].
Выбор стратегии лечения ФП всегда индивидуален и зависит от характера течения аритмии, степени выраженности клинических проявлений, наличия сопутствующих заболеваний и переносимости различных групп препаратов, немаловажную роль играет предпочтение пациента [1].
В ранее проведенных крупных исследованиях AF Follow-Up Investigation of Rhythm Management (AFFIRM) (n=4060) и RAte Control versus Electrical cardioversion for atrial fibrillation (RACE) (n=522) не установлено существенных различий между стратегиями контроля ЧСС и контроля ритма при сравнении показателей смертности от всех причин и ССО [30, 31]. Однако при субанализе исследования AFFIRM выявлено, что наличие синусового ритма ассоциировано со снижением риска летального исхода на 47% (р<0,0001), и в то же время применение антиаритмических препаратов (ААП), чаще всего амиодарона, для поддержания синусового ритма ассоциировалось с увеличением риска неблагоприятных событий [32].
Однако в многоцентровом рандомизированном исследовании The Early Treatment of Atrial Fibrillation for Stroke Prevention Trial (EAST-AFNET 4) [33] показано, что терапия для контроля ритма, начатая после постановки диагноза ФП, может снизить риск неблагоприятных исходов по сравнению с современной практикой отсроченного перехода к стратегии контроля ритма [33]. В это исследование были включены 2789 пациентов с недавно диагностированной ФП (медиана времени после постановки диагноза ФП составляла 36 дней). Пациенты в группе раннего контроля ритма получали ААП (87% случаев) или им проводили катетерную аблацию (КА) ФП (9% в начале лечения и 19% через 2 года наблюдения). За период наблюдения (медиана наблюдения 5,1 года) среди пациентов в группе раннего контроля ритма был статистически значимо ниже риск развития сердечно-сосудистой смерти на 28% (ОР 0,72; 95% ДИ 0,52–0,98), инсульта – на 35% (ОР 0,65; 95% ДИ 0,44–0,97) и риск наступления комбинированной первичной конечной точки (сумма неблагоприятных событий – сердечно-сосудистая смерть, инсульт, госпитализация из-за ухудшения сердечной недостаточности или острого коронарного синдрома) – на 21% (ОР 0,79; 95% ДИ 0,66–0,94, p=0,005) [33].
В субанализе исследования EAST-AFNET 4 среди пациентов (n=798) с симптомами хронической сердечной недостаточности (ХСН) (II или III функционального класса по Нью-Йоркской классификации) или фракцией выброса ЛЖ <50% у пациентов в группе с ранним контролем ритма также отмечалось снижение риска возникновения событий комбинированной первичной конечной точки (на 26%) по сравнению с пациентами из группы обычного лечения (ОР 0,74; 95% ДИ 0,56–0,97, р=0,03) [34].
В другом анализе EAST-AFNET 4 сравнивали эффект стратегии раннего контроля ритма в сравнении со стратегией контроля ЧСС среди пациентов с разной степенью выраженности симптомов ФП [35]. У пациентов с ФП без симптомов из группы раннего контроля ритма первичная конечная точка встречалась на 24% реже (ОР 0,76; 95% ДИ 0,60–1,03) по сравнению с группой контроля ЧСС, что сопоставимо с результатами исследования у симптомных больных [35]. Таким образом, клиническая польза раннего контроля ритма была сопоставима у бессимптомных и симптомных пациентов с ФП, что может изменить подходы к тактике ведения пациентов с пароксизмальной ФП в реальной практике, а именно расширить применение стратегии контроля ритма.
Анализируя результаты исследования EAST-AFNET 4 и его субанализов, можно заключить, что стратегия раннего контроля ритма перспективна и должна рассматриваться в качестве инструмента лечения пациентов с ФП вне зависимости от наличия/тяжести симптомов аритмии и ХСН.
Препаратом выбора в качестве профилактики рецидивов ФП у пациентов без структурного поражения сердца и ХСН является пропафенон [1]. Пропафенон – ААП IC-класса, замедляющий деполяризацию в клетках миокарда и обладающий слабыми бета-адреноблокирующими свойствами, местно-анестезирующим эффектом и прямым мембраностабилизирующим действием на миокард [36]. Он вызывает удлинение интервала PR и расширение комплекса QRS; расширение комплекса QRS затрудняет интерпретацию влияния пропафенона на интервал QT [1]. Данный препарат можно использовать как для поддержания синусового ритма, так и для купирования пароксизмов ФП, в том числе в качестве стратегии «таблетка в кармане» [1].
На российском рынке пропафенон представлен в виде препарата Пропанорм®, «ПРО. МЕД.ЦС Прага а.о.», Чехия. В исследовании ПРОМЕТЕЙ-ИНСК [37] (n=388) подтверждены эффективность и безопасность пропафенона (Пропанорм®) при купировании пароксизмальной формы ФП на догоспитальном этапе в сравнении с амиодароном. Эффективность, которую оценивали по факту и скорости восстановления сердечного ритма в течение 24 ч наблюдения, была наибольшей в группе Пропанорма® – 78% по сравнению с группой амиодарона (Кордарона®) – 62%; также Пропанорм® «выиграл» по скорости наступления эффекта у Кордарона® (в среднем 22 мин для Пропанорма® и 110 мин для Кордарона®). Купирование пароксизма ФП в течение ≤60 мин в группе Пропанорма® отмечено в 65% случаев, что значительно превышает подобный показатель в группе Кордарона® (26%; p<0,05 между группами) [37].
Таким образом, в ходе консультации пациенту была рекомендована антикоагулянтная терапия – апиксабан 5 мг 2 раза в сутки; антигипертензивная терапия – продолжение приема телмисартана 80 мг и индапамида 2,5 мг; гастроэнтеропротективная терапия – Ребагит 100 мг 3 раза в сутки + рабепразол 20 мг 2 раза/сутки (через 14 дней переход на прием рабепразола 20 мг 1 раз в сутки); эрадикационная терапия H. Pylori – кларитромицин 500 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки – 14 дней; профилактика рецидивов ФП – Пропанорм 150 мг 3 раза в сутки с динамическим контролем ЭКГ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Остроумова Ольга Дмитриевна – д-р мед. наук, проф., зав. каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО; проф. каф. клинической фармакологии и пропедевтики внутренних болезней, ФГАОУ ВО «Первый Московский медицинский университет им. И.М. Сеченова» (Сеченовский Университет). E-mail: ostroumova.olga@mail.ru; ORCID: 0000-0002-0795-8225
Olga D. Ostroumova – Dr. Sci. (Med.), Full Prof., Russian Medical Academy of Continuous Professional Education; Prof., Sechenov First Moscow Medical University (Sechenov University). E-mail: ostroumova.olga@mail.ru; ORCID: 0000-0002-0795-8225
Кочетков Алексей Иванович – канд. мед. наук, доцент, доцент каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: ak_info@list.ru; ORCID: 0000-0001-5801-3742
Alexey I. Kochetkov – Cand. Sci. (Med.), Assoc. Prof., Russian Medical Academy of Continuous Professional Education. E-mail: ak_info@list.ru; ORCID: 0000-0001-5801-3742
Литвинова Светлана Владимировна – канд. мед. наук, ассистент каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: batyukina.svetlana@yandex.ru; ORCID: 0000-0003-1316-7654
Svetlana V. Litvinova – Cand. Sci. (Med.), Russian Medical Academy of Continuous Professional Education. E-mail: batyukina.svetlana@yandex.ru; ORCID: 0000-0003-1316-7654
Филиппова Татьяна Владимировна – ассистент каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: atv-tess@mail.ru; ORCID: 0009-0004-7241-0938
Tatyana V. Filippova – Assistant, Russian Medical Academy of Continuous Professional Education. E-mail: atv-tess@mail.ru; ORCID: 0009-0004-7241-0938
Поступила в редакцию: 02.09.2024
Поступила после рецензирования: 06.09.2024
Принята к публикации: 06.09.2024
Received: 02.09.2024
Revised: 06.09.2024
Accepted: 06.09.2024
Клинический разбор в общей медицине №10 2024
Персонализация терапии у пациентов с фибрилляцией предсердий: клинический случай
Номера страниц в выпуске:70-77
Аннотация
Представлен клинический случай мужчины 65 лет с впервые диагностированной фибрилляции предсердий (ФП). Причиной обращения пациента к кардиологу послужил впервые возникший пароксизм ФП, который был купирован медикаментозно в стационаре (пропафенон в дозе 1,5 мг/кг внутривенно в течение 10 мин). Из анамнеза известно, что пациент страдает артериальной гипертензией и ожирением 1-й степени, ранее перенес желудочное кровотечение. По данным эзофагогастродуоденоскопии выявлен хронический хеликобактерный эрозивный активный выраженный гастрит. В ходе консультации пациенту была рекомендована антикоагулянтная терапия (апиксабан 5 мг 2 раза в сутки), гастроэнтеропротективная терапия (ребамипид 100 мг 3 раза в сутки + рабепразол 20 мг 2 раза в сутки), антиаритмическая терапия (пропафенон 150 мг 3 раза) и эрадикационная терапия H. pylori (кларитромицин 500 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки). На примере конкретного клинического случая в статье обсуждаются современные подходы к повышению безопасности антикоагулянтной терапии и выбору стратегии контроля ритма у пациентов с ФП.
Ключевые слова: фибрилляция предсердий, прямые оральные антикоагулянты, гастропротективная терапия, желудочно-кишечные кровотечения, ингибиторы протонной помпы, ребамипид, антиаритмическая терапия, антиаритмические препараты, пропафенон.
Для цитирования: Остроумова О.Д., Кочетков А.И., Литвинова С.В., Филиппова Т.В. Персонализация терапии у пациентов с фибрилляцией предсердий: клинический случай. Клинический разбор в общей медицине. 2024; 5 (10): 70–77. DOI: 10.47407/kr2024.5.10.00498
Представлен клинический случай мужчины 65 лет с впервые диагностированной фибрилляции предсердий (ФП). Причиной обращения пациента к кардиологу послужил впервые возникший пароксизм ФП, который был купирован медикаментозно в стационаре (пропафенон в дозе 1,5 мг/кг внутривенно в течение 10 мин). Из анамнеза известно, что пациент страдает артериальной гипертензией и ожирением 1-й степени, ранее перенес желудочное кровотечение. По данным эзофагогастродуоденоскопии выявлен хронический хеликобактерный эрозивный активный выраженный гастрит. В ходе консультации пациенту была рекомендована антикоагулянтная терапия (апиксабан 5 мг 2 раза в сутки), гастроэнтеропротективная терапия (ребамипид 100 мг 3 раза в сутки + рабепразол 20 мг 2 раза в сутки), антиаритмическая терапия (пропафенон 150 мг 3 раза) и эрадикационная терапия H. pylori (кларитромицин 500 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки). На примере конкретного клинического случая в статье обсуждаются современные подходы к повышению безопасности антикоагулянтной терапии и выбору стратегии контроля ритма у пациентов с ФП.
Ключевые слова: фибрилляция предсердий, прямые оральные антикоагулянты, гастропротективная терапия, желудочно-кишечные кровотечения, ингибиторы протонной помпы, ребамипид, антиаритмическая терапия, антиаритмические препараты, пропафенон.
Для цитирования: Остроумова О.Д., Кочетков А.И., Литвинова С.В., Филиппова Т.В. Персонализация терапии у пациентов с фибрилляцией предсердий: клинический случай. Клинический разбор в общей медицине. 2024; 5 (10): 70–77. DOI: 10.47407/kr2024.5.10.00498
Personalization of therapy in patients with atrial fibrillation: a case report
O.D. Ostroumova1,2, A.I. Kochetkov1, S.V. Litvinova1, T.V. Filippova11 Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
ostroumova.olga@mail.ru
Abstract
A clinical case of a 65-year-old man with newly diagnosed AF is presented. The patient consulted a cardiologist because of a first-time paroxysm of atrial fibrillation (AF), which was stopped with medication in hospital (propafenone at a dose of 1.5 mg/kg intravenously for 10 minutes). It is known from the anamnesis that the patient suffers from arterial hypertension and stage I obesity, and previously suffered from gastric bleeding. According to esophagogastroduodenoscopy, chronic Helicobacter erosive active severe gastritis was detected. During the consultation, the patient was recommended anticoagulant therapy (apixaban 5 mg × 2 times a day), gastroenteroprotective therapy (rebamipide 100 mg × 3 times a day + rabeprazole 20 mg 2 times a day), antiarrhythmic therapy (propafenone 150 mg × 3 times) and H. pylori eradication therapy (clarithromycin 500 mg × 2 times a day, amoxicillin 1000 mg × 2 times a day). Using a specific clinical case as an example, the article discusses modern approaches to improving the safety of anticoagulant therapy and choosing a rhythm control strategy in patients with AF.
Keywords: atrial fibrillation, direct oral anticoagulants, gastroprotective therapy, gastrointestinal bleeding, proton pump inhibitors, rebamipide, antiarrhythmic therapy, antiarrhythmic drugs, propafenone.
For citation: Ostroumova O.D., Kochetkov A.I., Litvinova S.V., Filippova T.V. Personalization of therapy in patients with atrial fibrillation: a case report. Clinical review for general practice. 2024; 5 (10): 70–77 (In Russ.). DOI: 10.47407/kr2024.5.10.00498
Введение
Фибрилляция предсердий (ФП) – одна из самых часто встречаемых аритмий, ее распространенность достигает 2% у населения в целом и 15% у лиц старше 80 лет [1]. ФП ассоциирована с ухудшением качества жизни, возрастанием количества госпитализаций и увеличением риска сердечно-сосудистых осложнений (ССО) [2]. Так, риск сердечно-сосудистой смерти у пациентов с ФП в среднем возрастает в 2 раза у женщин и в 1,5 раза у мужчин даже с учетом оптимальной, по современным представлениям, терапии [3].Пациентам с ФП для профилактики тромбоэмболических осложнений в абсолютном большинстве случаев необходим прием антикоагулянтов [1]. Однако данная терапия сопровождается повышенным риском кровотечений, среди которых наиболее опасны желудочно-кишечные кровотечения (ЖКК) [4]. Поэтому важная составляющая в ведении данных пациентов – назначение эффективной гастроэнтеропротективной терапии. Однако выбор оптимального лекарственного средства/оптимальной схемы фармакотерапии для надежной защиты желудочно-кишечного тракта (ЖКТ) требует уточнения.
Еще один активно изучаемый вопрос – персонализация антиаритмической терапии, поскольку пароксизмы ФП существенно снижают трудоспособность и качество жизни пациентов [5, 6].
Клинический случай
Пациент Л., 65 лет, 4 сентября 2023 г. обратился к кардиологу в поликлинике по месту жительства. Причиной обращения послужил возникший сутки назад впервые в жизни пациента пароксизм ФП, который был купирован медикаментозно в стационаре. На момент осмотра мужчина жалоб активно не предъявлял.Из анамнеза заболевания известно, что 1 сентября 2023 г. у пациента внезапно во время работы возникло ощущение очень частого и неровного биения сердца, сопровождаемое слабостью и потливостью. Данный приступ продолжался около 15–20 мин и закончился самостоятельно. За медицинской помощью не обращался. Однако уже 3 сентября 2023 г. у пациента вновь внезапно появилось ощущение выраженного сердцебиения, которое самостоятельно не купировалось на протяжении часа, в связи с чем была вызвана бригада скорой медицинской помощи. На догоспитальном этапе при регистрации электрокардиограммы (ЭКГ) была диагностирована тахисистолическая форма ФП с частотой сердечных сокращений (ЧСС) 93–134 в минуту без электрокардиографических и клинических признаков нестабильности гемодинамики. Бригада скорой медицинской помощи провела пульсурежающую (бисопролол 5 мг) и антикоагулянтную (гепарин натрия п/к) терапию с последующей госпитализацией в стационар.
В приемном отделении стационара пациенту выполнена эхокардиография: фракция выброса левого желудочка (ЛЖ) 61%, незначительная концентрическая гипертрофия миокарда ЛЖ (индекс массы миокарда ЛЖ – иММЛЖ) – 50,2 г/м2, толщина межжелудочковой перегородки 1,2 см, толщина задней стенки ЛЖ 1,0 см, полости сердца не расширены, митральная регургитация 1-й степени, трикуспидальная регургитация 1–2-й степени, зон нарушения локальной сократимости не выявлено, систолическое давление в легочной артерии (СДЛА) 27 мм рт. ст.
В отделении интенсивной терапии стационара посредством медикаментозной кардиоверсии пропафеноном (Пропанорм® в дозе 1,5 мг/кг внутривенно в течение 10 мин) восстановлен синусовый ритм. В дальнейшем пациент находился под наблюдением кардиолога в стационаре – срывов синусового ритма и нежелательных лекарственных реакций не возникало. От дальнейшего пребывания в стационаре пациент отказался. Направлен к кардиологу в поликлинику по месту жительства для продолжения терапии с рекомендациями в виде приема апиксабана 5 мг 2 раза в сутки и пропафенона 150 мг 3 раза в сутки.
Сопутствующие заболевания: артериальная гипертония III стадии, контролируемая артериальная гипертензия, очень высокий риск ССО (риск 4). Пациент принимает телмисартан 80 мг и индапамид (Индап®) 2,5 мг, при самоизмерении артериальное давление (АД) на уровне 125–128/75 мм рт. ст. Ожирение I степени.
В возрасте 39 лет перенес желудочное кровотечение. Согласно представленной документации, по данным эзофагогастродуоденоскопии (ЭГДС), источником стала эрозия в области малой кривизны желудка, а вероятной причиной – бесконтрольный прием нестероидных противовоспалительных препаратов (НПВП) в связи с головными болями. В последующем был консультирован неврологом с подбором терапии мигрени с положительным эффектом. Вместе с тем в настоящее время изредка принимает НПВП при выраженных головных болях. Хронический гастрит в анамнезе; курсами принимает омепразол.
Анамнез жизни: работает водителем такси. Курит около 40 лет, по 1 пачке в день, два-три раза в месяц по выходным употребляет алкоголь (со слов пациента, пиво, не более 1 бутылки). Питается несбалансированно, часто фастфудом. Аллергоанамнез: не отягощен.
Результаты физикального осмотра: состояние удовлетворительное. Индекс массы тела – 31,2 кг/м2, окружность талии – 113 см. Кожные покровы обычной окраски, чистые. Отеков нет. Над всей поверхностью легких ясный легочный звук. Дыхание везикулярное, хрипов нет. Частота дыханий – 16 в минуту. Пульс
76 уд/мин, ритмичный. Офисное АД 127/78 мм рт. ст. Живот мягкий, безболезненный. Печень по краю реберной дуги. Симптом поколачивания отрицательный с обеих сторон.
Результаты лабораторных исследований: клинический анализ крови и мочи – без патологии. Биохимическое исследование крови: креатинин –
98 мкмоль/л, глюкоза натощак – 5,7 ммоль/л, общий холестерин – 5,8 ммоль/л, триглицериды –
1,7 ммоль/л, липопротеины низкой плотности –
2,7 ммоль/л, липопротеины высокой плотности –
1,0 ммоль/л, мочевая кислота – 389 мкмоль/л, натрий – 138 ммоль/л, калий – 4,7 ммоль/л, аланинаминотрансфераза (АЛТ) – 29 Ед/л, аспартатаминотрансфераза (АСТ) – 26 Ед/л, скорость клубочковой фильтрации (СКФ) 69 мл/мин/1,73 м2. Клиренс креатинина 94 мл/мин. Коагулограмма – без особенностей (таблица).
Результаты инструментальных методов исследования
Электрокардиография: синусовый ритм с ЧСС 77 в минуту. Отклонение электрической оси сердца влево. Неспецифические изменения в миокарде.
Холтеровское мониторирование ЭКГ: ритм синусовый. Пароксизмов фибрилляции/трепетания предсердий не зарегистрировано. Выявлено 129 одиночных суправентрикулярных экстрасистол и 94 мономорфных одиночных желудочковых экстрасистол. Диагностически значимых пауз не обнаружено. Отклонений сегмента ST не зафиксировано. Продолжительность интервалов PQ и QT в пределах нормальных значений.
Суточное мониторирование АД: артериальная гипертензия не выявлена.
Эзофагогастродуоденоскопия с биопсией. Заключение: хронический гастрит с очаговой атрофией слизистой и наличием единичных эрозий, бульбит, дуоденогастральный рефлюкс. Косвенные признаки заболевания панкреатобилиарной зоны. Данные исследования биоптатов: фрагменты слизистой оболочки желудка из краев хронической эрозии с фовеолярной гиперплазией, хроническим воспалением умеренной активности. Helicobacter pylori +. Заключение: хронический хеликобактерный эрозивный активный выраженный гастрит.
При стратификации риска тромбоэмболических осложнений по шкале CHA2DS2VASc сумма баллов = 2, при оценке геморрагических осложнений по шкале HAS-BLED сумма баллов = 2.

Гастропротективная терапия
В качестве профилактики тромбоэмболических осложнении (сумма баллов по шкале CHA2DS2VASc =2) пациенту был назначен постоянный прием оральных антикоагулянтов (апиксабана 5 мг 2 раза всутки). Риск по шкале HAS-BLED составил 2 балла, что подтверждает умеренный риск геморрагических осложнений в ходе антикоагулянтной терапии.
Однако необходимо помнить, что прием антитромботической терапии (антикоагулянтной и/или антиагрегантной) ассоциирован с повышенным риском геморрагических осложнений, в том числе ЖКК [7–9]. Так, например, увеличение риска ЖКК отмечалось на фоне приема ацетилсалициловой кислоты в дозе до 100 мг в сутки (относительный риск – ОР – 2,7; 95% доверительный интервал – ДИ – 2,0–3,6), клопидогреля/тиклопидина (ОР 2,8; 95% ДИ 1,9–4,2) и антикоагулянтов (ОР 2,8; 95% ДИ 2,1–3,7) [8, 10]. Согласно результатам метаанализа, включавшего 43 рандомизированных контролируемых исследования (151 578 пациентов), в течение периода наблюдения (от 3 нед до 31 мес) назначение прямых оральных антикоагулянтов сопровождалось ЖКК в 1,5% случаев: для апиксабана ОР составил 23 (95% ДИ 0,56–2,73), для дабигатрана – 1,58 (95% ДИ 1,29–1,93), для эдоксабана – 0,31 (95% ДИ 0,01–7,69), для ривароксабана – 1,48 (95% ДИ 1,21–1,82) [11]. Причем большая часть (89%) от всех случаев ЖКК являлись большими ЖКК, т.е. вели к снижению уровня гемоглобина на 20 г/л и более в течение 24 ч, требовали гемотрансфузии ≥2 единиц эритроцитарной массы, хирургического вмешательства или приводили к смертельному исходу [11].
В Российской Федерации в 2021–2022 гг. проведено фармакоэпидемиологическое многоцентровое кросс-секционное клиническое исследование [12], посвященное оценке частоты и структуры назначения лекарственных препаратов гастропротективного действия у пациентов, получающих прямые оральные коагулянты (ПОАК). В исследовании ретроспективно проанализированы данные 662 пациентов, находившихся на терапии ПОАК и проходивших обследование в различных научных центрах и лечебно-профилактических учреждениях России (26 научных центров в 15 городах, 13 амбулаторных центров и 13 стационаров). Среди них 408 (61,6%) имели различные заболевания ЖКТ. Наиболее распространены были заболевания желудка (54,8%), пищевода (33,8%), кишечника (32,2%), желчного пузыря и желчевыводящих путей (21,6%). Заболевания печени отмечались у 10,7% больных, а патология поджелудочной железы – у 8,0%. ЖКК в анамнезе отмечались у 1,2% пациентов, при этом высокий риск кровотечений из ЖКТ имели 38,4% пациентов [12]. Гастропротективная терапия была назначена 378 (57,1%) пациентам, включенным в исследование: монотерапия – 50,9%, комбинированная терапия – 6,2%. Самыми часто назначаемыми гастропротективными препаратами были ингибиторы протонной помпы (ИПП) – в назначениях они встречались в 80,2% случаев, на втором месте по частоте встречаемости был ребамипид – 27,8%. [13]. Среди пациентов с высоким риском кровотечений из ЖКТ только 47,6% больных получали гастропротективную терапию, им наиболее часто назначали ИПП (85,9%), из них омепразол встречался чаще всего (69,2%), на втором месте находился ребамипид (25,6%). Среди пациентов с ЖКК в анамнезе гастропротективная терапия также была назначена не всем – 37,5% пациентов не получали гастропротекторы [13].
Согласно результатам исследования, основной стратегией гастропротекции среди пациентов, принимающих ПОАК, является назначение ИПП в монотерапии. Роль терапии ИПП для первичной гастропротекции у пациентов, принимающих антикоагулянты, изучали лишь в единичных исследованиях. Так, в ретроспективном когортном исследовании среди 1 643 123 пациентов, находящихся на терапии оральными антикоагулянтами (ОАК, апиксабан, дабигатран, ривароксабан, варфарин), авторы изучили частоту госпитализаций по поводу кровотечений из верхних отделов ЖКТ [14]. Результаты данного исследования свидетельствуют, что для каждого антикоагулянта частота госпитализаций по поводу кровотечения из верхних отделов ЖКТ была ниже среди пациентов, получавших сопутствующую терапию ИПП (коэффициент заболеваемости 0,66; 95% ДИ: 0,62–0,69) [14].
Однако необходимо учитывать, что ИПП оказывают действие лишь на уровне верхних отделов ЖКТ и не защищают его нижние отделы. Так, например, терапия ИПП среди пациентов, принимающих НПВП, снижает риски нежелательных явлений в верхних отделах ЖКТ и ассоциирована с увеличением частоты поражений нижних отделов ЖКТ [15, 16]. Следовательно, применение ИПП считается независимым фактором риска развития НПВП-индуцированных энтеропатий [16].
По итогам обследования больных с применением капсульной эндоскопии, повреждающее воздействие антитромботических препаратов не ограничивается слизистой оболочкой верхних отделов ЖКТ, а затрагивает и слизистую оболочку тонкой и толстой кишки и приводит к увеличению риска ЖКК, в том числе из нижних отделов [17–20].
Помимо этого, есть данные, что длительное применение ИПП ассоциировано с множеством нежелательных лекарственных реакций, к ним относятся повышенный риск заболевания почек (10–20%), деменции (4–80%), переломов костей (30–400%), инфекций (до 600%), дисбиоза (200–800%) дефицита микроэлементов (60–70%) и злокачественных новообразований ЖКТ [21, 22].
Таким образом, пациентам с высоким риском развития ЖКК, принимающим ПОАК в качестве гастропротекции, необходим препарат, обладающий протекцией на всем протяжении ЖКТ. На российском рынке доступно лекарственное средство ребамипид (препарат Ребагит, «ПРО. МЕД.ЦС Прага а.о.», Чехия), обладающее комплексными протективными эффектами на всем протяжении ЖКТ. Ребамипид оказывает защитный эффект на слизистую оболочку ЖКТ за счет регуляции уровня простагландинов, восстановления физиологической продукции слизи и плотных контактов, а также ингибирования продуктов окислительного стресса, провоспалительных цитокинов и хемокинов, что в комплексе ведет к устранению синдрома повышенной проницаемости слизистых оболочек, благодаря чему он поддерживает нормальную барьерную функцию стенки кишечника [23].
В 2021 г. опубликован Российский междисциплинарный Консенсус экспертов по снижению риска ЖКК у пациентов, получающих ПОАК, разработанный Российским научным медицинским обществом терапевтов (РНМОТ), Научным обществом гастроэнтерологов России (НОГР), Национальным обществом профилактической кардиологии [7]. В документе подчеркивается необходимость назначения гастропротективной терапии пациентам, принимающим антикоагулянты, включая ПОАК, в особенности с наличием ЖКК в анамнезе, язвенного поражения ЖКТ и с высоким риском ЖКК [7].
В настоящее время нет единого понятия «высокий риск ЖКК», однако эксперты понимают под этим наличие у пациента ряда факторов, увеличивающих риск развития ЖКК. К ним относятся язвенная болезнь или ЖКК в анамнезе; хроническое использование НПВП или глюкокортикостероидов и минимум два из следующих признаков: возраст ≥65 лет, диспепсия, желудочно-пищеводный рефлюкс, инфицирование Helicobacter pylori
(H. pylori), хроническое употребление алкоголя [7]. Таким образом, пациент из представленного клинического случая имел высокий риск ЖКК (ЖКК в анамнезе, возраст ≥65 лет, желудочно-пищеводный рефлюкс, инфицирование H. Pylori), что подчеркивает необходимость назначения эффективной гастропротективной терапии.
В качестве медикаментозной терапии эксперты рекомендуют назначение ИПП в сочетании с ребамипидом (препарат Ребагит®, Промед Прага ЦС, Чехия) как минимум в течение 3 месяцев [7]. Далее ИПП можно с течением времени переводить в режим поддерживающей дозы и далее по требованию. При этом подчеркивается необходимость назначения ребамипида на всем протяжении приема ПОАК терапии [7]. Также эксперты отмечают, что апиксабан является препаратом выбора среди ОАК с точки зрения минимизации риска кровотечений [7].
С другой стороны, пациенту необходима модификация факторов риска ЖКК, а именно назначение эффективной эрадикационной терапии H. Pylori. Стандартная эрадикационная терапия включает назначение ИПП (в стандартной дозе 2 раза в сутки), кларитромицин (500 мг 2 раза в сутки) и амоксициллин (1000 мг 2 раза в сутки внутрь) в течение 14 дней [24]. Однако последние данные крупных исследований и метаанализов свидетельствуют о прогрессивном снижении эффективности стандартных схем эрадикации вследствие роста антибиотикорезистентности [25–28]. В среднем частота неэффективного лечения при использовании стандартной комбинации составляет примерно 20–30% [29].
И в клинических рекомендациях по лечению гастрита и дуоденита в качестве меры повышения эффективности антигеликобактерного лечения рекомендовано добавление ребамипида в дозе 100 мг 3 раза в сутки в схемы эрадикации [24].
Терапия, направленная на профилактику рецидивов ФП
Для лечения пациентов с ФП рекомендованы две альтернативные терапевтические стратегии: 1) снижение частоты сокращений желудочков на фоне сохраняющейся ФП, так называемый контроль ЧСС, предполагающий применение ритмурежающих лекарственных средств и воздержание от собственно противоаритмического лечения; 2) восстановление (при необходимости) и как можно более длительное сохранение синусового ритма средствами лекарственного противоаритмического лечения (антиаритмические препараты), так называемый контроль ритма сердца [1].
Выбор стратегии лечения ФП всегда индивидуален и зависит от характера течения аритмии, степени выраженности клинических проявлений, наличия сопутствующих заболеваний и переносимости различных групп препаратов, немаловажную роль играет предпочтение пациента [1].
В ранее проведенных крупных исследованиях AF Follow-Up Investigation of Rhythm Management (AFFIRM) (n=4060) и RAte Control versus Electrical cardioversion for atrial fibrillation (RACE) (n=522) не установлено существенных различий между стратегиями контроля ЧСС и контроля ритма при сравнении показателей смертности от всех причин и ССО [30, 31]. Однако при субанализе исследования AFFIRM выявлено, что наличие синусового ритма ассоциировано со снижением риска летального исхода на 47% (р<0,0001), и в то же время применение антиаритмических препаратов (ААП), чаще всего амиодарона, для поддержания синусового ритма ассоциировалось с увеличением риска неблагоприятных событий [32].
Однако в многоцентровом рандомизированном исследовании The Early Treatment of Atrial Fibrillation for Stroke Prevention Trial (EAST-AFNET 4) [33] показано, что терапия для контроля ритма, начатая после постановки диагноза ФП, может снизить риск неблагоприятных исходов по сравнению с современной практикой отсроченного перехода к стратегии контроля ритма [33]. В это исследование были включены 2789 пациентов с недавно диагностированной ФП (медиана времени после постановки диагноза ФП составляла 36 дней). Пациенты в группе раннего контроля ритма получали ААП (87% случаев) или им проводили катетерную аблацию (КА) ФП (9% в начале лечения и 19% через 2 года наблюдения). За период наблюдения (медиана наблюдения 5,1 года) среди пациентов в группе раннего контроля ритма был статистически значимо ниже риск развития сердечно-сосудистой смерти на 28% (ОР 0,72; 95% ДИ 0,52–0,98), инсульта – на 35% (ОР 0,65; 95% ДИ 0,44–0,97) и риск наступления комбинированной первичной конечной точки (сумма неблагоприятных событий – сердечно-сосудистая смерть, инсульт, госпитализация из-за ухудшения сердечной недостаточности или острого коронарного синдрома) – на 21% (ОР 0,79; 95% ДИ 0,66–0,94, p=0,005) [33].
В субанализе исследования EAST-AFNET 4 среди пациентов (n=798) с симптомами хронической сердечной недостаточности (ХСН) (II или III функционального класса по Нью-Йоркской классификации) или фракцией выброса ЛЖ <50% у пациентов в группе с ранним контролем ритма также отмечалось снижение риска возникновения событий комбинированной первичной конечной точки (на 26%) по сравнению с пациентами из группы обычного лечения (ОР 0,74; 95% ДИ 0,56–0,97, р=0,03) [34].
В другом анализе EAST-AFNET 4 сравнивали эффект стратегии раннего контроля ритма в сравнении со стратегией контроля ЧСС среди пациентов с разной степенью выраженности симптомов ФП [35]. У пациентов с ФП без симптомов из группы раннего контроля ритма первичная конечная точка встречалась на 24% реже (ОР 0,76; 95% ДИ 0,60–1,03) по сравнению с группой контроля ЧСС, что сопоставимо с результатами исследования у симптомных больных [35]. Таким образом, клиническая польза раннего контроля ритма была сопоставима у бессимптомных и симптомных пациентов с ФП, что может изменить подходы к тактике ведения пациентов с пароксизмальной ФП в реальной практике, а именно расширить применение стратегии контроля ритма.
Анализируя результаты исследования EAST-AFNET 4 и его субанализов, можно заключить, что стратегия раннего контроля ритма перспективна и должна рассматриваться в качестве инструмента лечения пациентов с ФП вне зависимости от наличия/тяжести симптомов аритмии и ХСН.
Препаратом выбора в качестве профилактики рецидивов ФП у пациентов без структурного поражения сердца и ХСН является пропафенон [1]. Пропафенон – ААП IC-класса, замедляющий деполяризацию в клетках миокарда и обладающий слабыми бета-адреноблокирующими свойствами, местно-анестезирующим эффектом и прямым мембраностабилизирующим действием на миокард [36]. Он вызывает удлинение интервала PR и расширение комплекса QRS; расширение комплекса QRS затрудняет интерпретацию влияния пропафенона на интервал QT [1]. Данный препарат можно использовать как для поддержания синусового ритма, так и для купирования пароксизмов ФП, в том числе в качестве стратегии «таблетка в кармане» [1].
На российском рынке пропафенон представлен в виде препарата Пропанорм®, «ПРО. МЕД.ЦС Прага а.о.», Чехия. В исследовании ПРОМЕТЕЙ-ИНСК [37] (n=388) подтверждены эффективность и безопасность пропафенона (Пропанорм®) при купировании пароксизмальной формы ФП на догоспитальном этапе в сравнении с амиодароном. Эффективность, которую оценивали по факту и скорости восстановления сердечного ритма в течение 24 ч наблюдения, была наибольшей в группе Пропанорма® – 78% по сравнению с группой амиодарона (Кордарона®) – 62%; также Пропанорм® «выиграл» по скорости наступления эффекта у Кордарона® (в среднем 22 мин для Пропанорма® и 110 мин для Кордарона®). Купирование пароксизма ФП в течение ≤60 мин в группе Пропанорма® отмечено в 65% случаев, что значительно превышает подобный показатель в группе Кордарона® (26%; p<0,05 между группами) [37].
Таким образом, в ходе консультации пациенту была рекомендована антикоагулянтная терапия – апиксабан 5 мг 2 раза в сутки; антигипертензивная терапия – продолжение приема телмисартана 80 мг и индапамида 2,5 мг; гастроэнтеропротективная терапия – Ребагит 100 мг 3 раза в сутки + рабепразол 20 мг 2 раза/сутки (через 14 дней переход на прием рабепразола 20 мг 1 раз в сутки); эрадикационная терапия H. Pylori – кларитромицин 500 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки – 14 дней; профилактика рецидивов ФП – Пропанорм 150 мг 3 раза в сутки с динамическим контролем ЭКГ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Остроумова Ольга Дмитриевна – д-р мед. наук, проф., зав. каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО; проф. каф. клинической фармакологии и пропедевтики внутренних болезней, ФГАОУ ВО «Первый Московский медицинский университет им. И.М. Сеченова» (Сеченовский Университет). E-mail: ostroumova.olga@mail.ru; ORCID: 0000-0002-0795-8225
Olga D. Ostroumova – Dr. Sci. (Med.), Full Prof., Russian Medical Academy of Continuous Professional Education; Prof., Sechenov First Moscow Medical University (Sechenov University). E-mail: ostroumova.olga@mail.ru; ORCID: 0000-0002-0795-8225
Кочетков Алексей Иванович – канд. мед. наук, доцент, доцент каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: ak_info@list.ru; ORCID: 0000-0001-5801-3742
Alexey I. Kochetkov – Cand. Sci. (Med.), Assoc. Prof., Russian Medical Academy of Continuous Professional Education. E-mail: ak_info@list.ru; ORCID: 0000-0001-5801-3742
Литвинова Светлана Владимировна – канд. мед. наук, ассистент каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: batyukina.svetlana@yandex.ru; ORCID: 0000-0003-1316-7654
Svetlana V. Litvinova – Cand. Sci. (Med.), Russian Medical Academy of Continuous Professional Education. E-mail: batyukina.svetlana@yandex.ru; ORCID: 0000-0003-1316-7654
Филиппова Татьяна Владимировна – ассистент каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: atv-tess@mail.ru; ORCID: 0009-0004-7241-0938
Tatyana V. Filippova – Assistant, Russian Medical Academy of Continuous Professional Education. E-mail: atv-tess@mail.ru; ORCID: 0009-0004-7241-0938
Поступила в редакцию: 02.09.2024
Поступила после рецензирования: 06.09.2024
Принята к публикации: 06.09.2024
Received: 02.09.2024
Revised: 06.09.2024
Accepted: 06.09.2024
Список исп. литературыСкрыть список1. Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Рос. кардиол. журн. 2021;26(7):4594.
Arakelyan MG, Bockeria LA, Vasilieva EYu et al.2020 Clinical guidelines for Atrial fibrillation and atrial flutter. Russian J of Cardiol. 2021;26(7):4594 (in Russian).
2. Li C, Lin C, Lin Y et al. Newly Diagnosed Atrial Fibril- lation Is an Independent Factor for Future Major Adverse Cardiovascular.Events. PLoS ONE 2015; 10(4):e0123211.
3. Andersson T, Magnuson A, Bryngelsson I. et al. All-cause mortality in 272 186 patients hospitalized with incident atrial fibrillation 1995–2008: a Swedish nationwide long-term case–control study. Eur Heart J 2013;34(14):1061-1067.
4. Cheung KS, Leung WK. Gastrointestinal bleeding in patients on novel oral anticoagulants: Risk, prevention and management. World J Gastroenterol. 2017 Mar 21;23(11):1954-1963.
5. Rush KL, Seaton CL, Burton L. et al. Quality of life among patients with atrial fibrillation: A theoretically-guided cross-sectional study. PLoS One. 2023 Oct 5;18(10):e0291575.
6. Aliot E, Botto GL, Crijns HJ, Kirchhof P. Quality of life in patients with atrial fibrillation: how to assess it and how to improve it. Europace. 2014 Jun;16(6):787-796.
7. Консенсус экспертов по снижению риска желудочно-кишечных кровотечений у пациентов, получающих оральные антикоагулянты. Терапия. 2021;10:23-41.
Experts consensus on reducing the risk of gastrointestinal bleeding in patients receiving oral anticoagulants. Therapy. 2021; 10: 23-41 (in Russian).
8. Derry S, Loke YK. Risk of gastrointestinal haemorrhage with long term use of aspirin: meta-analysis. BMJ. 2000 Nov 11;321(7270):1183-1187.
9. Holster IL, Valkhoff VE, Kuipers EJ, Tjwa ETTL. New oral anticoagulants increase risk for gastrointestinal bleeding: a systematic review and meta-analysis. Gastroenterology. 2013 Jul;145(1):105-112.e15.
10. Lanas A, García-Rodríguez LA, Arroyo MT et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut. 2006 Dec;55(12):1731-1738.
11. Holster IL, Valkhoff VE, Kuipers EJ, Tjwa ETTL. New oral anticoagulants increase risk for gastrointestinal bleeding: a systematic review and meta-analysis. Gastroenterology. 2013 Jul;145(1):105-112.e15.
12. Остроумова О.Д., Орлова И.Ю., Кочетков А.И. и др. Структура сопутствующих заболеваний органов пищеварения у пациентов, получающих прямые оральные антикоагулянты: результаты многоцентрового кросс-секционного фармакоэпидемиологического исследования. Терапия. 2022;8(10):152-161.
Ostroumova OD, Orlova IY, Kochetkov AI et al. Structure of polymorbidities of the digestive diseases in patients receiving direct oral anticoagulants: results of a multicenter cross-sectional pharmacoepidemiological study. Therapy. 2022;8(10):152-161 (in Russian).
13. Остроумова О.Д., Орлова И.Ю., Кочетков А.И. и др. Структура назначения лекарственных препаратов гастропротективного действия у пациентов, получающих прямые оральные антикоагулянты: результаты многоцентрового кросс-секционного фармакоэпидемиологического исследования. Фарматека. 2022;(13):
62-69.
Ostroumova OD, Orlova IY, Kochetkov AI et al. Pattern of prescribing ga stroprotective drugs in patients receiving direct oral anticoagulants: results of a multicenter cross-sectional pharmacoepidemiological study. Pharmateka. 2022;(13):62-69 (in Russian).
14. Ray WA, Chung CP, Murray KT. et al. Association of Oral Anticoagulants and Proton Pump Inhibitor Cotherapy With Hospitalization for Upper Gastrointestinal Tract Bleeding. JAMA 2018 Dec 4;320(21): 2221-2230.
15. Daniell HW. NSAID-PPI enteropathy in humans. Gastroenterology. 2012 Apr;142(4):e20; author reply e20-21.
16. Marlicz W, Loniewski I, Grimes DS, Quigley EM. Nonsteroidal anti-inflammatory drugs, proton pump inhibitors, and gastrointestinal injury: contrasting interactions in the stomach and small intestine. Mayo Clin Proc 2014;89(12):1699-709.
17. Cheung KS, Leung WK. Gastrointestinal bleeding in patients on novel oral anticoagulants: Risk, prevention and management. World J Gastroenterol 2017;23(11):1954–63.
18. Fawzy AM, Yang WY, Lip GY. Safety of direct oral anticoagulants in real-world clinical practice: translating the trials to everyday clinical management. Expert Opin Drug Saf 2019 Mar;18(3):187-209.
19. Gao F, Chen X, Zhang J. Prevalence of Gastric and Small-Intestinal Mucosal Injury in Elderly Patients Taking Enteric-Coated Aspirin by Magnetically Controlled Capsule Endoscopy. Gastroenterol Res Pract 2019 Nov 5;2019:1582590.
20. Tziatzios G, Gkolfakis P, Papanikolaou IS, Triantafyllou K. Antithrombotic Treatment Is Associated with Small-Bowel Video Capsule Endoscopy Positive Findings in Obscure Gastrointestinal Bleeding: A Systematic Review and Meta-Analysis. Dig Dis Sci 2019;64(1):15-24.
21. Gwee KA, Goh V, Lima G, Setia S. Coprescribing proton-pump inhibitors with nonsteroidal anti-inflammatory drugs: risks versus benefits.
J Pain Res. 2018 Feb 14;11:361-374.
22. Freedberg DE, Kim LS, Yang YX. The Risks and Benefits of Long-term Use of Proton Pump Inhibitors: Expert Review and Best Practice Advice From the American Gastroenterological Association. Gastroenterology 2017 Mar;152(4):706-15.
23. Остроумова ОД, Кочетков АИ. Роль нарушений структуры кишечного барьера в патогенезе сердечно-сосудистых заболеваний и возможности ребамипида в их коррекции. Фарматека. 2020;13: 29-41.
Ostroumova OD. Kochetkov AI. The role of the disturbances in the intestinal barrier structure in relation to cardiovascular diseases pathogenesis and rebamipid potential in their correction. Farmateka. 2020; 13: 29–41 (in Russian).
24. Клинические рекомендации «Гастрит и дуоденит». Минздрав России. Год утверждения 2024.
Clinical guidelines «Gastritis and duodenitis». Ministry of Health of Russia. Year of approval 2024 (in Russian).
25. Feng L, Wen MY, Zhu YJ et al. Sequential Therapy or Standard Triple Therapy for Helicobacter pylori Infection: An Updated Systematic Review. Am J Ther. 2016;23(3):e880-893.
26. Puig I, Baylina M, Sánchez-Delgado J et al. Systematic review and meta-analysis: triple therapy combining a proton-pump inhibitor, amoxicillin and metronidazole for Helicobacter pylori first-line treatment. J Antimicrob Chemother. 2016;71(10):2740-53.
27. Nyssen OP, Bordin D, Tepes B et al. Hp-EuReg Investigators. European Registry on Helicobacter pylori management (Hp-EuReg): patterns and trends in first-line empirical eradication prescription and outcomes of 5 years and 21533 patients. Gut. 2020;70(1):40-54.
28. Бордин Д.С., Эмбутниекс Ю.В., Вологжанина Л.Г. и др. Европейский регистр Helicobacter pylori (Hp-EuReg): как изменилась клиническая практика в России с 2013 по 2018 г. Терапевтический архив. 2019;91(2):16-24.
Bordin DS, Embutnieks YuV, Vologzhanina LG et al. European registry Helicobacter pylori (Hp-EuReg): how has clinical practice changed in Russia from 2013 to 2018 years. Terapevticheskii Arkhiv. 2019;91(2):16-24 (in Russian).
29. Gisbert JP, McNicholl AG. Optimization strategies aimed to increase the efficacy of H. pylori eradication therapies. Helicobacter. 2017;22(4).
30. Wyse DG, Waldo AL, DiMarco JP. et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med. 2002 Dec 5;347(23):1825-1833.
31. Van Gelder IC, Hagens VE, Bosker HA. et al. Rate Control versus Electrical Cardioversion for Persistent Atri- al Fibrillation Study Group.
A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002;347(23):1834-1840.
32. Corley SD, Epstein AE, DiMarco JP. et al. Relationships between sinus rhythm, treatment, and survival in the Atrial Fibrillation Follow-Up Investigation of Rhythm Manage-ment (AFFIRM) Study. Circulation 2004;109(12):1509-1513.
33. Kirchhof P, Camm AJ, Goette A. et al. Early Rhythm-Control Therapy in Patients with Atrial Fibrillation. N Engl J Med 2020;383(14):1305-1316.
34. Rillig A, Magnussen C, Ozga AK. et al. Early Rhythm Control Therapy in Patients With Atrial Fibrillation and Heart Failure. Circulation 2021;144(11):845-858.
35. Willems S, Borof K, Brandes A. et al. Systematic, early rhythm control strategy for atrial fibrillation in patients with or without symptoms: the EAST-AFNET 4 trial. Eur Heart J 2022;43(12):1219-1230.
36. Stoschitzky K, Stoschitzky G, Lercher P. et al. Propafenone shows class Ic and class II antiarrhythmic effects. Europace 2016 Apr;18(4):568-71.
37. Тарасов А.В., Косых С.А., Бушуева Е.В. и др. Сравнение эффективности инъекционных форм антиаритмических препаратов пропафенона и амиодарона при проведении фармакологической кардиоверсии пароксизмальной фибрилляции предсердий. Consilium Medicum. 2019;21(1):81-86.
Tarasov AV, Kosykh SA, Bushueva EV et al. Comparison of the efficacy of injectable forms of antiarrhythmic drugs propafenone and amiodarone during pharmacological cardioversion of paroxysmal atrial fibrillation. Consilium Medicum. 2019;21(1):81-86 (in Russian).

