Клинический разбор в общей медицине №11 2024
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
musaeva-93@mail.ru
Abstract
Background. Rheumatoid arthritis (RA) is a systemic chronic autoimmune disease characterized by erosive and destructive joint lesions leading to their ankylosis, as well as damage to other organs and systems. The main types of RA treatment are reducing the severity of pain, slowing the rate of disease progression and improving the quality of life of patients. Despite advances in the treatment of RA, few significant biomarkers have been identified to date for the diagnosis and effectiveness of drug therapy control in RA. The results of scientific studies have shown that the pathogenesis of RA is based on complex biochemical phenomena involving metabolites arising from a variety of metabolic pathways. The overall metabolism of RA has not been fully studied, and the reliability of metabolic markers for the effectiveness of treatment at the cellular and molecular level is currently lacking. Metabolomics is a science that studies intermediate and conical products of metabolism depending on the quantitative assessment of the levels and dynamics of various metabolites in biological samples (blood, mocha and synovial fluid). metabolism is still not fully understood.
Aim. To identify changes in the metabolomic profile in patients with RA during biologic disease-modifying anti-rheumatic drugs.
Material and methods. The study participants were divided into 3 groups: the group of patients with RA not receiving antirheumatic therapy "RA de novo" included 14 people, the group of patients undergoing genetic engineering biological therapy "RA-bDMARDS" – 16 people and the control group "healthy volunteers" – 15 people. The study of intestinal metabolites of blood was carried out using ultra-efficient liquid chromatography in conjunction with a triple quadrupole analyzer. A correlation analysis of significant metabolites was performed in three groups of patients with active disease according to DAS28, CRP and ESR levels, the presence of RF and ACPA.
Results. When examining the metabolites of patients in all 3 groups, statistically significant levels of the following were identified: leucine/isoleucine (p=0.010), lysine (p<0.001), tryptophan metabolites (kyneurines (p<0.001), ornithine (p<0.001)), phenylalanine (p<0.001), valine (p=0.022), long-chain acylcarnitine’s (C14, C14-OH, C16-1, C18) (<0.001), proline (p<0.001), glutamine (p<0.001), tyrosine (p<0.001), aspartate (p<0.001). We identified a statistical comparison in the "RA de novo" and "RA-bDMARDS" groups between metabolites: phenylalanine (p=0.018), valine (p=0.026), tryptophan metabolites – kyneurines (p=0.047), leucine/isoleucine (p=0.047), at this level of metabolites of the "RA-bDMARDS" group (tyrosine and tryptophan, ornithine, proline) was close to the group of healthy volunteers.
Conclusion. Metabolomics allows us to identify the metabolites most associated with a disease, particularly RA, which opens up new opportunities for improving diagnostic accuracy and personalizing treatment.
Keywords: rheumatoid arthritis, metabolomic profiling, metabolites, biomarkers.
For citation: Musaeva L.M., Menshikova I.V., Appolonova S.A., Shestakova K.M. Metabolomic changes in rheumatoid arthritis: focus on biological disease-modifying antirheumatic drugs. Clinical review for general practice. 2024; 5 (11): 62–69 (In Russ.). DOI: 10.47407/kr2024.5.11.00518
Благодаря достижениям в области анализа низкомолекулярных соединений в течение последнего десятилетия активно ведутся работы по оценке метаболомного профиля плазмы при различных заболеваниях, в том числе ревматических [9–12]. Учитывая, что при любом заболевании возникает дисбаланс циркулирующих аминокислот, что, в свою очередь, оказывает специфическое влияние на различные патофизиологические процессы и функции организма, их изучение представляется перспективным направлением для наилучшего понимания патогенеза конкретного заболевания, а также поиска новых эффективных биомаркеров и терапевтических мишеней.
В 1-ю группу были включены пациенты с преимущественно ранней стадией РА (n=14), не получающие базисную противоревматическую или ГИБП, во 2-ю группу были включены пациенты с РА, получающие ГИБП (n=15), а 3-ю группу – группу контроля – составили лица без ревматологических и сердечно-сосудистых заболеваний (n=16). Диагноз РА устанавливали в соответствии с клиническими рекомендациями Минздрава России (2021 г.) «Ревматоидный артрит» и классификационными критериями Американского колледжа ревматологов (2010 г.). Оценку активности заболевания у пациентов первых двух групп проводили при физиологическом осмотре пациента, принимая во внимание число болезненных, припухших суставов с последующей оценкой по индексу активности заболевания DAS28-СРБ. Рентгенологическую стадию определяли по Штейнброкеру [13], оценивали также класс функциональных нарушений. Пациентам на этапе стационарного обследования проводили оценку антропометрических показателей, общеклиническое обследование, оценку локального статуса, клинического анализа крови, стандартное биохимическое исследование, рентгенографическую оценку кистей и стоп.
Группы РА были сопоставимы по полу, возрасту и индексу массы тела (ИМТ). У всех участников исследования были взяты образцы крови из вены после ночного голодания в пробирки, содержащие дегидратдикалиевую соль этилендиаминтетрауксусной кислоты. Образцы крови центрифугировали при 2000 об/мин в течение 20 мин, и полученную плазму крови хранили при -80°C до проведения анализа. В лаборатории фармакокинетики и метаболомного анализа Института трансляционной медицины и биотехнологии Сеченовского Университета был проведен метаболомный анализ полученных образцов, количественный анализ выполняли с использованием смеси изотопно-меченных стандартов исследуемых соединений. Инструментальный анализ методом высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии проводили на жидкостном хроматографе Agilent 1200, соединенном с трехквадрупольным масс-спектрометром 6450C (Agilent Technologies, США). Хроматографическое разделение выполняли на колонке Discovery PFP HS F 52,1×150,3 мкм (Supelco Inc., США) с использованием предколонки Waters WAT084560 (Waters Inc., США).
Все пациенты подписали информированное добровольное согласие на участие в исследовании, протокол которого был одобрен локальным этическим комитетом Сеченовского Университета и соответствовал этическим принципам проведения медицинских исследований с участием людей, изложенным в Хельсинкской декларации.
Статистический анализ проводился с использованием программы StatTech v. 4.1.7 (разработчик – ООО «Статтех», Россия). Данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3) или числа и пропорций (%). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела–Уоллиса, апостериорные сравнения – с помощью критерия Данна с поправкой Холма. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Различия считались статистически значимыми при p<0,05.
1-я группа – 71,4% (n=10) женщин и 28,6% (n=4) мужчин; 2-я – 86,7% (n=13) и 13,3% (n=2); 3-я – 62,5% (n=10) и 37,5% (n=6) соответственно. Артериальная гипертензия (АГ) была диагностирована среди пациентов 1 и 2-й групп в 71,4% (n=10) и 73,3% (n=11) случаев соответственно; ишемическая болезнь сердца (ИБС) – у 35,7% (n=5) и 13,3% (n=2) первых двух групп соответственно и 6,2% (n=1) группы контроля; сахарный диабет 2-го типа (СД 2) – у 14,3% (n=2) и 14,3% (n=2) 1 и 2-й групп, в группе контроля пациенты не страдали СД 2 (p=0,284).
У пациентов имелись следующие факторы риска РА:
• курение: у 21,4% (n=3) – в 1-й группе, 13,3% (n=2) – 2-й, 12,5% (n=2) – группе контроля (p=0,764);
• ожирение: у 28,6% (n=4) – в группе РА de novo, 20,0% (n=3) – РА-ГИБП и 6,2% (n=1) – в группе контроля (p=0,270);
• заболевания пародонта: у 35,7% (n=5) – в 1-й группе, 33,3% (n=5) – 2-й;
• дислипидемия: у 78,6% (n=11) – в 1-й группе, 53,3% (n=8) – 2-й и 62,5% (n=10) – группе контроля (p=0,358).
Пациенты, страдающие АГ, в обеих группах принимали антигипертензивные препараты – 71,4% (n=10) и 60% (n=9) соответственно. В группе РА-ГИБП 33,3% (n=5) принимали анти-В-клеточную терапию (ритуксимаб), ингибиторы фактора некроза опухоли – ФНО: этанерцепт – 13,3% (n=2), адалимумаб – 40,0% (n=6), ингибиторы интерлейкина (ИЛ)-6: тоцилизумаб – 6,7% (n=1). В контрольной группе испытуемые не принимали никаких лекарственных препаратов. Пациенты групп РА de novo и РА-ГИБП были сопоставимы по активности заболевания DAS28 (p=0,760), рентгенологической стадии (p=0,081), функциональной недостаточности (p=0,143), уровню РФ (p=0,067), СОЭ (p=0,205), однако различались по уровню АЦЦП (p<0,001) и СРБ (p=0,016). Полная характеристика групп представлена в табл. 1.
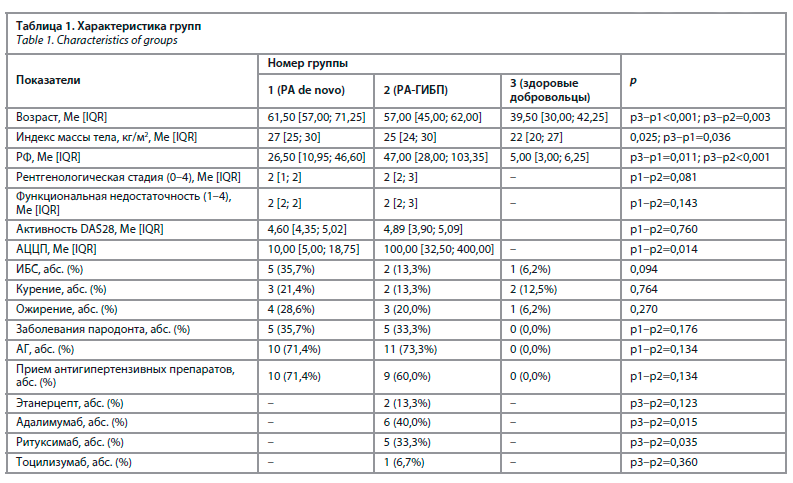
Проведена количественная оценка метаболитов во всех трех группах. При сравнении результатов значимых метаболитов в трех группах с поправкой на возраст было выявлено статистическое значимое различие уровней: лейцина/изолейцина (р=0,001), метаболитов триптофана (кинеуринов (р<0,001), орнитина (р<0,001), фенилаланина (р<0,001), валина (р=0,003), длинноцепочных ацилкарнитинов (С14, С14-ОН, С16-1, С18; р<0,001), пролина (р<0,001), глутамина (р<0,001), тирозина (р<0,001); табл. 2.
При этом было выявлено статистически значимое различие в группе РА de novo и РА-ГИБП между метаболитами: фенилаланин (р=0,018), валин (р=0,026), метаболитами триптофана – кинеурины (р=0,047), лейцин/изолейцин (р=0,047); рис. 1. Что важно, уровень метаболитов группы РА-ГИБП (тирозина и триптофана, орнитина, пролина) был близок к группе контроля.
 С помощью корреляционного анализа были исследованы взаимосвязи между концентрациями метаболитов и активностью РА по DAS28, рентгенологической стадией, функциональными нарушениями, показателями липидного профиля, уровнем СРБ, сопутствующими заболеваниями (АГ, СД 2, ИБС) и факторами риска РА. При сравнении групп больных РА была установлена обратная корреляционная связь активности (индекса DAS28) и АЦЦП с уровнем глутамина (р=0,005 и р=0,039 соответственно) и прямая корреляционная связь АЦЦП с уровнем пролина (р=0,02). У пациентов, негативных по РФ, уровень валина и фенилаланина был выше, чем у РФ-позитивных (р=0,017, р=0,041 соответственно).
С помощью корреляционного анализа были исследованы взаимосвязи между концентрациями метаболитов и активностью РА по DAS28, рентгенологической стадией, функциональными нарушениями, показателями липидного профиля, уровнем СРБ, сопутствующими заболеваниями (АГ, СД 2, ИБС) и факторами риска РА. При сравнении групп больных РА была установлена обратная корреляционная связь активности (индекса DAS28) и АЦЦП с уровнем глутамина (р=0,005 и р=0,039 соответственно) и прямая корреляционная связь АЦЦП с уровнем пролина (р=0,02). У пациентов, негативных по РФ, уровень валина и фенилаланина был выше, чем у РФ-позитивных (р=0,017, р=0,041 соответственно).
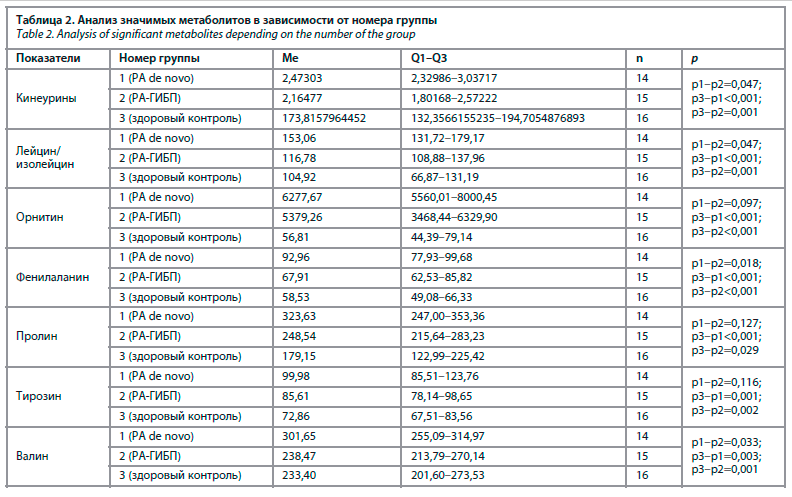
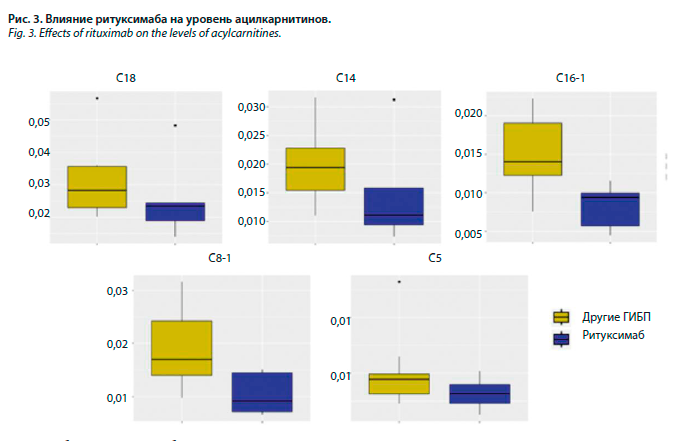
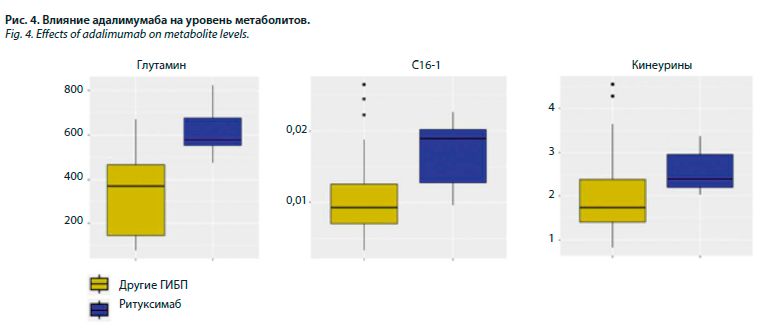
Проведена оценка влияния используемых препаратов на уровни метаболитов у больных 2-й группы: у пациентов, принимающих ритуксимаб, уровень глутамина (r=443, р=0,046) и пролина (r=229, р=0,037) статистически был ниже, выявлена также статистически незначимая тенденция к снижению уровня орнитина и фенилаланина (рис. 2). Уровень длинноцепочного ацилкарнитина С16-1 снизился на фоне приема ритуксимаба (r=0,00942, р=0,014), также была выявлена тенденция к снижению С14 и С18 ацилкарнитинов (рис. 3). Среднецепочный ацилкарнитин С8-1 и короткоцепочный ацилкарнитин С5 также статистически значимо снизились у пациентов, принимающих ритуксимаб (р=0,020 и р=0,049 соответственно). У пациентов, принимающих адалимумаб, уровень С16-1, глутамина и кинеуринов статистически значимо повысился (r=0,02955, р=0,024; r=609,02 р=0,034 и r=2,37, р=0,049 соответственно); рис. 4. При анализе группы РА-ГИБП не было выявлено статистически значимых изменений СРБ, РФ, АЦЦП, активности РА по DAS28 в зависимости от приема адалимумаба. Статистически значимых изменений метаболитов на фоне приема этанерцепта и тоцилизумаба выявлено не было.
По данным литературы, у больных РА было обнаружено повышенное содержание аминокислот, связанных с метаболизмом аргинина, включая цитруллин, орнитин и пролин, по сравнению со здоровыми людьми [23, 24]. В предыдущих исследованиях было показано, что метаболизм пролина тесно связан с РА [25], а его деградация сопряжена с энергетическим потреблением при длительном течении РА [26]. Было также обнаружено, что циркулирующие уровни орнитина повышены у пациентов со скелетно-мышечными болями [27]. Мы обнаружили, что уровень пролина у пациентов на фоне приема ГИБП был ниже, чем у пациентов, не применяющих противоревматическую терапию, а на фоне приема ритуксимаба уровень пролина статистически значимо был ниже, чем на фоне приема других ГИБП, хотя механизмы этих изменений остаются неизвестными. Орнитин образуется из аргинина и может метаболизироваться в цитруллин, коллаген или глутамат [28]. Было также обнаружено повышение уровня циркулирующего орнитина у пациентов со скелетно-мышечными болями, кроме того, орнитин важен для синтеза коллагена и заживления ран. РА может привести к деградации хряща и кости с хроническим дегенеративным состоянием. Таким образом, вполне вероятно, что повышенный уровень орнитина может быть частью компенсаторного или восстановительного механизма для костно-хрящевой ткани при РА. Глутамин, в свою очередь, приводит к высвобождению BCAA, глутамата, аспартата и аспарагина [29, 30]. У пациентов на фоне приема ритуксимаба уровень глутамина был статистически ниже, а уровень орнитина имел тенденцию к уровню здоровой когорты. Более того, концентрация глутамата в синовиальной жидкости увеличивается более чем в 50 раз у пациентов с РА [31], что, как было обнаружено, стимулирует экспрессию ФНО-α [32]. Орнитин, пролин, глутамин являются предшественниками глутамата, поэтому повышенные уровни этих аминокислот могут влиять на экспрессию ФНО-α посредством воздействия глутамата. В нашем исследовании уровни этих аминокислот были повышены у пациентов РА de novo и были ниже у пациентов РА-ГИБП.
Повышенные концентрации длинноцепочечных ацилкарнитинов отражают дисфункциональный метаболизм жирных кислот в митохондриях (недостаточное β-окисление) и, как следствие, способствуют воспалению [33]. Они повышают концентрации ФНО-α и ИЛ-17 в плазме и снижают концентрацию ИЛ-10-цитокина, подавляющего воспаление [34]. Аналогичным образом было показано, что вызванное лекарствами снижение доступности ацилкарнитинов снижает накопление макрофагов и моноцитов также снижает уровень циркулирующих воспалительных цитокинов [35]. Это, вероятно, связано с уменьшенным накоплением ацилкарнитинов в клетках. В совокупности эти результаты свидетельствуют о том, что ферменты и белки, участвующие в транспорте и производстве ацилкарнитинов, могут служить потенциальными лекарственными мишенями для ослабления воспалительных процессов при хронических заболеваниях. В нашем исследовании на фоне применения ГИБП было выявлено снижение длинноцепочечных ацилкарнитинов, таких как С14, С14-ОН, С16-1, С18, что свидетельствует об эффективности применяемой терапии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Мусаева Лариса Магомедовна – аспирантка каф. госпитальной терапии, врач-терапевт Университетской клинической больницы №1 Клинического центра ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет). E-mail: musaeva-93@mail.ru
Larisa M. Musaeva – Graduate Student, physician at University Clinical Hospital No.1, Sechenov First Moscow State Medical University (Sechenov University). E-mail: musaeva-93@mail.ru
Меньшикова Ирина Вадимовна – д-р мед. наук, проф. каф. госпитальной терапии №1, зав. ревматологическим отд-нием Университетской клинической больницы №1 Клинического центра ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Irina V. Menshikova – Dr. Sci. (Med.), Professor, department head at University Clinical Hospital No.1, Sechenov First Moscow State Medical University (Sechenov University)
Апполонова Светлана Александровна – канд. хим. наук, доц. каф. фармакологии, рук. Центра биофармацевтического анализа и метаболомных исследований ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Svetlana A. Appolonova – Cand. Sci. (Chem.), Associate Professor, Sechenov First Moscow State Medical University (Sechenov University)
Шестакова Ксения Михайловна – канд. фарм. наук, зав. лаб. биоинформатики и фармакологического моделирования ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Ksenya M. Shestakova – Cand. Sci. (Pharm.), head of the laboratory, Sechenov First Moscow State Medical University (Sechenov University)
Поступила в редакцию: 23.09.2024
Поступила после рецензирования: 30.09.2024
Принята к публикации: 03.10.2024
Received: 23.09.2024
Revised: 30.09.2024
Accepted: 03.10.2024Н
Клинический разбор в общей медицине №11 2024
Метаболомные изменения при ревматоидном артрите: фокус на генно-инженерную биологическую терапию
Номера страниц в выпуске:62-69
Аннотация
Актуальность. Ревматоидный артрит (РА) – это системное хроническое аутоиммунное заболевание, сопровождающееся эрозивно-деструктивным поражением суставов и ведущее к их анкилозированию, а также поражению других органов и систем. Основными целями лечения РА являются снижение выраженности болевого синдрома, замедление темпа прогрессирования заболевания и улучшение качества жизни пациентов. Несмотря на достижения в понимании РА, на сегодняшний день обнаружено мало клинически значимых биомаркеров для диагностики и контроля эффективности лекарственной терапии РА. Результаты научных исследований продемонстрировали, что в основе патогенеза РА лежат сложные биохимические реакции, в которых участвуют многочисленные метаболиты, возникающие в результате нарушений метаболических путей. Общий метаболизм РА не полностью изучен, и надежные метаболические маркеры для определения эффективности лечения на клеточно-молекулярном уровне в настоящее время отсутствуют. Метаболомика – это наука, которая изучает промежуточные и конечные продукты обмена веществ в организме на основании количественной оценки уровней и динамики различных метаболитов в биологических образцах (кровь, моча и синовиальная жидкость). Она может служить важным инструментом ранней диагностики РА, однако влияние лекарственной терапии на общий метаболизм до сих пор до конца не изучено.
Цель. Выявить изменения метаболомного профиля у пациентов с РА на фоне генно-инженерной биологической терапии.
Материалы и методы. Участники исследования были разделены на 3 группы: в группу пациентов с РА, не получающих противоревматическую терапию (РА de novo), были включены 14 человек, в группу пациентов, находящихся на генно-инженерной биологической терапии (РА-ГИБП), – 16 человек и в группу контроля (здоровые добровольцы) – 15 человек. Исследование метаболитов плазмы крови было проведено с помощью сверхэффективной жидкостной хроматографии в сочетании с тройным квадрупольным анализатором. Выполнен корреляционный анализ значимых метаболитов в трех группах больных с активностью заболевания по DAS28, уровнем С-реактивного белка и скорости оседания эритроцитов, наличием ревматоидного фактора и антител к циклическому цитруллинсодержащему пептиду.
Результаты. При сравнении метаболитов у больных во всех трех группах выявлено статистическое значимое различие уровней лейцина/изолейцина (р=0,010), метаболитов триптофана: кинеуринов (р<0,001), орнитина (р<0,001), фенилаланина (р<0,001), валина (р=0,022), длинноцепочных ацилкарнитинов С14, С14-ОН, С16-1, С18 (<0,001), – пролина (р<0,001), глутамина (р<0,001), тирозина (р<0,001). Нами было выявлено статистическое различие в группах РА de novo и РА-ГИБП между метаболитами: фенилаланин (р=0,018), валин (р=0,026), метаболитами триптофана – кинеурины (р=0,047), лейцин/изолейцин (р=0,047), при этом уровень метаболитов группы РА-ГИБП (тирозина и триптофана, орнитина, пролина) был близок к группе здоровых добровольцев.
Заключение. Метаболомика позволяет идентифицировать метаболиты, наиболее связанные с заболеванием, в частности с РА, что открывает новые возможности для повышения точности диагностики и персонификации терапии.
Ключевые слова: ревматоидный артрит, метаболомное профилирование, метаболиты, биомаркеры.
Для цитирования: Мусаева Л.М., Меньшикова И.В., Апполонова С.А., Шестакова К.М. Метаболомные изменения при ревматоидном артрите: фокус на генно-инженерную биологическую терапию. Клинический разбор в общей медицине. 2024; 5 (11): 62–69. DOI: 10.47407/ kr2024.5.11.00518
Актуальность. Ревматоидный артрит (РА) – это системное хроническое аутоиммунное заболевание, сопровождающееся эрозивно-деструктивным поражением суставов и ведущее к их анкилозированию, а также поражению других органов и систем. Основными целями лечения РА являются снижение выраженности болевого синдрома, замедление темпа прогрессирования заболевания и улучшение качества жизни пациентов. Несмотря на достижения в понимании РА, на сегодняшний день обнаружено мало клинически значимых биомаркеров для диагностики и контроля эффективности лекарственной терапии РА. Результаты научных исследований продемонстрировали, что в основе патогенеза РА лежат сложные биохимические реакции, в которых участвуют многочисленные метаболиты, возникающие в результате нарушений метаболических путей. Общий метаболизм РА не полностью изучен, и надежные метаболические маркеры для определения эффективности лечения на клеточно-молекулярном уровне в настоящее время отсутствуют. Метаболомика – это наука, которая изучает промежуточные и конечные продукты обмена веществ в организме на основании количественной оценки уровней и динамики различных метаболитов в биологических образцах (кровь, моча и синовиальная жидкость). Она может служить важным инструментом ранней диагностики РА, однако влияние лекарственной терапии на общий метаболизм до сих пор до конца не изучено.
Цель. Выявить изменения метаболомного профиля у пациентов с РА на фоне генно-инженерной биологической терапии.
Материалы и методы. Участники исследования были разделены на 3 группы: в группу пациентов с РА, не получающих противоревматическую терапию (РА de novo), были включены 14 человек, в группу пациентов, находящихся на генно-инженерной биологической терапии (РА-ГИБП), – 16 человек и в группу контроля (здоровые добровольцы) – 15 человек. Исследование метаболитов плазмы крови было проведено с помощью сверхэффективной жидкостной хроматографии в сочетании с тройным квадрупольным анализатором. Выполнен корреляционный анализ значимых метаболитов в трех группах больных с активностью заболевания по DAS28, уровнем С-реактивного белка и скорости оседания эритроцитов, наличием ревматоидного фактора и антител к циклическому цитруллинсодержащему пептиду.
Результаты. При сравнении метаболитов у больных во всех трех группах выявлено статистическое значимое различие уровней лейцина/изолейцина (р=0,010), метаболитов триптофана: кинеуринов (р<0,001), орнитина (р<0,001), фенилаланина (р<0,001), валина (р=0,022), длинноцепочных ацилкарнитинов С14, С14-ОН, С16-1, С18 (<0,001), – пролина (р<0,001), глутамина (р<0,001), тирозина (р<0,001). Нами было выявлено статистическое различие в группах РА de novo и РА-ГИБП между метаболитами: фенилаланин (р=0,018), валин (р=0,026), метаболитами триптофана – кинеурины (р=0,047), лейцин/изолейцин (р=0,047), при этом уровень метаболитов группы РА-ГИБП (тирозина и триптофана, орнитина, пролина) был близок к группе здоровых добровольцев.
Заключение. Метаболомика позволяет идентифицировать метаболиты, наиболее связанные с заболеванием, в частности с РА, что открывает новые возможности для повышения точности диагностики и персонификации терапии.
Ключевые слова: ревматоидный артрит, метаболомное профилирование, метаболиты, биомаркеры.
Для цитирования: Мусаева Л.М., Меньшикова И.В., Апполонова С.А., Шестакова К.М. Метаболомные изменения при ревматоидном артрите: фокус на генно-инженерную биологическую терапию. Клинический разбор в общей медицине. 2024; 5 (11): 62–69. DOI: 10.47407/ kr2024.5.11.00518
Metabolomic changes in rheumatoid arthritis: focus on biological disease-modifying antirheumatic drugs
Larisa M. Musaeva, Irina V. Menshikova, Svetlana A. Appolonova, Ksenya M. ShestakovaSechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
musaeva-93@mail.ru
Abstract
Background. Rheumatoid arthritis (RA) is a systemic chronic autoimmune disease characterized by erosive and destructive joint lesions leading to their ankylosis, as well as damage to other organs and systems. The main types of RA treatment are reducing the severity of pain, slowing the rate of disease progression and improving the quality of life of patients. Despite advances in the treatment of RA, few significant biomarkers have been identified to date for the diagnosis and effectiveness of drug therapy control in RA. The results of scientific studies have shown that the pathogenesis of RA is based on complex biochemical phenomena involving metabolites arising from a variety of metabolic pathways. The overall metabolism of RA has not been fully studied, and the reliability of metabolic markers for the effectiveness of treatment at the cellular and molecular level is currently lacking. Metabolomics is a science that studies intermediate and conical products of metabolism depending on the quantitative assessment of the levels and dynamics of various metabolites in biological samples (blood, mocha and synovial fluid). metabolism is still not fully understood.
Aim. To identify changes in the metabolomic profile in patients with RA during biologic disease-modifying anti-rheumatic drugs.
Material and methods. The study participants were divided into 3 groups: the group of patients with RA not receiving antirheumatic therapy "RA de novo" included 14 people, the group of patients undergoing genetic engineering biological therapy "RA-bDMARDS" – 16 people and the control group "healthy volunteers" – 15 people. The study of intestinal metabolites of blood was carried out using ultra-efficient liquid chromatography in conjunction with a triple quadrupole analyzer. A correlation analysis of significant metabolites was performed in three groups of patients with active disease according to DAS28, CRP and ESR levels, the presence of RF and ACPA.
Results. When examining the metabolites of patients in all 3 groups, statistically significant levels of the following were identified: leucine/isoleucine (p=0.010), lysine (p<0.001), tryptophan metabolites (kyneurines (p<0.001), ornithine (p<0.001)), phenylalanine (p<0.001), valine (p=0.022), long-chain acylcarnitine’s (C14, C14-OH, C16-1, C18) (<0.001), proline (p<0.001), glutamine (p<0.001), tyrosine (p<0.001), aspartate (p<0.001). We identified a statistical comparison in the "RA de novo" and "RA-bDMARDS" groups between metabolites: phenylalanine (p=0.018), valine (p=0.026), tryptophan metabolites – kyneurines (p=0.047), leucine/isoleucine (p=0.047), at this level of metabolites of the "RA-bDMARDS" group (tyrosine and tryptophan, ornithine, proline) was close to the group of healthy volunteers.
Conclusion. Metabolomics allows us to identify the metabolites most associated with a disease, particularly RA, which opens up new opportunities for improving diagnostic accuracy and personalizing treatment.
Keywords: rheumatoid arthritis, metabolomic profiling, metabolites, biomarkers.
For citation: Musaeva L.M., Menshikova I.V., Appolonova S.A., Shestakova K.M. Metabolomic changes in rheumatoid arthritis: focus on biological disease-modifying antirheumatic drugs. Clinical review for general practice. 2024; 5 (11): 62–69 (In Russ.). DOI: 10.47407/kr2024.5.11.00518
Введение
Ревматоидный артрит (РА) – это хроническое аутоиммунное инвалидизирующее заболевание, поражающие не только суставы, но и другие системы организма. Этиология заболевания является многофакторной, а распространенность его составляет 0,5–1% в промышленно развитых странах [1–3]. Основной целью лечения РА являются достижение и поддержание клинико-лабораторной ремиссии или низкой активности заболевания, предупреждение развития инвалидизации пациентов [4]. Внедрение в клиническую практику генно-инженерных биологических препаратов (ГИБП) произвело революцию в терапии пациентов с РА. ГИБП преимущественно являются антителами, нацеленными на конкретные воспалительные пути. Несмотря на успех применения ГИБП, значительная доля пациентов (примерно 30–40%) недостаточно реагируют на эти биологические препараты [5, 6]. Более того, на сегодняшний день нет достоверных биомаркеров, отражающих тяжесть заболевания и эффективность терапии, поэтому решения о выборе метода лечения в основном принимаются на основании клинической картины, вероятности развития специфических побочных эффектов, предпочтений пациентов и затрат на лекарственные препараты [7]. Диагностика РА усложняется у ряда пациентов, так как сывороточные биомаркеры, а именно скорость оседания эритроцитов (СОЭ) и уровень С-реактивного белка (СРБ), могут предоставлять информацию об активности заболевания, но зависят от возраста и пола, наличия атеросклероза и других изменений в организме [8], а ревматоидный фактор (РФ) и антитела к циклическому цитруллинсодержащему пептиду (АЦЦП) зачастую бывают негативными. Таким образом, идентификация новых диагностических биомаркеров для выбора метода лечения является актуальной.Благодаря достижениям в области анализа низкомолекулярных соединений в течение последнего десятилетия активно ведутся работы по оценке метаболомного профиля плазмы при различных заболеваниях, в том числе ревматических [9–12]. Учитывая, что при любом заболевании возникает дисбаланс циркулирующих аминокислот, что, в свою очередь, оказывает специфическое влияние на различные патофизиологические процессы и функции организма, их изучение представляется перспективным направлением для наилучшего понимания патогенеза конкретного заболевания, а также поиска новых эффективных биомаркеров и терапевтических мишеней.
Материалы и методы
В рамках исследования были обследованы 46 пациентов ревматологического отделения Университетской клинической больницы №1 Сеченовского Университета в период 2022–2023 годов.В 1-ю группу были включены пациенты с преимущественно ранней стадией РА (n=14), не получающие базисную противоревматическую или ГИБП, во 2-ю группу были включены пациенты с РА, получающие ГИБП (n=15), а 3-ю группу – группу контроля – составили лица без ревматологических и сердечно-сосудистых заболеваний (n=16). Диагноз РА устанавливали в соответствии с клиническими рекомендациями Минздрава России (2021 г.) «Ревматоидный артрит» и классификационными критериями Американского колледжа ревматологов (2010 г.). Оценку активности заболевания у пациентов первых двух групп проводили при физиологическом осмотре пациента, принимая во внимание число болезненных, припухших суставов с последующей оценкой по индексу активности заболевания DAS28-СРБ. Рентгенологическую стадию определяли по Штейнброкеру [13], оценивали также класс функциональных нарушений. Пациентам на этапе стационарного обследования проводили оценку антропометрических показателей, общеклиническое обследование, оценку локального статуса, клинического анализа крови, стандартное биохимическое исследование, рентгенографическую оценку кистей и стоп.
Группы РА были сопоставимы по полу, возрасту и индексу массы тела (ИМТ). У всех участников исследования были взяты образцы крови из вены после ночного голодания в пробирки, содержащие дегидратдикалиевую соль этилендиаминтетрауксусной кислоты. Образцы крови центрифугировали при 2000 об/мин в течение 20 мин, и полученную плазму крови хранили при -80°C до проведения анализа. В лаборатории фармакокинетики и метаболомного анализа Института трансляционной медицины и биотехнологии Сеченовского Университета был проведен метаболомный анализ полученных образцов, количественный анализ выполняли с использованием смеси изотопно-меченных стандартов исследуемых соединений. Инструментальный анализ методом высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии проводили на жидкостном хроматографе Agilent 1200, соединенном с трехквадрупольным масс-спектрометром 6450C (Agilent Technologies, США). Хроматографическое разделение выполняли на колонке Discovery PFP HS F 52,1×150,3 мкм (Supelco Inc., США) с использованием предколонки Waters WAT084560 (Waters Inc., США).
Все пациенты подписали информированное добровольное согласие на участие в исследовании, протокол которого был одобрен локальным этическим комитетом Сеченовского Университета и соответствовал этическим принципам проведения медицинских исследований с участием людей, изложенным в Хельсинкской декларации.
Статистический анализ проводился с использованием программы StatTech v. 4.1.7 (разработчик – ООО «Статтех», Россия). Данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3) или числа и пропорций (%). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела–Уоллиса, апостериорные сравнения – с помощью критерия Данна с поправкой Холма. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Различия считались статистически значимыми при p<0,05.
Результаты
Больные трех групп были сопоставимы по полу, однако пациенты основных групп были старше контрольной группы. Во всех группах преобладали женщины:1-я группа – 71,4% (n=10) женщин и 28,6% (n=4) мужчин; 2-я – 86,7% (n=13) и 13,3% (n=2); 3-я – 62,5% (n=10) и 37,5% (n=6) соответственно. Артериальная гипертензия (АГ) была диагностирована среди пациентов 1 и 2-й групп в 71,4% (n=10) и 73,3% (n=11) случаев соответственно; ишемическая болезнь сердца (ИБС) – у 35,7% (n=5) и 13,3% (n=2) первых двух групп соответственно и 6,2% (n=1) группы контроля; сахарный диабет 2-го типа (СД 2) – у 14,3% (n=2) и 14,3% (n=2) 1 и 2-й групп, в группе контроля пациенты не страдали СД 2 (p=0,284).
У пациентов имелись следующие факторы риска РА:
• курение: у 21,4% (n=3) – в 1-й группе, 13,3% (n=2) – 2-й, 12,5% (n=2) – группе контроля (p=0,764);
• ожирение: у 28,6% (n=4) – в группе РА de novo, 20,0% (n=3) – РА-ГИБП и 6,2% (n=1) – в группе контроля (p=0,270);
• заболевания пародонта: у 35,7% (n=5) – в 1-й группе, 33,3% (n=5) – 2-й;
• дислипидемия: у 78,6% (n=11) – в 1-й группе, 53,3% (n=8) – 2-й и 62,5% (n=10) – группе контроля (p=0,358).
Пациенты, страдающие АГ, в обеих группах принимали антигипертензивные препараты – 71,4% (n=10) и 60% (n=9) соответственно. В группе РА-ГИБП 33,3% (n=5) принимали анти-В-клеточную терапию (ритуксимаб), ингибиторы фактора некроза опухоли – ФНО: этанерцепт – 13,3% (n=2), адалимумаб – 40,0% (n=6), ингибиторы интерлейкина (ИЛ)-6: тоцилизумаб – 6,7% (n=1). В контрольной группе испытуемые не принимали никаких лекарственных препаратов. Пациенты групп РА de novo и РА-ГИБП были сопоставимы по активности заболевания DAS28 (p=0,760), рентгенологической стадии (p=0,081), функциональной недостаточности (p=0,143), уровню РФ (p=0,067), СОЭ (p=0,205), однако различались по уровню АЦЦП (p<0,001) и СРБ (p=0,016). Полная характеристика групп представлена в табл. 1.

Проведена количественная оценка метаболитов во всех трех группах. При сравнении результатов значимых метаболитов в трех группах с поправкой на возраст было выявлено статистическое значимое различие уровней: лейцина/изолейцина (р=0,001), метаболитов триптофана (кинеуринов (р<0,001), орнитина (р<0,001), фенилаланина (р<0,001), валина (р=0,003), длинноцепочных ацилкарнитинов (С14, С14-ОН, С16-1, С18; р<0,001), пролина (р<0,001), глутамина (р<0,001), тирозина (р<0,001); табл. 2.

При этом было выявлено статистически значимое различие в группе РА de novo и РА-ГИБП между метаболитами: фенилаланин (р=0,018), валин (р=0,026), метаболитами триптофана – кинеурины (р=0,047), лейцин/изолейцин (р=0,047); рис. 1. Что важно, уровень метаболитов группы РА-ГИБП (тирозина и триптофана, орнитина, пролина) был близок к группе контроля.

 С помощью корреляционного анализа были исследованы взаимосвязи между концентрациями метаболитов и активностью РА по DAS28, рентгенологической стадией, функциональными нарушениями, показателями липидного профиля, уровнем СРБ, сопутствующими заболеваниями (АГ, СД 2, ИБС) и факторами риска РА. При сравнении групп больных РА была установлена обратная корреляционная связь активности (индекса DAS28) и АЦЦП с уровнем глутамина (р=0,005 и р=0,039 соответственно) и прямая корреляционная связь АЦЦП с уровнем пролина (р=0,02). У пациентов, негативных по РФ, уровень валина и фенилаланина был выше, чем у РФ-позитивных (р=0,017, р=0,041 соответственно).
С помощью корреляционного анализа были исследованы взаимосвязи между концентрациями метаболитов и активностью РА по DAS28, рентгенологической стадией, функциональными нарушениями, показателями липидного профиля, уровнем СРБ, сопутствующими заболеваниями (АГ, СД 2, ИБС) и факторами риска РА. При сравнении групп больных РА была установлена обратная корреляционная связь активности (индекса DAS28) и АЦЦП с уровнем глутамина (р=0,005 и р=0,039 соответственно) и прямая корреляционная связь АЦЦП с уровнем пролина (р=0,02). У пациентов, негативных по РФ, уровень валина и фенилаланина был выше, чем у РФ-позитивных (р=0,017, р=0,041 соответственно).Проведена оценка влияния используемых препаратов на уровни метаболитов у больных 2-й группы: у пациентов, принимающих ритуксимаб, уровень глутамина (r=443, р=0,046) и пролина (r=229, р=0,037) статистически был ниже, выявлена также статистически незначимая тенденция к снижению уровня орнитина и фенилаланина (рис. 2). Уровень длинноцепочного ацилкарнитина С16-1 снизился на фоне приема ритуксимаба (r=0,00942, р=0,014), также была выявлена тенденция к снижению С14 и С18 ацилкарнитинов (рис. 3). Среднецепочный ацилкарнитин С8-1 и короткоцепочный ацилкарнитин С5 также статистически значимо снизились у пациентов, принимающих ритуксимаб (р=0,020 и р=0,049 соответственно). У пациентов, принимающих адалимумаб, уровень С16-1, глутамина и кинеуринов статистически значимо повысился (r=0,02955, р=0,024; r=609,02 р=0,034 и r=2,37, р=0,049 соответственно); рис. 4. При анализе группы РА-ГИБП не было выявлено статистически значимых изменений СРБ, РФ, АЦЦП, активности РА по DAS28 в зависимости от приема адалимумаба. Статистически значимых изменений метаболитов на фоне приема этанерцепта и тоцилизумаба выявлено не было.
Обсуждение
Большинство производимых внутриклеточных метаболитов участвует в регуляции биохимических реакций, которые составляют клеточную метаболическую сигнальную сеть, играющую роль в регуляции роста, дифференцировке и смерти клеток [15]. Многие состояния связаны с уменьшением/увеличением конкретных метаболитов, поскольку метаболиты являются продуктами клеточных систем и широко исследуются для установления связи между заболеванием и метаболическими профилями [16–20], и РА не является исключением. Повышенные уровни аминокислот с разветвленными боковыми цепями – BCAA (лейцина, изолейцина, валина) вызывают окислительный стресс и увеличение выработки активных форм кислорода (ROS) как через НАДФН-оксидазу, так и через митохондрии, а также активацию сигнальной системы Akt-mTOR, способствуя увеличению провоспалительных цитокинов, таких как ИЛ-6 и ФНО-α [21, 22]. У наших пациентов было выявлено статистически значимое снижение уровня ВСАА в группе РА-ГИБП при сравнении с РА de novo, кроме того, уровень ВСАА группы РА-ГИБП был сопоставим с группой здорового контроля, что может говорить об эффективности применяемой генно-инженерной терапии.
По данным литературы, у больных РА было обнаружено повышенное содержание аминокислот, связанных с метаболизмом аргинина, включая цитруллин, орнитин и пролин, по сравнению со здоровыми людьми [23, 24]. В предыдущих исследованиях было показано, что метаболизм пролина тесно связан с РА [25], а его деградация сопряжена с энергетическим потреблением при длительном течении РА [26]. Было также обнаружено, что циркулирующие уровни орнитина повышены у пациентов со скелетно-мышечными болями [27]. Мы обнаружили, что уровень пролина у пациентов на фоне приема ГИБП был ниже, чем у пациентов, не применяющих противоревматическую терапию, а на фоне приема ритуксимаба уровень пролина статистически значимо был ниже, чем на фоне приема других ГИБП, хотя механизмы этих изменений остаются неизвестными. Орнитин образуется из аргинина и может метаболизироваться в цитруллин, коллаген или глутамат [28]. Было также обнаружено повышение уровня циркулирующего орнитина у пациентов со скелетно-мышечными болями, кроме того, орнитин важен для синтеза коллагена и заживления ран. РА может привести к деградации хряща и кости с хроническим дегенеративным состоянием. Таким образом, вполне вероятно, что повышенный уровень орнитина может быть частью компенсаторного или восстановительного механизма для костно-хрящевой ткани при РА. Глутамин, в свою очередь, приводит к высвобождению BCAA, глутамата, аспартата и аспарагина [29, 30]. У пациентов на фоне приема ритуксимаба уровень глутамина был статистически ниже, а уровень орнитина имел тенденцию к уровню здоровой когорты. Более того, концентрация глутамата в синовиальной жидкости увеличивается более чем в 50 раз у пациентов с РА [31], что, как было обнаружено, стимулирует экспрессию ФНО-α [32]. Орнитин, пролин, глутамин являются предшественниками глутамата, поэтому повышенные уровни этих аминокислот могут влиять на экспрессию ФНО-α посредством воздействия глутамата. В нашем исследовании уровни этих аминокислот были повышены у пациентов РА de novo и были ниже у пациентов РА-ГИБП.

Повышенные концентрации длинноцепочечных ацилкарнитинов отражают дисфункциональный метаболизм жирных кислот в митохондриях (недостаточное β-окисление) и, как следствие, способствуют воспалению [33]. Они повышают концентрации ФНО-α и ИЛ-17 в плазме и снижают концентрацию ИЛ-10-цитокина, подавляющего воспаление [34]. Аналогичным образом было показано, что вызванное лекарствами снижение доступности ацилкарнитинов снижает накопление макрофагов и моноцитов также снижает уровень циркулирующих воспалительных цитокинов [35]. Это, вероятно, связано с уменьшенным накоплением ацилкарнитинов в клетках. В совокупности эти результаты свидетельствуют о том, что ферменты и белки, участвующие в транспорте и производстве ацилкарнитинов, могут служить потенциальными лекарственными мишенями для ослабления воспалительных процессов при хронических заболеваниях. В нашем исследовании на фоне применения ГИБП было выявлено снижение длинноцепочечных ацилкарнитинов, таких как С14, С14-ОН, С16-1, С18, что свидетельствует об эффективности применяемой терапии.
Заключение
РА – заболевание со сложным патогенезом. Активность РА, его прогрессирование и риск побочных эффектов зависят от многих факторов. Основной целью лечения РА является достижение низкой активности или клинической и лабораторной ремиссии. Для достижения данной цели одним из ключевых шагов является рациональный подбор противоревматической терапии. Для оценки эффективности терапии помимо традиционных шкал и лабораторных показателей необходимы новые ключевые маркеры эффективности терапии, которыми могут быть метаболиты или метаболические пути. Метаболомика открывает новые возможности для дальнейшего изучения патогенеза РА, поскольку позволяет идентифицировать метаболиты, наиболее связанные с заболеванием, поэтому наши данные могут являться первыми шагами для улучшения персонификации терапии.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Мусаева Лариса Магомедовна – аспирантка каф. госпитальной терапии, врач-терапевт Университетской клинической больницы №1 Клинического центра ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет). E-mail: musaeva-93@mail.ru
Larisa M. Musaeva – Graduate Student, physician at University Clinical Hospital No.1, Sechenov First Moscow State Medical University (Sechenov University). E-mail: musaeva-93@mail.ru
Меньшикова Ирина Вадимовна – д-р мед. наук, проф. каф. госпитальной терапии №1, зав. ревматологическим отд-нием Университетской клинической больницы №1 Клинического центра ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Irina V. Menshikova – Dr. Sci. (Med.), Professor, department head at University Clinical Hospital No.1, Sechenov First Moscow State Medical University (Sechenov University)
Апполонова Светлана Александровна – канд. хим. наук, доц. каф. фармакологии, рук. Центра биофармацевтического анализа и метаболомных исследований ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Svetlana A. Appolonova – Cand. Sci. (Chem.), Associate Professor, Sechenov First Moscow State Medical University (Sechenov University)
Шестакова Ксения Михайловна – канд. фарм. наук, зав. лаб. биоинформатики и фармакологического моделирования ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Ksenya M. Shestakova – Cand. Sci. (Pharm.), head of the laboratory, Sechenov First Moscow State Medical University (Sechenov University)
Поступила в редакцию: 23.09.2024
Поступила после рецензирования: 30.09.2024
Принята к публикации: 03.10.2024
Received: 23.09.2024
Revised: 30.09.2024
Accepted: 03.10.2024Н
Список исп. литературыСкрыть список1. Мазуров В.И. и др. Клиническая ревматология. Руководство для врачей. 2021.
Mazurov V.I. et al. Clinical Rheumatology. Guide for Physicians. 2021 (in Russian).
2. Wolfe AM, Kellgren JH, Masi AT. The epidemiology of rheumatoid arthritis: a review. II. Incidence and diagnostic criteria. Bull Rheum Dis 1968;19:524-9.
3. Silman AJ, Pearson JE. Epidemiology and genetics of rheumatoid arthritis. Arthritis Res 2002;4:S265-S272. DOI: 10.1186/ar578
4. Gabriel SE, Michaud K. Epidemiological studies in incidence, prevalence, mortality, and comorbidity of the rheumatic diseases. Arthritis Res Ther 2009;11:229. DOI: 10.1186/ar2669
5. Pashanova OV, Lopatina NB, Krivosheev SA, Baranova NY. Comparative Analysis of Approaches and Treatment Results of Patients with Early and Nonearly Rheumatoid Arthritis. Open Access Maced J Med Sci 2019;7(17):2802-6.
6. Keystone EC, Kavanaugh AF, Sharp JT et al. Radiographic, clinical, and functional outcomes of treatment with adalimumab (a human anti-tumor necrosis factor monoclonal antibody) in patients with active rheumatoid arthritis receiving concomitant methotrexate therapy: a randomized, placebo-controlled, 52-week trial. Arthritis Rheum 2004;50(5):1400-11.
7. Weinblatt ME, Kremer JM, Bankhurst AD et al. A trial of etanercept, a recombinant tumor necrosis factor receptor: Fc fusion protein, in patients with rheumatoid arthritis receiving methotrexate. N Engl J Med 1999;340(4):253-9.
8. Gavigan K, Nowell WB, Serna MS et al. Barriers to treatment optimization and achievement of patients’ goals: perspectives from people living with rheumatoid arthritis enrolled in the ArthritisPower registry. Arthritis Res Ther 2020;22(1):4.
9. Crowson CS, Rahman MU, Matteson EL. Which measure of inflammation to use? A comparison of erythrocyte sedimentation rate and C-reactive protein measurements from randomized clinical trials of golimumab in rheumatoid arthritis. J Rheumatol 2009;36(8):1606-10.
10. Беленков Ю.Н., Привалова Е.В., Кожевникова М.В. и др. Метаболомное профилирование больных с сердечно-сосудистыми заболеваниями. Кардиология. 2018;58(9):59-62.
Belenkov Yu.N., Privalova E.V., Kozhevnikova M.V. et al. Metabolomic Profiling of Patients With Cardiovascular Diseases. Kardiologiia. 2018;58(9):59-62 (in Russian).
11. Madsen R, Lundstedt T, Trygg J. Chemometrics in metabolomics—a review in human disease diagnosis. Anal Chim Acta 2010;659(1-2):23-33.
12. Leichtle AB, Nuoffer JM, Ceglarek U et al. Serum amino acid profiles and their alterations in colorectal cancer. Metabolomics 2012;8(4):643-53.
13. Semerano L, Roméo PH, Boissier MC. Metabolomics for rheumatic diseases: has the time come? Ann Rheum Dis 2015;74(7):1325-6.
14. Ревматоидный артрит. Клинические рекомендации. Утверждены Минздравом России. 2021.
Rheumatoid arthritis. Clinical guidelines. Approved by the Ministry of Health of Russia. 2021 (in Russian).
15. Yang XY, Zheng KD, Lin K et al. Energy Metabolism Disorder as a Contributing Factor of Rheumatoid Arthritis: A Comparative Proteomic and Metabolomic Study. PLoS One 2015;10(7):e0132695.
16. Wrzosek L et al. Microbiota tryptophan metabolism induces aryl hydrocarbon receptor activation and improves alcohol-induced liver injury. Gut 2021;70:1299-308.
17. Genchi A et al. Neural stem cell transplantation in patients with progressive multiple sclerosis: an open-label, phase 1 study. Nat Med 2023. DOI: 10.1038/s41591-022-02097-3
18. Gong Y et al. Metabolic-pathway-based subtyping of triple-negative breast cancer reveals potential therapeutic targets. Cell Metab 2021;33:51–64.e59.
19. Wrzosek L et al. Microbiota tryptophan metabolism induces aryl hydrocarbon receptor activation and improves alcohol-induced liver injury. Gut 2021;70:1299-308.
20. Ogawa T et al. Novel regulation of cardiac branched-chain amino acid metabolism through AMP deaminase: a possible therapeutic target for diabetic cardiomyopathy. Eur Heart J 2020;41:ehaa946.3619.
21. Zhenyukh O, Civantos E, Ruiz-Ortega M et al. High concentration of branched-chain amino acids promotes oxidative stress, inflammation and migration of human peripheral blood mononuclear cells via mTORC1 activation. Free Radic Biol Med 2017;104:
165-77.
22. Neishabouri SH, Hutson SM, Davoodi J. Chronic activation of mTOR complex 1 by branched chain amino acids and organ hypertrophy. Amino Acids 2015;47(6). DOI: 10.1007/s00726-015-1944-y. Epub 2015 Feb 27. PMID: 25721400.
23. Trang LE, Fürst P, Odebäck AC, Lövgren O. Plasma amino acids in rheumatoid arthritis. Scand J Rheumatol 1985;14(4):393-402.
24. Partsch G, Tausch G, Eberl R. Plasma amino acid level in rheumatoid arthritis and ankylosing spondylitis and its variation during age.
Z Rheumatol 1978;37(3-4):105-11.
25. He Z, Liu Z, Gong L. Biomarker identification and pathway analysis of rheumatoid arthritis based on metabolomics in combination with ingenuity pathway analysis. Proteomics 2021;21(11-12):e2100037.
26. Pandhare J, Donald SP, Cooper SK, Phang JM. Regulation and function of proline oxidase under nutrient stress. J Cell Biochem 2009;107(4):759-68.
27. Andonian BJ, Johannemann A, Hubal MJ et al. Altered skeletal muscle metabolic pathways, age, systemic inflammation, and low cardiorespiratory fitness associate with improvements in disease activity following high-intensity interval training in persons with rheumatoid arthritis. Arthritis Res Ther 2021;23(1):187.
28. Marini JC, Didelija IC, Castillo L, Lee B. Plasma arginine and ornithine are the main citrulline precursors in mice infused with arginine-free diets. J Nutr 2010;140(8):1432-7.
29. Curi R, Newsholme P, Procopio J et al. Glutamine, gene expression, and cell function. Front Biosci 2007;12:344-57.
30. Cruzat V, Macedo Rogero M, Noel Keane K et al. Glutamine: Metabolism and Immune Function, Supplementation and Clinical Translation. Nutrients 2018;10(11):1564.
31. McNearney T, Speegle D, Lawand N et al. Excitatory amino acid profiles of synovial fluid from patients with arthritis. J Rheumatol 2000;27(3):739-45.
32. McNearney T, Baethge BA, Cao S et al. Excitatory amino acids, TNF-alpha, and chemokine levels in synovial fluids of patients with active arthropathies. Clin Exp Immunol 2004;137(3):621-7.
33. Dambrova M, Makrecka-Kuka M, Kuka J et al. Acylcarnitines: Nomenclature, Biomarkers, Therapeutic Potential, Drug Targets, and Clinical Trials. Pharmacol Rev 2022;74(3):506-51.
34. McCoin CS, Gillingham MB, Knotts TA et al. Blood cytokine patterns suggest a modest inflammation phenotype in subjects with long-chain fatty acid oxidation disorders. Physiol Rep 2019;7(6):e14037.
35. Vilskersts R, Kuka J, Liepinsh E et al. Methyl-γ-butyrobetaine decreases levels of acylcarnitines and attenuates the development of atherosclerosis. Vascul Pharmacol 2015;72:101-7.
18 декабря 2024
Количество просмотров: 474


