Клинический разбор в общей медицине №11 2024
1 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 National Medical Research Center for Therapy and Preventive Medicine, Moscow, Russia;
3 City Clinical Hospital No. 52, Moscow, Russia
ela12@yandex.ru
Abstract
N-acetylcysteine (Fluimucil) is characterized by high antioxidant potential due to direct effect on both free radicals through inhibition of free radical reactions, including those related to the mechanisms underlying the iron-dependent cell death (ferroptosis), and the synthesis of the antioxidant molecules constituting the antioxidant protection system. The review is focused on the N-acetylcysteine involvement in the development of antioxidant protection and on the use of high doses of N-acetylcysteine in combination with thiamphenicol for treatment of bacterial infections.
Keywords: respiratory epithelium, inflammatory pulmonary diseases, bacterial infections, N-acetylcysteine.
For citation: Ponomareva L.A., Zubarev I.S., Berns S.A., Chinova A.A., Popova E.N. Modern respiratory epithelium protection mechanisms. Clinical review for general practice. 2024; 5 (11): 76–82 (In Russ.). DOI: 10.47407/kr2024.5.11.00520
Воспалительные заболевания органов дыхания остаются серьезной проблемой современного здравоохранения по причине сохраняющегося высокого риска жизнеугрожающих состояний и смертности [1].
Бронхиальная астма, хроническая обструктивная болезнь легких (ХОБЛ), а также различные варианты легочного фиброза, и прежде всего идиопатические интерстициальные пневмонии, не только оказывают значительное влияние на смертность, но требуют дополнительных медицинских затрат вследствие применения дорогостоящих методов диагностики и лечения [2, 3].
Контроль бронхиальной проходимости и разработка эффективных комбинаций бронхолитиков, позволяющих при относительно невысоких дозах лекарственного средства контролировать течение болезни и предупреждать обострения, являются основной современной терапевтической стратегией, направленной на подавление воспаления в стенке дыхательных путей (ДП) и, следовательно, поддержание функциональной активности и защиту клеток эпителия [4, 5].
Эпителиальный слой состоит из множества субпопуляций клеток, включая реснитчатые клетки, бокаловидные клетки, вырабатывающие слизь, базальные клетки, плотно прикрепленные к базальной мембране, субъединицы, обеспечивающие формирование плотных контактов и др. Базальная мембрана отделяет эпителиальный слой от следующего слоя, собственной пластинки, которая содержит иммуноактивные клетки и фибробласты, погруженные в смесь внеклеточного матрикса. C использованием трехмерных моделей (мультифлюидные модели, «органы на чипе»), воспроизводящих события in vivo, было показано, что при повреждении бронхиального эпителия возникает каскад межклеточных взаимодействий с участием поврежденной эпителиальной клетки, что сопровождается пролиферацией гладких мышц, изменением структуры элементов бронхиального дерева, экстрацеллюлярного матрикса, аналогично поражению легких при ХОБЛ или фиброзе легких [6, 7]. Интенсивность этих межклеточных реакций определяет клиническую тяжесть заболевания, выраженность и преобладающий фенотип в рамках той или иной нозологический формы. Например, при астме повреждение эпителия ДП сопровождается увеличением массы гладкой мускулатуры и повышенной выработкой цитокинов. При ХОБЛ метаплазия эпителия и пролиферация гладкомышечных клеток коррелируют с обструкцией ДП и необратимым снижением скоростных показателей воздушного потока, нарушением иммунного ответа и бактериальными осложнениями [8, 9]. При идиопатическом легочном фиброзе эпителий при взаимодействии с эндотелием, миофибробластами и гладкими мышцами участвует в образовании фибробластических очагов и избыточному накоплению эктсрацеллюлярного матрикса в зоне альвеолокапиллярной мембраны, нарушению транспорта кислорода и прогрессирующему снижению диффузионной способности легких [10, 11].
Процессы, происходящие в стареющем легком, во многом имеют признаки патологических изменений. При отсутствии явных заболеваний стареющее легкое имеет меньшую площадь альвеолярной поверхности, увеличивается размер альвеол и воздушного пространства [12]. У пожилого человека легкие постепенно теряют эластичность и становятся более жесткими, что определяется изменением экспрессии белков – ламина, эластина и фибронектина [13]. Утрата эластичности и растяжимости паренхимы, истончение альвеолярных перегородок и расширение альвеолярных ходов и ацинусов приводят к развитию старческой эмфиземы. Изменения диаметра бронхов, их ригидность из-за разрастания вокруг бронхов соединительной ткани ухудшают бронхиальную проходимость. В условиях возрастных изменений в организме уменьшение дыхательной поверхности легких на 40–45% способствует возникновению одышки и цианоза даже при незначительной физической нагрузке, снижается эффективность и нарушается равномерность легочной вентиляции. В старческом возрасте уменьшается скорость движения воздушного потока, повышается давление в малом круге кровообращения и, так же как при фиброзе легких, снижается площадь функционирующей альвеолярно-капиллярной поверхности [14].
Естественное старение легких характеризуется нарушением созревания и дифференцировки стволовых клеток, изменениями клеток воспаления и склероза в виде укорочения теломер, повышенной экспрессии маркеров клеточного старения: повреждения ДНК, активации свободнорадикальных и липидных реакций, активации различных типов клеточной смерти [15].
У пожилых людей респираторные и сердечно-сосудистые заболевания часто сосуществуют и отягощают течение друг друга. Крупные эпидемиологические исследования показали стойкую ассоциацию сердечно-сосудистых заболеваний как с ХОБЛ, бронхиальной астмой и легочным фиброзом, так и с острыми заболеваниями легких бактериальной и вирусной природы [16, 17].
Триггеры повреждения эпителия (вирусные и бактериальные инфекции, табачный дым, пыль во вдыхаемом воздухе, лекарственно-индуцированные реакции и др.) стимулируют выброс свободнорадикальных субстанций иммунокомпетентными клетками. При этом эпителиальные клетки также могут быть источниками свободных радикалов в процессе собственной гибели. Активация клеток воспаления запускает окислительный цикл, поддерживаемый высвобождением медиаторов воспаления и активацией протеаз [18]. Нейтрофилы и макрофаги высвобождают активные формы кислорода (АФК), лейкотриены, интерлейкины, сериновые протеазы, что приводит к разрушению волокон эластина, гиперсекреции и развитию эмфиземы.
В области роста колонии бактерий альвеолярные макрофаги в процессе межклеточных взаимодействий активируют нейтрофилы и другие иммунокомпетентные клетки, что усугубляет окислительный дисбаланс местно в очаге повреждения [19].
Из группы оппортунистических высоковирулентных внеклеточных грамотрицательных бактерий особое внимание уделяют Pseudomonas aeruginosa, так как возбудителя отличают как частота и интенсивность колонизации, так и резистентность к основным антибактериальным препаратам у пациентов с нозокомиальной пневмонией. P. aeruginosa входит в группу наиболее вирулентных и антибиотикорезистентных возбудителей, обозначенных аббревиатурой ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, P. aeruginosa и Enterobacter species). Бактерию отличает большой геном и в сравнении с другими возбудителями генетическая вариабельность, что позволяет ей расти в различных средах, продуцировать многообразные факторы вирулентности и проявлять устойчивость к большинству доступных в настоящее время антибиотиков [20]. Кроме того, P. Aeruginosa обладает 6 типами систем секреции для делегирования медиаторов повреждения в клетки мишени, транспортные системы выведения антибиотиков, содержит различные типы рецепторов для формирования межклеточных взаимодействий в процессе формирования биопленки [21]. Пребывая в различных состояниях – биопленки и планктонной форме – P. aeruginosa обладает уникальной способностью вызывать особый вид программированной гибели клеток-мишеней, опосредованный свободнорадикальными нарушениями с участием АФК, глутатионпероксидазы (ГП) и железосодержащих молекул, называемый ферроптозом.
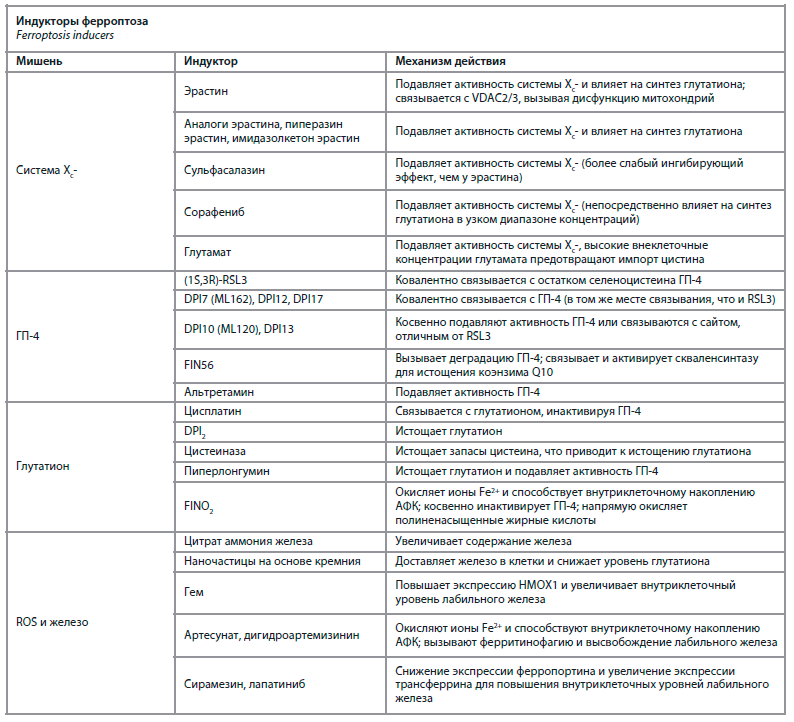
Ферроптоз – это новая форма гибели клеток, патофизиологически и морфологически отличающаяся от некроза и апоптоза, которая была впервые описана в 2012 г. Ферроптоз характеризуется избытком железозависимых АФК и перекисей липидов, что индуцирует окислительный стресс и приводит к гибели клетки. Особенность ферроптоза от других типов гибели клеток заключается в накоплении АФК, продуктов перекисного окисления липидов и, как результат, реакции Фентона с участием двухвалентного железа, которые затем индуцируют ферроптоз (см. таблицу). Активация ферроптоза происходит при ингибировании ГП-4, внутриклеточного фермента, предотвращающего перекисное окисление фосфолипидов. Катализаторами АФК также выступают 15-липоксигеназа, диоксигеназы полиненасыщенных жирных кислот в условиях, когда гидропероксид-фосфолипиды не могут быть инактивированы ГП-4. Помимо внутриклеточной индукции ферроптоза посредством ингибирования ГП-4 существует внеклеточный механизм, связанный с ингибированием системы Xc-, цистин/глутаматного транспортера, кодируемого геном SLC7A11, что ведет к уменьшению количества цистина в клетке и образования ГП-4. Морфологически ферроптоз характеризуется уменьшением объема митохондрий с конденсацией и уплотнением внутренних мембран, уменьшением и даже исчезновением митохондриальных крист, а также разрывами внешней митохондриальной мембраны, неповрежденной клеточной мембраной, интактным ядром и хроматином. На данный момент доказана роль ферроптоза в развитии различных патологических состояний, включая бронхолегочные заболевания [21]. При ферроптозе возникают дефицит ГП-4 и, соответственно, быстрое истощение депо глутатиона. Глутатион – это трипептид, состоящий из глутаминовой кислоты, цистеина и глицина.
Механизмы антиоксидантной защиты включают ферменты и неферментативные антиоксиданты, в том числе глутатион, альбумин, мочевую кислоту, витамины С и Е и другие низкомолекулярные органические молекулы [22–24]. Глутатион выполняет функции химического восстановления окислительных тиолов, стабилизирует мембраны клеток, поглощает свободные радикалы, поддерживает образование эндотелий-зависимых факторов вазодилатации . Истощение содержания глутатиона в ткани легких приводит к избыточному образованию активных форм кислорода, что поддерживает оксидативный стресс и негативно влияет на тяжесть клинических проявлений и темпы прогрессирования заболевания [24, 25].
Среди лекарственных средств, обладающих высоким антиоксидантным потенциалом, N-ацетилцистеин (NAC) известен достаточно давно. NAC изначально был представлен как муколитический препарат и широко использовался при хронических респираторных заболеваниях, связанных с избыточной продукцией мокроты. Однако механизм действия NAC выходит за рамки его муколитической активности и является сложным и многогранным. В отличие от других мукоактивных препаратов NAC проявляет антиоксидантную, противоинфекционную и противовоспалительную активность. Данные свойства вызвали интерес к его использованию для лечения хронических заболеваний легких, включая ХОБЛ, бронхоэктатическую болезнь, муковисцидоз и идиопатический легочный фиброз, которые связаны с окислительным стрессом, сниженным уровнем глутатиона и воспалением. Противовоспалительная активность NAC не является исключительно следствием его антиоксидантных свойств. При обострении ХОБЛ противовоспалительные эффекты наблюдались даже при назначении очень низких доз, особенно при длительном лечении. Механизм включает ингибирование активации NF-kB и продукции нейрокинина A, что снижает продукцию интерлейкина-6, цитокина, обильно присутствующего в мокроте и конденсате выдыхаемого воздуха пациентов с ХОБЛ и коррелирующего с количеством обострений. Уникальное сочетание муколитических, антиоксидантных, противоинфекционных и противовоспалительных свойств делает NAC безопасным, экономически выгодным и эффективным средством терапии респираторных заболеваний [26].
В 1980-х годах P. Moldéus и соавт. представили данные о протективном действии NAC против конденсатов сигаретного дыма и перекиси водорода (H2O2). Исследователи предположили, что антиоксидантный эффект NAC может быть обусловлен его функцией в качестве предшественника и усилителя биосинтеза глутатиона [27, 28]. Действительно, антиоксидантные свойства NAC неразрывно связаны с повышением содержания глутатиона, что приводит к снижению синтеза АФК [29]. Однако NAC также обладает способностью напрямую взаимодействовать с окислителями, такими как гидроксильный радикал, перекись водорода и гипохлорная кислота [30].
Антиоксидантные свойства NAC подтверждаются его защитным антиферроптотическим действием.
Как антиоксидант NAC подавляет ферроптоз, воздействуя на метаболизм цистеина. NAC также клинически показал улучшение симптомов, связанных с нейродегенерацией, за счет повышения уровня цистеина и облегчения синтеза γ-глутамилцистеина и глутатиона. Так как биодоступность NAC невысока, необходимо вводить его в довольно высоких дозах на протяжении длительного времени, что увеличивает риск побочных реакций. Для преодоления этих проблем был разработан амид NAC, модифицированная форма NAC с повышенной проницаемостью мембраны и биодоступностью (67% по сравнению с всего лишь 15% для NAC). На сегодняшний день была показана эффективность амида NAC в рамках доклинических испытаний [32].
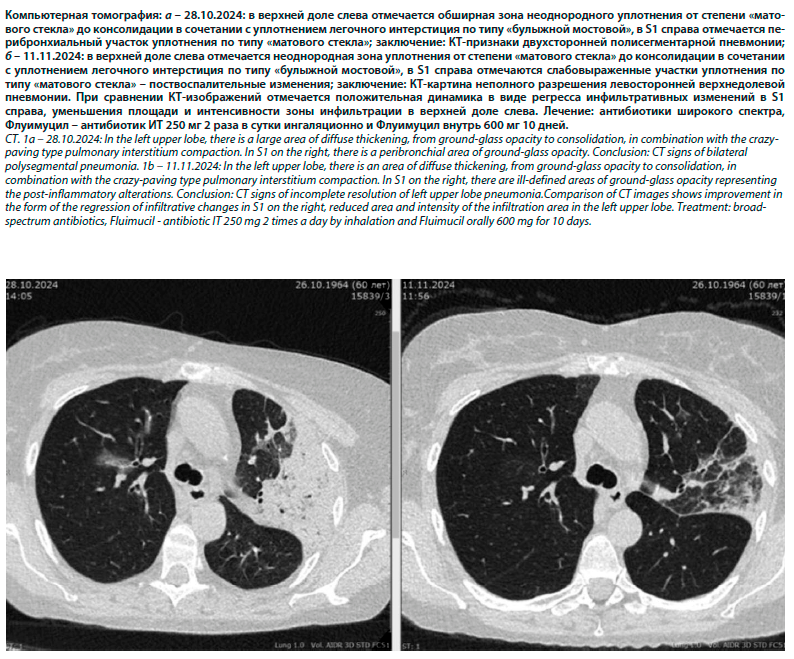
NAC обладает выраженными антибактериальными свойствами в том числе против высоковирулентных штаммов. При этом NAC может безопасно комбинироваться с антибиотиками при лечении пневмоний и других бактериальных инфекций (см. рисунок). При воздействии NAC на культуру P. aeruginosa количество жизнеспособных бактерий, связанных с биопленкой, снижалось по сравнению с контрольной группой [33]. Механизм антибактериального действия NAC связывают, с одной стороны, с тем, что он действует путем конкурентного ингибирования утилизации аминокислоты (цистеина), а с другой – за счет наличия сульфгидрильных групп взаимодействует с белками бактериальных клеток, что обеспечивает диспергирование биопленки. В то же время разрушение биопленок было пропорционально концентрации NAC. Полное разрушение биопленок наблюдалось при введении высоких доз препарата [33].
При вирусных инфекциях, в том числе при COVID-19, опыт использования NAC расширился в направлении введения пациентам с коронавирусной инфекцией, особенно находившихся в стационаре, высоких доз препарата даже в пероральной форме (600 мг каждые 8 ч), что благоприятно влияло в целом на выживаемость и тяжесть течения пневмоний, в том числе в группах пациентов с артериальной гипертензией, дислипидемией, сахарным диабетом и ХОБЛ. Даже при более высоком риске применение препарата при COVID-19 снижало смертность у коморбидных пациентов (отношение шансов 0,56; 95% доверительный интервал 0,47–0,67) [34].
Антибактериальный эффект NAC отдельно и в комбинации с антимикробными препаратами (амикацин, азтреонам, ципрофлоксацин и тобрамицин) продемонстрирован в исследовании адгезии на биопленках
P. aeruginosa и Achromobacter xylosoxidans [35, 36].
Высокой антибактериальной активностью обладает тиамфеникола глицинат ацетилцистеинат. Этот препарат объединяет в себе антибиотик широкого спектра действия (тиамфеникол) и муколитик (NAC).
Тиамфеникол – антибиотик из группы амфениколов – синтетическое производное хлорамфеникола. Тиамфеникол относится к синтетическим антибиотикам, нарушающим синтез белка в бактериальной клетке, и характеризуется широким спектром антибактериального действия. In vitro он продемонстрировал свою эффективность в отношении бактерий, наиболее часто вызывающих инфекции ДП.
По результатам микробиологических исследований установлено, что в отличие от антибиотиков, обычно используемых при лечении инфекционных заболеваний ДП, тиамфеникол активен в отношении штаммов, устойчивых к β-лактамным антибиотикам. Отмечена активность тиамфеникола против внутриклеточных микроорганизмов. Кроме того, чувствительность Streptococcus pneumoniae, Haemophilus influenzae, Chlamydophila pneumoniae (основных возбудителей респираторных инфекций) к тиамфениколу выше, чем к макролидам, тетрациклинам и ко-тримоксазолу [37, 38].
Наличие лекарственной формы тиамфеникола для местного применения и хорошая переносимость такой антибактериальной терапии позволяют рассматривать тиамфеникол в качестве альтернативного препарата в лечении бактериальных респираторных инфекций, в том числе вызванных пневмококками со сниженной чувствительностью к бензилпенициллину [39].
Важным преимуществом тиамфеникола в составе препарата Флуимуцил-Антибиотик ИТ является ингаляционный путь введения антибактериального препарата, предпочтительный при лечении многих респираторных заболеваний, когда действующее вещество доставляется непосредственно в ДП, создавая местно высокие концентрации при применении более низких доз, что позволяет свести к минимуму системные побочные эффекты, предотвратить реакции со стороны желудочно-кишечного тракта, а также минимизировать лекарственные взаимодействия. При ингаляции концентрация тиамфеникола в крови в течение 1 мин становится сопоставимой с его парентеральным применением. При этом максимальная концентрация препарата достигается уже через 15 мин от момента его поступления в организм [26]. Он оказывает бактериостатическое действие, ингибируя синтез белка бактериальной клетки путем воздействия на субъединицу 50S рибосомы, обладает широким спектром действия против грамположительных (S. pneumoniae, Corynebacterium diphtheriae, Staphylococcus spp., Streptococcus pyogenes, Listeria spp., Clostridium spp.) и грамотрицательных
(H. influenzae, Neisseria spp., Salmonella spp., Escherichia coli, Shigella spp., Bordetella pertussis, Yersinia pestis, Brucella spp., Bacteroides spp.), а также влияет на бактериальные штаммы, продуцирующие β-лактамазы. Следует отметить, что NAC и тиамфеникола глицинат ацетилцистеинат улучшают прогноз и снижают потребность в антибактериальных препаратах при инфекциях, вызванных C. pneumoniae, Mycoplasma pneumoniae, отличающихся наличием в жизненном цикле стадии персистирования в эпителии ДП, что делает возбудитель практически недоступным для антибиотиков широкого спектра [40, 41].
У стареющих пациентов NAC как в виде монотерапии, так и в комбинации с антибиотиком позволяет эффективно поддерживать протеостаз, посредством которого клетки взаимодействуют с белками, включая синтез, сворачивание, транспортировку, посттрансляционную модификацию и деградацию. В процессе старения происходит снижение протеостаза, поскольку с возрастом ухудшается контроль качества белка даже при отсутствии основного заболевания. Старение резидентных и системных иммунных клеток приводит к возникновению провоспалительной среды и снижению способности бороться с инфекционными заболеваниями [42]. Оценка терапевтической эффективности NAC по влиянию на окислительный стресс показана в группах коморбидных больных с нарушенной толерантностью к глюкозе, метаболическим синдромом. NAC усиливает активность фосфоинозитид-3-киназы, что корректирует гликемический профиль.
Таким образом, NAC остается ведущим по клинической эффективности из других широко используемых антиоксидантов. Его эффективность подтверждена у пациентов с различными типами воспалительных заболеваний легких (хронический бронхит, бронхиальная астма, заболевания легких с прогрессирующим фиброзирующим фенотипом), а также при респираторных инфекциях, коморбидных состояниях, определяющих высокий риск осложнений. Применение NAC в режиме высоких доз снижало частоту обострений при хронической обструктивной болезни и улучшало прогноз при тяжелом течении коронавирусной инфекции. NAC в виде монотерапии и в сочетании с тиамфеникола глицинат ацетилцистеинатом восполняет депо глутатиона, обеспечивая доставку L-цистеина в клетки и снижая интенсивность оксидативных реакций. NAC обладает многочисленными цитопротективными эффектами, ингибирует различные реакции повреждения клеток, затрагивающие системы антиоксидантной резистентности, что поддерживает целостность бронхиального эпителия, секреторную и дренажную функцию бронхиального дерева и тем самым улучшает прогноз при респираторных заболеваниях. Применение комбинированной терапии, включающей NAC и антибиотик, приводит к заметному сокращению сроков персистирования биопленок, сформированных с участием антибиотикорезистентных возбудителей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Пономарева Любовь Андреевна – ассистент каф. факультетской терапии №2, врач-кардиолог, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Lubov A. Ponomareva – Assistant, Sechenov First Moscow State Medical University (Sechenov University)
Зубарев Игорь Сергеевич – врач-рентгенолог отд-ния лучевой диагностики Университетской клинической больницы №3 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Igor S. Zubarev – radiologist, Sechenov First Moscow State Medical University (Sechenov University)
Бернс Светлана Александровна – д-р мед. наук, проф., рук. отд. изучения патогенетических аспектов старения ФГБУ НМИЦ ТПМ
Svetlana A. Berns – Dr. Sci. (Med.), Professor, National Medical Research Center for Therapy and Preventive Medicine
Чинова Алина Александровна – врач-терапевт ГБУЗ ГКБ №52
Alina A. Chinova – physician, City Clinical Hospital No. 52
Попова Елена Николаевна – проф. каф. внутренних, профессиональных болезней и ревматологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – Professor, Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Поступила в редакцию: 11.11.2024
Поступила после рецензирования: 19.11.2024
Принята к публикации: 21.11.2024
Received: 11.11.2024
Revised: 19.11.2024
Accepted: 21.11.2024
Клинический разбор в общей медицине №11 2024
Современные механизмы защиты эпителия дыхательных путей
Номера страниц в выпуске:76-82
Аннотация
N-ацетилцистеин (Флуимуцил) отличается высоким антиоксидантным потенциалом как за счет прямого влияния на свободные радикалы, ингибируя свободнорадикальные реакции, в том числе связанные с механизмами железозависимой клеточной смерти (ферро-птоз), так и на процессы синтеза антиоксидантных молекул, формирующих систему антиоксидантной защиты. В обзоре особое внимание уделено участию N-ацетилцистеина в формировании антиоксидантной защиты и использованию его в режиме высоких доз в комбинации с тиамфениколом в лечении бактериальных инфекций.
Ключевые слова: эпителий дыхательных путей, воспалительные заболевания легких, бактериальные инфекции, N-ацетилцистеин.
Для цитирования: Пономарева Л.А., Зубарев И.С., Бернс С.А., Чинова А.А., Попова Е.Н. Современные механизмы защиты эпителия дыхательных путей. Клинический разбор в общей медицине. 2024; 5 (11): 76–82. DOI: 10.47407/kr2024.5.11.00520
N-ацетилцистеин (Флуимуцил) отличается высоким антиоксидантным потенциалом как за счет прямого влияния на свободные радикалы, ингибируя свободнорадикальные реакции, в том числе связанные с механизмами железозависимой клеточной смерти (ферро-птоз), так и на процессы синтеза антиоксидантных молекул, формирующих систему антиоксидантной защиты. В обзоре особое внимание уделено участию N-ацетилцистеина в формировании антиоксидантной защиты и использованию его в режиме высоких доз в комбинации с тиамфениколом в лечении бактериальных инфекций.
Ключевые слова: эпителий дыхательных путей, воспалительные заболевания легких, бактериальные инфекции, N-ацетилцистеин.
Для цитирования: Пономарева Л.А., Зубарев И.С., Бернс С.А., Чинова А.А., Попова Е.Н. Современные механизмы защиты эпителия дыхательных путей. Клинический разбор в общей медицине. 2024; 5 (11): 76–82. DOI: 10.47407/kr2024.5.11.00520
Modern respiratory epithelium protection mechanisms
Lubov A. Ponomareva1, Igor S. Zubarev2, Svetlana A. Berns2, Alina A. Chinova3, Elena N. Popova11 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 National Medical Research Center for Therapy and Preventive Medicine, Moscow, Russia;
3 City Clinical Hospital No. 52, Moscow, Russia
ela12@yandex.ru
Abstract
N-acetylcysteine (Fluimucil) is characterized by high antioxidant potential due to direct effect on both free radicals through inhibition of free radical reactions, including those related to the mechanisms underlying the iron-dependent cell death (ferroptosis), and the synthesis of the antioxidant molecules constituting the antioxidant protection system. The review is focused on the N-acetylcysteine involvement in the development of antioxidant protection and on the use of high doses of N-acetylcysteine in combination with thiamphenicol for treatment of bacterial infections.
Keywords: respiratory epithelium, inflammatory pulmonary diseases, bacterial infections, N-acetylcysteine.
For citation: Ponomareva L.A., Zubarev I.S., Berns S.A., Chinova A.A., Popova E.N. Modern respiratory epithelium protection mechanisms. Clinical review for general practice. 2024; 5 (11): 76–82 (In Russ.). DOI: 10.47407/kr2024.5.11.00520
Воспалительные заболевания органов дыхания остаются серьезной проблемой современного здравоохранения по причине сохраняющегося высокого риска жизнеугрожающих состояний и смертности [1].
Бронхиальная астма, хроническая обструктивная болезнь легких (ХОБЛ), а также различные варианты легочного фиброза, и прежде всего идиопатические интерстициальные пневмонии, не только оказывают значительное влияние на смертность, но требуют дополнительных медицинских затрат вследствие применения дорогостоящих методов диагностики и лечения [2, 3].
Контроль бронхиальной проходимости и разработка эффективных комбинаций бронхолитиков, позволяющих при относительно невысоких дозах лекарственного средства контролировать течение болезни и предупреждать обострения, являются основной современной терапевтической стратегией, направленной на подавление воспаления в стенке дыхательных путей (ДП) и, следовательно, поддержание функциональной активности и защиту клеток эпителия [4, 5].
Эпителиальный слой состоит из множества субпопуляций клеток, включая реснитчатые клетки, бокаловидные клетки, вырабатывающие слизь, базальные клетки, плотно прикрепленные к базальной мембране, субъединицы, обеспечивающие формирование плотных контактов и др. Базальная мембрана отделяет эпителиальный слой от следующего слоя, собственной пластинки, которая содержит иммуноактивные клетки и фибробласты, погруженные в смесь внеклеточного матрикса. C использованием трехмерных моделей (мультифлюидные модели, «органы на чипе»), воспроизводящих события in vivo, было показано, что при повреждении бронхиального эпителия возникает каскад межклеточных взаимодействий с участием поврежденной эпителиальной клетки, что сопровождается пролиферацией гладких мышц, изменением структуры элементов бронхиального дерева, экстрацеллюлярного матрикса, аналогично поражению легких при ХОБЛ или фиброзе легких [6, 7]. Интенсивность этих межклеточных реакций определяет клиническую тяжесть заболевания, выраженность и преобладающий фенотип в рамках той или иной нозологический формы. Например, при астме повреждение эпителия ДП сопровождается увеличением массы гладкой мускулатуры и повышенной выработкой цитокинов. При ХОБЛ метаплазия эпителия и пролиферация гладкомышечных клеток коррелируют с обструкцией ДП и необратимым снижением скоростных показателей воздушного потока, нарушением иммунного ответа и бактериальными осложнениями [8, 9]. При идиопатическом легочном фиброзе эпителий при взаимодействии с эндотелием, миофибробластами и гладкими мышцами участвует в образовании фибробластических очагов и избыточному накоплению эктсрацеллюлярного матрикса в зоне альвеолокапиллярной мембраны, нарушению транспорта кислорода и прогрессирующему снижению диффузионной способности легких [10, 11].
Процессы, происходящие в стареющем легком, во многом имеют признаки патологических изменений. При отсутствии явных заболеваний стареющее легкое имеет меньшую площадь альвеолярной поверхности, увеличивается размер альвеол и воздушного пространства [12]. У пожилого человека легкие постепенно теряют эластичность и становятся более жесткими, что определяется изменением экспрессии белков – ламина, эластина и фибронектина [13]. Утрата эластичности и растяжимости паренхимы, истончение альвеолярных перегородок и расширение альвеолярных ходов и ацинусов приводят к развитию старческой эмфиземы. Изменения диаметра бронхов, их ригидность из-за разрастания вокруг бронхов соединительной ткани ухудшают бронхиальную проходимость. В условиях возрастных изменений в организме уменьшение дыхательной поверхности легких на 40–45% способствует возникновению одышки и цианоза даже при незначительной физической нагрузке, снижается эффективность и нарушается равномерность легочной вентиляции. В старческом возрасте уменьшается скорость движения воздушного потока, повышается давление в малом круге кровообращения и, так же как при фиброзе легких, снижается площадь функционирующей альвеолярно-капиллярной поверхности [14].
Естественное старение легких характеризуется нарушением созревания и дифференцировки стволовых клеток, изменениями клеток воспаления и склероза в виде укорочения теломер, повышенной экспрессии маркеров клеточного старения: повреждения ДНК, активации свободнорадикальных и липидных реакций, активации различных типов клеточной смерти [15].
У пожилых людей респираторные и сердечно-сосудистые заболевания часто сосуществуют и отягощают течение друг друга. Крупные эпидемиологические исследования показали стойкую ассоциацию сердечно-сосудистых заболеваний как с ХОБЛ, бронхиальной астмой и легочным фиброзом, так и с острыми заболеваниями легких бактериальной и вирусной природы [16, 17].
Триггеры повреждения эпителия (вирусные и бактериальные инфекции, табачный дым, пыль во вдыхаемом воздухе, лекарственно-индуцированные реакции и др.) стимулируют выброс свободнорадикальных субстанций иммунокомпетентными клетками. При этом эпителиальные клетки также могут быть источниками свободных радикалов в процессе собственной гибели. Активация клеток воспаления запускает окислительный цикл, поддерживаемый высвобождением медиаторов воспаления и активацией протеаз [18]. Нейтрофилы и макрофаги высвобождают активные формы кислорода (АФК), лейкотриены, интерлейкины, сериновые протеазы, что приводит к разрушению волокон эластина, гиперсекреции и развитию эмфиземы.
В области роста колонии бактерий альвеолярные макрофаги в процессе межклеточных взаимодействий активируют нейтрофилы и другие иммунокомпетентные клетки, что усугубляет окислительный дисбаланс местно в очаге повреждения [19].
Из группы оппортунистических высоковирулентных внеклеточных грамотрицательных бактерий особое внимание уделяют Pseudomonas aeruginosa, так как возбудителя отличают как частота и интенсивность колонизации, так и резистентность к основным антибактериальным препаратам у пациентов с нозокомиальной пневмонией. P. aeruginosa входит в группу наиболее вирулентных и антибиотикорезистентных возбудителей, обозначенных аббревиатурой ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, P. aeruginosa и Enterobacter species). Бактерию отличает большой геном и в сравнении с другими возбудителями генетическая вариабельность, что позволяет ей расти в различных средах, продуцировать многообразные факторы вирулентности и проявлять устойчивость к большинству доступных в настоящее время антибиотиков [20]. Кроме того, P. Aeruginosa обладает 6 типами систем секреции для делегирования медиаторов повреждения в клетки мишени, транспортные системы выведения антибиотиков, содержит различные типы рецепторов для формирования межклеточных взаимодействий в процессе формирования биопленки [21]. Пребывая в различных состояниях – биопленки и планктонной форме – P. aeruginosa обладает уникальной способностью вызывать особый вид программированной гибели клеток-мишеней, опосредованный свободнорадикальными нарушениями с участием АФК, глутатионпероксидазы (ГП) и железосодержащих молекул, называемый ферроптозом.

Ферроптоз – это новая форма гибели клеток, патофизиологически и морфологически отличающаяся от некроза и апоптоза, которая была впервые описана в 2012 г. Ферроптоз характеризуется избытком железозависимых АФК и перекисей липидов, что индуцирует окислительный стресс и приводит к гибели клетки. Особенность ферроптоза от других типов гибели клеток заключается в накоплении АФК, продуктов перекисного окисления липидов и, как результат, реакции Фентона с участием двухвалентного железа, которые затем индуцируют ферроптоз (см. таблицу). Активация ферроптоза происходит при ингибировании ГП-4, внутриклеточного фермента, предотвращающего перекисное окисление фосфолипидов. Катализаторами АФК также выступают 15-липоксигеназа, диоксигеназы полиненасыщенных жирных кислот в условиях, когда гидропероксид-фосфолипиды не могут быть инактивированы ГП-4. Помимо внутриклеточной индукции ферроптоза посредством ингибирования ГП-4 существует внеклеточный механизм, связанный с ингибированием системы Xc-, цистин/глутаматного транспортера, кодируемого геном SLC7A11, что ведет к уменьшению количества цистина в клетке и образования ГП-4. Морфологически ферроптоз характеризуется уменьшением объема митохондрий с конденсацией и уплотнением внутренних мембран, уменьшением и даже исчезновением митохондриальных крист, а также разрывами внешней митохондриальной мембраны, неповрежденной клеточной мембраной, интактным ядром и хроматином. На данный момент доказана роль ферроптоза в развитии различных патологических состояний, включая бронхолегочные заболевания [21]. При ферроптозе возникают дефицит ГП-4 и, соответственно, быстрое истощение депо глутатиона. Глутатион – это трипептид, состоящий из глутаминовой кислоты, цистеина и глицина.
Механизмы антиоксидантной защиты включают ферменты и неферментативные антиоксиданты, в том числе глутатион, альбумин, мочевую кислоту, витамины С и Е и другие низкомолекулярные органические молекулы [22–24]. Глутатион выполняет функции химического восстановления окислительных тиолов, стабилизирует мембраны клеток, поглощает свободные радикалы, поддерживает образование эндотелий-зависимых факторов вазодилатации . Истощение содержания глутатиона в ткани легких приводит к избыточному образованию активных форм кислорода, что поддерживает оксидативный стресс и негативно влияет на тяжесть клинических проявлений и темпы прогрессирования заболевания [24, 25].

Среди лекарственных средств, обладающих высоким антиоксидантным потенциалом, N-ацетилцистеин (NAC) известен достаточно давно. NAC изначально был представлен как муколитический препарат и широко использовался при хронических респираторных заболеваниях, связанных с избыточной продукцией мокроты. Однако механизм действия NAC выходит за рамки его муколитической активности и является сложным и многогранным. В отличие от других мукоактивных препаратов NAC проявляет антиоксидантную, противоинфекционную и противовоспалительную активность. Данные свойства вызвали интерес к его использованию для лечения хронических заболеваний легких, включая ХОБЛ, бронхоэктатическую болезнь, муковисцидоз и идиопатический легочный фиброз, которые связаны с окислительным стрессом, сниженным уровнем глутатиона и воспалением. Противовоспалительная активность NAC не является исключительно следствием его антиоксидантных свойств. При обострении ХОБЛ противовоспалительные эффекты наблюдались даже при назначении очень низких доз, особенно при длительном лечении. Механизм включает ингибирование активации NF-kB и продукции нейрокинина A, что снижает продукцию интерлейкина-6, цитокина, обильно присутствующего в мокроте и конденсате выдыхаемого воздуха пациентов с ХОБЛ и коррелирующего с количеством обострений. Уникальное сочетание муколитических, антиоксидантных, противоинфекционных и противовоспалительных свойств делает NAC безопасным, экономически выгодным и эффективным средством терапии респираторных заболеваний [26].
В 1980-х годах P. Moldéus и соавт. представили данные о протективном действии NAC против конденсатов сигаретного дыма и перекиси водорода (H2O2). Исследователи предположили, что антиоксидантный эффект NAC может быть обусловлен его функцией в качестве предшественника и усилителя биосинтеза глутатиона [27, 28]. Действительно, антиоксидантные свойства NAC неразрывно связаны с повышением содержания глутатиона, что приводит к снижению синтеза АФК [29]. Однако NAC также обладает способностью напрямую взаимодействовать с окислителями, такими как гидроксильный радикал, перекись водорода и гипохлорная кислота [30].
Антиоксидантные свойства NAC подтверждаются его защитным антиферроптотическим действием.
Как антиоксидант NAC подавляет ферроптоз, воздействуя на метаболизм цистеина. NAC также клинически показал улучшение симптомов, связанных с нейродегенерацией, за счет повышения уровня цистеина и облегчения синтеза γ-глутамилцистеина и глутатиона. Так как биодоступность NAC невысока, необходимо вводить его в довольно высоких дозах на протяжении длительного времени, что увеличивает риск побочных реакций. Для преодоления этих проблем был разработан амид NAC, модифицированная форма NAC с повышенной проницаемостью мембраны и биодоступностью (67% по сравнению с всего лишь 15% для NAC). На сегодняшний день была показана эффективность амида NAC в рамках доклинических испытаний [32].
NAC обладает выраженными антибактериальными свойствами в том числе против высоковирулентных штаммов. При этом NAC может безопасно комбинироваться с антибиотиками при лечении пневмоний и других бактериальных инфекций (см. рисунок). При воздействии NAC на культуру P. aeruginosa количество жизнеспособных бактерий, связанных с биопленкой, снижалось по сравнению с контрольной группой [33]. Механизм антибактериального действия NAC связывают, с одной стороны, с тем, что он действует путем конкурентного ингибирования утилизации аминокислоты (цистеина), а с другой – за счет наличия сульфгидрильных групп взаимодействует с белками бактериальных клеток, что обеспечивает диспергирование биопленки. В то же время разрушение биопленок было пропорционально концентрации NAC. Полное разрушение биопленок наблюдалось при введении высоких доз препарата [33].
При вирусных инфекциях, в том числе при COVID-19, опыт использования NAC расширился в направлении введения пациентам с коронавирусной инфекцией, особенно находившихся в стационаре, высоких доз препарата даже в пероральной форме (600 мг каждые 8 ч), что благоприятно влияло в целом на выживаемость и тяжесть течения пневмоний, в том числе в группах пациентов с артериальной гипертензией, дислипидемией, сахарным диабетом и ХОБЛ. Даже при более высоком риске применение препарата при COVID-19 снижало смертность у коморбидных пациентов (отношение шансов 0,56; 95% доверительный интервал 0,47–0,67) [34].
Антибактериальный эффект NAC отдельно и в комбинации с антимикробными препаратами (амикацин, азтреонам, ципрофлоксацин и тобрамицин) продемонстрирован в исследовании адгезии на биопленках
P. aeruginosa и Achromobacter xylosoxidans [35, 36].
Высокой антибактериальной активностью обладает тиамфеникола глицинат ацетилцистеинат. Этот препарат объединяет в себе антибиотик широкого спектра действия (тиамфеникол) и муколитик (NAC).
Тиамфеникол – антибиотик из группы амфениколов – синтетическое производное хлорамфеникола. Тиамфеникол относится к синтетическим антибиотикам, нарушающим синтез белка в бактериальной клетке, и характеризуется широким спектром антибактериального действия. In vitro он продемонстрировал свою эффективность в отношении бактерий, наиболее часто вызывающих инфекции ДП.
По результатам микробиологических исследований установлено, что в отличие от антибиотиков, обычно используемых при лечении инфекционных заболеваний ДП, тиамфеникол активен в отношении штаммов, устойчивых к β-лактамным антибиотикам. Отмечена активность тиамфеникола против внутриклеточных микроорганизмов. Кроме того, чувствительность Streptococcus pneumoniae, Haemophilus influenzae, Chlamydophila pneumoniae (основных возбудителей респираторных инфекций) к тиамфениколу выше, чем к макролидам, тетрациклинам и ко-тримоксазолу [37, 38].
Наличие лекарственной формы тиамфеникола для местного применения и хорошая переносимость такой антибактериальной терапии позволяют рассматривать тиамфеникол в качестве альтернативного препарата в лечении бактериальных респираторных инфекций, в том числе вызванных пневмококками со сниженной чувствительностью к бензилпенициллину [39].
Важным преимуществом тиамфеникола в составе препарата Флуимуцил-Антибиотик ИТ является ингаляционный путь введения антибактериального препарата, предпочтительный при лечении многих респираторных заболеваний, когда действующее вещество доставляется непосредственно в ДП, создавая местно высокие концентрации при применении более низких доз, что позволяет свести к минимуму системные побочные эффекты, предотвратить реакции со стороны желудочно-кишечного тракта, а также минимизировать лекарственные взаимодействия. При ингаляции концентрация тиамфеникола в крови в течение 1 мин становится сопоставимой с его парентеральным применением. При этом максимальная концентрация препарата достигается уже через 15 мин от момента его поступления в организм [26]. Он оказывает бактериостатическое действие, ингибируя синтез белка бактериальной клетки путем воздействия на субъединицу 50S рибосомы, обладает широким спектром действия против грамположительных (S. pneumoniae, Corynebacterium diphtheriae, Staphylococcus spp., Streptococcus pyogenes, Listeria spp., Clostridium spp.) и грамотрицательных
(H. influenzae, Neisseria spp., Salmonella spp., Escherichia coli, Shigella spp., Bordetella pertussis, Yersinia pestis, Brucella spp., Bacteroides spp.), а также влияет на бактериальные штаммы, продуцирующие β-лактамазы. Следует отметить, что NAC и тиамфеникола глицинат ацетилцистеинат улучшают прогноз и снижают потребность в антибактериальных препаратах при инфекциях, вызванных C. pneumoniae, Mycoplasma pneumoniae, отличающихся наличием в жизненном цикле стадии персистирования в эпителии ДП, что делает возбудитель практически недоступным для антибиотиков широкого спектра [40, 41].
У стареющих пациентов NAC как в виде монотерапии, так и в комбинации с антибиотиком позволяет эффективно поддерживать протеостаз, посредством которого клетки взаимодействуют с белками, включая синтез, сворачивание, транспортировку, посттрансляционную модификацию и деградацию. В процессе старения происходит снижение протеостаза, поскольку с возрастом ухудшается контроль качества белка даже при отсутствии основного заболевания. Старение резидентных и системных иммунных клеток приводит к возникновению провоспалительной среды и снижению способности бороться с инфекционными заболеваниями [42]. Оценка терапевтической эффективности NAC по влиянию на окислительный стресс показана в группах коморбидных больных с нарушенной толерантностью к глюкозе, метаболическим синдромом. NAC усиливает активность фосфоинозитид-3-киназы, что корректирует гликемический профиль.
Таким образом, NAC остается ведущим по клинической эффективности из других широко используемых антиоксидантов. Его эффективность подтверждена у пациентов с различными типами воспалительных заболеваний легких (хронический бронхит, бронхиальная астма, заболевания легких с прогрессирующим фиброзирующим фенотипом), а также при респираторных инфекциях, коморбидных состояниях, определяющих высокий риск осложнений. Применение NAC в режиме высоких доз снижало частоту обострений при хронической обструктивной болезни и улучшало прогноз при тяжелом течении коронавирусной инфекции. NAC в виде монотерапии и в сочетании с тиамфеникола глицинат ацетилцистеинатом восполняет депо глутатиона, обеспечивая доставку L-цистеина в клетки и снижая интенсивность оксидативных реакций. NAC обладает многочисленными цитопротективными эффектами, ингибирует различные реакции повреждения клеток, затрагивающие системы антиоксидантной резистентности, что поддерживает целостность бронхиального эпителия, секреторную и дренажную функцию бронхиального дерева и тем самым улучшает прогноз при респираторных заболеваниях. Применение комбинированной терапии, включающей NAC и антибиотик, приводит к заметному сокращению сроков персистирования биопленок, сформированных с участием антибиотикорезистентных возбудителей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Пономарева Любовь Андреевна – ассистент каф. факультетской терапии №2, врач-кардиолог, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Lubov A. Ponomareva – Assistant, Sechenov First Moscow State Medical University (Sechenov University)
Зубарев Игорь Сергеевич – врач-рентгенолог отд-ния лучевой диагностики Университетской клинической больницы №3 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Igor S. Zubarev – radiologist, Sechenov First Moscow State Medical University (Sechenov University)
Бернс Светлана Александровна – д-р мед. наук, проф., рук. отд. изучения патогенетических аспектов старения ФГБУ НМИЦ ТПМ
Svetlana A. Berns – Dr. Sci. (Med.), Professor, National Medical Research Center for Therapy and Preventive Medicine
Чинова Алина Александровна – врач-терапевт ГБУЗ ГКБ №52
Alina A. Chinova – physician, City Clinical Hospital No. 52
Попова Елена Николаевна – проф. каф. внутренних, профессиональных болезней и ревматологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – Professor, Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Поступила в редакцию: 11.11.2024
Поступила после рецензирования: 19.11.2024
Принята к публикации: 21.11.2024
Received: 11.11.2024
Revised: 19.11.2024
Accepted: 21.11.2024
Список исп. литературыСкрыть список1. Pawankar R, Canonica GW, Holgate ST, Lockey RF. Allergic diseases and asthma: a major global health concern. Curr Opin Allergy Clin Immunol 2012;12(1):39-41. DOI: 10.1097/ACI.0b013e32834ec13b. PMID: 22157151.
2. Lozano R, Naghavi M, Foreman K et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012;380(9859):2095-128. DOI: 10.1016/S0140-6736(12)61728-0. Erratum in: Lancet. 2013 Feb 23;381(9867):628.
3. Li X, Cao X, Guo M et al. Trends and risk factors of mortality and disability adjusted life years for chronic respiratory diseases from 1990 to 2017: systematic analysis for the Global Burden of Disease Study 2017. BMJ 2020;368:m234. DOI: 10.1136/bmj.m234. Erratum in: BMJ 2020;370:m3150. DOI: 10.1136/bmj.m3150. PMID: 32075787; PMCID: PMC7190065.
4. Abohalaka R. Bronchial epithelial and airway smooth muscle cell interactions in health and disease. Heliyon 2023;9(9):19976. DOI: 10.1016/j.heliyon.2023.e19976
5. Yan F. Roles of airway smooth muscle dysfunction in chronic obstructive pulmonary disease. J Transl Med 2018;(16):262.
6. Tankut G et al. Epithelial-stromal cell interactions and extracellular matrix mechanics drive the formation of airway-mimetic tubular morphology in lung organoids. iScience 2021;24(9):103061.
7. Humayun M, Chow CW, Young EWK. Microfluidic lung airway-on-a-chip with arrayable suspended gels for studying epithelial and smooth muscle cell interactions. Lab Chip 2018;18(9):1298-309. DOI: 10.1039/c7lc01357d. PMID: 29651473.
8. Burgoyne RA, Fisher AJ, Borthwick LA. The Role of Epithelial Damage in the Pulmonary Immune Response. Cells 2021;10(10):2763. DOI: 10.3390/cells10102763. PMID: 34685744; PMCID: PMC8534416.
9. Carmo-Fernandes A, Puschkarow M, Peters K et al. The Pathogenic Role of Smooth Muscle Cell-Derived Wnt5a in a Murine Model of Lung Fibrosis. Pharmaceuticals 2021;14(8):755.
10. Sauleda J, Núñez B, Sala E, Soriano JB. Idiopathic Pulmonary Fibrosis: Epidemiology, Natural History, Phenotypes. Med Sci (Basel) 2018;6(4):110. DOI: 10.3390/medsci6040110. PMID: 30501130; PMCID: PMC6313500.
11. Fain SB, Altes TA, Panth SR et al. Detection of age-dependent changes in healthy adult lungs with diffusion-weighted 3He MRI. Acad Radiol 2005;12:1385-93.
12. Godin LM, Sandri BJ, Wagner DE et al. Decreased Laminin Expression by Human Lung Epithelial Cells and Fibroblasts Cultured in Acellular Lung Scaffolds from Aged Mice. PLoS ONE 2016;(11):e0150966.
13. Schneider JL, Rowe JH, Garcia-de-Alba C et al. The aging lung: Physiology, disease, and immunity. Cell 2021;184(8):1990-2019. DOI: 10.1016/j.cell.2021.03.005. Epub 2021 Apr 2. PMID: 33811810; PMCID: PMC8052295.
14. Ascher K, Elliot SJ, Rubio GA, Glassberg MK. Lung Diseases of the Elderly: Cellular Mechanisms. Clin Geriatr Med 2017;33(4):473-90. DOI: 10.1016/j.cger.2017.07.001. Epub 2017 Aug 18. PMID: 28991645.
15. Carter P, Lagan J, Fortune C et al. Association of Cardiovascular Disease With Respiratory Disease. J Am Coll Cardiol 2019;73(17):2166-77. DOI: 10.1016/j.jacc.2018.11.063
16. Shen L, Jhund PS, Anand IS et al. Incidence and Outcomes of Pneumonia in Patients With Heart Failure. J Am Coll Cardiol 2021;77(16):1961-73. DOI: 10.1016/j.jacc.2021.03.001
17. Forman HJ, Zhang H. Targeting oxidative stress in disease: promise and limitations of antioxidant therapy. Nat Rev Drug Discov 2021;20(9):689-709. DOI: 10.1038/s41573-021-00233-1. Epub 2021 Jun 30. Erratum in: Nat Rev Drug Discov 2021;20(8):652. DOI: 10.1038/s41573-021-00267-5. PMID: 34194012; PMCID: PMC8243062.
18. Beavers WN, Skaar EP. Neutrophil-generated oxidative stress and protein damage in Staphylococcus aureus. Pathog Dis 2016;74(6):ftw060. DOI: 10.1093/femspd/ftw060. Epub 2016 Jun 27. PMID: 27354296; PMCID: PMC5975594.
19. Sathe N, Beech P, Croft L et al. Pseudomonas aeruginosa: Infections and novel approaches to treatment «Knowing the enemy» the threat of Pseudomonas aeruginosa and exploring novel approaches to treatment. Infect Med (Beijing) 2023;2(3):178-94. DOI: 10.1016/j.imj. 2023.05.003
20. Qin S, Xiao W, Zhou C et al. Pseudomonas aeruginosa: pathogenesis, virulence factors, antibiotic resistance, interaction with host, technology advances and emerging therapeutics. Signal Transduct Target Ther 2022;7(1):199. DOI:10.1038/s41392-022-01056-1
21. Dailah HG. Therapeutic Potential of Small Molecules Targeting Oxidative Stress in the Treatment of Chronic Obstructive Pulmonary Disease (COPD): A Comprehensive Review. Molecules 2022;27(17):5542. DOI: 10.3390/molecules27175542. PMID: 36080309; PMCID: PMC9458015.
22. Kumar S, Pandey AK. Chemistry and biological activities of flavonoids: an overview. Sci World J 2013;(2013):16. DOI: 10.1155/2013/162750. 162750
23. Gould NS, Day BJ. Targeting maladaptive glutathione responses in lung disease. Biochem Pharmacol 2011;81(2):187-93. DOI: 10.1016/ j.bcp.2010.10.001
24. Ghezzi P. Protein glutathionylation in health and disease. Biochim Biophys Acta 2013;1830(5):3165-72. DOI: 10.1016/j.bbagen.2013.02.009
25. Santus P, Signorello JC, Danzo F et al. Anti-Inflammatory and Anti-Oxidant Properties of N-Acetylcysteine: A Fresh Perspective. J Clin Med 2024;(13):4127. DOI: 10.3390/jcm13144127
26. Moldéus P, Cotgreave IA, Berggren M. Lung protection by a thiol-containing antioxidant: N-acetylcysteine. Respiration 1986;50(Suppl.1): 31-42. DOI: 10.1159/000195086
27. Tenório MCDS, Graciliano NG, Moura FA et al. N-Acetylcysteine (NAC): Impacts on Human Health. Antioxidants (Basel) 2021;10(6): 967. DOI: 10.3390/antiox10060967
28. Santus P, Corsico A, Solidoro P et al. Oxidative stress and respiratory system: pharmacological and clinical reappraisal of N-acetylcysteine. COPD 2014;11(6):705-17. DOI: 10.3109/15412555.2014.898040
29. Rushworth GF, Megson IL. Existing and potential therapeutic uses for N-acetylcysteine: the need for conversion to intracellular glutathione for antioxidant benefits. Pharmacol Ther 2014;141(2):150-9. DOI: 10.1016/j.pharmthera.2013.09.006. Epub 2013 Sep 28.
30. Zhao T, Liu Y. N-acetylcysteine inhibit biofilms produced by Pseudomonas aeruginosa. BMC Microbiol 2010;(10):140. DOI: 10.1186/1471-2180-10-140
31. Izquierdo JL, Soriano JB, González Y et al. Use of N-Acetylcysteine at high doses as an oral treatment for patients hospitalized with COVID-19. Sci Prog 2022;105(1):368504221074574. DOI: 10.1177/0036850422107 4574. PMID: 35084258; PMCID: PMC8795755.
32. Jiang X, Stockwell BR, Conrad M. Ferroptosis: mechanisms, biology and role in disease. Nat Rev Mol Cell Biol 2021;22(4):266-82. DOI: 10.1038/s41580-020-00324-8. Epub 2021 Jan 25.
33. Dar HH, Anthonymuthu TS, Ponomareva LA et al. A new thiol-independent mechanism of epithelial host defense against Pseudomonas aeruginosa: iNOS/NO – sabotage of theft-ferroptosis. Redox Biol 2021;45:102045. DOI: 10.1016/j.redox.2021.102045. Epub 2021 Jun 16. PMID: 34167028; PMCID: PMC8227829.
34. Kapralov AA, Yang Q, Dar HH et al. Redox lipid reprogramming commands susceptibility of macrophages and microglia to ferroptotic death. Nat Chem Biol 2020;16(3):278-90. DOI: 10.1038/s41589-019-0462-8. Epub 2020 Feb 17. PMID: 32080625; PMCID: PMC7233108
35. Del Pozo JL. Biofilm-related disease. Expert Rev Anti Infect Ther 2018;16(1):51-65. DOI: 10.1080/14787210.2018.1417036. Epub 2017 Dec 19.
36. Blasi F, Page C, Rossolini GM et al. The effect of N-acetylcysteine on biofilms: Implications for the treatment of respiratory tract infections. Respir Med 2016;(117):190-7. DOI: 10.1016/j.rmed.2016.06.015. Epub 2016 Jun 16.
37. Vance RE, Hong S, Gronert K et al. The opportunistic pathogen Pseudomonas aeruginosa carries a secretable arachidonate 15-lipoxygenase. Proc Natl Acad Sci U S A 2004;101(7):2135-9. DOI: 10.1073/pnas. 0307308101. Epub 2004 Feb 6.
38. Dar HH, Epperly MW, Tyurin VA et al. P. aeruginosa augments irradiation injury via 15-lipoxygenase-catalyzed generation of 15-HpETE-PE and induction of theft-ferroptosis. JCI Insight 2022;7(4):e156013. DOI: 10.1172/jci.insight.156013
39. Иванчик Н.В., Сухорукова М.В., Чагарян А.Н. и др. In vitro активность тиамфеникола в отношении клинических изолятов Haemophilus influenzae, Streptococcus pneumoniae и Streptococcus pyogenes. Клиническая микробиология и антимикробная химиотерапия. 2021;23(1):92-9.
Ivanchik N.V., Sukhorukova M.V., Chagaryan A.N., et al. In vitro activity of thiamphenicol against clinical isolates of Haemophilus influenzae, Streptococcus pneumoniae, and Streptococcus pyogenes. Clinical Microbiology and Antimicrobial Chemotherapy. 2021;23(1):92-9 (in Russian).
40. Drago L, Fassina MC, Mombelli B et al. Comparative effect of thiamphenicol glycinate, thiamphenicol glycinate N-acetylcysteinate, amoxicillin plus clavulanic acid, ceftriaxone and clarithromycin on pulmonary clearance of Haemophilus influenzae in an animal model. Chemotherapy 2000;46(4):275-81. DOI: 10.1159/000007299
41. Постников С.С., Грацианская А.Н. Ингаляционная терапия при респираторных инфекциях: Флуимуцил антибиотик ИТ. Практика педиатра. 2016;(3):56-9.
Postnikov S.S., Gratsianskaya A.N. Inhalation therapy for respiratory infections: Fluimucil antibiotic IT. Pediatrician Practice 2016;3:56-9 (in Russian).
42. Brandenberger C, Mühlfeld C. Mechanisms of lung aging. Cell Tissue Res 2017;367(3):469-80. DOI: 10.1007/s00441-016-2511-x. Epub 2016 Oct 14. PMID: 27743206.


