Клинический разбор в общей медицине №11 2024
1 Kazan State Medical Academy – branch of the Russian Medical Academy of Continuous Professional Education, Kazan, Russia;
2 Pirogov Russian National Research Medical University, Moscow, Russia;
3 Russian Medical Academy of Continuous Medical Education, Moscow, Russia;
4 Mari State University, Yoshkar-Ola, Russia;
5 Kazan State Medical University, Kazan, Russia;
6 Republican Clinical Hospital, Kazan, Russia
maksim_maksimov@mail.ru
Abstract
Aim. To systematize the data on the problem of patients who do not quit nicotine use and to answer the question: are alternative sources of nicotine delivery significantly less harmful than continuing to smoke traditional cigarettes for smokers who are not motivated to quit? To search for information, the studies were systematized according to the rules for preparing a systematic review according to the PICO requirements: Patients (P) – adults who smoke cigarettes; Intervention (I) – switching from cigarettes to ECs or ESDTs; Comparison (C) – participants who continue to smoke; Outcomes (O) – change in biomarkers of exposure and biomarkers of clinical risk.
Methods. The following keywords were used for the search. The influence of various factors on smoking cessation and relief of symptoms when switching to ECs: randomized controlled trial, smoking cessation, hospitalization, quitting tobacco smoking, quitting smoking, heated tobacco product. Pathogenetic effects of cigarette smoke on the body: cigarette smoke, tobacco products, nicotine delivery devices, cardiovascular system, risk, parameters, reward, cigarette. The following resources were used for the search: Cochrane Central Register of Controlled Trials (CENTRAL), PubMed, ClinicalTrials.gov, Elibrary, Scopus. The obtained materials were entered into Rayyan for systematization and primary analysis. First, duplicate articles were excluded, then articles were excluded by titles and/or abstracts. Editorials, comments, letters, news articles, studies that have not undergone peer review, including conference abstracts, unpublished clinical trials and articles from preprints were excluded from the study.
Results. The analyzed data report that the transition to alternative nicotine delivery systems (ANDS), although not helping to completely quit nicotine, reduces the impact of toxicants on the body of former smokers of classic cigarettes. ANDS contain fewer harmful and potentially harmful substances compared to tobacco smoke and have less cytotoxicity. However, they still contain carcinogenic substances, can cause oxidative stress and inflammation, but to a lesser extent than classic cigarettes. Complete cessation of smoking and nicotine-containing products remains the best option for maintaining health. At the same time, the study showed that not all patients are able to quit nicotine even with counseling and additional therapy, which demonstrates the need for flexible approaches to reduce harm in such patients.
Keywords: electronic nicotine delivery systems, tobacco heating system, alternative nicotine delivery sources, cardiovascular diseases, respiratory diseases, oncological diseases, smoking.
For citation: Maksimov M.L., Danilova M.S., Shikaleva A.A., Zvegintzeva A.A. Using alternative nicotine products to reduce harm to patients not refusing nicotine consumption. Narrative review. Clinical review for general practice. 2024; 5 (11): 85–100 (In Russ.). DOI: 10.47407/kr2024.5.11.00521
Табакокурение было и остается одним из главных модифицируемых факторов риска для пациентов. Стоит отметить, что курение является междисциплинарной проблемой и в лечении никотиновой зависимости, а также заболеваний, ассоцированных с употреблением табака, задействованы врачи разных специальностей: психиатры, наркологи, кардиологи, онкологи и др. [2]. Основное бремя ассоциированных с курением заболеваний приходится на онкологические заболевания и заболевания сердечно-сосудистой системы, что подчеркивает необходимость междисциплинарного подхода в изучении проблемы курения табака.
Значимость курения сигарет как фактора риска увеличивается в связи с высокой распространенностью этой привычки среди населения России. В России применены значительные запретительные меры по отношению к курильщикам. Введены запреты на курение на территории лечебно-профилактических учреждений, в общественных местах. Лечащий врач обязан дать пациенту, обратившемуся за оказанием медицинской помощи в медицинскую организацию, независимо от причины обращения рекомендации о прекращении потребления табака и предоставить необходимую информацию о медицинской помощи, которая может быть оказана [3]. Обозначенные и другие меры принесли свои результаты. По данным ВЦИОМ, с момента принятия закона «Об охране здоровья граждан от воздействия окружающего табачного дыма и последствий потребления табака» в 2013 г. доля курящих россиян начала снижаться (2013 г. – 41%, 2022 г. – 33%), но за последние 5 лет доля курильщиков в России остается неизменной на уровне 1/3 граждан. Другими словами, несмотря на динамику к уменьшению числа курильщиков, проблема табакокурения в России продолжает стоять остро. По данным Росстата за 2022 г., 20,1% населения России в возрасте после 15 лет считали себя курильщиками (36,4% мужчин, 6,6% женщин) [4]. Выборочное федеральное статистическое наблюдение здоровья населения 2024 г. сообщает, что в России ежедневно курят 16,4% населения после 15 лет [4].
Начиная с 2014 г. в научной среде интенсивно увеличивается количество публикаций на тему электронных сигарет (ЭС) и электронных систем нагревания табака (ЭСНТ). По теме «e-cigarettes» на платформе Pubmed насчитывается 427 публикаций за 2014 г. и 1564 публикации за 2023 г., что говорит о кратном росте научного интереса к заданной теме в научной среде. Интерес научного и медицинского сообщества к теме альтернативных источников доставки никотина (АИДН) также подтверждается попаданием данных устройств в клинические рекомендации различных медицинских сообществ, таких как Рекомендации Европейского общества кардиологов по профилактике сердечно-сосудистых заболеваний в клинической практике 2021 г. [5] и др. В большинстве работ на заданную тему подчеркивается необходимость дальнейших исследований и систематизации полученных данных.
АИДН – это группа устройств, доставляющих никотин пользователю без горения табака. АИДН можно разделить на две основные категории: ЭС (вейпы, или электронные системы доставки никотина – ЭСДН) и системы нагревания табака (СНТ). ЭСДН – электронное устройство, используемое для вдыхания аэрозоля, получаемого вследствие нагревания жидкости. Если в ЭС используется жидкость, состоящая из смеси растительного глицерина, пропиленгликоля, никотина и ароматизаторов, то в СНТ используется натуральный табачный лист. СНТ похожа на традиционную сигарету, за тем исключением, что в обычной сигарете происходит процесс горения табака, тогда как в СНТ происходит его нагревание, но не до температуры горения. Поэтому в процессе работы СНТ значительно снижено содержание угарного газа и других токсических соединений, присущих сигаретному дыму. Таким образом, СНТ и ЭС – это две принципиально разные технологии.
Цель данной работы – систематизация данных по заданной теме, сформулированная в вопросе: являются ли АИДН значительно менее вредными, чем продолжение курения традиционных сигарет для курильщиков, не мотивированных на отказ? Важным вопросом данной статьи также является разбор эффективности и недостатков существующих методов борьбы с никотиновой зависимостью.
Приверженность пациентов рекомендации по отказу от курения
Анализ исследований позволяет заключить, что не все пациенты-курильщики отказываются от курения табака даже после перенесенной госпитализации.
Средние показатели по годовому воздержанию от сигарет находятся в диапазоне от 20 до 40% и зависят от использования фармакологической и психотерапевтической помощи в отказе от курения, социального статуса исследуемой группы и других факторов [6, 7].
В обзоре исследований Update on the National Cancer Institute’s Smoking Cessation at Lung Examination Collaboration Trials оценивалась частота отказов от курения среди пациентов с онкологическим статусом в разных медицинских центрах США [7]. Было выявлено, что показатели по отказам от курения при условии разных стадий онкологического заболевания и условий лечения табачной зависимости варьировались в диапазоне от 13 до 58%:
1. Средний показатель успешности отказов от курения у пациентов с онкологическим диагнозом не превышал 1/3 пациентов.
2. Успех отказа от курения зависел от назначенной терапии, доступности психологического консультирования и эффективности лечения основного заболевания.
3. Наибольшая доля курильщиков, полностью отказавших от никотина через 6 мес после вмешательства, наблюдались в группе пациентов с положительным ответом на терапию основного заболевания и комбинацией фармакологической помощи и психотерапии.
Систематический обзор N. Benowitz показывает, что после перенесенного острого инфаркта миокарда (ОИМ) значительная часть госпитализированных пациентов отказываются от курения только благодаря консультации с врачом и добавлению никотинзаместительной терапии (НЗТ) [6], о чем также говорится в исследованиях М. Eisenberg и соавт., приведенных в табл. 1.
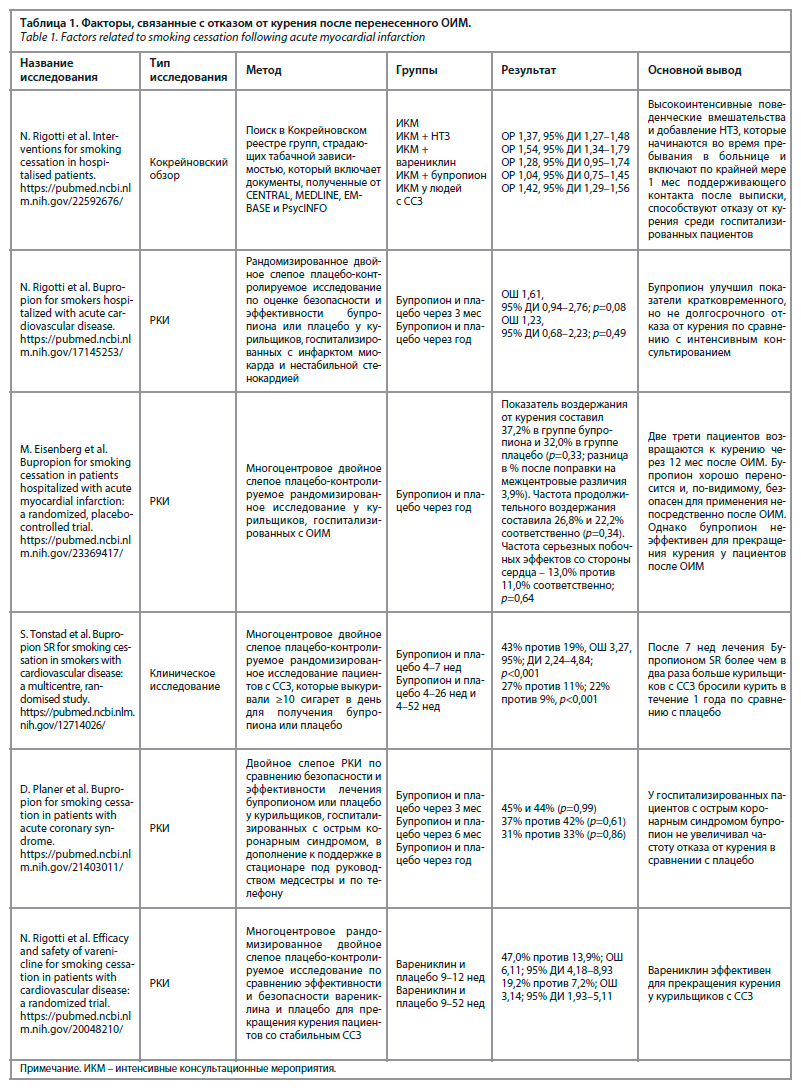
M. Eisenberg и соавт. в 2013 г. исследовали влияние буприпиона на отказ от курения и пришли к выводу, что и он неэффективен у пациентов после перенесенного ОИМ. Среди госпитализированных пациентов, которые отказались от курения, 2/3 вернулись к нему, хотя и сократили количество выкуренных в день сигарет (с 23,2±10,6 в исходном периоде до 8,4±11,3 через 12 мес); 37,2% в группе Бупропиона и 32,0% в группе плацебо не вернулись к курению. Проведенный анализ ITT непрерывного прекращения курения также не показал существенного различия в прекращении курения после перенесенного ОИМ – менее 25% пациентов последовательно воздерживались от курения в течение 12-месячного наблюдения без статистически значимой разницы между группами. Консультирование в данном исследовании не проверялось [8].
В исследовании P. Jankowski и соавт. проведен анализ 1034 пациентов, 764 (73,9%) из которых сообщили о том, что когда-либо курили в прошлом, и 296 (28,6%) – курили в течение 1 мес до госпитализации. Исследование показывает, что «воздействие пассивного курения и продолжительность курения были связаны с меньшей вероятностью отказа от курения, в то время как пожилой возраст, высокий социально-экономический статус, кардиологическая реабилитация после сердечно-сосудистых событий и консультация кардиолога были связаны с большей вероятностью отказа от курения» [9].
В исследовании EUROASPIRE IV говорится о положительной корреляции отказа курения, повышения возраста (отношение шансов – ОШ 1,50; 95% доверительный интервал – ДИ 1,09–2,06) и уровня образования (ОШ 1,38; 95% ДИ 1,08–1,75). Также те, кто успешно бросили курить, чаще сообщали, что им рекомендовали (56% против 47%, р<0,001) пройти программу кардиологической реабилитации (81% против 75%, р<0,01). Кроме того, исследование показало, что те, кто успешно бросил курить, сообщили о большем количестве действий по изменению здорового образа жизни, включая участие в программе кардиологической реабилитации, по сравнению с заядлыми курильщиками [10].
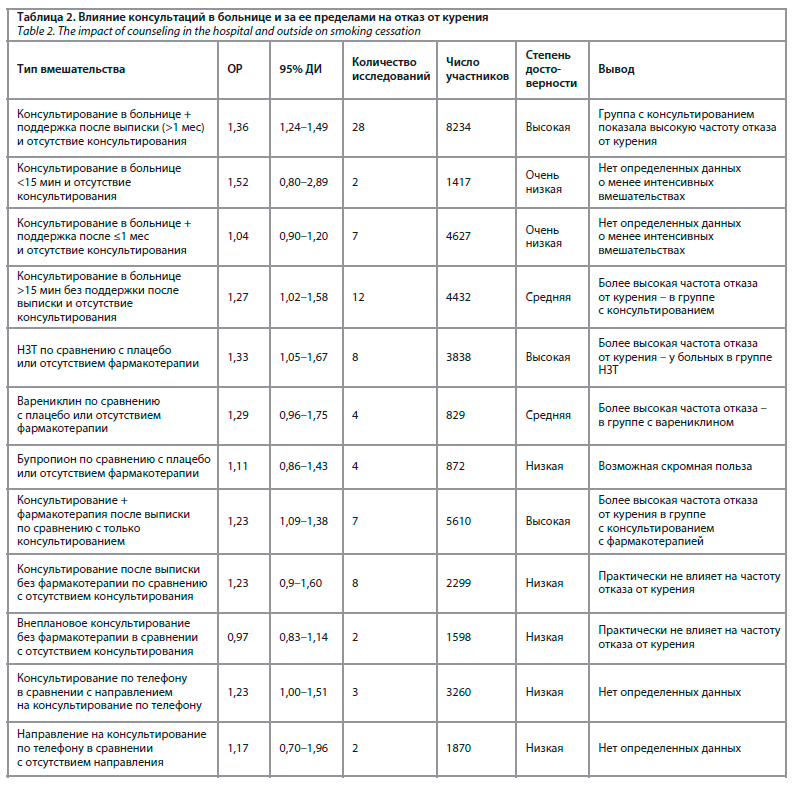
Из систематического обзора J. Streck [11] можно сделать несколько выводов:
1. У пациентов, получавших консультации по прекращению курения, которые начинались в больнице и продолжались более месяца после выписки, частота отказа от курения была выше по сравнению с пациентами, которые не получали таких консультаций. Данные о менее интенсивных или более коротких консультационных вмешательствах (например, консультирование менее 15 мин в стационаре или короткая поддержка после выписки) имеют низкую достоверность, результаты показывают неоднозначные эффекты; в свою очередь, консультирование по вопросам отказа от курения в стационаре без последующей поддержки после выписки имело более высокий уровень отказа от курения по сравнению с отсутствием консультирования.
2. НЗТ оказала положительное влияние на частоту отказа от курения по сравнению с плацебо или отсутствием фармакотерапии; варениклин показал некоторую эффективность в повышении частоты отказа от курения у госпитализированных пациентов по сравнению с плацебо или отсутствием терапии, однако достоверность данных о варениклине была средней; достоверность данных о бупропионе была низкой, и результаты показывают ограниченную пользу с широким ДИ.
3. Пациенты, получавшие и консультации по прекращению курения, и фармакотерапию после выписки, имели более высокие показатели отказа от курения по сравнению с пациентами, которые получали консультации только в больнице; мероприятия по консультированию после выписки, которые включали только телефонные консультации без фармакотерапии, имели ограниченное влияние на частоту отказа от курения, направление пациентов на телефонные линии по прекращению курения после выписки из больницы показало широкий ДИ, охватывающий как возможный вред, так и возможную пользу, и были оценены как имеющие очень низкую достоверность из‐за неточности, непоследовательности и риска предвзятости.
Подробные данные представлены в табл. 2.
 Из проанализированных данных становится понятно, что часть пациентов даже после перенесенной госпитализации, интенсивного консультирования и медицинского вмешательства не отказываются от курения полностью, поэтому в настоящее время важно продолжать поиски средства, помогающего бросить курить либо научно обоснованно снизить риски от потребления никотина.
Из проанализированных данных становится понятно, что часть пациентов даже после перенесенной госпитализации, интенсивного консультирования и медицинского вмешательства не отказываются от курения полностью, поэтому в настоящее время важно продолжать поиски средства, помогающего бросить курить либо научно обоснованно снизить риски от потребления никотина.
Суммируя изложенные данные:
1. Консультирование по отказу от курения повышает шансы полного и устойчивого отказа от никотина.
2. Частота отказа от курения зависит от мотивации пациента, социального статуса, уровня образования, образа жизни, назначенной терапии, доступности психологического консультирования и эффективности лечения основного заболевания.
3. Фармацевтическая поддержка отказа от курения (варениклин, бупропион, НЗТ) несет статистически значимые результаты, выраженные в увеличении частоты отказов среди пациентов.
4. Достигнуть устойчивого отказа от курения у большинства пациентов не удается даже с применением обширного медицинского вмешательства.
5. Существенным ограничением многих исследований является короткий срок наблюдения за пациентом, что не дает возможности отслеживания рецидивов курения у пациента.
Эффективность ЭС для полного отказа от курения – вопрос дискуссионный и неоднозначный. Эффективность ЭС в оказании помощи курильщикам при отказе от курения оценивается от очень низкой до низкой. Большинство включенных исследований показали, что ЭС, особенно II поколения, могут облегчить симптомы отмены курения и тягу к никотину в лабораторных условиях [26–29]. При этом была обнаружена положительная взаимосвязь между использованием ЭС и попытками бросить курить, хотя статистически значимой связи между употреблением ЭСДН и полным отказом от курения в этих исследованиях выявлено не было
[30, 31].
В 2024 г. была опубликована новая версия Кокрейновского обзора, которая включала 78 исследований (из них 47 являлись рандомизированными клиническими) и в совокупности 27 235 участников [12]. Эффективность использования никотинсодержащих ЭС как средств по отказу от курения сравнивалась с НЗТ (пластыри или жевательная резинка), ЭС без никотина, поведенческим вмешательством (совет или консультирование) или отсутствием какой-либо поддержки. ЭС с никотином были в 1,59 раза более эффективны, чем НЗТ, причем с высоким уровнем достоверности. При использовании никотинсодержащих ЭС число пациентов, бросивших курить, было в 1,88 раза больше, чем при использовании поведенческой поддержки или при ее отсутствии. Стоит отметить, что исследование было посвящено отказу от курения как способа потребления никотина. АИДН не являются способом лечения никотиновой зависимости.
При этом АИДН остается менее вредной альтернативой курению. При переходе с классических сигарет на АИДН отмечается благоприятное влияние на пациентов, страдающих хронической обструктивной болезнью легких (ХОБЛ) и сердечно-сосудистыми заболеваниями (ССЗ). В исследовании R. Polosa и соавт. наблюдалось значительное снижение ежегодных обострений ХОБЛ в среднем по группе (±SD) с 2,1 (±0,9) на исходном уровне до 1,4 (±0.8), 1,2 (±0.8) и 1,3 (±0,8) при 12-, 24- и 36-месячном наблюдении (p<0,05 для всех). Кроме того, во всех трех временных точках в когорте ЭСНТ были выявлены существенные и клинически значимые улучшения показателей COPD Assessment Test и теста с 6-минутной ходьбой. У пациентов с ХОБЛ, которые воздержались от курения или существенно сократили потребление сигарет, перейдя на использование ЭСНТ, наблюдалось стойкое улучшение респираторных симптомов, переносимости физических нагрузок, качества жизни и частоты обострений заболевания [13]. К аналогичному выводу пришли и P. Andreozzi и соавт.: «Пользователи ЭС имеют менее негативные последствия по сравнению с горючими сигаретами или двойным курением (горючие сигареты + ЭС); кроме того, переход на ЭС, по-видимому, связан с уменьшением обострений, улучшением симптоматики и уровня активности у пациентов с ХОБЛ». В том же исследовании сообщалось об улучшении динамики после перехода с обычных сигарет на ЭС у пациентов с астмой, однако стоит отметить, что эпидемиологические исследования задокументировали повышение частоты заболевания по сравнению с некурящими. Об осведомленности врачей относительно развития астмы и ХОБЛ можно судить по некоторым исследованиям [14, 15]. Известно, что обычные ароматизаторы признаны основными раздражителями слизистой оболочки дыхательных путей, а термическое разложение пропиленгликоля и растительного глицерина (основных компонентов жидкостей для ЭС) может привести к образованию активных карбонилов, токсичных для дыхательных путей [16].
 В исследовании J. Berlowitz и соавт. отмечается снижение риска ССЗ на 30–40% у пользователей АИДН по сравнению с курением классических сигарет. У лиц, употреблявших ЭС вместе с продолжением курения, риск развития ССЗ и ОИМ, сердечной недостаточности или инсульта не отличался от заядлых курильщиков (относительный риск – ОР 1,01, 95% ДИ 0,81–1,26 и ОР 0,94, 95% ДИ 0,65–1,36 соответственно). Также участники, использующие исключительно АИДН, имели такой же риск развития ССЗ, как у некурящих, и более высокий, хотя и незначительный, риск ОИМ, сердечной недостаточности или инсульта (ОР 1,00, 95% ДИ 0,69–1,45 и ОР 1,35, 95% ДИ 0,75–2,42 соответственно) [17].
В исследовании J. Berlowitz и соавт. отмечается снижение риска ССЗ на 30–40% у пользователей АИДН по сравнению с курением классических сигарет. У лиц, употреблявших ЭС вместе с продолжением курения, риск развития ССЗ и ОИМ, сердечной недостаточности или инсульта не отличался от заядлых курильщиков (относительный риск – ОР 1,01, 95% ДИ 0,81–1,26 и ОР 0,94, 95% ДИ 0,65–1,36 соответственно). Также участники, использующие исключительно АИДН, имели такой же риск развития ССЗ, как у некурящих, и более высокий, хотя и незначительный, риск ОИМ, сердечной недостаточности или инсульта (ОР 1,00, 95% ДИ 0,69–1,45 и ОР 1,35, 95% ДИ 0,75–2,42 соответственно) [17].
В популяционном исследовании среди корейских мужчин выявлено, что по сравнению с двойными курильщиками (ЭСДН + классическая сигарета; скорректированное отношение рисков 0,83, 95% ДИ 0,79–0,88) и курильщиками, недавно бросившие классические сигареты и перешедшие на АИДН (скорректированное отношение рисков 0,81, 95% ДИ 0,78–0,84), риск ССЗ был ниже. Но при этом у перешедеших на АИДН (скорректированное отношение рисков 1,31, 95% ДИ 1,01–1,70) риск ССЗ был выше, чем у недавно бросивших курить и полностью отказавшимся от никотина [18].
Табачный дым представляет собой аэрозоль, содержащий более 4500 различных веществ, которые обладают токсическим, мутагенным и канцерогенным действием. К ним относятся никотин, смолы, аммиак, монооксид углерода (СО), двуокись углерода, формальдегид, акролеин, ацетон, полициклические ароматические углеводороды, гидроксихинон, оксиды азота и кадмий и др. [26, 27]. Курение влияет на множество органов и систем нашего организма, но главная проблема курения не никотин, а продукты горения табака.
Необходимо отметить, что исследования, уточняющие роль никотина в процессах индукции эндотелиальной дисфункции (ЭД), идут уже давно. Например, в монументальной работе N. Benowitz и соавт. [19] было показано, что никотин играет прямую роль в процессах ЭД наряду с другими компонентами табачного дыма, роль которых не вызывает сомнений. Однако в этой же работе отмечено, что «никотин можно безопасно использовать, чтобы помочь курильщикам бросить курить, и, вероятно, он будет достаточно безопасен для длительного поддержания никотиновой зависимости вместо курения сигарет для тех, кто не может избавиться от зависимости» [19]. Рекомендации Европейского общества кардиологов 2021 г. подтверждают этот тезис, сообщая, что «НЗТ не оказывает неблагоприятного воздействия на пациентов с атеросклеротическими ССЗ» [5], т.е. клиническая значимость никотина в процессах ЭД остается невыясненной.
Таким образом, индукция ЭД и свободнорадикальные процессы в значительной степени индуцируются продуктами горения табака и компонентами табачного дыма, который содержит более 4500 различных веществ, но не самим никотином [20]. Исследование Smoking and Endothelial Dysfunction: An Integrated Medical and Molecular Review – 2022 гласит: «Атеросклероз, связанный с курением, не обязательно является результатом воздействия никотина, но, вероятно, является результатом совместного действия различных компонентов сигаретного дыма. Активные формы кислорода, содержащиеся в газовой фазе табака, способствуют возникновению и прогрессированию атеросклероза» [21].
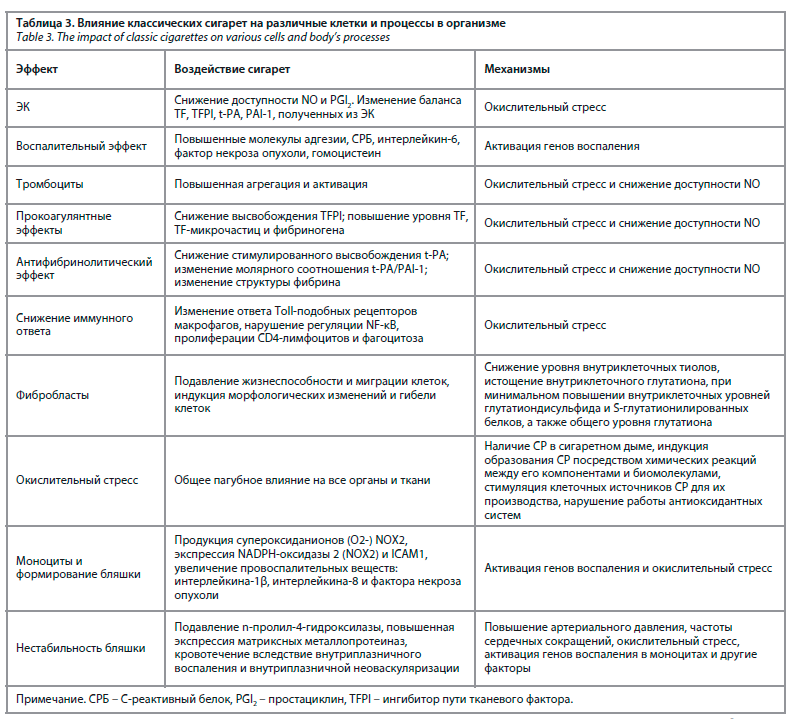
Никотин, несомненно, является аддиктивным веществом, из-за которого люди курят. Но он не является канцерогеном (никогда не включался в этот список). На данный момент идут поиски возможного использования никотина в медицинских целях (лечение болезни Альцгеймера и противовоспалительное средство). Никотин имеет влияние на развитие ССЗ как активатор симпатической нервной системы (повышение артериального давления и частоты сердечных сокращений) [22], но долгосрочное его влияние значительно ниже продуктов горения табака. Сводные данные по влиянию табачного дыма на организм представлены в табл. 3.
Многие исследования показывают, что содержание большинства вредных и потенциально вредных веществ в сигаретном дыме выше в 2–15 раз, чем в ЭСНТ и ЭС. Однако аэрозоль АИДН по-прежнему содержат канцерогенные соединения (например, формальдегид, ацетальдегид и бензопирен) [23, 24]. При этом АИДН обладает сниженной цитотоксичностью по сравнению с сигаретным дымом. ЭСНТ и ЭС способны усиливать окислительный стресс и воспалительную реакцию, но только при более интенсивном воздействии, чем сигаретный дым [22, 25].
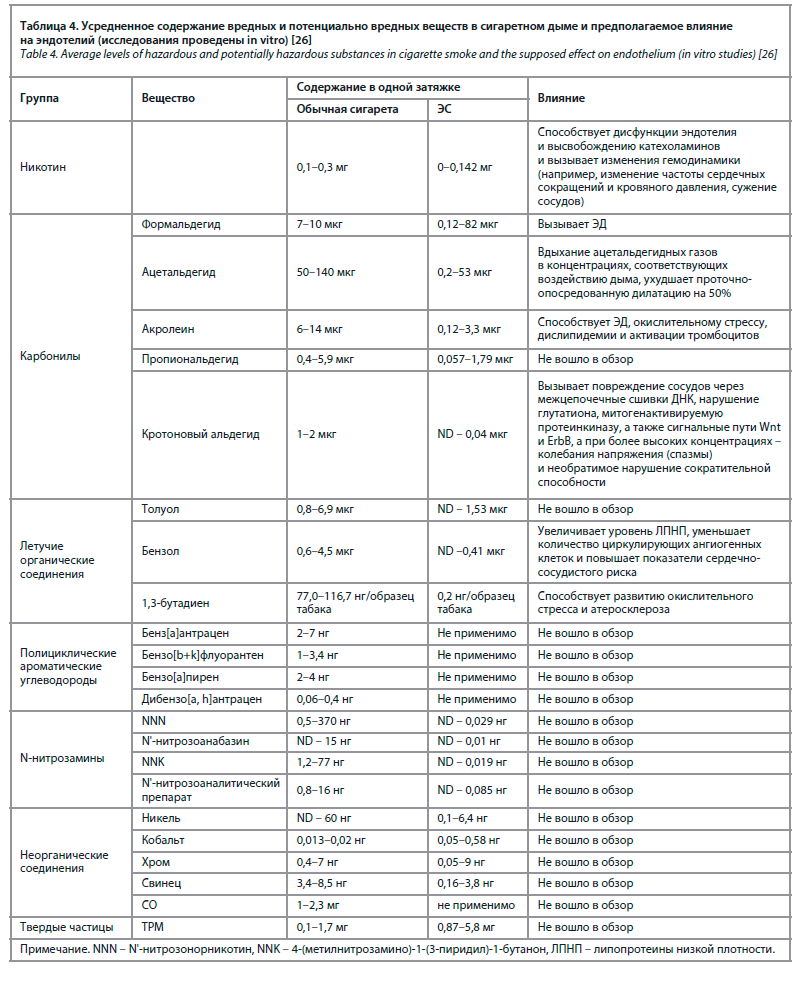
Сравнительную характеристику содержания патогенных веществ можно увидеть в табл. 4.
Табачный дым вызывает патологические изменения, такие как разрушение эпителия, цилиарная дисфункция и гиперсекреция слизи в дыхательных путях человека. Он также влияет на широкий спектр иммунологических функций дыхательных путей и связан с повышенной восприимчивостью к инфекциям. Макрофаги, подвергшиеся воздействию сигаретного дыма, экспрессируют повышенные уровни лизосомальных ферментов, кислородных радикалов, миелопероксидазы и эластазы, которые повреждают соединительную ткань [26, 34].
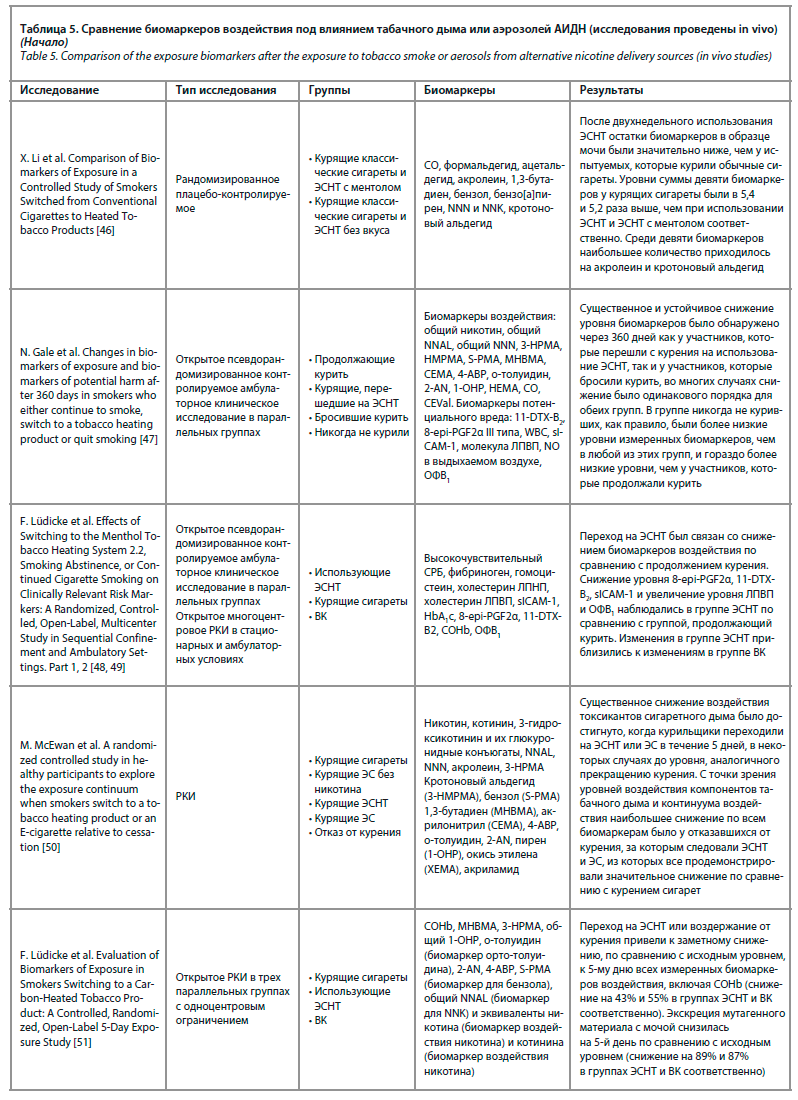
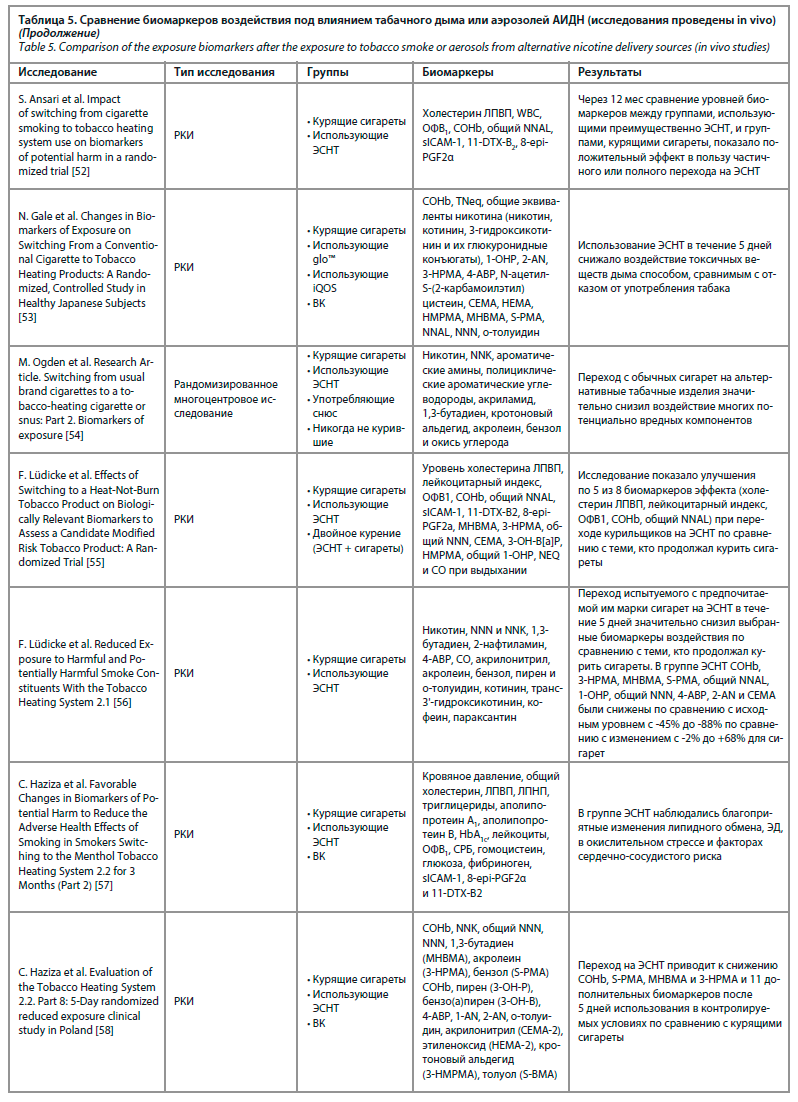
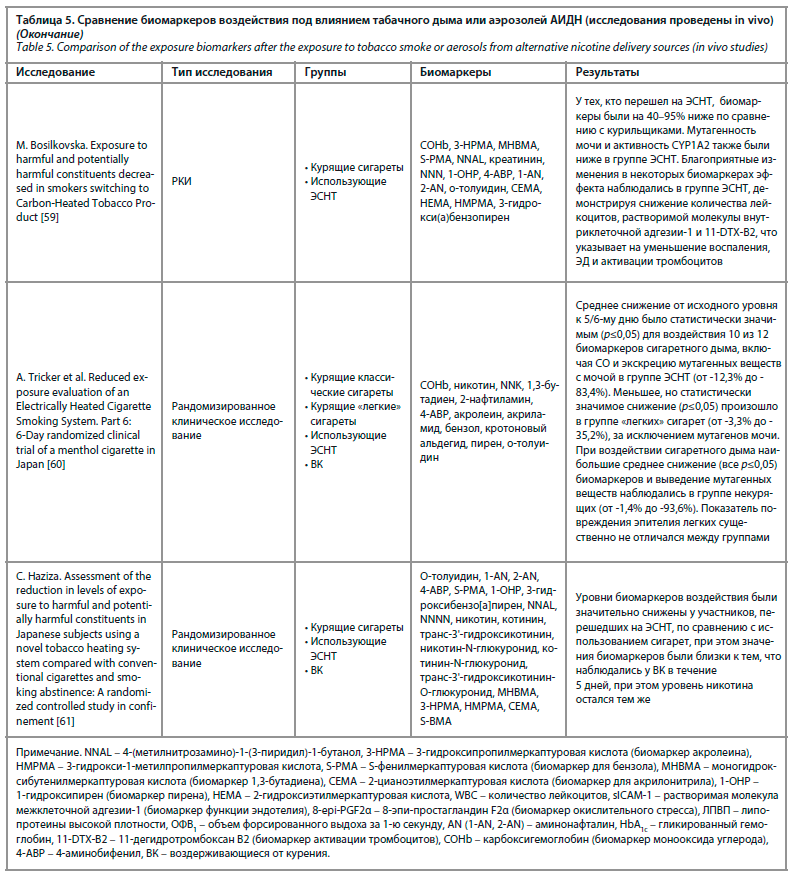
Компоненты табачного дыма ингибируют некоторые из ключевых функций врожденного и адаптивного иммунного ответа, изменяют ответ Toll-подобных рецепторов, нарушают регуляцию NF-κB, пролиферацию CD4-лимфоцитов и фагоцитоз. Во многих работах продемонстрировано, что курение табака повышает восприимчивость к бактериальной инфекции [35]. Обобщенные сведения по содержанию биомаркеров воздействия в организме человека под влиянием аэрозолей АИДН или табачного дыма можно увидеть в табл. 5.
Сравнивая эффекты табачного дыма, аэрозолей ЭС и ЭСНТ на фибробласты полости рта, L. Marinucci и соавт. пришли к выводу, что неразбавленный экстракт табачного дыма вызывал значительное подавление жизнеспособности и миграции клеток, морфологические изменения и индуцировал увеличение гибели клеток. После обработки аэрозолем ЭС изменений или повреждений клеток не наблюдалось. Аэрозоль ЭСНТ индуцировал пролиферацию, что подтверждается увеличением жизнеспособности клеток и их миграцией, а также изменениями в анализе циклов [36]. Аналогичное влияние сигаретного дыма на фибробласты полости рта доказали и G. Colombo и соавт. [37]. В исследовании F. Zanetti и соавт. прямо указывается на меньшее воздействие ЭС и ЭСНТ на десны человека: «Мы не наблюдали цитотоксичности и большего высвобождения провоспалительных медиаторов после воздействия ЭСНТ по сравнению с сигаретным дымом. Компьютерный анализ данных транскриптомики также подтвердил общее более низкое влияние ЭСНТ на уровни мРНК и микроРНК с возможным снижением окислительного стресса и воспаления, с нормализацией метаболизма ксенобиотиков по сравнению с сигаретным дымом. Реакция транскриптома на ЭСНТ через 4 ч после воздействия была не только ниже, чем для сигаретного дыма, но и более кратковременной» [38].
Огромное влияние табачный дым оказывает на сердечно-сосудистую систему. В первую очередь курение негативно сказывается на эндотелиальных клетках (ЭК) сосудов. Исследования показали, что сыворотки активных курильщиков уменьшают доступность NO в эндотелии как пупочной вены, так и коронарной артерии человека, нарушая экспрессию и активность эндотелиальной NO-синтазы. Это связано с высокими уровнями свободных радикалов (СР) в сигаретном дыме, которые поглощают NO и изменяют активность синтазы [39]. СР служат распространенными патогенными медиаторами в развитии проблем со здоровьем, вызванных курением. Помимо присутствия СР в сигаретном дыме дым изолированно индуцирует образование СР посредством химических реакций между его компонентами и биомолекулами и стимулирует клеточные источники СР для их производства. Кроме того, сигаретный дым нарушает работу антиоксидантных систем, влияя на окислительно-восстановительное состояние и, следовательно, усиливая воздействие СР [40]. В итоге снижение NO может привести к увеличению воспаления, активации тромбоцитов и тромбообразования, что способствует развитию тромботических осложнений. Стимуляция ЭК обычным сигаретным дымом приводит к более раннему запуску антиоксидантных и провоспалительных механизмов по сравнению с воздействием ЭС [41].
Так как ЭК являются источником тромбообразующих (фактор тканевого тромбообразования – TF) и антитромбообразующих факторов (ингибитор пути TF-1), а также фибринолитических (тканевой активатор плазминогена – t-PA) и антифибринолитических факторов (ингибитор активатора плазминогена-1 – PAI-1). Воздействие сигаретного дыма вызывает дисбаланс этих факторов, что ведет к усилению тромбообразования и повышению вероятности тромбообразующих событий. Сигаретный дым также способствует активации тромбоцитов через два параллельных пути, увеличивая их агрегацию и выработку тромбоксана A2. Это связано с потерей NO и повышенным окислительным стрессом, что приводит к усилению тромбообразования [42].
J. Sevilla-Montero и соавт. доказали, что воздействие сигаретного дыма непосредственно способствовало клеточному старению. Кроме того, сигаретный дым влиял на сократительную способность клеток и нарушал регуляцию экспрессии и активности K+ канала Kv7.4. Это способствовало нарушению вазоконстрикции и вазодилатации [43].
Несмотря на меньшее содержание патогенных веществ в АИДН, они все же оказывают пагубное влияние на сердечно-сосудистую систему, хоть и в меньшей степени. Негативное действие табачного дыма, аэрозолей ЭС и ЭСНТ было продемонстрированно в исследовании T. Münzel и соавт. Авторы приходят к выводу, что кратковременное употребление ЭС у здоровых курильщиков вызывало выраженное нарушение функции эндотелия и увеличение жесткости артерий. Другие исследования продемонстрировали острую микрососудистую ЭД у курильщиков наряду с повышением маркеров окислительного стресса и жесткости артерий после воздействия ЭС с никотином, но не после ЭС без никотина. Аналогичное нарушение жесткости сосудов наблюдалось после употребления табака или ЭС у курильщиков. При этом влияние ЭС на эндотелий и жесткость артерии все еще было меньше, чем при курении классических сигарет, что связано с разными уровнями токсических компонентов в ЭС и классической сигарете [25].
K. Haptonstall и соавт. утверждают, что хотя повышение уровня никотина в плазме крови было сходным после употребления и ЭС, и классической сигареты (5,75±0,74 против 5,88±0,69 нг/мл, p=0,47), использование ЭС не ухудшало вазодилатацию, однако вазодилатация значительно падала после выкуривания одной классической сигареты, что согласуется с представлением о том, что не никотиновые компоненты в табачном дыме провоцируют нарушение сосудистой стенки. И ходя данное исследование приходит к выводу об отсутствии влияния ЭС на сосудистую стенку, было бы опасно и преждевременно делать вывод, что ЭС не приводят к сосудистым нарушениям. Также стоит отметить, что средний возраст некурящих был 26,3±5,2 года, курящих ЭС – 27,4±5,45, табак – 27,1±5,51, в похожих исследованиях оценивался больший возрастной промежуток [44].
Моноциты, обладающие провоспалительным фенотипом, играют ключевую роль в адгезии и развитии атеросклеротических бляшек. В исследовании, проведенном S. Giebe и соавт., говорится о меньшем влиянии ЭС на антиоксидантные и провоспалительные процессы в моноцитах человека [45]. Стоит отметить, что ЭС не полностью устраняли вредные эффекты курения, но эти эффекты были явно отсрочены, а для их запуска требовалась более высокая доза воздействия ЭС [45].
В анализируемых исследованиях оценивались два типа биомаркеров с принципиальной физиологической разницей: биомаркеры воздейcтвия и биомаркеры клинического риска:
• Биомаркеры воздействия – химические вещества или метаболиты, которые могут быть измерены в организме для определения различных характеристик воздействия на организм.
• Биомаркеры клинического риска – вещества, продукты жизнедеятельности органов и тканей организма, которые могут быть измерены для определения риска возникновения или прогрессирования заболевания.
Рассматривая данные исследований, систематизированные в табл. 5, можно заключить, что биомаркеры воздействия и биомаркеры клинического риска были наиболее оптимальны в группе пациентов, полностью отказавшихся от курения табака. Наихудшие показатели биомаркеров воздействия наблюдались в группе пациентов, продолжавших курить. Группа пациентов, перешедших на АИДН, занимала промежуточное место между полностью отказавшимися от курения и продолжавшими курить традиционные сигареты. Важно отметить, что во всех исследованиях были получены достоверные и статистически значимые данные о снижении биомаркеров воздействия у пациентов в группе перешедших на АИДН. Степень разницы с группой продолжавших курить варьировалась и зависела от биомаркера, времени наблюдения и методики исследования, оставаясь статистически значимой.
Также нужны перспективные эпидемиологические исследования, чтобы оценить субклинические и доклинические факторы риска (например, гипертензию, гиперлипидемию), которые могут влиять на заболевания, связанные с курением.
На данный момент существует несколько популяционных исследований, подтверждающих выводы о снижении вреда при переключении курильщиков на альтернативные продукты, исключающие горение табака. В исследовании Cigarette Use and Risk of Cardiovascular Disease: A Longitudinal Analysis of the PATH Study (2013–2019) с участием 24 027 респондентов получены данные, что по сравнению с курением использование ЭС было связано с 30–40% снижением риска ССЗ, эта связь была значимой для любого исхода ССЗ [17]. Подобные результаты получены в корейском исследовании, где в выборку вошли 5 159 538 взрослых мужчин. Авторы отмечают, что по сравнению с постоянными курильщиками пользователи АИДН (без горения табака) имели на 17% ниже риск ССЗ, чем продолжавшие курить. В то же время лица, бросившие курить обычные сигареты и перешедшие на ЭС, имели на 31% выше риск ССЗ, чем у недавно бросивших курить и полностью отказавшихся от употребления никотина [18].
Следует отметить, что АИДН не рассматриваются как безопасная альтернатива или конечная точка взаимодействия с пациентом, а исключительно как вынужденное решение для снижения вреда у пациентов, которые не отказываются от курения. Лучшим вариантом для пациентов-курильщиков остается полный отказ от курения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование не имело спонсорской поддержки.
Financing. The study had no sponsorship.
Информация об авторах
Information about the authors
Максимов Максим Леонидович – д-р мед. наук, проф., зав. каф. клинической фармакологии и фармакотерапии КГМА – филиала ФГБОУ ДПО РМАНПО, проф. каф. фармакологии ИФМХ ФГАОУ ВО «РНИМУ им. Н.И. Пирогова», декан фак-та профилактической медицины и организации здравоохранения ФГБОУ ДПО РМАНПО. E-mail: maksim_maksimov@mail.ru; ORCID: 0000-0002-8979-8084; SPIN-код: 6261-3982; Author ID: 196259, Scopus Author ID: 55672273000
Maksim L. Maksimov – Dr. Sci. (Med.), Professor, Kazan State Medical Academy – branch of the Russian Medical Academy of Continuous Professional Education, Pirogov Russian National Research Medical University, Russian Medical Academy of Continuous
Medical Education. E-mail: maksim_maksimov@mail.ru; ORCID: 0000-0002-8979-8084; SPIN code: 6261-3982; Author ID: 196259, Scopus Author ID: 55672273000
Данилова Марина Сергеевна – сотрудник Международного научно-образовательного центра Медицинского института ФГБОУ ВО «Марийский государственный университет». E-mail: 67cloud40@gmail.com; ORCID: 0009-0000-1656-6517
Marina S. Danilova – Mari State University. E-mail: 67cloud40@gmail.com; ORCID: 0009-0000-1656-6517
Шикалева Анастасия Алексеевна – канд. мед. наук, доц. каф. клинической фармакологии и фармакотерапии КГМА – филиала ФГБОУ ДПО РМАНПО, ассистент каф. общей гигиены ФГБОУ ВО «Казанский ГМУ». E-mail: shikaleva@gmail.com;
ORCID: 0000-0003-1798-0490; SPIN-код: 4092-1591; Author ID: 1009243
Anastasiia A. Shikaleva – Cand. Sci. (Med.), Associate Professor, Kazan State Medical Academy – branch of the Russian Medical Academy of Continuous Professional Education, Kazan State Medical University. E-mail: shikaleva@gmail.com; ORCID: 0000-0003-1798-0490; SPIN code: 4092-1591; Author ID: 1009243
Звегинцева Альбина Айратовна – врач-клинический фармаколог, зав. отд-нием клинической фармакологии ГАУЗ РКБ
МЗ РТ, ассистент каф. клинической фармакологии и фармакотерапии, ассистент каф. безопасности медицинской деятельности и оценки технологий здравоохранения КГМА – филиала ФГБОУ ДПО РМАНПО. E-mail: albina.zvegintseva@yandex.ru; ORCID: 0000-0002-9327-9324
Albina A. Zvegintzeva – department head, Republican Clinical Hospital, Kazan State Medical Academy – branch of the Russian Medical Academy of Continuous Professional Education. E-mail: albina.zvegintseva@yandex.ru; ORCID: 0000-0002-9327-9324
Поступила в редакцию: 11.11.2024
Поступила после рецензирования: 21.11.2024
Принята к публикации: 21.11.2024
Received: 11.11.2024
Revised: 21.11.2024
Accepted: 21.11.2024
Клинический разбор в общей медицине №11 2024
Использование альтернативных никотинсодержащих продуктов для снижения вреда у пациентов, не отказывающихся от потребления никотина. Нарративный обзор
Номера страниц в выпуске:85-100
Аннотация
Цель. Систематизировать данные о проблеме пациентов, не отказывающихся от употребления никотина, и ответить на вопрос: являются ли альтернативные источники доставки никотина значительно менее вредными, чем продолжение курения традиционных сигарет для курильщиков, не мотивированных на отказ? Для поиска информации исследования были систематизированы по правилам подготовки систематического обзора согласно требованиям PICO: пациенты (P) – взрослые, курящие сигареты; вмешательство (I) – замена сигарет на электронные сигареты или электронные системы нагревания табака; сравнение (C) – участники, продолжающие курить; исходы (O) – изменение биомаркеров воздействия и биомаркерков клинического риска.
Методы. Для поиска использовались следующие ключевые слова: влияние различных факторов на отказ от курения и облегчение состояния при переходе на альтернативные источники доставки никотина (АИДН) – randomized controlled trial, smoking cessation, hospitalization, quitting tobacco smoking, quitting smoking, heated tobacco product; патогенетическое влияние сигаретного дыма на организм – cigarette smoke, tobacco products, nicotine delivery devices, cardiovascular system, risk, parameters, reward, cigarette. Для поиска использовались следующие ресурсы: Cochrane Central Register of Controlled Trials (CENTRAL), PubMed, ClinicalTrials.gov, Elibrary, Scopus. Полученные материалы введены в Rayyan для систематизации и первичного анализа. Сначала были исключены дублирующиеся статьи, затем статьи исключались по заголовкам и/или резюме. Из исследования исключались редакционные статьи, комментарии, письма, новостные статьи, исследования, не прошедшие рецензирование, включая тезисы конференций, неопубликованные клинические испытания и статьи из препринтов.
Результаты. Проанализированные данные сообщают, что переход на АИДН хотя и не помогает полностью отказаться от никотина, но снижает воздейcтвие токсикантов на организм бывших курильщиков классических сигарет. АИДН содержат меньше вредных и потенциально вредных веществ по сравнению с табачным дымом и имеют меньшую цитотоксичность. Однако они все еще содержат канцерогенные вещества, могут вызывать окислительный стресс и воспаление, но в меньшей степени, чем классические сигареты. Полный отказ от курения и никотинсодержащих продуктов остается наилучшим вариантом для поддержания здоровья. В то же время в рамках исследования показано, что не все пациенты способны отказаться от никотина даже в условиях консультирования и применения дополнительной терапии, что демонстрирует необходимость гибких подходов для снижения вреда у таких пациентов.
Ключевые слова: электронные системы доставки никотина, система нагревания табака, альтернативные источники доставки никотина, сердечно-сосудистые заболевания, респираторные заболевания, онкологические заболевания, курение.
Для цитирования: Максимов М.Л., Данилова М.С., Шикалева А.А., Звегинцева А.А. Использование альтернативных никотинсодержащих продуктов для снижения вреда у пациентов, не отказывающихся от потребления никотина. Нарративный обзор. Клинический разбор в общей медицине. 2024; 5 (11): 85–100. DOI: 10.47407/kr2024.5.11.00521
Цель. Систематизировать данные о проблеме пациентов, не отказывающихся от употребления никотина, и ответить на вопрос: являются ли альтернативные источники доставки никотина значительно менее вредными, чем продолжение курения традиционных сигарет для курильщиков, не мотивированных на отказ? Для поиска информации исследования были систематизированы по правилам подготовки систематического обзора согласно требованиям PICO: пациенты (P) – взрослые, курящие сигареты; вмешательство (I) – замена сигарет на электронные сигареты или электронные системы нагревания табака; сравнение (C) – участники, продолжающие курить; исходы (O) – изменение биомаркеров воздействия и биомаркерков клинического риска.
Методы. Для поиска использовались следующие ключевые слова: влияние различных факторов на отказ от курения и облегчение состояния при переходе на альтернативные источники доставки никотина (АИДН) – randomized controlled trial, smoking cessation, hospitalization, quitting tobacco smoking, quitting smoking, heated tobacco product; патогенетическое влияние сигаретного дыма на организм – cigarette smoke, tobacco products, nicotine delivery devices, cardiovascular system, risk, parameters, reward, cigarette. Для поиска использовались следующие ресурсы: Cochrane Central Register of Controlled Trials (CENTRAL), PubMed, ClinicalTrials.gov, Elibrary, Scopus. Полученные материалы введены в Rayyan для систематизации и первичного анализа. Сначала были исключены дублирующиеся статьи, затем статьи исключались по заголовкам и/или резюме. Из исследования исключались редакционные статьи, комментарии, письма, новостные статьи, исследования, не прошедшие рецензирование, включая тезисы конференций, неопубликованные клинические испытания и статьи из препринтов.
Результаты. Проанализированные данные сообщают, что переход на АИДН хотя и не помогает полностью отказаться от никотина, но снижает воздейcтвие токсикантов на организм бывших курильщиков классических сигарет. АИДН содержат меньше вредных и потенциально вредных веществ по сравнению с табачным дымом и имеют меньшую цитотоксичность. Однако они все еще содержат канцерогенные вещества, могут вызывать окислительный стресс и воспаление, но в меньшей степени, чем классические сигареты. Полный отказ от курения и никотинсодержащих продуктов остается наилучшим вариантом для поддержания здоровья. В то же время в рамках исследования показано, что не все пациенты способны отказаться от никотина даже в условиях консультирования и применения дополнительной терапии, что демонстрирует необходимость гибких подходов для снижения вреда у таких пациентов.
Ключевые слова: электронные системы доставки никотина, система нагревания табака, альтернативные источники доставки никотина, сердечно-сосудистые заболевания, респираторные заболевания, онкологические заболевания, курение.
Для цитирования: Максимов М.Л., Данилова М.С., Шикалева А.А., Звегинцева А.А. Использование альтернативных никотинсодержащих продуктов для снижения вреда у пациентов, не отказывающихся от потребления никотина. Нарративный обзор. Клинический разбор в общей медицине. 2024; 5 (11): 85–100. DOI: 10.47407/kr2024.5.11.00521
Using alternative nicotine products to reduce harm to patients not refusing nicotine consumption. Narrative review
Maksim L. Maksimov1–3, Marina S. Danilova4, Anastasiia A. Shikaleva1,5, Albina A. Zvegintzeva1,61 Kazan State Medical Academy – branch of the Russian Medical Academy of Continuous Professional Education, Kazan, Russia;
2 Pirogov Russian National Research Medical University, Moscow, Russia;
3 Russian Medical Academy of Continuous Medical Education, Moscow, Russia;
4 Mari State University, Yoshkar-Ola, Russia;
5 Kazan State Medical University, Kazan, Russia;
6 Republican Clinical Hospital, Kazan, Russia
maksim_maksimov@mail.ru
Abstract
Aim. To systematize the data on the problem of patients who do not quit nicotine use and to answer the question: are alternative sources of nicotine delivery significantly less harmful than continuing to smoke traditional cigarettes for smokers who are not motivated to quit? To search for information, the studies were systematized according to the rules for preparing a systematic review according to the PICO requirements: Patients (P) – adults who smoke cigarettes; Intervention (I) – switching from cigarettes to ECs or ESDTs; Comparison (C) – participants who continue to smoke; Outcomes (O) – change in biomarkers of exposure and biomarkers of clinical risk.
Methods. The following keywords were used for the search. The influence of various factors on smoking cessation and relief of symptoms when switching to ECs: randomized controlled trial, smoking cessation, hospitalization, quitting tobacco smoking, quitting smoking, heated tobacco product. Pathogenetic effects of cigarette smoke on the body: cigarette smoke, tobacco products, nicotine delivery devices, cardiovascular system, risk, parameters, reward, cigarette. The following resources were used for the search: Cochrane Central Register of Controlled Trials (CENTRAL), PubMed, ClinicalTrials.gov, Elibrary, Scopus. The obtained materials were entered into Rayyan for systematization and primary analysis. First, duplicate articles were excluded, then articles were excluded by titles and/or abstracts. Editorials, comments, letters, news articles, studies that have not undergone peer review, including conference abstracts, unpublished clinical trials and articles from preprints were excluded from the study.
Results. The analyzed data report that the transition to alternative nicotine delivery systems (ANDS), although not helping to completely quit nicotine, reduces the impact of toxicants on the body of former smokers of classic cigarettes. ANDS contain fewer harmful and potentially harmful substances compared to tobacco smoke and have less cytotoxicity. However, they still contain carcinogenic substances, can cause oxidative stress and inflammation, but to a lesser extent than classic cigarettes. Complete cessation of smoking and nicotine-containing products remains the best option for maintaining health. At the same time, the study showed that not all patients are able to quit nicotine even with counseling and additional therapy, which demonstrates the need for flexible approaches to reduce harm in such patients.
Keywords: electronic nicotine delivery systems, tobacco heating system, alternative nicotine delivery sources, cardiovascular diseases, respiratory diseases, oncological diseases, smoking.
For citation: Maksimov M.L., Danilova M.S., Shikaleva A.A., Zvegintzeva A.A. Using alternative nicotine products to reduce harm to patients not refusing nicotine consumption. Narrative review. Clinical review for general practice. 2024; 5 (11): 85–100 (In Russ.). DOI: 10.47407/kr2024.5.11.00521
Введение
На сегодняшний день в мире насчитывается более 1 млрд курильщиков. По данным Всемирной организации здравоохранения, от заболеваний, связанных с употреблением табака, умирают ежегодно более 8 млн человек [1].Табакокурение было и остается одним из главных модифицируемых факторов риска для пациентов. Стоит отметить, что курение является междисциплинарной проблемой и в лечении никотиновой зависимости, а также заболеваний, ассоцированных с употреблением табака, задействованы врачи разных специальностей: психиатры, наркологи, кардиологи, онкологи и др. [2]. Основное бремя ассоциированных с курением заболеваний приходится на онкологические заболевания и заболевания сердечно-сосудистой системы, что подчеркивает необходимость междисциплинарного подхода в изучении проблемы курения табака.
Значимость курения сигарет как фактора риска увеличивается в связи с высокой распространенностью этой привычки среди населения России. В России применены значительные запретительные меры по отношению к курильщикам. Введены запреты на курение на территории лечебно-профилактических учреждений, в общественных местах. Лечащий врач обязан дать пациенту, обратившемуся за оказанием медицинской помощи в медицинскую организацию, независимо от причины обращения рекомендации о прекращении потребления табака и предоставить необходимую информацию о медицинской помощи, которая может быть оказана [3]. Обозначенные и другие меры принесли свои результаты. По данным ВЦИОМ, с момента принятия закона «Об охране здоровья граждан от воздействия окружающего табачного дыма и последствий потребления табака» в 2013 г. доля курящих россиян начала снижаться (2013 г. – 41%, 2022 г. – 33%), но за последние 5 лет доля курильщиков в России остается неизменной на уровне 1/3 граждан. Другими словами, несмотря на динамику к уменьшению числа курильщиков, проблема табакокурения в России продолжает стоять остро. По данным Росстата за 2022 г., 20,1% населения России в возрасте после 15 лет считали себя курильщиками (36,4% мужчин, 6,6% женщин) [4]. Выборочное федеральное статистическое наблюдение здоровья населения 2024 г. сообщает, что в России ежедневно курят 16,4% населения после 15 лет [4].
Начиная с 2014 г. в научной среде интенсивно увеличивается количество публикаций на тему электронных сигарет (ЭС) и электронных систем нагревания табака (ЭСНТ). По теме «e-cigarettes» на платформе Pubmed насчитывается 427 публикаций за 2014 г. и 1564 публикации за 2023 г., что говорит о кратном росте научного интереса к заданной теме в научной среде. Интерес научного и медицинского сообщества к теме альтернативных источников доставки никотина (АИДН) также подтверждается попаданием данных устройств в клинические рекомендации различных медицинских сообществ, таких как Рекомендации Европейского общества кардиологов по профилактике сердечно-сосудистых заболеваний в клинической практике 2021 г. [5] и др. В большинстве работ на заданную тему подчеркивается необходимость дальнейших исследований и систематизации полученных данных.
АИДН – это группа устройств, доставляющих никотин пользователю без горения табака. АИДН можно разделить на две основные категории: ЭС (вейпы, или электронные системы доставки никотина – ЭСДН) и системы нагревания табака (СНТ). ЭСДН – электронное устройство, используемое для вдыхания аэрозоля, получаемого вследствие нагревания жидкости. Если в ЭС используется жидкость, состоящая из смеси растительного глицерина, пропиленгликоля, никотина и ароматизаторов, то в СНТ используется натуральный табачный лист. СНТ похожа на традиционную сигарету, за тем исключением, что в обычной сигарете происходит процесс горения табака, тогда как в СНТ происходит его нагревание, но не до температуры горения. Поэтому в процессе работы СНТ значительно снижено содержание угарного газа и других токсических соединений, присущих сигаретному дыму. Таким образом, СНТ и ЭС – это две принципиально разные технологии.
Цель данной работы – систематизация данных по заданной теме, сформулированная в вопросе: являются ли АИДН значительно менее вредными, чем продолжение курения традиционных сигарет для курильщиков, не мотивированных на отказ? Важным вопросом данной статьи также является разбор эффективности и недостатков существующих методов борьбы с никотиновой зависимостью.
Приверженность пациентов рекомендации по отказу от курения
Анализ исследований позволяет заключить, что не все пациенты-курильщики отказываются от курения табака даже после перенесенной госпитализации.
Средние показатели по годовому воздержанию от сигарет находятся в диапазоне от 20 до 40% и зависят от использования фармакологической и психотерапевтической помощи в отказе от курения, социального статуса исследуемой группы и других факторов [6, 7].
В обзоре исследований Update on the National Cancer Institute’s Smoking Cessation at Lung Examination Collaboration Trials оценивалась частота отказов от курения среди пациентов с онкологическим статусом в разных медицинских центрах США [7]. Было выявлено, что показатели по отказам от курения при условии разных стадий онкологического заболевания и условий лечения табачной зависимости варьировались в диапазоне от 13 до 58%:
1. Средний показатель успешности отказов от курения у пациентов с онкологическим диагнозом не превышал 1/3 пациентов.
2. Успех отказа от курения зависел от назначенной терапии, доступности психологического консультирования и эффективности лечения основного заболевания.
3. Наибольшая доля курильщиков, полностью отказавших от никотина через 6 мес после вмешательства, наблюдались в группе пациентов с положительным ответом на терапию основного заболевания и комбинацией фармакологической помощи и психотерапии.
Систематический обзор N. Benowitz показывает, что после перенесенного острого инфаркта миокарда (ОИМ) значительная часть госпитализированных пациентов отказываются от курения только благодаря консультации с врачом и добавлению никотинзаместительной терапии (НЗТ) [6], о чем также говорится в исследованиях М. Eisenberg и соавт., приведенных в табл. 1.

M. Eisenberg и соавт. в 2013 г. исследовали влияние буприпиона на отказ от курения и пришли к выводу, что и он неэффективен у пациентов после перенесенного ОИМ. Среди госпитализированных пациентов, которые отказались от курения, 2/3 вернулись к нему, хотя и сократили количество выкуренных в день сигарет (с 23,2±10,6 в исходном периоде до 8,4±11,3 через 12 мес); 37,2% в группе Бупропиона и 32,0% в группе плацебо не вернулись к курению. Проведенный анализ ITT непрерывного прекращения курения также не показал существенного различия в прекращении курения после перенесенного ОИМ – менее 25% пациентов последовательно воздерживались от курения в течение 12-месячного наблюдения без статистически значимой разницы между группами. Консультирование в данном исследовании не проверялось [8].
В исследовании P. Jankowski и соавт. проведен анализ 1034 пациентов, 764 (73,9%) из которых сообщили о том, что когда-либо курили в прошлом, и 296 (28,6%) – курили в течение 1 мес до госпитализации. Исследование показывает, что «воздействие пассивного курения и продолжительность курения были связаны с меньшей вероятностью отказа от курения, в то время как пожилой возраст, высокий социально-экономический статус, кардиологическая реабилитация после сердечно-сосудистых событий и консультация кардиолога были связаны с большей вероятностью отказа от курения» [9].
В исследовании EUROASPIRE IV говорится о положительной корреляции отказа курения, повышения возраста (отношение шансов – ОШ 1,50; 95% доверительный интервал – ДИ 1,09–2,06) и уровня образования (ОШ 1,38; 95% ДИ 1,08–1,75). Также те, кто успешно бросили курить, чаще сообщали, что им рекомендовали (56% против 47%, р<0,001) пройти программу кардиологической реабилитации (81% против 75%, р<0,01). Кроме того, исследование показало, что те, кто успешно бросил курить, сообщили о большем количестве действий по изменению здорового образа жизни, включая участие в программе кардиологической реабилитации, по сравнению с заядлыми курильщиками [10].
Из систематического обзора J. Streck [11] можно сделать несколько выводов:
1. У пациентов, получавших консультации по прекращению курения, которые начинались в больнице и продолжались более месяца после выписки, частота отказа от курения была выше по сравнению с пациентами, которые не получали таких консультаций. Данные о менее интенсивных или более коротких консультационных вмешательствах (например, консультирование менее 15 мин в стационаре или короткая поддержка после выписки) имеют низкую достоверность, результаты показывают неоднозначные эффекты; в свою очередь, консультирование по вопросам отказа от курения в стационаре без последующей поддержки после выписки имело более высокий уровень отказа от курения по сравнению с отсутствием консультирования.
2. НЗТ оказала положительное влияние на частоту отказа от курения по сравнению с плацебо или отсутствием фармакотерапии; варениклин показал некоторую эффективность в повышении частоты отказа от курения у госпитализированных пациентов по сравнению с плацебо или отсутствием терапии, однако достоверность данных о варениклине была средней; достоверность данных о бупропионе была низкой, и результаты показывают ограниченную пользу с широким ДИ.
3. Пациенты, получавшие и консультации по прекращению курения, и фармакотерапию после выписки, имели более высокие показатели отказа от курения по сравнению с пациентами, которые получали консультации только в больнице; мероприятия по консультированию после выписки, которые включали только телефонные консультации без фармакотерапии, имели ограниченное влияние на частоту отказа от курения, направление пациентов на телефонные линии по прекращению курения после выписки из больницы показало широкий ДИ, охватывающий как возможный вред, так и возможную пользу, и были оценены как имеющие очень низкую достоверность из‐за неточности, непоследовательности и риска предвзятости.
Подробные данные представлены в табл. 2.

 Из проанализированных данных становится понятно, что часть пациентов даже после перенесенной госпитализации, интенсивного консультирования и медицинского вмешательства не отказываются от курения полностью, поэтому в настоящее время важно продолжать поиски средства, помогающего бросить курить либо научно обоснованно снизить риски от потребления никотина.
Из проанализированных данных становится понятно, что часть пациентов даже после перенесенной госпитализации, интенсивного консультирования и медицинского вмешательства не отказываются от курения полностью, поэтому в настоящее время важно продолжать поиски средства, помогающего бросить курить либо научно обоснованно снизить риски от потребления никотина.Суммируя изложенные данные:
1. Консультирование по отказу от курения повышает шансы полного и устойчивого отказа от никотина.
2. Частота отказа от курения зависит от мотивации пациента, социального статуса, уровня образования, образа жизни, назначенной терапии, доступности психологического консультирования и эффективности лечения основного заболевания.
3. Фармацевтическая поддержка отказа от курения (варениклин, бупропион, НЗТ) несет статистически значимые результаты, выраженные в увеличении частоты отказов среди пациентов.
4. Достигнуть устойчивого отказа от курения у большинства пациентов не удается даже с применением обширного медицинского вмешательства.
5. Существенным ограничением многих исследований является короткий срок наблюдения за пациентом, что не дает возможности отслеживания рецидивов курения у пациента.
Эффективность ЭС для полного отказа от курения – вопрос дискуссионный и неоднозначный. Эффективность ЭС в оказании помощи курильщикам при отказе от курения оценивается от очень низкой до низкой. Большинство включенных исследований показали, что ЭС, особенно II поколения, могут облегчить симптомы отмены курения и тягу к никотину в лабораторных условиях [26–29]. При этом была обнаружена положительная взаимосвязь между использованием ЭС и попытками бросить курить, хотя статистически значимой связи между употреблением ЭСДН и полным отказом от курения в этих исследованиях выявлено не было
[30, 31].
В 2024 г. была опубликована новая версия Кокрейновского обзора, которая включала 78 исследований (из них 47 являлись рандомизированными клиническими) и в совокупности 27 235 участников [12]. Эффективность использования никотинсодержащих ЭС как средств по отказу от курения сравнивалась с НЗТ (пластыри или жевательная резинка), ЭС без никотина, поведенческим вмешательством (совет или консультирование) или отсутствием какой-либо поддержки. ЭС с никотином были в 1,59 раза более эффективны, чем НЗТ, причем с высоким уровнем достоверности. При использовании никотинсодержащих ЭС число пациентов, бросивших курить, было в 1,88 раза больше, чем при использовании поведенческой поддержки или при ее отсутствии. Стоит отметить, что исследование было посвящено отказу от курения как способа потребления никотина. АИДН не являются способом лечения никотиновой зависимости.
При этом АИДН остается менее вредной альтернативой курению. При переходе с классических сигарет на АИДН отмечается благоприятное влияние на пациентов, страдающих хронической обструктивной болезнью легких (ХОБЛ) и сердечно-сосудистыми заболеваниями (ССЗ). В исследовании R. Polosa и соавт. наблюдалось значительное снижение ежегодных обострений ХОБЛ в среднем по группе (±SD) с 2,1 (±0,9) на исходном уровне до 1,4 (±0.8), 1,2 (±0.8) и 1,3 (±0,8) при 12-, 24- и 36-месячном наблюдении (p<0,05 для всех). Кроме того, во всех трех временных точках в когорте ЭСНТ были выявлены существенные и клинически значимые улучшения показателей COPD Assessment Test и теста с 6-минутной ходьбой. У пациентов с ХОБЛ, которые воздержались от курения или существенно сократили потребление сигарет, перейдя на использование ЭСНТ, наблюдалось стойкое улучшение респираторных симптомов, переносимости физических нагрузок, качества жизни и частоты обострений заболевания [13]. К аналогичному выводу пришли и P. Andreozzi и соавт.: «Пользователи ЭС имеют менее негативные последствия по сравнению с горючими сигаретами или двойным курением (горючие сигареты + ЭС); кроме того, переход на ЭС, по-видимому, связан с уменьшением обострений, улучшением симптоматики и уровня активности у пациентов с ХОБЛ». В том же исследовании сообщалось об улучшении динамики после перехода с обычных сигарет на ЭС у пациентов с астмой, однако стоит отметить, что эпидемиологические исследования задокументировали повышение частоты заболевания по сравнению с некурящими. Об осведомленности врачей относительно развития астмы и ХОБЛ можно судить по некоторым исследованиям [14, 15]. Известно, что обычные ароматизаторы признаны основными раздражителями слизистой оболочки дыхательных путей, а термическое разложение пропиленгликоля и растительного глицерина (основных компонентов жидкостей для ЭС) может привести к образованию активных карбонилов, токсичных для дыхательных путей [16].
 В исследовании J. Berlowitz и соавт. отмечается снижение риска ССЗ на 30–40% у пользователей АИДН по сравнению с курением классических сигарет. У лиц, употреблявших ЭС вместе с продолжением курения, риск развития ССЗ и ОИМ, сердечной недостаточности или инсульта не отличался от заядлых курильщиков (относительный риск – ОР 1,01, 95% ДИ 0,81–1,26 и ОР 0,94, 95% ДИ 0,65–1,36 соответственно). Также участники, использующие исключительно АИДН, имели такой же риск развития ССЗ, как у некурящих, и более высокий, хотя и незначительный, риск ОИМ, сердечной недостаточности или инсульта (ОР 1,00, 95% ДИ 0,69–1,45 и ОР 1,35, 95% ДИ 0,75–2,42 соответственно) [17].
В исследовании J. Berlowitz и соавт. отмечается снижение риска ССЗ на 30–40% у пользователей АИДН по сравнению с курением классических сигарет. У лиц, употреблявших ЭС вместе с продолжением курения, риск развития ССЗ и ОИМ, сердечной недостаточности или инсульта не отличался от заядлых курильщиков (относительный риск – ОР 1,01, 95% ДИ 0,81–1,26 и ОР 0,94, 95% ДИ 0,65–1,36 соответственно). Также участники, использующие исключительно АИДН, имели такой же риск развития ССЗ, как у некурящих, и более высокий, хотя и незначительный, риск ОИМ, сердечной недостаточности или инсульта (ОР 1,00, 95% ДИ 0,69–1,45 и ОР 1,35, 95% ДИ 0,75–2,42 соответственно) [17]. В популяционном исследовании среди корейских мужчин выявлено, что по сравнению с двойными курильщиками (ЭСДН + классическая сигарета; скорректированное отношение рисков 0,83, 95% ДИ 0,79–0,88) и курильщиками, недавно бросившие классические сигареты и перешедшие на АИДН (скорректированное отношение рисков 0,81, 95% ДИ 0,78–0,84), риск ССЗ был ниже. Но при этом у перешедеших на АИДН (скорректированное отношение рисков 1,31, 95% ДИ 1,01–1,70) риск ССЗ был выше, чем у недавно бросивших курить и полностью отказавшимся от никотина [18].
Табачный дым представляет собой аэрозоль, содержащий более 4500 различных веществ, которые обладают токсическим, мутагенным и канцерогенным действием. К ним относятся никотин, смолы, аммиак, монооксид углерода (СО), двуокись углерода, формальдегид, акролеин, ацетон, полициклические ароматические углеводороды, гидроксихинон, оксиды азота и кадмий и др. [26, 27]. Курение влияет на множество органов и систем нашего организма, но главная проблема курения не никотин, а продукты горения табака.
Необходимо отметить, что исследования, уточняющие роль никотина в процессах индукции эндотелиальной дисфункции (ЭД), идут уже давно. Например, в монументальной работе N. Benowitz и соавт. [19] было показано, что никотин играет прямую роль в процессах ЭД наряду с другими компонентами табачного дыма, роль которых не вызывает сомнений. Однако в этой же работе отмечено, что «никотин можно безопасно использовать, чтобы помочь курильщикам бросить курить, и, вероятно, он будет достаточно безопасен для длительного поддержания никотиновой зависимости вместо курения сигарет для тех, кто не может избавиться от зависимости» [19]. Рекомендации Европейского общества кардиологов 2021 г. подтверждают этот тезис, сообщая, что «НЗТ не оказывает неблагоприятного воздействия на пациентов с атеросклеротическими ССЗ» [5], т.е. клиническая значимость никотина в процессах ЭД остается невыясненной.
Таким образом, индукция ЭД и свободнорадикальные процессы в значительной степени индуцируются продуктами горения табака и компонентами табачного дыма, который содержит более 4500 различных веществ, но не самим никотином [20]. Исследование Smoking and Endothelial Dysfunction: An Integrated Medical and Molecular Review – 2022 гласит: «Атеросклероз, связанный с курением, не обязательно является результатом воздействия никотина, но, вероятно, является результатом совместного действия различных компонентов сигаретного дыма. Активные формы кислорода, содержащиеся в газовой фазе табака, способствуют возникновению и прогрессированию атеросклероза» [21].
Никотин, несомненно, является аддиктивным веществом, из-за которого люди курят. Но он не является канцерогеном (никогда не включался в этот список). На данный момент идут поиски возможного использования никотина в медицинских целях (лечение болезни Альцгеймера и противовоспалительное средство). Никотин имеет влияние на развитие ССЗ как активатор симпатической нервной системы (повышение артериального давления и частоты сердечных сокращений) [22], но долгосрочное его влияние значительно ниже продуктов горения табака. Сводные данные по влиянию табачного дыма на организм представлены в табл. 3.
Многие исследования показывают, что содержание большинства вредных и потенциально вредных веществ в сигаретном дыме выше в 2–15 раз, чем в ЭСНТ и ЭС. Однако аэрозоль АИДН по-прежнему содержат канцерогенные соединения (например, формальдегид, ацетальдегид и бензопирен) [23, 24]. При этом АИДН обладает сниженной цитотоксичностью по сравнению с сигаретным дымом. ЭСНТ и ЭС способны усиливать окислительный стресс и воспалительную реакцию, но только при более интенсивном воздействии, чем сигаретный дым [22, 25].
Сравнительную характеристику содержания патогенных веществ можно увидеть в табл. 4.

Табачный дым вызывает патологические изменения, такие как разрушение эпителия, цилиарная дисфункция и гиперсекреция слизи в дыхательных путях человека. Он также влияет на широкий спектр иммунологических функций дыхательных путей и связан с повышенной восприимчивостью к инфекциям. Макрофаги, подвергшиеся воздействию сигаретного дыма, экспрессируют повышенные уровни лизосомальных ферментов, кислородных радикалов, миелопероксидазы и эластазы, которые повреждают соединительную ткань [26, 34].

Компоненты табачного дыма ингибируют некоторые из ключевых функций врожденного и адаптивного иммунного ответа, изменяют ответ Toll-подобных рецепторов, нарушают регуляцию NF-κB, пролиферацию CD4-лимфоцитов и фагоцитоз. Во многих работах продемонстрировано, что курение табака повышает восприимчивость к бактериальной инфекции [35]. Обобщенные сведения по содержанию биомаркеров воздействия в организме человека под влиянием аэрозолей АИДН или табачного дыма можно увидеть в табл. 5.
Сравнивая эффекты табачного дыма, аэрозолей ЭС и ЭСНТ на фибробласты полости рта, L. Marinucci и соавт. пришли к выводу, что неразбавленный экстракт табачного дыма вызывал значительное подавление жизнеспособности и миграции клеток, морфологические изменения и индуцировал увеличение гибели клеток. После обработки аэрозолем ЭС изменений или повреждений клеток не наблюдалось. Аэрозоль ЭСНТ индуцировал пролиферацию, что подтверждается увеличением жизнеспособности клеток и их миграцией, а также изменениями в анализе циклов [36]. Аналогичное влияние сигаретного дыма на фибробласты полости рта доказали и G. Colombo и соавт. [37]. В исследовании F. Zanetti и соавт. прямо указывается на меньшее воздействие ЭС и ЭСНТ на десны человека: «Мы не наблюдали цитотоксичности и большего высвобождения провоспалительных медиаторов после воздействия ЭСНТ по сравнению с сигаретным дымом. Компьютерный анализ данных транскриптомики также подтвердил общее более низкое влияние ЭСНТ на уровни мРНК и микроРНК с возможным снижением окислительного стресса и воспаления, с нормализацией метаболизма ксенобиотиков по сравнению с сигаретным дымом. Реакция транскриптома на ЭСНТ через 4 ч после воздействия была не только ниже, чем для сигаретного дыма, но и более кратковременной» [38].

Огромное влияние табачный дым оказывает на сердечно-сосудистую систему. В первую очередь курение негативно сказывается на эндотелиальных клетках (ЭК) сосудов. Исследования показали, что сыворотки активных курильщиков уменьшают доступность NO в эндотелии как пупочной вены, так и коронарной артерии человека, нарушая экспрессию и активность эндотелиальной NO-синтазы. Это связано с высокими уровнями свободных радикалов (СР) в сигаретном дыме, которые поглощают NO и изменяют активность синтазы [39]. СР служат распространенными патогенными медиаторами в развитии проблем со здоровьем, вызванных курением. Помимо присутствия СР в сигаретном дыме дым изолированно индуцирует образование СР посредством химических реакций между его компонентами и биомолекулами и стимулирует клеточные источники СР для их производства. Кроме того, сигаретный дым нарушает работу антиоксидантных систем, влияя на окислительно-восстановительное состояние и, следовательно, усиливая воздействие СР [40]. В итоге снижение NO может привести к увеличению воспаления, активации тромбоцитов и тромбообразования, что способствует развитию тромботических осложнений. Стимуляция ЭК обычным сигаретным дымом приводит к более раннему запуску антиоксидантных и провоспалительных механизмов по сравнению с воздействием ЭС [41].

Так как ЭК являются источником тромбообразующих (фактор тканевого тромбообразования – TF) и антитромбообразующих факторов (ингибитор пути TF-1), а также фибринолитических (тканевой активатор плазминогена – t-PA) и антифибринолитических факторов (ингибитор активатора плазминогена-1 – PAI-1). Воздействие сигаретного дыма вызывает дисбаланс этих факторов, что ведет к усилению тромбообразования и повышению вероятности тромбообразующих событий. Сигаретный дым также способствует активации тромбоцитов через два параллельных пути, увеличивая их агрегацию и выработку тромбоксана A2. Это связано с потерей NO и повышенным окислительным стрессом, что приводит к усилению тромбообразования [42].

J. Sevilla-Montero и соавт. доказали, что воздействие сигаретного дыма непосредственно способствовало клеточному старению. Кроме того, сигаретный дым влиял на сократительную способность клеток и нарушал регуляцию экспрессии и активности K+ канала Kv7.4. Это способствовало нарушению вазоконстрикции и вазодилатации [43].
Несмотря на меньшее содержание патогенных веществ в АИДН, они все же оказывают пагубное влияние на сердечно-сосудистую систему, хоть и в меньшей степени. Негативное действие табачного дыма, аэрозолей ЭС и ЭСНТ было продемонстрированно в исследовании T. Münzel и соавт. Авторы приходят к выводу, что кратковременное употребление ЭС у здоровых курильщиков вызывало выраженное нарушение функции эндотелия и увеличение жесткости артерий. Другие исследования продемонстрировали острую микрососудистую ЭД у курильщиков наряду с повышением маркеров окислительного стресса и жесткости артерий после воздействия ЭС с никотином, но не после ЭС без никотина. Аналогичное нарушение жесткости сосудов наблюдалось после употребления табака или ЭС у курильщиков. При этом влияние ЭС на эндотелий и жесткость артерии все еще было меньше, чем при курении классических сигарет, что связано с разными уровнями токсических компонентов в ЭС и классической сигарете [25].
K. Haptonstall и соавт. утверждают, что хотя повышение уровня никотина в плазме крови было сходным после употребления и ЭС, и классической сигареты (5,75±0,74 против 5,88±0,69 нг/мл, p=0,47), использование ЭС не ухудшало вазодилатацию, однако вазодилатация значительно падала после выкуривания одной классической сигареты, что согласуется с представлением о том, что не никотиновые компоненты в табачном дыме провоцируют нарушение сосудистой стенки. И ходя данное исследование приходит к выводу об отсутствии влияния ЭС на сосудистую стенку, было бы опасно и преждевременно делать вывод, что ЭС не приводят к сосудистым нарушениям. Также стоит отметить, что средний возраст некурящих был 26,3±5,2 года, курящих ЭС – 27,4±5,45, табак – 27,1±5,51, в похожих исследованиях оценивался больший возрастной промежуток [44].
Моноциты, обладающие провоспалительным фенотипом, играют ключевую роль в адгезии и развитии атеросклеротических бляшек. В исследовании, проведенном S. Giebe и соавт., говорится о меньшем влиянии ЭС на антиоксидантные и провоспалительные процессы в моноцитах человека [45]. Стоит отметить, что ЭС не полностью устраняли вредные эффекты курения, но эти эффекты были явно отсрочены, а для их запуска требовалась более высокая доза воздействия ЭС [45].
В анализируемых исследованиях оценивались два типа биомаркеров с принципиальной физиологической разницей: биомаркеры воздейcтвия и биомаркеры клинического риска:
• Биомаркеры воздействия – химические вещества или метаболиты, которые могут быть измерены в организме для определения различных характеристик воздействия на организм.
• Биомаркеры клинического риска – вещества, продукты жизнедеятельности органов и тканей организма, которые могут быть измерены для определения риска возникновения или прогрессирования заболевания.
Рассматривая данные исследований, систематизированные в табл. 5, можно заключить, что биомаркеры воздействия и биомаркеры клинического риска были наиболее оптимальны в группе пациентов, полностью отказавшихся от курения табака. Наихудшие показатели биомаркеров воздействия наблюдались в группе пациентов, продолжавших курить. Группа пациентов, перешедших на АИДН, занимала промежуточное место между полностью отказавшимися от курения и продолжавшими курить традиционные сигареты. Важно отметить, что во всех исследованиях были получены достоверные и статистически значимые данные о снижении биомаркеров воздействия у пациентов в группе перешедших на АИДН. Степень разницы с группой продолжавших курить варьировалась и зависела от биомаркера, времени наблюдения и методики исследования, оставаясь статистически значимой.
Обсуждение
Для обзора были выбраны кросс-секционные исследования с исходами в виде суррогатных конечных точек, для которых существуют убедительные доказательства причинно-следственной связи с неинфекционными заболеваниями, по причине большего числа таких исследований и высокой достоверности связи исследуемых параметров. Кросс-секционные исследования не всегда позволяют установить причинно-следственные связи, особенно если учесть неизмеряемые факторы, тем не менее они дают представление о том, как АИДН снижают вред от курения. Чтобы лучше оценить влияние АИДН на исходы и течение заболеваний, необходимы рандомизированные контролируемые (РКИ) и проспективные когортные исследования.Также нужны перспективные эпидемиологические исследования, чтобы оценить субклинические и доклинические факторы риска (например, гипертензию, гиперлипидемию), которые могут влиять на заболевания, связанные с курением.
На данный момент существует несколько популяционных исследований, подтверждающих выводы о снижении вреда при переключении курильщиков на альтернативные продукты, исключающие горение табака. В исследовании Cigarette Use and Risk of Cardiovascular Disease: A Longitudinal Analysis of the PATH Study (2013–2019) с участием 24 027 респондентов получены данные, что по сравнению с курением использование ЭС было связано с 30–40% снижением риска ССЗ, эта связь была значимой для любого исхода ССЗ [17]. Подобные результаты получены в корейском исследовании, где в выборку вошли 5 159 538 взрослых мужчин. Авторы отмечают, что по сравнению с постоянными курильщиками пользователи АИДН (без горения табака) имели на 17% ниже риск ССЗ, чем продолжавшие курить. В то же время лица, бросившие курить обычные сигареты и перешедшие на ЭС, имели на 31% выше риск ССЗ, чем у недавно бросивших курить и полностью отказавшихся от употребления никотина [18].
Следует отметить, что АИДН не рассматриваются как безопасная альтернатива или конечная точка взаимодействия с пациентом, а исключительно как вынужденное решение для снижения вреда у пациентов, которые не отказываются от курения. Лучшим вариантом для пациентов-курильщиков остается полный отказ от курения.
Вывод
Не все пациенты даже после перенесенной госпитализации отказываются от курения. Интенсивное консультирование по прекращению курения и добавление НЗТ значительно повышают вероятность отказа от курения. При этом возраст, социально-экономический статус, участие в реабилитации и консультации врача положительно связаны с большей вероятностью отказа от курения. Часть пациентов хоть и сокращают количество выкуриваемых в день сигарет, но не отказываются от курения полностью, поэтому необходимо искать другие пути решения и снижения вреда от горючих сигарет. Переход на АИДН хотя и не помогает полностью отказаться от никотина, но облегчает симптомы астмы, ХОБЛ и ССЗ у бывших курильщиков классических сигарет. АИДН остаются менее вредной альтернативой, так как табачный дым содержит более 4500 различных токсичных веществ, включая канцерогенные и мутагенные. Эти компоненты вызывают значительное повреждение клеточных мембран, системное хроническое воспаление и ЭД, что приводит к повышению риска ССЗ и тромбообразующих событий. АИДН содержат меньше вредных и потенциально вредных веществ по сравнению с табачным дымом и имеют меньшую цитотоксичность, однако они все еще содержат канцерогенные вещества, могут вызывать окислительный стресс и воспаление, но в меньшей степени, чем классические сигареты. Хотя ЭСНТ и ЭС считаются менее вредными по сравнению с традиционными сигаретами, они не являются полностью безопасными. Полный отказ от курения и никотинсодержащих продуктов остается наилучшим вариантом для поддержания здоровья.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование не имело спонсорской поддержки.
Financing. The study had no sponsorship.
Информация об авторах
Information about the authors
Максимов Максим Леонидович – д-р мед. наук, проф., зав. каф. клинической фармакологии и фармакотерапии КГМА – филиала ФГБОУ ДПО РМАНПО, проф. каф. фармакологии ИФМХ ФГАОУ ВО «РНИМУ им. Н.И. Пирогова», декан фак-та профилактической медицины и организации здравоохранения ФГБОУ ДПО РМАНПО. E-mail: maksim_maksimov@mail.ru; ORCID: 0000-0002-8979-8084; SPIN-код: 6261-3982; Author ID: 196259, Scopus Author ID: 55672273000
Maksim L. Maksimov – Dr. Sci. (Med.), Professor, Kazan State Medical Academy – branch of the Russian Medical Academy of Continuous Professional Education, Pirogov Russian National Research Medical University, Russian Medical Academy of Continuous
Medical Education. E-mail: maksim_maksimov@mail.ru; ORCID: 0000-0002-8979-8084; SPIN code: 6261-3982; Author ID: 196259, Scopus Author ID: 55672273000
Данилова Марина Сергеевна – сотрудник Международного научно-образовательного центра Медицинского института ФГБОУ ВО «Марийский государственный университет». E-mail: 67cloud40@gmail.com; ORCID: 0009-0000-1656-6517
Marina S. Danilova – Mari State University. E-mail: 67cloud40@gmail.com; ORCID: 0009-0000-1656-6517
Шикалева Анастасия Алексеевна – канд. мед. наук, доц. каф. клинической фармакологии и фармакотерапии КГМА – филиала ФГБОУ ДПО РМАНПО, ассистент каф. общей гигиены ФГБОУ ВО «Казанский ГМУ». E-mail: shikaleva@gmail.com;
ORCID: 0000-0003-1798-0490; SPIN-код: 4092-1591; Author ID: 1009243
Anastasiia A. Shikaleva – Cand. Sci. (Med.), Associate Professor, Kazan State Medical Academy – branch of the Russian Medical Academy of Continuous Professional Education, Kazan State Medical University. E-mail: shikaleva@gmail.com; ORCID: 0000-0003-1798-0490; SPIN code: 4092-1591; Author ID: 1009243
Звегинцева Альбина Айратовна – врач-клинический фармаколог, зав. отд-нием клинической фармакологии ГАУЗ РКБ
МЗ РТ, ассистент каф. клинической фармакологии и фармакотерапии, ассистент каф. безопасности медицинской деятельности и оценки технологий здравоохранения КГМА – филиала ФГБОУ ДПО РМАНПО. E-mail: albina.zvegintseva@yandex.ru; ORCID: 0000-0002-9327-9324
Albina A. Zvegintzeva – department head, Republican Clinical Hospital, Kazan State Medical Academy – branch of the Russian Medical Academy of Continuous Professional Education. E-mail: albina.zvegintseva@yandex.ru; ORCID: 0000-0002-9327-9324
Поступила в редакцию: 11.11.2024
Поступила после рецензирования: 21.11.2024
Принята к публикации: 21.11.2024
Received: 11.11.2024
Revised: 21.11.2024
Accepted: 21.11.2024
Список исп. литературыСкрыть список1. Institute of Health Metrics. Global Burden of Disease [database]. Washington, DC: Institute of Health Metrics, 2019 [cited 2023 Jul 17]. Available at: https://extranet.who.int/ncdsmicrodata/index.php/catalog/270
2. Клинические рекомендации. Синдром зависимости от табака, синдром отмены табака у взрослых. 2018.
Clinical guidelines. Tobacco dependence syndrome, tobacco withdrawal syndrome in adults. 2018 (in Russian).
3. Федеральный закон от 23.02.2013 №15-ФЗ «Об охране здоровья граждан от воздействия окружающего табачного дыма и последствий потребления табака».
Federal Law of 23.02.2013 No. 15-FZ «On the Protection of Citizens‘ Health from the Effects of Second-Hand Tobacco Smoke and the Consequences of Tobacco Consumption» (in Russian).
4. Российский статистический ежегодник. 2023: Стат.сб./Росстат. М., 2023.
Russian statistical yearbook. 2023: Stat.sb./Rosstat. Moscow, 2023 (in Russian).
5. Visseren FLJ, Mach F, Smulders YM et al.; ESC Scientific Document Group (2021). 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2021;42(34):3227–337. DOI: 10.1093/eurheartj/ehab484
6. Benowitz NL, Prochaska JJ. Smoking cessation after acute myocardial infarction. JACC 2013;61(5):533-5. DOI: 10.1016/j.jacc.2012.11.017
7. Lang AE. Update on the National Cancer Institute’s Smoking Cessation at Lung Examination Collaboration Trials. Chest 2024;165(6):1302-6. DOI: 10.1016/j.chest.2023.12.016
8. Eisenberg MJ, Grandi SM, Gervais A et al. & ZESCA Investigators. Bupropion for smoking cessation in patients hospitalized with acute myocardial infarction: a randomized, placebo-controlled trial. JACC 2013;61(5):524-32. DOI: 10.1016/j.jacc.2012.08.1030
9. Jankowski P, Kosior DA, Sowa P et al. Secondary prevention of coronary artery disease in Poland. Results from the POLASPIRE survey. Cardiol J 2020;27(5):533-40. DOI: 10.5603/CJ.a2020.0072
10. Snaterse M, Deckers JW, Lenzen MJ et al. & EUROASPIRE Investigators. Smoking cessation in European patients with coronary heart disease. Results from the EUROASPIRE IV survey: A registry from the European Society of Cardiology. Int J Cardiol 2018;(258):1-6. DOI: 10.1016/j.ijcard.2018.01.064
11. Streck JM, Rigotti NA, Livingstone-Banks J et al. Interventions for smoking cessation in hospitalised patients. Cochrane Database Syst Rev 2024;5(5):CD001837. DOI: 10.1002/14651858.CD001837.
pub4
12. Hartmann–Boyce J, McRobbie H, Butler AR et al. Electronic cigarettes for smoking cessation. Cochrane Database Syst Rev 2021;9(8):CD010216. DOI: 10.1002/14651858.CD010216.pub5
13. Polosa R, Morjaria JB, Prosperini U et al. Health outcomes in COPD smokers using heated tobacco products: a 3-year follow-up. Int Emergency Med 2021;16(3):687-96. DOI: 10.1007/s11739-021-02674-3
14. Бонцевич Р.А., Шершнева А.С., Вовк Я.Р. и др. Хроническая обструктивная болезнь легких: оценка знаний врачей терапевтического профиля. Итоги исследования ASCO-II. Врач. 2020;(7):68-74. DOI: 10.29296/25877305-2020-07-13
Bontsevich R.A., Shershneva A.S., Vovk Ya.R. et al. Chronic obstructive pulmonary disease: assessment of knowledge of physicians of the therapeutic profile. Results of the ASCO-II study. Doctor. 2020;(7):68-74. DOI: 10.29296/25877305-2020-07-13 (in Russian).
15. Бонцевич Р.А., Водяхина А.Я., Умеренков А.А. и др. Бронхиальная астма – фармакоэпидемиологический срез знаний врачей. Итоги исследования «ASSA–III». Вестник современной клинической медицины. 2024;17(2):23-33. DOI: 10.20969/VSKM.2024.17(2).23-33
Bontsevich R.A., Vodakhina A.Ya., Umerenkov A.A., et al. Bronchial asthma – a pharmacoepidemiological cross-section of physicians’ knowledge. Results of the “ASSA–III” study. Bulletin of Contemporary Clinical Medicine. 2024;17(2):23–33. DOI: 10.20969/VSKM.2024. 17(2).23–33 (in Russian).
16. Andreozzi P, Gussoni G, Sesti G et al. Impact of electronic cigarettes (e-cigs) and heat-not-burn/heated tobacco products (HnB/HTP) on asthma and chronic obstructive pulmonary disease: a viewpoint of the Italian Society of Internal Medicine. Intern Emerg Med 2024;(19):1829-37. DOI: 10.1007/s11739-024-03648-x
17. Berlowitz JB, Xie W, Harlow AF et al. E-Cigarette Use and Risk of Cardiovascular Disease: A Longitudinal Analysis of the PATH Study (2013-2019). Circulation 2022;145(20):1557-9. DOI: 10.1161/CIRCULATIONAHA.121.057369
18. Choi S, Lee K, Park SM. Combined Associations of Changes in Noncombustible Nicotine or Tobacco Product and Combustible Cigarette Use Habits With Subsequent Short-Term Cardiovascular Disease Risk Among South Korean Men: A Nationwide Cohort Study. Circulation 2021;144(19):1528-38. DOI: 10.1161/CIRCULATIONAHA.121.054967
19. Benowitz NL. Cigarette smoking and cardiovascular disease: pathophysiology and implications for treatment. Prog Cardiovasc Dis 2003;46(1):91-111. DOI: 10.1016/s0033-0620(03)00087-2. PMID: 12920702
20. Caliri AW, Tommasi S, Besaratinia A. Relationships among smoking, oxidative stress, inflammation, macromolecular damage, and cancer. Mutat Res Rev Mutat Res 2021;(787):108365. DOI: 10.1016/j.mrrev. 2021.108365. Epub 2021 Jan 11. PMID: 34083039; PMCID: PMC8287787
21. Yugar-Toledo C, Rodrigues B, Vilela-Martin J et al. Smoking and Endothelial Dysfunction: An Integrated – Medical and Molecular Review. Med Res Arch 2022;(10). DOI: 10.18103/mra.v10i9.3105
22. Klein J, Diaba-Nuhoho P, Giebe S et al. Regulation of endothelial function by cigarette smoke and next-generation tobacco and nicotine products. Pflugers Arch 2023;475(7):835-44. DOI: 10.1007/s00424-023-02824-w
23. Stephens WE. Comparing the cancer potencies of emissions from vapourised nicotine products including e-cigarettes with those of tobacco smoke. Tobacco control, tobaccocontrol-2017-053808. Advance Online Publication 2017. DOI: 10.1136/tobaccocontrol-2017-053808
24. Chapman F, Sticken ET, Wieczorek R et al. Multiple endpoint in vitro toxicity assessment of a prototype heated tobacco product indicates substantially reduced effects compared to those of combustible cigarette. Toxicol In Vitro 2023;(86):105510. DOI: 10.1016/j.tiv.2022. 105510
25. Münzel T, Hahad O, Kuntic M et al. Effects of tobacco cigarettes, e-cigarettes, and waterpipe smoking on endothelial function and clinical outcomes. Eur Heart J 2020;41(41):4057-70. DOI: 10.1093/eurheartj/ehaa460
26. Lugg ST, Scott A, Parekh D et al. Cigarette smoke exposure and alveolar macrophages: mechanisms for lung disease. Thorax 2022;77(1):94-101. DOI: 10.1136/thoraxjnl-2020-216296
27. Forster M, Fiebelkorn S, Yurteri C et al. Assessment of novel tobacco heating product THP1.0. Part 3: Comprehensive chemical characterisation of harmful and potentially harmful aerosol emissions. Regul Toxicol Pharmacol 2018;(93):14-33. DOI: 10.1016/j.yrtph.2017.10.006
28. Malas M, van der Tempel J, Schwartz R et al. Electronic Cigarettes for Smoking Cessation: A Systematic Review. Nicotine Tob Res 2016;18(10):1926-36. DOI: 10.1093/ntr/ntw119
29. Tan AS, Bigman CA. E-cigarette awareness and perceived harmfulness: prevalence and associations with smoking-cessation outcomes. Am J Prev Med 2014;47(2):141-9. DOI: 10.1016/j.amepre.2014.02.011. Epub 2014 Apr 30. Erratum in: Am J Prev Med 2016;50(5):674-6. DOI: 10.1016/j.amepre.2016.01.006
30. Tattan-Birch H, Hartmann-Boyce J, Kock L et al. Heated tobacco products for smoking cessation and reducing smoking prevalence. Cochrane Database Syst Rev 2022;1(1):CD013790. DOI: 10.1002/14651858.CD013790.pub2
31. Cruz-Jiménez L, Barrientos-Gutiérrez I, Vidaña-Pérez D et al. Heated tobacco product use frequency, smoking quit attempts, and smoking reduction among Mexican adult smokers. Tob Induc Dis 2024;(22). DOI: 10.18332/tid/187576
32. Pasquereau A, Guignard R, Andler R, Nguyen-Thanh V. Electronic cigarettes, quit attempts and smoking cessation: a 6-month follow-up. Addiction 2017;112(9):1620-8. DOI: 10.1111/add.13869
33. Mantey DS, Cooper MR, Loukas A, Perry CL. E-cigarette Use and Cigarette Smoking Cessation among Texas College Students. Am J Health Behav 2017;41(6):750-9. DOI: 10.5993/AJHB.41.6.9
34. Obernolte H, Niehof M, Braubach P et al. Cigarette smoke alters inflammatory genes and the extracellular matrix – investigations on viable sections of peripheral human lungs. Cell Tissue Res 2022;387(2):249-60. DOI: 10.1007/s00441-021-03553-1
35. Титова О.Н., Суховская О.А., Куликов В.Д. Табакокурение и внебольничная пневмония. РМЖ. Медицинское обозрение. 2019;3(9,I):34-7.
Titova O.N., Sukhovskaya O.A., Kulikov V.D. Tobacco smoking and community-acquired pneumonia. RMJ. Medical Review. 2019;3(9,I):34-7 (in Russian).
36. Marinucci L, Coniglio M, Valenti C et al. In Vitro effects of alternative smoking devices on oral cells: Electronic cigarette and heated tobacco product versus tobacco smoke. Arch Oral Biol 2022;144:105550. DOI: 10.1016/j.archoralbio.2022.105550
37. Colombo G, Dalle-Donne I, Orioli M et al. Oxidative damage in human gingival fibroblasts exposed to cigarette smoke. Free Radic Biol Med 2012;52(9):1584-96. DOI: 10.1016/j.freeradbiomed.2012.02.030
38. Zanetti F, Titz B, Sewer A et al. Comparative systems toxicology analysis of cigarette smoke and aerosol from a candidate modified risk tobacco product in organotypic human gingival epithelial cultures: A 3-day repeated exposure study. Food Chem Toxicol 2017;(101):15-35. DOI: 10.1016/j.fct.2016.12.027
39. Ishida M, Sakai C, Kobayashi Y, Ishida T. Cigarette Smoking and Atherosclerotic Cardiovascular Disease. J Atheroscler Thromb 2024;31(3):189-200. DOI: 10.5551/jat.RV22015
40. Seo YS, Park JM, Kim JH, Lee MY. Cigarette Smoke-Induced Reactive Oxygen Species Formation: A Concise Review. Antioxidants (Basel) 2023;12(9):1732. DOI: 10.3390/antiox12091732
41. Giebe S, Hofmann A, Brux M et al. Comparative study of the effects of cigarette smoke versus next generation tobacco and nicotine product extracts on endothelial function. Redox Biol 2021;(47):102150. DOI: 10.1016/j.redox.2021.102150
42. Barua RS, Ambrose JA. Mechanisms of coronary thrombosis in cigarette smoke exposure. Arterioscler Thromb Vasc Biol 2013;33(7):1460-7. DOI: 10.1161/ATVBAHA.112.300154
43. Sevilla-Montero J, Labrousse-Arias D, Fernández-Pérez C et al. Cigarette Smoke Directly Promotes Pulmonary Arterial Remodeling and Kv7.4 Channel Dysfunction. Am J Respir Crit Care Med 2021;203(10):1290-305. DOI: 10.1164/rccm.201911-2238OC
44. Haptonstall KP, Choroomi Y, Moheimani R et al. Differential effects of tobacco cigarettes and electronic cigarettes on endothelial function in healthy young people. Am J Physiol Heart Circ Physiol 2020;319(3):H547-H556. DOI: 10.1152/ajpheart.00307.2020
45. Giebe S, Brux M, Hofmann A et al. Comparative study of the effects of cigarette smoke versus next-generation tobacco and nicotine product extracts on inflammatory biomarkers of human monocytes. Pflugers Arch 2023;475(7):823-33. DOI: 10.1007/s00424-023-02809-9
46. Li X, Wang X, Cui P et al. Comparison of Biomarkers of Exposure in a Controlled Study of Smokers Switched from Conventional Cigarettes to Heated Tobacco Products. Toxics 2023;11(10):816. DOI: 10.3390/toxics11100816
47. Gale N, McEwan M, Hardie G et al. Changes in biomarkers of exposure and biomarkers of potential harm after 360 days in smokers who either continue to smoke, switch to a tobacco heating product or quit smoking. Intern Emerg Med 2022;17(7):2017-30. DOI: 10.1007/s11739-022-03062-1
48. Lüdicke F, Picavet P, Baker G et al. Effects of Switching to the Menthol Tobacco Heating System 2.2, Smoking Abstinence, or Continued Cigarette Smoking on Clinically Relevant Risk Markers: A Randomized, Controlled, Open-Label, Multicenter Study in Sequential Confinement and Ambulatory Settings (Part 2). Nicotine Tob Res 2018;20(2):173-82. DOI: 10.1093/ntr/ntx028
49. Lüdicke F, Picavet P, Baker G et al. Effects of Switching to the Tobacco Heating System 2.2 Menthol, Smoking Abstinence, or Continued Cigarette Smoking on Biomarkers of Exposure: A Randomized, Controlled, Open-Label, Multicenter Study in Sequential Confinement and Ambulatory Settings (Part 1). Nicotine Tob Res 2018;20(2):161-72. DOI: 10.1093/ntr/ntw287
50. McEwan M, Gale N, Ebajemito JK et al. A randomized controlled study in healthy participants to explore the exposure continuum when smokers switch to a tobacco heating product or an E-cigarette relative to cessation. Toxicol Rep 2021;8:994-1001. DOI: 10.1016/j.toxrep.2021.05.003
51. Lüdicke F, Haziza C, Weitkunat R, Magnette J. Evaluation of Biomarkers of Exposure in Smokers Switching to a Carbon-Heated Tobacco Product: A Controlled, Randomized, Open-Label 5-Day Exposure Study. Nicotine Tob Res 2016;18(7):1606-13. DOI: 10.1093/ntr/ ntw022
52. Ansari SM, Hession PS, David M et al. Impact of switching from cigarette smoking to tobacco heating system use on biomarkers of potential harm in a randomized trial. Biomarkers 2024;29(5):298-314. DOI: 10.1080/1354750X.2024.2358318
53. Gale N, McEwan M, Eldridge AC et al. Changes in Biomarkers of Exposure on Switching From a Conventional Cigarette to Tobacco Heating Products: A Randomized, Controlled Study in Healthy Japanese Subjects. Nicotine Tob Res 2019;21(9):1220-7. DOI: 10.1093/ntr/nty104
54. Ogden MW, Marano KM, Jones BA et al. Switching from usual brand cigarettes to a tobacco-heating cigarette or snus: Part 2. Biomarkers of exposure. Biomarkers 2015;20(6-7):391-403. DOI: 10.3109/1354750X.2015.1094134
55. Lüdicke F, Ansari SM, Lama N et al. Effects of Switching to a Heat-Not-Burn Tobacco Product on Biologically Relevant Biomarkers to Assess a Candidate Modified Risk Tobacco Product: A Randomized Trial. Cancer Epidemiol Biomarkers Prev 2019;28(11):1934-43. DOI: 10.1158/1055-9965.EPI-18-0915
56. Lüdicke F, Baker G, Magnette J et al. Reduced Exposure to Harmful and Potentially Harmful Smoke Constituents With the Tobacco Heating System 2.1. Nicotine Tob Res 2017;19(2):168-75. DOI: 10.1093/ntr/ntw164
57. Haziza C, de La Bourdonnaye G, Donelli A et al. Favorable Changes in Biomarkers of Potential Harm to Reduce the Adverse Health Effects of Smoking in Smokers Switching to the Menthol Tobacco Heating System 2.2 for 3 Months (Part 2). Nicotine Tob Res 2020;22(4):549-59. DOI: 10.1093/ntr/ntz084
58. Haziza C, de La Bourdonnaye G, Skiada D et al. Evaluation of the Tobacco Heating System 2.2. Part 8: 5-Day randomized reduced exposure clinical study in Poland. Regul Toxicol Pharmacol 2016;81(Suppl.2):S139-S150. DOI: 10.1016/j.yrtph.2016.11.003
59. Bosilkovska M, Tran CT, de La Bourdonnaye G et al. Exposure to harmful and potentially harmful constituents decreased in smokers switching to Carbon-Heated Tobacco Product. Toxicol Lett. Published online May 5, 2020. DOI: 10.1016/j.toxlet.2020.04.013
60. Tricker AR, Kanada S, Takada K et al. Reduced exposure evaluation of an Electrically Heated Cigarette Smoking System. Part 6: 6-Day randomized clinical trial of a menthol cigarette in Japan. Regul Toxicol Pharmacol 2012;64(Suppl.2):S64-S73. DOI: 10.1016/j.yrtph.2012.08.007
61. Haziza C, de La Bourdonnaye G, Merlet S et al. Assessment of the reduction in levels of exposure to harmful and potentially harmful constituents in Japanese subjects using a novel tobacco heating system compared with conventional cigarettes and smoking abstinence: A randomized controlled study in confinement. Regul Toxicol Pharmacol 2016;(81):489-99. DOI: 10.1016/j.yrtph.2016.09.014
18 декабря 2024
Количество просмотров: 480


