Клинический разбор в общей медицине №11 2024
Клинический разбор в общей медицине №11 2024
Псевдоаневризма селезеночной артерии: краткий обзор литературы и клиническое наблюдение
Номера страниц в выпуске:135-141
Аннотация
Актуальность. Псевдоаневризма селезеночной артерии (ПСА) – это редкая патология, имеющая большое клиническое значение. Аневризма селезеночной артерии является третьей по частоте встречаемости среди интраабдоминальных аневризм после аневризмы брюшной аорты и подвздошных артерий и составляет 60–70% от всех висцеральных аневризм. Хотя большинство аневризм селезеночной артерии бессимптомные и диагностируются случайно, ее разрыв как первое ее проявление встречается в 2–10% случаев и представляет собой фатальное осложнение. ПСА встречается гораздо реже, чем истинная аневризма, однако ее распространенность среди всех псевдоаневризм висцеральных ветвей достигает 27%; развивается чаще у мужчин, чем у женщин. Учитывая редкую встречаемость, которая часто сопровождается различной сопутствующей патологией, выбор вмешательства при псевдоаневризме, носящего в большинстве случаев безотлагательный характер, является трудной задачей. Хирургическое пособие в течение многих лет служило методом выбора. Однако за последнее десятилетие возросло количество эндоваскулярных вмешательств, проведенных у таких больных. Поскольку ПСА представляет собой редкое заболевание и большинство исследований являются ретроспективными и включают малое число пациентов, в настоящее время нет методов лечения с уровнем доказательности I. Среди возможных причин выделяют панкреатит, травму, послеоперационные осложнения и пептическую язву. В большинстве случаев их течение является бессимптомным, и они выявляются случайно при выполнении компьютерной или магнитно-резонансной томографии по поводу других заболеваний. ПСА практически всегда сопровождаются клиническими проявлениями, среди которых наиболее часто встречаются боль в животе (29,5%), гематохезия и мелена (26,2%), гематомезис (14,8%). Вторичное кровоизлияние из псевдоаневризм, как правило, происходит в брюшную полость, а также в вирсунгов проток, прилежащие органы (желудок, кишку) или в полость сформировавшейся вокруг ложной аневризмы псевдокисты поджелудочной железы. Разрыв псевдоаневризм является жизнеугрожающим состоянием, требующим выполнения ургентного оперативного пособия. Кроме того, висцеральные псевдоаневризмы могут являться источником рецидивирующего желудочно-кишечного кровотечения, диагностика которого является сложной задачей для хирурга. Для диагностики на сегодняшний день успешно применяют как селективное ангиографическое исследование, так и метод ангиографии. Необходимо отметить, что несмотря на то, что эндоваскулярные методики в настоящее время являются «золотым стандартом» лечения висцеральных псевдоаневризм, отсутствуют четкие указания относительно тактики лечения, а также остается неясной роль открытых хирургических вмешательств при данной патологии, что требует их дальнейшего изучения.
Цель. Анализ клинических и инструментальных особенностей диагностики ПСА. Демонстрация клинического наблюдения редкого источника кровотечения в желудочно-кишечный тракт из ПСА.
Материалы и методы. Представлен краткий анализ литературы с демонстрацией собственного клинического наблюдения пациента с рецидивирующими желудочно-кишечными кровотечениями на фоне ПСА.
Результаты. Демонстрация варианта эффективного лечения рецидивирующего желудочно-кишечного кровотечения на фоне ПСА.
Заключение. Кровотечение из ПСА до сих пор остается сложным в плане диагностики и лечения клиническим случаем, требующим от клиницистов особой внимательности и настороженности. В случае несвоевременного распознавания ее осложнения могут иметь фатальные последствия.
Ключевые слова: псевдоаневризма селезеночной артерии, желудочно-кишечное кровотечение, опухоль поджелудочной железы.
Для цитирования: Семенков А.В., Скугарев А.Л., Сетдикова Г.Р., Степанова Е.А., Болдырев М.А. Псевдоаневризма селезеночной артерии: краткий обзор литературы и клиническое наблюдение. Клинический разбор в общей медицине. 2024; 5 (11): 135–141. DOI: 10.47407/kr2024.5.11.00527
Актуальность. Псевдоаневризма селезеночной артерии (ПСА) – это редкая патология, имеющая большое клиническое значение. Аневризма селезеночной артерии является третьей по частоте встречаемости среди интраабдоминальных аневризм после аневризмы брюшной аорты и подвздошных артерий и составляет 60–70% от всех висцеральных аневризм. Хотя большинство аневризм селезеночной артерии бессимптомные и диагностируются случайно, ее разрыв как первое ее проявление встречается в 2–10% случаев и представляет собой фатальное осложнение. ПСА встречается гораздо реже, чем истинная аневризма, однако ее распространенность среди всех псевдоаневризм висцеральных ветвей достигает 27%; развивается чаще у мужчин, чем у женщин. Учитывая редкую встречаемость, которая часто сопровождается различной сопутствующей патологией, выбор вмешательства при псевдоаневризме, носящего в большинстве случаев безотлагательный характер, является трудной задачей. Хирургическое пособие в течение многих лет служило методом выбора. Однако за последнее десятилетие возросло количество эндоваскулярных вмешательств, проведенных у таких больных. Поскольку ПСА представляет собой редкое заболевание и большинство исследований являются ретроспективными и включают малое число пациентов, в настоящее время нет методов лечения с уровнем доказательности I. Среди возможных причин выделяют панкреатит, травму, послеоперационные осложнения и пептическую язву. В большинстве случаев их течение является бессимптомным, и они выявляются случайно при выполнении компьютерной или магнитно-резонансной томографии по поводу других заболеваний. ПСА практически всегда сопровождаются клиническими проявлениями, среди которых наиболее часто встречаются боль в животе (29,5%), гематохезия и мелена (26,2%), гематомезис (14,8%). Вторичное кровоизлияние из псевдоаневризм, как правило, происходит в брюшную полость, а также в вирсунгов проток, прилежащие органы (желудок, кишку) или в полость сформировавшейся вокруг ложной аневризмы псевдокисты поджелудочной железы. Разрыв псевдоаневризм является жизнеугрожающим состоянием, требующим выполнения ургентного оперативного пособия. Кроме того, висцеральные псевдоаневризмы могут являться источником рецидивирующего желудочно-кишечного кровотечения, диагностика которого является сложной задачей для хирурга. Для диагностики на сегодняшний день успешно применяют как селективное ангиографическое исследование, так и метод ангиографии. Необходимо отметить, что несмотря на то, что эндоваскулярные методики в настоящее время являются «золотым стандартом» лечения висцеральных псевдоаневризм, отсутствуют четкие указания относительно тактики лечения, а также остается неясной роль открытых хирургических вмешательств при данной патологии, что требует их дальнейшего изучения.
Цель. Анализ клинических и инструментальных особенностей диагностики ПСА. Демонстрация клинического наблюдения редкого источника кровотечения в желудочно-кишечный тракт из ПСА.
Материалы и методы. Представлен краткий анализ литературы с демонстрацией собственного клинического наблюдения пациента с рецидивирующими желудочно-кишечными кровотечениями на фоне ПСА.
Результаты. Демонстрация варианта эффективного лечения рецидивирующего желудочно-кишечного кровотечения на фоне ПСА.
Заключение. Кровотечение из ПСА до сих пор остается сложным в плане диагностики и лечения клиническим случаем, требующим от клиницистов особой внимательности и настороженности. В случае несвоевременного распознавания ее осложнения могут иметь фатальные последствия.
Ключевые слова: псевдоаневризма селезеночной артерии, желудочно-кишечное кровотечение, опухоль поджелудочной железы.
Для цитирования: Семенков А.В., Скугарев А.Л., Сетдикова Г.Р., Степанова Е.А., Болдырев М.А. Псевдоаневризма селезеночной артерии: краткий обзор литературы и клиническое наблюдение. Клинический разбор в общей медицине. 2024; 5 (11): 135–141. DOI: 10.47407/kr2024.5.11.00527
Review and Clinical Case
Mikhail А. Boldyrev3
1 Vladimirsky Moscow Regional Research Clinical Institute, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
3 Shumakov National Medical Research Center for Transplantology and Artificial Organs, Moscow, Russia
semenkov@inbox.ru
Abstract
Relevance. Splenic artery pseudoaneurysm (SAP) is a rare pathology of great clinical significance. Splenic artery aneurysm is the third most common intraabdominal aneurysm after abdominal aortic and iliac artery aneurysms and accounts for 60-70% of all visceral aneurysms.
Although most splenic artery aneurysms are asymptomatic and are diagnosed incidentally, its rupture as its first manifestation occurs in 2-10% of cases and is a fatal complication. SAP is much less common than true aneurysm, but its prevalence among all visceral branch pseudoaneurysms reaches 27%; it develops more often in men than in women. Given its rare occurrence, which is often accompanied by various concomitant pathologies, the choice of pseudoaneurysm intervention, which is urgent in most cases, is a difficult task. Surgery has been the method of choice for many years. However, the number of endovascular interventions performed in such patients has increased over the last decade. Because SAP is a rare disease and most studies are retrospective, involving a small number of patients, there are currently no Level I evidence-based treatments. Possible causes include pancreatitis, trauma, postoperative complications and peptic ulcer. In most cases, their course is asymptomatic and they are detected incidentally by computed tomography or magnetic resonance imaging for other diseases. SAP are almost always accompanied by clinical manifestations, with abdominal pain (29.5%), hematochezia and melena (26.2%), and hematomesis (14.8%) being the most common. Secondary hemorrhage from pseudoaneurysms usually occurs in the abdominal cavity, as well as in the viment duct, adjacent organs (stomach, intestine) or in the cavity of pancreatic pseudocyst formed around a false aneurysm Rupture of pseudoaneurysms is a life-threatening condition requiring urgent surgical intervention. Besides, visceral pseudo aneurysms may be the source of recurrent gastrointestinal bleeding, and their diagnosis is a difficult task for a surgeon. Currently, both selective angiographic examination and angiography are successfully used for diagnosis. It should be noted that despite the fact that endovascular techniques are currently the "gold standard" for treatment of visceral pseudoaneurysms, there are no clear guidelines regarding treatment tactics, and the role of open surgical interventions in this pathology remains unclear, which requires further study.
Aim. Analysis of clinical and instrumental features of diagnosis of SAP. Demonstration of clinical observation of a rare source of bleeding into the gastrointestinal tract from SAP.
Materials and methods. A brief review of the literature is presented with a demonstration of our own clinical observation of a patient with recurrent gastrointestinal bleeding against SAP.
Results. Demonstration of an option for effective treatment of recurrent gastrointestinal bleeding on the background of SAP.
Conclusion. Bleeding from SAP is still a difficult clinical case in terms of diagnosis and treatment, requiring special attention and vigilance from clinicians. In case of untimely recognition, its complications may have fatal consequences.
Keywords: splenic artery pseudoaneurysm, gastrointestinal bleeding, pancreatic tumor.
For citation: Semenkov A.V., Skugarev A.L., Setdikova G.R., Stepanova E.A., Boldyrev M.А. Pseudoaneurysm of splenic artery: literature review and clinical case. Clinical review for general practice. 2024; 5 (11): 135–141 (In Russ.). DOI: 10.47407/kr2024.5.11.00527
Одним из необычных источников ЖКК являются аневризмы висцеральных артерий, в первую очередь селезеночной (АСА), реже – общей печеночной, гастродуоденальной и левой желудочной артерии [1, 2], будучи довольно редким явлением (менее 0,8%, АСА занимают до 0,01% в общей популяции) [3–5]. Единственной манифестацией висцеральных аневризм служит мелена либо (реже) гематемезис [6]. В целом истинные аневризмы протекают бессимптомно [7], являясь случайной находкой во время проведения рутинных исследований (компьютерной – КТ и магнитно-резонансной томографии – МРТ). В большинстве описанных случаев кровотечения атеросклеротический генез (в старшей возрастной группе), фибромышечная дисплазия и сегментарный артериальный медиолиз являются ведущими причинами формирования истинных аневризм [6, 8].
Еще реже встречаются так называемые ложные, или псевдоаневризмы, которые, однако, чаще, чем истинные, являются источником кровотечения [9].
Псевдоаневризма селезеночной артерии (ПСА) встречается чаще, чем псевдоаневризма любых других висцеральных артерий [3, 9, 10], что отчасти связано с ее анатомическими особенностями – локализацией либо вблизи паренхимы поджелудочной железы (ПЖ), либо в ее толще. В этом случае острый либо хронический воспалительный процесс в ПЖ способствует повреждению стенки артерии панкреатическими ферментами, что ведет к образованию псевдоаневризмы [11]. Альтернативный вариант развития ПСА – разрушение стенки артерии панкреатическими ферментами, содержащимися в псевдокистах ПЖ с последующим образованием фистулы [12].
Кроме этого, ПСА может формироваться в результате травмы, а также при системных воспалительных заболеваниях, например склеродермии (вследствие повреждения vasa vasorum и ишемии сосудистой стенки) [1, 2, 10, 13]. В дальнейшем ПСА может служить источником ЖКК, что является наиболее распространенной клинической манифестацией [13].
Нестандартной клинической ситуацией и самым редким источником ЖКК из верхних отделов желудочно-кишечного тракта (в среднем 1 на 1500 случаев [14]) является кровотечение из ПСА в панкреатический проток и далее через фатеров сосочек двенадцатиперстной кишки в ее просвет [15, 16]. Реже источником кровотечения служит желудочная артерия, печеночная артерия, чревный ствол, гастродуоденальная артерия [9], опухоль ПЖ [17–19], истинная АСА (довольно редко) [20–23], локальный участок повреждения ятрогенного генеза [24, 25] и т.д. Для описания данного состояния было предложено несколько терминов – вирсунгоррагия (Van Kemmel, 1969), гемовирсунгия, гемодуктальный панкреатит (Longmire, Rose, 1973), однако наиболее распространенным является термин hemosuccus pancreaticus (НР), предложенный Sandblom в 1970 г. [14] Необходимо отметить, что кровотечение может также носить полостной (в свободную брюшную полость либо в сальниковую сумку) либо ретроперитонеальный (в ретропанкреатическую забрюшинную клетчатку) характер [14, 21, 26]. Кровотечению, как правило, предшествует боль по типу колики, иррадиирущая в спину, что связано с повышением давления в панкреатическом протоке из-за активного поступления в него крови [14], после чего нарастает симптомокомплекс, характерный для тяжелого ЖКК, вплоть до гиповолемического геморрагического шока [14, 26]. НР имеет интермиттирующий характер, связанный с периодической окклюзией панкреатического протока (либо, реже, ампулы фатерого соска/области конфлюенса общего желчного протока и панкреатического протока) тромботическими массами и тампонадой источника кровотечения [14]. У пациентов относительно редко может наблюдаться повышение панкреатических (липаза и амилаза) и печеночных ферментов в крови [15] и транзиторная желтуха (из-за окклюзии тромботическими массами общего желчного протока) [9, 14, 16].
Инструментальная диагностика основывается на стандартных диагностических процедурах у пациентов с ЖКК – фиброэзофагогастродуоденоскопии и колоноскопии. Иногда возникает необходимость выполнения более сложных диагностических методов: КТ-ангиографии с чувствительностью до 96% [14, 27], МРТ (главное преимущество – отсутствие необходимости контрастного усиления, однако подходит не для всех пациентов ввиду сложности проведения самого исследования [13]) и ангиографии (целиакографии) [9, 14, 28]. Диагноз является очевидным при визуализации кровотечения из фатерова сосочка, но, учитывая интермиттирующий характер кровотечения, диагностическая ценность данной находки составляет лишь 30% [14, 29]. На НР может указать наличие сгустков крови в 1 и 2 порции двенадцатиперстной кишки, а также выявление так называемого «сторожевого сгустка» [9, 30]. Визуализация аневризматического расширения селезеночной артерии (либо, реже, другой артерии), псевдокисты ПЖ при КТ либо МРТ вкупе с анамнезом острого или хронического панкреатита, возрастом (4–5-я декада жизни), полом (мужчины чаще женщин приблизительно в 5 раз) также могут оказаться полезными в дифференциальной диагностике НР [13, 14, 22, 27, 31].
УЗИ-доплерография может быть использована при диагностике НР с рядом ограничений (операторзависимая процедура, низкая эффективность при образованиях маленького размера, плохая визуализация селезеночной артерии ввиду возможного пневматоза кишки, атеросклероза и т.д.) [13, 14]. Несмотря на ценность вышеуказанных методов, «золотым стандартом» диагностики аневризм и кровотечения из них остается ангиография (чувствительность составляет 96%) [32], хотя связь аневризмы и панкреатического протока удается выявить не у всех пациентов [9].
В настоящее время не существует стандартизированного протокола лечения НР. Так как чаще всего этиологическим фактором кровотечения служит аррозия ПСА (реже – псевдоаневризмы других висцеральных артерий – чревной, левой желудочной), то первой ступенью лечения у гемодинамически стабильных пациентов является эндоваскулярная эмболизация селезеночной артерии c немедленным гемостазом 79–100% и общей эффективностью 67% [13, 14, 33]. К основным недостаткам метода относят возможность дистального смещения эмболов с развитием чаще всего инфаркта селезенки, риск реперфузии и рецидива кровотечения (в 12–20% случаев), а также невозможность выполнения эмболизации по техническим причинам [32, 34, 35]. Второй ступенью лечения (либо первой ступенью для гемодинамически нестабильных пациентов) является хирургическое вмешательство: традиционное либо лапароскопическое, заключающееся, в зависимости от ситуации, в хирургическом контроле кровотечения, резекции псевдокисты, дистальной резекции ПЖ либо (реже) панкреатодуоденальной резекции [14, 15, 33].
Редко, при невозможности лигирования, можно прибегнуть к лигированию селезеночной артерии и дренированию псевдокисты, однако риск рецидива в такой ситуации довольно высок [14]. В ряде случаев операция может нести определенные риски, в случае, например, кровотечения на фоне острого панкреатита. Эффективность хирургического лечения составляет 70–85%, однако летальность остается высокой и составляет от 10 до 50%, а риск рецидива кровотечения – от 0 до 5% [28]. При отсутствии своевременной диагностики и лечения риск смерти увеличивается до 90% [2, 36].
Таким образом, ввиду редкой встречаемости и, как следствие, ограниченного количества информации и публикаций (которые, как правило, представляют собой описание случая либо серию случаев) НР до сих пор остается сложным в плане диагностики и лечения клиническим случаем, требующим от клиницистов особой внимательности и настороженности. Очевидна необходимость в дальнейших исследованиях для создания единого алгоритма диагностики и лечения НР.
При видеодуоденоскопии в области устья большого дуоденального сосочка определяются небольшие фиксированные темно-вишневые сгустки крови. Картина состоявшегося ЖКК из большого дуоденального сосочка. На момент осмотра данных в пользу продолжающегося кровотечения не выявлено.
При КТ органов брюшной полости с внутривенным контрастированием (рис. 1, 2): на границе тела и хвоста ПЖ визуализирован участок неоднородно пониженной плотности с нечеткими контурами размерами 16×23×18 мм, слабо негомогенно накапливающий контрастный препарат. Вирсунгов проток выражен неравномерно, заметно не расширен. Селезенка в размерах не увеличена, на уровне передне-верхних отделов визуализируются участки пониженной плотности с нечеткими контурами, без заметного накопления контрастного препарата. Выявлена АСА диаметром до 6 мм. Селезеночная вена не контрастируется (тромбоз).
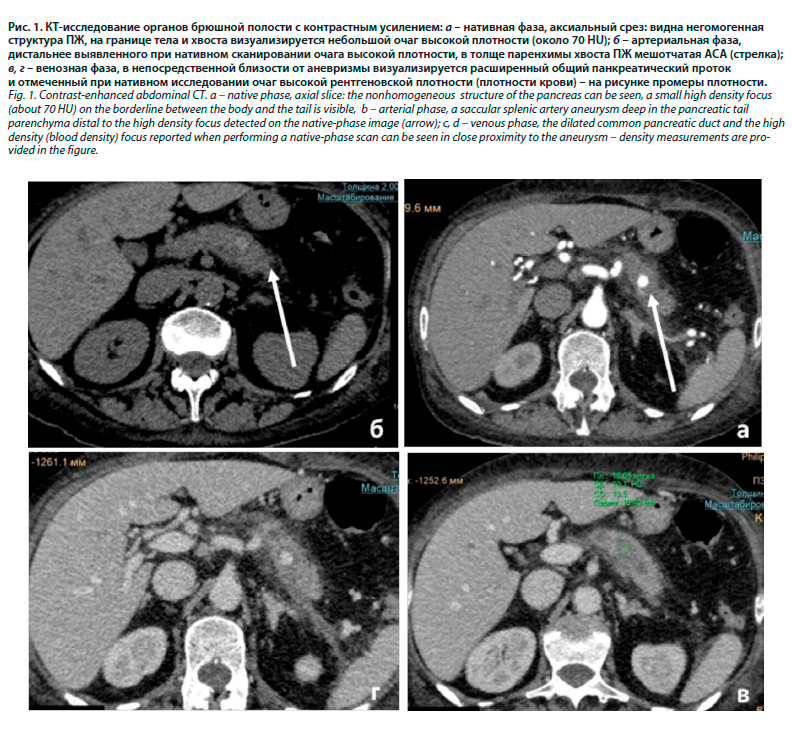
 Заключение: КТ-картину изменений ПЖ с наличием участков неоднородно пониженной плотности на границе тела и хвоста следует дифференцировать между проявлением панкреонекроза и опухолевым процессом с вовлечением селезеночной вены. Участки пониженной плотности в селезенке – вероятно, участки инфаркта. АСА. Уровень онкомаркеров СА 19-9, РЭА – в пределах референсных значений. За период госпитализации в динамике отмечена клиническая картина рецидивирующих ЖКК. Лабораторно – анемия средней, тяжелой степени (гемоглобин в пределах 67–97 г/л) на фоне повторных гемотрансфузий. Учитывая клиническую картину рецидивирующего ЖКК с наличием в дифференциально-диагностическом ряду потенциально резектабельной опухоли хвоста ПЖ, принято решение от выполнения эмболизации отказаться в пользу радикального хирургического лечения.
Заключение: КТ-картину изменений ПЖ с наличием участков неоднородно пониженной плотности на границе тела и хвоста следует дифференцировать между проявлением панкреонекроза и опухолевым процессом с вовлечением селезеночной вены. Участки пониженной плотности в селезенке – вероятно, участки инфаркта. АСА. Уровень онкомаркеров СА 19-9, РЭА – в пределах референсных значений. За период госпитализации в динамике отмечена клиническая картина рецидивирующих ЖКК. Лабораторно – анемия средней, тяжелой степени (гемоглобин в пределах 67–97 г/л) на фоне повторных гемотрансфузий. Учитывая клиническую картину рецидивирующего ЖКК с наличием в дифференциально-диагностическом ряду потенциально резектабельной опухоли хвоста ПЖ, принято решение от выполнения эмболизации отказаться в пользу радикального хирургического лечения.
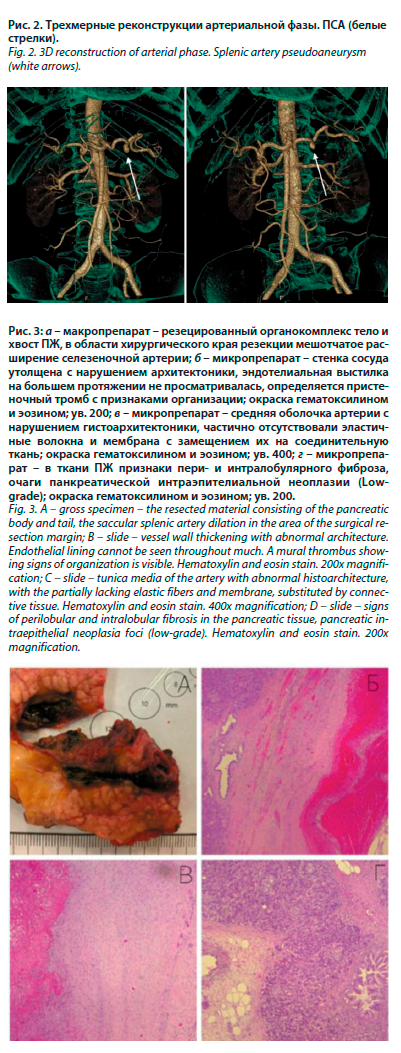
Интраоперационно при ревизии выявлено наличие плотного инфильтрата парапанкреатической клетчатки с участками стеатонекроза, распространяющегося по ходу селезеночных сосудов. Аневризматическое расширение селезеночной артерии расположено в толще паренхимы хвоста ПЖ. Выполнено хирургическое вмешательство в объеме дистальной резекции ПЖ.
При макроскопическом исследовании полученного при оперативном вмешательстве материала – органокомплекс представлен телом и хвостом ПЖ с прилежащей селезенкой. Тело и хвост размером 5,0×4,0×3,0 см. Главный панкреатический проток диаметром 0,3 см, проходим. На разрезе железа дольчатая, желтоватого цвета, с очаговым липоматозом. На уровне хирургического края резекции ПЖ отмечается мешотчатое расширение селезеночной артерии до 1,5 см с прилежащим пристеночным тромбом (рис. 3, а.) На остальном протяжении артерия с многочисленными кровянистыми наложениями. Селезенка размером 10,0×7,0×2,0 см, на разрезе вишневого цвета, соскоба пульпы не дает. При микроскопическом исследовании стенка сосуда утолщена с нарушением архитектоники. Эндотелиальная выстилка на большем протяжении не просматривалась. В медии частично отсутствовали эластичные волокна и мембрана, с замещением их на соединительную ткань. В участках микротравм определялись скопления макрофагов, элементы хронического воспаления, гемосидерин. Пристеночный тромб с признаками организации. В окружающей ткани ПЖ признаки пери- и интралобулярного фиброза, очаги панкреатической интраэпителиальной неоплазии (Low-grade), липоматоз (рис. 3, б–г).
Послеоперационный период протекал без осложнений. В удовлетворительном состоянии пациентка выписана из стационара на 7-е сутки после операции.
В последующем рецидивов ЖКК не отмечалось.
В представленном наблюдении проведенный комплекс инструментальных исследований не обладал достаточной специфичностью для постановки окончательного диагноза до проведения оперативного вмешательства. По данным инструментальных методов обследования одним из дифференциальных диагнозов была резектабельная опухоль на границе тела и хвоста ПЖ. Согласно рекомендациям Ассоциации онкологов России, у пациентов с раком ПЖ при резектабельности рекомендуется на первом этапе проведение хирургического лечения с соблюдением онкологических принципов. Консервативное лечение показало свою неэффективность в связи с рецидивом ЖКК, поэтому хирургическое вмешательство было единственной опцией, позволяющей не только ликвидировать источник кровотечения, но и поставить окончательный диагноз.
Конфликт интересов. Авторы заявляет об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Семенков Алексей Владимирович – д-р мед. наук, рук. онкологического отд-ния хирургических методов лечения ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского», проф. каф. онкологии радиотерапии и реконструктивной хирургии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: semenkov@inbox.ru; ORCID: 0000-0002-7365-6081
Alexey V. Semenkov – D. Sci. (Med.), Professor, Vladimirsky Moscow Regional Research Clinical Institute, Sechenov First Moscow State Medical University (Sechenov University). E-mail: semenkov@inbox.ru; ORCID: 0000-0002-7365-6081
Скугарев Александр Львович – врач-онколог онкологического отд-ния хирургических методов лечения ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: skugarev90@yandex.ru; ORCID: 0000-0002-0522-3508
Alexander L. Skugarev – oncologist, Vladimirsky Moscow Regional Research Clinical Institute. E-mail: skugarev90@yandex.ru;
ORCID: 0000-0002-0522-3508
Сетдикова Галия Равилевна – рук. отд-ния морфологической диагностики отд. онкологии ГБУЗ МО «МОНИКИ им.
М.Ф. Владимирского». E-mail: dr.setdikоva@mail.ru; ORCID: 0000-0002-5262-4953
Galiya R. Setdikova – department head, Vladimirsky Moscow Regional Research Clinical Institute. E-mail: dr.setdikоva@mail.ru;
ORCID: 0000-0002-5262-4953
Степанова Елена Александровна – д-р мед. наук, рук. отд. лучевой диагностики ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: stepanovamoniki@gmail.com; ORCID: 0000-0002-9037-0034
Elena A. Stepanova – D. Sci. (Med.), Vladimirsky Moscow Regional Research Clinical Institute. E-mail: stepanovamoniki@gmail.com; ORCID: 0000-0002-9037-0034
Болдырев Михаил Александрович – ординатор ФГБУ «НМИЦ ТИО им. акад. В.И. Шумакова». E-mail: comex.ksb@gmail.com;
ORCID: 0000-0003-4048-3564
Mikhail А. Boldyrev – resident, Shumakov National Medical Research Center for Transplantology and Artificial Organs. E-mail: comex.ksb@gmail.com; ORCID: 0000-0003-4048-3564
Поступила в редакцию: 10.10.2024
Поступила после рецензирования: 18.10.2024
Принята к публикации: 24.10.2024
Received: 10.10.2024
Revised: 18.10.2024
Accepted: 24.10.2024
Pseudoaneurysm of splenic artery: literature review and clinical case
Alexey V. Semenkov1,2, Alexander L. Skugarev1, Galiya R. Setdikova1, Elena A. Stepanova1,Mikhail А. Boldyrev3
1 Vladimirsky Moscow Regional Research Clinical Institute, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
3 Shumakov National Medical Research Center for Transplantology and Artificial Organs, Moscow, Russia
semenkov@inbox.ru
Abstract
Relevance. Splenic artery pseudoaneurysm (SAP) is a rare pathology of great clinical significance. Splenic artery aneurysm is the third most common intraabdominal aneurysm after abdominal aortic and iliac artery aneurysms and accounts for 60-70% of all visceral aneurysms.
Although most splenic artery aneurysms are asymptomatic and are diagnosed incidentally, its rupture as its first manifestation occurs in 2-10% of cases and is a fatal complication. SAP is much less common than true aneurysm, but its prevalence among all visceral branch pseudoaneurysms reaches 27%; it develops more often in men than in women. Given its rare occurrence, which is often accompanied by various concomitant pathologies, the choice of pseudoaneurysm intervention, which is urgent in most cases, is a difficult task. Surgery has been the method of choice for many years. However, the number of endovascular interventions performed in such patients has increased over the last decade. Because SAP is a rare disease and most studies are retrospective, involving a small number of patients, there are currently no Level I evidence-based treatments. Possible causes include pancreatitis, trauma, postoperative complications and peptic ulcer. In most cases, their course is asymptomatic and they are detected incidentally by computed tomography or magnetic resonance imaging for other diseases. SAP are almost always accompanied by clinical manifestations, with abdominal pain (29.5%), hematochezia and melena (26.2%), and hematomesis (14.8%) being the most common. Secondary hemorrhage from pseudoaneurysms usually occurs in the abdominal cavity, as well as in the viment duct, adjacent organs (stomach, intestine) or in the cavity of pancreatic pseudocyst formed around a false aneurysm Rupture of pseudoaneurysms is a life-threatening condition requiring urgent surgical intervention. Besides, visceral pseudo aneurysms may be the source of recurrent gastrointestinal bleeding, and their diagnosis is a difficult task for a surgeon. Currently, both selective angiographic examination and angiography are successfully used for diagnosis. It should be noted that despite the fact that endovascular techniques are currently the "gold standard" for treatment of visceral pseudoaneurysms, there are no clear guidelines regarding treatment tactics, and the role of open surgical interventions in this pathology remains unclear, which requires further study.
Aim. Analysis of clinical and instrumental features of diagnosis of SAP. Demonstration of clinical observation of a rare source of bleeding into the gastrointestinal tract from SAP.
Materials and methods. A brief review of the literature is presented with a demonstration of our own clinical observation of a patient with recurrent gastrointestinal bleeding against SAP.
Results. Demonstration of an option for effective treatment of recurrent gastrointestinal bleeding on the background of SAP.
Conclusion. Bleeding from SAP is still a difficult clinical case in terms of diagnosis and treatment, requiring special attention and vigilance from clinicians. In case of untimely recognition, its complications may have fatal consequences.
Keywords: splenic artery pseudoaneurysm, gastrointestinal bleeding, pancreatic tumor.
For citation: Semenkov A.V., Skugarev A.L., Setdikova G.R., Stepanova E.A., Boldyrev M.А. Pseudoaneurysm of splenic artery: literature review and clinical case. Clinical review for general practice. 2024; 5 (11): 135–141 (In Russ.). DOI: 10.47407/kr2024.5.11.00527
Введение
Желудочно-кишечное кровотечение (ЖКК) является грозным осложнением целого ряда заболеваний и синдромов и без соответствующего вмешательства может привести к гибели пациента. Основным тактическим моментом в лечении является достижение контроля источника кровотечения различными малоинвазивными способами либо с помощью традиционных открытых вмешательств. Однако в ряде случаев источник кровотечения остается неизвестным, несмотря на проведение всех стандартных диагностических процедур, что подвергает пациентов большому риску возобновления кровотечения. Выявление источника кровотечения в подобных ситуациях остается сложной клинической задачей, требующей мультидисциплинарного подхода и широкого кругозора специалистов.Одним из необычных источников ЖКК являются аневризмы висцеральных артерий, в первую очередь селезеночной (АСА), реже – общей печеночной, гастродуоденальной и левой желудочной артерии [1, 2], будучи довольно редким явлением (менее 0,8%, АСА занимают до 0,01% в общей популяции) [3–5]. Единственной манифестацией висцеральных аневризм служит мелена либо (реже) гематемезис [6]. В целом истинные аневризмы протекают бессимптомно [7], являясь случайной находкой во время проведения рутинных исследований (компьютерной – КТ и магнитно-резонансной томографии – МРТ). В большинстве описанных случаев кровотечения атеросклеротический генез (в старшей возрастной группе), фибромышечная дисплазия и сегментарный артериальный медиолиз являются ведущими причинами формирования истинных аневризм [6, 8].
Еще реже встречаются так называемые ложные, или псевдоаневризмы, которые, однако, чаще, чем истинные, являются источником кровотечения [9].
Псевдоаневризма селезеночной артерии (ПСА) встречается чаще, чем псевдоаневризма любых других висцеральных артерий [3, 9, 10], что отчасти связано с ее анатомическими особенностями – локализацией либо вблизи паренхимы поджелудочной железы (ПЖ), либо в ее толще. В этом случае острый либо хронический воспалительный процесс в ПЖ способствует повреждению стенки артерии панкреатическими ферментами, что ведет к образованию псевдоаневризмы [11]. Альтернативный вариант развития ПСА – разрушение стенки артерии панкреатическими ферментами, содержащимися в псевдокистах ПЖ с последующим образованием фистулы [12].
Кроме этого, ПСА может формироваться в результате травмы, а также при системных воспалительных заболеваниях, например склеродермии (вследствие повреждения vasa vasorum и ишемии сосудистой стенки) [1, 2, 10, 13]. В дальнейшем ПСА может служить источником ЖКК, что является наиболее распространенной клинической манифестацией [13].
Нестандартной клинической ситуацией и самым редким источником ЖКК из верхних отделов желудочно-кишечного тракта (в среднем 1 на 1500 случаев [14]) является кровотечение из ПСА в панкреатический проток и далее через фатеров сосочек двенадцатиперстной кишки в ее просвет [15, 16]. Реже источником кровотечения служит желудочная артерия, печеночная артерия, чревный ствол, гастродуоденальная артерия [9], опухоль ПЖ [17–19], истинная АСА (довольно редко) [20–23], локальный участок повреждения ятрогенного генеза [24, 25] и т.д. Для описания данного состояния было предложено несколько терминов – вирсунгоррагия (Van Kemmel, 1969), гемовирсунгия, гемодуктальный панкреатит (Longmire, Rose, 1973), однако наиболее распространенным является термин hemosuccus pancreaticus (НР), предложенный Sandblom в 1970 г. [14] Необходимо отметить, что кровотечение может также носить полостной (в свободную брюшную полость либо в сальниковую сумку) либо ретроперитонеальный (в ретропанкреатическую забрюшинную клетчатку) характер [14, 21, 26]. Кровотечению, как правило, предшествует боль по типу колики, иррадиирущая в спину, что связано с повышением давления в панкреатическом протоке из-за активного поступления в него крови [14], после чего нарастает симптомокомплекс, характерный для тяжелого ЖКК, вплоть до гиповолемического геморрагического шока [14, 26]. НР имеет интермиттирующий характер, связанный с периодической окклюзией панкреатического протока (либо, реже, ампулы фатерого соска/области конфлюенса общего желчного протока и панкреатического протока) тромботическими массами и тампонадой источника кровотечения [14]. У пациентов относительно редко может наблюдаться повышение панкреатических (липаза и амилаза) и печеночных ферментов в крови [15] и транзиторная желтуха (из-за окклюзии тромботическими массами общего желчного протока) [9, 14, 16].
Инструментальная диагностика основывается на стандартных диагностических процедурах у пациентов с ЖКК – фиброэзофагогастродуоденоскопии и колоноскопии. Иногда возникает необходимость выполнения более сложных диагностических методов: КТ-ангиографии с чувствительностью до 96% [14, 27], МРТ (главное преимущество – отсутствие необходимости контрастного усиления, однако подходит не для всех пациентов ввиду сложности проведения самого исследования [13]) и ангиографии (целиакографии) [9, 14, 28]. Диагноз является очевидным при визуализации кровотечения из фатерова сосочка, но, учитывая интермиттирующий характер кровотечения, диагностическая ценность данной находки составляет лишь 30% [14, 29]. На НР может указать наличие сгустков крови в 1 и 2 порции двенадцатиперстной кишки, а также выявление так называемого «сторожевого сгустка» [9, 30]. Визуализация аневризматического расширения селезеночной артерии (либо, реже, другой артерии), псевдокисты ПЖ при КТ либо МРТ вкупе с анамнезом острого или хронического панкреатита, возрастом (4–5-я декада жизни), полом (мужчины чаще женщин приблизительно в 5 раз) также могут оказаться полезными в дифференциальной диагностике НР [13, 14, 22, 27, 31].
УЗИ-доплерография может быть использована при диагностике НР с рядом ограничений (операторзависимая процедура, низкая эффективность при образованиях маленького размера, плохая визуализация селезеночной артерии ввиду возможного пневматоза кишки, атеросклероза и т.д.) [13, 14]. Несмотря на ценность вышеуказанных методов, «золотым стандартом» диагностики аневризм и кровотечения из них остается ангиография (чувствительность составляет 96%) [32], хотя связь аневризмы и панкреатического протока удается выявить не у всех пациентов [9].
В настоящее время не существует стандартизированного протокола лечения НР. Так как чаще всего этиологическим фактором кровотечения служит аррозия ПСА (реже – псевдоаневризмы других висцеральных артерий – чревной, левой желудочной), то первой ступенью лечения у гемодинамически стабильных пациентов является эндоваскулярная эмболизация селезеночной артерии c немедленным гемостазом 79–100% и общей эффективностью 67% [13, 14, 33]. К основным недостаткам метода относят возможность дистального смещения эмболов с развитием чаще всего инфаркта селезенки, риск реперфузии и рецидива кровотечения (в 12–20% случаев), а также невозможность выполнения эмболизации по техническим причинам [32, 34, 35]. Второй ступенью лечения (либо первой ступенью для гемодинамически нестабильных пациентов) является хирургическое вмешательство: традиционное либо лапароскопическое, заключающееся, в зависимости от ситуации, в хирургическом контроле кровотечения, резекции псевдокисты, дистальной резекции ПЖ либо (реже) панкреатодуоденальной резекции [14, 15, 33].
Редко, при невозможности лигирования, можно прибегнуть к лигированию селезеночной артерии и дренированию псевдокисты, однако риск рецидива в такой ситуации довольно высок [14]. В ряде случаев операция может нести определенные риски, в случае, например, кровотечения на фоне острого панкреатита. Эффективность хирургического лечения составляет 70–85%, однако летальность остается высокой и составляет от 10 до 50%, а риск рецидива кровотечения – от 0 до 5% [28]. При отсутствии своевременной диагностики и лечения риск смерти увеличивается до 90% [2, 36].
Таким образом, ввиду редкой встречаемости и, как следствие, ограниченного количества информации и публикаций (которые, как правило, представляют собой описание случая либо серию случаев) НР до сих пор остается сложным в плане диагностики и лечения клиническим случаем, требующим от клиницистов особой внимательности и настороженности. Очевидна необходимость в дальнейших исследованиях для создания единого алгоритма диагностики и лечения НР.
Клиническое наблюдение
Женщина 62 лет поступила в хирургический стационар по месту жительства с клинической картиной ЖКК. При первичном обследовании выявлена анемия тяжелой степени тяжести, потребовавшая трансфузии компонентов крови. Эндоскопические признаки геморрагического гастрита. По данным МРТ-исследования: ПЖ увеличена в области тела и хвоста; на границе тела и хвоста определяется образование с неровными контурами неоднородной структуры 11×13 мм. Вирсунгов проток на этом уровне расширен и деформирован. После внутривенного контрастирования отмечено интенсивное неравномерное накопление контрастного вещества стенками выявленного образования. МР-картина интерпретирована как наличие внутрипротоковой папиллярной муцинозной опухоли (IPNM-карциномы) ПЖ. В связи с полученными данными, выявлением объемного образования хвоста ПЖ пациентка была переведена в онкологическое отделение хирургических методов лечения ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». При дополнительном обследовании по данным эзофагогастродуоденоскопии в антральном отделе желудка определяются темно-вишневые сгустки в небольшом количестве, выступающие из луковицы двенадцатиперстной кишки. Последняя не деформирована. Слизистая оболочка желудка бледная, бархатистая, дефектов слизистой оболочки не найдено. В постбульбарных отделах также выявлены темно-вишневые сгустки крови. Слизистая двенадцатиперстной кишки бледная, бархатистая, дефектов слизистой оболочки не обнаружено.При видеодуоденоскопии в области устья большого дуоденального сосочка определяются небольшие фиксированные темно-вишневые сгустки крови. Картина состоявшегося ЖКК из большого дуоденального сосочка. На момент осмотра данных в пользу продолжающегося кровотечения не выявлено.
При КТ органов брюшной полости с внутривенным контрастированием (рис. 1, 2): на границе тела и хвоста ПЖ визуализирован участок неоднородно пониженной плотности с нечеткими контурами размерами 16×23×18 мм, слабо негомогенно накапливающий контрастный препарат. Вирсунгов проток выражен неравномерно, заметно не расширен. Селезенка в размерах не увеличена, на уровне передне-верхних отделов визуализируются участки пониженной плотности с нечеткими контурами, без заметного накопления контрастного препарата. Выявлена АСА диаметром до 6 мм. Селезеночная вена не контрастируется (тромбоз).

 Заключение: КТ-картину изменений ПЖ с наличием участков неоднородно пониженной плотности на границе тела и хвоста следует дифференцировать между проявлением панкреонекроза и опухолевым процессом с вовлечением селезеночной вены. Участки пониженной плотности в селезенке – вероятно, участки инфаркта. АСА. Уровень онкомаркеров СА 19-9, РЭА – в пределах референсных значений. За период госпитализации в динамике отмечена клиническая картина рецидивирующих ЖКК. Лабораторно – анемия средней, тяжелой степени (гемоглобин в пределах 67–97 г/л) на фоне повторных гемотрансфузий. Учитывая клиническую картину рецидивирующего ЖКК с наличием в дифференциально-диагностическом ряду потенциально резектабельной опухоли хвоста ПЖ, принято решение от выполнения эмболизации отказаться в пользу радикального хирургического лечения.
Заключение: КТ-картину изменений ПЖ с наличием участков неоднородно пониженной плотности на границе тела и хвоста следует дифференцировать между проявлением панкреонекроза и опухолевым процессом с вовлечением селезеночной вены. Участки пониженной плотности в селезенке – вероятно, участки инфаркта. АСА. Уровень онкомаркеров СА 19-9, РЭА – в пределах референсных значений. За период госпитализации в динамике отмечена клиническая картина рецидивирующих ЖКК. Лабораторно – анемия средней, тяжелой степени (гемоглобин в пределах 67–97 г/л) на фоне повторных гемотрансфузий. Учитывая клиническую картину рецидивирующего ЖКК с наличием в дифференциально-диагностическом ряду потенциально резектабельной опухоли хвоста ПЖ, принято решение от выполнения эмболизации отказаться в пользу радикального хирургического лечения.Интраоперационно при ревизии выявлено наличие плотного инфильтрата парапанкреатической клетчатки с участками стеатонекроза, распространяющегося по ходу селезеночных сосудов. Аневризматическое расширение селезеночной артерии расположено в толще паренхимы хвоста ПЖ. Выполнено хирургическое вмешательство в объеме дистальной резекции ПЖ.
При макроскопическом исследовании полученного при оперативном вмешательстве материала – органокомплекс представлен телом и хвостом ПЖ с прилежащей селезенкой. Тело и хвост размером 5,0×4,0×3,0 см. Главный панкреатический проток диаметром 0,3 см, проходим. На разрезе железа дольчатая, желтоватого цвета, с очаговым липоматозом. На уровне хирургического края резекции ПЖ отмечается мешотчатое расширение селезеночной артерии до 1,5 см с прилежащим пристеночным тромбом (рис. 3, а.) На остальном протяжении артерия с многочисленными кровянистыми наложениями. Селезенка размером 10,0×7,0×2,0 см, на разрезе вишневого цвета, соскоба пульпы не дает. При микроскопическом исследовании стенка сосуда утолщена с нарушением архитектоники. Эндотелиальная выстилка на большем протяжении не просматривалась. В медии частично отсутствовали эластичные волокна и мембрана, с замещением их на соединительную ткань. В участках микротравм определялись скопления макрофагов, элементы хронического воспаления, гемосидерин. Пристеночный тромб с признаками организации. В окружающей ткани ПЖ признаки пери- и интралобулярного фиброза, очаги панкреатической интраэпителиальной неоплазии (Low-grade), липоматоз (рис. 3, б–г).
Послеоперационный период протекал без осложнений. В удовлетворительном состоянии пациентка выписана из стационара на 7-е сутки после операции.
В последующем рецидивов ЖКК не отмечалось.
Обсуждение
От 1,2 до 7,5% из всех случаев острого панкреатита может реализоваться в развитие ПСА. ПСА практически всегда сопровождаются клиническими проявлениями, среди которых наиболее часто встречаются боль в животе (29,5%), гематохезия и мелена (26,2%), гематомезис (14,8%). Вторичное кровоизлияние из псевдоаневризм, как правило, происходит в брюшную полость, а также в вирсунгов проток, прилежащие органы (желудок, кишку) или в полость сформировавшейся вокруг ложной аневризмы псевдокисты ПЖ. Разрыв псевдоаневризм является жизнеугрожающим состоянием, требующим выполнения ургентного оперативного пособия.В представленном наблюдении проведенный комплекс инструментальных исследований не обладал достаточной специфичностью для постановки окончательного диагноза до проведения оперативного вмешательства. По данным инструментальных методов обследования одним из дифференциальных диагнозов была резектабельная опухоль на границе тела и хвоста ПЖ. Согласно рекомендациям Ассоциации онкологов России, у пациентов с раком ПЖ при резектабельности рекомендуется на первом этапе проведение хирургического лечения с соблюдением онкологических принципов. Консервативное лечение показало свою неэффективность в связи с рецидивом ЖКК, поэтому хирургическое вмешательство было единственной опцией, позволяющей не только ликвидировать источник кровотечения, но и поставить окончательный диагноз.
Заключение
Кровотечение из ПСА до сих пор остается сложной в плане диагностики и лечения клинической ситуацией, требующей от клиницистов особой внимательности и настороженности. В случае несвоевременной диагностики ее осложнения могут иметь фатальные последствия. Поэтому даже случайная находка при плановом медицинском обследовании должна быть стимулом для обсуждения многопрофильной командой специалистов и выработки индивидуального плана активной хирургической тактики.Конфликт интересов. Авторы заявляет об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Семенков Алексей Владимирович – д-р мед. наук, рук. онкологического отд-ния хирургических методов лечения ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского», проф. каф. онкологии радиотерапии и реконструктивной хирургии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: semenkov@inbox.ru; ORCID: 0000-0002-7365-6081
Alexey V. Semenkov – D. Sci. (Med.), Professor, Vladimirsky Moscow Regional Research Clinical Institute, Sechenov First Moscow State Medical University (Sechenov University). E-mail: semenkov@inbox.ru; ORCID: 0000-0002-7365-6081
Скугарев Александр Львович – врач-онколог онкологического отд-ния хирургических методов лечения ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: skugarev90@yandex.ru; ORCID: 0000-0002-0522-3508
Alexander L. Skugarev – oncologist, Vladimirsky Moscow Regional Research Clinical Institute. E-mail: skugarev90@yandex.ru;
ORCID: 0000-0002-0522-3508
Сетдикова Галия Равилевна – рук. отд-ния морфологической диагностики отд. онкологии ГБУЗ МО «МОНИКИ им.
М.Ф. Владимирского». E-mail: dr.setdikоva@mail.ru; ORCID: 0000-0002-5262-4953
Galiya R. Setdikova – department head, Vladimirsky Moscow Regional Research Clinical Institute. E-mail: dr.setdikоva@mail.ru;
ORCID: 0000-0002-5262-4953
Степанова Елена Александровна – д-р мед. наук, рук. отд. лучевой диагностики ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: stepanovamoniki@gmail.com; ORCID: 0000-0002-9037-0034
Elena A. Stepanova – D. Sci. (Med.), Vladimirsky Moscow Regional Research Clinical Institute. E-mail: stepanovamoniki@gmail.com; ORCID: 0000-0002-9037-0034
Болдырев Михаил Александрович – ординатор ФГБУ «НМИЦ ТИО им. акад. В.И. Шумакова». E-mail: comex.ksb@gmail.com;
ORCID: 0000-0003-4048-3564
Mikhail А. Boldyrev – resident, Shumakov National Medical Research Center for Transplantology and Artificial Organs. E-mail: comex.ksb@gmail.com; ORCID: 0000-0003-4048-3564
Поступила в редакцию: 10.10.2024
Поступила после рецензирования: 18.10.2024
Принята к публикации: 24.10.2024
Received: 10.10.2024
Revised: 18.10.2024
Accepted: 24.10.2024
Список исп. литературыСкрыть список1. Tessier DJ, Stone WM, Fowl RJ. Clinical features and management of splenic artery pseudoaneurysm: case series and cumulative review of literature. J Vasc Surg 2003;38(5):969-74.
2. Manoj K, Hatimi H, Kumar P et al. An innovative modification of sandwich embolization technique for simultaneous management of ruptured pseudoaneurysm of branch of splenic artery and hypersplenism syndrome. Indian J Gastroenterol 2015;34(2):178-81
3. Sticco A, Aggarwal A, Shapiro M et al. A comparison of open and endovascular treatment strategies for the management of splenic artery aneurysms. Vascular 2016;24(5):487-91.
4. Reed NR, Oderich GS, Manunga J et al. Feasibility of endovascular repair of splenic artery aneurysms using stent grafts. J Vasc Surg 2015;62(6):1504-10.
5. Ayalon A, Wiesner RH, Perkins JD et al. Splenic artery aneurysms in liver transplant patients. Transplantation 1988;(45):386-8.
6. Sul HR, Lee HW, Kim JW et al. Endovascular management of hemosuccus pancreaticus, a rare case report of gastrointestinal bleeding. BMC Gastroenterol 2016;(16):5.
7. Etienn ES, Pessaux P, Tuech JJ et al. Hemosuccus pancreaticus: a rare cause of gastrointestinal bleeding. A series of 9 cases. Gastroenterol Clin Biol 2005;(29):237-42.
8. Patel R, Girgis M. Splenic artery pseudoaneurysm with hemosuccus pancreaticus requiring multimodal treatment. J Vasc Surg 2019;69(2):592-5.
9. Sadhu S, Sarkar S, Verma R et al. Haemosuccus pancreaticus due to true splenic artery aneurysm: a rare cause of massive upper gastrointestinal bleeding. J Surg Case Rep 2010;(5):4.
10. Schatz RA, Schabel S, Rockey DC. Idiopathic splenic artery pseudoaneurysm rupture as an uncommon cause of hemorrahagic shock. J Investig Med High Impact Case Rep 2015;3(2):1-5.
11. Puri S, Nicholson AA, Breen DJ. Percutaneous thrombin injection for the treatment of a post-pancreatitis pseudoaneurysm. Eur Radiol 2003;13(Suppl.4):L79-L82.
12. Kapoor S, Rao P, Pal S, Chattopadhyay TK. Hemosuccus pancreaticus: an uncommon cause of gastrointestinal hemorrhage. A case report.
J Pancreas 2004;(5):373-6.
13. Prette PR et al. Tratamento endovascular da hemorragia digestiva aguda por volumoso pseudoaneurisma esplênico: relato de caso e revisão da literature. J Vasc Brasileiro 2018;17(3):234-42.
14. Yu P, Gong J. Hemosuccus pancreaticus: A mini-review. Ann Med Surg (Lond) 2018;(28):45-8.
15. Mohan SC, Srinivasan S, Paul SPL et al. Hemosuccus pancreatitis due to a ruptured splenic artery pseudoaneurysm – diagnosis and endovascular management. J Radiol Case Rep 2020;14(5):7-15.
16. Massani M, Bridda A, Caratozzolo E et al. Hemosuccus Pancreaticus Due to Primary Splenic Artery Aneurysm: A Diagnostic and Therapeutic Challenge. J Pancreas 2009;10(1):48-52.
17. Shinzeki M, Hori Y, Fujino Y et al. Mucinous cystic neoplasm of the pancreas presenting with hemosuccus pancreaticus: report of a case. Surg Today 2010;40(5):470-3.
18. Shan YS, Sy ED, Tsai HM. Chronic hemosuccus pancreaticus: a rare complication of pancreatic microcystic adenoma successfully treated with Whipple’s procedure. Pancreas 2000;(20):416-8.
19. Kuruma S, Kamisawa T, Tu Y et al. Hemosuccus pancreaticus due to intraductal papillary-mucinous carcinoma of the pancreas. Clin J Gastroenterol 2009;(2):27-9.
20. Wagner WH, Cossman DV, Treiman RL et al. Hemosuccus pancreaticus from intraductal rupture of a primary splenic artery aneurysm. J Vasc Surg 1994;(19):158-64.
21. Han B, Song ZF, Sun B. Hemosuccus pancreaticus: a rare cause of gastrointestinal bleeding. Hepatobiliary Pancreat Dis Int 2012;(11):479-88.
22. Rammohan A, Palaniappan R, Ramaswami S et al. Hemosuccus pancreaticus: 15 year experience from a tertiary care GI bleed centre. ISRN Radiol 2013;p.191794.
23. Morare NMT, Bosman C, Ogunrombi AB. Splenic artery aneurysm as a rare cause of an upper GIT bleed. BMJ Case Rep 2019;(12):e232383.
24. Kim SS, Roberts RR, Nagy KK et al. Hemosuccus pancreaticus after penetrating trauma to the abdomen. J Trauma 2000;(49):948-50.
25. Cheruvattath R. Hemosuccus pancreaticus after EUS-FNA of a pancreatic tail cyst. Gastrointest Endosc 2009;(70):817.
26. Maheshwaran MU, Jeswanth S, Ramasamy S et al. Hemosuccus pancreaticus: 18-year experience from a tertiary care GI bleed centre in India. HPB 2016;(18).
27. Hiltrop N, Vanhauwaert A, Palmers PJ et al. Hemosuccus pancreaticus caused by rupture of a splenic artery pseudoaneurysm complicating chronic alcoholic pancreatitis: an uncommon cause of gastrointestinal bleeding. Acta Gastr Belg 2015;78(4):427-30.
28. Mandaliya R, Krevsky B, Sankineni A et al. Hemosuccus pancreaticus: a mysterious cause of gastrointestinal bleeding. Gastroenterol Res 2014;(7):32-7.
29. Peroux JL, Arput JP, Saint-Paul MC et al. Wirsungorrhagia complicating chronic pancreatitis associated with a neuroendocrine tumor of the pancreas. Gastroenterol Clin Biol 1994;(18):1142-5.
30. Koizumi J, Inoue S, Yonekawa H, Kunieda T. Hemosuccus pancreaticus: diagnosis with CT and MRI and treatment with transcatheter embolization. Abdom Imaging 2002;(27):77-81.
31. Zuchelli T, Alsheik E, Bhandari B et al. A unique case of hematemesis in a 17-year-old female. ACG Case Rep J 2014;(1):151.
32. Bergert H, Hinterseher I, Kersting S et al. Management and outcome of hemorrhage due to arterial pseudoaneurysms in pancreatitis. Surgery 2005;(137):323-8.
33. Barge JU, Lopera JE. Vascular complications of pancreatitis: role of interventional therapy. Korean J Radiol 2012;13(Suppl.1):S45-S55.
34. Gambiez LP, Ernst OJ, Merlier OA et al. Arterial embolization for bleeding pseudocysts complicating chronic pancreatitis. Arch Surg 1997;(132):1016-21.
35. Pitton MB, Dappa E, Jungmann F et al. Visceral artery aneurysms: Incidence, management, and outcome analysis in a tertiary care center over one decade. Eur Radiol 2015;25(7):2004-14.
36. Sawicki M, Marlicz W, Czapla N et al. Massive upper gastrointestinal bleeding from a splenic artery pseudoaneurysm caused by a penetrating gastric ulcer: case report and review of literature. Pol J Radiol 2015;(80):384-7.


