Клинический разбор в общей медицине №12 2024
Клинический разбор в общей медицине №12 2024
Клинический случай лечения пациентки с радиоиндуцированной ангиосаркомой молочной железы
Номера страниц в выпуске:6-9
Аннотация
Развитие радиоиндуцированной ангиосаркомы молочной железы является крайне редким и поздним осложнением лучевого лечения рака молочной железы, частота встречаемости которых не достигает и 1% в структуре всех злокачественных опухолей данной локализации. Стандартным подходом в лечении такой онкологической патологии являются мастэктомия или же широкое иссечение пораженной области, однако, вне зависимости от объема проведенного лечения, прогноз течения болезни остается неблагоприятным: пятилетняя выживаемость не превышает 54%. Во всем мире обсуждаются необходимость и различные варианты адъювантного лечения, и на данный момент общепринятых рекомендаций по ведению данной когорты пациентов не существует. Целью данной работы является демонстрация клинического случая успешного хирургического лечения пациентки со вторичной ангиосаркомой молочной железы.
Ключевые слова: лучевая терапия, радиоиндуцированная саркома, рак молочной железы, хирургическое лечение, клинический случай.
Для цитирования: Потапова А.О., Харитонова А.А., Малик Д.С., Шитарева В.Н., Резник И.П., Левицкая Н.В. Клинический случай лечения пациентки с радиоиндуцированной ангиосаркомой молочной железы. Клинический разбор в общей медицине. 2024; 5 (12): 6–9. DOI: 10.47407/kr2024.5.12.00530
Развитие радиоиндуцированной ангиосаркомы молочной железы является крайне редким и поздним осложнением лучевого лечения рака молочной железы, частота встречаемости которых не достигает и 1% в структуре всех злокачественных опухолей данной локализации. Стандартным подходом в лечении такой онкологической патологии являются мастэктомия или же широкое иссечение пораженной области, однако, вне зависимости от объема проведенного лечения, прогноз течения болезни остается неблагоприятным: пятилетняя выживаемость не превышает 54%. Во всем мире обсуждаются необходимость и различные варианты адъювантного лечения, и на данный момент общепринятых рекомендаций по ведению данной когорты пациентов не существует. Целью данной работы является демонстрация клинического случая успешного хирургического лечения пациентки со вторичной ангиосаркомой молочной железы.
Ключевые слова: лучевая терапия, радиоиндуцированная саркома, рак молочной железы, хирургическое лечение, клинический случай.
Для цитирования: Потапова А.О., Харитонова А.А., Малик Д.С., Шитарева В.Н., Резник И.П., Левицкая Н.В. Клинический случай лечения пациентки с радиоиндуцированной ангиосаркомой молочной железы. Клинический разбор в общей медицине. 2024; 5 (12): 6–9. DOI: 10.47407/kr2024.5.12.00530
Clinical Case
Natal'ya V. Levickaya
Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia
november2896@gmail.com
Abstract
The development of radiation-induced angiosarcoma in the breast is a very rare and late complication after radiation therapy for breast cancer. The incidence of this condition does not even reach 1% of all malignant tumors in this location. The standard treatment for this type of cancer is mastectomy or extensive removal of the affected area. However, despite the treatment, the prognosis for this disease remains poor, with a five-year survival rate of less than 54%. There is ongoing discussion about the need for and various options for additional treatment for these patients. At present, there are no universally accepted guidelines for managing this group of patients. The aim of this study is to present a case study of a successful surgical intervention for a patient with secondary angiosarcoma of the breast.
Keywords: radiation therapy, radiation-induced sarcoma, breast cancer, surgical treatment, clinical case.
For citation: Potapova A.O., Kharitoniva A.A., Malik D.S., Shitareva V.N., Reznik I.P., N.V. Levickaya. A clinical case of treatment of a patient with radiation-associated breast angiosarcomas. Clinical review for general practice. 2024; 5 (12): 6–9 (In Russ.). DOI: 10.47407/kr2024.5.12.00530
Радиоиндуцированная ангиосаркома молочной железы (АСМЖ) является поздним и крайне редким осложнением лучевой терапии, и составляет всего 0,05–0,3% в структуре злокачественных новообразований данной локализации [7]. Первый случай наблюдения вторичной АСМЖ был опубликован еще в 1987 г. [8], однако на сегодняшний момент до сих пор нет единых стандартов в лечении данной патологии. По данным различных авторов [9–13], медиана времени развития вторичных ангиосарком молочной железы после проведенной лучевой терапии составляет 5–7 лет. Основным методом лечения радиоиндуцированных АСМЖ является хирургический, заключающийся в проведении радикальной мастэктомии или широком иссечении пораженных тканей, достигая резекции R0, что значимо повышает общую (ОВ) и безрецидивную выживаемость пациентов [14, 15]. Для вторичных АСМЖ также не характерно лимфогенное метастазирование, поэтому аксиллярная лимфодиссекция не рекомендована [15]. Однако прогноз заболевания и по сей день остается неблагоприятным: пятилетняя общая выживаемость, вне зависимости от объема проведенного лечения, не превышает 35–50% [16–19]. В связи с этим в настоящее время во всем мире обсуждаются подходы к лечению данной когорты пациентов, а также поиск адъювантных методов лечения.
В данной статье представлен клинический случай лечения пациентки с радиоиндуцированной АСМЖ.
Пациентка К., 78 лет. Госпитализирована в Медицинский радиологический научный центр им. А.Ф. Цыба (МРНЦ им. А.Ф. Цыба) с жалобами на образование в правой молочной железе.
Из анамнеза: в 2013 г. по месту жительства был верифицирован рак правой молочной железы cT1N0M0,
IA ст. Гистологическое заключение: протоковая аденокарцинома. Иммуногистохимическое (ИГХ) исследование: люминальный B тип (подтверждено данными пересмотра стеклопрепаратов в МРНЦ им. А.Ф. Цыба). 11.09.2013 по месту жительства проведено хирургическое лечение в объеме радикальной резекции правой молочной железы, а также дистанционная лучевая терапия СОД 40,5 Гр. Лечение перенесла удовлетворительно, без проявления лучевых реакций. В дальнейшем в течение 5 лет пациентка получала гормонотерапию летрозолом и находилась под динамическим наблюдением у онколога по месту жительства.
В феврале 2024 г. пациентка обратила внимание на уплотнение правой молочной железы и обратилась к врачу по месту жительства.
Выполнена маммография: отмечается утолщение кожи правой молочной железы до 11 мм. В центральном отделе и ретроареолярной области определяется фиброзная структура без четких контуров, 7×6 см с асимметрией.
Ультразвуковое исследование (УЗИ) молочных желез, регионарных лимфатических узлов: состояние после резекции правой молочной железы с подмышечной лимфаденэктомией справа. Фиброзно-жировая инволюция правой молочной железы с преобладанием фиброзного компонента в центральном квадранте. Небольшой лимфатический отек мягких тканей правой молочной железы.
Компьютерная томография (КТ) органов грудной клетки: правая молочная железа отечна, кожа утолщена до 13 мм. Структура правой молочной железы неоднородная, с участками уплотнений и кальцинатов. Увеличенных лимфоузлов в подмышечных областях не определяется.
По данным остеосцинтиграфии, КТ органов брюшной полости, малого таза с внутривенным контрастированием, данных, подтверждающих отдаленное метастазирование основного заболевания, не получено.
Под УЗИ-контролем выполнена трепан-биопсия образования правой молочной железы.
Гистологическое исследование № 09340 от 18.04.2024 (пересмотр стеклопрепаратов в МРНЦ им. А.Ф. Цыба): в готовых препаратах кожа с ростом опухоли из клеток веретеновидной формы; в предоставленных иммуногистохимических препаратах в клетках опухоли не выявлена экспрессия CK Pan, LCA; индекс Ki 67 – 35% – морфологическая и иммуногистохимическая картина более всего соответствует мезенхимальной опухоли – лейомиосаркома?
ИГХ исследование (пересмотр стеклопрепаратов в МРНЦ им. А.Ф. Цыба): в клетках опухоли выявлена экспрессия ERG, CD31 и не выявлена экспрессия HHV-8, Caldesmon, Desmin – морфологическая и иммуногистохимическая картина более всего соответствует ангиосаркоме. Рекомендуется сопоставление с данными лучевых методов исследования. Заключение: морфологическая и иммуногистохимическая картина более всего соответствует ангиосаркоме.
Пациентка в мае 2024 г. с представленными данными обследований обратилась в МРНЦ им. А.Ф. Цыба.
Местный статус: правая молочная железа диффузно уплотнена, кожа темно-синюшная отечная; в левой молочной железе узловых образований не пальпируется; регионарные лимфатические узлы не пальпируются.
Проведен онкологический консилиум, рекомендовано проведение радикальной мастэктомии без подмышечной лимфаденэктомии.
17.06.2024 проведена радикальная мастэктомия справа.
Макроскопическое описание операционного материала. Тело правой молочной железы общим размером 27,0×25,0×10,5 см, покрытое кожным лоскутом размером 23,0×17,5 см. Сосок плотной консистенции, синюшно-желтоватого цвета, на поверхности которого, а также на поверхности кожного лоскута определяются красно-коричневые корочки размером от 0,2 до 2,0 см в наибольшем измерении. На разрезах в центральной части молочной железы с распространением по границе верхних квадрантов с преимущественным вовлечением верхне-наружного квадранта определяется опухоль плотной консистенции с лучистыми контурами, бело-желтого цвета с наличием участков костной плотности, обширных кровоизлияний примерным размером 4,5×5,5×7,0 см.
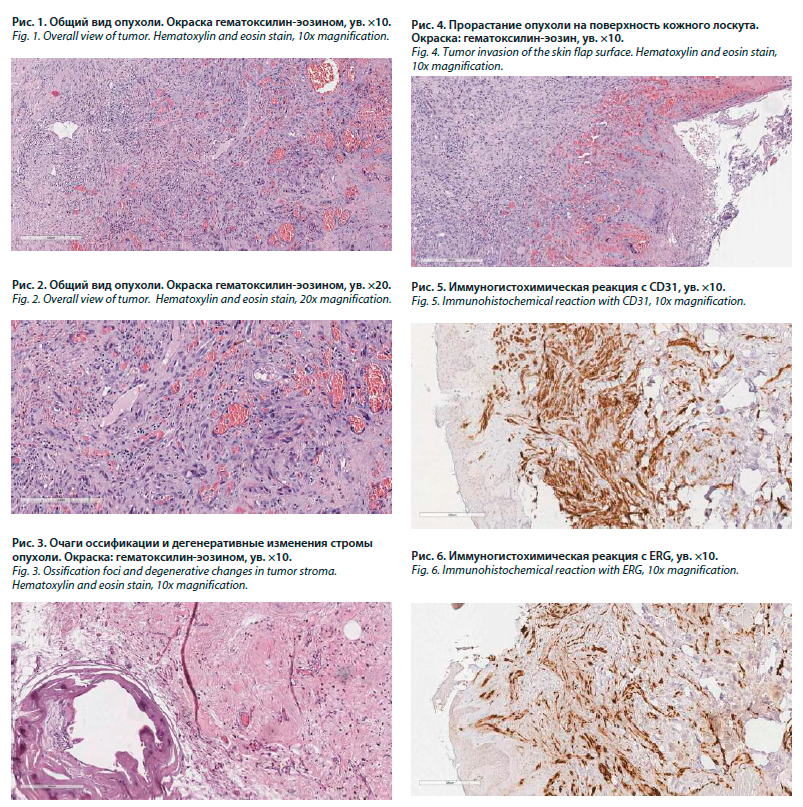
При микроскопическом исследовании в ткани молочной железы в области макроскопически описанных изменений определяется рост опухоли солидного строения, представленной пучками полиморфных овальных и веретеновидных клеток, формирующих на отдельных участках дольчатые структуры, заполненные эритроцитами (рис. 1, 2).
Строма опухоли с очаговой выраженной лимфоплазмоцитарной инфильтрацией с примесью гемосидерофагов, очагами оссификации (рис. 3) и обширными кровоизлияниями.
Рост опухоли определяется преимущественно в дерме кожного лоскута молочной железы с прорастанием на его поверхность (рис. 4), а также вовлечением паренхимы молочной железы. Края резекции интактны.
При ИГХ исследовании в клетках опухоли обнаружена диффузная выраженная цитоплазматическая экспрессия CD31 (рис. 5), диффузная выраженная ядерная экспрессия ERG (рис. 6); не обнаружено экспрессии мультицитокератина АЕ1/АЕ3, Caldesmon, Desmin.
Клинико-морфологическая картина и иммунофенотип соответствуют постлучевой ангиосаркоме правой молочной железы. ICD-0 code: 9120/3.
По результатам гистологического исследования проведен онкологический консилиум, было рекомендовано динамическое наблюдение онкологом по месту жительства. Согласно результатам представленных контрольных обследований, данных, подтверждающих прогрессирование основного заболевания, не получено.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация о финансировании. Исследование и публикация статьи осуществлены в рамках бюджетного финансирования по месту работы авторов.
Funding. State organization.
Вклад авторов
А.О. Потапова – концепция и дизайн статьи, написание текста, подготовка статьи. А.А. Харитонова – концепция и дизайн статьи, научное редактирование, бсуждение тактики лечения, выполнение операции. Н.В. Левицкая, Д.С. Малик – концепция и дизайн статьи, обсуждение тактики лечения, участие в операции. В.Н. Шитарева – написание текста статьи, оформление библиографического списка, техническое редактирование. И.П. Резник – предоставление снимков гистопрепаратов, описание гистопрепаратов.
Contribution of the authors
A.O. Potapova– the concept and design of the article, writing the text, preparing the article. A.A. Kharitonova – the concept and design of the article, scientific editing, discussion of treatment tactics, performing surgery. N.V. Levickaya, D.S. Malik – the concept and design of the article, discussion of treatment tactics, participation in the operation. V.N. Shitareva – writing the text of the article, making a bibliographic list, technical editing. I.P. Reznik – providing pictures of histopreparations, description of histopreparations
Информация об авторах
Information about the authors
Потапова Ангелина Олеговна – врач-онколог, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: november2896@gmail.com
Angelina A. Potapova – Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: november2896@gmail.com
Харитонова Алена Андреевна – канд. мед. наук, врач-онколог, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: a.kharitonova17@yandex.ru; ORCID: 0000-0001-9893-5143
Alena A. Kharitonova – Oncologist, Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: a.kharitonova17@yandex.ru; ORCID: 0000-0001-9893-5143
Малик Денис Сергеевич – канд. мед. наук, врач-онколог, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: denis-malik1@mail.ru
Denis S. Malik – Oncologist, Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: denis-malik1@mail.ru
Шитарева Вероника Николаевна – врач-онколог, мл. науч. сотр., МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: veronikashitareva@gmail.com; ORCID: 0000-0002-0031-0354
Veronirka N. Shitareva – Oncologist, Res. Assist., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: veronikashitareva@gmail.com; ORCID: 0000-0002-0031-0354
Резник Иван Павлович – врач-патологоанатом, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: dr_reznik.ip@mail.ru; ORCID: 0009-0008-2841-9870
Ivan P. Reznik – Patologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: dr_reznik.ip@mail.ru; ORCID: 0009-0008-2841-9870
Левицкая Наталья Вячеславовна – зав. отделением, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
Natal'ya V. Levickaya – Head of the department, Tsyb medicalradiological research centre – branch of the national medical research radiological centre.
Поступила в редакцию: 10.12.2024
Поступила после рецензирования: 12.12.2024
Принята к публикации: 12.12.2024
Received: 10.12.2024
Revised: 12.12.2024
Accepted: 12.12.2024
A clinical case of treatment of a patient with radiation-associated breast angiosarcomas
Angelina A. Potapova, Alena A. Kharitonova, Denis S. Malik, Veronirka N. Shitareva, Ivan P. Reznik,Natal'ya V. Levickaya
Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia
november2896@gmail.com
Abstract
The development of radiation-induced angiosarcoma in the breast is a very rare and late complication after radiation therapy for breast cancer. The incidence of this condition does not even reach 1% of all malignant tumors in this location. The standard treatment for this type of cancer is mastectomy or extensive removal of the affected area. However, despite the treatment, the prognosis for this disease remains poor, with a five-year survival rate of less than 54%. There is ongoing discussion about the need for and various options for additional treatment for these patients. At present, there are no universally accepted guidelines for managing this group of patients. The aim of this study is to present a case study of a successful surgical intervention for a patient with secondary angiosarcoma of the breast.
Keywords: radiation therapy, radiation-induced sarcoma, breast cancer, surgical treatment, clinical case.
For citation: Potapova A.O., Kharitoniva A.A., Malik D.S., Shitareva V.N., Reznik I.P., N.V. Levickaya. A clinical case of treatment of a patient with radiation-associated breast angiosarcomas. Clinical review for general practice. 2024; 5 (12): 6–9 (In Russ.). DOI: 10.47407/kr2024.5.12.00530
Введение
Рак молочной железы (РМЖ) в настоящее время является одной из самых распространенных опухолей среди всех злокачественных новообразований, занимая первое место в Российской федерации [1] и второе место в мире [2]. Лучевая терапия в лечении опухолей данной локализации является одним из основных этапов лечения [3, 4], и ее проведение в адъювантном режиме после органосохраняющих операций на молочной железе является стандартом лечения раннего РМЖ [5]. И даже в случае длительной ремиссии такие пациенты подвержены риску возникновения радиоиндуцированного рака, который в настоящее время за рубежом называют «ятрогенной болезнью успеха» [6].Радиоиндуцированная ангиосаркома молочной железы (АСМЖ) является поздним и крайне редким осложнением лучевой терапии, и составляет всего 0,05–0,3% в структуре злокачественных новообразований данной локализации [7]. Первый случай наблюдения вторичной АСМЖ был опубликован еще в 1987 г. [8], однако на сегодняшний момент до сих пор нет единых стандартов в лечении данной патологии. По данным различных авторов [9–13], медиана времени развития вторичных ангиосарком молочной железы после проведенной лучевой терапии составляет 5–7 лет. Основным методом лечения радиоиндуцированных АСМЖ является хирургический, заключающийся в проведении радикальной мастэктомии или широком иссечении пораженных тканей, достигая резекции R0, что значимо повышает общую (ОВ) и безрецидивную выживаемость пациентов [14, 15]. Для вторичных АСМЖ также не характерно лимфогенное метастазирование, поэтому аксиллярная лимфодиссекция не рекомендована [15]. Однако прогноз заболевания и по сей день остается неблагоприятным: пятилетняя общая выживаемость, вне зависимости от объема проведенного лечения, не превышает 35–50% [16–19]. В связи с этим в настоящее время во всем мире обсуждаются подходы к лечению данной когорты пациентов, а также поиск адъювантных методов лечения.
В данной статье представлен клинический случай лечения пациентки с радиоиндуцированной АСМЖ.
Клиническое наблюдение
Пациентка К., 78 лет. Госпитализирована в Медицинский радиологический научный центр им. А.Ф. Цыба (МРНЦ им. А.Ф. Цыба) с жалобами на образование в правой молочной железе.
Из анамнеза: в 2013 г. по месту жительства был верифицирован рак правой молочной железы cT1N0M0,
IA ст. Гистологическое заключение: протоковая аденокарцинома. Иммуногистохимическое (ИГХ) исследование: люминальный B тип (подтверждено данными пересмотра стеклопрепаратов в МРНЦ им. А.Ф. Цыба). 11.09.2013 по месту жительства проведено хирургическое лечение в объеме радикальной резекции правой молочной железы, а также дистанционная лучевая терапия СОД 40,5 Гр. Лечение перенесла удовлетворительно, без проявления лучевых реакций. В дальнейшем в течение 5 лет пациентка получала гормонотерапию летрозолом и находилась под динамическим наблюдением у онколога по месту жительства.
В феврале 2024 г. пациентка обратила внимание на уплотнение правой молочной железы и обратилась к врачу по месту жительства.
Выполнена маммография: отмечается утолщение кожи правой молочной железы до 11 мм. В центральном отделе и ретроареолярной области определяется фиброзная структура без четких контуров, 7×6 см с асимметрией.
Ультразвуковое исследование (УЗИ) молочных желез, регионарных лимфатических узлов: состояние после резекции правой молочной железы с подмышечной лимфаденэктомией справа. Фиброзно-жировая инволюция правой молочной железы с преобладанием фиброзного компонента в центральном квадранте. Небольшой лимфатический отек мягких тканей правой молочной железы.
Компьютерная томография (КТ) органов грудной клетки: правая молочная железа отечна, кожа утолщена до 13 мм. Структура правой молочной железы неоднородная, с участками уплотнений и кальцинатов. Увеличенных лимфоузлов в подмышечных областях не определяется.
По данным остеосцинтиграфии, КТ органов брюшной полости, малого таза с внутривенным контрастированием, данных, подтверждающих отдаленное метастазирование основного заболевания, не получено.
Под УЗИ-контролем выполнена трепан-биопсия образования правой молочной железы.
Гистологическое исследование № 09340 от 18.04.2024 (пересмотр стеклопрепаратов в МРНЦ им. А.Ф. Цыба): в готовых препаратах кожа с ростом опухоли из клеток веретеновидной формы; в предоставленных иммуногистохимических препаратах в клетках опухоли не выявлена экспрессия CK Pan, LCA; индекс Ki 67 – 35% – морфологическая и иммуногистохимическая картина более всего соответствует мезенхимальной опухоли – лейомиосаркома?
ИГХ исследование (пересмотр стеклопрепаратов в МРНЦ им. А.Ф. Цыба): в клетках опухоли выявлена экспрессия ERG, CD31 и не выявлена экспрессия HHV-8, Caldesmon, Desmin – морфологическая и иммуногистохимическая картина более всего соответствует ангиосаркоме. Рекомендуется сопоставление с данными лучевых методов исследования. Заключение: морфологическая и иммуногистохимическая картина более всего соответствует ангиосаркоме.
Пациентка в мае 2024 г. с представленными данными обследований обратилась в МРНЦ им. А.Ф. Цыба.
Местный статус: правая молочная железа диффузно уплотнена, кожа темно-синюшная отечная; в левой молочной железе узловых образований не пальпируется; регионарные лимфатические узлы не пальпируются.
Проведен онкологический консилиум, рекомендовано проведение радикальной мастэктомии без подмышечной лимфаденэктомии.
17.06.2024 проведена радикальная мастэктомия справа.
Макроскопическое описание операционного материала. Тело правой молочной железы общим размером 27,0×25,0×10,5 см, покрытое кожным лоскутом размером 23,0×17,5 см. Сосок плотной консистенции, синюшно-желтоватого цвета, на поверхности которого, а также на поверхности кожного лоскута определяются красно-коричневые корочки размером от 0,2 до 2,0 см в наибольшем измерении. На разрезах в центральной части молочной железы с распространением по границе верхних квадрантов с преимущественным вовлечением верхне-наружного квадранта определяется опухоль плотной консистенции с лучистыми контурами, бело-желтого цвета с наличием участков костной плотности, обширных кровоизлияний примерным размером 4,5×5,5×7,0 см.
При микроскопическом исследовании в ткани молочной железы в области макроскопически описанных изменений определяется рост опухоли солидного строения, представленной пучками полиморфных овальных и веретеновидных клеток, формирующих на отдельных участках дольчатые структуры, заполненные эритроцитами (рис. 1, 2).
Строма опухоли с очаговой выраженной лимфоплазмоцитарной инфильтрацией с примесью гемосидерофагов, очагами оссификации (рис. 3) и обширными кровоизлияниями.
Рост опухоли определяется преимущественно в дерме кожного лоскута молочной железы с прорастанием на его поверхность (рис. 4), а также вовлечением паренхимы молочной железы. Края резекции интактны.
При ИГХ исследовании в клетках опухоли обнаружена диффузная выраженная цитоплазматическая экспрессия CD31 (рис. 5), диффузная выраженная ядерная экспрессия ERG (рис. 6); не обнаружено экспрессии мультицитокератина АЕ1/АЕ3, Caldesmon, Desmin.

Клинико-морфологическая картина и иммунофенотип соответствуют постлучевой ангиосаркоме правой молочной железы. ICD-0 code: 9120/3.
По результатам гистологического исследования проведен онкологический консилиум, было рекомендовано динамическое наблюдение онкологом по месту жительства. Согласно результатам представленных контрольных обследований, данных, подтверждающих прогрессирование основного заболевания, не получено.
Заключение
Диагностика и лечение радиоиндуцированных АСМЖ остаются предметом дискуссий специалистов по всему миру. Описание отдельных клинических случаев, а также создание регистра пациентов с данной патологией могут стать важным шагом к поиску решения данной проблемы. В настоящее время основным методом лечения у данной когорты пациентов остается широкое иссечение новообразования с достижением краев резекции R0, что может увеличить общую и безрецидивную выживаемость.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация о финансировании. Исследование и публикация статьи осуществлены в рамках бюджетного финансирования по месту работы авторов.
Funding. State organization.
Вклад авторов
А.О. Потапова – концепция и дизайн статьи, написание текста, подготовка статьи. А.А. Харитонова – концепция и дизайн статьи, научное редактирование, бсуждение тактики лечения, выполнение операции. Н.В. Левицкая, Д.С. Малик – концепция и дизайн статьи, обсуждение тактики лечения, участие в операции. В.Н. Шитарева – написание текста статьи, оформление библиографического списка, техническое редактирование. И.П. Резник – предоставление снимков гистопрепаратов, описание гистопрепаратов.
Contribution of the authors
A.O. Potapova– the concept and design of the article, writing the text, preparing the article. A.A. Kharitonova – the concept and design of the article, scientific editing, discussion of treatment tactics, performing surgery. N.V. Levickaya, D.S. Malik – the concept and design of the article, discussion of treatment tactics, participation in the operation. V.N. Shitareva – writing the text of the article, making a bibliographic list, technical editing. I.P. Reznik – providing pictures of histopreparations, description of histopreparations
Информация об авторах
Information about the authors
Потапова Ангелина Олеговна – врач-онколог, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: november2896@gmail.com
Angelina A. Potapova – Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: november2896@gmail.com
Харитонова Алена Андреевна – канд. мед. наук, врач-онколог, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: a.kharitonova17@yandex.ru; ORCID: 0000-0001-9893-5143
Alena A. Kharitonova – Oncologist, Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: a.kharitonova17@yandex.ru; ORCID: 0000-0001-9893-5143
Малик Денис Сергеевич – канд. мед. наук, врач-онколог, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: denis-malik1@mail.ru
Denis S. Malik – Oncologist, Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: denis-malik1@mail.ru
Шитарева Вероника Николаевна – врач-онколог, мл. науч. сотр., МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: veronikashitareva@gmail.com; ORCID: 0000-0002-0031-0354
Veronirka N. Shitareva – Oncologist, Res. Assist., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: veronikashitareva@gmail.com; ORCID: 0000-0002-0031-0354
Резник Иван Павлович – врач-патологоанатом, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: dr_reznik.ip@mail.ru; ORCID: 0009-0008-2841-9870
Ivan P. Reznik – Patologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: dr_reznik.ip@mail.ru; ORCID: 0009-0008-2841-9870
Левицкая Наталья Вячеславовна – зав. отделением, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
Natal'ya V. Levickaya – Head of the department, Tsyb medicalradiological research centre – branch of the national medical research radiological centre.
Поступила в редакцию: 10.12.2024
Поступила после рецензирования: 12.12.2024
Принята к публикации: 12.12.2024
Received: 10.12.2024
Revised: 12.12.2024
Accepted: 12.12.2024
Список исп. литературыСкрыть список1. Состояние онкологической помощи населению России в 2023 году. Под ред. А.Д. Каприна и др. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии», 2024. ISBN 978-5-85502-297-1
The state of cancer care for the Russian population in 2023. Ed. A.D. Kaprin et al. Moscow: Herzen Moscow Oncology Research Institute – branch of National Medical Research Center for Radiology, 2024. ISBN 978-5-85502-297-1 (in Russian).
2. Bray F, Laversanne M, Sung H et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2024;74(3):229-63. DOI: 10.3322/caac.21834. Epub 2024 Apr 4. PMID: 38572751
3. Рак молочной железы. Клинические рекомендации Минздрава России. М., 2021.
Breast cancer. Clinical recommendations of the Ministry of Health of the Russian Federation (in Russian). Moscow, 2021 (in Russian).
4. Gradishar WJ, Moran MS, Abraham J et al. Breast Cancer, Version 3.2024, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2024;22(5):331-57. DOI: 10.6004/jnccn.2024.0035. PMID: 39019058.
5. Veronesi U, Cascinelli N, Mariani L et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med 2002;347(16):1227-32. DOI: 10.1056/NEJMoa020989
6. Huvos AG, Woodard HQ, Cahan WG et al. Postradiation osteogenic sarcoma of bone and soft tissues. A clinicopathologic study of 66 patients. Cancer 1985;55(6):1244-55. DOI: 10.1002/1097-0142(19850315)55: 6<1244::aid-cncr2820550617>3.0.co;2-1. PMID: 3855683.
7. Huang J, Mackillop WJ. Increased risk of soft tissue sarcoma after radiotherapy in women with breast carcinoma. Cancer 2001;92(1):172-80.
8. Body G et al. Cutaneous angiosarcoma of the breast following surgery and irradiation of breast adenocarcinoma [French]. J Gynecol Obstet Biol Reprod (Paris) 1987;16:479-83.
9. Chesebro AL, Chikarmane SA, Gombos EC, Giardino AA. Radiationassociated angiosarcoma of the breast: what the radiologist needs to know. AJR Am J Roentgenol 2016;207(1):217-25. DOI: 10.2214/AJR.15.15888
10. Seinen JM, Styring E, Verstappen V et al. Radiation-associated angiosarcoma after breast cancer: high recurrence rate and poor survival despite surgical treatment with R0 resection. Ann Surg Oncol 2012;19(8):2700-6. DOI: 10.1245/s10434-012-2310-x
11. Fineberg S, Rosen PP. Cutaneous angiosarcoma and atypical vascular lesions of the skin and breast after radiation therapy for breast carcinoma. Am J Clin Pathol 1994;102(6):757-63. DOI: 10.1093/ajcp/ 102.6.757. PMID: 7801888.
12. Sessions SC, Smink RD Jr. Cutaneous angiosarcoma of the breast after segmental mastectomy and radiation therapy. Arch Surg 1992;127(11):1362-3. DOI: 10.1001/archsurg.1992.01420110114023. PMID: 1332648.
13. Cohen-Hallaleh RB, Smith HG, Smith RC et al. Radiation induced angiosarcoma of the breast: outcomes from a retrospective case series. Clin Sarcoma Res. 2017;7:15. DOI: 10.1186/s13569-017-0081-7. PMID: 28794852; PMCID: PMC5547463.
14. Thijssens KM, van Ginkel RJ, Suurmeijer AJ et al. Radia tion-induced sarcoma: A challenge for the surgeon. Ann Surg Oncol 2005;12:237-45.
15. Barrow BJ, Janjan NA, Gutman Hetal. Role of radiotherapy in sarcoma of the breast – a retrospective review of the M.D. Anderson experience. Radiother Oncol 1999;52:173-8.
16. Erel E, Vlachou E, Athanasiadou M et al. Management of radiation-induced sarcomas in a tertiary referral centre: a review of 25 cases. Breast 2010;19(5):424-7. DOI: 10.1016/j.breast.2010.04.006. Epub 2010 Jun 9. PMID: 20542697.
17. Bjerkehagen B, Smeland S, Walberg L et al. Radiation-induced sarcoma: 25-year experience from the Norwegian Radium Hospital. Acta Oncol 2008;47(8):1475-82. DOI: 10.1080/02841860802047387. PMID: 18607853
18. D’Angelo SP, Antonescu CR, Kuk D et al. Highrisk features in radiation-associated breast angiosarcomas. Br J Cancer 2013;109(9):2340-6. DOI: 10.1038/bjc.2013.590
19. Buta M, Santrac N, Zegarac M et al. Radiation-Induced Breast Angiosarcoma-A Single-Institution Experience. Diagnostics (Basel) 2024;14(20):2326. DOI: 10.3390/diagnostics14202326. PMID: 39451649; PMCID: PMC11506978.
26 декабря 2024
Количество просмотров: 10498

