Клинический разбор в общей медицине №12 2024
Gamzat G. Aminov1, Elena V. Litvyakova1, Irina A. Zharikova1
1 Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2 National Medical Research Radiological Centre, Moscow, Russia;
3 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
4 Herzen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, Moscow, Russia
kismarvic@mail.ru
Abstract
Relevance. Breast cancer is the first most common cancer in women not only in Russia, but also around the world. In Russia in 2021, there were 76 000 women diagnosed with breast cancer. As a result of screening programmes, preventive examinations, and educational work, the detection rate of the disease at stages I–II has reached 72%. This determines the implementation of organ-preserving surgical interventions, but a postoperative course of radiotherapy can significantly worsen the cosmetic result.
Materials and methods. In our work, we analyzed the cosmetic results in 166 patients who received surgical treatment including lumpectomy for breast cancer with cT1сN0M0 stage. All patients had a luminal, HER2 negative tumor subtype. In accordance with the treatment methods, the main clinical group A (n=80) was formed, which included women who underwent organ-preserving surgical treatment and multifractional high-dose rate brachytherapy with a dose of 1.7 Gy ×2 times a day up to a dose of 34 Gy. Group B (n=86) included patients who underwent organ-preserving surgery and standard radiation therapy with a dose of 2 Gy per day up to a dose of 50 Gy. The groups were comparable in molecular biological characteristics, age and number of patients.
Results. According to the 4-scale assessment of cosmetic results, it should be noted that after 6 months, “excellent” and “good cosmetic result” was higher in group B and it was 81.4% compared to 62.5% in Group A. This was due to the defects in the area of introducers placement and additional pigmentation in this area. According to our data, at 24 months there was an increase in “satisfactory” results in the group with external beam radiation therapy, which was associated with the occurrence of late radiation injuries, and the group with interstitial radiation therapy has better cosmetic results of 87.5% compared to 77.9%, as well as fewer satisfactory results: 12.5% compared to 22.1%.To receive a subjective assessment from the patients, we used a questionnaire with a 10-point scale. When studying questionnaires, it was noted that in group A, women were more satisfied with the cosmetic results, which was associated not only with a less scope of surgical intevention (lumpectomy versus sectoral resection), which affected the shape of the mammary gland, but also in this group there was less swelling and thickening of the breast skin and changes in the breast tissue itself.
Conclusions. Brachytherapy in patients with early stages of breast cancer has good cosmetic results, which has a positive effect on the emotional state of women.
Keywords: breast cancer, lumptectomy, Ir-192 brachytherapy, cosmetic result.
For citation: Kiseleva M.V., Kaprin А.D., Ivanov S.А., Gulidov I.A., Aminov G.G., Litviakova E.V., Zharikova I.A. Cosmetic results of using high-output Ir-192 brachytherapy in the treatment of luminal breast cancer. Clinical review for general practice. 2024; 5 (12): 10–16 (In Russ.).
DOI: 10.47407/kr2024.5.12.00531
В России в 2021 г. выявлено 76 тыс. новых случаев данного заболевания у женщин [1].
Благодаря скринингу, профилактическим осмотрам, просветительской работе частота выявления заболеваний на I–II стадии достигла 72% [2].
Увеличение числа больных с локализованными формами РМЖ в развитых странах привело к росту органосохраняющих операций, что позволило обеспечить улучшение качества жизни этого контингента [3].
Одной из основных проблем органосохраняющего лечения является более высокий риск развития местных рецидивов опухоли по сравнению с радикальной мастэктомией [4–6]. Для снижения риска местного рецидива проводится послеоперационная дистанционная лучевая терапия. Как показали результаты крупных рандомизированных исследований (NSABP, EORTC, UK CCCR, EBCTCG), дистанционная лучевая терапия позволяет уменьшить частоту возникновения местных рецидивов на 60–70% при инвазивном РМЖ [7].
Однако ранние и поздние лучевые осложнения кожи, смежных органов, а также самой молочной железы зачастую нивелируют косметический результат проведенного хирургического лечения и ухудшают качество жизни пациенток. Длительные сроки лечения отрицательно сказываются на экономическом аспекте лечения РМЖ.
Согласно исследованиям Е.В. Хмелевского, изучившего осложнения дистанционной лучевой терапии 1032 женщин, влажные и сухие эпидермиты встречались в 72% случаев, а частота пульмонитов и кардиальных поражений достигала 10–15% случаев [8]. Следует отметить, что, по данным Биндт и соавт. [9], пульмониты приводят к потере части легкого, что равносильно утрате 15 лет жизни пациентки. Постлучевые изменения сердечно-сосудистой системы являются причиной вторичной сердечной смертности у 5% излеченных от рака женщин.
Альтернативным методом контроля местного рецидива может выступать брахитерапия, которая существенно сокращает время лечения, воздействуя только на часть ткани молочной железы, окружающую область лампэктомии [10, 11]. Таким образом, уменьшается воздействие излучения на сердце и легкие, по сравнению с облучением всей молочной железы [12]. Снижение воздействия излучения на окружающие здоровые ткани уменьшает риск возникновения вторичных радиационно-индуцированных злокачественных новообразований [13, 14].
В исследованиях Шарлоты Э. Коулз опубликованы данные 3-й фазы пятилетних результатов, где на 2018 женщинах доказана безопасность и эффективность частичного облучения молочной железы по сравнению с полным ее облучением. В данном исследовании были оценены и косметические результаты. Для этого все пациентки заполняли базовый опросник Европейской организации по исследованию и лечению рака (EORTC) QLQ-C30, модуль EORTC QLQ-BR23 по РМЖ, шкалу изображений тела, вопросы, относящиеся к протоколу (изменился ли внешний вид кожи, изменился ли общий вид груди, грудь стала меньше, грудь стала тверже на ощупь или присутствует ригидность), больничную шкалу тревоги и депрессии и другие вопросы. Эти опросники заполнялись до брахитерапии, через 6 мес, а также через 1, 2 и 5 лет. Кроме опросников выполнялись фотографии молочных желез до облучения, через 2 года и через 5 лет. По данным этого исследования не обнаружено доказательств статистически значимой разницы в доле пациенток с изменением внешнего вида груди ни при экспериментальном режиме, ни при лучевой терапии всей молочной железы через 2 года (уменьшенная доза p=0,527; частичная лучевая терапия молочной железы p=0,446) или через 5 лет (уменьшенная доза p=0,917; частичная лучевая терапия молочной железы p=0,165) [15].
Аналогичным исследованием, изучившим поздние побочные эффекты и косметические результаты у пациенток, получавших брахитерапию по сравнению с общим облучением молочной железы, было исследование Гасаба Полгара [16]. В исследование вошли 1328 пациенток, рандомизированных на 2 группы: с общим облучением молочной железы – 673 пациентки или брахитерапией – 655 пациенток. Пятилетние профили токсичности и косметические результаты были аналогичны в двух подгруппах, со значительно меньшим количеством поздних кожных побочных эффектов 2–3-й степени после брахитерапии. Эти результаты предоставляют дополнительные клинические доказательства рутинного использования APBI на основе интерстициальной мультикатетерной брахитерапии при лечении пациенток с РМЖ низкого риска прогрессирования, которые делают выбор в пользу сохранения груди.
 В наше ретроспективное исследование включены 166 пациенток, имеющих стадию заболевания cT1сN0M0, получивших хирургическое лечение в объеме лампэктомии. По молекулярно-биологическому подтипу у всех диагностирован люминальный HER2 отрицательный подтип опухоли.
В наше ретроспективное исследование включены 166 пациенток, имеющих стадию заболевания cT1сN0M0, получивших хирургическое лечение в объеме лампэктомии. По молекулярно-биологическому подтипу у всех диагностирован люминальный HER2 отрицательный подтип опухоли.
В соответствии с методиками лечения сформирована основная клиническая группа A (n=80), в которую вошли женщины с органосохранным хирургическим лечением и мультифракционной высокомощностной брахитерапией в РОД 1,7 Гр два раза в день до СОД 34 ГР.
Группа Б (n=86) – пациентки с органосохранным хирургическим лечением и стандартной лучевой терапией в РОД 2 Гр в день до СОД 50 Гр.
Возраст пациенток был старше 50 лет.
Группы пациенток и возраст соответствовал протоколу «Высокомощностная брахитерапия в комплексном лечении рака молочной железы», утвержденного в МРНЦ 15.02.2019.
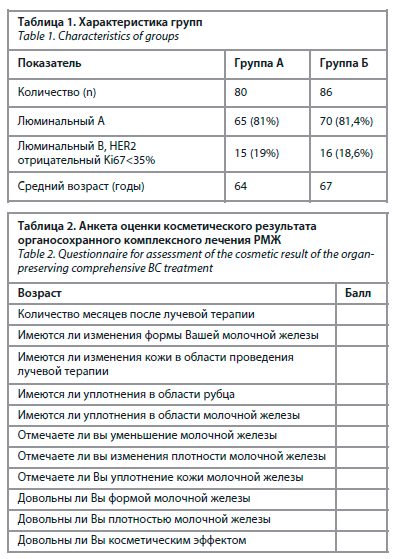
Как видно из табл. 1. группы были сопоставимы по молекулярно-биологическим характеристикам опухоли, возрасту и числу пациенток.
Для оценки косметического эффекта нами была разработана анкета-опросник (табл. 2), которую пациентки заполняли после завершения лучевой терапии, через 3, 6, 12, 24 мес.
Через 3, 6 и 12 мес после операции, далее каждые 12 мес пациентки проходили плановое контрольное обследование в соответствии с программой наблюдения больных РМЖ.
Пациентки самостоятельно заполняли анкету, отвечая на вопросы. При ответе учитывалась 10-балльная шкала, где 1 – это отрицательный результат, а 10 – максимально положительный. В анкете вопросы отражают субъективную оценку своих молочных желез, с оценкой кожи, плотности тканей, наличия патологических изменений и косметического эффекта.
Для объективной оценки использовались фотографии молочных желез, выполненные до хирургического лечения, перед лучевой терапией и спустя 6, 12 и 24 мес.
Как видно из ниже представленных фотографий, выполненных на сроке 2 года после проведенного лечения (см. рисунок), визуализируются отличные косметические показатели по состоянию кожи и ткани молочной железы. Не отмечается фиброза и постлучевых изменений. Учитывая возраст пациенток, состояние подкожно-жировой клетчатки (ПЖК), по данным пальпации, не отличалось от здоровой молочной железы.
Дополнительно использовалась и 4-ступенчатая шкала, принятая в Joint Center for Radiation Therapy (Бостон, США) [17]. Данная шкала служила для субъективной оценки врача хирурга и радиолога после проведенного лечения.
Согласно данной шкале:
1) прекрасный косметический эффект – полная симметричность молочных желез, отсутствие поздних лучевых повреждений кожи и ПЖК;
2) хороший косметический эффект – незначительная асимметрия молочных желез, вызванная послеоперационными рубцовыми изменениями и поздними лучевыми повреждениями кожи и ПЖК I степени;
3) удовлетворительный косметический эффект – выраженная асимметрия, деформация молочных желез, вызванная послеоперационными рубцовыми изменениями и/или поздними лучевыми повреждениями кожи и ПЖК II степени;
4) плохой косметический эффект – значительная асимметрия и деформация молочных желез, вызванная послеоперационными рубцовыми изменениями и поздними лучевыми повреждениями кожи и ПЖК III–IV степени.
Объективную оценку выполнял врач-онколог, не принимавший участия в лечении пациенток, включенных в исследование, и не имеющий информации о проводимой лучевой терапии. При осмотре и пальпации учитывались наиболее часто возникающие косметические дефекты, такие как телеангиэктазии, жировой некроз, фиброз.
Телеангиэктазии характеризуются локальной дилатацией мелких сосудов, приводящих к покраснению кожи. Врачом-онкологом проводился подсчет числа телеангиэктазий на 1 см2 облученных кожных покровов. Согласно Common Terminology Criteria for Adverse Events (CTCAE) v. 5.0 (2017) при наличии телеангиэктазий, покрывающих <10% исследуемой площади, присваивалась I степень, при наличии телеангиэктазий, покрывающих >10% исследуемой площади, – II степень.
Фиброз – это прогрессирующая индурация, отек и утолщение дермы и подкожных тканей [18]. Для уточнения наличия и степени выраженности постлучевого фиброза проводили осмотр и пальпацию молочных желез, а степень фиброза определяли в соответствии со следующими критериями:
• 0 – изменений нет;
• I степень – фиброз и атрофия кожи слабо выражены;
• II степень – умеренно выраженный фиброз и телеангиэктазии;
• III степень – выраженная атрофия и фиброз с площадью >10% зоны облучения;
• IV степень – зоны некроза и изъязвления.
 Косметический эффект проведенного лечения оценен у 166 пациенток через 6, 12, 24 мес после окончания лечения. Согласно 4-шкальной оценке косметических результатов, следует отметить, что на сроке 6 мес «прекрасный» и «хороший косметический эффект» был выше в группе Б и он составил 81,4% против 62,5% в группе А (табл. 3, 4). Это было связано с наличием дефектов в области введения интрадьюсеров и дополнительной пигментации в данной области.
Косметический эффект проведенного лечения оценен у 166 пациенток через 6, 12, 24 мес после окончания лечения. Согласно 4-шкальной оценке косметических результатов, следует отметить, что на сроке 6 мес «прекрасный» и «хороший косметический эффект» был выше в группе Б и он составил 81,4% против 62,5% в группе А (табл. 3, 4). Это было связано с наличием дефектов в области введения интрадьюсеров и дополнительной пигментации в данной области.
На сроке 12 мес также отмечается преимущество в косметическом результате в подгруппе пациенток, получавших дистанционную лучевую терапию, однако отмечается уменьшение разрыва между двумя группами (81,4% против 75% соответственно).
Согласно нашим данным, на сроке 24 мес отмечается увеличение «удовлетворительных» результатов в группе с дистанционной лучевой терапией, что связано с возникновением поздних лучевых повреждений. Группа с внутритканевой лучевой терапией имеет лучшие косметические результаты (87,5% против 77,9%), а также меньшее количество «удовлетворительных» результатов (12,5%, против 22,1%).
Учитывая, что вышеизложенное оценивалось независимым онкологом, нам было интересно узнать мнение самих пациенток и их субъективную оценку косметических результатов.
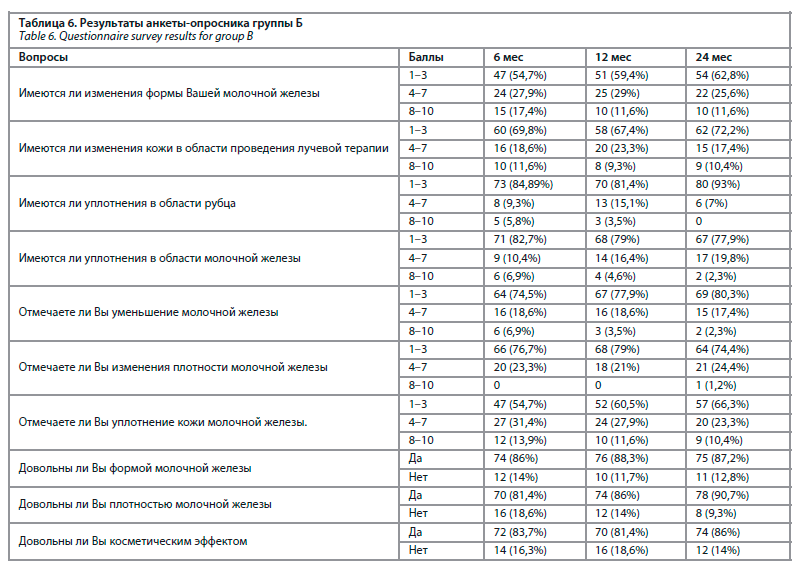
При анализе анкет, заполняемых пациентками, мы использовали 10-балльную систему. Для оценки данных ответов мы объединили балльную систему следующим образом: 1–3 балла – незначительные изменения, 4–7 баллов – средние изменения, 8–10 баллов – выраженные изменения. А на последние три вопроса ответы делились на «да» и «нет» (табл. 5, 6).
Проведенные зарубежные исследования не выявили разницы в косметических результатах. Поэтому в нашем исследовании мы оценивали не только объективный статус, но и оценку самих женщин кожи и ткани молочной железы после проведенного лечения на разных сроках после проведенного лечения.
Полученные результаты отличались от данных зарубежных авторов, что вызывает интерес и самобытность данного исследования.
При изучении анкет-опросников отмечается, что в подгруппе А женщины были более довольны косметическим эффектом, что связано не только с уменьшением объема хирургического лечения (лампэктомия против секторальной резекции), что влияло на форму молочной железы, но также в данной подгруппе отмечались меньшая частота отека и уплотнения кожи молочной железы и изменения самой ткани молочной железы.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Киселева Марина Викторовна – д-р мед. наук, проф., зав. отд-нием новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: kismarvic@mail.ru; ORCID: 0000-0001-8464-1726
Marina V. Kiseleva – Dr. Sci. (Med.), Full Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: kismarvic@mail.ru; ORCID: 0000-0001-8464-1726
Каприн Андрей Дмитриевич – д-р мед. наук, проф., академик РАН, академик РАО, член Президиума РАН, член Президиума РАО, заслуженный врач России, генеральный директор ФГБУ «НМИЦ радиологии», зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института РУДН, директор МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Dr. Sci. (Med.), Full Prof., Acad. RAS, Acad. RAE, General Director National Medical Research Radiological Centre, Head of the Department, Patrice Lumumba People’s Friendship university of Russia (RUDN University), Director Hertsen Moscow Oncology Research Institute. ORCID: 0000-0001-8784-8415
Иванов Сергей Анатольевич – д-р мед. наук, чл.-корр. РАН, директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии», проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института РУДН. ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Dr. Sci. (Med.), Corr. Memb. RAS, Director of Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). ORCID: 0000-0001-7689-6032
Гулидов Игорь Александрович – д-р мед. наук, проф., зав. отделом лучевой терапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии», засл. деятель науки России, засл. врач России, член Европейского общества терапевтической радиологии и онкологии и Российской ассоциации терапевтических радиационных онкологов
Igor A. Gulidov – Dr. Sci. (Med.), Full Prof., Head of the Radiotherapy Department, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre
Аминов Гамзат Гашимович – канд. мед. наук, врач отд-ния новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0009-0007-4649-8878
Gamzat G. Aminov – Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0009-0007-4649-8878
Литвякова Елена Викторовна – врач отд-ния новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: el.lit95@mail.ru; ORCID: 0000-0001-9146-2603
Elena V. Litvyakova – doctor, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: el.lit95@mail.ru; ORCID: 0000-0001-9146-2603
Жарикова Ирина Анатольевна – канд. мед. наук, ст. науч. сотр. отд-ния новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-9187-9863
Irina A. Zharikova – Cand. Sci. (Med.), Senior Res. Officer, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0001-9187-9863
Поступила в редакцию: 28.11.2024
Поступила после рецензирования: 06.12.2024
Принята к публикации: 12.12.2024
Received: 28.11.2024
Revised: 06.12.2024
Accepted: 12.12.2024
Клинический разбор в общей медицине №12 2024
Косметические результаты использования высокомощностной брахитерапии Ir-192 в лечении люминального рака молочной железы
Номера страниц в выпуске:10-16
Аннотация
Актуальность. Рак молочной железы занимает первое место среди онкологических патологий по заболеваемости у женского населения не только в России, но и в мире. В России в 2021 г. выявлено 76 тыс. новых случаев данного заболевания у женщин. Благодаря скринингу, профилактическим осмотрам, просветительской работе частота выявления заболеваний на I–II стадии достигла 72%, что
обусловливает проведение органосохранных хирургических вмешательств. Однако послеоперационный курс дистанционной лучевой терапии может значительно ухудшить косметический эффект.
Материалы и методы. В нашей работе мы проанализировали косметический эффект у 166 пациенток, получивших хирургическое лечение в объеме лампэктомии по поводу рака молочной железы, имеющих cT1сN0M0 стадию заболевания. Все пациентки имели люминальный HER2 отрицательный подтип опухоли. В соответствии с методиками лечения сформирована основная клиническая группа A (n=80), в которую вошли женщины с проведенным органосохранным хирургическим лечением и мультифракционной высокомощностной брахитерапией в РОД 1,7 Гр два раза в день до СОД 34 Гр. Группа Б (n=86) – пациентки с проведенной органосохранным хирургическим лечением и стандартной лучевой терапией в РОД 2 Гр в день до СОД 50 Гр. Группы были сопоставимы по молекулярно-биологическим характеристикам, возрасту и количеству пациенток.
Результаты. Согласно 4-шкальной оценке косметических результатов, следует отметить, что на сроке 6 мес «прекрасный» и «хороший косметический эффект» был выше в группе Б и он составил 81,4% против 62,5% в группе А. Это было связано с наличием дефектов в области введения интрадьюсеров и дополнительной пигментации в данной области. Согласно нашим данным, на сроке 24 мес отмечается увеличение «удовлетворительных» результатов в группе с дистанционной лучевой терапией, что связано с возникновением поздних лучевых повреждений, и группа с внутритканевой лучевой терапией имеет лучшие косметические результаты 87,5% против 77,9%, а также меньшее количество удовлетворительных результатов – 12,5% против 22,1%. Для субъективной оценки самих пациенток мы использовали анкету – опросник с 10-балльной системой. При изучении анкет-опросников отмечается, что в подгруппе А женщины были более довольны косметическим эффектом, что связано не только с уменьшением объема хирургического лечения (лампэктомия против секторальной резекции), влияющего на форму молочной железы, но также в данной подгруппе отмечалось меньшее количество отека и уплотнения кожи молочной железы и изменения самой ткани молочной железы.
Выводы. Проведение брахитерапии у пациенток с начальными стадиями рака молочной железы имеет хорошие косметические результаты, что положительно сказывается на эмоциональном состоянии женщин.
Ключевые слова: рак молочной железы, лампэктомия, брахитерапия, косметические результаты.
Для цитирования: Киселева М.В., Каприн А.Д., Иванов С.А., Гулидов И.А., Аминов Г.Г., Литвякова Е.В., Жарикова И.А. Косметические результаты использования высокомощностной брахитерапии Ir-192 в лечении люминального рака молочной железы. Клинический разбор в общей медицине. 2024; 5 (12): 10–16. DOI: 10.47407/kr2024.5.12.00531
Актуальность. Рак молочной железы занимает первое место среди онкологических патологий по заболеваемости у женского населения не только в России, но и в мире. В России в 2021 г. выявлено 76 тыс. новых случаев данного заболевания у женщин. Благодаря скринингу, профилактическим осмотрам, просветительской работе частота выявления заболеваний на I–II стадии достигла 72%, что
обусловливает проведение органосохранных хирургических вмешательств. Однако послеоперационный курс дистанционной лучевой терапии может значительно ухудшить косметический эффект.
Материалы и методы. В нашей работе мы проанализировали косметический эффект у 166 пациенток, получивших хирургическое лечение в объеме лампэктомии по поводу рака молочной железы, имеющих cT1сN0M0 стадию заболевания. Все пациентки имели люминальный HER2 отрицательный подтип опухоли. В соответствии с методиками лечения сформирована основная клиническая группа A (n=80), в которую вошли женщины с проведенным органосохранным хирургическим лечением и мультифракционной высокомощностной брахитерапией в РОД 1,7 Гр два раза в день до СОД 34 Гр. Группа Б (n=86) – пациентки с проведенной органосохранным хирургическим лечением и стандартной лучевой терапией в РОД 2 Гр в день до СОД 50 Гр. Группы были сопоставимы по молекулярно-биологическим характеристикам, возрасту и количеству пациенток.
Результаты. Согласно 4-шкальной оценке косметических результатов, следует отметить, что на сроке 6 мес «прекрасный» и «хороший косметический эффект» был выше в группе Б и он составил 81,4% против 62,5% в группе А. Это было связано с наличием дефектов в области введения интрадьюсеров и дополнительной пигментации в данной области. Согласно нашим данным, на сроке 24 мес отмечается увеличение «удовлетворительных» результатов в группе с дистанционной лучевой терапией, что связано с возникновением поздних лучевых повреждений, и группа с внутритканевой лучевой терапией имеет лучшие косметические результаты 87,5% против 77,9%, а также меньшее количество удовлетворительных результатов – 12,5% против 22,1%. Для субъективной оценки самих пациенток мы использовали анкету – опросник с 10-балльной системой. При изучении анкет-опросников отмечается, что в подгруппе А женщины были более довольны косметическим эффектом, что связано не только с уменьшением объема хирургического лечения (лампэктомия против секторальной резекции), влияющего на форму молочной железы, но также в данной подгруппе отмечалось меньшее количество отека и уплотнения кожи молочной железы и изменения самой ткани молочной железы.
Выводы. Проведение брахитерапии у пациенток с начальными стадиями рака молочной железы имеет хорошие косметические результаты, что положительно сказывается на эмоциональном состоянии женщин.
Ключевые слова: рак молочной железы, лампэктомия, брахитерапия, косметические результаты.
Для цитирования: Киселева М.В., Каприн А.Д., Иванов С.А., Гулидов И.А., Аминов Г.Г., Литвякова Е.В., Жарикова И.А. Косметические результаты использования высокомощностной брахитерапии Ir-192 в лечении люминального рака молочной железы. Клинический разбор в общей медицине. 2024; 5 (12): 10–16. DOI: 10.47407/kr2024.5.12.00531
Cosmetic results of using high-output Ir-192 brachytherapy in the treatment of luminal breast cancer
Marina V. Kiseleva1, Andrey D. Kaprin2-4, Sergey A. Ivanov1,3, Igor A. Gulidov1,Gamzat G. Aminov1, Elena V. Litvyakova1, Irina A. Zharikova1
1 Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2 National Medical Research Radiological Centre, Moscow, Russia;
3 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
4 Herzen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, Moscow, Russia
kismarvic@mail.ru
Abstract
Relevance. Breast cancer is the first most common cancer in women not only in Russia, but also around the world. In Russia in 2021, there were 76 000 women diagnosed with breast cancer. As a result of screening programmes, preventive examinations, and educational work, the detection rate of the disease at stages I–II has reached 72%. This determines the implementation of organ-preserving surgical interventions, but a postoperative course of radiotherapy can significantly worsen the cosmetic result.
Materials and methods. In our work, we analyzed the cosmetic results in 166 patients who received surgical treatment including lumpectomy for breast cancer with cT1сN0M0 stage. All patients had a luminal, HER2 negative tumor subtype. In accordance with the treatment methods, the main clinical group A (n=80) was formed, which included women who underwent organ-preserving surgical treatment and multifractional high-dose rate brachytherapy with a dose of 1.7 Gy ×2 times a day up to a dose of 34 Gy. Group B (n=86) included patients who underwent organ-preserving surgery and standard radiation therapy with a dose of 2 Gy per day up to a dose of 50 Gy. The groups were comparable in molecular biological characteristics, age and number of patients.
Results. According to the 4-scale assessment of cosmetic results, it should be noted that after 6 months, “excellent” and “good cosmetic result” was higher in group B and it was 81.4% compared to 62.5% in Group A. This was due to the defects in the area of introducers placement and additional pigmentation in this area. According to our data, at 24 months there was an increase in “satisfactory” results in the group with external beam radiation therapy, which was associated with the occurrence of late radiation injuries, and the group with interstitial radiation therapy has better cosmetic results of 87.5% compared to 77.9%, as well as fewer satisfactory results: 12.5% compared to 22.1%.To receive a subjective assessment from the patients, we used a questionnaire with a 10-point scale. When studying questionnaires, it was noted that in group A, women were more satisfied with the cosmetic results, which was associated not only with a less scope of surgical intevention (lumpectomy versus sectoral resection), which affected the shape of the mammary gland, but also in this group there was less swelling and thickening of the breast skin and changes in the breast tissue itself.
Conclusions. Brachytherapy in patients with early stages of breast cancer has good cosmetic results, which has a positive effect on the emotional state of women.
Keywords: breast cancer, lumptectomy, Ir-192 brachytherapy, cosmetic result.
For citation: Kiseleva M.V., Kaprin А.D., Ivanov S.А., Gulidov I.A., Aminov G.G., Litviakova E.V., Zharikova I.A. Cosmetic results of using high-output Ir-192 brachytherapy in the treatment of luminal breast cancer. Clinical review for general practice. 2024; 5 (12): 10–16 (In Russ.).
DOI: 10.47407/kr2024.5.12.00531
Введение
Рак молочной железы (РМЖ) занимает первое место среди онкологических патологий по заболеваемости у женского населения не только в России, но и в мире.В России в 2021 г. выявлено 76 тыс. новых случаев данного заболевания у женщин [1].
Благодаря скринингу, профилактическим осмотрам, просветительской работе частота выявления заболеваний на I–II стадии достигла 72% [2].
Увеличение числа больных с локализованными формами РМЖ в развитых странах привело к росту органосохраняющих операций, что позволило обеспечить улучшение качества жизни этого контингента [3].
Одной из основных проблем органосохраняющего лечения является более высокий риск развития местных рецидивов опухоли по сравнению с радикальной мастэктомией [4–6]. Для снижения риска местного рецидива проводится послеоперационная дистанционная лучевая терапия. Как показали результаты крупных рандомизированных исследований (NSABP, EORTC, UK CCCR, EBCTCG), дистанционная лучевая терапия позволяет уменьшить частоту возникновения местных рецидивов на 60–70% при инвазивном РМЖ [7].
Однако ранние и поздние лучевые осложнения кожи, смежных органов, а также самой молочной железы зачастую нивелируют косметический результат проведенного хирургического лечения и ухудшают качество жизни пациенток. Длительные сроки лечения отрицательно сказываются на экономическом аспекте лечения РМЖ.
Согласно исследованиям Е.В. Хмелевского, изучившего осложнения дистанционной лучевой терапии 1032 женщин, влажные и сухие эпидермиты встречались в 72% случаев, а частота пульмонитов и кардиальных поражений достигала 10–15% случаев [8]. Следует отметить, что, по данным Биндт и соавт. [9], пульмониты приводят к потере части легкого, что равносильно утрате 15 лет жизни пациентки. Постлучевые изменения сердечно-сосудистой системы являются причиной вторичной сердечной смертности у 5% излеченных от рака женщин.
Альтернативным методом контроля местного рецидива может выступать брахитерапия, которая существенно сокращает время лечения, воздействуя только на часть ткани молочной железы, окружающую область лампэктомии [10, 11]. Таким образом, уменьшается воздействие излучения на сердце и легкие, по сравнению с облучением всей молочной железы [12]. Снижение воздействия излучения на окружающие здоровые ткани уменьшает риск возникновения вторичных радиационно-индуцированных злокачественных новообразований [13, 14].
В исследованиях Шарлоты Э. Коулз опубликованы данные 3-й фазы пятилетних результатов, где на 2018 женщинах доказана безопасность и эффективность частичного облучения молочной железы по сравнению с полным ее облучением. В данном исследовании были оценены и косметические результаты. Для этого все пациентки заполняли базовый опросник Европейской организации по исследованию и лечению рака (EORTC) QLQ-C30, модуль EORTC QLQ-BR23 по РМЖ, шкалу изображений тела, вопросы, относящиеся к протоколу (изменился ли внешний вид кожи, изменился ли общий вид груди, грудь стала меньше, грудь стала тверже на ощупь или присутствует ригидность), больничную шкалу тревоги и депрессии и другие вопросы. Эти опросники заполнялись до брахитерапии, через 6 мес, а также через 1, 2 и 5 лет. Кроме опросников выполнялись фотографии молочных желез до облучения, через 2 года и через 5 лет. По данным этого исследования не обнаружено доказательств статистически значимой разницы в доле пациенток с изменением внешнего вида груди ни при экспериментальном режиме, ни при лучевой терапии всей молочной железы через 2 года (уменьшенная доза p=0,527; частичная лучевая терапия молочной железы p=0,446) или через 5 лет (уменьшенная доза p=0,917; частичная лучевая терапия молочной железы p=0,165) [15].
Аналогичным исследованием, изучившим поздние побочные эффекты и косметические результаты у пациенток, получавших брахитерапию по сравнению с общим облучением молочной железы, было исследование Гасаба Полгара [16]. В исследование вошли 1328 пациенток, рандомизированных на 2 группы: с общим облучением молочной железы – 673 пациентки или брахитерапией – 655 пациенток. Пятилетние профили токсичности и косметические результаты были аналогичны в двух подгруппах, со значительно меньшим количеством поздних кожных побочных эффектов 2–3-й степени после брахитерапии. Эти результаты предоставляют дополнительные клинические доказательства рутинного использования APBI на основе интерстициальной мультикатетерной брахитерапии при лечении пациенток с РМЖ низкого риска прогрессирования, которые делают выбор в пользу сохранения груди.
Материалы и методы
 В наше ретроспективное исследование включены 166 пациенток, имеющих стадию заболевания cT1сN0M0, получивших хирургическое лечение в объеме лампэктомии. По молекулярно-биологическому подтипу у всех диагностирован люминальный HER2 отрицательный подтип опухоли.
В наше ретроспективное исследование включены 166 пациенток, имеющих стадию заболевания cT1сN0M0, получивших хирургическое лечение в объеме лампэктомии. По молекулярно-биологическому подтипу у всех диагностирован люминальный HER2 отрицательный подтип опухоли.В соответствии с методиками лечения сформирована основная клиническая группа A (n=80), в которую вошли женщины с органосохранным хирургическим лечением и мультифракционной высокомощностной брахитерапией в РОД 1,7 Гр два раза в день до СОД 34 ГР.
Группа Б (n=86) – пациентки с органосохранным хирургическим лечением и стандартной лучевой терапией в РОД 2 Гр в день до СОД 50 Гр.
Возраст пациенток был старше 50 лет.
Группы пациенток и возраст соответствовал протоколу «Высокомощностная брахитерапия в комплексном лечении рака молочной железы», утвержденного в МРНЦ 15.02.2019.
Как видно из табл. 1. группы были сопоставимы по молекулярно-биологическим характеристикам опухоли, возрасту и числу пациенток.
Для оценки косметического эффекта нами была разработана анкета-опросник (табл. 2), которую пациентки заполняли после завершения лучевой терапии, через 3, 6, 12, 24 мес.
Через 3, 6 и 12 мес после операции, далее каждые 12 мес пациентки проходили плановое контрольное обследование в соответствии с программой наблюдения больных РМЖ.
Пациентки самостоятельно заполняли анкету, отвечая на вопросы. При ответе учитывалась 10-балльная шкала, где 1 – это отрицательный результат, а 10 – максимально положительный. В анкете вопросы отражают субъективную оценку своих молочных желез, с оценкой кожи, плотности тканей, наличия патологических изменений и косметического эффекта.
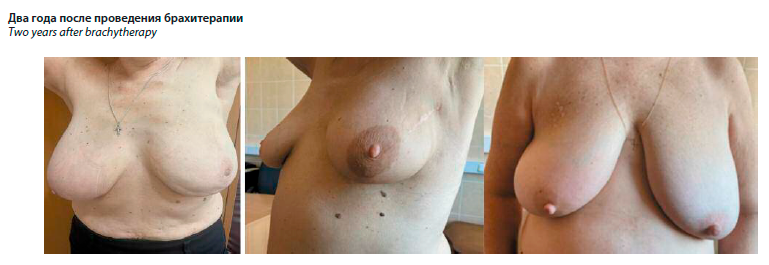
Для объективной оценки использовались фотографии молочных желез, выполненные до хирургического лечения, перед лучевой терапией и спустя 6, 12 и 24 мес.
Как видно из ниже представленных фотографий, выполненных на сроке 2 года после проведенного лечения (см. рисунок), визуализируются отличные косметические показатели по состоянию кожи и ткани молочной железы. Не отмечается фиброза и постлучевых изменений. Учитывая возраст пациенток, состояние подкожно-жировой клетчатки (ПЖК), по данным пальпации, не отличалось от здоровой молочной железы.
Дополнительно использовалась и 4-ступенчатая шкала, принятая в Joint Center for Radiation Therapy (Бостон, США) [17]. Данная шкала служила для субъективной оценки врача хирурга и радиолога после проведенного лечения.
Согласно данной шкале:
1) прекрасный косметический эффект – полная симметричность молочных желез, отсутствие поздних лучевых повреждений кожи и ПЖК;
2) хороший косметический эффект – незначительная асимметрия молочных желез, вызванная послеоперационными рубцовыми изменениями и поздними лучевыми повреждениями кожи и ПЖК I степени;
3) удовлетворительный косметический эффект – выраженная асимметрия, деформация молочных желез, вызванная послеоперационными рубцовыми изменениями и/или поздними лучевыми повреждениями кожи и ПЖК II степени;
4) плохой косметический эффект – значительная асимметрия и деформация молочных желез, вызванная послеоперационными рубцовыми изменениями и поздними лучевыми повреждениями кожи и ПЖК III–IV степени.

Объективную оценку выполнял врач-онколог, не принимавший участия в лечении пациенток, включенных в исследование, и не имеющий информации о проводимой лучевой терапии. При осмотре и пальпации учитывались наиболее часто возникающие косметические дефекты, такие как телеангиэктазии, жировой некроз, фиброз.
Телеангиэктазии характеризуются локальной дилатацией мелких сосудов, приводящих к покраснению кожи. Врачом-онкологом проводился подсчет числа телеангиэктазий на 1 см2 облученных кожных покровов. Согласно Common Terminology Criteria for Adverse Events (CTCAE) v. 5.0 (2017) при наличии телеангиэктазий, покрывающих <10% исследуемой площади, присваивалась I степень, при наличии телеангиэктазий, покрывающих >10% исследуемой площади, – II степень.
Фиброз – это прогрессирующая индурация, отек и утолщение дермы и подкожных тканей [18]. Для уточнения наличия и степени выраженности постлучевого фиброза проводили осмотр и пальпацию молочных желез, а степень фиброза определяли в соответствии со следующими критериями:
• 0 – изменений нет;
• I степень – фиброз и атрофия кожи слабо выражены;
• II степень – умеренно выраженный фиброз и телеангиэктазии;
• III степень – выраженная атрофия и фиброз с площадью >10% зоны облучения;
• IV степень – зоны некроза и изъязвления.
Результаты
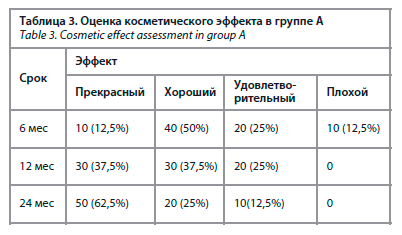
 Косметический эффект проведенного лечения оценен у 166 пациенток через 6, 12, 24 мес после окончания лечения. Согласно 4-шкальной оценке косметических результатов, следует отметить, что на сроке 6 мес «прекрасный» и «хороший косметический эффект» был выше в группе Б и он составил 81,4% против 62,5% в группе А (табл. 3, 4). Это было связано с наличием дефектов в области введения интрадьюсеров и дополнительной пигментации в данной области.
Косметический эффект проведенного лечения оценен у 166 пациенток через 6, 12, 24 мес после окончания лечения. Согласно 4-шкальной оценке косметических результатов, следует отметить, что на сроке 6 мес «прекрасный» и «хороший косметический эффект» был выше в группе Б и он составил 81,4% против 62,5% в группе А (табл. 3, 4). Это было связано с наличием дефектов в области введения интрадьюсеров и дополнительной пигментации в данной области.На сроке 12 мес также отмечается преимущество в косметическом результате в подгруппе пациенток, получавших дистанционную лучевую терапию, однако отмечается уменьшение разрыва между двумя группами (81,4% против 75% соответственно).
Согласно нашим данным, на сроке 24 мес отмечается увеличение «удовлетворительных» результатов в группе с дистанционной лучевой терапией, что связано с возникновением поздних лучевых повреждений. Группа с внутритканевой лучевой терапией имеет лучшие косметические результаты (87,5% против 77,9%), а также меньшее количество «удовлетворительных» результатов (12,5%, против 22,1%).
Учитывая, что вышеизложенное оценивалось независимым онкологом, нам было интересно узнать мнение самих пациенток и их субъективную оценку косметических результатов.
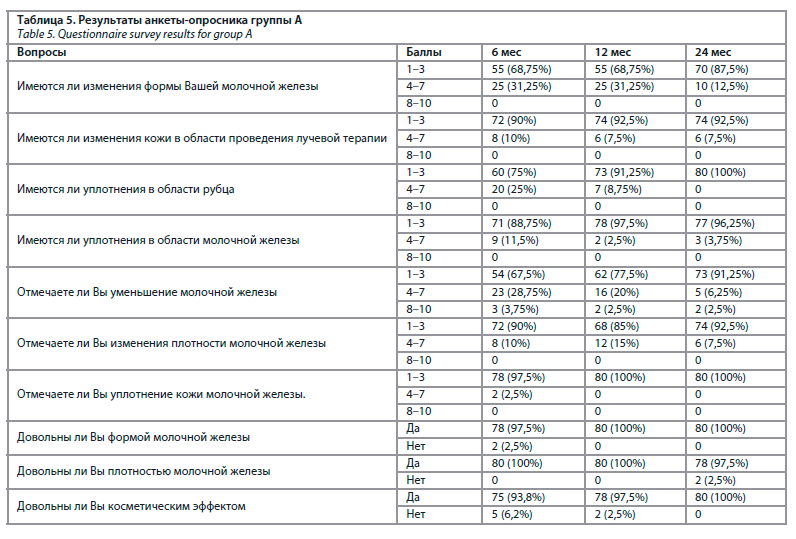
При анализе анкет, заполняемых пациентками, мы использовали 10-балльную систему. Для оценки данных ответов мы объединили балльную систему следующим образом: 1–3 балла – незначительные изменения, 4–7 баллов – средние изменения, 8–10 баллов – выраженные изменения. А на последние три вопроса ответы делились на «да» и «нет» (табл. 5, 6).


Обсуждение
В последнее время все больше внимание уделяется не только увеличению общей и безрецидивной выживаемости при лечении РМЖ, но и косметическим результатам, которые помогают в социализации и реабилитации пациенток, перенесших данное заболевание.Проведенные зарубежные исследования не выявили разницы в косметических результатах. Поэтому в нашем исследовании мы оценивали не только объективный статус, но и оценку самих женщин кожи и ткани молочной железы после проведенного лечения на разных сроках после проведенного лечения.
Полученные результаты отличались от данных зарубежных авторов, что вызывает интерес и самобытность данного исследования.
При изучении анкет-опросников отмечается, что в подгруппе А женщины были более довольны косметическим эффектом, что связано не только с уменьшением объема хирургического лечения (лампэктомия против секторальной резекции), что влияло на форму молочной железы, но также в данной подгруппе отмечались меньшая частота отека и уплотнения кожи молочной железы и изменения самой ткани молочной железы.
Выводы
Проведение брахитерапии при начальных формах РМЖ является не только безопасным методом, не ухудшающим общую и безрецидивную выживаемость, но и видом лечения, который помогает получить хорошие косметические результаты и тем самым социализировать и реабилитировать пациенток.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Киселева Марина Викторовна – д-р мед. наук, проф., зав. отд-нием новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: kismarvic@mail.ru; ORCID: 0000-0001-8464-1726
Marina V. Kiseleva – Dr. Sci. (Med.), Full Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: kismarvic@mail.ru; ORCID: 0000-0001-8464-1726
Каприн Андрей Дмитриевич – д-р мед. наук, проф., академик РАН, академик РАО, член Президиума РАН, член Президиума РАО, заслуженный врач России, генеральный директор ФГБУ «НМИЦ радиологии», зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института РУДН, директор МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Dr. Sci. (Med.), Full Prof., Acad. RAS, Acad. RAE, General Director National Medical Research Radiological Centre, Head of the Department, Patrice Lumumba People’s Friendship university of Russia (RUDN University), Director Hertsen Moscow Oncology Research Institute. ORCID: 0000-0001-8784-8415
Иванов Сергей Анатольевич – д-р мед. наук, чл.-корр. РАН, директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии», проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института РУДН. ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Dr. Sci. (Med.), Corr. Memb. RAS, Director of Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). ORCID: 0000-0001-7689-6032
Гулидов Игорь Александрович – д-р мед. наук, проф., зав. отделом лучевой терапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии», засл. деятель науки России, засл. врач России, член Европейского общества терапевтической радиологии и онкологии и Российской ассоциации терапевтических радиационных онкологов
Igor A. Gulidov – Dr. Sci. (Med.), Full Prof., Head of the Radiotherapy Department, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre
Аминов Гамзат Гашимович – канд. мед. наук, врач отд-ния новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0009-0007-4649-8878
Gamzat G. Aminov – Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0009-0007-4649-8878
Литвякова Елена Викторовна – врач отд-ния новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: el.lit95@mail.ru; ORCID: 0000-0001-9146-2603
Elena V. Litvyakova – doctor, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: el.lit95@mail.ru; ORCID: 0000-0001-9146-2603
Жарикова Ирина Анатольевна – канд. мед. наук, ст. науч. сотр. отд-ния новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-9187-9863
Irina A. Zharikova – Cand. Sci. (Med.), Senior Res. Officer, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0001-9187-9863
Поступила в редакцию: 28.11.2024
Поступила после рецензирования: 06.12.2024
Принята к публикации: 12.12.2024
Received: 28.11.2024
Revised: 06.12.2024
Accepted: 12.12.2024
Список исп. литературыСкрыть список1. Злокачественные новообразования в России в 2023 году (заболеваемость и смертность). Под ред. А.Д. Каприна и др. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2024. ISBN 978-5-85502-298-8
Malignant neoplasms in Russia in 2023 (morbidity and mortality). Ed. A.D. Kaprin et al. Moscow: Herzen Moscow Oncology Research Institute – branch of National Medical Research Center for Radiology, 2024. ISBN 978-5-85502-298-8 (in Russian).
2. Рак молочной железы в цифрах: эпидемиология, диаграммы, видео. Информационно-аналитическое издание «Вместе против рака» 1 июня 2022 года. URL: https://protiv-raka.ru/analytics/epidemiologiya-rmzh-v-interaktivnyh-diagrammah/
Breast cancer in numbers: epidemiology, diagrams, videos. Information and analytical publication «Together against cancer» on June 1, 2022. URL: https://protiv-raka.ru/analytics/epidemiologiya-rmzh-v-interaktivnyh-diagrammah/ (in Russian).
3. Vaidya JS, Joseph DJ, Tobias JS et al. Targeted intraoperative radiotherapy versus whole breast radiotherapy for breast cancer (TARGIT-A trial): an international, prospective, randomized, non-inferiority phase 3 trial. Lancet 2010;376(9735):91-102.
4. Fisher B, Anderson S, Bryant J et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med 2002;347(16):1233-41.
5. Pawlik TM, Buchholz TA, Kuerer HM. The biologic rational for and emerging role of accelerated partial breast irradiation for breast cancer. J Am Coll Surg 2004;199(3):479-92.
6. Schroen AT, Brenin DR, Kelly MD et al. Impact of patient distance to radiation therapy on mastectomy use in early-stage breast cancer patients. J Clin Oncol 2005;23(28):7074-80.
7. Вершинина Д.А., Семиглазов В.В., Новиков С.Н. Повышение эффективности послеоперационной лучевой терапии раннего рака молочной железы. Эффективная фармакотерапия. 2020;16(11): 32–41.
Vershinina D.A., Semiglazov V.V., Novikov S.N. Improving the effectiveness of postoperative radiation therapy for early breast cancer. Effective pharmacotherapy. 2020;16(11):32–41 (in Russian).
8. Хмелевский Е.В., Добренький М.Н., Сергоманова Н.Н. и др. Факторы риска постлучевых поражений при заболевании раком молочной железы. Вестник Российского научного центр рентгенорадиологии №5 Москва. URL: http://vestnik.rncrr.ru/vestnik/v5/papers/hmel_v5.htm
Khmelevsky E.V., Dobrenky M.N., Sergomanova N.N. et al. Risk factors for post-radiation lesions in breast cancer. Bulletin of the Russian Scientific Center of Radiology No.5 Moscow. URL: http://vestnik. rncrr.ru/vestnik/v5/papers/hmel_v5.htm (in Russian).
9. Бинд П., Росфорс С., Веннберг Б. и др. Функция легких после адъювантной химиотерапии и лучевой терапии рака молочной железы и вопросы трехмерного планирования лечения. Radiother Oncol. 1998;49:245-54.
Band P., Rosfors S., Weinberg B. et al. Lung function after adjuvant chemotherapy and radiation therapy for breast cancer and issues of three-dimensional treatment planning. Radiother Oncol. 1998;49:245-54 (in Russian).
10. Arthur DW, Winter K, Kuske RR et al. A Phase II trial of brachytherapy alone after lumpectomy for select breast cancer: tumor control and survival outcomes of RTOG 95-17. Int J Radiat Oncol Biol Phys 2008;72:467-47.
11. Cormick B. A Phase II trial of brachytherapy alone after lumpectomy for select breast cancer: tumor control and survival outcomes of RTOG 95-17. Int J Radiat Oncol Biol Phys 2008;72:467-47.
12. Masuda N et al. Neoadjuvant anastrozole versus tamoxifen in patients receiving goserelin for premenopausal breast cancer (STAGE): a double-blind, randomised phase 3 trial. Lancet Oncol 2012;13(4):345-52. DOI: 10.1016/S1470-2045(11)70373-4
13. Latorre, Javier Anchuelo; Galdós et al. Accelerated partial breast irradiation in a single 18 Gy fraction with high-dose-rate brachytherapy: preliminary results. Journal of Contemporary Brachytherapy 2018;10(1):58-63.
14. Vicini FA, Beitsch PD, Quiet CA et al. Three-year analysis of efficacy, cosmetic, and toxicity by the American Society of Breast Surgeons MammoSite breast brachytherapy registry trial in patients with accelerated partial breast irradiation (APBI). Cancer 2008;112(4):758-66.
15. Wishart, Gordon et al. Partial-breast radiotherapy after breast conservation surgery for patients with early breast cancer (UK IMPORT LOW trial): 5- year results from a multicentre, randomised, controlled, phase 3, non-inferiority trial. The Lancet. Online First – In Press, Corrected Proof, 2017.
16. Polgár C, Ott OJ, Hildebrandt G et al; Groupe Européen de Curiethérapie of European Society for Radiotherapy and Oncology (GEC-ESTRO).
17. Wazer DE, Kaufman S, Cuttino L et al. Accelerated partial breast irradiation: an analysis of variables associated with late toxicity and long-term cosmetic outcome after high-dose-rate interstitial brachytherapy. Int J Radiat Oncol Biol Phys 2006;64(2):489-95.
18. Radiation Therapy Oncology Group National Surgical Adjuvant Breast and Bowel Project (NSABP) protocol B-39 and Radiation Therapy Oncology Group (RTOG) protocol 0413. 2005. Mar. Accessed Oct 22, 2010.

