Клинический разбор в общей медицине №12 2024
Ruiz Ninõ de Guzmán Roberto, Oleg B. Karyakin
Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia
shukina-elizavet@mail.ru
Abstract
Renal cell carcinoma is one of the most common malignant neoplasms of the genitourinary system. Disease progression occurs in 30% of patients after radical surgical treatment. Disease progression with metastatic spread to the contralateral kidney is quite rare (in 1–2% of cases). In such cases, differential diagnostics of disease progression with primary multiple malignant neoplasms of the kidneys is relevant. This is necessary to determine the correct treatment for patients.
Keywords: renal cell carcinoma, renal cell carcinoma progression, metastatic spread to the contralateral kidney, primary multiple cancer.
For citation: Chaykov V.S., Shchukina E.O., Dementev I.O., Biryukov V.A., Ruiz Ninõ de Guzmán Roberto, Karyakin O.B. Clinical case of long-term surgical treatment of a patient with progression of renal cell carcinoma. Clinical review for general practice. 2024; 5 (12): 18–25 (In Russ.). DOI: 10.47407/kr2024.5.12.00532
В случае поражения контрлатеральной почки актуальна дифференциальная диагностика прогрессирования заболевания с первично-множественными злокачественными новообразованиями почек. По данным литературы, первично-множественный рак почки развивается в 4,6% случаев [23]. Сделать вывод о таком заболевании возможно в случае, если опухоли имеют разную гистологическую структуру при исключении лечебного патоморфоза метастазов, и каждая из них должна иметь картину злокачественности; кроме того, исключена вероятность метастазирования одной опухоли по отношению к другой. Основная трудность диагностики состоит в доказательстве разной гистологической структуры опухолей, что часто ведет к неправильному стадированию и усложняет принятие решения о выборе тактики ведения пациента [24].
Обобщив вышесказанное, считаем интересным собственное клиническое наблюдение длительного лечения больного раком почки с прогрессированием заболевания.
Пациент Т., 55 лет, в марте 2002 г. обратился за медицинской помощью в МРНЦ им. А.Ф. Цыба. Из анамнеза известно, что 23.02.2002 больной отметил эпизод макрогематурии, а 08.03.2002 появление боли в поясничной области справа. В связи с появившимися симптомами по месту жительства было выполнено УЗИ органов брюшной полости, выявлено образование верхнего полюса правой почки размерами ~80×60 мм. Для лечения больной обратился в отделение онкоурологии МРНЦ им. А.Ф. Цыба. По данным урографии (03.04.2002), в верхнем полюсе правой почки определяется объемное образование ~80×60 мм, выступающее в значительной степени за пределы почки и смещающее книзу деформированные верхние чашечки. При остеосцинтиграфии данных, подтверждающих специфическое поражение костей скелета, не получено. При рентгенологическом исследовании органов грудной клетки патологических изменений не выявлено. Была проведена почечная ангиография (09.04.2002): в верхнем и среднем сегменте правой почки определяется умеренно васкуляризованная опухоль 12×8 см, выходящая за капсулу почки. Правая почечная вена не визуализируется.
Таким образом, по результатам проведенных обследований пациенту поставлен клинический диагноз: рак правой почки сТ3аN0М0, III стадия. 11.04.2002 проведено хирургическое лечение в объеме: лапаротомия, нефрэктомия справа. Послеоперационный период протекал без особенностей, дренаж из забрюшинного пространства справа удален на третьи сутки.
 Результаты планового морфологического исследования: почечноклеточный светлоклеточный рак, многоузловая форма роста. Имеется распространение на ткань почки и в жировую клетчатку почки, в других местах отграничена от прилежащих тканей фиброзной капсулой. Установлен заключительный диагноз: рак правой почки III стадии рT3аN0M0.
Результаты планового морфологического исследования: почечноклеточный светлоклеточный рак, многоузловая форма роста. Имеется распространение на ткань почки и в жировую клетчатку почки, в других местах отграничена от прилежащих тканей фиброзной капсулой. Установлен заключительный диагноз: рак правой почки III стадии рT3аN0M0.
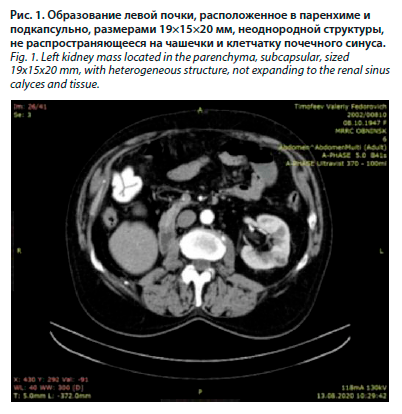
Пациенту было рекомендовано динамическое наблюдение, под которым он находился в течение 16 лет (192 мес). В марте 2018 г. при очередном контрольном обследовании по месту жительства при рентгенографии органов грудной клетки выявлено затемнение в правом легком. Выполнена спиральная компьютерная томография (СКТ) органов грудной клетки (22.03.2018): образование по ходу задней и боковой костальной плевры левого легкого размерами до 16 мм. 27.03.2018 обратился в МРНЦ. Позитронно-эмиссионная томография (ПЭТ)-КТ от 19.04.2018: признаки образования в паренхиме правого легкого (S6) и по плевре справа. Учитывая отсутствие другой очаговой патологии и олигометастатический характер поражения правого легкого, на междисциплинарном консилиуме была выбрана хирургическая тактика лечения. 11.05.2018 выполнена видеоторакоскопическая резекция нижней доли правого легкого и костальной плевры. Морфологическая и иммуногистохимическая картина соответствовали метастазу светлоклеточного ПКР. Пациент находился под динамическим наблюдением 17 мес, до ноября 2019 г. По результатам СКТ 01.11.2019 выявлено очаговое образование в нижней доле правого легкого в S10 размером до 16×13 мм, расположенное субплеврально. По данным ПЭТ-КТ 17.11.2019 в S10 правого легкого субплеврально определяется мягкотканное образование размерами 12×17 мм с гиперфиксацией радиофармпрепарата (РФП). Других очагов патологического накопления РФП не выявлено. Пациент обсужден на междисциплинарном консилиуме, 11.12.2019 выполнена видеоторакоскопическая резекция правого легкого. Морфологическая и иммуногистохимическая картина соответствовали метастазу светлоклеточного ПКР. Пациент был оставлен под наблюдение. Спустя 8 мес, в августе 2020 г., при контрольной СКТ в паренхиме левой почки выявлено образование негомогенной кистозной плотности, расположенное в паренхиме и подкапсульно, размерами 19×15×20 мм, неоднородной структуры, не распространяющееся на чашечки и клетчатку почечного синуса (рис. 1). 16.09.2020 выполнена люмботомия, резекция левой почки.
Послеоперационный период протекал без осложнений. Результат планового морфологического исследования: светлоклеточный ПКР почки, grade 3 по ISUP. Опухоль не прорастает в капсулу почки, паранефральная жировая клетчатка интактна. От опухоли до ближайшего паренхиматозного края резекции 1 мм. В крае резекции опухоли не обнаружено. При сравнительном анализе гистологических препаратов опухолей левой и правой почек обнаружена аналогичная морфологическая и иммуно-гистохимическая картина, что позволило установить окончательный диагноз: рак правой почки сT3аN0M0, III стадия, II клиническая группа. Радикальная нефрэктомия справа (2002 г.) рT3аN0M0. Прогрессирование (май 2018 г.). Метастатическое поражение правого легкого. Видеоторакоскопическая резекция правого легкого 2018 г. Прогрессирование (ноябрь 2019 г.). Метастатическое поражение правой плевральной полости. Видеоторакоскопическое удаление опухоли плевры справа 2019 г. Прогрессирование (август 2020 г.). Метастатическое поражение левой почки. Резекция левой почки 2020 г.
Пациент продолжил динамическое наблюдение до 2024 г., когда при контрольном обследовании 29.08.2024 по результатам ПЭТ-КТ с 18F-ФДГ было выявлено очаговое образование левой почки размером 11 мм, с метаболической активностью 18F-ФДГ (SUVmax=5,4), очаг в левом легком на границе S4/S2 7 мм, очаг накопления РФП в верхней трети правой бедренной кости (SUVmax=3,2), что соответствует проявлению неопластического процесса. На междисциплинарном консилиуме принято решение о проведении лекарственного лечения по схеме левантиниб + пембролизумаб. Таким образом, общее время наблюдения за пациентом на момент публикации составило 22 года (266 мес).
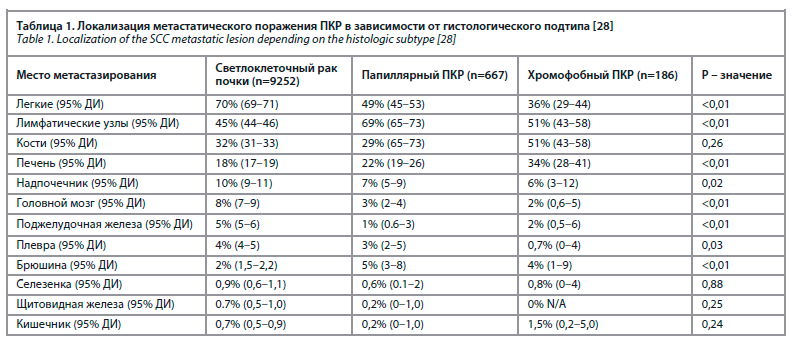
В когортном исследовании Shaan Dudani и соавт., включавшем 10 105 пациентов, была изучена частота и локализация метастатических очагов в зависимости от гистологического подтипа. Исследование включало в себя 9252 пациента со светлоклеточным ПКР (92%), 667 пациентов с папиллярным ПКР (7%) и 186 пациентов с хромофобным ПКР (2%) (табл. 1) [28].
Согласно последним рекомендациям NCCN метастазэктомия и нефрэктомия показаны пациентам с первичным ПКР и олигометастазами или тем пациентам, у кого олигометастазы развились после длительного безрецидивного периода после проведенной нефрэктомии. Данному лечению могут быть подвержены очаги, имеющие такую локализацию, как кости, мозг и легкие. Первичная опухоль и метастазы могут быть удалены во время одной процедуры или в разное время [29].
Метастазы в легких связаны с наилучшим прогнозом при относительно низкой смертности и заболеваемости. Ouzaid и соавт. [30] в систематическом обзоре определили 1-, 3-, 5- и 10-летнюю общую выживаемость в 84%, 59%, 43% и 20% соответственно.
Было показано, что метастазы в легких имеют более высокую общую выживаемость после метастазэктомии по сравнению с таргетной или иммунотерапией [31]. Procházková и соавт. изучили группу из 35 пациентов с метастатическим поражением легких при ПКР. Пациенты подверглись метастазэктомии. Исследование продемонстрировало трехлетнюю общую выживаемость без прогрессирования (ВБП) 63,5% и 39,4% соответственно и пятилетнюю общую выживаемость и ВБП 44,9% и 29% соответственно. Авторы пришли к выводу, что общая выживаемость и ВБП значительно зависели от размера метастатического очага [32]. Согласно опубликованным данным, размер метастазов ≥2 см и длительность безрецидивного периода 5 лет являются независимыми прогностическими факторами для выживания [33].
Международный регистр пациентов с метастазами в легких на основе трех параметров – резектабельности, длительности безрецидивного интервала и количества метастазов создал шкалу (табл. 2), которая классифицирует пациентов на четыре прогностические группы [34].
На сегодняшний день известно, что рак почки является иммуногенной опухолью, в результате чего разработаны эффективные режимы лечения на основе таргетных и иммуноонкологических препаратов (рис. 2).
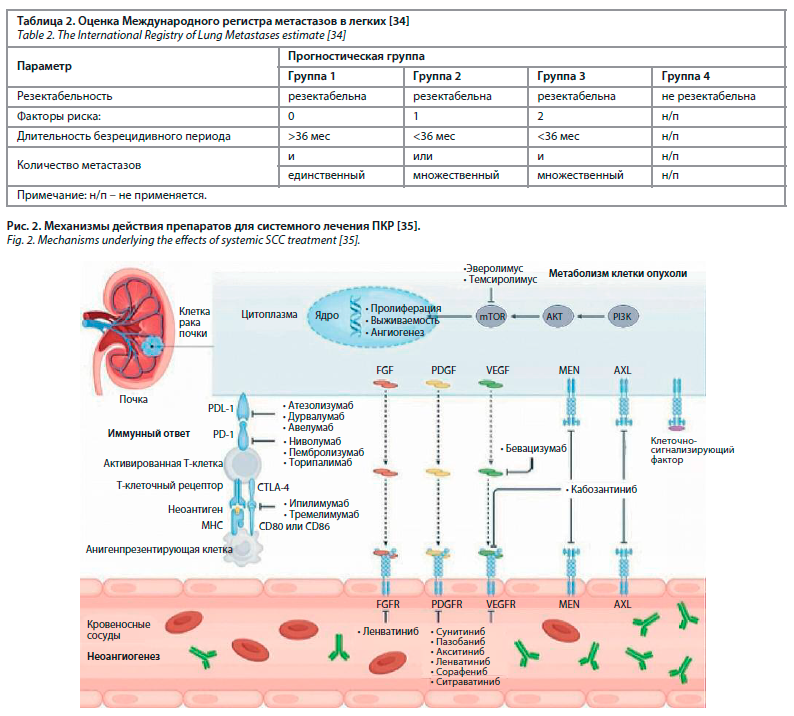
Таргетные препараты блокируют функции генов, связанных с ангиогенезом или функционирующих в составе основных сигнальных путей развития рака почки. К ним относятся ингибиторы тирозинкиназ: акситиниб, кабозантиниб, ленватиниб (одобрен в комбинации с эверолимусом), пазопаниб, сорафениб и сунитиниб, а также антитело к VEGF – бевацизумаб [36, 37]. Благодаря усовершенствованию молекулярных технологий появились более эффективные новые подходы и препараты: современная иммунотерапия, основанная на ингибировании иммунных контрольных точек. Контрольные точки – особые молекулы на клетках иммунной системы, которые используются для того, чтобы здоровые клетки могли сдерживать цитотоксические лимфоциты от иммунной атаки. В настоящий момент в иммунотерапии рака почки наибольшее внимание уделяется моноклональным антителам – ингибиторам контрольных точек – PD-1, PD-L1, CTLA-4 (cytotoxic T-lymphocyte-associatedprotein 4) [36]. По результатам клинических исследований, успешной явилась комбинация ингибиторов PD-1 (ниволумаб) и CTLA-4 (ипилимумаб), которая демонстрирует увеличение общей выживаемости больных ПКР, а также меньшую токсичность по сравнению с лечением сунитинибом, у пациентов промежуточного и неблагоприятного прогноза (табл. 3) [27, 36–39].
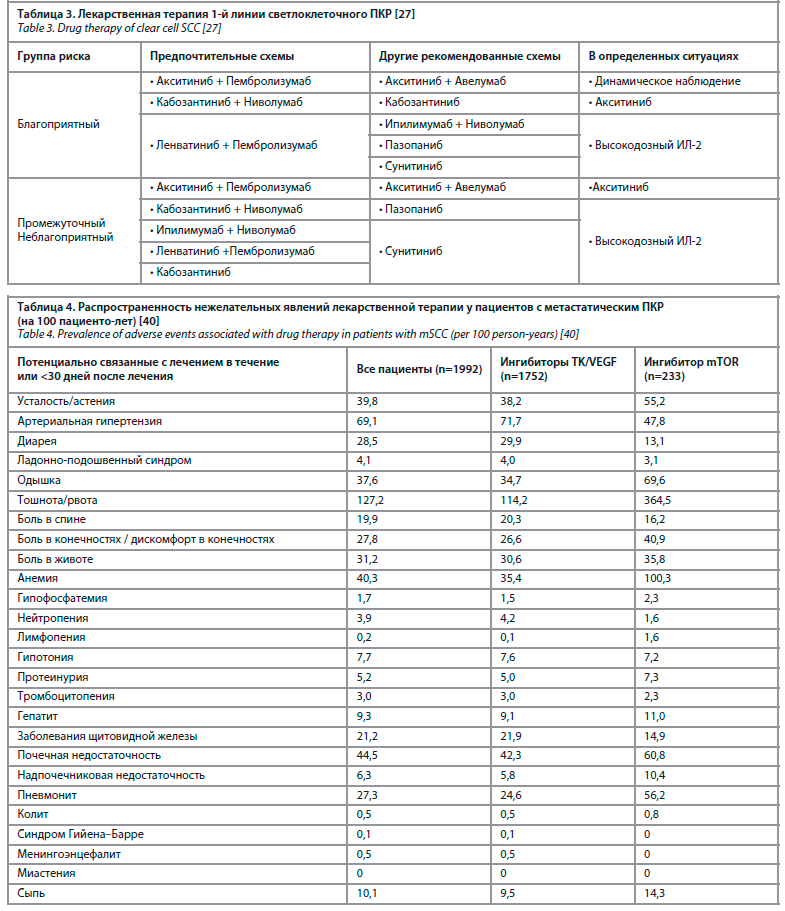
Однако, несмотря на высокую эффективность системного лечения, оно характеризуется нежелательными явлениями, затрагивающими, как правило, все системы организма пациента (табл. 4) [40].
В процессе терапии таргетными препаратами побочные реакции наблюдаются со стороны сердечно-сосудистой системы (изменение артериального давления, тромбозы, нарушения в электрокардиограмме, аритмии, мио- или перикардиты, инфаркт миокарда, кардиомиопатия, сердечная недостаточность (чаще левожелудочковая); дыхательной системы (двусторонние инфильтраты в легких, интерстициальный пневмонит, облитерирующий бронхиолит); мочевыделительной системы (протеинурия, микроангиопатия, нефротический синдром, почечная недостаточность); желудочно-кишечного тракта (диарея, мукозиты, перфорации, фистулы); центральной нервной системы (синдром задней обратимой лейкоэнцефалопатии); со стороны эндокринных желез (гипопаратиреоидизм); костного мозга; кожи (ладонно-подошвенный синдром, сыпь) [41, 42].
При терапии анти-CTLA–4 чаще всего поражается кожа (сыпь, зуд) и желудочно-кишечный тракт (диарея, колит) [42]. При терапии анти-PD–1/PD-L1 препаратами тяжелые побочные явления развиваются реже –
у 7–12% пациентов, и проявляются усталостью, сыпью, зудом, диарей, тошнотой, снижением аппетита и артралгией [44–47].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Чайков Владимир Сергеевич – врач-онколог, врач-хирург, науч. сотр. отд-ния лучевого и хирургического лечения урологических заболеваний с группой брахитерапии рака предстательной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-8711-4937
Vladimir S. Chaykov – Oncologist, Res. Officer, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-8711-4937
Щукина Елизавета Олеговна – врач-онколог отд-ния лучевого и хирургического лечения урологических заболеваний с группой брахитерапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: shukina-elizavet@mail.ru; ORCID: 0000-0001-5431-8696
Elizaveta O. Shchukina – Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: shukina-elizavet@mail.ru; ORCID: 0000-0001-5431-8696
Дементьев Иван Олегович – врач-уролог, мл. науч. сотр. отд-ния лучевого и хирургического лечения урологических заболеваний с группой брахитерапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: dementevio@mail.ru; ORCID: 0000-0003-2780-9822
Ivan O. Dementev – Urologist, Res. Assist., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: dementevio@mail.ru; ORCID: 0000-0003-2780-9822
Бирюков Виталий Александрович – канд. мед. наук, врач-онколог, радиотерапевт, ст. науч. сотр. отд-ния лучевого и хирургического лечения урологических заболеваний с группой брахитерапии рака предстательной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-6750-521X
Vitaly A. Biryukov – Oncologist, Cand. Sci. (Med.), Senior Res. Officer, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-6750-521X
Руис Ниньо Де Гузман Роберто – клинический ординатор по специальности «Онкология» 1-го года обучения, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии»
Ruiz Ninõ de Guzmán Roberto – Clinical Resident, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre
Карякин Олег Борисович – д-р мед. наук, проф., зав. отд-нием лучевого и хирургического лечения урологических заболеваний с группой брахитерапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: karyakin@mrrc.obninsk.ru; ORCID: 0000-0002-6112-2840
Oleg B. Karyakin – Dr. Sci. (Med.), Full Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: karyakin@mrrc.obninsk.ru; ORCID: 0000-0002-6112-2840
Поступила в редакцию: 03.12.2024
Поступила после рецензирования: 10.12.2024
Принята к публикации: 12.12.2024
Received: 03.12.2024
Revised: 10.12.2024
Accepted: 12.12.2024
Клинический разбор в общей медицине №12 2024
Клинический случай длительного хирургического лечения больного с прогрессированием почечно-клеточного рака
Номера страниц в выпуске:18-25
Аннотация
Почечно-клеточный рак – одно из наиболее распространенных злокачественных новообразований мочеполовой системы. Прогрессирование заболевания встречается у 30% пациентов после радикального хирургического лечения. Достаточно редко (в 1–2% случаев) встречается прогрессирование заболевания с метастатическим поражением контралатеральной почки. В таких случаях актуальна дифференциальная диагностика прогрессирования заболевания с первично-множественными злокачественными новообразованиями почек. Это необходимо для определения правильной тактики ведения пациента.
Ключевые слова: почечно-клеточный рак, прогрессирование почечно-клеточного рака, метастатическое поражение контралатеральной почки, первично-множественный рак.
Для цитирования: Чайков В.С., Щукина Е.О., Дементьев И.О., Бирюков В.А., Руис Ниньо Де Гузман Роберто, Карякин О.Б. Клинический случай длительного хирургического лечения больного с прогрессированием почечно-клеточного рака. Клинический разбор в общей медицине. 2024; 5 (12): 18–25. DOI: 10.47407/kr2024.5.12.00532
Почечно-клеточный рак – одно из наиболее распространенных злокачественных новообразований мочеполовой системы. Прогрессирование заболевания встречается у 30% пациентов после радикального хирургического лечения. Достаточно редко (в 1–2% случаев) встречается прогрессирование заболевания с метастатическим поражением контралатеральной почки. В таких случаях актуальна дифференциальная диагностика прогрессирования заболевания с первично-множественными злокачественными новообразованиями почек. Это необходимо для определения правильной тактики ведения пациента.
Ключевые слова: почечно-клеточный рак, прогрессирование почечно-клеточного рака, метастатическое поражение контралатеральной почки, первично-множественный рак.
Для цитирования: Чайков В.С., Щукина Е.О., Дементьев И.О., Бирюков В.А., Руис Ниньо Де Гузман Роберто, Карякин О.Б. Клинический случай длительного хирургического лечения больного с прогрессированием почечно-клеточного рака. Клинический разбор в общей медицине. 2024; 5 (12): 18–25. DOI: 10.47407/kr2024.5.12.00532
Clinical case of long-term surgical treatment of a patient with progression of renal cell carcinoma
Vladimir S. Chaykov, Elizaveta O. Shchukina, Ivan O. Dementev, Vitaly A. Biryukov,Ruiz Ninõ de Guzmán Roberto, Oleg B. Karyakin
Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia
shukina-elizavet@mail.ru
Abstract
Renal cell carcinoma is one of the most common malignant neoplasms of the genitourinary system. Disease progression occurs in 30% of patients after radical surgical treatment. Disease progression with metastatic spread to the contralateral kidney is quite rare (in 1–2% of cases). In such cases, differential diagnostics of disease progression with primary multiple malignant neoplasms of the kidneys is relevant. This is necessary to determine the correct treatment for patients.
Keywords: renal cell carcinoma, renal cell carcinoma progression, metastatic spread to the contralateral kidney, primary multiple cancer.
For citation: Chaykov V.S., Shchukina E.O., Dementev I.O., Biryukov V.A., Ruiz Ninõ de Guzmán Roberto, Karyakin O.B. Clinical case of long-term surgical treatment of a patient with progression of renal cell carcinoma. Clinical review for general practice. 2024; 5 (12): 18–25 (In Russ.). DOI: 10.47407/kr2024.5.12.00532
Введение
На сегодняшний день заболеваемость почечно-клеточным раком (ПКР) продолжает расти. В 2022 г. в мире, по данным Всемирной организации здравоохранения, зарегистрированы более 434 840 новых случаев ПКР [1]. В России рак почки в структуре злокачественных новообразований составляет 3,9% [2]. Благодаря развитию современных методов диагностики – ультразвуковому исследованию (УЗИ), компьютерной томографии (КТ), магнитно-резонансной томографии, опухоли почек часто выявляют на ранних стадиях [3, 4]. Наиболее эффективным и достоверно оправданным методом лечения локализованных и местно-распространенных форм рака почки остается хирургический. Однако у 20–40% пациентов после радикального хирургического лечения наблюдается прогрессирование ПКР [6–7]. Наиболее частая локализация метастазов при ПКР – легкие (до 50%), кости (30–40%), лимфатические узлы, реже печень и мозг [8–11]. Преобладающую долю всех случаев прогрессирования регистрируют в течение первых трех лет после радикально проведенного хирургического лечения [5]. Риск прогрессирования ПКР у данной группы пациентов напрямую связан со стадией опухолевого процесса, наличием несветлоклеточного ПКР, степенью дифференцировки опухоли (для местных рецидивов и метастазов) и использованием органосохраняющего лечения (для местных рецидивов). Риск местного рецидива ПКР повышается при использовании аблативного лечения и несколько ниже – после резекции почки (коррелирует с размерами удаленной опухоли) [12]. Частота местного рецидива после радикальной нефрэктомии колеблется от 1 до 2% в различных исследованиях [13–15]. Время диагностики местного рецидива варьирует от 3 мес до 45 лет, что подчеркивает важность длительного наблюдения больных [15–17]. Случаи рецидива рака почки после выполнения органосохраняющего хирургического лечения встречаются с частотой до 10,6% [18–21]. В 1–2% случаев у пациентов, перенесших радикальную нефрэктомию по поводу рака почки, встречается прогрессирование заболевания с метастатическим поражением контралатеральной почки [22]. В исследовании A.H. Bani-Hani и соавт. с участием более 2352 пациентов было определено, что прогрессирование возникает в среднем в течение 5–6 лет после хирургического лечения, а наиболее значимыми предикторами в данном случае являются положительный край резекции, мультифокальность опухоли и стадия заболевания [22].В случае поражения контрлатеральной почки актуальна дифференциальная диагностика прогрессирования заболевания с первично-множественными злокачественными новообразованиями почек. По данным литературы, первично-множественный рак почки развивается в 4,6% случаев [23]. Сделать вывод о таком заболевании возможно в случае, если опухоли имеют разную гистологическую структуру при исключении лечебного патоморфоза метастазов, и каждая из них должна иметь картину злокачественности; кроме того, исключена вероятность метастазирования одной опухоли по отношению к другой. Основная трудность диагностики состоит в доказательстве разной гистологической структуры опухолей, что часто ведет к неправильному стадированию и усложняет принятие решения о выборе тактики ведения пациента [24].
Обобщив вышесказанное, считаем интересным собственное клиническое наблюдение длительного лечения больного раком почки с прогрессированием заболевания.
Пациент Т., 55 лет, в марте 2002 г. обратился за медицинской помощью в МРНЦ им. А.Ф. Цыба. Из анамнеза известно, что 23.02.2002 больной отметил эпизод макрогематурии, а 08.03.2002 появление боли в поясничной области справа. В связи с появившимися симптомами по месту жительства было выполнено УЗИ органов брюшной полости, выявлено образование верхнего полюса правой почки размерами ~80×60 мм. Для лечения больной обратился в отделение онкоурологии МРНЦ им. А.Ф. Цыба. По данным урографии (03.04.2002), в верхнем полюсе правой почки определяется объемное образование ~80×60 мм, выступающее в значительной степени за пределы почки и смещающее книзу деформированные верхние чашечки. При остеосцинтиграфии данных, подтверждающих специфическое поражение костей скелета, не получено. При рентгенологическом исследовании органов грудной клетки патологических изменений не выявлено. Была проведена почечная ангиография (09.04.2002): в верхнем и среднем сегменте правой почки определяется умеренно васкуляризованная опухоль 12×8 см, выходящая за капсулу почки. Правая почечная вена не визуализируется.
Таким образом, по результатам проведенных обследований пациенту поставлен клинический диагноз: рак правой почки сТ3аN0М0, III стадия. 11.04.2002 проведено хирургическое лечение в объеме: лапаротомия, нефрэктомия справа. Послеоперационный период протекал без особенностей, дренаж из забрюшинного пространства справа удален на третьи сутки.
 Результаты планового морфологического исследования: почечноклеточный светлоклеточный рак, многоузловая форма роста. Имеется распространение на ткань почки и в жировую клетчатку почки, в других местах отграничена от прилежащих тканей фиброзной капсулой. Установлен заключительный диагноз: рак правой почки III стадии рT3аN0M0.
Результаты планового морфологического исследования: почечноклеточный светлоклеточный рак, многоузловая форма роста. Имеется распространение на ткань почки и в жировую клетчатку почки, в других местах отграничена от прилежащих тканей фиброзной капсулой. Установлен заключительный диагноз: рак правой почки III стадии рT3аN0M0. Пациенту было рекомендовано динамическое наблюдение, под которым он находился в течение 16 лет (192 мес). В марте 2018 г. при очередном контрольном обследовании по месту жительства при рентгенографии органов грудной клетки выявлено затемнение в правом легком. Выполнена спиральная компьютерная томография (СКТ) органов грудной клетки (22.03.2018): образование по ходу задней и боковой костальной плевры левого легкого размерами до 16 мм. 27.03.2018 обратился в МРНЦ. Позитронно-эмиссионная томография (ПЭТ)-КТ от 19.04.2018: признаки образования в паренхиме правого легкого (S6) и по плевре справа. Учитывая отсутствие другой очаговой патологии и олигометастатический характер поражения правого легкого, на междисциплинарном консилиуме была выбрана хирургическая тактика лечения. 11.05.2018 выполнена видеоторакоскопическая резекция нижней доли правого легкого и костальной плевры. Морфологическая и иммуногистохимическая картина соответствовали метастазу светлоклеточного ПКР. Пациент находился под динамическим наблюдением 17 мес, до ноября 2019 г. По результатам СКТ 01.11.2019 выявлено очаговое образование в нижней доле правого легкого в S10 размером до 16×13 мм, расположенное субплеврально. По данным ПЭТ-КТ 17.11.2019 в S10 правого легкого субплеврально определяется мягкотканное образование размерами 12×17 мм с гиперфиксацией радиофармпрепарата (РФП). Других очагов патологического накопления РФП не выявлено. Пациент обсужден на междисциплинарном консилиуме, 11.12.2019 выполнена видеоторакоскопическая резекция правого легкого. Морфологическая и иммуногистохимическая картина соответствовали метастазу светлоклеточного ПКР. Пациент был оставлен под наблюдение. Спустя 8 мес, в августе 2020 г., при контрольной СКТ в паренхиме левой почки выявлено образование негомогенной кистозной плотности, расположенное в паренхиме и подкапсульно, размерами 19×15×20 мм, неоднородной структуры, не распространяющееся на чашечки и клетчатку почечного синуса (рис. 1). 16.09.2020 выполнена люмботомия, резекция левой почки.
Послеоперационный период протекал без осложнений. Результат планового морфологического исследования: светлоклеточный ПКР почки, grade 3 по ISUP. Опухоль не прорастает в капсулу почки, паранефральная жировая клетчатка интактна. От опухоли до ближайшего паренхиматозного края резекции 1 мм. В крае резекции опухоли не обнаружено. При сравнительном анализе гистологических препаратов опухолей левой и правой почек обнаружена аналогичная морфологическая и иммуно-гистохимическая картина, что позволило установить окончательный диагноз: рак правой почки сT3аN0M0, III стадия, II клиническая группа. Радикальная нефрэктомия справа (2002 г.) рT3аN0M0. Прогрессирование (май 2018 г.). Метастатическое поражение правого легкого. Видеоторакоскопическая резекция правого легкого 2018 г. Прогрессирование (ноябрь 2019 г.). Метастатическое поражение правой плевральной полости. Видеоторакоскопическое удаление опухоли плевры справа 2019 г. Прогрессирование (август 2020 г.). Метастатическое поражение левой почки. Резекция левой почки 2020 г.
Пациент продолжил динамическое наблюдение до 2024 г., когда при контрольном обследовании 29.08.2024 по результатам ПЭТ-КТ с 18F-ФДГ было выявлено очаговое образование левой почки размером 11 мм, с метаболической активностью 18F-ФДГ (SUVmax=5,4), очаг в левом легком на границе S4/S2 7 мм, очаг накопления РФП в верхней трети правой бедренной кости (SUVmax=3,2), что соответствует проявлению неопластического процесса. На междисциплинарном консилиуме принято решение о проведении лекарственного лечения по схеме левантиниб + пембролизумаб. Таким образом, общее время наблюдения за пациентом на момент публикации составило 22 года (266 мес).
Обсуждение
Стандартом лечения локализованных и местно-распространенных форм ПКР остается хирургический метод. Несмотря на радикальность этого метода, в 20–40% случаев встречается прогрессирование заболевания. При наличии солитарных очагов метастатического поражения при ПКР с точки зрения общей выживаемости хирургическая тактика является эффективным методом лечения [16, 25, 26]. Однако она всегда остается предметом обсуждений в связи с высокой вероятностью наличия неопределяемых микрометастазов [6, 7].Следует отметить, что Национальная онкологическая сеть США рекомендует метастазэктомию при олигометастатическом поражении при ПКР [27].В когортном исследовании Shaan Dudani и соавт., включавшем 10 105 пациентов, была изучена частота и локализация метастатических очагов в зависимости от гистологического подтипа. Исследование включало в себя 9252 пациента со светлоклеточным ПКР (92%), 667 пациентов с папиллярным ПКР (7%) и 186 пациентов с хромофобным ПКР (2%) (табл. 1) [28].

Согласно последним рекомендациям NCCN метастазэктомия и нефрэктомия показаны пациентам с первичным ПКР и олигометастазами или тем пациентам, у кого олигометастазы развились после длительного безрецидивного периода после проведенной нефрэктомии. Данному лечению могут быть подвержены очаги, имеющие такую локализацию, как кости, мозг и легкие. Первичная опухоль и метастазы могут быть удалены во время одной процедуры или в разное время [29].
Метастазы в легких связаны с наилучшим прогнозом при относительно низкой смертности и заболеваемости. Ouzaid и соавт. [30] в систематическом обзоре определили 1-, 3-, 5- и 10-летнюю общую выживаемость в 84%, 59%, 43% и 20% соответственно.
Было показано, что метастазы в легких имеют более высокую общую выживаемость после метастазэктомии по сравнению с таргетной или иммунотерапией [31]. Procházková и соавт. изучили группу из 35 пациентов с метастатическим поражением легких при ПКР. Пациенты подверглись метастазэктомии. Исследование продемонстрировало трехлетнюю общую выживаемость без прогрессирования (ВБП) 63,5% и 39,4% соответственно и пятилетнюю общую выживаемость и ВБП 44,9% и 29% соответственно. Авторы пришли к выводу, что общая выживаемость и ВБП значительно зависели от размера метастатического очага [32]. Согласно опубликованным данным, размер метастазов ≥2 см и длительность безрецидивного периода 5 лет являются независимыми прогностическими факторами для выживания [33].
Международный регистр пациентов с метастазами в легких на основе трех параметров – резектабельности, длительности безрецидивного интервала и количества метастазов создал шкалу (табл. 2), которая классифицирует пациентов на четыре прогностические группы [34].
На сегодняшний день известно, что рак почки является иммуногенной опухолью, в результате чего разработаны эффективные режимы лечения на основе таргетных и иммуноонкологических препаратов (рис. 2).

Таргетные препараты блокируют функции генов, связанных с ангиогенезом или функционирующих в составе основных сигнальных путей развития рака почки. К ним относятся ингибиторы тирозинкиназ: акситиниб, кабозантиниб, ленватиниб (одобрен в комбинации с эверолимусом), пазопаниб, сорафениб и сунитиниб, а также антитело к VEGF – бевацизумаб [36, 37]. Благодаря усовершенствованию молекулярных технологий появились более эффективные новые подходы и препараты: современная иммунотерапия, основанная на ингибировании иммунных контрольных точек. Контрольные точки – особые молекулы на клетках иммунной системы, которые используются для того, чтобы здоровые клетки могли сдерживать цитотоксические лимфоциты от иммунной атаки. В настоящий момент в иммунотерапии рака почки наибольшее внимание уделяется моноклональным антителам – ингибиторам контрольных точек – PD-1, PD-L1, CTLA-4 (cytotoxic T-lymphocyte-associatedprotein 4) [36]. По результатам клинических исследований, успешной явилась комбинация ингибиторов PD-1 (ниволумаб) и CTLA-4 (ипилимумаб), которая демонстрирует увеличение общей выживаемости больных ПКР, а также меньшую токсичность по сравнению с лечением сунитинибом, у пациентов промежуточного и неблагоприятного прогноза (табл. 3) [27, 36–39].
Однако, несмотря на высокую эффективность системного лечения, оно характеризуется нежелательными явлениями, затрагивающими, как правило, все системы организма пациента (табл. 4) [40].

В процессе терапии таргетными препаратами побочные реакции наблюдаются со стороны сердечно-сосудистой системы (изменение артериального давления, тромбозы, нарушения в электрокардиограмме, аритмии, мио- или перикардиты, инфаркт миокарда, кардиомиопатия, сердечная недостаточность (чаще левожелудочковая); дыхательной системы (двусторонние инфильтраты в легких, интерстициальный пневмонит, облитерирующий бронхиолит); мочевыделительной системы (протеинурия, микроангиопатия, нефротический синдром, почечная недостаточность); желудочно-кишечного тракта (диарея, мукозиты, перфорации, фистулы); центральной нервной системы (синдром задней обратимой лейкоэнцефалопатии); со стороны эндокринных желез (гипопаратиреоидизм); костного мозга; кожи (ладонно-подошвенный синдром, сыпь) [41, 42].
При терапии анти-CTLA–4 чаще всего поражается кожа (сыпь, зуд) и желудочно-кишечный тракт (диарея, колит) [42]. При терапии анти-PD–1/PD-L1 препаратами тяжелые побочные явления развиваются реже –
у 7–12% пациентов, и проявляются усталостью, сыпью, зудом, диарей, тошнотой, снижением аппетита и артралгией [44–47].
Заключение
Таким образом, учитывая широкий спектр побочных явлений системной терапии, хирургическая тактика при развитии олигометастатического поражения при ПКР становится особенно актуальной. Наш клинический пример демонстрирует успешное длительное лечение пациента с прогрессированием ПКР после радикального лечения без назначения лекарственной терапии. Однако необходимо отметить, что достижение положительного результата невозможно без соблюдения установленных сроков наблюдения и приверженности к нему пациента.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Чайков Владимир Сергеевич – врач-онколог, врач-хирург, науч. сотр. отд-ния лучевого и хирургического лечения урологических заболеваний с группой брахитерапии рака предстательной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-8711-4937
Vladimir S. Chaykov – Oncologist, Res. Officer, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-8711-4937
Щукина Елизавета Олеговна – врач-онколог отд-ния лучевого и хирургического лечения урологических заболеваний с группой брахитерапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: shukina-elizavet@mail.ru; ORCID: 0000-0001-5431-8696
Elizaveta O. Shchukina – Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: shukina-elizavet@mail.ru; ORCID: 0000-0001-5431-8696
Дементьев Иван Олегович – врач-уролог, мл. науч. сотр. отд-ния лучевого и хирургического лечения урологических заболеваний с группой брахитерапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: dementevio@mail.ru; ORCID: 0000-0003-2780-9822
Ivan O. Dementev – Urologist, Res. Assist., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: dementevio@mail.ru; ORCID: 0000-0003-2780-9822
Бирюков Виталий Александрович – канд. мед. наук, врач-онколог, радиотерапевт, ст. науч. сотр. отд-ния лучевого и хирургического лечения урологических заболеваний с группой брахитерапии рака предстательной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-6750-521X
Vitaly A. Biryukov – Oncologist, Cand. Sci. (Med.), Senior Res. Officer, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-6750-521X
Руис Ниньо Де Гузман Роберто – клинический ординатор по специальности «Онкология» 1-го года обучения, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии»
Ruiz Ninõ de Guzmán Roberto – Clinical Resident, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre
Карякин Олег Борисович – д-р мед. наук, проф., зав. отд-нием лучевого и хирургического лечения урологических заболеваний с группой брахитерапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: karyakin@mrrc.obninsk.ru; ORCID: 0000-0002-6112-2840
Oleg B. Karyakin – Dr. Sci. (Med.), Full Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: karyakin@mrrc.obninsk.ru; ORCID: 0000-0002-6112-2840
Поступила в редакцию: 03.12.2024
Поступила после рецензирования: 10.12.2024
Принята к публикации: 12.12.2024
Received: 03.12.2024
Revised: 10.12.2024
Accepted: 12.12.2024
Список исп. литературыСкрыть список1. Global Cancer Observatory 2022. URL: https://gco.iarc.fr/en
2. Злокачественные новообразования в России в 2023 году (заболеваемость и смертность). Под ред. А.Д. Каприна и др. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2024. ISBN 978-5-85502-298-8
Malignant neoplasms in Russia in 2023 (morbidity and mortality). Ed. A.D. Kaprin et al. Moscow: Herzen Moscow Oncology Research Institute – branch of National Medical Research Center for Radiology, 2024. ISBN 978-5-85502-298-8 (in Russian).
3. Чайков В.С., Дементьев И.О., Карякин О.Б. и др. Ретроперитонеоскопический доступ при органосохраняющем лечении почечно-клеточного рака. Онкоурология. 2023;19(1):25-34. DOI: 10.17650/1726-9776-2023-19-1-25-34
Chaikov V.S., Dementiev I.O., Karyakin O.B. et al. Retroperitoneoscopic access in organ-preserving treatment of renal cell carcinoma. Oncourology. 2023;19(1):25-34. DOI: 10.17650/1726-9776-2023-19-1-25-34 (in Russian).
4. Базаев В.В., Дутов В.В., Еян П.А., Казанцева И.А. Инцидентальный почечно-клеточный рак: клинико-морфологические особенности. Урология. 2013;(2):66-9.
Bazaev V.V., Dutov V.V., Yeyan P.A., Kazantseva I.A. Incident renal cell carcinoma: clinical and morphological features. Urology. 2013;(2):66-9 (in Russian).
5. Beisland C, Guðbrandsdottir G, Reisæter LA et al. Aprospectiverisk-stratified followupprogramme for radically treated renal cell carcinoma patients: evaluation after eight 90 years of clinical use. World J Urol 2016;34(8):1087-99.
6. Пикин О.В., Алексеев Б.Я., Амиралиев А.М. Факторы прогноза хирургического лечения больных с метастазами рака почки в легких. Российский онкологический журнал. 2012;(3).
Pikin O.V., Alekseev B.Ya., Amiraliev A.M. Prognostic factors of surgical treatment of patients with metastases of kidney cancer in the lungs. Russian Journal of Oncology. 2012;(3) (in Russian).
7. Tosco L, Van Poppel H, Frea B et al. Survival and impact of clinical prognostic factors in surgically treated metastatic renal cell carcinoma. Eur Urol 2013;63(4):646-52. DOI: 10.1016/j.eururo.2012.09.037
8. Амиралиев А.М. Лечение больных с метастазами рака почки в легких. Диссертация канд. мед. наук. М., 2011.
Amiraliev A.M. Treatment of patients with metastases of kidney cancer in the lungs. Dissertation of the Candidate of Medical Sciences. Moscow, 2011 (in Russian).
9. Семков А.С., Махсон А.Н., Петерсон С.Б., Широкорад В.И. Хирургическое лечение костных метастазов рака почки. Онкоурология. 2010;(4):10-5.
Semkov A.S., Makhson A.N., Peterson S.B., Shirokorad V.I. Surgical treatment of bone metastases of kidney cancer. Oncourology. 2010;(4):10-5 (in Russian).
10. Кострицкий С.В., Широкорад В.И., Семенов Д.В. и др. Хирургическое лечение больных с метастазами рака почки в позвоночник. Онкоурология. 2014(3):40.
Kostritsky S.V., Shirokorad V.I., Semenov D.V. et al. Surgical treatment of patients with kidney cancer metastases in the spine. Oncourology. 2014(3):40 (in Russian).
11. Bianchi M, Sun M, Jeldres C, Shariat SF et al. Distribution of metastatic sites in renal cell carcinoma: a population-based analysis. Ann Oncol 2012;23(4):973-80. DOI: 10.1093/annonc/mdr362
12. Eggener SE, Yossepowitch O, Pettus JA. Renal cell carcinoma recurrence after nephrectomy for localized disease: predicting survival from time of recurrence. J Clin Oncol 2006;24(19):3101-6.
13. Itano NB, Blute ML, Spotts B, Zincke H. Outcome of isolated renal cell carcinoma fossa recurrence after nephrectomy. J Urol 2000;164(2):322-25. DOI: 10.1016/s0022-5347(05)67350-8
14. Margulis V, McDonald M, Tamboli P et al. Predictors of oncological outcome after resection of locally recurrent renal cell carcinoma. J Urol 2009;181(5):2044-2051. DOI: 10.1016/j.juro.2009.01.043
15. ÖmerAcar, ÖnerŞanlı. Surgical Management of Local Recurrences of Renal Cell Carcinoma. Surgery Research and Practice 2016;2016:2394942. DOI: 10.1155/2016/2394942
16. Featherstone JM, Bass P, Cumming J, Smart CJ. Solitary, late metastatic recurrence of renal cell carcinoma: two extraordinary cases. Int J Urol 2006;13(12):1525-7. DOI: 10.1111/j.1442-2042.2006. 01577.x
17. Tapper H, Klein H, Rubenstein W et al. Recurrent renal cell carcinoma after 45 years. Clinical Imaging 1997;21(4):273-5. DOI: 10.1016/S0899-7071(96)00042-3
18. Novick AC, Streem S, Montie JE et al. Conservative surgery for renal cell carcinoma: a single-center experience with 100 patients. J Urol 1989;141(4):835-9. PMID: 2926874.
19. Lapini A, Serni S, Minervini А et al. Progression and long-term survival after simple enucleation for the elective treatmentof renal cell carcinoma: experience in 107 patients. J Urol 2005;174(1):57-60. DOI: 10.1097/01.ju.0000162019.45820.53. PMID: 15947577.
20. Serni S, Vittori G, Frizzi J et al. Simple enucleation for the treatment of highly complex renal tumors: Perioperative, functional and oncological results. Eur J Surg Oncol 2015;41(7):934-40. DOI: 10.1016/j.ejso. 2015.02.019. PMID: 25957967.
21. Wood EL, Adibi M, Qiao W et al. Local tumor bed recurrence following partial nephrectomy in patients with small renal masses. J Urol 2017;PII:S0022–5347(17)77555–6. DOI: 10.1016/j.juro.2017.09.072. PMID: 28941919.
22. Bani-Hani A.H et al. Associations with contralateral recurrence following nephrectomy for renal cell carcinoma using a cohort of 2,352 patients. J Urol 2005;173:391.
23. Степанова Ю.А., Калинин Д.В., Вишневский В.А. Первично-множественные опухоли (обзор литературы). Медицинская визуализация. 2015;(6):93-102.
Stepanova Yu.A., Kalinin D.V., Vishnevsky V.A. Primary multiple tumors (literature review). Medical imaging. 2015;(6):93-102 (in Russian).
24. Первично-множественные злокачественные опухоли. Руководство для врачей. Под ред. В.И. Чиссова, А.X. Трахтенберга. М.: Медицина, 2000.
Primary-multiple malignant tumors. A guide for doctors. Edited by V.I. Chissov, A.X. Trachtenberg. Moscow: Medicine, 2000 (in Russian).
25. Dabestani S, Marconi L, Hofmann F et al. Local treatments for metastases of renal cell carcinoma: a systematic review. Lancet Oncol 2014;15(12):e549–61. DOI: 10.1016/s1470-2045(14)70235-9
26. Hang Lin, Heng Zhang, Yuanda Cheng, Chunfang Zhang. Solitary Metastasis in the Mediastinal Lymph Node After Radical Nephrectomy for Clear Cell Renal Cell Carcinoma: A Case Report and Literature Review. Case Reports Front Oncol 2020;10:593142. DOI: 10.3389/fonc.2020. 593142.eCollection 2020
27. NCCN Guidelines. NCCN Guidelines Version 1.2022.
28. Dudani Sh, de Velasco G, Wells JC et al. Evaluation of Clear Cell, Papillary, and Chromophobe Renal Cell Carcinoma Metastasis Sites and Association With Survival. JAMA Netw Open 2021;4(1):e2021869. DOI: 10.1001/jamanetworkopen.2020.21869
29. Matuszczak M, Kiljańczyk A, Salagierski M. Surgical Approach in Metastatic Renal Cell Carcinoma: A Literature Review. Cancers 2023;15:1804. DOI: 10.3390/cancers15061804
30. Ouzaid I, Capitanio U, Staehler M et al. Surgical Metastasectomy in Renal Cell Carcinoma: ASystematic Review. Eur Urol Oncol 2018;2:141-9.
31. Amiraliev A, Pikin O, Alekseev BY, Kalpinksiy A. Treatment strategy in patients with pulmonary metastases of renal cell cancer. Interact. CardioVasc Thorac Surg 2012;15:SXIII-F068.
32. Procházková K, Vodička J, Fichtl J et al. Outcomes for Patients after Resection of Pulmonary Metastases from Clear Cell Renal Cell Carcinoma: 18 Years of Experience. Urol Int 2019;103:297-302.
33. Meacci E, Nachira D, Congedo MT et al. Lung metastasectomy following kidney tumors: Outcomes and prognostic factors from a single-center experience. J Thorac Dis 2017; 9:S1267-S1272.
34. Pastorino U, Buyse, M, Friedel G et al. Long-term results of lung metastasectomy: Prognostic analyses based on 5206 cases. J Thorac. Cardiovasc Surg 1997;113:37-49.
35. Ingels A, Campi R., Capitanio U et al. Complementary roles of surgery and systemic treatment in clear cell renal cell carcinoma. Nat Rev Urol 2022;19:391-418. DOI: 10.1038/s41585-022-00592-3
36. Коротаева А.А., Апанович Н.В., Брага Э.А. и др. Современные достижения в иммунотерапии рака почки. Онкоурология 2019; 15(4):30-8.
Korotaeva A.A., Apanovich N.V., Braga E.A. et al. Modern achievements in immunotherapy of kidney cancer. Oncourology 2019;15(4): 30-8 (in Russian).
37. Матвеев В.Б., Волкова М.И. Последовательная таргетная терапия при диссеминированном раке почки. Онкоурология. 2013;9(1):28-33.
Matveev V.B., Volkova M.I. Sequential targeted therapy for disseminated kidney cancer. Onkourologiya = Cancer Urology 2013;9(1):28-33 (in Russian).
38. Motzer RJ, Tannir NM, McDermott DF et al. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018;378:1277-90. DOI: 10.1056/NEJMoa1712126
39. Cella D, Grünwald V, Escudier B et al. Patient-reported outcomes of patients with advanced renal cell carcinoma treatedwithnivolumab plus ipilimumab versus sunitinib (CheckMate 214): a randomised, phase 3 trial. Lancet Oncol 2019;20(2):297-310. DOI: 10.1016/S1470-2045(18)30778-2
40. Sumanta Pal, Jun Gong, Shivani K Mhatre et al. Real-world treatment patterns and adverse events in metastatic renal cell carcinoma from a large US claims database. BMC Cancer 2019;19(1):548. DOI: 10.1186/s12885-019-5716-z
41. Kaprin AD, Ivanov SA, Klimenko AA, Dobrovolskaya NY. An example of the use of tyrosine kinase inhibitors as a targeted therapy for metastatic renal cell carcinoma. Malignanttumours 2015;1:49-52DOI: 10.18027/2224-5057-2015-1-49-52
42. Чубенко В.А. Осложнения таргетной терапии. Практическая онкология. 2010;11(3):192-202.
Chubenko V.A. Complications of targeted therapy. Practical oncology. 2010;11(3):192-202 (in Russian).
43. Hodi FS, O’Day SJ, McDermott DF et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010;363:711e23.
44. Reutova EV, Laktionov KP, Breder VV et al. Immune-mediatedadverse events associated with immune checkpoint inhibitors therapy. Malignant Tumours 2016;4:68-76
45. Brahmer J, Reckamp KL, Baas P et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015;373(2):123-35.
46. Borghaei H, Paz-Ares L, Horn L et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373(17):1627-39.
47. Herbst RS, Baas P, Kim DW et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE–010): a randomizedcontrolled trial. Lancet 2016;387(10027):1540–50.
48. Topalian SL, Hodi FS, Brahmer J R et al. Safety, activity, and immune correlates of anti-PD–1 antibody in cancer. N Engl J Med 2012;366:2443e54.
49. Michot JM, Bigenwald C, Champiat S et al. Immunerelated adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer 2016;54(1)39-48.
26 декабря 2024
Количество просмотров: 494

