Клинический разбор в общей медицине №12 2024
Ivanovo Regional Oncological Dispensary, Ivanovo, Russia
andrey.semenov@mail.ru
Abstract
Background and aim. The development of non-metastatic castration-resistant prostate cancer (nmCRPC) in patients is usually associated with high risk of the disease progression to the metastatic castration-resistant disease. A number of studies have confirmed the feasibility of using novel antiandrogens (specifically darolutamide) to improve metastasis-free survival and overall survival in this category of patients. However, scientific data on the long-term follow-up of patients receiving darolutamide under conditions of real clinical practice are actually missing and are limited to the periods of follow-up within the framework of clinical trials. That is why the case reports from real clinical practice, in which the data on the health of patients receiving darolutamide for a long time due to nmCRPC are provided, are of special interest.
Methods. The paper reports a clinical case of using darolutamide for more than seven years in a patient with nmCRPC at high risk of the disease progression.
Results and conclusions. The case report provided showing the efficacy and safety profile of the long-term darolutamide therapy and the case report analysis will help optimize treatment tactics selection in other such situations.
Keywords: non-metastatic castration-resistant prostate cancer, darolutamide, safety of long-term use
For citation: Semenov A.V. On the issue of efficacy and safety of the long-term use of darolutamide in combination therapy in patients with non-metastatic castration-resistant prostate cancer (on the example of one clinical case). Clinical review for general practice. 2024; 5 (12): 32–37 (In Russ.). DOI: DOI: 10.47407/kr2024.5.12.00534
Известно, что в течение пяти лет наблюдения у 10–20% пациентов с метастазами РПЖ разовьется кастрационно-резистентный рак простаты (КРРПЖ), и медиана общей выживаемости этих больных с момента развития кастрационной резистентности составит примерно 14 мес [2, 3].
В ряде случаев после развития биохимического рецидива на фоне стандартной андроген-депривационной терапии (АДТ) прогрессия заболевания может идти по другому сценарию, с развитием неметастатического КРРПЖ (нмКРРПЖ), без фазы гормонально-чуствительного метастатического процесса. Главным критерием прогрессии заболевания в этом случае будет прогрессивный рост простатического специфического антигена (ПСА) на фоне отсутствия радиологических признаков метастатического процесса и кастрационного уровня тестостерона [4].
Известно, что пациенты с нмКРРПЖ подвергаются более высокому риску прогрессии заболевания. В течение двух лет наблюдения метастазы могут развиться у 1/3 пациентов, что увеличивает бремя смертности в этой популяции [5]. Предиктором такого исхода является время удвоения ПСА (ВУПСА) менее 10 мес [6].
В ряде исследований показано, что отсрочка времени до метастазирования в результате применения того или иного метода лечения, известная как выживаемость без метастазов, при РПЖ коррелирует с улучшением общей выживаемости и качества жизни [7, 8]. Кроме того, увеличение выживаемости без метастазов сопровождается значимой клинической пользой, измеряемой увеличением времени до развития хронического болевого синдрома, патологических переломов и компрессии спинного мозга [9].
В международных многоцентровых исследованиях PROSPER, SPARTAN и ARAMIS была подтверждена целесообразность применения энзалутамида [10], апалутамида [11] и даролутамида [12] у пациентов с нмКРРПЖ. Во всех трех исследованиях продемонстрировано достоверное увеличение выживаемости без метастазов в группах комбинированной терапии антиандрогенами 2-го поколения (АА-2)+АДТ по сравнению с моно-АДТ. На момент завершения исследований отсутствовали данные по медиане ОВ, но при этом было установлено статистически значимое преимущество по снижению риска летального исхода в группах комбинированной терапии. Поэтому, вопрос об изучении безопасности долговременного приема новых антиандрогенов, является актуальным.
В этой связи интерес представляет объединенный анализ данных пациентов, получавших лечение даролутамидом более двух лет, проведенный R.H. Jones и соавт. [13]. В обзоре приведены сведения о 13 пациентах, получавших даролутамид в течение двух и более лет, при этом 7 пациентов получали лечение от 2 до 4 лет, а 6 пациентов получали лечение более 4 лет. Медиана возраста пациентов составлял 68 (55–81) лет. Пациентов обследовали каждые 3 мес для оценки безопасности и переносимости терапии даролутамидом при длительном применении. У большинства пациентов была нормальная функция почек и печени (77%), ECOG-статус был равен нулю у 92% больных. Большинство пациентов имели агрессивные опухоли предстательной железы (сумма Глисона 7 или выше у 69%). Медиана времени от первоначального диагноза РПЖ до первой дозы приема даролутамида составила 32,4 (9,7–191,0) мес, а медиана исходного уровня ПСА до начала приема даролутамида – 18,1 (4,6–53,6) нг/дл. Все пациенты до лечения даролутамидом получали АДТ, ни один из них не получал ранее химиотерапию. Медиана продолжительности лечения даролутамидом составила 38,1 (24,2–90,0) мес для всех 13 пациентов, получавших лечение более двух, и 62,6 (48,6–90,0) мес для пациентов, получавших лечение более четырех лет.
О развитии тех или иных нежелательных явлений (НЯ) сообщали все 13 пациентов. Наиболее распространенными НЯ были диарея, боль в животе и тошнота. НЯ 3-й степени тяжести были отмечены у 6 пациентов, о событиях 4 или 5-й степени не сообщалось. Ни одно из событий 3-й степени не наблюдалось более чем у одного пациента, и ни одно из них не было расценено как связанное с применением даролутамида. Серьезные НЯ были зарегистрированы у 6 пациентов, но ни одно из них не было расценено как связанное с терапией даролутамидом. Исследование показало, что НЯ, связанные с лечением, не привели к отмене даролутамида.
А пока его итоги не подведены, особый интерес представляют наблюдения из реальной клинической практики, в которых излагаются сведения о состоянии здоровья пациентов, длительно получающих даролутамид по поводу нмКРРПЖ.
Ниже представлен опыт длительной терапии из личной клинической практики, в течение нескольких лет предотвращающей развитие метастазов у больного РПЖ.
При дальнейшем обследовании при проведении магнитно-резонансной томографии малого таза было выявлено распространение опухоли за пределы капсулы предстательной железы, в том числе ее инвазивный рост в стенку прямой кишки. При остеосцинтиграфии данных, подтверждающих специфическую гиперфиксацию радиофармпрепарата, не получено. Установлен диагноз: рак предстательной железы сT4N0M0, IV стадии, II клиническая группа.
В феврале 2007 г. пациенту была назначена АДТ в режиме максимальной андрогенной блокады – МАБ (гозерелин-депо + бикалутамид 50 мг/сут). После консультации в ФГБУ РНЦРР Минздрава России (Москва) в мае-июне 2007 г. там же проведены 2 курса дистанционной лучевой терапии, суммарная очаговая доза (СОД) на первом этапе – 24 Гр, СОД на втором этапе указать не представляется возможным вследствие утраты документов. АДТ в объеме МАБ была продолжена в непрерывном режиме до марта 2008 г., достигнут надир ПСА 0,9 нг/мл.
В ноябре 2008 г. имело место увеличение уровня ПСА до 3,2 нг/мл, констатирован биохимический рецидив РПЖ, была возобновлена АДТ в объеме МАБ.
С февраля 2009 г. по декабрь 2015 г. АДТ проводилась в интермиттирующем режиме, с колебаниями ПСА от 0,1 нг/мл до 15,6 нг/мл. В течение этого периода времени пациент регулярно обследовался, при проведении остеосцинтиграфии (ОСГ), а также ультразвукового исследования внутренних органов и рентгенологическом исследовании легких, которые выполнялась 2 раза в год, не было выявлено признаков метастатического поражения костей и внутренних органов.
С января 2016 г. АДТ проводилась непрерывно. Несмотря на кастрационный уровень тестостерона, ПСА прогрессивно повышался (с 4,25 нг/мл до 6,8 нг/мл; рис. 1).
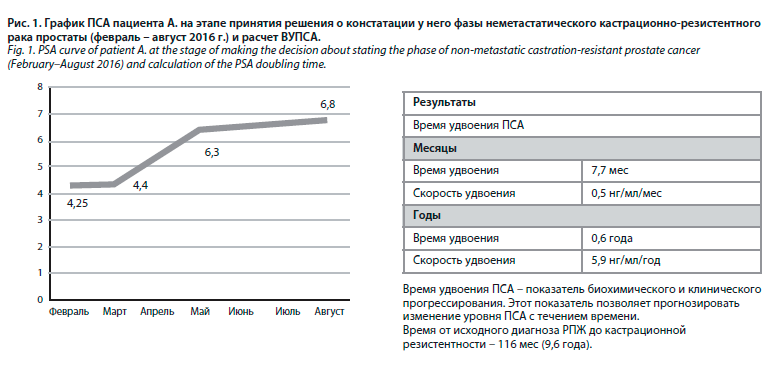
В августе 2016 г. ВУПСА составило 7,7 нг/мл, а при проведении ОСГ и мультиспиральной компьютерная томографии (МСКТ) брюшной, грудной полостей и малого таза метастазов выявлено не было.
Учитывая биохимическую прогрессию заболевания (последовательный рост ПСА в трех измерениях, сделанных с интервалом не менее одной недели, более чем на 50% от надира ПСА, при уровне ПСА более 2 нг/мл) и отсутствие данных, подтверждающих радиологическую прогрессию опухолевого процесса на фоне непрерывной АДТ и кастрационного уровня тестостерона, пациенту установлена фаза неметастатического кастрационно-резистентного РПЖ. Период времени от первоначального диагноза РПЖ до констатации нмКРРПЖ составил 116 мес.
Осенью 2016 г. не существовало никаких специальных опций для лечения такой категории больных, кроме продолжения АДТ. Возможно поэтому, в ноябре 2016 г. пациент согласился принять участие в международном исследовании ARAMIS (№3104007 «Многонациональное, рандомизированное, двойное слепое, плацебо контролируемое исследование III фазы для оценки эффективности и безопасности препарата ODM-201 у мужчин с неметастатическим кастрационно-устойчивым раком предстательной железы высокого риска»).
После выполнения процедур скрининга, диагноз нмКРРПЖ был подтвержден. Также было констатировано, что показатель ВУПСА у пациента составляет менее 10 мес на фоне кастрационного уровня тестостерона. Такая скорость удвоения ПСА была одним из главных критериев включения больного в протокол ARAMIS, и позже вошла в клинические рекомендации как показание для назначения комбинированного лечения (АА2+АДТ) при нмКРРПЖ.
В настоящее время все участники проекта ARAMIS расслеплены, в слепой фазе исследования пациент был рандомизирован в группу исследуемого препарата (ODM-201, получивший впоследствии наименование даролутамид). С целью андрогенной депривации пациент продолжил лечение аналогами рилизинг-гормона лютеинизирующего гормона, во время участия в протоколе он получал препарат гозерелин-депо 10,8 мг, подкожно, 1 раз в 84 дня в непрерывном режиме.
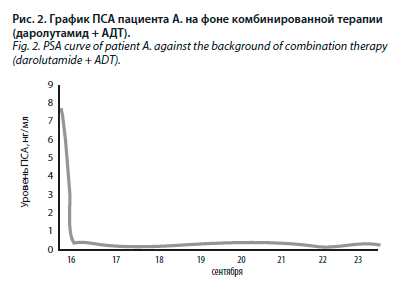 Пациент А. не имел прогрессии заболевания в слепой фазе исследования ARAMIS, в марте 2019 г. он успешно перешел в открытую фазу исследования и также продолжил комбинированную терапию даролутамидом на фоне АДТ. Он имел стабильно низкий уровень ПСА (рис. 2), при регулярном радиологическом обследовании (МСКТ и ОСГ каждые 16 нед) метастазов выявлено не было.
Пациент А. не имел прогрессии заболевания в слепой фазе исследования ARAMIS, в марте 2019 г. он успешно перешел в открытую фазу исследования и также продолжил комбинированную терапию даролутамидом на фоне АДТ. Он имел стабильно низкий уровень ПСА (рис. 2), при регулярном радиологическом обследовании (МСКТ и ОСГ каждые 16 нед) метастазов выявлено не было.
В конце 2019 г. исследование ARAMIS было завершено, показатель выживаемости без метастазов в группе больных нмКРРПЖ достоверно превышает аналогичный параметр группы плацебо. Больным, которые сохранили показания для продолжения приема даролутамида на фоне АТД, был предложен переход в исследование III фазы №20321 «Открытое, не сравнительное, дополнительное исследование для обеспечения продолжения терапии даролутамидом для пациентов, ранее принимавших участие в исследованиях, спонсируемых компанией Байер», целью которого был контроль безопасности при длительной терапии даролутамидом. Из 13 пациентов, прошедших скрининг в ARAMIS в нашем исследовательском центре, в исследование 20321 перешли 4 пациента, в том числе и пациент А. (с декабря 2020 г.).
В настоящее время пациент продолжает прием препарата даролутамид на фоне АДТ, не имея ни биохимической, ни радиологической прогрессии. По состоянию на сентябрь 2024 г. пациент живет с диагнозом РПЖ 17,9 года (215 мес.), в том числе более 8 лет живет в кастрационно-резистентной фазе болезни (97 мес), не имея при этом никаких метастатических очагов. Прием даролутамида в составе комбинирований терапии продолжается 94 мес (7 лет и 10 мес).
За все время лечения даролутамидом осуществлялся мониторинг возникновения и развития НЯ. В медицинской документации больного за все время наблюдения отмечены только два НЯ: головная боль (степень 1) и боль в спине (степень 1). Серьезных НЯ зарегистрировано не было. Тестирование пациента А. по опросникам оценки качества жизни (FACT-P и EQ-5D) показало стабильно высокую самооценку качества жизни.
Пациент А. имел ряд хронических заболеваний, в целом типичных для его возраста. Такие как гипертоническая болезнь, ишемическая болезнь сердца, ожирение I степени, атеросклероз, доброкачественная гиперплазия простаты с симптомами нижних мочевых путей. Имел место хронический прием сопутствующих лекарственных препаратов (амлодипин, эналаприл, торасемид, тамсулозин), который продолжается в настоящее время. Пациент наблюдается у терапевта территориальной поликлиники, и следует отметить, что за столь длительное время наблюдения не отмечено декомпенсации его соматических заболеваний и необходимости коррекции доз принимаемых лекарств.
За все почти 8 лет наблюдения у пациента сохранялся ECOG статус 1, несмотря на пенсионный возраст и сопутствующие заболевания, его трудовая деятельность не прекратилась, он продолжает заниматься творчеством – пишет и редактирует книги.
Но, кроме эффективности, не меньшее значение имеет безопасность столь длительного применения даролутамида.
РПЖ у пациента А. был впервые выявлен в местно-распространной фазе опухолевого процесса, имелась инвазия опухоли в стенку прямой кишки, уровень ПСА был довольно высок (40 нг/мл), по результатам морфологического исследования опухолевой ткани пациент был отнесен к четвертой прогностической группе (предпоследней) по ISUP (Глисон 4+4=8 баллов). После проведенного радикального лечения пациент относился к группе высокого риска биохимического рецидива [14], который и был констатирован у него через 16 мес. По поводу биохимического рецидива пациент получал АДТ в различных режимах, соответствующую существующим на тот момент клиническими рекомендациям.
Диагноз нмКРРПЖ у больного А. был установлен в полном соответствии с принятыми критериями – наличием биохимической прогрессии на фоне кастрационного уровня тестостерона и отсутствием радиологической прогрессии, которая оценивается на основании классических методов контроля у больных РПЖ (МСКТ и ОСГ) по критериям PCWG3 [15]. ВУПСА на момент постановки диагноза нмКРРПЖ была менее 10 мес, т.е. пациент имел высокий риск развития метастазов и последующего перехода болезни в последнюю и наиболее тяжелую фазу – развитие мКРРПЖ [16].
В двух абзацах этого раздела пересказана типичная история болезни несвоевременно выявленного больного агрессивной формой рака простаты. Однако с 2016 г.
история перестает быть типичной – назначенная пациенту комбинированная терапия, включающая андрогенную депривацию и новый терапевтический агент даролутамид, обеспечила достижение полного ПСА-ответа и период жизни свободный от метастазов более 8 лет(!).
По мнению K. Fizazi и соавт. (2014), даролутамид является более афинным антагонистом андрогеновых рецепторов, чем энзалутамид или апалутамид [17]. Впрочем, высокая эффективность даролутамида при нмКРРПЖ вполне известна и после завершения исследования ARAMIS не нуждается в дополнительных подтверждениях. Интерес представляет долгосрочная безопасность.
Как показали результаты доклинических исследований [18], особенности химической структуры даролутамида обеспечивают меньшее и менее тяжелое токсическое действие, чем другие представители ингибиторов андрогенных рецепторов (иАР) II поколения, из-за низкого проникновения через гематоэнцефалический барьер и низкого сродства связывания с рецепторами γ-аминомасляной кислоты типа А [19].
Возможно поэтому, в исследовании ARAMIS частоты выявления НЯ, связанные с воздействием на центральную нервную систему, были схожими в обеих группах. Так, артериальная гипертензия (6,6% против 5,2%) и усталость/астенические состояния (15,8% против 11,4%) чаще встречались у пациентов, получавших даролутамид, а падения (4,2% против 4,7%) чаще встречались в группе плацебо [20].
В метаанализе F. Turco и соавт. (2023), после систематического обзора трех работ, включающих 1652 пациента, получавших даролутамид, и 1250 пациентов, получавших плацебо, было показано, что даролутамид не увеличивал частоту НЯ, приводящих к прекращению лечения по сравнению с плацебо [21]. Не было никакой разницы в частоте НЯ между группами даролутамида и плацебо с точки зрения развития астении, аритмии, ишемической болезни сердца, депрессии, расстройства настроения, падений, усталости, сердечной недостаточности, приливов, гипертонии, психических расстройств, сыпи, судорог и потери массы тела. Единственным «представляющим интерес НЯ» со статистически значимой разницей в пользу плацебо были переломы костей (отношение шансов 1,523, 95% доверительный интервал 1,081–2,146).
Кроме того, даролутамид хорошо переносился при длительном наблюдении. В исследовании ARAMIS почти все пациенты получили полную запланированную дозу, и почти все пациенты с изменениями дозы смогли возобновить и восстановить запланированную дозу [12].
Важным фактором для выбора лекарственного препарата у больных неметастатическим и метастатическим КРРПЖ с учетом возраста пациентов и наличия сопутствующей патологии является риск развития нежелательных явлений в результате межлекарственных взаимодействий.
Анализ исследования ARAMIS показал, что практически все больные нмКРРПЖ, получавшие андроген-депривационную терапию ингибиторами андрогенных рецепторов, имели сопутствующие заболевания, требующие применения дополнительных лекарственных препаратов. Результаты доклинических испытаний продемонстрировали благоприятный профиль межлекарственных взаимодействий даролутамида: применение препарата ассоциировано с крайне незначительной индукцией CYP3A4 без клинически значимых эффектов, также отмечено отсутствие влияния на фармакокинетику других препаратов, наиболее часто используемых для лечения коморбидных состояний [22].
В таком случае важно выбрать правильную стратегию лечения, позволяющую увеличить как выживаемость пациентов, так и обеспечивающую им достойное качество жизни. Приведенное клиническое наблюдение, показавшее возможность эффективной и безопасной длительной терапии препаратом даролутамид и его анализ, позволит сделать правильный выбор лечебной тактики в других подобных ситуациях.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе
Information about the author
Семенов Андрей Владимирович – д-р мед. наук, ОБУЗ «Ивановский областной онкологический диспансер».
E-mail: andrey.semenov@mail.ru
Andrey V. Semenov – Dr. Sci. (Med.), Ivanovo Regional Oncological Dispensary. E-mail: andrey.semenov@mail.ru
Поступила в редакцию: 17.10.2024
Поступила после рецензирования: 30.10.2024
Принята к публикации: 14.11.2024
Received: 17.10.2024
Revised: 30.10.2024
Accepted: 14.11.2024
Клинический разбор в общей медицине №12 2024
К вопросу об эффективности и безопасности длительного применения даролутамида в комбинированной терапии больного с неметастатическим кастрационно-резистентным раком простаты (на примере одного клинического случая)
Номера страниц в выпуске:32-37
Аннотация
Актуальность и цель. Развитие у пациента неметастатического кастрационно-резистентного рака простаты (нмКРРПЖ), как правило, сопряжено с высоким риском прогрессии заболевания до метастатического кастрационно-резистентного процесса. В ряде исследований была подтверждена целесообразность применения новых антиандрогенов (в частности, препарата даролутамид) для улучшения выживаемости без метастазов и общей выживаемости данной категории больных. Однако научные данные по длительному наблюдению за пациентами, получающими даролутамид, в условиях реальной клинической практики фактически отсутствуют и ограничиваются периодом наблюдения в рамках клинических исследований. Поэтому особый интерес представляют наблюдения из реальной клинической практики, в которых излагаются сведения о состоянии здоровья пациентов, длительно получающих даролутамид по поводу нмКРРПЖ.
Материалы и методы. В работе приведено описание клинического случая применения препарата даролутамид на протяжении более чем 7 лет у пациента с нмКРРПЖ высокого риска прогрессии заболевания.
Результаты и выводы. Приведенное клиническое наблюдение, показавшее профиль эффективности и безопасности при длительной терапии препаратом даролутамид и его анализ, позволит оптимизировать выбор лечебной тактики в других подобных ситуациях.
Ключевые слова: неметастатический кастрационно-резистентный рак простаты, даролутамид, безопасность длительного применения.
Для цитирования: Семенов А.В. К вопросу об эффективности и безопасности длительного применения даролутамида в комбинированной терапии больного с неметастатическим кастрационно-резистентным раком простаты (на примере одного клинического случая).
Клинический разбор в общей медицине. 2024; 5 (12): 32–37. DOI: DOI: 10.47407/kr2024.5.12.00534
Актуальность и цель. Развитие у пациента неметастатического кастрационно-резистентного рака простаты (нмКРРПЖ), как правило, сопряжено с высоким риском прогрессии заболевания до метастатического кастрационно-резистентного процесса. В ряде исследований была подтверждена целесообразность применения новых антиандрогенов (в частности, препарата даролутамид) для улучшения выживаемости без метастазов и общей выживаемости данной категории больных. Однако научные данные по длительному наблюдению за пациентами, получающими даролутамид, в условиях реальной клинической практики фактически отсутствуют и ограничиваются периодом наблюдения в рамках клинических исследований. Поэтому особый интерес представляют наблюдения из реальной клинической практики, в которых излагаются сведения о состоянии здоровья пациентов, длительно получающих даролутамид по поводу нмКРРПЖ.
Материалы и методы. В работе приведено описание клинического случая применения препарата даролутамид на протяжении более чем 7 лет у пациента с нмКРРПЖ высокого риска прогрессии заболевания.
Результаты и выводы. Приведенное клиническое наблюдение, показавшее профиль эффективности и безопасности при длительной терапии препаратом даролутамид и его анализ, позволит оптимизировать выбор лечебной тактики в других подобных ситуациях.
Ключевые слова: неметастатический кастрационно-резистентный рак простаты, даролутамид, безопасность длительного применения.
Для цитирования: Семенов А.В. К вопросу об эффективности и безопасности длительного применения даролутамида в комбинированной терапии больного с неметастатическим кастрационно-резистентным раком простаты (на примере одного клинического случая).
Клинический разбор в общей медицине. 2024; 5 (12): 32–37. DOI: DOI: 10.47407/kr2024.5.12.00534
On the issue of efficacy and safety of the long-term use of darolutamide in combination therapy in patients with non-metastatic castration-resistant prostate cancer (on the example of one clinical case)
Andrey V. SemenovIvanovo Regional Oncological Dispensary, Ivanovo, Russia
andrey.semenov@mail.ru
Abstract
Background and aim. The development of non-metastatic castration-resistant prostate cancer (nmCRPC) in patients is usually associated with high risk of the disease progression to the metastatic castration-resistant disease. A number of studies have confirmed the feasibility of using novel antiandrogens (specifically darolutamide) to improve metastasis-free survival and overall survival in this category of patients. However, scientific data on the long-term follow-up of patients receiving darolutamide under conditions of real clinical practice are actually missing and are limited to the periods of follow-up within the framework of clinical trials. That is why the case reports from real clinical practice, in which the data on the health of patients receiving darolutamide for a long time due to nmCRPC are provided, are of special interest.
Methods. The paper reports a clinical case of using darolutamide for more than seven years in a patient with nmCRPC at high risk of the disease progression.
Results and conclusions. The case report provided showing the efficacy and safety profile of the long-term darolutamide therapy and the case report analysis will help optimize treatment tactics selection in other such situations.
Keywords: non-metastatic castration-resistant prostate cancer, darolutamide, safety of long-term use
For citation: Semenov A.V. On the issue of efficacy and safety of the long-term use of darolutamide in combination therapy in patients with non-metastatic castration-resistant prostate cancer (on the example of one clinical case). Clinical review for general practice. 2024; 5 (12): 32–37 (In Russ.). DOI: DOI: 10.47407/kr2024.5.12.00534
Введение и актуальность
Рак предстательной железы (РПЖ) остается одной из самых актуальных проблем современной онкологии. Прежде всего это связано с прогрессивно возрастающими показателями заболеваемости РПЖ, а также со стабильно высокой летальностью, с одной стороны, и, несмотря на увеличение числа пациентов с локализованными формами заболевания, высокой частотой рецидивов и прогрессии заболевания (до 50% в течение 10 лет после радикального лечения), с другой [1].Известно, что в течение пяти лет наблюдения у 10–20% пациентов с метастазами РПЖ разовьется кастрационно-резистентный рак простаты (КРРПЖ), и медиана общей выживаемости этих больных с момента развития кастрационной резистентности составит примерно 14 мес [2, 3].
В ряде случаев после развития биохимического рецидива на фоне стандартной андроген-депривационной терапии (АДТ) прогрессия заболевания может идти по другому сценарию, с развитием неметастатического КРРПЖ (нмКРРПЖ), без фазы гормонально-чуствительного метастатического процесса. Главным критерием прогрессии заболевания в этом случае будет прогрессивный рост простатического специфического антигена (ПСА) на фоне отсутствия радиологических признаков метастатического процесса и кастрационного уровня тестостерона [4].
Известно, что пациенты с нмКРРПЖ подвергаются более высокому риску прогрессии заболевания. В течение двух лет наблюдения метастазы могут развиться у 1/3 пациентов, что увеличивает бремя смертности в этой популяции [5]. Предиктором такого исхода является время удвоения ПСА (ВУПСА) менее 10 мес [6].
В ряде исследований показано, что отсрочка времени до метастазирования в результате применения того или иного метода лечения, известная как выживаемость без метастазов, при РПЖ коррелирует с улучшением общей выживаемости и качества жизни [7, 8]. Кроме того, увеличение выживаемости без метастазов сопровождается значимой клинической пользой, измеряемой увеличением времени до развития хронического болевого синдрома, патологических переломов и компрессии спинного мозга [9].
В международных многоцентровых исследованиях PROSPER, SPARTAN и ARAMIS была подтверждена целесообразность применения энзалутамида [10], апалутамида [11] и даролутамида [12] у пациентов с нмКРРПЖ. Во всех трех исследованиях продемонстрировано достоверное увеличение выживаемости без метастазов в группах комбинированной терапии антиандрогенами 2-го поколения (АА-2)+АДТ по сравнению с моно-АДТ. На момент завершения исследований отсутствовали данные по медиане ОВ, но при этом было установлено статистически значимое преимущество по снижению риска летального исхода в группах комбинированной терапии. Поэтому, вопрос об изучении безопасности долговременного приема новых антиандрогенов, является актуальным.
В этой связи интерес представляет объединенный анализ данных пациентов, получавших лечение даролутамидом более двух лет, проведенный R.H. Jones и соавт. [13]. В обзоре приведены сведения о 13 пациентах, получавших даролутамид в течение двух и более лет, при этом 7 пациентов получали лечение от 2 до 4 лет, а 6 пациентов получали лечение более 4 лет. Медиана возраста пациентов составлял 68 (55–81) лет. Пациентов обследовали каждые 3 мес для оценки безопасности и переносимости терапии даролутамидом при длительном применении. У большинства пациентов была нормальная функция почек и печени (77%), ECOG-статус был равен нулю у 92% больных. Большинство пациентов имели агрессивные опухоли предстательной железы (сумма Глисона 7 или выше у 69%). Медиана времени от первоначального диагноза РПЖ до первой дозы приема даролутамида составила 32,4 (9,7–191,0) мес, а медиана исходного уровня ПСА до начала приема даролутамида – 18,1 (4,6–53,6) нг/дл. Все пациенты до лечения даролутамидом получали АДТ, ни один из них не получал ранее химиотерапию. Медиана продолжительности лечения даролутамидом составила 38,1 (24,2–90,0) мес для всех 13 пациентов, получавших лечение более двух, и 62,6 (48,6–90,0) мес для пациентов, получавших лечение более четырех лет.
О развитии тех или иных нежелательных явлений (НЯ) сообщали все 13 пациентов. Наиболее распространенными НЯ были диарея, боль в животе и тошнота. НЯ 3-й степени тяжести были отмечены у 6 пациентов, о событиях 4 или 5-й степени не сообщалось. Ни одно из событий 3-й степени не наблюдалось более чем у одного пациента, и ни одно из них не было расценено как связанное с применением даролутамида. Серьезные НЯ были зарегистрированы у 6 пациентов, но ни одно из них не было расценено как связанное с терапией даролутамидом. Исследование показало, что НЯ, связанные с лечением, не привели к отмене даролутамида.
Цель и задачи
Мы надеемся получить ответ на вопрос о профиле безопасности долговременного применения даролутамида по завершению продолжающегося в настоящее время международного открытого многоцентрового клинического исследования Roll-Over Study, куда были включены пациенты, ранее принимавшие даролутамид в других клинических исследованиях III фазы по изучению препарата даролутамид и продолжавшие получать клиническую пользу от проводимой терапии. Анализ, который будет проведен по завершению данного проекта, позволит с высокой степенью достоверности оценить клиническую пользу и профиль безопасности длительного применения препарата даролутамид у пациентов, в том числе с нмКРРПЖ.А пока его итоги не подведены, особый интерес представляют наблюдения из реальной клинической практики, в которых излагаются сведения о состоянии здоровья пациентов, длительно получающих даролутамид по поводу нмКРРПЖ.
Ниже представлен опыт длительной терапии из личной клинической практики, в течение нескольких лет предотвращающей развитие метастазов у больного РПЖ.
Собственный материал
Пациент А., 1942 г.р., РПЖ (в обеих долях мелкоацинарная аденокарцинома, сумма Глисона 4+4=8 баллов) был верифицирован в январе 2007 г. при повторной биопсии, показанием к биопсии явился повышенный до 40 нг/мл уровень ПСА. В анамнезе у пациента трансуретральная резекция предстательной железы по поводу острой задержки мочеиспускания после биопсии предстательной железы (в январе 2006 г.), гистологическое заключение – доброкачественная гиперплазия.При дальнейшем обследовании при проведении магнитно-резонансной томографии малого таза было выявлено распространение опухоли за пределы капсулы предстательной железы, в том числе ее инвазивный рост в стенку прямой кишки. При остеосцинтиграфии данных, подтверждающих специфическую гиперфиксацию радиофармпрепарата, не получено. Установлен диагноз: рак предстательной железы сT4N0M0, IV стадии, II клиническая группа.
В феврале 2007 г. пациенту была назначена АДТ в режиме максимальной андрогенной блокады – МАБ (гозерелин-депо + бикалутамид 50 мг/сут). После консультации в ФГБУ РНЦРР Минздрава России (Москва) в мае-июне 2007 г. там же проведены 2 курса дистанционной лучевой терапии, суммарная очаговая доза (СОД) на первом этапе – 24 Гр, СОД на втором этапе указать не представляется возможным вследствие утраты документов. АДТ в объеме МАБ была продолжена в непрерывном режиме до марта 2008 г., достигнут надир ПСА 0,9 нг/мл.
В ноябре 2008 г. имело место увеличение уровня ПСА до 3,2 нг/мл, констатирован биохимический рецидив РПЖ, была возобновлена АДТ в объеме МАБ.
С февраля 2009 г. по декабрь 2015 г. АДТ проводилась в интермиттирующем режиме, с колебаниями ПСА от 0,1 нг/мл до 15,6 нг/мл. В течение этого периода времени пациент регулярно обследовался, при проведении остеосцинтиграфии (ОСГ), а также ультразвукового исследования внутренних органов и рентгенологическом исследовании легких, которые выполнялась 2 раза в год, не было выявлено признаков метастатического поражения костей и внутренних органов.
С января 2016 г. АДТ проводилась непрерывно. Несмотря на кастрационный уровень тестостерона, ПСА прогрессивно повышался (с 4,25 нг/мл до 6,8 нг/мл; рис. 1).

В августе 2016 г. ВУПСА составило 7,7 нг/мл, а при проведении ОСГ и мультиспиральной компьютерная томографии (МСКТ) брюшной, грудной полостей и малого таза метастазов выявлено не было.
Учитывая биохимическую прогрессию заболевания (последовательный рост ПСА в трех измерениях, сделанных с интервалом не менее одной недели, более чем на 50% от надира ПСА, при уровне ПСА более 2 нг/мл) и отсутствие данных, подтверждающих радиологическую прогрессию опухолевого процесса на фоне непрерывной АДТ и кастрационного уровня тестостерона, пациенту установлена фаза неметастатического кастрационно-резистентного РПЖ. Период времени от первоначального диагноза РПЖ до констатации нмКРРПЖ составил 116 мес.
Осенью 2016 г. не существовало никаких специальных опций для лечения такой категории больных, кроме продолжения АДТ. Возможно поэтому, в ноябре 2016 г. пациент согласился принять участие в международном исследовании ARAMIS (№3104007 «Многонациональное, рандомизированное, двойное слепое, плацебо контролируемое исследование III фазы для оценки эффективности и безопасности препарата ODM-201 у мужчин с неметастатическим кастрационно-устойчивым раком предстательной железы высокого риска»).
После выполнения процедур скрининга, диагноз нмКРРПЖ был подтвержден. Также было констатировано, что показатель ВУПСА у пациента составляет менее 10 мес на фоне кастрационного уровня тестостерона. Такая скорость удвоения ПСА была одним из главных критериев включения больного в протокол ARAMIS, и позже вошла в клинические рекомендации как показание для назначения комбинированного лечения (АА2+АДТ) при нмКРРПЖ.
В настоящее время все участники проекта ARAMIS расслеплены, в слепой фазе исследования пациент был рандомизирован в группу исследуемого препарата (ODM-201, получивший впоследствии наименование даролутамид). С целью андрогенной депривации пациент продолжил лечение аналогами рилизинг-гормона лютеинизирующего гормона, во время участия в протоколе он получал препарат гозерелин-депо 10,8 мг, подкожно, 1 раз в 84 дня в непрерывном режиме.
 Пациент А. не имел прогрессии заболевания в слепой фазе исследования ARAMIS, в марте 2019 г. он успешно перешел в открытую фазу исследования и также продолжил комбинированную терапию даролутамидом на фоне АДТ. Он имел стабильно низкий уровень ПСА (рис. 2), при регулярном радиологическом обследовании (МСКТ и ОСГ каждые 16 нед) метастазов выявлено не было.
Пациент А. не имел прогрессии заболевания в слепой фазе исследования ARAMIS, в марте 2019 г. он успешно перешел в открытую фазу исследования и также продолжил комбинированную терапию даролутамидом на фоне АДТ. Он имел стабильно низкий уровень ПСА (рис. 2), при регулярном радиологическом обследовании (МСКТ и ОСГ каждые 16 нед) метастазов выявлено не было.В конце 2019 г. исследование ARAMIS было завершено, показатель выживаемости без метастазов в группе больных нмКРРПЖ достоверно превышает аналогичный параметр группы плацебо. Больным, которые сохранили показания для продолжения приема даролутамида на фоне АТД, был предложен переход в исследование III фазы №20321 «Открытое, не сравнительное, дополнительное исследование для обеспечения продолжения терапии даролутамидом для пациентов, ранее принимавших участие в исследованиях, спонсируемых компанией Байер», целью которого был контроль безопасности при длительной терапии даролутамидом. Из 13 пациентов, прошедших скрининг в ARAMIS в нашем исследовательском центре, в исследование 20321 перешли 4 пациента, в том числе и пациент А. (с декабря 2020 г.).
В настоящее время пациент продолжает прием препарата даролутамид на фоне АДТ, не имея ни биохимической, ни радиологической прогрессии. По состоянию на сентябрь 2024 г. пациент живет с диагнозом РПЖ 17,9 года (215 мес.), в том числе более 8 лет живет в кастрационно-резистентной фазе болезни (97 мес), не имея при этом никаких метастатических очагов. Прием даролутамида в составе комбинирований терапии продолжается 94 мес (7 лет и 10 мес).
За все время лечения даролутамидом осуществлялся мониторинг возникновения и развития НЯ. В медицинской документации больного за все время наблюдения отмечены только два НЯ: головная боль (степень 1) и боль в спине (степень 1). Серьезных НЯ зарегистрировано не было. Тестирование пациента А. по опросникам оценки качества жизни (FACT-P и EQ-5D) показало стабильно высокую самооценку качества жизни.
Пациент А. имел ряд хронических заболеваний, в целом типичных для его возраста. Такие как гипертоническая болезнь, ишемическая болезнь сердца, ожирение I степени, атеросклероз, доброкачественная гиперплазия простаты с симптомами нижних мочевых путей. Имел место хронический прием сопутствующих лекарственных препаратов (амлодипин, эналаприл, торасемид, тамсулозин), который продолжается в настоящее время. Пациент наблюдается у терапевта территориальной поликлиники, и следует отметить, что за столь длительное время наблюдения не отмечено декомпенсации его соматических заболеваний и необходимости коррекции доз принимаемых лекарств.
За все почти 8 лет наблюдения у пациента сохранялся ECOG статус 1, несмотря на пенсионный возраст и сопутствующие заболевания, его трудовая деятельность не прекратилась, он продолжает заниматься творчеством – пишет и редактирует книги.
Обсуждение
Итак, представленный клинический случай, как и исследование ARAMIS, показали эффективность препарата даролутамид по пролонгации времени до метастатической фазы болезни у больных с нмКРРПЖ.Но, кроме эффективности, не меньшее значение имеет безопасность столь длительного применения даролутамида.
РПЖ у пациента А. был впервые выявлен в местно-распространной фазе опухолевого процесса, имелась инвазия опухоли в стенку прямой кишки, уровень ПСА был довольно высок (40 нг/мл), по результатам морфологического исследования опухолевой ткани пациент был отнесен к четвертой прогностической группе (предпоследней) по ISUP (Глисон 4+4=8 баллов). После проведенного радикального лечения пациент относился к группе высокого риска биохимического рецидива [14], который и был констатирован у него через 16 мес. По поводу биохимического рецидива пациент получал АДТ в различных режимах, соответствующую существующим на тот момент клиническими рекомендациям.
Диагноз нмКРРПЖ у больного А. был установлен в полном соответствии с принятыми критериями – наличием биохимической прогрессии на фоне кастрационного уровня тестостерона и отсутствием радиологической прогрессии, которая оценивается на основании классических методов контроля у больных РПЖ (МСКТ и ОСГ) по критериям PCWG3 [15]. ВУПСА на момент постановки диагноза нмКРРПЖ была менее 10 мес, т.е. пациент имел высокий риск развития метастазов и последующего перехода болезни в последнюю и наиболее тяжелую фазу – развитие мКРРПЖ [16].
В двух абзацах этого раздела пересказана типичная история болезни несвоевременно выявленного больного агрессивной формой рака простаты. Однако с 2016 г.
история перестает быть типичной – назначенная пациенту комбинированная терапия, включающая андрогенную депривацию и новый терапевтический агент даролутамид, обеспечила достижение полного ПСА-ответа и период жизни свободный от метастазов более 8 лет(!).
По мнению K. Fizazi и соавт. (2014), даролутамид является более афинным антагонистом андрогеновых рецепторов, чем энзалутамид или апалутамид [17]. Впрочем, высокая эффективность даролутамида при нмКРРПЖ вполне известна и после завершения исследования ARAMIS не нуждается в дополнительных подтверждениях. Интерес представляет долгосрочная безопасность.
Как показали результаты доклинических исследований [18], особенности химической структуры даролутамида обеспечивают меньшее и менее тяжелое токсическое действие, чем другие представители ингибиторов андрогенных рецепторов (иАР) II поколения, из-за низкого проникновения через гематоэнцефалический барьер и низкого сродства связывания с рецепторами γ-аминомасляной кислоты типа А [19].
Возможно поэтому, в исследовании ARAMIS частоты выявления НЯ, связанные с воздействием на центральную нервную систему, были схожими в обеих группах. Так, артериальная гипертензия (6,6% против 5,2%) и усталость/астенические состояния (15,8% против 11,4%) чаще встречались у пациентов, получавших даролутамид, а падения (4,2% против 4,7%) чаще встречались в группе плацебо [20].
В метаанализе F. Turco и соавт. (2023), после систематического обзора трех работ, включающих 1652 пациента, получавших даролутамид, и 1250 пациентов, получавших плацебо, было показано, что даролутамид не увеличивал частоту НЯ, приводящих к прекращению лечения по сравнению с плацебо [21]. Не было никакой разницы в частоте НЯ между группами даролутамида и плацебо с точки зрения развития астении, аритмии, ишемической болезни сердца, депрессии, расстройства настроения, падений, усталости, сердечной недостаточности, приливов, гипертонии, психических расстройств, сыпи, судорог и потери массы тела. Единственным «представляющим интерес НЯ» со статистически значимой разницей в пользу плацебо были переломы костей (отношение шансов 1,523, 95% доверительный интервал 1,081–2,146).
Кроме того, даролутамид хорошо переносился при длительном наблюдении. В исследовании ARAMIS почти все пациенты получили полную запланированную дозу, и почти все пациенты с изменениями дозы смогли возобновить и восстановить запланированную дозу [12].
Важным фактором для выбора лекарственного препарата у больных неметастатическим и метастатическим КРРПЖ с учетом возраста пациентов и наличия сопутствующей патологии является риск развития нежелательных явлений в результате межлекарственных взаимодействий.
Анализ исследования ARAMIS показал, что практически все больные нмКРРПЖ, получавшие андроген-депривационную терапию ингибиторами андрогенных рецепторов, имели сопутствующие заболевания, требующие применения дополнительных лекарственных препаратов. Результаты доклинических испытаний продемонстрировали благоприятный профиль межлекарственных взаимодействий даролутамида: применение препарата ассоциировано с крайне незначительной индукцией CYP3A4 без клинически значимых эффектов, также отмечено отсутствие влияния на фармакокинетику других препаратов, наиболее часто используемых для лечения коморбидных состояний [22].
Заключение и выводы
Итак, в большинстве случаев, пациенты с нмКРРПЖ не имеют симптомов со стороны опухоли, остаются физически и социально активными людьми, помогают детям, воспитывают внуков, занимаются спортом. Поэтому сохранение качества жизни пациентов с нмКРРПЖ является одной из ключевых терапевтических задач при выборе тактики лечения. В то же время пациенты с нмКРРПЖ страдают множеством сопутствующих заболеваний, например, таких как сахарный диабет и артериальная гипертензия, которые удается контролировать с помощью ежедневной сопутствующей терапии.В таком случае важно выбрать правильную стратегию лечения, позволяющую увеличить как выживаемость пациентов, так и обеспечивающую им достойное качество жизни. Приведенное клиническое наблюдение, показавшее возможность эффективной и безопасной длительной терапии препаратом даролутамид и его анализ, позволит сделать правильный выбор лечебной тактики в других подобных ситуациях.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе
Information about the author
Семенов Андрей Владимирович – д-р мед. наук, ОБУЗ «Ивановский областной онкологический диспансер».
E-mail: andrey.semenov@mail.ru
Andrey V. Semenov – Dr. Sci. (Med.), Ivanovo Regional Oncological Dispensary. E-mail: andrey.semenov@mail.ru
Поступила в редакцию: 17.10.2024
Поступила после рецензирования: 30.10.2024
Принята к публикации: 14.11.2024
Received: 17.10.2024
Revised: 30.10.2024
Accepted: 14.11.2024
Список исп. литературыСкрыть список1. Paller CJ, Antonarakis ES. Management of biochemically recurrent prostate cancer after local therapy: evolving standards of care and new directions. Clin Adv Hematol Oncol 2013;11(1):14-23. PMID: 23416859; PMCID: PMC3624708.
2. Kirby M, Hirst C, Crawford ED. Characterising the castration-resistant prostate cancer population: a systematic review. Int J Clin Pract 2011;65(11):1180-92. DOI: 10.1111/j.1742-1241.2011.02799.x. PMID: 21995694
3. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin 2022;72(1):7-33. DOI: 10.3322/caac.21708. PMID: 35020204.
4. Scher HI, Solo K, Valant J et al. Prevalence of Prostate Cancer Clinical States and Mortality in the United States: Estimates Using a Dynamic Progression Model. PLoS One 2015;10(10):e0139440. DOI: 10.1371/journal.pone.0139440. PMID: 26460686; PMCID: PMC4603789.
5. Hirst CJ, Cabrera C, Kirby M. Epidemiology of castration resistant prostate cancer: a longitudinal analysis using a UK primary care database. Cancer Epidemiol 2012;36(6):e349-53. DOI: 10.1016/j.canep.2012. 07.012. PMID: 22910034.
6. Smith MR, Cook R, Lee KA, Nelson JB. Disease and host characteristics as predictors of time to first bone metastasis and death in men with progressive castration-resistant nonmetastatic prostate cancer. Cancer 2011;117(10):2077-85. DOI: 10.1002/cncr.25762. PMID: 21523719; PMCID: PMC3116053.
7. Xie W, Regan MM, Buyse M et al; ICECaP Working Group. Metastasis-Free Survival Is a Strong Surrogate of Overall Survival in Localized Prostate Cancer. J Clin Oncol 2017;35(27):3097-104. DOI: 10.1200/JCO.2017.73.9987. PMID: 28796587; PMCID: PMC5652387.
8. Mori A, Hashimoto K, Koroki Y et al. The correlation between metastasis-free survival and overall survival in non-metastatic castration resistant prostate cancer patients from the Medical Data Vision claims database in Japan. Curr Med Res Opin 2019;35(10):1745-50. DOI: 10.1080/03007995.2019.1619543. PMID: 31084438.
9. Beaver JA, Kluetz PG, Pazdur R. Metastasis-free Survival – A New End Point in Prostate Cancer Trials. N Engl J Med 2018;378(26):2458-60. DOI: 10.1056/NEJMp1805966. PMID: 29949489.
10. Hussain M, Fizazi K, Saad F et al. Enzalutamide in Men with Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2018;378(26):2465-74. DOI: 10.1056/NEJMoa1800536. PMID: 29949494; PMCID: PMC8288034.
11. Smith MR, Saad F, Chowdhury S et al; SPARTAN Investigators. Apalutamide Treatment and Metastasis-free Survival in Prostate Cancer. N Engl J Med 2018;378(15):1408-18. DOI: 10.1056/NEJMoa1715546. PMID: 29420164.
12. Fizazi K, Shore N, Tammela TL et al; ARAMIS Investigators. Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2019;380(13):1235-46. DOI: 10.1056/NEJMoa1815671. Erratum in: N Engl J Med 2022;387(9):860. DOI: 10.1056/NEJMx220007. PMID: 30763142.
13. Jones RH, Fizazi K, James ND et al. Safety and tolerability of long-term treatment with darolutamide in patients with metastatic castration-resistant prostate cancer. Prostate Cancer Prostatic Dis 2023; Oct 26. DOI: 10.1038/s41391-023-00740-9. Epub ahead of print. PMID: 37884613.
14. Preisser F, Abrams-Pompe RS, Stelwagen PJ et al.; EAU-YAU Prostate Cancer Working Group. European Association of Urology Biochemical Recurrence Risk Classification as a Decision Tool for Salvage Radiotherapy-A Multicenter Study. Eur Urol 2024;85(2):164-70. DOI: 10.1016/j.eururo.2023.05.038. PMID: 37355358.
15. Scher HI, Morris MJ, Stadler WM et al; Prostate Cancer Clinical Trials Working Group 3. Trial Design and Objectives for Castration-Resistant Prostate Cancer: Updated Recommendations From the Prostate Cancer Clinical Trials Working Group 3. J Clin Oncol 2016;34(12):1402-18. DOI: 10.1200/JCO.2015.64.2702. PMID: 26903579; PMCID: PMC4872347.
16. Smith MR, Kabbinavar F, Saad F et al. Natural history of rising serum prostate-specific antigen in men with castrate nonmetastatic prostate cancer. J Clin Oncol 2005;23(13):2918-25. DOI: 10.1200/JCO.2005.01.529. PMID: 15860850.
17. Fizazi K, Massard C, Bono P et al. Activity and safety of ODM-201 in patients with progressive metastatic castration-resistant prostate cancer (ARADES): an open-label phase 1 dose-escalation and randomised phase 2 dose expansion trial. Lancet Oncol 2014;15:975-85.
18. Moilanen AM, Riikonen R, Oksala R et al. ODM-201 – new generation androgen receptor inhibitor with excellent antiandrogenic and antitumor activity in nonclinical models of CRPC. Eur J Cancer 2013;49(Suppl 2):S685.
19. Moilanen AM, Riikonen R, Oksala R et al. Discovery of ODM-201, a new-generation androgen receptor inhibitor targeting resistance mechanisms to androgen signaling-directed prostate cancer therapies. Sci Rep 2015;(5):12007. DOI: 10.1038/srep12007. PMID: 26137992; PMCID: PMC4490394.
20. Fizazi K, Shore N, Tammela TL et al; ARAMIS Investigators. Nonmetastatic, Castration-Resistant Prostate Cancer and Survival with Darolutamide. N Engl J Med 2020;383(11):1040-9. DOI: 10.1056/NEJMoa2001342. PMID: 32905676.
21. Turco F, Gillessen S, Treglia G et al. Safety profile of darolutamide versus placebo: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis 2024;27(3):385-92. DOI: 10.1038/s41391-023-00775-y. PMID: 38097723.
22. Алексеев Б.Я., Нюшко К.М., Козлова П.С. и др. Современные возможности терапии больных неметастатическим кастрационно-рефрактерным раком предстательной железы. Онкоурология. 2020;16(3):190-7.
Alekseev B.Ya., Nyushko K.M., Kozlova P.S. et al. Modern possibilities of therapy in patients with metastatic castration-refractory prostate cancer. Oncourology. 2020;16(3):190-7 (in Russian).
26 декабря 2024
Количество просмотров: 500

