Клинический разбор в общей медицине №12 2024
1 Vladimirsky Moscow Regional Research Clinical Institute (MONIKI), Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
semenkov@inbox.ru
Abstract
Relevance. Epithelial pseudoinvasion of colorectal adenoma is morphologically characterized by the detection of glands in the submucosa.
The aim of the study was to increase awareness of submucosal pseudoinvasion for clinical purposes to prevent overly aggressive surgical treatment.
Materials and methods. The surgical materials of 147 patients with polypoid and laterally spreading neoplasms of the colon were analyzed. Cases of pseudoinvasion in colon adenomas were described in detail.
Results. Pseudoinvasion was detected in 3.4% (4/147) of cases. In 3 neoplasms, foci of severe dysplasia in the superficial sections were detected against the background of villous adenoma. In one case, a focus of epithelial prolapse was detected against the background of intramucosal carcinoma. Pseudoinvasion was detected in the muscularis mucosa and submucosal layer in the form of foci of a similar adenoma surrounded by fibrous stroma, the presence of extracellular mucus fields, elements of chronic inflammation with an admixture of segmented leukocytes, hemosiderin-rich macrophages, but without signs of stromal desmoplasia. Single glands were incomplete and uneven, with cytological signs of low-grade atypia. Unlike invasive carcinoma, tumor kidneys, lymphovascular and/or perineural invasion were not detected. In all cases of resection of colon neoplasms with pseudoinvasion, severe fibrosis of the submucosal layer was observed, which led to non-radical resection (the vertical resection margin passed along the prolapse focus – R1). Despite non-radical resections, no signs of relapse were obtained during control endoscopic examinations. At the stage of endoscopic dissection, foci of epithelial prolapse are difficult to differentiate from true tumor invasion, which may determine an unjustified transition to traditional surgical intervention.
Conclusion. Pseudoinvasion in colon adenomas is a rare phenomenon. Endoscopic removal of such neoplasms is a difficult task due to severe fibrosis of the submucosal layer and is associated with a high probability of incomplete resection. However, the risks of recurrence after incomplete endoscopic resection are minimal.
Keywords: pseudoinvasion, colon adenoma, invasive colon carcinoma, colon neoplasia, endoscopic colon resection.
For citation: Verbovsky A.N., Setdikova G.R., Shikina V.E., Semenkov A.V. Pseudoinvasion in colon adenomas mimicking invasive carcinoma: diagnostic challenges and literature review. Clinical review for general practice. 2024; 5 (12): 45–50 (In Russ.). DOI: 10.47407/kr2024.5.12.00536
С активным внедрением методов эндоскопической резекции новообразований многие неопластические поражения, включая ранний рак толстой кишки, стали эндоскопически операбельными, несмотря на размер [6–8]. Крупные поверхностные эпителиальные новообразования толстой кишки эндоскопически могут быть удалены двумя способами: эндоскопическая резекция фрагментами и эндоскопическая подслизистая диссекция. Лишь метод эндоскопической подслизистой диссекции обеспечивает высокую частоту резекции единым блоком в пределах здоровых тканей вне зависимости от размера новообразования. Резекция новообразований единым блоком имеет два основных преимущества: более точная гистологическая оценка краев резекции и снижение риска рецидива, в сравнении с эндоскопической резекцией фрагментами [9]. Кроме того, при морфологической оценке аденом необходимо выявить участки с тяжелой дисплазией, а также структуры инвазивной карциномы. Однако некоторые аденомы, особенно размером более 3,0 см, расположенные в сигмовидной кишке, могут вызвать трудности при гистологическом исследовании в виду сложности дифференциальной диагностики между истинным инвазивным ростом и неправильно расположенным аденоматозным эпителием в подслизистой основе – псевдоинвазией [10, 11].
В литературе псевдоинвазия встречается под такими синонимами, как эпителиальное смещение или эпителиальный пролапс [12]. Данный феномен обычно является результатом повторного травматического повреждения толстой кишки [13]. Именно для аденом, локализующихся в сигмовидной кишке, характерна псевдоинвазия из-за ее узкого просвета и склонности к дивертикулярной болезни. Однако, по литературным данным, псевдоинвазия описана в различных отделах толстой кишки, особенно при достаточно крупных новообразованиях [14]. Морфологически эпителиальный пролапс (псевдоинвазия) характеризуется наличием железистых структур с цитологической атипией, аналогичной таковой из вышележащего (несмещенного) эпителия, окруженных собственной пластинкой слизистой оболочки с многочисленными макрофагами, нагруженные гемосидерином, без десмопластической реакции стромы [12, 13].
Безусловно псевдоинвазия диагностируется морфологически, после проведенного эндоскопического удаления, хотя описаны случаи диагностики с помощью эндосонографии. Однако при кистозно-расширенных криптах, заполненных муцинозным содержимым, имитирующих кисты и инвазивную коллоидную карциному, данный метод диагностически не эффективен [15].
Следует отметить, что в реальной практике часто встречаются случаи, когда трудно отличить псевдоинвазию от истинного инфильтративного роста, особенно при коллоидной карциноме или при минимально инвазивных формах рака. Важно поставить точный диагноз наличия и глубины инвазии в подслизистую основу в образцах после эндоскопически удаленных колоректальных новообразований, чтобы избежать последующего агрессивного хирургического лечения. Учитывая низкую осведомленность как эндоскопических хирургов и онкологов, так и морфологов, а также невысокую частоту обнаружения эпителиального пролапса в аденомах толстой кишки, в настоящем исследовании детально рассмотрены эндоскопические и морфологические изменения, наблюдаемые при данном феномене.
Цель исследования – повышение осведомленности о подслизистой псевдоинвазии в клинических целях для предотвращения чрезмерно агрессивного хирургического лечения.
При визуализации колоректальных новообразований для описания сосудистого рисунка и микроструктуры поверхности эпителия в узком световом спектре (NBI) использовали универсальную эндоскопическую японскую классификацию JNET. После проведенной эндоскопической подслизистой диссекции материал фиксировался на пенопластовом полотне иглами без натяжения тканей (рис. 1).
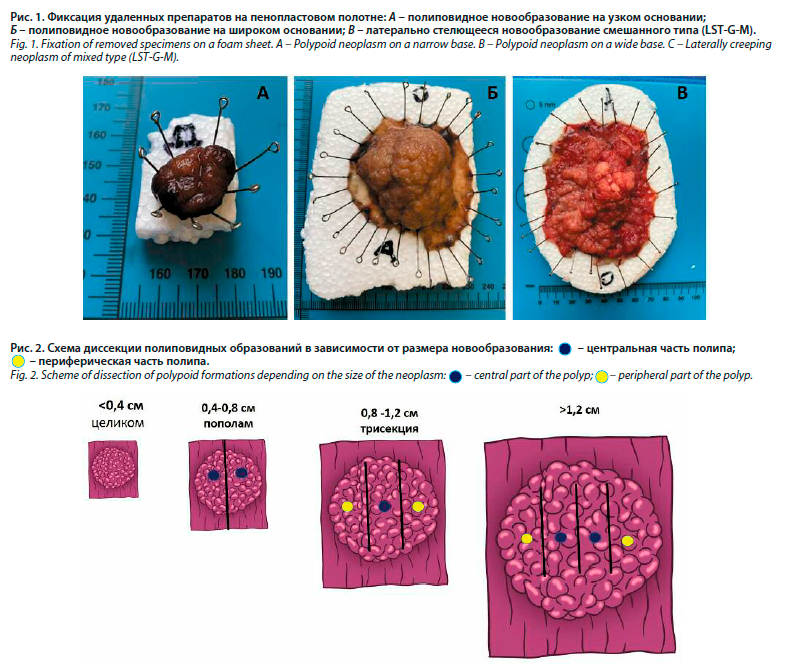
Это важно, поскольку после проведения эндоскопической подслизистой диссекции и погружения образца в формалин происходит его деформация, он сжимается и уменьшается в объеме, что может негативно влиять на оценку краев резекции, заведомо повышая процент ложноположительного края.
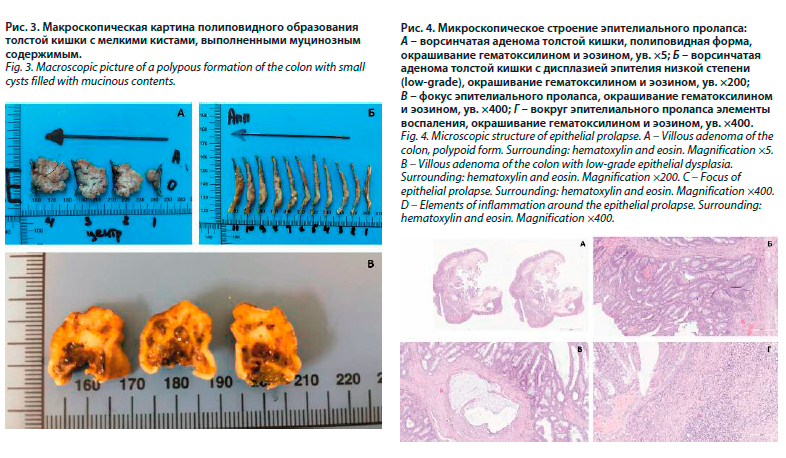
При макроскопическом исследовании указывался размер всего иссеченного образца, затем размер образования с обязательным измерением расстояния до краев резекции. После этого при латерально-распространяющихся опухолях производили параллельные разрезы от одного края резекции до другого с шагом – 2–3 мм. При полиповидных образованиях также проводили параллельные разрезы, с обязательной маркировкой центральной части полипа и периферической в зависимости от размера полипа (рис. 2).
Следует отметить, что в преобладающем большинстве случаев на разрезе новообразования были однородные, мягко-эластичной консистенции, белесовато-сероватого цвета. И лишь в одном случае при диссекции полиповидного образования обнаружены мелкие кисты, наполненные муцинозным содержимым (рис. 3). При укладке образцов в кассеты забирали все фрагменты. Материал фиксировали в 10% забуференном растворе формалина, затем заливали в парафин по обычной методике. Серийные парафиновые срезы толщиной 3 мкм депарафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином.
Силу и значимость связи между анализируемыми признаками оценивали с помощью корреляционно-регрессионного анализа. Для количественных признаков вычисляли корреляционный коэффициент Пирсона. За уровень статистической значимости принимали р<0,05. Достоверность различий между кривыми выживаемости подтверждали с помощью лог-рангового теста, с использованием пакета программ Statistica для Microsoft Windows (версия 13.0).
По локализации в отделах толстой кишки образования локализовались следующим образом – лидирующие сайты прямая и восходящий отдел толстой кишки, 38/147 (25,8%) и 30/147 (20,4%) соответственно. Далее в убывающем порядке слепая и сигмовидная кишка, 21/147 (14,3%) и 20/147 (13,6%) соответственно. Остальные локализации не превышали 8%, а опухоли с пограничными локализациями – единичные наблюдения.
При анализе морфологической картины ворсинчатые аденомы 58/147 (39,5%) являются лидирующим гистологическим типом образований, далее следуют тубулярные 5/147 (3,4%) и смешанные формы 49/147 (33,3%). Структуры тяжелой дисплазии и фокусы инвазивной карциномы обнаруживались при всех гистологических типах, без статистически значимой корреляции (р=0,071). При анализе локализации опухоли в толстой кишке и морфологического строения канцеризация в большинстве случаев характерна для прямой кишки (R=0,28; p=0,021).
При анализе корреляционной зависимости между гистологическим строением и размером образований корреляция не выявлена, поскольку ранний колоректальный рак и/или структуры аденомы high-grade выявляются при любом размере неопластического процесса. Следует отметить, что во всех образованиях более 8,0 см выявлена тяжелая степень дисплазии и/или минимально-инвазивный колоректальный рак.
По нашим данным резекция единым блоком выполнена в 97% (145/147) случаев. В большинстве случаев достигнута полная радикальность при выполнении эндоскопического лечения – в 94,5% (139/147); R1 – 4,1% (6/147) и позитивный горизонтальный край или фрагментация образования в 4,4% (6/136) случаев.
Псевдоинвазия выявлена в 3,4% (4/147) случаев с локализацией всех аденом в сигмовидной кишке, однако именно эти образования вызвали трудности при морфологическом исследовании. В трех неоплазиях на фоне ворсинчатой аденомы выявлены фокусы тяжелой дисплазии в поверхностных отделах. В одном случае на фоне интрамукозальной карциномы выявлен фокус эпителиального пролапса. Псевдоинвазия обнаружена в мышечной пластинке слизистой оболочки и подслизистом слое в виде фокусов аналогичной аденомы, окруженных фиброзной стромой, наличием внеклеточных полей слизи, элементы хронического воспаления с примесью сегментоядерных лейкоцитов, макрофагов, богатых гемосидерином, но без признаков десмоплазии стромы (рис. 4). Единичные железы были неполными и неровными, с цитологическими признаками атипии низкой степени злокачественности. Опухолевые почки, лимфоваскулярная и/или периневральная инвазия не обнаружены, в отличие от инвазивной карциномы. Во всех четырех случаях вертикальный край резекции проходил по фокусу пролапса (R1). При контрольных эндоскопических осмотрах через 3, 6 и 12 мес данных, подтверждающих местный рецидив, не было получено. Во всех случаях область резекции новообразований была представлена рубцовыми изменениями.
С развитием эндоскопических технологий в диагностике новообразований толстой кишки, эндоскопическая ультрасонография (ЭУС) может быть полезна для диагностики псевдоинвазии и выбора оптимальной тактики лечения пациентов, особенно в случаях формировании кист [17]. Учитывая низкую частоту обнаружения данного феномена при аденомах толстой кишки, применение ЭУС в рутинной практике на сегодняшний день требует дальнейшего изучения. Безусловно, эпителиальный пролапс – это морфологическая находка, и в литературе описаны четкие гистологические критерии категоризации диагноза [15, 16]. Однако не следует забывать о правилах диссекции как полиповидных, так и латерально-распространяющихся опухолей с забором всего материала, что является неотъемлемой частью для постановки объективного патологоанатомического заключения [18]. В описанных случаях материал исследован тотально, что позволило выявить и дифференцировать псевдоинвазию в аденоме от инвазивной карциномы. Эпителиальный пролапс был представлен в виде небольших фокусов погруженных желез в 1–2 фрагментах аденомы и в одном случае в виде кистозных полостей диаметром до 5 мм, заполненных муцинозным содержимым.
Если говорить о патогенезе, наиболее вероятным объяснением данного феномена является то, что возникновению пролапса способствует активная перистальтика в сигмовидной кишке и ее узкий просвет, что вызывает повышенную травматизацию новообразования, с участками кровоизлияний в аденоме. Эти изменения совместно с возникающим воспалительным ответом облегчают погружение желез в подслизистую основу. Также имеются данные, что недавно выполненная биопсия тоже может привести к эпителиальному пролапсу, поэтому обязательно в направительных заключениях указывать даты проведения биопсии и гистологическое заключение [11].
Морфологическая картина была типичной во всех случаях и соответствовала описаниям, встреченным нами в литературе. Выявлялись погруженные железы в собственную пластинку слизистой оболочки и подслизистый слой, которые были окружены фиброзной стромой без признаков десмоплазии. Присутствовали единичные неполные железы, внеклеточные поля слизи, элементы хронического воспаления с примесью сегментоядерных лейкоцитов и макрофагов, богатых гемосидерином. Следует отметить, что при псевдоинвазии диспластические изменения эпителия сопоставимы с вышележащим (несмещенным) эпителием и не могут присутствовать участки тяжелой дисплазии в эпителиальном пролапсе. Именно сочетание псевдоинвазии и интрамукозальной карциномы было крайне диагностически затруднительно. Для точной морфологической верификации производились серийные срезы с подозрительных участков. Однако четкая гистологическая картина и различия в степени дисплазии эпителия позволяли диагностировать феномен эпителиального пролапса.
Новообразования с псевдоинвазией вызывают определенные технические трудности при операции эндоскопической подслизистой диссекции в связи с наличием паратуморозных фибротических изменений. Известно, что фиброз подслизистого слоя ассоциирован с высокими рисками интраоперационной перфорации и неполной резекции при проведении эндоскопической подслизистой диссекции [19, 20]. Во всех случаях удаления новообразований ободочной кишки с псевдоинвазией мы наблюдали тяжелый фиброз подслизистого слоя, что привело к нерадикальной резекции. Понимая высокую вероятность неполной резекции, заключительным этапом операции мы проводили деструкцию очагов фиброза в дне пострезекционного дефекта щипцами для горячей биопсии. Несмотря на то что при гистологическом исследовании вертикальный край резекции проходил по фокусу пролапса, при контрольных эндоскопических исследованиях признаков рецидива не получено. Данные литературы также демонстрируют минимальные риски рецидива при псевдоинвазии в аденомах толстой кишки [3, 11]. Важно отметить, что на этапе эндоскопической диссекции в подслизистом слое фокусы эпителиального пролапса сложно дифференцировать от истинной опухолевой инвазии. Это, в свою очередь, может привести к прекращению операции с необоснованным переходом на традиционное хирургическое вмешательство.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Вербовский Александр Николаевич – зав. отделением эндоскопии, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: verbovsky_a@mail.ru; ORCID: 0000-0002-0831-0973
Alexander N. Verbovsky – Head of the department, Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail:
verbovsky_a@mail.ru; ORCID: 0000-0002-0831-0973
Сетдикова Галия Равилевна – д-р мед. наук, руководитель отделения морфологической диагностики отдела онкологии, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: dr.setdikоva@mail.ru; ORCID: 0000-0002-5262-4953
Galiya R. Setdikova – Dr. Sci. (Med.), Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail: dr.setdikоva@mail.ru; ORCID: 0000-0002-5262-4953
Шикина Валентина Евгеньевна – канд. мед. наук, проф. каф. онкологии и торакальной хирургии ФУВ, зам. директора по онкологии, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского».
E-mail: shik-val@mail.ru; ORCID: 0000-0002-6672-4269
Valentina E. Shikina – Cand. Sci. (Med.), Prof., Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail: shik-val@mail.ru; ORCID: 0000-0002-6672-4269
Семенков Алексей Владимирович – д-р мед. наук, руководитель онкологического отделения хирургических методов лечения, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского», проф. каф. онкологии радиотерапии и реконструктивной хирургии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: semenkov@inbox.ru; ORCID: 0000-0002-7365-6081
Alexey V. Semenkov – Dr. Sci. (Med.), Vladimirsky Moscow Regional Research Clinical Institute (MONIKI), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail:
semenkov@inbox.ru; ORCID: 0000-0002-7365-6081
Поступила в редакцию: 02.10.2024
Поступила после рецензирования: 14.10.2024
Принята к публикации: 24.10.2024
Received: 02.10.2024
Revised: 14.10.2024
Accepted: 24.10.2024
Клинический разбор в общей медицине №12 2024
Псевдоинвазия в аденомах толстой кишки, имитирующая инвазивную карциному: трудности диагностики и литературный обзор
Номера страниц в выпуске:45-50
Аннотация
Актуальность. Эпителиальная псевдоинвазия в колоректальной аденоме морфологически характеризуется выявлением желез
в подслизистой основе.
Цель. Повышение осведомленности о подслизистой псевдоинвазии в клинических целях для предотвращения чрезмерно агрессивного хирургического лечения.
Материалы и методы. Проанализированы операционные материалы 147 пациентов с полиповидными и латерально распространяющимися новообразованиями толстой кишки. Детально описаны случаи псевдоинвазии в аденомах толстой кишки.
Результаты. Псевдоинвазия выявлена в 3,4% (4/147) случаев. В трех неоплазиях на фоне ворсинчатой аденомы выявлены фокусы тяжелой дисплазии в поверхностных отделах. В одном случае на фоне интрамукозальной карциномы выявлен фокус эпителиального пролапса. Псевдоинвазия обнаружена в мышечной пластинке слизистой оболочки и подслизистом слое в виде фокусов аналогичной аденомы, окруженных фиброзной стромой, наличием внеклеточных полей слизи, элементов хронического воспаления с примесью сегментоядерных лейкоцитов, макрофагов, богатых гемосидерином, но без признаков десмоплазии стромы. Единичные железы были неполными и неровными, с цитологическими признаками атипии низкой степени злокачественности. В отличие от инвазивной карциномы, опухолевые почки, лимфоваскулярная и/или периневральная инвазия не выявлялись. Во всех случаях удаления новообразований ободочной кишки с псевдоинвазией наблюдался тяжелый фиброз подслизистого слоя, что приводило к нерадикальной резекции (вертикальный край резекции проходил по фокусу пролапса – R1). Несмотря на нерадикальные резекции, при контрольных эндоскопических исследованиях признаков рецидива не получено. На этапе эндоскопической диссекции фокусы эпителиального пролапса сложно дифференцировать от истинной опухолевой инвазии, что может определять необоснованный переход на традиционное хирургическое вмешательство.
Заключение. Псевдоинвазия в аденомах толстой кишки является редким явлением. Эндоскопическое удаление подобных новообразований является сложной задачей вследствие выраженного фиброза подслизистого слоя и сопряжено с высокой вероятностью неполной резекции. Тем не менее риски рецидива после неполной эндоскопической резекции минимальны.
Ключевые слова: псевдоинвазия, аденома толстой кишки, инвазивная карцинома толстой кишки, неоплазии толстой кишки, эндоскопическая резекция толстой кишки.
Для цитирования: Вербовский А.Н., Сетдикова Г.Р., Шикина В.Е., Семенков А.В. Псевдоинвазия в аденомах толстой кишки, имитирующая инвазивную карциному: трудности диагностики и литературный обзор. Клинический разбор в общей медицине. 2024; 5 (12): 45–50.DOI: 10.47407/kr2024.5.12.00536
Актуальность. Эпителиальная псевдоинвазия в колоректальной аденоме морфологически характеризуется выявлением желез
в подслизистой основе.
Цель. Повышение осведомленности о подслизистой псевдоинвазии в клинических целях для предотвращения чрезмерно агрессивного хирургического лечения.
Материалы и методы. Проанализированы операционные материалы 147 пациентов с полиповидными и латерально распространяющимися новообразованиями толстой кишки. Детально описаны случаи псевдоинвазии в аденомах толстой кишки.
Результаты. Псевдоинвазия выявлена в 3,4% (4/147) случаев. В трех неоплазиях на фоне ворсинчатой аденомы выявлены фокусы тяжелой дисплазии в поверхностных отделах. В одном случае на фоне интрамукозальной карциномы выявлен фокус эпителиального пролапса. Псевдоинвазия обнаружена в мышечной пластинке слизистой оболочки и подслизистом слое в виде фокусов аналогичной аденомы, окруженных фиброзной стромой, наличием внеклеточных полей слизи, элементов хронического воспаления с примесью сегментоядерных лейкоцитов, макрофагов, богатых гемосидерином, но без признаков десмоплазии стромы. Единичные железы были неполными и неровными, с цитологическими признаками атипии низкой степени злокачественности. В отличие от инвазивной карциномы, опухолевые почки, лимфоваскулярная и/или периневральная инвазия не выявлялись. Во всех случаях удаления новообразований ободочной кишки с псевдоинвазией наблюдался тяжелый фиброз подслизистого слоя, что приводило к нерадикальной резекции (вертикальный край резекции проходил по фокусу пролапса – R1). Несмотря на нерадикальные резекции, при контрольных эндоскопических исследованиях признаков рецидива не получено. На этапе эндоскопической диссекции фокусы эпителиального пролапса сложно дифференцировать от истинной опухолевой инвазии, что может определять необоснованный переход на традиционное хирургическое вмешательство.
Заключение. Псевдоинвазия в аденомах толстой кишки является редким явлением. Эндоскопическое удаление подобных новообразований является сложной задачей вследствие выраженного фиброза подслизистого слоя и сопряжено с высокой вероятностью неполной резекции. Тем не менее риски рецидива после неполной эндоскопической резекции минимальны.
Ключевые слова: псевдоинвазия, аденома толстой кишки, инвазивная карцинома толстой кишки, неоплазии толстой кишки, эндоскопическая резекция толстой кишки.
Для цитирования: Вербовский А.Н., Сетдикова Г.Р., Шикина В.Е., Семенков А.В. Псевдоинвазия в аденомах толстой кишки, имитирующая инвазивную карциному: трудности диагностики и литературный обзор. Клинический разбор в общей медицине. 2024; 5 (12): 45–50.DOI: 10.47407/kr2024.5.12.00536
Pseudoinvasion in colon adenomas mimicking invasive carcinoma: diagnostic challenges and literature review
Alexander N. Verbovsky1, Galiya R. Setdikova1, Valentina E. Shikina1, Alexey V. Semenkov1,21 Vladimirsky Moscow Regional Research Clinical Institute (MONIKI), Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
semenkov@inbox.ru
Abstract
Relevance. Epithelial pseudoinvasion of colorectal adenoma is morphologically characterized by the detection of glands in the submucosa.
The aim of the study was to increase awareness of submucosal pseudoinvasion for clinical purposes to prevent overly aggressive surgical treatment.
Materials and methods. The surgical materials of 147 patients with polypoid and laterally spreading neoplasms of the colon were analyzed. Cases of pseudoinvasion in colon adenomas were described in detail.
Results. Pseudoinvasion was detected in 3.4% (4/147) of cases. In 3 neoplasms, foci of severe dysplasia in the superficial sections were detected against the background of villous adenoma. In one case, a focus of epithelial prolapse was detected against the background of intramucosal carcinoma. Pseudoinvasion was detected in the muscularis mucosa and submucosal layer in the form of foci of a similar adenoma surrounded by fibrous stroma, the presence of extracellular mucus fields, elements of chronic inflammation with an admixture of segmented leukocytes, hemosiderin-rich macrophages, but without signs of stromal desmoplasia. Single glands were incomplete and uneven, with cytological signs of low-grade atypia. Unlike invasive carcinoma, tumor kidneys, lymphovascular and/or perineural invasion were not detected. In all cases of resection of colon neoplasms with pseudoinvasion, severe fibrosis of the submucosal layer was observed, which led to non-radical resection (the vertical resection margin passed along the prolapse focus – R1). Despite non-radical resections, no signs of relapse were obtained during control endoscopic examinations. At the stage of endoscopic dissection, foci of epithelial prolapse are difficult to differentiate from true tumor invasion, which may determine an unjustified transition to traditional surgical intervention.
Conclusion. Pseudoinvasion in colon adenomas is a rare phenomenon. Endoscopic removal of such neoplasms is a difficult task due to severe fibrosis of the submucosal layer and is associated with a high probability of incomplete resection. However, the risks of recurrence after incomplete endoscopic resection are minimal.
Keywords: pseudoinvasion, colon adenoma, invasive colon carcinoma, colon neoplasia, endoscopic colon resection.
For citation: Verbovsky A.N., Setdikova G.R., Shikina V.E., Semenkov A.V. Pseudoinvasion in colon adenomas mimicking invasive carcinoma: diagnostic challenges and literature review. Clinical review for general practice. 2024; 5 (12): 45–50 (In Russ.). DOI: 10.47407/kr2024.5.12.00536
Введение
Неоплазии толстой кишки являются актуальной проблемой с высокой частотой заболеваемости и смертности в структуре онкологических заболеваний [1]. Широкое распространение скрининга позволило повысить выявляемость колоректального рака на ранних стадиях [2]. Согласно данным литературы, почти 10% всех злокачественных поражений толстой кишки развиваются на фоне аденом [3, 4]. При этом для латерально распространяющихся опухолей, согласно данным литературы, характерно более частое наличие участков озлокачествления по сравнению с полиповидными новообразованиями [5].С активным внедрением методов эндоскопической резекции новообразований многие неопластические поражения, включая ранний рак толстой кишки, стали эндоскопически операбельными, несмотря на размер [6–8]. Крупные поверхностные эпителиальные новообразования толстой кишки эндоскопически могут быть удалены двумя способами: эндоскопическая резекция фрагментами и эндоскопическая подслизистая диссекция. Лишь метод эндоскопической подслизистой диссекции обеспечивает высокую частоту резекции единым блоком в пределах здоровых тканей вне зависимости от размера новообразования. Резекция новообразований единым блоком имеет два основных преимущества: более точная гистологическая оценка краев резекции и снижение риска рецидива, в сравнении с эндоскопической резекцией фрагментами [9]. Кроме того, при морфологической оценке аденом необходимо выявить участки с тяжелой дисплазией, а также структуры инвазивной карциномы. Однако некоторые аденомы, особенно размером более 3,0 см, расположенные в сигмовидной кишке, могут вызвать трудности при гистологическом исследовании в виду сложности дифференциальной диагностики между истинным инвазивным ростом и неправильно расположенным аденоматозным эпителием в подслизистой основе – псевдоинвазией [10, 11].
В литературе псевдоинвазия встречается под такими синонимами, как эпителиальное смещение или эпителиальный пролапс [12]. Данный феномен обычно является результатом повторного травматического повреждения толстой кишки [13]. Именно для аденом, локализующихся в сигмовидной кишке, характерна псевдоинвазия из-за ее узкого просвета и склонности к дивертикулярной болезни. Однако, по литературным данным, псевдоинвазия описана в различных отделах толстой кишки, особенно при достаточно крупных новообразованиях [14]. Морфологически эпителиальный пролапс (псевдоинвазия) характеризуется наличием железистых структур с цитологической атипией, аналогичной таковой из вышележащего (несмещенного) эпителия, окруженных собственной пластинкой слизистой оболочки с многочисленными макрофагами, нагруженные гемосидерином, без десмопластической реакции стромы [12, 13].
Безусловно псевдоинвазия диагностируется морфологически, после проведенного эндоскопического удаления, хотя описаны случаи диагностики с помощью эндосонографии. Однако при кистозно-расширенных криптах, заполненных муцинозным содержимым, имитирующих кисты и инвазивную коллоидную карциному, данный метод диагностически не эффективен [15].
Следует отметить, что в реальной практике часто встречаются случаи, когда трудно отличить псевдоинвазию от истинного инфильтративного роста, особенно при коллоидной карциноме или при минимально инвазивных формах рака. Важно поставить точный диагноз наличия и глубины инвазии в подслизистую основу в образцах после эндоскопически удаленных колоректальных новообразований, чтобы избежать последующего агрессивного хирургического лечения. Учитывая низкую осведомленность как эндоскопических хирургов и онкологов, так и морфологов, а также невысокую частоту обнаружения эпителиального пролапса в аденомах толстой кишки, в настоящем исследовании детально рассмотрены эндоскопические и морфологические изменения, наблюдаемые при данном феномене.
Цель исследования – повышение осведомленности о подслизистой псевдоинвазии в клинических целях для предотвращения чрезмерно агрессивного хирургического лечения.
Материал и методы
Работа основана на операционном материале 147 пациентов с полиповидными и латерально распространяющимися новообразованиями толстой кишки, находившихся на лечении в ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» в период с 01.08.2021 по 01.08.2023 г. Среди больных преобладали женщины в соотношении Ж:М=1,3:1. Возраст пациентов варьировал от 28 до 84 лет. Средний возраст мужчин – 66,1±0,8 года, средний возраст женщин – 65,1±0,7 года.При визуализации колоректальных новообразований для описания сосудистого рисунка и микроструктуры поверхности эпителия в узком световом спектре (NBI) использовали универсальную эндоскопическую японскую классификацию JNET. После проведенной эндоскопической подслизистой диссекции материал фиксировался на пенопластовом полотне иглами без натяжения тканей (рис. 1).

Это важно, поскольку после проведения эндоскопической подслизистой диссекции и погружения образца в формалин происходит его деформация, он сжимается и уменьшается в объеме, что может негативно влиять на оценку краев резекции, заведомо повышая процент ложноположительного края.
При макроскопическом исследовании указывался размер всего иссеченного образца, затем размер образования с обязательным измерением расстояния до краев резекции. После этого при латерально-распространяющихся опухолях производили параллельные разрезы от одного края резекции до другого с шагом – 2–3 мм. При полиповидных образованиях также проводили параллельные разрезы, с обязательной маркировкой центральной части полипа и периферической в зависимости от размера полипа (рис. 2).
Следует отметить, что в преобладающем большинстве случаев на разрезе новообразования были однородные, мягко-эластичной консистенции, белесовато-сероватого цвета. И лишь в одном случае при диссекции полиповидного образования обнаружены мелкие кисты, наполненные муцинозным содержимым (рис. 3). При укладке образцов в кассеты забирали все фрагменты. Материал фиксировали в 10% забуференном растворе формалина, затем заливали в парафин по обычной методике. Серийные парафиновые срезы толщиной 3 мкм депарафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином.
Силу и значимость связи между анализируемыми признаками оценивали с помощью корреляционно-регрессионного анализа. Для количественных признаков вычисляли корреляционный коэффициент Пирсона. За уровень статистической значимости принимали р<0,05. Достоверность различий между кривыми выживаемости подтверждали с помощью лог-рангового теста, с использованием пакета программ Statistica для Microsoft Windows (версия 13.0).

Результаты
Размер новообразований варьировал в диапазоне от 5 до 130 мм, средний размер – 37,4 мм, и в преобладающем большинстве случаев – 69,4% (102/147) образования превышали 20 мм. При эндоскопическом осмотре гранулярный тип латерально-стелящейся опухоли (LST) обнаружен у 86/147 (58,5%) пациентов. Из которых гомогенный гранулярный тип LST встречался у 55/147 (37,4%) пациентов, смешанный гранулярный тип LST – 31/147 (21,1%) пациентов. Негранулярный тип LST был обнаружен у 19/147 (13%) пациентов, из которых плоско-приподнятый тип – 7/147 (4,8%), а псевдоуглубленный – 12/147 (8,2%) пациентов. Полиповидные новообразования на широком основании, тип 0-Is, отмечены в 38/147 (25,9%) случаях, тип 0-Ip – 4/147 (2,7%) случаях. Эндоскопический осмотр поверхности новообразований в узкоспектральном режиме с увеличением показал наличие регулярного ямочного рисунка (тип 2а по JNET) в 82/147 (55,8%) случаях. Нерегулярный ямочный и микрососудистый рисунки обнаружены в 65/147 (44,2%) случаях.По локализации в отделах толстой кишки образования локализовались следующим образом – лидирующие сайты прямая и восходящий отдел толстой кишки, 38/147 (25,8%) и 30/147 (20,4%) соответственно. Далее в убывающем порядке слепая и сигмовидная кишка, 21/147 (14,3%) и 20/147 (13,6%) соответственно. Остальные локализации не превышали 8%, а опухоли с пограничными локализациями – единичные наблюдения.
При анализе морфологической картины ворсинчатые аденомы 58/147 (39,5%) являются лидирующим гистологическим типом образований, далее следуют тубулярные 5/147 (3,4%) и смешанные формы 49/147 (33,3%). Структуры тяжелой дисплазии и фокусы инвазивной карциномы обнаруживались при всех гистологических типах, без статистически значимой корреляции (р=0,071). При анализе локализации опухоли в толстой кишке и морфологического строения канцеризация в большинстве случаев характерна для прямой кишки (R=0,28; p=0,021).
При анализе корреляционной зависимости между гистологическим строением и размером образований корреляция не выявлена, поскольку ранний колоректальный рак и/или структуры аденомы high-grade выявляются при любом размере неопластического процесса. Следует отметить, что во всех образованиях более 8,0 см выявлена тяжелая степень дисплазии и/или минимально-инвазивный колоректальный рак.
По нашим данным резекция единым блоком выполнена в 97% (145/147) случаев. В большинстве случаев достигнута полная радикальность при выполнении эндоскопического лечения – в 94,5% (139/147); R1 – 4,1% (6/147) и позитивный горизонтальный край или фрагментация образования в 4,4% (6/136) случаев.
Псевдоинвазия выявлена в 3,4% (4/147) случаев с локализацией всех аденом в сигмовидной кишке, однако именно эти образования вызвали трудности при морфологическом исследовании. В трех неоплазиях на фоне ворсинчатой аденомы выявлены фокусы тяжелой дисплазии в поверхностных отделах. В одном случае на фоне интрамукозальной карциномы выявлен фокус эпителиального пролапса. Псевдоинвазия обнаружена в мышечной пластинке слизистой оболочки и подслизистом слое в виде фокусов аналогичной аденомы, окруженных фиброзной стромой, наличием внеклеточных полей слизи, элементы хронического воспаления с примесью сегментоядерных лейкоцитов, макрофагов, богатых гемосидерином, но без признаков десмоплазии стромы (рис. 4). Единичные железы были неполными и неровными, с цитологическими признаками атипии низкой степени злокачественности. Опухолевые почки, лимфоваскулярная и/или периневральная инвазия не обнаружены, в отличие от инвазивной карциномы. Во всех четырех случаях вертикальный край резекции проходил по фокусу пролапса (R1). При контрольных эндоскопических осмотрах через 3, 6 и 12 мес данных, подтверждающих местный рецидив, не было получено. Во всех случаях область резекции новообразований была представлена рубцовыми изменениями.
Обсуждение
Впервые термин псевдоинвазия или псевдокарциноматозная инвазия описан и применен в 1973 г. [16]. Были проанализированы свыше 2300 аденом толстой кишки и выделена группа аденом, в которых обнаружены погруженные в подслизистую основу железы, без убедительных признаков инфильтративного злокачественного потенциала. Как правило, полипы с псевдоинвазией локализуются в сигмовидной кишке, однако могут быть обнаружены и в других областях толстой кишки вне зависимости от размера полипа. В нашем исследовании все образования локализовались в сигмовидной кишке, их размер варьировал от 1,0 до 3,0 см с полиповидным и латерально-распространяющимся характером роста.С развитием эндоскопических технологий в диагностике новообразований толстой кишки, эндоскопическая ультрасонография (ЭУС) может быть полезна для диагностики псевдоинвазии и выбора оптимальной тактики лечения пациентов, особенно в случаях формировании кист [17]. Учитывая низкую частоту обнаружения данного феномена при аденомах толстой кишки, применение ЭУС в рутинной практике на сегодняшний день требует дальнейшего изучения. Безусловно, эпителиальный пролапс – это морфологическая находка, и в литературе описаны четкие гистологические критерии категоризации диагноза [15, 16]. Однако не следует забывать о правилах диссекции как полиповидных, так и латерально-распространяющихся опухолей с забором всего материала, что является неотъемлемой частью для постановки объективного патологоанатомического заключения [18]. В описанных случаях материал исследован тотально, что позволило выявить и дифференцировать псевдоинвазию в аденоме от инвазивной карциномы. Эпителиальный пролапс был представлен в виде небольших фокусов погруженных желез в 1–2 фрагментах аденомы и в одном случае в виде кистозных полостей диаметром до 5 мм, заполненных муцинозным содержимым.
Если говорить о патогенезе, наиболее вероятным объяснением данного феномена является то, что возникновению пролапса способствует активная перистальтика в сигмовидной кишке и ее узкий просвет, что вызывает повышенную травматизацию новообразования, с участками кровоизлияний в аденоме. Эти изменения совместно с возникающим воспалительным ответом облегчают погружение желез в подслизистую основу. Также имеются данные, что недавно выполненная биопсия тоже может привести к эпителиальному пролапсу, поэтому обязательно в направительных заключениях указывать даты проведения биопсии и гистологическое заключение [11].
Морфологическая картина была типичной во всех случаях и соответствовала описаниям, встреченным нами в литературе. Выявлялись погруженные железы в собственную пластинку слизистой оболочки и подслизистый слой, которые были окружены фиброзной стромой без признаков десмоплазии. Присутствовали единичные неполные железы, внеклеточные поля слизи, элементы хронического воспаления с примесью сегментоядерных лейкоцитов и макрофагов, богатых гемосидерином. Следует отметить, что при псевдоинвазии диспластические изменения эпителия сопоставимы с вышележащим (несмещенным) эпителием и не могут присутствовать участки тяжелой дисплазии в эпителиальном пролапсе. Именно сочетание псевдоинвазии и интрамукозальной карциномы было крайне диагностически затруднительно. Для точной морфологической верификации производились серийные срезы с подозрительных участков. Однако четкая гистологическая картина и различия в степени дисплазии эпителия позволяли диагностировать феномен эпителиального пролапса.
Новообразования с псевдоинвазией вызывают определенные технические трудности при операции эндоскопической подслизистой диссекции в связи с наличием паратуморозных фибротических изменений. Известно, что фиброз подслизистого слоя ассоциирован с высокими рисками интраоперационной перфорации и неполной резекции при проведении эндоскопической подслизистой диссекции [19, 20]. Во всех случаях удаления новообразований ободочной кишки с псевдоинвазией мы наблюдали тяжелый фиброз подслизистого слоя, что привело к нерадикальной резекции. Понимая высокую вероятность неполной резекции, заключительным этапом операции мы проводили деструкцию очагов фиброза в дне пострезекционного дефекта щипцами для горячей биопсии. Несмотря на то что при гистологическом исследовании вертикальный край резекции проходил по фокусу пролапса, при контрольных эндоскопических исследованиях признаков рецидива не получено. Данные литературы также демонстрируют минимальные риски рецидива при псевдоинвазии в аденомах толстой кишки [3, 11]. Важно отметить, что на этапе эндоскопической диссекции в подслизистом слое фокусы эпителиального пролапса сложно дифференцировать от истинной опухолевой инвазии. Это, в свою очередь, может привести к прекращению операции с необоснованным переходом на традиционное хирургическое вмешательство.
Заключение
Псевдоинвазия в аденомах толстой кишки является редким явлением, ассоциированным с травматизацией новообразования вследствие активной перистальтики толстой кишки, дивертикулитом или проведением биопсии. Эндоскопическое удаление подобных новообразований зачастую является сложной задачей по причине выраженного фиброза подслизистого слоя и сопряжено с высокой вероятностью неполной резекции, тем не менее риски рецидива после неполной эндоскопической резекции минимальны.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Вербовский Александр Николаевич – зав. отделением эндоскопии, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: verbovsky_a@mail.ru; ORCID: 0000-0002-0831-0973
Alexander N. Verbovsky – Head of the department, Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail:
verbovsky_a@mail.ru; ORCID: 0000-0002-0831-0973
Сетдикова Галия Равилевна – д-р мед. наук, руководитель отделения морфологической диагностики отдела онкологии, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: dr.setdikоva@mail.ru; ORCID: 0000-0002-5262-4953
Galiya R. Setdikova – Dr. Sci. (Med.), Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail: dr.setdikоva@mail.ru; ORCID: 0000-0002-5262-4953
Шикина Валентина Евгеньевна – канд. мед. наук, проф. каф. онкологии и торакальной хирургии ФУВ, зам. директора по онкологии, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского».
E-mail: shik-val@mail.ru; ORCID: 0000-0002-6672-4269
Valentina E. Shikina – Cand. Sci. (Med.), Prof., Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail: shik-val@mail.ru; ORCID: 0000-0002-6672-4269
Семенков Алексей Владимирович – д-р мед. наук, руководитель онкологического отделения хирургических методов лечения, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского», проф. каф. онкологии радиотерапии и реконструктивной хирургии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: semenkov@inbox.ru; ORCID: 0000-0002-7365-6081
Alexey V. Semenkov – Dr. Sci. (Med.), Vladimirsky Moscow Regional Research Clinical Institute (MONIKI), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail:
semenkov@inbox.ru; ORCID: 0000-0002-7365-6081
Поступила в редакцию: 02.10.2024
Поступила после рецензирования: 14.10.2024
Принята к публикации: 24.10.2024
Received: 02.10.2024
Revised: 14.10.2024
Accepted: 24.10.2024
Список исп. литературыСкрыть список1. Состояние онкологической помощи населению России в 2021 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2022.
The state of oncological care for the population of Russia in 2021. Edited by A.D. Kaprin, V.V. Starinsky, A.O. Shakhzadova. Moscow, 2022 (in Russian).
2. Vogel JD, Felder SI, Bhama AR et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Management of Colon Cancer. Diseases of the Colon and Rectum 2022;65(2):148-77.
3. Johnson GGRJ, Helewa R, Moffatt DC et al. Colorectal polyp classification and management of complex polyps for surgeon endoscopists. Canadian Journal of Surgery 2023;66(5):E491-E498.
4. Logan RFA, Patnick J, Nickerson C et al. Outcomes of the Bowel Cancer Screening Programme (BCSP) in England after the first 1 million tests. Gut 2012;61(10):1439-46.
5. Facciorusso A, Antonino M, Di Maso M et al. Non-polypoid colorectal neoplasms: Classification, therapy and follow-up. World Journal of Gastroenterology 2015;21(17):5149-57.
6. Baidoun F, Elshiwy K, Elkeraie Y et al. Colorectal Cancer Epidemiology: Recent Trends and Impact on Outcomes. Current Drug Targets 2021;22(9):998-1009.
7. Dos Santos CEO, Pereira-Lima JC, Onófrio F de Q. Large Colorectal Lesions: Evaluation and Management. GE Portuguese journal of gastroenterology 2016;23(4):197-207.
8. Zhu M, Xu Y, Yu L et al. Endoscopic submucosal dissection for colorectal laterally spreading tumors: Clinical outcomes and predictors of technical difficulty. Journal of Digestive Diseases 2022;23(4):228-36.
9. Saito Y, Fujii T, Kondo H et al. Endoscopic treatment for laterally spreading tumors in the colon. Endoscopy 2001;33(8):682-6.
10. Aust DE, Rüschoff J. Polyps of the colorectum: non-neoplastic and non-hamartomatous. Der Pathologe 2011;32(4): 297-302.
11. Shepherd NA, Griggs RKL. Bowel cancer screening-generated diagnostic conundrum of the century: pseudoinvasion in sigmoid colonic polyps. Modern Pathology 2015;28:S88-S94.
12. Griggs RKL, Novelli MR, Sanders DSA et al. Challenging diagnostic issues in adenomatous polyps with epithelial misplacement in bowel cancer screening: 5 years’ experience of the Bowel Cancer Screening Programme Expert Board. Histopathology 2017;70(3):466-72.
13. Loughrey MB, Shepherd NA. The pathology of bowel cancer screening. Histopathology 2015;66(1):66-77. DOI: 10.1111/his.12530. PMID: 25123305
14. Panarelli NC, Somarathna T, Samowitz WS et al. Diagnostic Challenges Caused by Endoscopic Biopsy of Colonic Polyps: A Systematic Evaluation of Epithelial Misplacement With Review of Problematic Polyps From the Bowel Cancer Screening Program, United Kingdom. The American Journal of Surgical Pathology 2016;40(8):1075-83.
15. Pascal RR, Hertzler G, Hunter S, Goldschmid S. Pseudoinvasion with high-grade dysplasia in a colonic adenoma. Distinction from adenocarcinoma The American Journal of Surgical Pathology 1990;14(7):
694-7.
16. Muto T, Bussey HJ, Morson BC. Pseudo-carcinomatous invasion in adenomatous polyps of the colon and rectum. J Clin Pathol 1973;26(1):25-31. DOI: 10.1136/jcp.26.1.25
17. Davila RE, Rajan E, Adler D et al. ASGE ASGE guideline: the role of endoscopy in the diagnosis, staging, and management of colorectal cancer. Gastrointestinal Endoscopy 2005;61(1):1-7.
18. Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015;47(9):829-54.
19. Sato K, Ito S, Kitagawa T et al. Factors affecting the technical difficulty and clinical outcome of endoscopic submucosal dissection for colorectal tumors. Surgical Endoscopy 2014;28(10):2959-65.
20. Mizushima T, Kato M, Iwanaga I et al. Technical difficulty according to location, and risk factors for perforation, in endoscopic submucosal dissection of colorectal tumors. Surgical Endoscopy 2015;29(1):
133-9.

