Клинический разбор в общей медицине №1 2025
Valeria S. Karpelevich3, Alsu R. Kuzhina2, Alleiss I. Magomedova4, Ildar R. Valeev2,
Gulnaz S. Gimranova2, Leysan M. Sayarova2, Nadezhda A. Klavdieva5, Aminat A. Ataeva1,
Natali Yu. Salimova2, Diana R. Menyasheva2, Bakhrom M. Berdiev2
1 Rostov State Medical University, Rostov-on-Don, Russia;
2 Bashkir State Medical University, Ufa, Russia;
3 Russian University of Medicine, Moscow, Russia;
4 Kuban State Medical University, Krasnodar, Russia;
5 Puchkov Ambulance and Emergency Medical Care Station in Moscow, Moscow, Russia
bestielal@rambler.ru
Abstract
Introduction. Cardiovascular diseases (CVD) continue to be the leading cause of death worldwide. The development of new therapeutic approaches that can more accurately affect the molecular mechanisms of CVD is extremely important. Recent breakthroughs in the field of genetic engineering, such as CRISPR-Cas9 (Clustered Regularly Interspaced Palindromic Repeats/CRISPR associated protein 9) technology and related gene-modulating enzymes, open unprecedented opportunities for the creation of new therapies. These technologies make it possible not only to edit the genome, but also to directly eliminate the root causes of CVD.
Aim. To analyze the literature on the use of CRISPR-Cas9 in CVD therapy.
Materials and methods. The authors conducted a search for publications in the electronic databases PubMed and Elibrary. The evaluation of the articles was carried out in accordance with the recommendations of PRISMA. After the selection procedure, 72 articles were included in the review.
Results. The article discusses various aspects of the use of CRISPR for the correction of genetic mutations that contribute to the development of cardiopathies, as well as the prospects of this technology in the context of gene therapy. The article focuses on the possibilities that CRISPR therapy opens up to improve the effectiveness of CVD treatment, and also emphasizes the need for further research to address issues of safety, delivery and long-term effectiveness. The results of the analysis give hope for the creation of innovative approaches to the fight against cardiac ailments, which can significantly improve the quality of life of patients and reduce the incidence rate.
Conclusion. To date, the rapidly developing CRISPR toolkit has been successfully implemented into clinical practice due to the many encouraging successes achieved in basic research laboratories and in preclinical trials. These achievements give hope that the complex and long-term problems of CVD can be solved with the help of innovative approaches based on genome editing, which creates a new era in medicine.
Keywords: CRISPR-Cas9, cardiovascular diseases, cardiology, genetic editing, genetic modification, gene therapy.
For citation: Gretseva T.A., Enikeyev D.A., Shaidullina E.A., Djanbekova L.M., Karpelevich V.S., Kuzhina A.R., Magomedova A.I., Valeev I.R., Gimranova G.S., Sayarova L.M., Klavdieva N.A., Ataeva A.A., Salimova N.Yu., Menyasheva D.R., Berdiev B.M. Genetic modifications in cardiology: the role of CRISPR-Cas9 in the treatment of cardiovascular diseases. Clinical review for general practice. 2025; 6 (1): 29–40 (In Russ.). DOI: 10.47407/kr2024.6.1.00547
Разработка новых терапевтических подходов, позволяющих более точно воздействовать на молекулярные механизмы ССЗ, крайне важна. Недавние прорывы в области генной инженерии, такие как технология CRISPR-Cas9 (Clustered Regularly Interspaced Palindromic Repeats / CRISPR associated protein 9) и связанные с ней генномодулирующие ферменты, открывают беспрецедентные возможности для создания новых методов лечения [5]. Эти технологии позволяют не только редактировать геном, но и непосредственно устранять первопричины ССЗ.
Например, CRISPR может быть использован для коррекции мутаций, ответственных за наследственные формы заболеваний, таких как семейная гиперхолестеринемия или некоторые виды кардиомиопатий. Путем целенаправленного редактирования генетических мутаций можно значительно улучшить прогноз для пациентов и существенно снизить риск сердечно-сосудистых катастроф [6].
Кроме того, использование CRISPR может расширить горизонты для создания новых терапевтических подходов, которые не только направлены на лечение существующих патологий, но и на профилактику. Генетическая модификация, направленная на повышение устойчивости к факторам риска, может снизить заболеваемость и смертность от ССЗ на глобальном уровне [7].
Тем не менее необходимо учитывать и этические аспекты, связанные с редактированием генов, особенно в контексте лечения CCЗ. Необходимы строгие регуляции и тщательное обоснование целесообразности применения методов генной инженерии в клинической практике, чтобы избежать потенциальных негативных последствий и обеспечить безопасность пациентов [8].
Таким образом, внедрение прорывных технологий, таких как CRISPR-Cas9, в кардиологическую практику может привести к созданию более эффективных и целенаправленных подходов к лечению ССЗ, что, в свою очередь, может значительно снизить уровень смертности и улучшить качество жизни миллионов людей по всему миру.
Цель обзора – провести анализ литературы, посвященной применению CRISPR-Cas9 в терапии ССЗ.
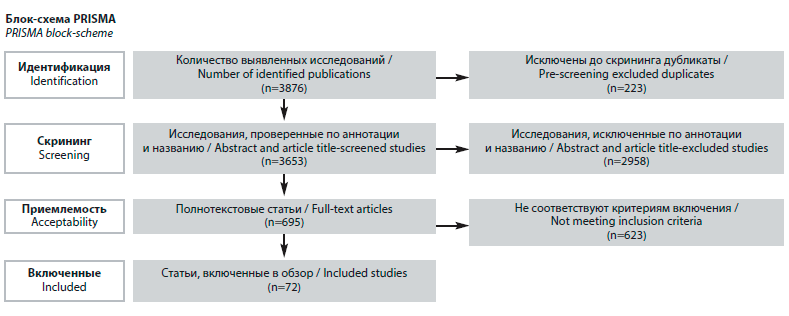
В результате поиска были извлечены 2153 публикации. Поисковые запросы включали следующие ключевые слова и их сочетания: CRISPR-Cas9; сердечно-сосудистые заболевания; кардиология; генетическое редактирование; генетическая модификация; генная терапия; cardiovascular diseases; cardiology; genetic editing; genetic modification; gene therapy. Временной интервал поиска: с момента основания соответствующей базы данных по октябрь 2024 г. Независимо друг от друга все авторы проводили скрининг названий и аннотаций выявленных статей, при обнаружении релевантных исследований извлекался полный текст соответствующей статьи. Дубликаты и неполнотекстовые версии статей были исключены.
Полнотекстовые версии статей оценивались на предмет соответствия следующим критериям включения:
• работа опубликована на английском или русском языках;
• работа опубликована в рецензируемом научном издании;
• работа представляет собой обзор литературы, экспериментальное или клиническое исследование и описывает применение технологий CRISPR-Cas9 в контексте кардиологии.
После процедуры отбора в обзор были включены 72 статьи.
Редактирование нуклеазой CRISPR-Cas9. При традиционном редактировании генома с использованием технологии CRISPR-Cas9 применяется рибонуклеопротеиновый комплекс (RNP), состоящий из программируемой молекулы РНК и эндонуклеазы Cas9, выделенной из Streptococcus pyogenes (SpCas9), далее именуемой просто Cas9. Важно отметить, что природные аналоги Cas9, обнаруженные у других видов бактерий, также могут быть использованы для редактирования генома на основе CRISPR и обладают рядом уникальных характеристик, таких как вариабельность размеров, эндонуклеазная активность и программируемость. Эти особенности были успешно внедрены в стратегии редактирования генома, направленные на сердечно-сосудистую систему [9–11]. Тем не менее на сегодняшний день Cas9 из Streptococcus pyogenes остается наиболее широко используемой эндонуклеазой для технологий редактирования генома. Подробные описания разнообразия и сложности других РНК-управляемых эндонуклеаз, встречающихся в природе, представлены в работе A. Cebrian-Serrano и соавт. [12].
Для внесения изменений в геном комплекс Cas9 RNP направляется в определенную область генома человека с помощью направляющей РНК (sgRNA), специально разработанной для распознавания конкретной последовательности с использованием спаривания оснований по принципу Уотсона–Крика [13]. После связывания sgRNA с целевой последовательностью наличие протоспейсерной области (PAM) инициирует действие Cas9, который генерирует разрыв двухцепочечной ДНК (DSB, double-strand break) на три нуклеотида выше PAM, используя свои каталитические домены RuvC и HNH [14]. Впоследствии активируются пути репарации DSB, которые включают негомологичное соединение концов (NHEJ, non-homologous end joining) и гомологичную рекомбинацию (HR, homologous recombination). Каждый из этих механизмов приводит к различным результатам в зависимости от условий и характеристик окружения.
Чаще всего DSB, опосредованные Cas9, восстанавливаются с использованием предрасположенного к ошибкам механизма NHEJ, что приводит к вставкам и/или удалениям (indels) в месте DSB [15]. Эти изменения могут активировать пути нонсенс-опосредованного распада мРНК (NMD, nonsense-mediated mRNA decay), которые снижают уровни целевой мРНК и белка или изменяют аминокислотный состав самой мРНК, что приводит к образованию дисфункциональных или гипофункциональных белков [16, 17].
В лабораторных условиях индуцированные с помощью Cas9 indels могут служить мощным инструментом для исследования функций генов-мишеней. Однако в качестве терапевтической стратегии они имеют значительные ограничения, связанные с неточностью редактирования и потенциальной генотоксичностью. Нецелевое редактирование генома может привести к неожиданным изменениям, таким как крупные делеции, вставки, хромосомные перестройки или даже потеря целых хромосом, что, в частности, повышает риск развития рака [18].
Кроме того, традиционное редактирование генома с помощью CRISPR-Cas9 может нарушать функции патологических генов и аллелей, а также усиливать полезные функции генов. Это особенно критично в контексте ССЗ, обусловленных механизмами гаплонедостаточности, когда уровень нормального белка, вырабатываемого из немутировавшего аллеля, недостаточен для поддержания нормальной функции клеток и тканей. Например, в настоящее время считается, что как гипертрофическая кардиомиопатия (ГКМП), вызванная гетерозиготными мутациями гена MYBPC3 (myosin-binding protein C), так и дилатационная кардиомиопатия (ДКМП), вызванная гетерозиготными мутациями гена TTN, развиваются через механизмы гаплонедостаточности, что затрудняет их лечение традиционными подходами CRISPR-Cas9 [19, 20].
Тем не менее, несмотря на ограниченную область применения, существуют клинические возможности для традиционной терапии с использованием CRISPR-Cas9, нацеленной на борьбу с ССЗ. В недавнем клиническом исследовании CRISPR-Cas9 использовался для разрушения транстиретина (кодируемого геном TTR – transthyretin) у пациентов с транстиретиновым амилоидозом сердца. Это заболевание вызвано наследственными мутациями в более чем 100 вариантах TTR, что ведет к неправильному сворачиванию и агрегации белков в интерстициальной ткани сердца, и может постепенно приводить к дисфункции сердца и возможной смерти пациентов [21–23]. Исследование показало, что использование CRISPR-Cas9 для генерации показателей потери функции в TTR позволяет снизить уровень циркулирующего транстиретина на 87% по сравнению с уровнем до начала терапии, и это было связано с улучшением симптомов у пациентов [21].
Кроме того, помимо создания изменений, приводящих к потере функции, Cas9 можно использовать и для восстановления поврежденных рамок считывания, нарушенных патогенными indels. Например, мутации, вызывающие сдвиг рамки в гене титина (TTN, Titin), являются одной из основных причин ДКМП, для лечения которой на данный момент не существует эффективных методов, направленных на устранение основного генетического повреждения. В одном из недавних in vitro исследований использовали Cas9 и аллель-специфичную sgRNA для внедрения коррекции в рамку считывания TTN [24]. Эта модификация не только восстанавливает обратную гаплонедостаточность, но и снижает уровень пептида титина, что также может способствовать прогрессированию ДКМП [24].
В дополнение к механизму NHEJ, DSB также могут быть восстановлены с помощью HR, которая в первую очередь активна в пролиферирующих клетках. При введении ДНК-матрицы, содержащей гомологичные участки ДНК, расположенные по обе стороны от сайта DSB и вдоль боковых РНК Cas9, может происходить точная репарация ДНК. Теоретически процессы HR могут быть использованы для коррекции многих одиночных нуклеотидных мутаций и небольших отклонений in vivo. Однако низкие показатели эффективности и конкуренция со стороны доминирующего механизма NHEJ могут препятствовать применению этой терапевтической стратегии для лечения ССЗ. Это, вероятно, связано с тем, что кардиомиоциты взрослых обладают очень ограниченной способностью к делению и, как предполагается, преимущественно используют нерегулярный механизм репарации, что может повышать риск генотоксичности или цитотоксичности [25].
На сегодняшний день разработано множество вариаций оригинальной эндонуклеазы Cas9, каждая из которых обладает уникальными свойствами, расширяющими возможности редактирования генома. Например, благодаря достижениям белковой инженерии был разработан вариант Cas9 с нарушенной эндонуклеазной активностью, известный как нуклеазно-деактивированный Cas9 (dCas9). Этот вариант связывает ДНК, но не разрезает ее. Кроме того, был разработан никелированный Cas9 (nCas9), который генерирует одноцепочечные разрывы или зазубрины [26, 27]. Эти модифицированные формы Cas9 увеличивают возможности и безопасность редактирования генома и часто используются в различных новых инструментах редактирования генома [28–30].
Более того, другие модификации Cas9 улучшили распознавание последовательностей PAM, расширив целевые возможности для CRISPR-Cas9-терапии и позволив редактировать участки, где отсутствуют обычные последовательности NGG PAM [32, 32]. Важно отметить, что эта гибкость PAM также была применена к dCas9 благодаря новым конструкциям, которые способны распознавать различные последовательности PAM и демонстрируют высокую эффективность в клетках млекопитающих [33].
Таким образом, разнообразная коллекция вариантов Cas9 создала набор передовых технологий на основе CRISPR, которые выводят CRISPR-терапию за пределы стандартного редактирования с помощью CRISPR-Cas9 и открывают новые возможности для лечения множества заболеваний.
Существует два основных класса РО: редакторы цитозиновых оснований (CBE, cytosine base editor) и редакторы адениновых оснований (ABE, adenine base editor). CBE модифицируют цитозины (C) в урацилы (U), тогда как ABE модифицируют аденины (A) в инозины (I) [29, 34]. После спаривания или репликации ДНК промежуточные базы U и I преобразуются в тимин (T) и гуанин (G) соответственно, что завершает переход от C/G к T/A для CBE и от A/T к G/C для ABE.
Кроме того, CBE II поколения дополнительно используют домен ингибитора урацилгликозилазы (UGI), который тандемно соединен с nCas9, чтобы предотвратить нежелательное восстановление правок C к T. Показано, что эта модификация увеличивает среднюю эффективность редактирования в три раза [29].
РО предлагает уникальные возможности для редактирования генома, отличающиеся от традиционных RNP Cas9. Это создает перспективы для применения различных стратегий редактирования. Например,
ABE-max – это новейшая версия ABE, который обладает узким окном редактирования, охватывающим позиции протоспейсера с 4 по 7. Это позволяет целенаправленно дезаминировать аденины, что особенно важно в случаях, когда другие аденины находятся поблизости от области протоспейсера [35]. Недавно также было продолжено направление исследования, касающееся эволюции дезаминаз с использованием фагов. Эти достижения подчеркивают гибкость и потенциал технологий РО для более точного и эффективного редактирования генома, что может открыть новые горизонты в коррекции генетических мутаций и разработке методов лечения ССЗ.
Однонуклеотидный полиморфизм (SNV, Single Nucleotide Variant) играет важную роль в патогенезе ССЗ, что делает РО привлекательной стратегией для их лечения [36]. В частности, аминокислотные замены в белках саркомеров часто приводят к мышечной дисфункции и заболеваниям сердца. Например, мутация R403Q в β-миозине (MYH7) является известной причиной ГКМП, так как патогенный вариант заменяет остаток G на A, изменяя кодон 403 [37]. Несколько исследований продемонстрировали способность ABE точно корректировать патогенный A обратно на G в мышиных моделях R403Q, что предотвращает возникновение ГКМП [38, 39]. Хотя остается неясным, может ли эта стратегия обратить вспять уже существующие изменения кардиомиоцитов, возникающие при ГКМП, данные концептуальные исследования подтверждают эффективность РО как профилактического средства для лечения ССЗ, обусловленных аминокислотными заменами, при этом риск генотоксичности снижается благодаря минимальному образованию DSB и indel.
Хотя SNV могут приводить к аминокислотным заменам, они также могут вызывать другие виды мутаций, такие как преждевременные стоп-кодоны (PTC, premature stopcodons). Известно, что многие PTC, часто встречающиеся в генах, связанных с саркомерами, повреждают сердце и другие ткани, что способствует развитию ССЗ. Например, варианты усечения в гене MYBPC3, вызывающие ГКМП, могут привести к гаплонедостаточности MYBPC3 в кардиомиоцитах [40]. В недавнем исследовании сообщалось о разработке системы редактирования, способной воздействовать на вариант MYBPC3 PTC и предотвращать развитие ГКМП на мышиных моделях [40].
SNV могут также приводить к пропуску экзонов, явлению, которое, по оценкам, является причиной 70% случаев мышечной дистрофии Дюшенна (МДД). Эта болезнь вызвана патогенными мутациями в гене DMD (Dystrophin) и характеризуется дисфункцией миоцитов, что в конечном итоге приводит к преждевременной смерти [41]. Для исправления рамки считывания мутированного гена DMD была разработана система редактирования Cas9, однако по причине неожиданных indel остаются опасения по поводу генотоксичности при использовании этого метода. В последнее время технологии ABE применяются для преодоления этих ограничений, позволяя вернуть рамку считывания гена DMD и восстанавливая его экспрессию, при этом избегая образования DSB [42].
Введение ABE внутривенно мышам с мутацией, вызывающей пропуск экзонов в DMD, частично восстановило уровень дистрофина в сердце и скелетной мышце. Это сопровождалось значительными улучшениями функционирования мышц, которые сохранялись как минимум в течение 10 мес после введения, что дополнительно подтверждает эффективность стратегий РО как терапевтических инструментов с потенциалом для постоянной коррекции ранее недоступных мутаций, вызывающих ССЗ [42].
Хотя методы редактирования оснований могут быть использованы для лечения генетических мутаций, приобретенные ССЗ также могут быть подвержены терапии с использованием геномного редактирования. Например, была разработана система редактирования оснований, нацеленная на патологические сигнальные пути, характерные для приобретенных форм ССЗ, таких как инфаркт миокарда. Центральным компонентом этих сигнальных путей и ключевым регулятором гомеостаза сердца является Ca2+/кальмодулин-зависимая протеинкиназа IIδ (CaMKIIδ) [43]. Гиперактивация CaMKIIδ происходит за счет фосфорилирования двух соседних остатков метионина. Преобразование этих двух остатков метионина в валины с использованием ABE in vivo ингибировало гиперактивацию и обеспечивало кардиопротекцию на фоне ишемии–реперфузии [43]. Этот креативный подход к воздействию на сигнальный путь, связанный с ишемическим повреждением, демонстрирует потенциал инструментов на основе CRISPR для лечения приобретенных форм ССЗ. В будущем стратегии редактирования оснований, вероятно, будут адаптированы для нацеливания на сигнальные пути, участвующие в других распространенных формах ССЗ, связанных с аналогичными факторами риска и клеточными сигнальными путями.
На сегодняшний день существует множество модернизированных версий оригинальной системы PE, каждая из которых улучшает и расширяет возможности своих предшественников. Размер, последовательность PAM, окно редактирования и активность обратной транскриптазы были модифицированы для повышения эффективности, стабильности и экспрессии [45]. Тем не менее, несмотря на обширные улучшения, PE по-прежнему ограничены относительно низкой эффективностью по сравнению с технологиями РО, что сдерживает функциональность PE для лечения ССЗ [46]. Для иллюстрации этого факта PE были сопоставлены с РО в качестве методов коррекции патогенных мутаций в гене RBM20, вызывающих ДКМП, с использованием клеточных и животных моделей [46]. В то время как РО корректировали 66% мутаций in vivo с заметными улучшениями в сердечно-сосудистой функции, терапия PE корректировала всего 40% мутаций в индуцированных плюрипотентных стволовых клетках человека (hiPSC, Human Induced Pluripotent Stem Cells) и впоследствии исследование не продолжалось in vivo [46].
Кроме того, могут существовать тканеспецифические ограничения для технологий PE, поскольку недавно сообщалось, что в сердце снижена возможность к редактированию в пять раз по сравнению с печенью и мозгом [47]. В итоге, хотя технологии PE увеличивают разнообразие типов редактирования, остаются ключевые ограничения, особенно в отношении эффективности редактирования генома сердца, которые необходимо преодолеть для ускорения внедрения PE в клиническую практику для терапии ССЗ.
Современные варианты CRISPRa/i предлагают широкий диапазон возможностей для активации и подавления генов [52, 53]. Например, dCas9-VPR был разработан для CRISPRa через слияние dCas9 с синтетическим трехсторонним активаторным доменом, включающим VP64, p65 и Rta. Это значительно увеличивает уровень активации генов в различных типах клеток, включая кардиомиоциты [52, 20]. В свою очередь, CRISPRi теперь использует домен KRAB (Krüppel-associated box) для рекрутирования комплекса, формирующего гетерохроматин, что приводит к надежному подавлению генов через модификацию гистонов [53].
Благодаря этим улучшениям технологии CRISPRa/i открывают новые возможности для динамической настройки экспрессии генов, что значительно расширяет их потенциал в качестве терапевтического инструмента.
По сравнению с традиционными трансгенными подходами, CRISPRa обладает рядом уникальных преимуществ. Например, избыточная экспрессия трансгенов может быть ограничена из-за размера векторов доставки, таких как аденоассоциированные вирусы (AAV, Adeno-associated dependoparvovirus A), которые не могут переносить большие гены [54]. В то же время было показано, что CRISPR эффективно работает с очень крупными генами [20]. Кроме того, активируя эндогенные локусы, CRISPR позволяет лучше сохранять физиологическую регуляцию экспрессии генов, избегая токсичных уровней сверхэкспрессии и нарушения регуляторных путей, контролируемых нетранслируемыми участками. Напротив, трансгенные конструкции, доставляемые с помощью AAV, которые могут содержать множество копий генов на клетку, обходят эти ограничения и часто используют неродные регуляторные последовательности, что может увеличивать токсичность.
Однако, как и стратегии замены генов, CRISPRa/i может столкнуться с ограничениями, связанными с необходимостью поддерживать постоянную экспрессию для обеспечения терапевтической эффективности. Это может привести к токсичности из-за иммунного ответа при повторных введениях или даже к нецелевым эффектам.
Что касается клинического применения, то было продемонстрировано, что CRISPR способен устранять последствия мутаций, ассоциированных с ССЗ, действуя через механизмы гаплонедостаточности. Например, преждевременные усекающие мутации в гене TTN (Titin) являются одной из самых частых причин ДКМП, и, учитывая огромный размер гена TTN, он вряд ли подходит для современных стратегий замены генов. Недавно была исследована активация транскрипции TTN с помощью конструкции dCas9-VPR на моделях кардиомиоцитов, полученных из hiPSC, имеющих патогенную мутацию в гене TTN [20]. Вектор RNP, содержащий dCas9-VPR, способен повышать уровень белка TTN, несмотря на его большой размер, за счет запрограммированного связывания как с промотором, так и с энхансерными элементами [20]. Исследования показали, что активация TTN устраняет сократительную дисфункцию и недостаточность саркомеров [20]. Эти результаты подтверждают гаплонедостаточность как важный механизм, способствующий развитию ДКМП, связанной с мутациями усечения TTN, и поддерживают использование CRISPRa как потенциального средства лечения распространенной формы сердечной недостаточности [20].
CRISPRa в кардиомиоцитах также демонстрирует свою эффективность in vivo, обеспечивая физиологически значимую активацию генов. Недавнее исследование показало трехкратное увеличение уровня белка MEF2D в сердце взрослых мышей с использованием dCas9-VPR, а также трехкратную активацию гена Klf15 [55]. Аналогичная активирующая система на основе dCas9 была применена in vivo для терапевтической регуляции дистрофина – белка, уровень которого обычно снижен при сердечной недостаточности [56]. Увеличение уровня дистрофина с помощью CRISPR значительно уменьшило смертность и предрасположенность к аритмиям в мышиной модели сердечной недостаточности с аортальным стенозом [56]. Эти исследования подтверждают способность CRISPRa точно активировать экспрессию целевых генов в сердце без явной токсичности и рекомендуют данный подход для дальнейшего развития и совершенствования в лечении ССЗ, особенно в случаях, когда генные мутации вызывают патологию через механизмы гаплонедостаточности.
Для расширения возможностей интеграции экзогенной ДНК, опосредованной CRISPR, была оптимизирована комбинация twinPE с интегразой Bxb1. Использование системы программируемого добавления с помощью сайт-специфичных целевых элементов (PASTE, Programmable addition via site-specific targeting elements) позволяет значительно улучшить интеграцию ДНК-груза, размер которого в шесть раз превышает тот, что доступен с помощью комбинации twinPE + Bxb1 [59].
Данное улучшение достигается за счет ковалентной связи фермента Bxb1 с комплексом, состоящим из Cas9 и обратной транскриптазы. Эта связь обеспечивает более эффективную интеграцию экзогенной ДНК в геном, позволяя достичь большей точности и стабильности в процессе редактирования.
Оптимизированная версия этой конструкции, известная как PASTEv3, демонстрирует эффективность интеграции в диапазоне 10–20% in vitro при трансфекции матрицами размером от 1 до 36 тыс. нуклеотидов в локусах β-актина (ACTB) и ламина B1 (LMNB1) [59]. Это открывает новые горизонты для применений в генной терапии, позволяя интегрировать большие фрагменты ДНК и улучшая возможность лечения различных генетических заболеваний.
В ходе этого поиска было разработано и протестировано множество различных стратегий доставки, направленных как на сердце, так и на другие органы. Эти технологии могут включать вирусные векторы, такие как аденовирусы и аденозиновые вирусы, а также невирусные методы, включая липидные наноносители и полимерные системы. Каждый подход имеет свои преимущества и недостатки, и необходимые характеристики нескольких векторов остаются не до конца удовлетворительными, что делает их менее эффективными для клинических приложений.
При этом своей целью исследователи ставят устранение сохраняющихся ограничений, таких как низкая трансфекционная эффективность, необходимость разработки специфичных для тканей методов доставки и избежание иммунного ответа на введенные векторы. Успешное преодоление этих барьеров может значительно продвинуть технологии редактирования генома к клиническому применению, особенно в кардиологии и других областях медицины.
Аденоассоциированные вирусы. AAV в настоящее время считаются одним из наиболее перспективных методов доставки CRISPR-терапии в сердечную мышцу и сердечно-сосудистую систему. Потенциал AAV для лечения ССЗ был признан еще в 2009 г., когда была предпринята первая попытка использования внутрикоронарной инфузии AAV для доставки SERCA2a пациентам с сердечной недостаточностью [60].
AAV представляют собой небольшие вирусы (диаметром 20–22 нм), не обладающие оболочкой и содержащие примерно 4,7 тыс. пар оснований одноцепочечной ДНК. Они обладают множеством качеств, делающих их привлекательными кандидатами для генной терапии [54]. В частности, AAV не являются патогенными для человека и способны доставлять свое генетическое содержимое в ядро как обычных, так и специализированных клеток млекопитающих в виде стабильной эписомы [61].
Кроме того, AAV, используемые в клинических условиях, подвергаются инженерной модификации, которая включает в себя мутации, повышающие безопасность векторов. Эти модификации делают AAV неспособными к репликации и значительно снижают риск потенциально опасной интеграции в геном хозяина [62]. Таким образом, AAV представляют собой многообещающий инструмент для эффективной и безопасной доставки CRISPR-терапии, что открывает новые возможности для лечения различных ССЗ.
Структурные вариации капсидных белков на поверхности AAV играют ключевую роль в их тропности и эффективности инфицирования различных типов клеток. Это позволяет клиницистам целенаправленно воздействовать на определенные органы с помощью AAV, даже при системном использовании. Направленная эволюция капсидных белков дополнительно повысила специфичность и эффективность доставки, например, создав капсид MyoAAV, который улучшает нацеливание именно на сердце и скелетные мышцы [63].
Кроме того, кардиоспецифичные промоторы и регуляторные элементы могут быть использованы для контроля точной экспрессии компонентов CRISPR, что позволяет минимизировать нежелательные эффекты. Однако утечка экспрессии остается областью беспокойства для этих векторов, особенно в печени, где экспрессия может приводить к непредсказуемым последствиям [64].
Основным недостатком AAV является его небольшой размер, примерно 4,7 Кбайт. При этом размер одного SpCas9 составляет около 4,1 Кбайт, что занимает около 87% всего отведенного пространства в AAV. Это делает включение дополнительных белковых доменов, промоторов или sgRNA, необходимых для успешного редактирования генома, чрезвычайно сложной задачей [65]. Таким образом, преодоление этого ограничения является важной задачей для дальнейшего развития AAV как платформы для доставки CRISPR-терапии.
Двухвекторная система AAV. Чтобы преодолеть ограничения по размеру векторов, связанных с доставкой CRISPR-компонентов, можно использовать несколько базовых плазмидных векторов (БПВ). Это часто достигается путем распределения функций: одной векторной системе назначается полная эндонуклеаза, а другой – sgRNA. Однако в некоторых случаях Cas-слитые белки, такие как те, которые используются в РО, PE и CRISPRa/i, по-прежнему превышают допустимые пределы упаковки [66].
Чтобы решить эту проблему, часто применяется технология расщепления интеина. Эта технология позволяет воссоздавать отдельные пептиды, полученные из различных вирусных частиц, в единый белок без образования «шрамов». Амино- и карбоксильные концевые фрагменты интеина генетически закодированы в соответствующих частях конструкций слитых белков Cas9. После тандемного инфицирования интеинпептиды способствуют транс-сплайсингу белка, соединяя связанные пептиды с помощью пептидной связи, формируя функциональный комплекс Cas9. Этот метод был успешно применен для коррекции патогенной мутации MYH7 R403Q у мышей, которая известна как вызывающая ГКМП [38, 40, 43].
Одновекторная система AAV. Несмотря на то что методы лечения, разработанные на основе двухвекторных систем, демонстрируют свои преимущества в лабораторных условиях, они имеют ряд ограничений. Например, необходимость разделения конструкции на два AAV приводит к удвоению дозы вируса, необходимого для достижения сопоставимых уровней экспрессии генов. Это может вызвать дозозависимые иммунные реакции. Кроме того, многовекторные подходы подвержены неэффективному редактированию, что связано со снижением скорости клеточной трансдукции и неэффективной активностью рекомбинации интеина.
В противовес этому, компактные эндонуклеазы позволяют упаковать sgRNA и даже другие компоненты, такие как дезаминазы, в единый вектор, что позволяет избежать ограничения по размеру AAV. Такой подход гарантирует, что каждая клетка, получающая даже один вирус, содержит все необходимые компоненты для редактирования, что повышает эффективность по сравнению с двухвекторными системами. Например, недавно меньшая по размеру эндонуклеаза Cas9 из Staphylococcus aureus (SaCas9), упакованная в систему AAV с одним вектором, успешно восстановила уровни сердечного дистрофина до 48% от уровня дикого типа в мышиной модели мышечной дистрофии Дюшенна, улучшив мышечную функцию даже при создании всего 8–12% от общего количества остаточных веществ [9].
Тем не менее многие альтернативные эндонуклеазы демонстрируют низкую активность у млекопитающих, и продолжается активная работа по оптимизации этих альтернатив Cas9 для использования in vivo. Целью этой работы является внедрение преимуществ одновекторных систем AAV в клиническую практику, что представляется многообещающим направлением в области генной терапии [67].
Липидные наночастицы. Липидные наночастицы (ЛНЧ) представляют собой альтернативу AAV в качестве системы доставки CRISPR-терапии. Хотя AAV остаются ведущей системой доставки, существует ряд ограничений, таких как высокая стоимость, потенциальные проблемы безопасности, связанные с длительной экспрессией их содержимого, а также вопросы, касающиеся дозировки и иммуногенности. ЛНЧ предлагают ряд преимуществ как синтетические переносчики, поскольку они не подвержены ограничениям, наложенным биологическими процессами, и могут быть разработаны для упаковки крупногабаритных молекул, что расширяет возможности редактирования генома с помощью CRISPR.
ЛНЧ могут быть использованы для транспортировки различных форм, таких как белки и мРНК, что позволяет реализовать временную экспрессию in vivo и минимизировать токсичность, связанную с мутагенезом вне мишени или длительной экспрессией. Кроме того, ЛНЧ имеют меньшее иммуностимулирующее действие по сравнению с вирусами, что дает возможность вводить их последовательно в соответствии с индивидуальными планами лечения [61].
Иммунологическая безопасность является критически важным аспектом, поскольку недавнее применение AAV для лечения мышечной дистрофии Дюшенна привело к смерти пациента, предположительно, из-за врожденных иммунных реакций на AAV вектор [62]. Этот инцидент подчеркивает необходимость разработки более безопасных и эффективных методов доставки, таких как ЛНЧ, для минования связанных рисков и улучшения результатов терапии.
Использование ЛНЧ, нацеленных на сердце, до настоящего времени ограничено из-за недостаточной тропности и склонности к накоплению в печени. Эта характерная структура поверхности липопротеинов создает проблемы при разработке терапии, направленной на коррекцию повреждений сердечной мышцы [63]. Для решения данной проблемы исследователи экспериментируют с различными химическими свойствами липидной поверхности в попытках не только уменьшить пассивное накопление в печени, но и разработать подходы, обеспечивающие специфический тропизм для различных типов клеток [64].
Например, концепция селективных ЛНЧ, нацеленных на органы (SORT, selective organ targeting), была успешно применена для систематической доставки CRISPR-терапии в легкие in vivo [64]. Однако использование данного метода для достижения доставки компонентов CRISPR в сердечную ткань еще не продемонстрировано, что подчеркивает необходимость дальнейших исследований в этой области. Улучшение таргетной доставки к сердцу станет важным шагом в направлении разработки эффективных терапий для различных ССЗ.
Несмотря на ограниченный тропизм, ЛНЧ в их текущей форме уже способны оказывать положительное воздействие на сердечно-сосудистую систему, воздействуя на факторы, секретируемые печенью. Одним из примеров успешной доставки через ЛНЧ является удаление PCSK9, который проводится с помощью опосредованного сайтом сплайсинга удержания PTC, расположенного в интроне 1 гена PCSK9 [65]. Этот подход продемонстрировал свою эффективность как на мышах, так и на приматах, и в настоящее время проходит клинические испытания для пациентов с ишемической болезнью сердца и гиперхолестеринемией [65].
Тем не менее, несмотря на перспективность ЛНЧ как метода для CRISPR-терапии, прежде чем они смогут найти более широкое применение в клинической практике в области ССЗ, необходимо провести оптимизацию для повышения их эффективности при очень низкой частоте сердечных сокращений. Это требует дальнейших исследований для улучшения специфичности и эффективности доставки терапевтических агентов непосредственно в сердечную ткань и обеспечения их безопасного и эффективного воздействия на сердечно-сосудистую систему.
На сегодняшний день быстро развивающийся инструментарий CRISPR успешно внедряется в клиническую практику благодаря множеству обнадеживающих успехов, достигнутых в лабораториях фундаментальных исследований и в ходе доклинических испытаний. Эти достижения дают надежду на то, что сложные и долгосрочные проблемы ССЗ смогут быть решены с помощью инновационных подходов, основанных на редактировании генома, что создает новую эру в медицине.
Тем не менее перед тем как терапия, опосредованная CRISPR, станет повсеместной в клинической практике, необходимо преодолеть ряд значительных ограничений. Вопросы, касающиеся доставки терапевтических агентов, их эффективности и потенциальной токсичности, особенно в долгосрочной перспективе, требуют тщательного рассмотрения. Успешная реализация мощного потенциала этой уникальной технологии требует систематического подхода к оптимизации существующих методов доставки, что позволит минимизировать риски побочных эффектов и обеспечить длительную эффективность лечения.
Таким образом, преодоление этих вызовов становится краеугольным камнем для широкого внедрения CRISPR-терапии в клиническую практику. Мир науки и медицины находится на пороге великого открытия, и с каждым шагом вперед мы приближаемся к превращению этой многообещающей технологии в реальный инструмент, способный изменить методы лечения ССЗ. Это путь, полный надежд и возможностей, который может, в конечном счете, привести к снижению заболеваемости и улучшению качества жизни для миллионов пациентов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Грецева Татьяна Александровна – студент, ФГБОУ ВО «Ростовский ГМУ». E-mail: bestielal@rambler.ru; ORCID: 0009-0007-4544-9193
Tatyana A. Gretseva – student, Rostov State Medical University.
E-mail: bestielal@rambler.ru; ORCID: 0009-0007-4544-9193
Еникеев Дамир Ахметович – д-р мед. наук, проф. каф. патологической физиологии, ФГБОУ ВО БГМУ. E-mail: enikeyev@mail.ru; SPIN-код: 4894-0744; AuthorID: 568207; ORCID: 0000-0001-6270-583X
Damir A. Enikeyev – Dr. Sci. (Med.), Prof. of the department of pathophysiology, Bashkir State Medical University. E-mail: enikeyev@mail.ru; SPIN: 4894-0744; AuthorID: 568207; ORCID: 0000-0001-6270-583X
Шайдуллина Эвелина Артуровна – студент, ФГБОУ ВО БГМУ. E-mail: diipsy060@gmail.com; ORCID: 0009-0005-2464-8981
Evelina A. Shaidullina – student, Bashkir State Medical University. E-mail: diipsy060@gmail.com; ORCID: 0009-0005-2464-8981
Джанбекова Лиана Мурадовна – студент, ФГБОУ ВО «Ростовский ГМУ». E-mail: mm.mumakova@mail.ru; ORCID: 0009-0002-7785-3602
Liana M. Djanbekova – student, Rostov State Medical University. E-mail: mm.mumakova@mail.ru; ORCID: 0009-0002-7785-3602
Карпелевич Валерия Сергеевна – студент, ФГБОУ ВО
«РосУниМед». E-mail: ValeraKarpel@yandex.ru; ORCID: 0009-0002-0933-3437
Valeria S. Karpelevich – student, Russian Medical University.
E-mail: ValeraKarpel@yandex.ru; ORCID: 0009-0002-0933-3437
Кужина Алсу Руслановна – студент, ФГБОУ ВО БГМУ. E-mail: kalsu301@gmail.com; ORCID: 0009-0004-1541-9477
Alsu R. Kuzhina – student, Bashkir State Medical University.
E-mail: kalsu301@gmail.com; ORCID: 0009-0004-1541-9477
Магомедова Аллейсс Ибрагимовна – студент, ФГБОУ ВО КубГМУ. E-mail: agadadova01@gmail.com; ORCID: 0009-0000-3034-2237
Alleiss I. Magomedova – student, Kuban State Medical University.
E-mail: agadadova01@gmail.com; ORCID: 0009-0000-3034-2237
Валеев Ильдар Рафисович – студент, ФГБОУ ВО БГМУ.
E-mail: ildar-valeev-01@mail.ru; ORCID: 0009-0009-5381-7093
Ildar R. Valeev – student, Bashkir State Medical University. E-mail: ildar-valeev-01@mail.ru; ORCID: 0009-0009-5381-7093
Гимранова Гульназ Саматовна – студент, ФГБОУ ВО БГМУ. E-mail: gulnazikgimr10gmail.com; ORCID: 0009-0003-8308-8342
Gulnaz S. Gimranova – student, Bashkir State Medical University. E-mail: gulnazikgimr10gmail.com; ORCID: 0009-0003-8308-8342
Саярова Лейсан Марсовна – студент, ФГБОУ ВО БГМУ.
E-mail: leysansayarova@gmail.com; ORCID: 0009-0000-5792-4747
Leysan M. Sayarova – student, Bashkir State Medical University. E-mail: leysansayarova@gmail.com; ORCID: 0009-0000-5792-4747
Клавдиева Надежда Александровна – врач Станции скорой и неотложной медицинской помощи им. А.С. Пучкова города Москвы. E-mail: nadezdaklavd@gmail.com; ORCID: 0009-0005-3946-0789
Nadezhda A. Klavdieva – doctor, Puchkov Ambulance and Emergency Medical Care Station in Moscow. E-mail: nadezdaklavd@gmail.com; ORCID: 0009-0005-3946-0789
Атаева Аминат Арсланбековна – студент, ФГБОУ ВО «Ростовский ГМУ». E-mail: ataevaamina002@gmail.com; ORCID: 0009-0009-2783-3321
Aminat A. Ataeva – student, Rostov State Medical University.
E-mail: ataevaamina002@gmail.com; ORCID: 0009-0009-2783-3321
Салимова Натали Юнуновна – студент, ФГБОУ ВО БГМУ.
E-mail: natali_salimova_01@mail.ru; ORCID: 0009-0006-2846-7114
Natali Yu. Salimova – student, Bashkir State Medical University.
E-mail: natali_salimova_01@mail.ru; ORCID: 0009-0006-2846-7114
Меняшева Диана Рафаилевна – студент, ФГБОУ ВО БГМУ.
E-mail: menyasheva01@inbox.ru; ORCID: 0009-0008-9254-6313
Diana R. Menyasheva – student, Bashkir State Medical University.
E-mail: menyasheva01@inbox.ru; ORCID: 0009-0008-9254-6313
Бердиев Бахром Мухаммадиевич – студент, ФГБОУ ВО БГМУ. E-mail: bakhrom_01@mail.ru; ORCID: 0009-0008-8992-925X
Bakhrom M. Berdiev – student, Bashkir State Medical University.
E-mail: bakhrom_01@mail.ru; ORCID: 0009-0008-8992-925X
Поступила в редакцию: 26.11.2024
Поступила после рецензирования: 12.12.2024
Принята к публикации: 19.12.2024
Received: 26.11.2024
Revised: 12.12.2024
Accepted: 19.12.2024
Клинический разбор в общей медицине №1 2025
Генетические модификации в кардиологии: роль CRISPR-Cas9 в терапии сердечно-сосудистых заболеваний
Номера страниц в выпуске:29-40
Аннотация
Введение. Сердечно-сосудистые заболевания (ССЗ) продолжают оставаться основной причиной смертности во всем мир. Разработка новых терапевтических подходов, позволяющих более точно воздействовать на молекулярные механизмы ССЗ, крайне важна. Недавние прорывы в области генной инженерии, такие как технология CRISPR-Cas9 (Clustered Regularly Interspaced Palindromic Repeats / CRISPR associated protein 9) и связанные с ней генномодулирующие ферменты, открывают беспрецедентные возможности для создания новых методов лечения. Эти технологии позволяют не только редактировать геном, но и непосредственно устранять первопричины ССЗ.
Цель. Провести анализ литературы, посвященной применению CRISPR-Cas9 в терапии ССЗ.
Материалы и методы. Авторами был проведен поиск публикаций в электронных базах данных PubMed и Elibrary. Оценка статей проводилась в соответствии с рекомендациями PRISMA. После процедуры отбора в обзор были включены 72 статьи.
Результаты. В статье обсуждаются различные аспекты применения CRISPR для коррекции генетических мутаций, способствующих развитию кардиопатий, а также перспективы этой технологии в контексте генной терапии. Статья акцентирует внимание на возможностях, которые открывает CRISPR-терапия для улучшения эффективности лечения ССЗ, а также подчеркивает необходимость дальнейших исследований для решения вопросов безопасности, доставки и долговременной эффективности. Результаты анализа дают надежду на создание инновационных подходов к борьбе с кардиологическими недугами, что может значительно улучшить качество жизни пациентов и снизить уровень заболеваемости.
Заключение. На сегодняшний день быстро развивающийся инструментарий CRISPR успешно внедряется в клиническую практику благодаря множеству обнадеживающих успехов, достигнутых в лабораториях фундаментальных исследований и в ходе доклинических испытаний. Эти достижения дают надежду на то, что сложные и долгосрочные проблемы ССЗ смогут быть решены с помощью инновационных подходов, основанных на редактировании генома, что создает новую эру в медицине.
Ключевые слова: CRISPR-Cas9, сердечно-сосудистые заболевания, кардиология, генетическое редактирование, генетическая модификация, генная терапия.
Для цитирования: Грецева Т.А., Еникеев Д.А., Шайдуллина Э.А., Джанбекова Л.М., Карпелевич В.С., Кужина А.Р., Магомедова А.И., Валеев И.Р., Гимранова Г.С., Саярова Л.М., Клавдиева Н.А., Атаева А.А., Салимова Н.Ю., Меняшева Д.Р., Бердиев Б.М. Генетические модификации в кардиологии: роль CRISPR-Cas9 в терапии сердечно-сосудистых заболеваний. Клинический разбор в общей медицине. 2025; 6 (1): 29–40. DOI: 10.47407/kr2024.6.1.00547
Введение. Сердечно-сосудистые заболевания (ССЗ) продолжают оставаться основной причиной смертности во всем мир. Разработка новых терапевтических подходов, позволяющих более точно воздействовать на молекулярные механизмы ССЗ, крайне важна. Недавние прорывы в области генной инженерии, такие как технология CRISPR-Cas9 (Clustered Regularly Interspaced Palindromic Repeats / CRISPR associated protein 9) и связанные с ней генномодулирующие ферменты, открывают беспрецедентные возможности для создания новых методов лечения. Эти технологии позволяют не только редактировать геном, но и непосредственно устранять первопричины ССЗ.
Цель. Провести анализ литературы, посвященной применению CRISPR-Cas9 в терапии ССЗ.
Материалы и методы. Авторами был проведен поиск публикаций в электронных базах данных PubMed и Elibrary. Оценка статей проводилась в соответствии с рекомендациями PRISMA. После процедуры отбора в обзор были включены 72 статьи.
Результаты. В статье обсуждаются различные аспекты применения CRISPR для коррекции генетических мутаций, способствующих развитию кардиопатий, а также перспективы этой технологии в контексте генной терапии. Статья акцентирует внимание на возможностях, которые открывает CRISPR-терапия для улучшения эффективности лечения ССЗ, а также подчеркивает необходимость дальнейших исследований для решения вопросов безопасности, доставки и долговременной эффективности. Результаты анализа дают надежду на создание инновационных подходов к борьбе с кардиологическими недугами, что может значительно улучшить качество жизни пациентов и снизить уровень заболеваемости.
Заключение. На сегодняшний день быстро развивающийся инструментарий CRISPR успешно внедряется в клиническую практику благодаря множеству обнадеживающих успехов, достигнутых в лабораториях фундаментальных исследований и в ходе доклинических испытаний. Эти достижения дают надежду на то, что сложные и долгосрочные проблемы ССЗ смогут быть решены с помощью инновационных подходов, основанных на редактировании генома, что создает новую эру в медицине.
Ключевые слова: CRISPR-Cas9, сердечно-сосудистые заболевания, кардиология, генетическое редактирование, генетическая модификация, генная терапия.
Для цитирования: Грецева Т.А., Еникеев Д.А., Шайдуллина Э.А., Джанбекова Л.М., Карпелевич В.С., Кужина А.Р., Магомедова А.И., Валеев И.Р., Гимранова Г.С., Саярова Л.М., Клавдиева Н.А., Атаева А.А., Салимова Н.Ю., Меняшева Д.Р., Бердиев Б.М. Генетические модификации в кардиологии: роль CRISPR-Cas9 в терапии сердечно-сосудистых заболеваний. Клинический разбор в общей медицине. 2025; 6 (1): 29–40. DOI: 10.47407/kr2024.6.1.00547
Genetic modifications in cardiology: the role of CRISPR-Cas9 in the treatment of cardiovascular diseases
Tatyana A. Gretseva1, Damir A. Enikeyev2, Evelina A. Shaidullina2, Liana M. Djanbekova1,Valeria S. Karpelevich3, Alsu R. Kuzhina2, Alleiss I. Magomedova4, Ildar R. Valeev2,
Gulnaz S. Gimranova2, Leysan M. Sayarova2, Nadezhda A. Klavdieva5, Aminat A. Ataeva1,
Natali Yu. Salimova2, Diana R. Menyasheva2, Bakhrom M. Berdiev2
1 Rostov State Medical University, Rostov-on-Don, Russia;
2 Bashkir State Medical University, Ufa, Russia;
3 Russian University of Medicine, Moscow, Russia;
4 Kuban State Medical University, Krasnodar, Russia;
5 Puchkov Ambulance and Emergency Medical Care Station in Moscow, Moscow, Russia
bestielal@rambler.ru
Abstract
Introduction. Cardiovascular diseases (CVD) continue to be the leading cause of death worldwide. The development of new therapeutic approaches that can more accurately affect the molecular mechanisms of CVD is extremely important. Recent breakthroughs in the field of genetic engineering, such as CRISPR-Cas9 (Clustered Regularly Interspaced Palindromic Repeats/CRISPR associated protein 9) technology and related gene-modulating enzymes, open unprecedented opportunities for the creation of new therapies. These technologies make it possible not only to edit the genome, but also to directly eliminate the root causes of CVD.
Aim. To analyze the literature on the use of CRISPR-Cas9 in CVD therapy.
Materials and methods. The authors conducted a search for publications in the electronic databases PubMed and Elibrary. The evaluation of the articles was carried out in accordance with the recommendations of PRISMA. After the selection procedure, 72 articles were included in the review.
Results. The article discusses various aspects of the use of CRISPR for the correction of genetic mutations that contribute to the development of cardiopathies, as well as the prospects of this technology in the context of gene therapy. The article focuses on the possibilities that CRISPR therapy opens up to improve the effectiveness of CVD treatment, and also emphasizes the need for further research to address issues of safety, delivery and long-term effectiveness. The results of the analysis give hope for the creation of innovative approaches to the fight against cardiac ailments, which can significantly improve the quality of life of patients and reduce the incidence rate.
Conclusion. To date, the rapidly developing CRISPR toolkit has been successfully implemented into clinical practice due to the many encouraging successes achieved in basic research laboratories and in preclinical trials. These achievements give hope that the complex and long-term problems of CVD can be solved with the help of innovative approaches based on genome editing, which creates a new era in medicine.
Keywords: CRISPR-Cas9, cardiovascular diseases, cardiology, genetic editing, genetic modification, gene therapy.
For citation: Gretseva T.A., Enikeyev D.A., Shaidullina E.A., Djanbekova L.M., Karpelevich V.S., Kuzhina A.R., Magomedova A.I., Valeev I.R., Gimranova G.S., Sayarova L.M., Klavdieva N.A., Ataeva A.A., Salimova N.Yu., Menyasheva D.R., Berdiev B.M. Genetic modifications in cardiology: the role of CRISPR-Cas9 in the treatment of cardiovascular diseases. Clinical review for general practice. 2025; 6 (1): 29–40 (In Russ.). DOI: 10.47407/kr2024.6.1.00547
Введение
Сердечно-сосудистые заболевания (ССЗ) продолжают оставаться основной причиной смертности во всем мире, по оценкам Всемирной организации здравоохранения от них погибает около 17,9 млн человек ежегодно [1]. В Российской Федерации ССЗ занимают первое место среди причин смертности, экономический ущерб, причиненный ими в 2016 г., составил 2,7 трлн рублей (3,2% ВВП) [2]. Высокий уровень смертности остается стабильным на протяжении десятилетий, несмотря на значительные усилия, направленные на разработку и внедрение различных методов лечения [3]. В настоящее время кардиологи в основном полагаются на методы, которые улучшают симптомы или воздействуют на молекулярные пути, связанные с заболеванием, но часто с низкой специфичностью и точностью [4]. Хотя эти подходы имеют определенную ценность, они зачастую не устраняют основную молекулярную или генетическую патологию, приводящую к развитию ССЗ.Разработка новых терапевтических подходов, позволяющих более точно воздействовать на молекулярные механизмы ССЗ, крайне важна. Недавние прорывы в области генной инженерии, такие как технология CRISPR-Cas9 (Clustered Regularly Interspaced Palindromic Repeats / CRISPR associated protein 9) и связанные с ней генномодулирующие ферменты, открывают беспрецедентные возможности для создания новых методов лечения [5]. Эти технологии позволяют не только редактировать геном, но и непосредственно устранять первопричины ССЗ.
Например, CRISPR может быть использован для коррекции мутаций, ответственных за наследственные формы заболеваний, таких как семейная гиперхолестеринемия или некоторые виды кардиомиопатий. Путем целенаправленного редактирования генетических мутаций можно значительно улучшить прогноз для пациентов и существенно снизить риск сердечно-сосудистых катастроф [6].
Кроме того, использование CRISPR может расширить горизонты для создания новых терапевтических подходов, которые не только направлены на лечение существующих патологий, но и на профилактику. Генетическая модификация, направленная на повышение устойчивости к факторам риска, может снизить заболеваемость и смертность от ССЗ на глобальном уровне [7].
Тем не менее необходимо учитывать и этические аспекты, связанные с редактированием генов, особенно в контексте лечения CCЗ. Необходимы строгие регуляции и тщательное обоснование целесообразности применения методов генной инженерии в клинической практике, чтобы избежать потенциальных негативных последствий и обеспечить безопасность пациентов [8].
Таким образом, внедрение прорывных технологий, таких как CRISPR-Cas9, в кардиологическую практику может привести к созданию более эффективных и целенаправленных подходов к лечению ССЗ, что, в свою очередь, может значительно снизить уровень смертности и улучшить качество жизни миллионов людей по всему миру.
Цель обзора – провести анализ литературы, посвященной применению CRISPR-Cas9 в терапии ССЗ.
Материалы и методы
Авторами был проведен поиск публикаций в электронных базах данных PubMed и Elibrary. Оценка статей проводилась в соответствии с рекомендациями PRISMA. Алгоритм отбора исследований представлен на рисунке.В результате поиска были извлечены 2153 публикации. Поисковые запросы включали следующие ключевые слова и их сочетания: CRISPR-Cas9; сердечно-сосудистые заболевания; кардиология; генетическое редактирование; генетическая модификация; генная терапия; cardiovascular diseases; cardiology; genetic editing; genetic modification; gene therapy. Временной интервал поиска: с момента основания соответствующей базы данных по октябрь 2024 г. Независимо друг от друга все авторы проводили скрининг названий и аннотаций выявленных статей, при обнаружении релевантных исследований извлекался полный текст соответствующей статьи. Дубликаты и неполнотекстовые версии статей были исключены.
Полнотекстовые версии статей оценивались на предмет соответствия следующим критериям включения:
• работа опубликована на английском или русском языках;
• работа опубликована в рецензируемом научном издании;
• работа представляет собой обзор литературы, экспериментальное или клиническое исследование и описывает применение технологий CRISPR-Cas9 в контексте кардиологии.
После процедуры отбора в обзор были включены 72 статьи.

Результаты и обсуждение
Технологии CRISPR-Cas9 и их применениеРедактирование нуклеазой CRISPR-Cas9. При традиционном редактировании генома с использованием технологии CRISPR-Cas9 применяется рибонуклеопротеиновый комплекс (RNP), состоящий из программируемой молекулы РНК и эндонуклеазы Cas9, выделенной из Streptococcus pyogenes (SpCas9), далее именуемой просто Cas9. Важно отметить, что природные аналоги Cas9, обнаруженные у других видов бактерий, также могут быть использованы для редактирования генома на основе CRISPR и обладают рядом уникальных характеристик, таких как вариабельность размеров, эндонуклеазная активность и программируемость. Эти особенности были успешно внедрены в стратегии редактирования генома, направленные на сердечно-сосудистую систему [9–11]. Тем не менее на сегодняшний день Cas9 из Streptococcus pyogenes остается наиболее широко используемой эндонуклеазой для технологий редактирования генома. Подробные описания разнообразия и сложности других РНК-управляемых эндонуклеаз, встречающихся в природе, представлены в работе A. Cebrian-Serrano и соавт. [12].
Для внесения изменений в геном комплекс Cas9 RNP направляется в определенную область генома человека с помощью направляющей РНК (sgRNA), специально разработанной для распознавания конкретной последовательности с использованием спаривания оснований по принципу Уотсона–Крика [13]. После связывания sgRNA с целевой последовательностью наличие протоспейсерной области (PAM) инициирует действие Cas9, который генерирует разрыв двухцепочечной ДНК (DSB, double-strand break) на три нуклеотида выше PAM, используя свои каталитические домены RuvC и HNH [14]. Впоследствии активируются пути репарации DSB, которые включают негомологичное соединение концов (NHEJ, non-homologous end joining) и гомологичную рекомбинацию (HR, homologous recombination). Каждый из этих механизмов приводит к различным результатам в зависимости от условий и характеристик окружения.
Чаще всего DSB, опосредованные Cas9, восстанавливаются с использованием предрасположенного к ошибкам механизма NHEJ, что приводит к вставкам и/или удалениям (indels) в месте DSB [15]. Эти изменения могут активировать пути нонсенс-опосредованного распада мРНК (NMD, nonsense-mediated mRNA decay), которые снижают уровни целевой мРНК и белка или изменяют аминокислотный состав самой мРНК, что приводит к образованию дисфункциональных или гипофункциональных белков [16, 17].
В лабораторных условиях индуцированные с помощью Cas9 indels могут служить мощным инструментом для исследования функций генов-мишеней. Однако в качестве терапевтической стратегии они имеют значительные ограничения, связанные с неточностью редактирования и потенциальной генотоксичностью. Нецелевое редактирование генома может привести к неожиданным изменениям, таким как крупные делеции, вставки, хромосомные перестройки или даже потеря целых хромосом, что, в частности, повышает риск развития рака [18].
Кроме того, традиционное редактирование генома с помощью CRISPR-Cas9 может нарушать функции патологических генов и аллелей, а также усиливать полезные функции генов. Это особенно критично в контексте ССЗ, обусловленных механизмами гаплонедостаточности, когда уровень нормального белка, вырабатываемого из немутировавшего аллеля, недостаточен для поддержания нормальной функции клеток и тканей. Например, в настоящее время считается, что как гипертрофическая кардиомиопатия (ГКМП), вызванная гетерозиготными мутациями гена MYBPC3 (myosin-binding protein C), так и дилатационная кардиомиопатия (ДКМП), вызванная гетерозиготными мутациями гена TTN, развиваются через механизмы гаплонедостаточности, что затрудняет их лечение традиционными подходами CRISPR-Cas9 [19, 20].
Тем не менее, несмотря на ограниченную область применения, существуют клинические возможности для традиционной терапии с использованием CRISPR-Cas9, нацеленной на борьбу с ССЗ. В недавнем клиническом исследовании CRISPR-Cas9 использовался для разрушения транстиретина (кодируемого геном TTR – transthyretin) у пациентов с транстиретиновым амилоидозом сердца. Это заболевание вызвано наследственными мутациями в более чем 100 вариантах TTR, что ведет к неправильному сворачиванию и агрегации белков в интерстициальной ткани сердца, и может постепенно приводить к дисфункции сердца и возможной смерти пациентов [21–23]. Исследование показало, что использование CRISPR-Cas9 для генерации показателей потери функции в TTR позволяет снизить уровень циркулирующего транстиретина на 87% по сравнению с уровнем до начала терапии, и это было связано с улучшением симптомов у пациентов [21].
Кроме того, помимо создания изменений, приводящих к потере функции, Cas9 можно использовать и для восстановления поврежденных рамок считывания, нарушенных патогенными indels. Например, мутации, вызывающие сдвиг рамки в гене титина (TTN, Titin), являются одной из основных причин ДКМП, для лечения которой на данный момент не существует эффективных методов, направленных на устранение основного генетического повреждения. В одном из недавних in vitro исследований использовали Cas9 и аллель-специфичную sgRNA для внедрения коррекции в рамку считывания TTN [24]. Эта модификация не только восстанавливает обратную гаплонедостаточность, но и снижает уровень пептида титина, что также может способствовать прогрессированию ДКМП [24].
В дополнение к механизму NHEJ, DSB также могут быть восстановлены с помощью HR, которая в первую очередь активна в пролиферирующих клетках. При введении ДНК-матрицы, содержащей гомологичные участки ДНК, расположенные по обе стороны от сайта DSB и вдоль боковых РНК Cas9, может происходить точная репарация ДНК. Теоретически процессы HR могут быть использованы для коррекции многих одиночных нуклеотидных мутаций и небольших отклонений in vivo. Однако низкие показатели эффективности и конкуренция со стороны доминирующего механизма NHEJ могут препятствовать применению этой терапевтической стратегии для лечения ССЗ. Это, вероятно, связано с тем, что кардиомиоциты взрослых обладают очень ограниченной способностью к делению и, как предполагается, преимущественно используют нерегулярный механизм репарации, что может повышать риск генотоксичности или цитотоксичности [25].
На сегодняшний день разработано множество вариаций оригинальной эндонуклеазы Cas9, каждая из которых обладает уникальными свойствами, расширяющими возможности редактирования генома. Например, благодаря достижениям белковой инженерии был разработан вариант Cas9 с нарушенной эндонуклеазной активностью, известный как нуклеазно-деактивированный Cas9 (dCas9). Этот вариант связывает ДНК, но не разрезает ее. Кроме того, был разработан никелированный Cas9 (nCas9), который генерирует одноцепочечные разрывы или зазубрины [26, 27]. Эти модифицированные формы Cas9 увеличивают возможности и безопасность редактирования генома и часто используются в различных новых инструментах редактирования генома [28–30].
Более того, другие модификации Cas9 улучшили распознавание последовательностей PAM, расширив целевые возможности для CRISPR-Cas9-терапии и позволив редактировать участки, где отсутствуют обычные последовательности NGG PAM [32, 32]. Важно отметить, что эта гибкость PAM также была применена к dCas9 благодаря новым конструкциям, которые способны распознавать различные последовательности PAM и демонстрируют высокую эффективность в клетках млекопитающих [33].
Таким образом, разнообразная коллекция вариантов Cas9 создала набор передовых технологий на основе CRISPR, которые выводят CRISPR-терапию за пределы стандартного редактирования с помощью CRISPR-Cas9 и открывают новые возможности для лечения множества заболеваний.
Редактирование оснований
Редактирование оснований (РО) было впервые описано в 2016 г. как инструмент CRISPR, позволяющий точно редактировать отдельные нуклеотиды без образования DSB [29]. Вместо использования шаблона для восстановления системы РО применяют ферменты дезаминазы, соединенные с nCas9 RNP, чтобы напрямую изменять нуклеозиды путем удаления аминогруппы и стимулирования замены целевых пар оснований. В отличие от традиционного редактирования с использованием CRISPR-Cas9, системы РО обладают значительным потенциалом для лечения генетических мутаций, вызывающих заболевания, посредством механизмов доминантно-негативной реакции, гаплонедостаточности и потери функции.Существует два основных класса РО: редакторы цитозиновых оснований (CBE, cytosine base editor) и редакторы адениновых оснований (ABE, adenine base editor). CBE модифицируют цитозины (C) в урацилы (U), тогда как ABE модифицируют аденины (A) в инозины (I) [29, 34]. После спаривания или репликации ДНК промежуточные базы U и I преобразуются в тимин (T) и гуанин (G) соответственно, что завершает переход от C/G к T/A для CBE и от A/T к G/C для ABE.
Кроме того, CBE II поколения дополнительно используют домен ингибитора урацилгликозилазы (UGI), который тандемно соединен с nCas9, чтобы предотвратить нежелательное восстановление правок C к T. Показано, что эта модификация увеличивает среднюю эффективность редактирования в три раза [29].
РО предлагает уникальные возможности для редактирования генома, отличающиеся от традиционных RNP Cas9. Это создает перспективы для применения различных стратегий редактирования. Например,
ABE-max – это новейшая версия ABE, который обладает узким окном редактирования, охватывающим позиции протоспейсера с 4 по 7. Это позволяет целенаправленно дезаминировать аденины, что особенно важно в случаях, когда другие аденины находятся поблизости от области протоспейсера [35]. Недавно также было продолжено направление исследования, касающееся эволюции дезаминаз с использованием фагов. Эти достижения подчеркивают гибкость и потенциал технологий РО для более точного и эффективного редактирования генома, что может открыть новые горизонты в коррекции генетических мутаций и разработке методов лечения ССЗ.
Однонуклеотидный полиморфизм (SNV, Single Nucleotide Variant) играет важную роль в патогенезе ССЗ, что делает РО привлекательной стратегией для их лечения [36]. В частности, аминокислотные замены в белках саркомеров часто приводят к мышечной дисфункции и заболеваниям сердца. Например, мутация R403Q в β-миозине (MYH7) является известной причиной ГКМП, так как патогенный вариант заменяет остаток G на A, изменяя кодон 403 [37]. Несколько исследований продемонстрировали способность ABE точно корректировать патогенный A обратно на G в мышиных моделях R403Q, что предотвращает возникновение ГКМП [38, 39]. Хотя остается неясным, может ли эта стратегия обратить вспять уже существующие изменения кардиомиоцитов, возникающие при ГКМП, данные концептуальные исследования подтверждают эффективность РО как профилактического средства для лечения ССЗ, обусловленных аминокислотными заменами, при этом риск генотоксичности снижается благодаря минимальному образованию DSB и indel.
Хотя SNV могут приводить к аминокислотным заменам, они также могут вызывать другие виды мутаций, такие как преждевременные стоп-кодоны (PTC, premature stopcodons). Известно, что многие PTC, часто встречающиеся в генах, связанных с саркомерами, повреждают сердце и другие ткани, что способствует развитию ССЗ. Например, варианты усечения в гене MYBPC3, вызывающие ГКМП, могут привести к гаплонедостаточности MYBPC3 в кардиомиоцитах [40]. В недавнем исследовании сообщалось о разработке системы редактирования, способной воздействовать на вариант MYBPC3 PTC и предотвращать развитие ГКМП на мышиных моделях [40].
SNV могут также приводить к пропуску экзонов, явлению, которое, по оценкам, является причиной 70% случаев мышечной дистрофии Дюшенна (МДД). Эта болезнь вызвана патогенными мутациями в гене DMD (Dystrophin) и характеризуется дисфункцией миоцитов, что в конечном итоге приводит к преждевременной смерти [41]. Для исправления рамки считывания мутированного гена DMD была разработана система редактирования Cas9, однако по причине неожиданных indel остаются опасения по поводу генотоксичности при использовании этого метода. В последнее время технологии ABE применяются для преодоления этих ограничений, позволяя вернуть рамку считывания гена DMD и восстанавливая его экспрессию, при этом избегая образования DSB [42].
Введение ABE внутривенно мышам с мутацией, вызывающей пропуск экзонов в DMD, частично восстановило уровень дистрофина в сердце и скелетной мышце. Это сопровождалось значительными улучшениями функционирования мышц, которые сохранялись как минимум в течение 10 мес после введения, что дополнительно подтверждает эффективность стратегий РО как терапевтических инструментов с потенциалом для постоянной коррекции ранее недоступных мутаций, вызывающих ССЗ [42].
Хотя методы редактирования оснований могут быть использованы для лечения генетических мутаций, приобретенные ССЗ также могут быть подвержены терапии с использованием геномного редактирования. Например, была разработана система редактирования оснований, нацеленная на патологические сигнальные пути, характерные для приобретенных форм ССЗ, таких как инфаркт миокарда. Центральным компонентом этих сигнальных путей и ключевым регулятором гомеостаза сердца является Ca2+/кальмодулин-зависимая протеинкиназа IIδ (CaMKIIδ) [43]. Гиперактивация CaMKIIδ происходит за счет фосфорилирования двух соседних остатков метионина. Преобразование этих двух остатков метионина в валины с использованием ABE in vivo ингибировало гиперактивацию и обеспечивало кардиопротекцию на фоне ишемии–реперфузии [43]. Этот креативный подход к воздействию на сигнальный путь, связанный с ишемическим повреждением, демонстрирует потенциал инструментов на основе CRISPR для лечения приобретенных форм ССЗ. В будущем стратегии редактирования оснований, вероятно, будут адаптированы для нацеливания на сигнальные пути, участвующие в других распространенных формах ССЗ, связанных с аналогичными факторами риска и клеточными сигнальными путями.
Праймированное редактирование генома
Ранние технологии РО ограничиваются заместительными изменениями пар оснований, которые возникают в результате дезаминирования, что составляет лишь 2 из 12 возможных изменений в ДНК. Несмотря на недавнее расширение возможностей технологии РО, включающее трансверсии C в G, по-прежнему остаются значительные ограничения в редактировании [44]. Однако технологии праймированного редактирования генома (PE, Prime Editors) преодолевают эти ограничения, позволяя осуществлять все возможные замены пар оснований, а также вводить специфические вставки и удаления до примерно 44 и 80 пар оснований соответственно [30]. Как и РО, PE работают без образования DSB. В данном случае nCas9 снова выступает в роли каркаса, соединяясь с доменом обратной транскриптазы, что и обеспечивает характерную универсальность PE. Намеченная мутация закодирована в направляющей PE РНК (pegRNA, prime editing guide RNA), с которой обратная транскриптаза считывает и синтезирует необходимое редактирование [30]. nCas9 помечает место вставки путем создания надреза в одноцепочечной ДНК. Совместно координируя действия этих трех компонентов, технологии PE могут производить сложные изменения с высокой специфичностью, сопоставимой с CRISPR-Cas HDR, но с безопасностью, характерной для РО, представляя собой значительное дополнение к арсеналу CRISPR-Cas9.На сегодняшний день существует множество модернизированных версий оригинальной системы PE, каждая из которых улучшает и расширяет возможности своих предшественников. Размер, последовательность PAM, окно редактирования и активность обратной транскриптазы были модифицированы для повышения эффективности, стабильности и экспрессии [45]. Тем не менее, несмотря на обширные улучшения, PE по-прежнему ограничены относительно низкой эффективностью по сравнению с технологиями РО, что сдерживает функциональность PE для лечения ССЗ [46]. Для иллюстрации этого факта PE были сопоставлены с РО в качестве методов коррекции патогенных мутаций в гене RBM20, вызывающих ДКМП, с использованием клеточных и животных моделей [46]. В то время как РО корректировали 66% мутаций in vivo с заметными улучшениями в сердечно-сосудистой функции, терапия PE корректировала всего 40% мутаций в индуцированных плюрипотентных стволовых клетках человека (hiPSC, Human Induced Pluripotent Stem Cells) и впоследствии исследование не продолжалось in vivo [46].
Кроме того, могут существовать тканеспецифические ограничения для технологий PE, поскольку недавно сообщалось, что в сердце снижена возможность к редактированию в пять раз по сравнению с печенью и мозгом [47]. В итоге, хотя технологии PE увеличивают разнообразие типов редактирования, остаются ключевые ограничения, особенно в отношении эффективности редактирования генома сердца, которые необходимо преодолеть для ускорения внедрения PE в клиническую практику для терапии ССЗ.
Регулирование экспрессии генов с помощью CRISPR
Технологии CRISPR могут управлять функциями генома без непосредственного изменения его последовательности. Например, dCas9, связанный с эпигенетическими эффектными доменами, способен обеспечивать селективное метилирование и деметилирование ДНК, ацетилирование и дезацетилирование гистонов, а также прямую активацию или подавление транскрипции [48–51]. С помощью sgRNA можно рекрутировать эффекторные домены, что позволяет непосредственно активировать (CRISPRa) или ингибировать (CRISPRi) транскрипцию целевых генов. Эти технологии CRISPRa/i обладают потенциалом для коррекции дисфункциональной регуляции генов, что является характерным признаком многих ССЗ и основной причиной наследственных заболеваний, связанных с гаплонедостаточностью.Современные варианты CRISPRa/i предлагают широкий диапазон возможностей для активации и подавления генов [52, 53]. Например, dCas9-VPR был разработан для CRISPRa через слияние dCas9 с синтетическим трехсторонним активаторным доменом, включающим VP64, p65 и Rta. Это значительно увеличивает уровень активации генов в различных типах клеток, включая кардиомиоциты [52, 20]. В свою очередь, CRISPRi теперь использует домен KRAB (Krüppel-associated box) для рекрутирования комплекса, формирующего гетерохроматин, что приводит к надежному подавлению генов через модификацию гистонов [53].
Благодаря этим улучшениям технологии CRISPRa/i открывают новые возможности для динамической настройки экспрессии генов, что значительно расширяет их потенциал в качестве терапевтического инструмента.
По сравнению с традиционными трансгенными подходами, CRISPRa обладает рядом уникальных преимуществ. Например, избыточная экспрессия трансгенов может быть ограничена из-за размера векторов доставки, таких как аденоассоциированные вирусы (AAV, Adeno-associated dependoparvovirus A), которые не могут переносить большие гены [54]. В то же время было показано, что CRISPR эффективно работает с очень крупными генами [20]. Кроме того, активируя эндогенные локусы, CRISPR позволяет лучше сохранять физиологическую регуляцию экспрессии генов, избегая токсичных уровней сверхэкспрессии и нарушения регуляторных путей, контролируемых нетранслируемыми участками. Напротив, трансгенные конструкции, доставляемые с помощью AAV, которые могут содержать множество копий генов на клетку, обходят эти ограничения и часто используют неродные регуляторные последовательности, что может увеличивать токсичность.
Однако, как и стратегии замены генов, CRISPRa/i может столкнуться с ограничениями, связанными с необходимостью поддерживать постоянную экспрессию для обеспечения терапевтической эффективности. Это может привести к токсичности из-за иммунного ответа при повторных введениях или даже к нецелевым эффектам.
Что касается клинического применения, то было продемонстрировано, что CRISPR способен устранять последствия мутаций, ассоциированных с ССЗ, действуя через механизмы гаплонедостаточности. Например, преждевременные усекающие мутации в гене TTN (Titin) являются одной из самых частых причин ДКМП, и, учитывая огромный размер гена TTN, он вряд ли подходит для современных стратегий замены генов. Недавно была исследована активация транскрипции TTN с помощью конструкции dCas9-VPR на моделях кардиомиоцитов, полученных из hiPSC, имеющих патогенную мутацию в гене TTN [20]. Вектор RNP, содержащий dCas9-VPR, способен повышать уровень белка TTN, несмотря на его большой размер, за счет запрограммированного связывания как с промотором, так и с энхансерными элементами [20]. Исследования показали, что активация TTN устраняет сократительную дисфункцию и недостаточность саркомеров [20]. Эти результаты подтверждают гаплонедостаточность как важный механизм, способствующий развитию ДКМП, связанной с мутациями усечения TTN, и поддерживают использование CRISPRa как потенциального средства лечения распространенной формы сердечной недостаточности [20].
CRISPRa в кардиомиоцитах также демонстрирует свою эффективность in vivo, обеспечивая физиологически значимую активацию генов. Недавнее исследование показало трехкратное увеличение уровня белка MEF2D в сердце взрослых мышей с использованием dCas9-VPR, а также трехкратную активацию гена Klf15 [55]. Аналогичная активирующая система на основе dCas9 была применена in vivo для терапевтической регуляции дистрофина – белка, уровень которого обычно снижен при сердечной недостаточности [56]. Увеличение уровня дистрофина с помощью CRISPR значительно уменьшило смертность и предрасположенность к аритмиям в мышиной модели сердечной недостаточности с аортальным стенозом [56]. Эти исследования подтверждают способность CRISPRa точно активировать экспрессию целевых генов в сердце без явной токсичности и рекомендуют данный подход для дальнейшего развития и совершенствования в лечении ССЗ, особенно в случаях, когда генные мутации вызывают патологию через механизмы гаплонедостаточности.
Развитие технологий, основанных на CRISPR
Редактирование генома в широких масштабах. Нестабильность генома может привести к крупным мутациям в масштабе килобазы, которые стимулируют развитие ССЗ [57]. Современные инструменты CRISPR, описанные выше, не могут надежно корректировать такие крупные генетические изменения безопасным и контролируемым образом, они способны вносить лишь относительно небольшие изменения в ДНК (~80 нуклеотидов для PE) [58]. Таким образом, существует неудовлетворенная потребность в технологии редактирования генома, которая позволяет безопасно и точно манипулировать большими последовательностями ДНК. Одним из решений является недавно разработанная система twin prime editing (twinPE), модификация традиционной технологии PE для облегчения интеграции последовательностей ДНК в масштабе гена, а также инверсии больших последовательностей [58]. Используя второй комплекс PEGRNA-nCas9, twinPE фиксирует область генома и синтезирует два комплементарных фрагмента ДНК de novo, которые гибридизуются, чтобы полностью заменить эндогенную последовательность, расположенную по бокам, после репарации [58]. Сайт-специфичные интегразы, такие как Bxb1, в сочетании с этим методом позволяют осуществлять крупномасштабные вставки ДНК (5 т.п.н.) и инверсии (40 т.п.н.) в клетках человека в терапевтически значимых локусах, которые могут быть выполнены в неделящихся клетках, таких как кардиомиоциты [58].Для расширения возможностей интеграции экзогенной ДНК, опосредованной CRISPR, была оптимизирована комбинация twinPE с интегразой Bxb1. Использование системы программируемого добавления с помощью сайт-специфичных целевых элементов (PASTE, Programmable addition via site-specific targeting elements) позволяет значительно улучшить интеграцию ДНК-груза, размер которого в шесть раз превышает тот, что доступен с помощью комбинации twinPE + Bxb1 [59].
Данное улучшение достигается за счет ковалентной связи фермента Bxb1 с комплексом, состоящим из Cas9 и обратной транскриптазы. Эта связь обеспечивает более эффективную интеграцию экзогенной ДНК в геном, позволяя достичь большей точности и стабильности в процессе редактирования.
Оптимизированная версия этой конструкции, известная как PASTEv3, демонстрирует эффективность интеграции в диапазоне 10–20% in vitro при трансфекции матрицами размером от 1 до 36 тыс. нуклеотидов в локусах β-актина (ACTB) и ламина B1 (LMNB1) [59]. Это открывает новые горизонты для применений в генной терапии, позволяя интегрировать большие фрагменты ДНК и улучшая возможность лечения различных генетических заболеваний.
Стратегии доставки с использованием технологии CRISPR
С момента открытия технологии CRISPR-Cas9 было предложено множество стратегий доставки, специально нацеленных на сердце. Тем не менее на сегодняшний день остаются значительные пробелы в наших знаниях и возможностях в этой области. Исследователи продолжают искать идеальный вектор, который отвечал бы критериям безопасности и эффективности в качестве терапевтического средства для редактирования генома.В ходе этого поиска было разработано и протестировано множество различных стратегий доставки, направленных как на сердце, так и на другие органы. Эти технологии могут включать вирусные векторы, такие как аденовирусы и аденозиновые вирусы, а также невирусные методы, включая липидные наноносители и полимерные системы. Каждый подход имеет свои преимущества и недостатки, и необходимые характеристики нескольких векторов остаются не до конца удовлетворительными, что делает их менее эффективными для клинических приложений.
При этом своей целью исследователи ставят устранение сохраняющихся ограничений, таких как низкая трансфекционная эффективность, необходимость разработки специфичных для тканей методов доставки и избежание иммунного ответа на введенные векторы. Успешное преодоление этих барьеров может значительно продвинуть технологии редактирования генома к клиническому применению, особенно в кардиологии и других областях медицины.
Аденоассоциированные вирусы. AAV в настоящее время считаются одним из наиболее перспективных методов доставки CRISPR-терапии в сердечную мышцу и сердечно-сосудистую систему. Потенциал AAV для лечения ССЗ был признан еще в 2009 г., когда была предпринята первая попытка использования внутрикоронарной инфузии AAV для доставки SERCA2a пациентам с сердечной недостаточностью [60].
AAV представляют собой небольшие вирусы (диаметром 20–22 нм), не обладающие оболочкой и содержащие примерно 4,7 тыс. пар оснований одноцепочечной ДНК. Они обладают множеством качеств, делающих их привлекательными кандидатами для генной терапии [54]. В частности, AAV не являются патогенными для человека и способны доставлять свое генетическое содержимое в ядро как обычных, так и специализированных клеток млекопитающих в виде стабильной эписомы [61].
Кроме того, AAV, используемые в клинических условиях, подвергаются инженерной модификации, которая включает в себя мутации, повышающие безопасность векторов. Эти модификации делают AAV неспособными к репликации и значительно снижают риск потенциально опасной интеграции в геном хозяина [62]. Таким образом, AAV представляют собой многообещающий инструмент для эффективной и безопасной доставки CRISPR-терапии, что открывает новые возможности для лечения различных ССЗ.
Структурные вариации капсидных белков на поверхности AAV играют ключевую роль в их тропности и эффективности инфицирования различных типов клеток. Это позволяет клиницистам целенаправленно воздействовать на определенные органы с помощью AAV, даже при системном использовании. Направленная эволюция капсидных белков дополнительно повысила специфичность и эффективность доставки, например, создав капсид MyoAAV, который улучшает нацеливание именно на сердце и скелетные мышцы [63].
Кроме того, кардиоспецифичные промоторы и регуляторные элементы могут быть использованы для контроля точной экспрессии компонентов CRISPR, что позволяет минимизировать нежелательные эффекты. Однако утечка экспрессии остается областью беспокойства для этих векторов, особенно в печени, где экспрессия может приводить к непредсказуемым последствиям [64].
Основным недостатком AAV является его небольшой размер, примерно 4,7 Кбайт. При этом размер одного SpCas9 составляет около 4,1 Кбайт, что занимает около 87% всего отведенного пространства в AAV. Это делает включение дополнительных белковых доменов, промоторов или sgRNA, необходимых для успешного редактирования генома, чрезвычайно сложной задачей [65]. Таким образом, преодоление этого ограничения является важной задачей для дальнейшего развития AAV как платформы для доставки CRISPR-терапии.
Двухвекторная система AAV. Чтобы преодолеть ограничения по размеру векторов, связанных с доставкой CRISPR-компонентов, можно использовать несколько базовых плазмидных векторов (БПВ). Это часто достигается путем распределения функций: одной векторной системе назначается полная эндонуклеаза, а другой – sgRNA. Однако в некоторых случаях Cas-слитые белки, такие как те, которые используются в РО, PE и CRISPRa/i, по-прежнему превышают допустимые пределы упаковки [66].
Чтобы решить эту проблему, часто применяется технология расщепления интеина. Эта технология позволяет воссоздавать отдельные пептиды, полученные из различных вирусных частиц, в единый белок без образования «шрамов». Амино- и карбоксильные концевые фрагменты интеина генетически закодированы в соответствующих частях конструкций слитых белков Cas9. После тандемного инфицирования интеинпептиды способствуют транс-сплайсингу белка, соединяя связанные пептиды с помощью пептидной связи, формируя функциональный комплекс Cas9. Этот метод был успешно применен для коррекции патогенной мутации MYH7 R403Q у мышей, которая известна как вызывающая ГКМП [38, 40, 43].
Одновекторная система AAV. Несмотря на то что методы лечения, разработанные на основе двухвекторных систем, демонстрируют свои преимущества в лабораторных условиях, они имеют ряд ограничений. Например, необходимость разделения конструкции на два AAV приводит к удвоению дозы вируса, необходимого для достижения сопоставимых уровней экспрессии генов. Это может вызвать дозозависимые иммунные реакции. Кроме того, многовекторные подходы подвержены неэффективному редактированию, что связано со снижением скорости клеточной трансдукции и неэффективной активностью рекомбинации интеина.
В противовес этому, компактные эндонуклеазы позволяют упаковать sgRNA и даже другие компоненты, такие как дезаминазы, в единый вектор, что позволяет избежать ограничения по размеру AAV. Такой подход гарантирует, что каждая клетка, получающая даже один вирус, содержит все необходимые компоненты для редактирования, что повышает эффективность по сравнению с двухвекторными системами. Например, недавно меньшая по размеру эндонуклеаза Cas9 из Staphylococcus aureus (SaCas9), упакованная в систему AAV с одним вектором, успешно восстановила уровни сердечного дистрофина до 48% от уровня дикого типа в мышиной модели мышечной дистрофии Дюшенна, улучшив мышечную функцию даже при создании всего 8–12% от общего количества остаточных веществ [9].
Тем не менее многие альтернативные эндонуклеазы демонстрируют низкую активность у млекопитающих, и продолжается активная работа по оптимизации этих альтернатив Cas9 для использования in vivo. Целью этой работы является внедрение преимуществ одновекторных систем AAV в клиническую практику, что представляется многообещающим направлением в области генной терапии [67].
Липидные наночастицы. Липидные наночастицы (ЛНЧ) представляют собой альтернативу AAV в качестве системы доставки CRISPR-терапии. Хотя AAV остаются ведущей системой доставки, существует ряд ограничений, таких как высокая стоимость, потенциальные проблемы безопасности, связанные с длительной экспрессией их содержимого, а также вопросы, касающиеся дозировки и иммуногенности. ЛНЧ предлагают ряд преимуществ как синтетические переносчики, поскольку они не подвержены ограничениям, наложенным биологическими процессами, и могут быть разработаны для упаковки крупногабаритных молекул, что расширяет возможности редактирования генома с помощью CRISPR.
ЛНЧ могут быть использованы для транспортировки различных форм, таких как белки и мРНК, что позволяет реализовать временную экспрессию in vivo и минимизировать токсичность, связанную с мутагенезом вне мишени или длительной экспрессией. Кроме того, ЛНЧ имеют меньшее иммуностимулирующее действие по сравнению с вирусами, что дает возможность вводить их последовательно в соответствии с индивидуальными планами лечения [61].
Иммунологическая безопасность является критически важным аспектом, поскольку недавнее применение AAV для лечения мышечной дистрофии Дюшенна привело к смерти пациента, предположительно, из-за врожденных иммунных реакций на AAV вектор [62]. Этот инцидент подчеркивает необходимость разработки более безопасных и эффективных методов доставки, таких как ЛНЧ, для минования связанных рисков и улучшения результатов терапии.
Использование ЛНЧ, нацеленных на сердце, до настоящего времени ограничено из-за недостаточной тропности и склонности к накоплению в печени. Эта характерная структура поверхности липопротеинов создает проблемы при разработке терапии, направленной на коррекцию повреждений сердечной мышцы [63]. Для решения данной проблемы исследователи экспериментируют с различными химическими свойствами липидной поверхности в попытках не только уменьшить пассивное накопление в печени, но и разработать подходы, обеспечивающие специфический тропизм для различных типов клеток [64].
Например, концепция селективных ЛНЧ, нацеленных на органы (SORT, selective organ targeting), была успешно применена для систематической доставки CRISPR-терапии в легкие in vivo [64]. Однако использование данного метода для достижения доставки компонентов CRISPR в сердечную ткань еще не продемонстрировано, что подчеркивает необходимость дальнейших исследований в этой области. Улучшение таргетной доставки к сердцу станет важным шагом в направлении разработки эффективных терапий для различных ССЗ.
Несмотря на ограниченный тропизм, ЛНЧ в их текущей форме уже способны оказывать положительное воздействие на сердечно-сосудистую систему, воздействуя на факторы, секретируемые печенью. Одним из примеров успешной доставки через ЛНЧ является удаление PCSK9, который проводится с помощью опосредованного сайтом сплайсинга удержания PTC, расположенного в интроне 1 гена PCSK9 [65]. Этот подход продемонстрировал свою эффективность как на мышах, так и на приматах, и в настоящее время проходит клинические испытания для пациентов с ишемической болезнью сердца и гиперхолестеринемией [65].
Тем не менее, несмотря на перспективность ЛНЧ как метода для CRISPR-терапии, прежде чем они смогут найти более широкое применение в клинической практике в области ССЗ, необходимо провести оптимизацию для повышения их эффективности при очень низкой частоте сердечных сокращений. Это требует дальнейших исследований для улучшения специфичности и эффективности доставки терапевтических агентов непосредственно в сердечную ткань и обеспечения их безопасного и эффективного воздействия на сердечно-сосудистую систему.
Заключение
Методы лечения на основе CRISPR представляют собой революционную технологию, обладающую беспрецедентной способностью детально контролировать последовательности и активность человеческого генома. Эта уникальная перспектива становится особенно важной в свете множества ССЗ, которые продолжают оставаться одной из ведущих причин заболеваемости и смертности в современном мире. Научные достижения в области CRISPR открывают новые горизонты для создания целенаправленных и эффективных методов лечения, способных изменить жизнь миллионов людей.На сегодняшний день быстро развивающийся инструментарий CRISPR успешно внедряется в клиническую практику благодаря множеству обнадеживающих успехов, достигнутых в лабораториях фундаментальных исследований и в ходе доклинических испытаний. Эти достижения дают надежду на то, что сложные и долгосрочные проблемы ССЗ смогут быть решены с помощью инновационных подходов, основанных на редактировании генома, что создает новую эру в медицине.
Тем не менее перед тем как терапия, опосредованная CRISPR, станет повсеместной в клинической практике, необходимо преодолеть ряд значительных ограничений. Вопросы, касающиеся доставки терапевтических агентов, их эффективности и потенциальной токсичности, особенно в долгосрочной перспективе, требуют тщательного рассмотрения. Успешная реализация мощного потенциала этой уникальной технологии требует систематического подхода к оптимизации существующих методов доставки, что позволит минимизировать риски побочных эффектов и обеспечить длительную эффективность лечения.
Таким образом, преодоление этих вызовов становится краеугольным камнем для широкого внедрения CRISPR-терапии в клиническую практику. Мир науки и медицины находится на пороге великого открытия, и с каждым шагом вперед мы приближаемся к превращению этой многообещающей технологии в реальный инструмент, способный изменить методы лечения ССЗ. Это путь, полный надежд и возможностей, который может, в конечном счете, привести к снижению заболеваемости и улучшению качества жизни для миллионов пациентов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Грецева Татьяна Александровна – студент, ФГБОУ ВО «Ростовский ГМУ». E-mail: bestielal@rambler.ru; ORCID: 0009-0007-4544-9193
Tatyana A. Gretseva – student, Rostov State Medical University.
E-mail: bestielal@rambler.ru; ORCID: 0009-0007-4544-9193
Еникеев Дамир Ахметович – д-р мед. наук, проф. каф. патологической физиологии, ФГБОУ ВО БГМУ. E-mail: enikeyev@mail.ru; SPIN-код: 4894-0744; AuthorID: 568207; ORCID: 0000-0001-6270-583X
Damir A. Enikeyev – Dr. Sci. (Med.), Prof. of the department of pathophysiology, Bashkir State Medical University. E-mail: enikeyev@mail.ru; SPIN: 4894-0744; AuthorID: 568207; ORCID: 0000-0001-6270-583X
Шайдуллина Эвелина Артуровна – студент, ФГБОУ ВО БГМУ. E-mail: diipsy060@gmail.com; ORCID: 0009-0005-2464-8981
Evelina A. Shaidullina – student, Bashkir State Medical University. E-mail: diipsy060@gmail.com; ORCID: 0009-0005-2464-8981
Джанбекова Лиана Мурадовна – студент, ФГБОУ ВО «Ростовский ГМУ». E-mail: mm.mumakova@mail.ru; ORCID: 0009-0002-7785-3602
Liana M. Djanbekova – student, Rostov State Medical University. E-mail: mm.mumakova@mail.ru; ORCID: 0009-0002-7785-3602
Карпелевич Валерия Сергеевна – студент, ФГБОУ ВО
«РосУниМед». E-mail: ValeraKarpel@yandex.ru; ORCID: 0009-0002-0933-3437
Valeria S. Karpelevich – student, Russian Medical University.
E-mail: ValeraKarpel@yandex.ru; ORCID: 0009-0002-0933-3437
Кужина Алсу Руслановна – студент, ФГБОУ ВО БГМУ. E-mail: kalsu301@gmail.com; ORCID: 0009-0004-1541-9477
Alsu R. Kuzhina – student, Bashkir State Medical University.
E-mail: kalsu301@gmail.com; ORCID: 0009-0004-1541-9477
Магомедова Аллейсс Ибрагимовна – студент, ФГБОУ ВО КубГМУ. E-mail: agadadova01@gmail.com; ORCID: 0009-0000-3034-2237
Alleiss I. Magomedova – student, Kuban State Medical University.
E-mail: agadadova01@gmail.com; ORCID: 0009-0000-3034-2237
Валеев Ильдар Рафисович – студент, ФГБОУ ВО БГМУ.
E-mail: ildar-valeev-01@mail.ru; ORCID: 0009-0009-5381-7093
Ildar R. Valeev – student, Bashkir State Medical University. E-mail: ildar-valeev-01@mail.ru; ORCID: 0009-0009-5381-7093
Гимранова Гульназ Саматовна – студент, ФГБОУ ВО БГМУ. E-mail: gulnazikgimr10gmail.com; ORCID: 0009-0003-8308-8342
Gulnaz S. Gimranova – student, Bashkir State Medical University. E-mail: gulnazikgimr10gmail.com; ORCID: 0009-0003-8308-8342
Саярова Лейсан Марсовна – студент, ФГБОУ ВО БГМУ.
E-mail: leysansayarova@gmail.com; ORCID: 0009-0000-5792-4747
Leysan M. Sayarova – student, Bashkir State Medical University. E-mail: leysansayarova@gmail.com; ORCID: 0009-0000-5792-4747
Клавдиева Надежда Александровна – врач Станции скорой и неотложной медицинской помощи им. А.С. Пучкова города Москвы. E-mail: nadezdaklavd@gmail.com; ORCID: 0009-0005-3946-0789
Nadezhda A. Klavdieva – doctor, Puchkov Ambulance and Emergency Medical Care Station in Moscow. E-mail: nadezdaklavd@gmail.com; ORCID: 0009-0005-3946-0789
Атаева Аминат Арсланбековна – студент, ФГБОУ ВО «Ростовский ГМУ». E-mail: ataevaamina002@gmail.com; ORCID: 0009-0009-2783-3321
Aminat A. Ataeva – student, Rostov State Medical University.
E-mail: ataevaamina002@gmail.com; ORCID: 0009-0009-2783-3321
Салимова Натали Юнуновна – студент, ФГБОУ ВО БГМУ.
E-mail: natali_salimova_01@mail.ru; ORCID: 0009-0006-2846-7114
Natali Yu. Salimova – student, Bashkir State Medical University.
E-mail: natali_salimova_01@mail.ru; ORCID: 0009-0006-2846-7114
Меняшева Диана Рафаилевна – студент, ФГБОУ ВО БГМУ.
E-mail: menyasheva01@inbox.ru; ORCID: 0009-0008-9254-6313
Diana R. Menyasheva – student, Bashkir State Medical University.
E-mail: menyasheva01@inbox.ru; ORCID: 0009-0008-9254-6313
Бердиев Бахром Мухаммадиевич – студент, ФГБОУ ВО БГМУ. E-mail: bakhrom_01@mail.ru; ORCID: 0009-0008-8992-925X
Bakhrom M. Berdiev – student, Bashkir State Medical University.
E-mail: bakhrom_01@mail.ru; ORCID: 0009-0008-8992-925X
Поступила в редакцию: 26.11.2024
Поступила после рецензирования: 12.12.2024
Принята к публикации: 19.12.2024
Received: 26.11.2024
Revised: 12.12.2024
Accepted: 19.12.2024
Список исп. литературыСкрыть список1. World Health Organization: Cardiovascular diseases (CVDs) 2021. URL: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds).
2. Концевая А.В., Муканеева Д.К., Игнатьева В.И. и др. Экономика профилактики сердечно-сосудистых заболеваний в Российской Федерации. Российский кардиологический журнал. 2023;28(9):5521. DOI: 10.15829/1560-4071-2023-5521
Kontsevaya A.V., Mukaneeva D.K., Ignatieva V.I. et al. Economics of cardiovascular prevention in the Russian Federation. Russian Journal of Cardiology. 2023;28(9):5521. DOI: 10.15829/1560-4071-2023-5521 (in Russian).
3. Погосова Н.В., Бойцов С.А. Профилактическая кардиология 2024: состояние проблемы и перспективы развития. Кардиология. 2024;64(1):4-13. DOI:10.18087/cardio.2024.1.n2636
Pogosova N.V., Boytsov S.A. Preventive Cardiology 2024: State of Problem Perspectives of Development. Kardiologiia. 2024;64(1):4-13. DOI:10.18087/cardio.2024.1.n2636 (in Russian).
4. Бойцов С.А., Демкина А.Е., Ощепкова Е.В., Долгушева Ю.А. Достижения и проблемы практической кардиологии в России на современном этапе. Кардиология. 2019;59(3):53-59. DOI:10.18087/cardio.2019.3.10242
Boytsov S.A., Demkina A.E., Oshchepkova E.V., Dolgusheva Yu.A. Progress and Problems of Practical Cardiology in Russia at the Present Stage. Kardiologiia. 2019;59(3):53-9. DOI:10.18087/cardio.2019. 3.10242 (in Russian).
5. Намиот Е.Д., Кузнецова В.С., Куставинова Е.В., Карташкина Н.Л. Перспективы использования системы CRISPR/Cas9 для лечения и моделирования сердечно-сосудистых заболеваний (обзор). Журнал медико-биологических исследований. 2021; 9(2): 213-25. DOI: 10.37482/2687-1491-Z059
Namiot E.D., Kuznetsova V.S., Kustinova E.V., Kartokina N.L. Experts on the use of the CRISPR/Cas9 system for the treatment and modeling of cardio-Juror (review). Journal of Biomedical Research. 2021; 9(2): 213–225. DOI: 10.37482/2687-1491-Z059 (in Russian).
6. Колбин А.С., Гомон Ю.М. Перспективы применения системы CRISPR/Cas9 с позиции клинической фармакологии. Клиническая фармакология и терапия. 2024;33(2):7-15. DOI: 10.32756/ 0869-5490-2024-2-7-15
Kolbin A.S., Gomon Yu.M. The use of the CRISPR/Cas9 system from the perspective of clinical pharmacology. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther. 2024;33(2):7-15. DOI: 10.32756/ 0869-5490-2024-2-7-15 (in Russian).
7. Затейщиков Д.А., Фаворова О.О., Чумакова О.С. Молекулярная кардиология: от расшифровки генетической природы и механизмов развития заболевания до внедрения в клиническую практику. Терапевтический архив. 2022;94(4):463-6.
Zateyshchikov D.A., Favorova O.O., Chumakova O.S. Molecular cardiology: from decoding the genetic nature and mechanisms of the diseases development to the introduction into the clinic. Terapevticheskii Arkhiv = Ter Arkh. 2022;94(4):463-6. DOI: 10.26442/00403660. 2022.04.201467 (in Russian).
8. Пестрикова А.А. Правовые и этические нормы редактирования генома человека. Журнал зарубежного законодательства и сравнительного правоведения. 2021;17(5):37-51. DOI: 10.12737/ jflcl.2021.052
Pestrikova A. A. Analysis of Legal and Ethical Standards in the Field of Human Gene Editing. Journal of Foreign Legislation and Comparative Law. 2021;17(5):37-51. DOI: 10.12737/jflcl.2021.052 (in Russian).
9. Zhang Y, Nishiyama T, Li H et al. A consolidated AAV system for single-cut CRISPR correction of a common Duchenne muscular dystrophy mutation. Mol Ther Methods Clin Dev 2021;22:122-32. DOI: 10.1016/j.omtm.2021.05.014
10. Gier RA, Budinich KA, Evitt NH et al. High-performance CRISPR-Cas12a genome editing for combinatorial genetic screening. Nat Commun 2020;11(1):3455. DOI: 10.1038/s41467-020-17209-1
11. Sun W, Wang J, Hu Q et al. CRISPR-Cas12a delivery by DNA-mediated bioresponsive editing for cholesterol regulation. Sci Adv 2020;6(21):eaba2983. DOI: 10.1126/sciadv.aba2983
12. Cebrian-Serrano A, Davies B. CRISPR-Cas orthologues and variants: optimizing the repertoire, specificity and delivery of genome engineering tools. Mamm Genome 2017;28(7-8):247-61. DOI: 10.1007/s00335-017-9697-4
13. Marraffini LA, Sontheimer EJ. CRISPR interference limits horizontal gene transfer in staphylococci by targeting DNA. Science 2008;322(5909):1843-5. DOI: 10.1126/science.1165771
14. Doudna JA, Charpentier E. Genome editing. The new frontier of genome engineering with CRISPR-Cas9. Science 2014;346 (6213):1258096. DOI: 10.1126/science.1258096
15. Zhang LP, Nie YH, Tang T et al. Analysis of Nonhomologous End Joining and Homologous Recombination Efficiency in HEK-293T Cells using GFP Based Reporter Systems. J Vis Exp 2024;(204). DOI: 10.3791/66501
16. Popp MW, Maquat LE. Leveraging Rules of Nonsense-Mediated mRNA Decay for Genome Engineering and Personalized Medicine. Cell 2016;165(6):1319-22. DOI: 10.1016/j.cell.2016.05.053
17. Ma X, Chen C, Veevers J et al. CRISPR/Cas9-mediated gene manipulation to create single-amino-acid-substituted and floxed mice with a cloning-free method. Sci Rep 2017;7:42244. DOI: 10.1038/srep42244
18. Papathanasiou S, Markoulaki S, Blaine LJ et al. Whole chromosome loss and genomic instability in mouse embryos after CRISPR-Cas9 genome editing. Nat Commun 2021;12(1):5855. DOI: 10.1038/s41467-021-26097-y
19. Steczina S, Mohran S, Bailey LRJ et al. MYBPC3-c.772G>A mutation results in haploinsufficiency and altered myosin cycling kinetics in a patient induced stem cell derived cardiomyocyte model of hypertrophic cardiomyopathy. J Mol Cell Cardiol 2024;191:27-39. DOI: 10.1016/j.yjmcc.2024.04.010
20. Ghahremani S, Kanwal A, Pettinato A et al. CRISPR Activation Reverses Haploinsufficiency and Functional Deficits Caused by TTN Truncation Variants. Circulation 2024;149(16):1285-97. DOI: 10.1161/CIRCULATIONAHA.123.063972
21. Gillmore JD, Gane E, Taubel J et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med 2021;385(6):493-502. DOI: 10.1056/NEJMoa2107454
22. Yee AW, Aldeghi M, Blakeley MP et al. A molecular mechanism for transthyretin amyloidogenesis. Nat Commun 2019;10(1):925. DOI: 10.1038/s41467-019-08609-z
23. Чумакова О.С., Насонова С.Н., Фролова Ю.В. и др. Редкий вариант в гене TTR (p.E112K) ассоциирован с развитием системного амилоидоза и новым симптомом – гиперемией кожи в ответ на прием этанола: сегрегационный анализ в семье и обзор литературы. Терапевтический архив. 2023;95(4):335-40. DOI: 10.26442/ 00403660.2023.04.202160
Chumakova O.S., Nasonova S.N., Frolova Y.V. et al. A rare variant in the TTR gene (p.E112K) is associated with systemic amyloidosis and a new symptom – skin hyperemia in response to ethanol intake: family segregation analysis, literature review, and a clinical case. Case report. Terapevticheskii arkhiv. 2023;95(4):335-40. DOI: 10.26442/ 00403660.2023.04.202160 (in Russian).
24. Romano R, Ghahremani S, Zimmerman T et al. Reading Frame Repair of TTN Truncation Variants Restores Titin Quantity and Functions. Circulation 2022;145(3):194-205. DOI: 10.1161/CIRCULATIONAHA.120.049997
25. Yutzey KE. Cardiomyocyte Proliferation: Teaching an Old Dogma New Tricks. Circ Res 2017;120(4):627-9. DOI: 10.1161/CIRCRESAHA.116.310058
26. Wang L, Wang P, Liu Y et al. The HpSGNi system: A compact approach for genetic suppression without sequence limitation in Escherichia coli. J Biotechnol 2024;379:18-24. DOI: 10.1016/j.jbiotec.2023.11.004
27. Wang Y, Feng YL, Liu Q et al. TREX2 enables efficient genome disruption mediated by paired CRISPR-Cas9 nickases that generate 3'-overhanging ends. Mol Ther Nucleic Acids 2023;34:102072. DOI: 10.1016/j.omtn.2023.102072
28. Ran FA, Hsu PD, Wright J et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc 2013;8(11):2281-308. DOI: 10.1038/ nprot.2013.143
29. Komor AC, Kim YB, Packer MS et al. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 2016;533(7603):420-4. DOI: 10.1038/nature17946
30. Anzalone AV, Randolph PB, Davis JR et al. Search-and-replace genome editing without double-strand breaks or donor DNA. Nature 2019;576(7785):149-57. DOI: 10.1038/s41586-019-1711-4
31. Tang L, Yang F, He X et al. Efficient cleavage resolves PAM preferences of CRISPR-Cas in human cells. Cell Regen 2019;8(2):44-50. DOI: 10.1016/j.cr.2019.08.002
32. Miller SM, Wang T, Randolph PB et al. Continuous evolution of SpCas9 variants compatible with non-G PAMs. Nat Biotechnol 2020;38(4):471-81. DOI: 10.1038/s41587-020-0412-8
33. Hu JH, Miller SM, Geurts MH et al. Evolved Cas9 variants with broad PAM compatibility and high DNA specificity. Nature 2018;556(7699): 57-63. DOI: 10.1038/nature26155
34. Gaudelli NM, Komor AC, Rees HA et al. Programmable base editing of AT to GC in genomic DNA without DNA cleavage. Nature 2017; 551(7681):464-71. DOI: 10.1038/nature24644
35. Koblan LW, Doman JL, Wilson C et al. Improving cytidine and adenine base editors by expression optimization and ancestral reconstruction. Nat Biotechnol 2018;36(9):843-6. DOI: 10.1038/nbt.4172
36. Pettinato AM, Ladha FA, Mellert DJ et al. Development of a Cardiac Sarcomere Functional Genomics Platform to Enable Scalable Interrogation of Human TNNT2 Variants. Circulation 2020;142(23):2262-75. DOI: 10.1161/CIRCULATIONAHA.120.047999
37. Hartman JJ, Hwee DT, Robert-Paganin J et al. Aficamten is a small-molecule cardiac myosin inhibitor designed to treat hypertrophic cardiomyopathy. Nat Cardiovasc Res 2024;3(8):1003-16. DOI: 10.1038/s44161-024-00505-0
38. Chai AC, Cui M, Chemello F et al. Base editing correction of hypertrophic cardiomyopathy in human cardiomyocytes and humanized mice. Nat Med 2023;29(2):401-11. DOI: 10.1038/s41591-022-02176-5
39. Reichart D, Newby GA, Wakimoto H et al. Efficient in vivo genome editing prevents hypertrophic cardiomyopathy in mice. Nat Med 2023;29(2):412-21. DOI: 10.1038/s41591-022-02190-7
40. Wu S, Yang P, Geng Z et al. Base editing effectively prevents early-onset severe cardiomyopathy in Mybpc3 mutant mice. Cell Res 2024;34(4):327-30. DOI: 10.1038/s41422-024-00930-7
41. Артемьева С.Б., Белоусова Е.Д., Влодавец Д.В. и др. Опыт применения терапии пропуском экзона 45 у пациентов с прогрессирующей мышечной дистрофией Дюшенна. Медицинская генетика. 2024;23(1):19-25. DOI: 10.25557/2073-7998.2024.01.19-25
Artemyeva S.B., Belousova E.D., Vlodavets D.V. et al. Experience with exon 45 skipping therapy in patients with Duchenne muscular dystrophy. Medical Genetics. 2024;23(1):19-25. DOI: 10.25557/2073-7998.2024.01.19-25 (in Russian).
42. Lin J, Jin M, Yang D et al. Adenine base editing-mediated exon skipping restores dystrophin in humanized Duchenne mouse model. Nat Commun 2024;15(1):5927. DOI: 10.1038/s41467-024-50340-x
43. Lebek S, Chemello F, Caravia XM et al. Ablation of CaMKIIδ oxidation by CRISPR-Cas9 base editing as a therapy for cardiac disease. Science 2023;379(6628):179-85. DOI: 10.1126/science.ade1105
44. Kurt IC, Zhou R, Iyer S et al. CRISPR C-to-G base editors for inducing targeted DNA transversions in human cells. Nat Biotechnol 2021;39(1):41-6. DOI: 10.1038/s41587-020-0609-x
45. Chen PJ, Liu DR. Prime editing for precise and highly versatile genome manipulation. Nat Rev Genet 2023r;24(3):161-77. DOI: 10.1038/ s41576-022-00541-1
46. Nishiyama T, Zhang Y, Cui M et al. Precise genomic editing of pathogenic mutations in RBM20 rescues dilated cardiomyopathy. Sci Transl Med 2022;14(672):eade1633. DOI: 10.1126/scitranslmed.ade1633
47. Davis JR, Banskota S, Levy JM et al. Efficient prime editing in mouse brain, liver and heart with dual AAVs. Nat Biotechnol 2024;42(2):253-64. DOI: 10.1038/s41587-023-01758-z
48. Gjaltema RAF, Goubert D, Huisman C et al. KRAB-Induced Heterochromatin Effectively Silences PLOD2Gene Expression in Somatic Cells and is Resilient to TGFβ1 Activation. Int J Mol Sci 2020;21(10):3634. DOI: 10.3390/ijms21103634
49. Nuñez JK, Chen J, Pommier GC et al. Genome-wide programmable transcriptional memory by CRISPR-based epigenome editing. Cell 2021;184(9):2503-19.e17. DOI: 10.1016/j.cell.2021.03.025
50. Kwon DY, Zhao YT, Lamonica JM, Zhou Z. Locus-specific histone deacetylation using a synthetic CRISPR-Cas9-based HDAC. Nat Commun 2017;8:15315. DOI: 10.1038/ncomms15315
51. Wen X, Han M, Hosoya M et al. Identification of BRAF Inhibitor Resistance-associated lncRNAs Using Genome-scale CRISPR-Cas9 Transcriptional Activation Screening. Anticancer Res 2024;44(6):2349-58. DOI: 10.21873/anticanres.17042
52. Chavez A, Scheiman J, Vora S et al. Highly efficient Cas9-mediated transcriptional programming. Nat Methods 2015;12(4):326-8. DOI: 10.1038/nmeth
53. Gilbert LA, Larson MH, Morsut L et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell 2013;154(2):442-51. DOI: 10.1016/j.cell.2013.06.044
54. Drouin LM, Agbandje-McKenna M. Adeno-associated virus structural biology as a tool in vector development. Future Virol 2013;8(12):1183-99. DOI: 10.2217/fvl.13.112
55. Schoger E, Carroll KJ, Iyer LM et al. CRISPR-Mediated Activation of Endogenous Gene Expression in the Postnatal Heart. Circ Res 2020;126(1):6-24. DOI: 10.1161/CIRCRESAHA.118.314522
56. Zhang R, Liu J, Xue G et al. Forced activation of dystrophin transcription by CRISPR/dCas9 reduced arrhythmia susceptibility via restoring membrane Nav1.5 distribution. Gene Ther 2023;30(1-2):142-9. DOI: 10.1038/s41434-022-00348-z
57. Cirino AL, Cuddy S, Lakdawala NK. Deletion of entire LMNA gene as a cause of cardiomyopathy. Heart Rhythm Case Rep 2020;6(7):395-397. DOI: 10.1016/j.hrcr.2020.03.008
58. Anzalone AV, Gao XD, Podracky CJ et al. Programmable deletion, replacement, integration and inversion of large DNA sequences with twin prime editing. Nat Biotechnol 2022;40(5):731-40. DOI: 10.1038/s41587-021-01133-w
59. Yarnall MTN, Ioannidi EI, Schmitt-Ulms C et al. Drag-and-drop genome insertion of large sequences without double-strand DNA cleavage using CRISPR-directed integrases. Nat Biotechnol 2023;41(4):500-12. DOI: 10.1038/s41587-022-01527-4
60. Jaski BE, Jessup ML, Mancini DM et al; Calcium Up-Regulation by Percutaneous Administration of Gene Therapy In Cardiac Disease (CUPID) Trial Investigators. Calcium upregulation by percutaneous administration of gene therapy in cardiac disease (CUPID Trial), a first-in-human phase 1/2 clinical trial. J Card Fail 2009;15(3):171-81. DOI: 10.1016/j.cardfail.2009.01.013
61. Greig JA, Martins KM, Breton C et al. Integrated vector genomes may contribute to long-term expression in primate liver after AAV administration. Nat Biotechnol 2024;42(8):1232-42. DOI: 10.1038/s41587-023-01974-7
62. Naso MF, Tomkowicz B, Perry WL 3rd, Strohl WR. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs 2017;31(4):317-34. DOI: 10.1007/s40259-017-0234-5
63. Tabebordbar M, Lagerborg KA, Stanton A et al. Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species. Cell 2021;184(19):4919-4938.e22. DOI: 10.1016/j.cell.2021.08.028
64. Hinderer C, Katz N, Buza EL et al. Severe Toxicity in Nonhuman Primates and Piglets Following High-Dose Intravenous Administration of an Adeno-Associated Virus Vector Expressing Human SMN. Hum Gene Ther 2018;29(3):285-298. DOI: 10.1089/hum.2018.015
65. Kim E, Koo T, Park SW et al. In vivo genome editing with a small Cas9 orthologue derived from Campylobacter jejuni. Nat Commun 2017;8:14500. DOI: 10.1038/ncomms14500
66. Appleby JH, Zhou K, Volkmann G, Liu XQ. Novel split intein for trans-splicing synthetic peptide onto C terminus of protein. J Biol Chem 2009;284(10):6194-9. DOI: 10.1074/jbc.M805474200
67. Ling X, Chang L, Chen H et al. Improving the efficiency of CRISPR-Cas12a-based genome editing with site-specific covalent Cas12a-crRNA conjugates. Mol Cell 2021;81(22):4747-4756.e7. DOI: 10.1016/j.molcel. 2021.09.021
68. Kenjo E, Hozumi H, Makita Y et al. Low immunogenicity of LNP allows repeated administrations of CRISPR-Cas9 mRNA into skeletal muscle in mice. Nat Commun 2021;12(1):7101. DOI: 10.1038/s41467-021-26714-w
69. Palaz F. Death after High-Dose rAAV9 Gene Therapy in a Patient with Duchenne's Muscular Dystrophy. N Engl J Med 2023;389(23):2210-2211. DOI: 10.1056/NEJMc2312288.
70. Mitchell MJ, Billingsley MM, Haley RM et al. Engineering precision nanoparticles for drug delivery. Nat Rev Drug Discov 2021;20(2):101-24. DOI: 10.1038/s41573-020-0090-8
71. Wei T, Sun Y, Cheng Q et al. Lung SORT LNPs enable precise homology-directed repair mediated CRISPR/Cas genome correction in cystic fibrosis models. Nat Commun 2023;14(1):7322. DOI: 10.1038/s41467-023-42948-2
72. Musunuru K, Chadwick AC, Mizoguchi T et al. In vivo CRISPR base editing of PCSK9 durably lowers cholesterol in primates. Nature 2021;593(7859):429-34. DOI: 10.1038/s41586-021-03534-y
24 февраля 2025
Количество просмотров: 9289

