Клинический разбор в общей медицине №1 2025
1 Federal Center of Brain Research and Neurotechnologies, Moscow, Russia;
2 Pirogov Russian National Research Medical University, Moscow, Russia
g.sadekova.neuro@gmail.com
Abstract
Acute disseminated encephalomyelitis is an acute autoimmune inflammatory disease of the central nervous system, which is traditionally considered as a monophasic demyelinating process that develops mainly in children and adolescents. In recent years, the number of cases of relapsing forms of this disease has increased, however, the etiological and pathogenetic factors of chronic demyelinating process after the onset of the disease have not been sufficiently studied. We searched for publications devoted to relapsing forms of acute disseminated encephalomyelitis in the information databases PubMed, Scopus and Mendeley. This article provides an overview of current concepts of the diagnosis and treatment of acute disseminated encephalomyelitis, issues of differential diagnosis with other demyelinating diseases based on the clinical features, neuroimaging findings and specific biomarkers. The literature data on relapsing forms of the disease, prognostic factors of chronic of demyelinating process, including evolution into multiple sclerosis.
Keywords: acute disseminated encephalomyelitis, mulphasic acute disseminated encephalomyelitis, prognostic factors, multiple sclerosis.
For citation: Sadekova G.I., Omarova M.A., Boyko A.N. Relapsing forms of acute disseminated encephalomyelitis: current concepts of diagnosis and treatment, possible causes of chronic demyelinating process. Clinical review for general practice. 2025; 6 (1): 80–87 (In Russ.). DOI: 10.47407/kr2024.6.01.00p435
Изучение прогностических факторов хронизации демиелинизирующего процесса после перенесенного ОРЭМ имеет важное клиническое значение для своевременной диагностики и лечения демиелинизирующих заболеваний.
Этиология и патогенез
ОРЭМ считается постинфекционным заболеванием ЦНС. В 50–85% случаев развитию ОРЭМ предшествует инфекция или вакцинация. Чаще всего ОРЭМ ассоциирован с предшествующей вирусной инфекцией дыхательных путей и желудочно-кишечного тракта. Среди микроорганизмов, ассоциированных с ОРЭМ, чаще встречается цитомегаловирус, вирус Эпштейна–Барр, вирус простого герпеса, вирус герпеса человека-6, вирус гриппа, вирус гепатита А, вирус иммунодефицита человека, Mycoplasma pneumoniae, лептоспиры, β-гемолитические стрептококки и Borrelia burgdorferi, хотя в большинстве случаев возбудитель остается неиндентифицированным. В большинстве случаев ОРЭМ развивается через нескольких дней и до 2 мес после вирусной или бактериальной инфекции (в среднем 26 дней) [1, 3]. ОРЭМ может развиваться после вакцинации от бешенства, кори, коклюша, столбняка, гриппа, гепатита В, дифтерии, краснухи, пневмококка, ветряной оспы, вируса папилломы человека, полиомиелита, SARS-CoV-2 [3].
Считается, что основу патогенеза ОРЭМ составляет аутоиммунный и воспалительный процесс в ЦНС, возникающий под воздействием факторов окружающей среды (инфекция, вакцинация) и развивающийся у людей с генетической предрасположенностью [2].
Одним из главных механизмов иммуноопосредованного повреждения ЦНС является «молекулярная мимикрия» – перекрестная реакция антител, вырабатываемых в ответ на воздействие микроорганизмов с аутоантигенами миелина [основным белком миелина, протеолипидным белком и миелин-олигодендроцитарным гликопротеином – МОГ (антитела к МОГ)], приводящая к активации гуморальных и клеточных иммунных реакций и, как следствие, к демиелинизирующему процессу [1, 2, 4, 5]. Эта гипотеза подтверждается наличием аутоантител иммуноглобулина (Ig) G и Т-хелперных клеток, реагирующих на белок миелина, у пациентов с ОРЭМ. Последующая активация воспалительного каскада приводит к увеличению проницаемости сосудов, отеку и разрушению гематоэнцефалического барьера. Антитела к МОГ были обнаружены как в сыворотке крови, так и в ликворе пациентов во время острой фазы заболевания, и их количество постепенно снижалось в процессе выздоровления. Экспрессия МОГ в зрелых олигодендроцитах предполагает его возможную роль в созревании самих олигодендроцитов, а также играет ключевую роль в поддержании целостности миелина, в адгезии и взаимодействии между клетками [2].
При исследовании уровня провоспалительных цитокинов в ликворе у пациентов с ОРЭМ было описано повышение тех цитокинов, которые связаны с Th1- и
Th2-клетками. Уровень цитокинов, связанных с макрофагами/микроглией, также был повышен, что указывает на роль врожденного иммунитета при ОРЭМ. Во всех исследованиях интерлейкин (ИЛ)-6 был одним из цитокинов, который, по-видимому, регулярно повышался у пациентов с ОРЭМ и коррелировал с обнаружением олигоклональных иммуноглобулинов (ОКИ) и антител к МОГ [5].
Среди других воспалительных факторов, потенциально связанных с развитием ОРЭМ, S. Yang и соавт. были отмечены фактор роста нервов бета (β-NGF), цистатин D, ИЛ-7, пептидный трансформирующий фактор роста β1 (TGF-β1) и нейротрофин-3 (NT-3) [6].
Обнаружение специфических воспалительных факторов, участвующих в патогенезе ОРЭМ, имеет важное прогностическое значение для разработки патогенетических методов лечения.
Эпидемиология
Частота ОРЭМ среди детской популяции варьируется от 0,07 до 0,9 на 100 тыс. населения. Пик заболеваемости среди детей приходит на возраст от 5 до 8 лет.
У взрослых случаи ОРЭМ зафиксированы в возрасте от 18 до 82 лет со средним возрастом от 33 до 41 года [1]. Заболевание чаще регистрируется у мужчин, чем у женщин, с соотношением 1,3:1 [3]. Отмечается тенденция к росту заболеваемости в зимне-весенний период. Географическое распределение аналогично таковому при рассеянном склерозе (РС) с распространенностью, которая увеличивается с удалением от экватора [2, 5].
Клиническая картина
ОРЭМ характеризуется мультифокальной неврологической симптоматикой, быстро прогрессирующей в течение нескольких дней или недель [3]. Клиническая картина ОРЭМ неоднородна. Наиболее распространенными клиническими проявлениями ОРЭМ были пирамидные признаки, двигательный дефицит, нарушения походки, стволовые симптомы и энцефалопатия [7]. Как правило, у пациентов наблюдаются продромальные симптомы, такие как лихорадка, головная боль, общая слабость, тошнота и рвота. Острая фаза наступает с появлением энцефалопатии, облигатного признака ОРЭМ, характеризующейся изменением поведения (раздражительностью, спутанностью сознания) и сознания (летаргия, сопор, кома), связанными с мультифокальным или очаговым неврологическим дефицитом в зависимости от области, вовлеченной в процесс демиелинизации [2, 8]. При поражении затылочной доли и зрительной коры у пациентов могут наблюдаться нарушения зрения – от одноименных дефектов полей зрения до кортикальной слепоты. Поражение ассоциативных областей коры вызывает афазию, алексию, аграфию или акалькулию. Пирамидные признаки, такие как парезы/плегия, гиперрефлексия, спастичность и симптом Бабинского, могут возникать, если в патологический процесс вовлечена двигательная кора головного мозга (ГМ). Сенсорные нарушения включают аграфестезию, астереогнозию, потерю проприоцепции и изменение восприятия боли и температуры. Поражение зрительного нерва может привести к отеку диска зрительного нерва и одностороннему или двустороннему невриту зрительного нерва. Поражение ствола ГМ приводит к нарушению функции III–XII черепно-мозговых нервов (диплопия, нарушение экстраокулярных движений, дисфагия, дизартрия, нистагм, головокружение, атаксия, нарушение слуха и вкуса), нарушению сознания и к дыхательной недостаточности. Повреждение спинного мозга может вызвать вялый паралич с нарушением дефекации и мочеиспускания. Судороги нередки и могут быть фокальными или генерализованными [2].
Другие атипичные симптомы включают менингеальные признаки, дистонию или паркинсонизм, хореоподобные движения и нервно-психические симптомы (изменение поведения, раздражительность, агрессия). ОРЭМ у детей характеризуется симптомами менингоэнцефалита, включающими энцефалопатию, лихорадку, головную боль, тошноту и рвоту [2, 5].
У некоторых взрослых наблюдаются признаки поражения периферической нервной системы (ПНС) в виде парестезией, гипестезий и атрофии мышц. Пациенты с ОРЭМ с поражением ПНС обычно имеют худший прогноз и повышенный риск рецидива заболевания по сравнению с пациентами с поражением только ЦНС [1].
Подходы к диагностике
Предпочтительным методом диагностики ОРЭМ является магнитно-резонансная томография (МРТ). Для МРТ-картины ГМ при ОРЭМ характерно наличие гиперинтенсивных очагов с нечеткими границами на
Т2-взвешенных изображениях, FLAIR. Очаги обычно не визуализируются на Т1-взвешенных изображениях, хотя более крупные очаги могут проявляться как гипоинтенсивные. Наиболее характерно, что ОРЭМ проявляется в виде множественных, широко распространенных, асимметричных поражений >1–2 см в диаметре, с нечеткими краями с обеих сторон по всему ГМ [1–3, 5, 8, 9]. У большинства пациентов с ОРЭМ выявляется вазогенный отек ГМ на диффузно-взвешенных изображениях (DWI) [7]. Чаще всего наблюдается поражение глубокого и подкоркового вещества, реже – перивентрикулярного белого вещества, иногда – базальных ганглиев, таламуса, коры. Могут быть дополнительные инфратенториальные поражения ствола ГМ, мозжечка и спинного мозга, но они редко проявляются как изолированные поражения без сопутствующего поражения ГМ. При геморрагическом и сверхостром вариантах ОРЭМ могут обнаруживаться области острого кровоизлияния [1–3]. Характерным признаком является отсутствие диссеминации патологического процесса во времени по данным нейровизуализации (отсутствие гипоинтенсивных очагов в режиме Т1-взвешенных изображений, одновременное накопление контрастного вещества всеми очагами) [4].
У взрослых поражение СМ на МРТ может быть представлено продольно-распространенным поперечным миелитом (LETM), который в значительной степени связан с серопозитивным вариантом заболевания спектра оптиконевромиелита (ЗСОНМ), но у детей чаще встречаются более протяженные очаги. Короткие, клиновидные, эксцентрические очаги чаще наблюдаются при РС. Миелит, связанный с антителами к МОГ, может сопровождаться LETM, и в этих поражениях преобладает поражение серого вещества, что иногда затрудняет дифференциальную диагностику с острым вялым миелитом (AFM) [8].
Наличие 2 или более перивентрикулярных очагов, наличие симптома «черных дыр» на T1-взвешенных изображениях и отсутствие двустороннего характера поражения во время первого демиелинизирующего эпизода характерны для РС [1].
Компьютерная томография (КТ) является менее информативным методом диагностики ОРЭМ. КТ-признаки поражения вещества ГМ могут отсутствовать, однако в субкортикальном белом веществе иногда выявляются неспецифические очаги, накапливающие или не накапливающие контрастное вещество. В дальнейшем на КТ наблюдается диффузное снижение плотности белого вещества (признак распространенной демиелинизации) [10].
Электроэнцефалография используется как дополнительный метод диагностики у пациентов с судорожным синдромом в клинической картине ОРЭМ. Электроэнцефалография может выявить замедление биоэлектрической активности, а также, в некоторых случаях, эпилептиформную активность [3].
Диагностика и дифференциальный диагноз
Диагноз ОРЭМ является клиническим и подтверждается с помощью данных нейровизуализации. До сих пор нет конкретных биологических маркеров, подтверждающих диагноз, что является целью дальнейших исследований. При постановке диагноза необходимо проводить дифференциальную диагностику путем исключения заболеваний, имитирующих ОРЭМ [2, 5]. Первоочередной задачей является исключение острой бактериальной или вирусной инфекции ЦНС, поскольку ОРЭМ часто проявляется как острый менингоэнцефалит. Поэтому необходимо как можно скорее провести люмбальную пункцию с исследованием ликвора с применением культуральных методов, вирусологических исследований (на вирусы простого герпеса 1 и 2-го типа, энтеровирус, вирус гриппа, вирус Эпштейна–Барр, вирус ветряной оспы, вирус Западного Нила, цитомегаловирус) и бактериальных/вирусных серологических исследований (антитела к боррелии, бледной трепонеме, микоплазме, вирусу краснухи) [2, 3]. Метагеномное секвенирование нового поколения все чаще используется для диагностики менее распространенных инфекций ЦНС [8].
Показатели ликворограммы у пациентов с ОРЭМ могут быть в пределах референсных значений или демонстрировать умеренный плеоцитоз с преобладанием лимфоцитов и моноцитов, повышенный уровень белка (в 50–80% случаев). У 1/3 пациентов обнаруживается интратекальный синтез олигоклональных антител, который может быть транзиторным [2, 4, 5].
Является необходимым проводить дифференциальную диагностику ОРЭМ с другими аутоиммунными заболеваниями ЦНС. В настоящее время определен спектр аутоиммунных заболеваний ЦНС, при которых могут образовываться следующие антитела [3]:
1) антитела к нейронам – антитела к внутриклеточным белкам (Hu, Yo, Ma2);
2) антитела к внеклеточным мембранным белкам (аквапорину 4 – AQP-4, антитела к МОГ, LGI1, CASPR2, рецептору глицина, GABAA-рецептору, GABAB-рецептору, AMPA-рецептору, mGluR5, DPPX, D2R, IgLON5, neurexin 3α, mGluR1 и др.);
3) антитела к внутриклеточным белкам, которые могут выходить на поверхность во время экзоцитоза синаптических пузырьков (amphiphysin, septin 5, synapsin);
4) антитела к другим структурам ЦНС (внеклеточный мембранный белок астроцитов GFAP);
5) антитела, поражающие не только нервную систему, но и другие системы органов (системные аутоиммунные заболевания).
Международная группа по изучению РС у детей (The International Pediatric Multiple Sclerosis Study Group – IPMSSG) разработала современные диагностические критерии (см. таблицу), опубликованные в 2007 г. и обновленные в 2013 г., которые определяют ОРЭМ как острый демиелинизирующий эпизод, для которого характерно наличие энцефалопатии, полиочагового поражения ЦНС и очагов демиелинизации по данным МРТ [1–3, 5, 8].
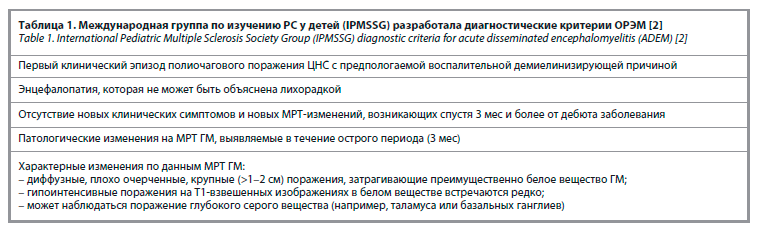
Однако критерии диагностики IPMSSG подвергаются критике в связи с необходимостью таких признаков для постановки диагноза, как энцефалопатия и многоочаговое поражение ЦНС, которые обнаруживаются не во всех случаях. По данным M. Boesen и соавт., даже у детей диагноз ОРЭМ ставится в полном соответствии с критериями IPMSSG лишь в 35% случаев. Диагностические критерии ОРЭМ для взрослых не разработаны [4].
Клинические и нейровизуализационные характеристики ОРЭМ существенно различаются в зависимости от возраста. Применение диагностических критериев IPMSSG ко всем взрослым с диагнозом ОРЭМ приводит к тому, что более чем в 1/2 случаев диагноз не верифицируется [7].
Дифференциальный диагноз ОРЭМ проводится с первым клиническим демиелинизирующим эпизодом РС, МОГ-IgG-ассоциированным заболеванием, острым вирусным энцефалитом, метастатическим поражением ГМ [1]. При возникновении полисимптомной энцефалопатии (например, двигательных расстройств, судорог, психоза) при дифференциальной диагностике
следует учитывать энцефалит, вызванный анти-NMDA-рецепторами, лимбический энцефалит, энцефалит
Хашимото и энцефалит Рассмусена. Кроме того, дифференциальный диагноз ОРЭМ должен включать злокачественные новообразования ЦНС, пищевые, токсические и нейрометаболические нарушения (особенно митохондриопатии) [2].
Наиболее сложной представляется дифференциальная диагностика ОРЭМ с ОРЭМ-подобным началом РС. Точная диагностика любого из этих состояний имеет важное значение, поскольку подход к лечению этих двух заболеваний существенно различается. У пациентов с ОРЭМ в анамнезе часто отмечаются симптомы продромального периода вирусных заболеваний, такие как: лихорадка, ригидность затылочных мышц, остро возникшая атаксия, нарушение сознания и энцефалопатия, которые являются не характерными для РС. Различается и МРТ-картина поражения ГМ и спинного мозга при ОРЭМ и РС. Для ОРЭМ характерны обширные, двусторонние, асимметричные поражения с нечеткими границами. Поражения области таламуса чаще наблюдаются при ОРЭМ, в то время как перивентрикулярные очаги демиелинизации чаще встречаются при РС [1]. Для того чтобы отличить ОРЭМ от РС во время первого клинического эпизода, потенциально полезны три признака [5]:
1) два или более перивентрикулярных поражения;
2) наличие симптома «черных дыр»;
3) отсутствие двустороннего характера поражения ГМ.
При наличии двух из этих трех признаков вероятность РС выше, чем ОРЭМ. Тем не менее следует отметить, что эти критерии не являются диагностическими.
Исследование олигоклональных антител рекомендуется для проведения дифференциальной диагностики с РС, так как 2-й тип их синтеза часто встречается при РС и редко – при ОРЭМ. При РС, как правило, не определяются антитела к МОГ, тогда как при ОРЭМ в 40% случаев возможно их обнаружение [3].
При отрицательном анализе на антитела к МОГ и обнаружении в сыворотке крови антител к AQP-4 следует заподозрить ЗСОНМ. Также в пользу данного диагноза могут свидетельствовать синдром area postrema (эпизоды икоты или тошноты и рвоты, необъяснимой другими причинами), симптоматическая нарколепсия или острый клинический синдром поражения промежуточного мозга. Кроме того, расстройства из спектра оптиконевромиелита более характерны для пациентов женского пола, дебют заболевания отмечается во взрослом возрасте; поражение спинного мозга наблюдается чаще, чем зрительных нервов; оптический неврит в дебюте заболевания чаще односторонний [3].
В некоторых случаях возникают трудности в дифференциальной диагностике ОРЭМ со злокачественными новообразованиями ГМ. Тогда может проводиться исследование ликвора цитологическим методом и методом проточной цитометрии, редко возникает необходимость в биопсии ГМ [3].
Терапия ОРЭМ
В настоящее время не существует рандомизированных плацебо-контролируемых исследований, устанавливающих подходы к лечению ОРЭМ. Стандартом терапии является неспецифическая иммуносупрессивная терапия, включающая глюкокортикостероиды (ГКС), внутривенные иммуноглобулины (ВВИГ) и плазмаферез. Лечение 1-й линии состоит из внутривенного введения высоких доз ГКС с последующим переходом на пероральный прием с постепенным снижением дозы.
В большинстве случаев доза пероральных ГКС начинается с использования преднизолона в дозе 1–2 мг/кг в сутки, а затем постепенно снижается в течение 4–6 нед [2, 5]. Раннее прекращение приема ГКС (менее 3 нед) может увеличить риск рецидива заболевания [5, 8]. Механизмы действия ГКС в высоких дозах включают подавление продукции воспалительных цитокинов, ингибирование активации Т-клеток, уменьшение проникновения иммунных клеток в ЦНС и облегчение апоптоза активированных иммунных клеток [8].
Использование внутривенного Ig и плазмафереза считается терапией 2-й линии у пациентов с резистентностью к ГКС, а также у пациентов с противопоказаниями к применению ГКС и рецидивами ОРЭМ. Плазмаферез следует рассматривать на ранних стадиях молниеносного течения ОРЭМ [2]. Weinshenker и соавт. исследовали эффективность плазмафереза при лечении пациентов с тяжелыми демиелинизирующими заболеваниями ЦНС, не реагирующими на ГКС, в рандомизированном контролируемом исследовании по сравнению с плацебо. Исследование выявило улучшение неврологического статуса пациентов, которым проводился плазмаферез, по сравнению с другими участниками исследования. Плазмаферез обычно состоит из 3–6 сеансов с различным графиком проведения – от ежедневного использования до проведения через 1 день или в течение 10–14 дней. Некоторые клинические и рентгенологические характеристики заболевания могут быть полезны для принятия решения о выборе плазмафереза в пользу других методов терапии. Kozioelk и соавт. представили ретроспективное исследование, включающее 3 клинических случая ОРЭМ: у 2 пациентов развились двигательные симптомы, а у 1 пациента наблюдался рецидив ОРЭМ с невритом зрительного нерва. После лечения ГКС в высоких дозах и отсутствия клинического улучшения этим пациентам проведен плазмаферез с хорошим ответом на проводимую терапию. Показанием к плазмаферезу в данном случае являлись оценка по шкале EDSS≥6 или тяжелая потеря зрения (≤0,2) на одном глазу и отсутствие изменений симптомов по крайней мере после 5 дней применения ГКС в высоких дозах. Khurana и соавт. предложили использовать плазмаферез при наличии МРТ-признаков поражения глубокого серого вещества и ствола ГМ, которые могут быть связаны с отсутствием реакции на терапию ГКС [2].
Возможным фактором, свидетельствующим о неэффективности использования ГКС, является поражение ПНС. В таких случаях использование ВВИГ в дозировке 2 г/кг массы тела в течение 2–5 дней является терапевтическим вариантом [2, 5]. В качестве терапии 2-й линии ВВИГ могут назначаться в качестве монотерапии или в сочетании со вторым курсом ГКС, так как их совместное применение может оказывать синергетический эффект. Сообщалось о применении циклофосфамида у взрослых пациентов с ОРЭМ, которые не реагировали на стандартную терапию [2].
Прогноз
Прогноз при ОРЭМ сильно варьирует в зависимости от возраста пациента, показателей клинической картины и результатов МРТ-диагностики, а также наличия антител к МОГ. Наиболее тяжелые случаи ОРЭМ представляют собой острый геморрагический лейкоэнцефалит и острый некротизирующий лейкоэнцефалит, которые характеризуются кровоизлияниями в очагах демиелинизации. Предполагалось, что острый геморрагический лейкоэнцефалит является гиперострым вариантом ОРЭМ, но из-за различий в патофизиологии (увеличения количества нейтрофилов, разрушения мелких сосудов с отложением фибрина и кровоизлияний) он также рассматривался как отдельное заболевание [1, 11]. При монофазном течении ОРЭМ летальный исход может достигать 30% случаев. От 50 до 80% пациентов полностью выздоравливают при монофазном течении ОРЭМ. Около 25% госпитализированных детей нуждаются в интенсивной терапии, при этом смертность составляет от 1 до 3%. Взрослые чаще попадают в отделения интенсивной терапии, дольше находятся в стационаре, чаще наблюдаются летальные исходы [1].
Среди прогностических неблагоприятных факторов функционального восстановления после ОРЭМ у детей были выделены следующие: отсутствие продромальной головной боли, наличие миоклонуса в клинической картине заболевания и обнаружение очагового поражения мозжечка по данным МРТ ГМ [12]. Стоит отметить, что развитие миоклонуса как варианта двигательного расстройства у взрослых в дебюте ОРЭМ не является характерным и описано по данным литературы у пациентки с новой коронавирусной инфекцией (SARS-CoV-2) [13].
В большинстве случаев ОРЭМ протекает монофазно с возвращением к исходному неврологическому уровню в течение 3 мес после появления первых симптомов [2]. У 10–36% пациентов развивается повторный демиелинизирующий эпизод после перенесенного ОРЭМ [5].
Для оценки динамики демиелинизирующего процесса и последующего развития мультифазный ОРЭМ (МРЭМ) необходимо повторное проведение нейровизуализации (МРТ) не ранее чем через 3 мес после первого клинического эпизода, поскольку результаты радиологических исследований могут колебаться в течение этого периода времени [5].
Рецидивирующие формы ОРЭМ
Любые клинические симптомы и рентгенологические признаки ОРЭМ, проявляющиеся в течение следующих 3 мес с момента начала заболевания, считаются частью первоначального события. Когда второй эпизод ОРЭМ возникает по крайней мере через 3 мес после первого эпизода, он определяется как МРЭМ. Второй эпизод ОРЭМ может характеризоваться новыми или предшествующими неврологическими симптомами, признаками и поражениями по данным МРТ [2, 5].
МРЭМ у взрослых – это редкое заболевание с нетипичным течением, которое вызывает трудности диагностики. Asif и соавт. описал клинический случай
59-летнего мужчины, у которого было диагностировано два эпизода ОРЭМ, произошедших с временным интервалом в 26 лет, в отсутствие какой-либо недавней вирусной инфекции, вакцинации или других классических причин [14].
Три или более клинических эпизода позволяют пересмотреть диагноз ОРЭМ и рассмотреть другое хроническое заболевание, такое как РС, – заболевание, ассоциированное с антителами к МОГ, или ЗСОНМ. Иногда эти расстройства могут сливаться, как при ОРЭМ-оптическом неврите (ОРЭМ-ОН), который является подтипом рецидивирующего ОРЭМ, связанным с повторяющимися эпизодами неврита зрительного нерва без энцефалопатии [2, 5]. Частота эпизодов одностороннего воспаления зрительных нервов может достигать 9, иногда в сочетании с дальнейшими приступами, подобными ОРЭМ. Интересно, что у детей во время рецидива ОН редко обнаруживаются новые повреждения при МРТ [5].
W. Zang и соавт. провели ретроспективное исследование с целью анализа клинических, лабораторных, нейровизуализационных показателей 56 пациентов с ОРЭМ, из которых у 1/4 больных развился МРЭМ. Было отмечено, что некоторые исходные клинические характеристики могут быть использованы для различия монофазного и многофазного течения. Например, у пациентов с МРЭМ часто наблюдаются симптомы поражения зрительного нерва и вегетативной нервной системы. Кроме того, МРЭМ чаще встречается у женщин, пациентов с обнаружением ОКИ и пациентов с поражениями серого вещества коры ГМ, подкоркового белого вещества, а также с супратенториальными и инфратенториальными поражениями, выявленными по данным МРТ ГМ [9].
Выделяют и другие рецидивирующие формы ОРЭМ, такие как: ОРЭМ-РС и ОРЭМ-ЗСОНМ. ОРЭМ-РС характеризуется развитием нового клинического эпизода спустя 3 мес после перенесенного ОРЭМ с появлением очагов демиелинизации по данным МРТ, соответствующих критериям МакДональда для РС. Для ОРЭМ-ЗСОНМ характерно развитие ОН, миелита, поражения зоны area postrema с соблюдением диагностических критериев заболевания [5].
В связи с этим выявление сывороточных аутоантител, нацеленных на антигены ЦНС, может помочь исключить диагноз ОРЭМ и предсказать клинический исход, хотя их роль в патогенезе заболевания не ясна. Персистенция антител к МОГ была связана как с МРЭМ, так и с ОРЭМ-ОН. Однако антитела к МОГ не являются специфичными для ОРЭМ и были обнаружены у пациентов с ОН, поперечным миелитом и ЗСОНМ. Наличие сывороточных антител IgG к AQP-4 может помочь дифференцировать ОРЭМ от ЗСОНМ, поскольку они ассоциированы с ЗСОНМ, но не с ОРЭМ [2].
Прогностические факторы хронизации демиелинизирующего процесса после ОРЭМ
Понимание предикторов прогрессирования от первого демиелинизирующего события ко второму (и прежде всего диагноза РС) имеет важное клиническое значение.
L. Papetti и соавт. провели ретроспективное исследование, включающее 91 пациента ≤16 лет с острым демиелинизирующим эпизодом (ОДЭ) с целью выявления возможных прогностических факторов хронизации демиелинизирующего процесса и развития РС. Среди 33 пациентов с ОРЭМ у 7 пациентов в последующем диагностирован РС. Было установлено, что антитела класса IgG к вирусу Эпштейна–Барр были обнаружены у 100% пациентов с ОРЭМ, у которых развился РС, и только у 34,6% пациентов с монофазным ОРЭМ. Обнаружение ОКИ в ликворе у пациентов являлось важным предиктором развития РС (р<0,001), однако наличие ОКИ в ликворе не является патогномоничным признаком для РС, так как они выявляются у 8–15% детей с ОДЭ, у которых не развивается РС. Среди нейровизуализационных прогностических показателей развития РС после ОДЭ отмечены [15]:
1) наличие хотя бы одного перивентрикулярного очага демиелинизации;
2) наличие хотя бы одного очага демиелинизации в мозолистом теле;
3) хотя бы один гипоинтенсивный очаг на Т1-взвешенном изображении.
Прогностически неблагоприятными нейровизуализационными факторами у детей с ОРЭМ, по данным S. Arktout, являются: симметричные зоны поражения височных, теменных и затылочных долей по данным первой выполненной МРТ ГМ и наличие очагов демиелинизации в лобных или теменных долях на последующей МРТ ГМ [16].
У некоторых пациентов с рецидивирующими формами ОРЭМ были выявлены антитела к МОГ, для которых было характерно более частое развитие ОН и LETM [1, 2]. Как правило, обнаружение антител к МОГ в высоких титрах характерно для дебюта ОРЭМ с дальнейшим снижением их уровня до полного отсутствия после выздоровления [17]. Пациенты с антителами к МОГ, по-видимому, реагируют на стероидную терапию, демонстрируя монофазное течение заболевания и лучший исход, особенно при переходе в серонегативный статус [2]. У ряда пациентов наблюдается более двух приступов ОРЭМ в сочетании с обнаружением антител к МОГ [5]. Высокий титр (>1:1280) и персистенция антител к МОГ в крови пациентов считается одним из прогностических факторов развития РС, рецидивов ОН и неполного восстановления ОРЭМ [11, 17].
Второе демиелинизирующее событие обычно происходит в течение следующих 12 мес, но временной интервал и частота приступов значительно варьируются у разных пациентов и развитие повторного события может занять до 4 лет. У детей с ОРЭМ и последующими рецидивирующими демилиенизирующими эпизодами на фоне отсутствия антител к МОГ в сыворотке крови с большей вероятностью со временем будет поставлен альтернативный диагноз [5].
Доказательства патогенности и персистентности антител к МОГ у пациентов как с монофазной, так и с рецидивирующей формами ОРЭМ все еще находятся в стадии разработки. Роль антител к МОГ и серологический статус других антител должны быть рассмотрены в будущих диагностических критериях ОРЭМ [5].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Данная статья выполнена при финансовой поддержке РНФ, грант №22-15-00284.
Financing. This article was funded by the Russian Science Foundation, grant №22-15-00284.
Информация об авторах
Information about the authors
Садекова Галина Игоревна – врач-невролог, ФГБУ ФЦМН.
E-mail: g.sadekova.neuro@gmail.com; ORCID: 0000-0002-4123-2313
Galina I. Sadekova – Neurologist, Federal Center of Brain Research and Neurotechnologies. E-mail: g.sadekova.neuro@gmail.com;
ORCID: 0000-0002-4123-2313
Омарова Мадина Алиевна – врач-невролог, ФГБУ ФЦМН.
E-mail: omarova.neurology@mail.ru; ORCID: 0000-0002-6744-2191
Madina A. Omarova – Neurologist, Federal Center of Brain Research and Neurotechnologies. E-mail: omarova.neurology@mail.ru; ORCID: 0000-0002-6744-2191
Бойко Алексей Николаевич – д-р мед. наук, проф. каф. неврологии, нейрохирургии, медицинской генетики, ФГАОУ ВО
«РНИМУ им. Н.И. Пирогова», врач-невролог, рук. отд. нейроиммунологии ФГБУ ФЦМН. E-mail: anboyko1377@gmail.com; ORCID: 0000-0002-2975-4151
Alexey N. Boyko – Dr. Sci. (Med.), Federal Center of Brain Research and Neurotechnologies, Pirogov Russian National Research Medical University. E-mail: anboyko1377@gmail.com; ORCID: 0000-0002-2975-4151
Поступила в редакцию: 14.11.2024
Поступила после рецензирования: 26.11.2024
Принята к публикации: 28.11.2024
Received: 14.11.2024
Revised: 26.11.2024
Accepted: 28.11.2024
Клинический разбор в общей медицине №1 2025
Рецидивирующие формы острого рассеянного энцефаломиелита: современные представления диагностики и лечения, возможные причины хронизации демиелинизирующего процесса
Номера страниц в выпуске:80-87
Аннотация
Острый рассеянный энцефаломиелит (ОРЭ) – это острое аутоиммунное воспалительное заболевание центральной нервной системы, которое традиционно рассматривается как монофазный демиелинизирующий процесс, развивающийся преимущественно у детей и подростков. В последние годы количество случаев рецидивирующего течения данного заболевания увеличивается, однако этиологические и патогенетические факторы хронизации демиелинизирующего процесса после дебюта заболевания недостаточно изучены. Нами проведен поиск публикаций, посвященных рецидивирующим формам ОРЭ, в информационных базах PubMed, Scopus и Mendeley. В настоящей статье представлены обзор современных представлений о диагностике и лечении ОРЭ, вопросы дифференциальной диагностики с другими демиелинизирующими заболеваниями на основании клинической картины, нейровизуализационных данных и специфичных лабораторных маркеров. Обобщены литературные данные о рецидивирующих формах заболевания, прогностических факторах хронизации демиелинизирущего процесса, в том числе трансформации в рассеянный склероз.
Ключевые слова: острый рассеянный энцефаломиелит, мультифазный рассеянный энцефаломиелит, прогностические факторы, рассеянный склероз.
Для цитирования: Садекова Г.И., Омарова М.А., Бойко А.Н. Рецидивирующие формы острого рассеянного энцефаломиелита: современные представления диагностики и лечения, возможные причины хронизации демиелинизирующего процесса. Клинический разбор в общей медицине. 2025; 6 (1): 80–87. DOI: 10.47407/kr2024.6.01.00p435
Острый рассеянный энцефаломиелит (ОРЭ) – это острое аутоиммунное воспалительное заболевание центральной нервной системы, которое традиционно рассматривается как монофазный демиелинизирующий процесс, развивающийся преимущественно у детей и подростков. В последние годы количество случаев рецидивирующего течения данного заболевания увеличивается, однако этиологические и патогенетические факторы хронизации демиелинизирующего процесса после дебюта заболевания недостаточно изучены. Нами проведен поиск публикаций, посвященных рецидивирующим формам ОРЭ, в информационных базах PubMed, Scopus и Mendeley. В настоящей статье представлены обзор современных представлений о диагностике и лечении ОРЭ, вопросы дифференциальной диагностики с другими демиелинизирующими заболеваниями на основании клинической картины, нейровизуализационных данных и специфичных лабораторных маркеров. Обобщены литературные данные о рецидивирующих формах заболевания, прогностических факторах хронизации демиелинизирущего процесса, в том числе трансформации в рассеянный склероз.
Ключевые слова: острый рассеянный энцефаломиелит, мультифазный рассеянный энцефаломиелит, прогностические факторы, рассеянный склероз.
Для цитирования: Садекова Г.И., Омарова М.А., Бойко А.Н. Рецидивирующие формы острого рассеянного энцефаломиелита: современные представления диагностики и лечения, возможные причины хронизации демиелинизирующего процесса. Клинический разбор в общей медицине. 2025; 6 (1): 80–87. DOI: 10.47407/kr2024.6.01.00p435
Relapsing forms of acute disseminated encephalomyelitis: current concepts of diagnosis and treatment, possible causes of chronic demyelinating process
Galina I. Sadekova1, Madina A. Omarova1, Alexey N. Boyko1,21 Federal Center of Brain Research and Neurotechnologies, Moscow, Russia;
2 Pirogov Russian National Research Medical University, Moscow, Russia
g.sadekova.neuro@gmail.com
Abstract
Acute disseminated encephalomyelitis is an acute autoimmune inflammatory disease of the central nervous system, which is traditionally considered as a monophasic demyelinating process that develops mainly in children and adolescents. In recent years, the number of cases of relapsing forms of this disease has increased, however, the etiological and pathogenetic factors of chronic demyelinating process after the onset of the disease have not been sufficiently studied. We searched for publications devoted to relapsing forms of acute disseminated encephalomyelitis in the information databases PubMed, Scopus and Mendeley. This article provides an overview of current concepts of the diagnosis and treatment of acute disseminated encephalomyelitis, issues of differential diagnosis with other demyelinating diseases based on the clinical features, neuroimaging findings and specific biomarkers. The literature data on relapsing forms of the disease, prognostic factors of chronic of demyelinating process, including evolution into multiple sclerosis.
Keywords: acute disseminated encephalomyelitis, mulphasic acute disseminated encephalomyelitis, prognostic factors, multiple sclerosis.
For citation: Sadekova G.I., Omarova M.A., Boyko A.N. Relapsing forms of acute disseminated encephalomyelitis: current concepts of diagnosis and treatment, possible causes of chronic demyelinating process. Clinical review for general practice. 2025; 6 (1): 80–87 (In Russ.). DOI: 10.47407/kr2024.6.01.00p435
Введение
Острый рассеянный энцефаломиелит (ОРЭМ) – это острое демиелинизирующее воспалительное заболевание центральной нервной системы (ЦНС), которое чаще развивается у детей и подростков после предшествующей инфекции или вакцинации [1, 2]. Клиническая картина заболевания представлена полифокальной неврологической симптоматикой, которая при благоприятном исходе регрессирует в течение нескольких недель [3]. Диагностика ОРЭМ может вызывать затруднения ввиду отсутствия разработанных диагностических критериев у взрослых [4]. В большинстве случаев ОРЭМ протекает монофазно с возвращением к исходному неврологическому уровню в течение 3 мес после появления первых симптомов [2]. У 10–36% пациентов наблюдаются рецидивирующие формы ОРЭМ [5].Изучение прогностических факторов хронизации демиелинизирующего процесса после перенесенного ОРЭМ имеет важное клиническое значение для своевременной диагностики и лечения демиелинизирующих заболеваний.
Этиология и патогенез
ОРЭМ считается постинфекционным заболеванием ЦНС. В 50–85% случаев развитию ОРЭМ предшествует инфекция или вакцинация. Чаще всего ОРЭМ ассоциирован с предшествующей вирусной инфекцией дыхательных путей и желудочно-кишечного тракта. Среди микроорганизмов, ассоциированных с ОРЭМ, чаще встречается цитомегаловирус, вирус Эпштейна–Барр, вирус простого герпеса, вирус герпеса человека-6, вирус гриппа, вирус гепатита А, вирус иммунодефицита человека, Mycoplasma pneumoniae, лептоспиры, β-гемолитические стрептококки и Borrelia burgdorferi, хотя в большинстве случаев возбудитель остается неиндентифицированным. В большинстве случаев ОРЭМ развивается через нескольких дней и до 2 мес после вирусной или бактериальной инфекции (в среднем 26 дней) [1, 3]. ОРЭМ может развиваться после вакцинации от бешенства, кори, коклюша, столбняка, гриппа, гепатита В, дифтерии, краснухи, пневмококка, ветряной оспы, вируса папилломы человека, полиомиелита, SARS-CoV-2 [3].
Считается, что основу патогенеза ОРЭМ составляет аутоиммунный и воспалительный процесс в ЦНС, возникающий под воздействием факторов окружающей среды (инфекция, вакцинация) и развивающийся у людей с генетической предрасположенностью [2].
Одним из главных механизмов иммуноопосредованного повреждения ЦНС является «молекулярная мимикрия» – перекрестная реакция антител, вырабатываемых в ответ на воздействие микроорганизмов с аутоантигенами миелина [основным белком миелина, протеолипидным белком и миелин-олигодендроцитарным гликопротеином – МОГ (антитела к МОГ)], приводящая к активации гуморальных и клеточных иммунных реакций и, как следствие, к демиелинизирующему процессу [1, 2, 4, 5]. Эта гипотеза подтверждается наличием аутоантител иммуноглобулина (Ig) G и Т-хелперных клеток, реагирующих на белок миелина, у пациентов с ОРЭМ. Последующая активация воспалительного каскада приводит к увеличению проницаемости сосудов, отеку и разрушению гематоэнцефалического барьера. Антитела к МОГ были обнаружены как в сыворотке крови, так и в ликворе пациентов во время острой фазы заболевания, и их количество постепенно снижалось в процессе выздоровления. Экспрессия МОГ в зрелых олигодендроцитах предполагает его возможную роль в созревании самих олигодендроцитов, а также играет ключевую роль в поддержании целостности миелина, в адгезии и взаимодействии между клетками [2].
При исследовании уровня провоспалительных цитокинов в ликворе у пациентов с ОРЭМ было описано повышение тех цитокинов, которые связаны с Th1- и
Th2-клетками. Уровень цитокинов, связанных с макрофагами/микроглией, также был повышен, что указывает на роль врожденного иммунитета при ОРЭМ. Во всех исследованиях интерлейкин (ИЛ)-6 был одним из цитокинов, который, по-видимому, регулярно повышался у пациентов с ОРЭМ и коррелировал с обнаружением олигоклональных иммуноглобулинов (ОКИ) и антител к МОГ [5].
Среди других воспалительных факторов, потенциально связанных с развитием ОРЭМ, S. Yang и соавт. были отмечены фактор роста нервов бета (β-NGF), цистатин D, ИЛ-7, пептидный трансформирующий фактор роста β1 (TGF-β1) и нейротрофин-3 (NT-3) [6].
Обнаружение специфических воспалительных факторов, участвующих в патогенезе ОРЭМ, имеет важное прогностическое значение для разработки патогенетических методов лечения.
Эпидемиология
Частота ОРЭМ среди детской популяции варьируется от 0,07 до 0,9 на 100 тыс. населения. Пик заболеваемости среди детей приходит на возраст от 5 до 8 лет.
У взрослых случаи ОРЭМ зафиксированы в возрасте от 18 до 82 лет со средним возрастом от 33 до 41 года [1]. Заболевание чаще регистрируется у мужчин, чем у женщин, с соотношением 1,3:1 [3]. Отмечается тенденция к росту заболеваемости в зимне-весенний период. Географическое распределение аналогично таковому при рассеянном склерозе (РС) с распространенностью, которая увеличивается с удалением от экватора [2, 5].
Клиническая картина
ОРЭМ характеризуется мультифокальной неврологической симптоматикой, быстро прогрессирующей в течение нескольких дней или недель [3]. Клиническая картина ОРЭМ неоднородна. Наиболее распространенными клиническими проявлениями ОРЭМ были пирамидные признаки, двигательный дефицит, нарушения походки, стволовые симптомы и энцефалопатия [7]. Как правило, у пациентов наблюдаются продромальные симптомы, такие как лихорадка, головная боль, общая слабость, тошнота и рвота. Острая фаза наступает с появлением энцефалопатии, облигатного признака ОРЭМ, характеризующейся изменением поведения (раздражительностью, спутанностью сознания) и сознания (летаргия, сопор, кома), связанными с мультифокальным или очаговым неврологическим дефицитом в зависимости от области, вовлеченной в процесс демиелинизации [2, 8]. При поражении затылочной доли и зрительной коры у пациентов могут наблюдаться нарушения зрения – от одноименных дефектов полей зрения до кортикальной слепоты. Поражение ассоциативных областей коры вызывает афазию, алексию, аграфию или акалькулию. Пирамидные признаки, такие как парезы/плегия, гиперрефлексия, спастичность и симптом Бабинского, могут возникать, если в патологический процесс вовлечена двигательная кора головного мозга (ГМ). Сенсорные нарушения включают аграфестезию, астереогнозию, потерю проприоцепции и изменение восприятия боли и температуры. Поражение зрительного нерва может привести к отеку диска зрительного нерва и одностороннему или двустороннему невриту зрительного нерва. Поражение ствола ГМ приводит к нарушению функции III–XII черепно-мозговых нервов (диплопия, нарушение экстраокулярных движений, дисфагия, дизартрия, нистагм, головокружение, атаксия, нарушение слуха и вкуса), нарушению сознания и к дыхательной недостаточности. Повреждение спинного мозга может вызвать вялый паралич с нарушением дефекации и мочеиспускания. Судороги нередки и могут быть фокальными или генерализованными [2].
Другие атипичные симптомы включают менингеальные признаки, дистонию или паркинсонизм, хореоподобные движения и нервно-психические симптомы (изменение поведения, раздражительность, агрессия). ОРЭМ у детей характеризуется симптомами менингоэнцефалита, включающими энцефалопатию, лихорадку, головную боль, тошноту и рвоту [2, 5].
У некоторых взрослых наблюдаются признаки поражения периферической нервной системы (ПНС) в виде парестезией, гипестезий и атрофии мышц. Пациенты с ОРЭМ с поражением ПНС обычно имеют худший прогноз и повышенный риск рецидива заболевания по сравнению с пациентами с поражением только ЦНС [1].
Подходы к диагностике
Предпочтительным методом диагностики ОРЭМ является магнитно-резонансная томография (МРТ). Для МРТ-картины ГМ при ОРЭМ характерно наличие гиперинтенсивных очагов с нечеткими границами на
Т2-взвешенных изображениях, FLAIR. Очаги обычно не визуализируются на Т1-взвешенных изображениях, хотя более крупные очаги могут проявляться как гипоинтенсивные. Наиболее характерно, что ОРЭМ проявляется в виде множественных, широко распространенных, асимметричных поражений >1–2 см в диаметре, с нечеткими краями с обеих сторон по всему ГМ [1–3, 5, 8, 9]. У большинства пациентов с ОРЭМ выявляется вазогенный отек ГМ на диффузно-взвешенных изображениях (DWI) [7]. Чаще всего наблюдается поражение глубокого и подкоркового вещества, реже – перивентрикулярного белого вещества, иногда – базальных ганглиев, таламуса, коры. Могут быть дополнительные инфратенториальные поражения ствола ГМ, мозжечка и спинного мозга, но они редко проявляются как изолированные поражения без сопутствующего поражения ГМ. При геморрагическом и сверхостром вариантах ОРЭМ могут обнаруживаться области острого кровоизлияния [1–3]. Характерным признаком является отсутствие диссеминации патологического процесса во времени по данным нейровизуализации (отсутствие гипоинтенсивных очагов в режиме Т1-взвешенных изображений, одновременное накопление контрастного вещества всеми очагами) [4].
У взрослых поражение СМ на МРТ может быть представлено продольно-распространенным поперечным миелитом (LETM), который в значительной степени связан с серопозитивным вариантом заболевания спектра оптиконевромиелита (ЗСОНМ), но у детей чаще встречаются более протяженные очаги. Короткие, клиновидные, эксцентрические очаги чаще наблюдаются при РС. Миелит, связанный с антителами к МОГ, может сопровождаться LETM, и в этих поражениях преобладает поражение серого вещества, что иногда затрудняет дифференциальную диагностику с острым вялым миелитом (AFM) [8].
Наличие 2 или более перивентрикулярных очагов, наличие симптома «черных дыр» на T1-взвешенных изображениях и отсутствие двустороннего характера поражения во время первого демиелинизирующего эпизода характерны для РС [1].
Компьютерная томография (КТ) является менее информативным методом диагностики ОРЭМ. КТ-признаки поражения вещества ГМ могут отсутствовать, однако в субкортикальном белом веществе иногда выявляются неспецифические очаги, накапливающие или не накапливающие контрастное вещество. В дальнейшем на КТ наблюдается диффузное снижение плотности белого вещества (признак распространенной демиелинизации) [10].
Электроэнцефалография используется как дополнительный метод диагностики у пациентов с судорожным синдромом в клинической картине ОРЭМ. Электроэнцефалография может выявить замедление биоэлектрической активности, а также, в некоторых случаях, эпилептиформную активность [3].
Диагностика и дифференциальный диагноз
Диагноз ОРЭМ является клиническим и подтверждается с помощью данных нейровизуализации. До сих пор нет конкретных биологических маркеров, подтверждающих диагноз, что является целью дальнейших исследований. При постановке диагноза необходимо проводить дифференциальную диагностику путем исключения заболеваний, имитирующих ОРЭМ [2, 5]. Первоочередной задачей является исключение острой бактериальной или вирусной инфекции ЦНС, поскольку ОРЭМ часто проявляется как острый менингоэнцефалит. Поэтому необходимо как можно скорее провести люмбальную пункцию с исследованием ликвора с применением культуральных методов, вирусологических исследований (на вирусы простого герпеса 1 и 2-го типа, энтеровирус, вирус гриппа, вирус Эпштейна–Барр, вирус ветряной оспы, вирус Западного Нила, цитомегаловирус) и бактериальных/вирусных серологических исследований (антитела к боррелии, бледной трепонеме, микоплазме, вирусу краснухи) [2, 3]. Метагеномное секвенирование нового поколения все чаще используется для диагностики менее распространенных инфекций ЦНС [8].
Показатели ликворограммы у пациентов с ОРЭМ могут быть в пределах референсных значений или демонстрировать умеренный плеоцитоз с преобладанием лимфоцитов и моноцитов, повышенный уровень белка (в 50–80% случаев). У 1/3 пациентов обнаруживается интратекальный синтез олигоклональных антител, который может быть транзиторным [2, 4, 5].
Является необходимым проводить дифференциальную диагностику ОРЭМ с другими аутоиммунными заболеваниями ЦНС. В настоящее время определен спектр аутоиммунных заболеваний ЦНС, при которых могут образовываться следующие антитела [3]:
1) антитела к нейронам – антитела к внутриклеточным белкам (Hu, Yo, Ma2);
2) антитела к внеклеточным мембранным белкам (аквапорину 4 – AQP-4, антитела к МОГ, LGI1, CASPR2, рецептору глицина, GABAA-рецептору, GABAB-рецептору, AMPA-рецептору, mGluR5, DPPX, D2R, IgLON5, neurexin 3α, mGluR1 и др.);
3) антитела к внутриклеточным белкам, которые могут выходить на поверхность во время экзоцитоза синаптических пузырьков (amphiphysin, septin 5, synapsin);
4) антитела к другим структурам ЦНС (внеклеточный мембранный белок астроцитов GFAP);
5) антитела, поражающие не только нервную систему, но и другие системы органов (системные аутоиммунные заболевания).
Международная группа по изучению РС у детей (The International Pediatric Multiple Sclerosis Study Group – IPMSSG) разработала современные диагностические критерии (см. таблицу), опубликованные в 2007 г. и обновленные в 2013 г., которые определяют ОРЭМ как острый демиелинизирующий эпизод, для которого характерно наличие энцефалопатии, полиочагового поражения ЦНС и очагов демиелинизации по данным МРТ [1–3, 5, 8].

Однако критерии диагностики IPMSSG подвергаются критике в связи с необходимостью таких признаков для постановки диагноза, как энцефалопатия и многоочаговое поражение ЦНС, которые обнаруживаются не во всех случаях. По данным M. Boesen и соавт., даже у детей диагноз ОРЭМ ставится в полном соответствии с критериями IPMSSG лишь в 35% случаев. Диагностические критерии ОРЭМ для взрослых не разработаны [4].
Клинические и нейровизуализационные характеристики ОРЭМ существенно различаются в зависимости от возраста. Применение диагностических критериев IPMSSG ко всем взрослым с диагнозом ОРЭМ приводит к тому, что более чем в 1/2 случаев диагноз не верифицируется [7].
Дифференциальный диагноз ОРЭМ проводится с первым клиническим демиелинизирующим эпизодом РС, МОГ-IgG-ассоциированным заболеванием, острым вирусным энцефалитом, метастатическим поражением ГМ [1]. При возникновении полисимптомной энцефалопатии (например, двигательных расстройств, судорог, психоза) при дифференциальной диагностике
следует учитывать энцефалит, вызванный анти-NMDA-рецепторами, лимбический энцефалит, энцефалит
Хашимото и энцефалит Рассмусена. Кроме того, дифференциальный диагноз ОРЭМ должен включать злокачественные новообразования ЦНС, пищевые, токсические и нейрометаболические нарушения (особенно митохондриопатии) [2].
Наиболее сложной представляется дифференциальная диагностика ОРЭМ с ОРЭМ-подобным началом РС. Точная диагностика любого из этих состояний имеет важное значение, поскольку подход к лечению этих двух заболеваний существенно различается. У пациентов с ОРЭМ в анамнезе часто отмечаются симптомы продромального периода вирусных заболеваний, такие как: лихорадка, ригидность затылочных мышц, остро возникшая атаксия, нарушение сознания и энцефалопатия, которые являются не характерными для РС. Различается и МРТ-картина поражения ГМ и спинного мозга при ОРЭМ и РС. Для ОРЭМ характерны обширные, двусторонние, асимметричные поражения с нечеткими границами. Поражения области таламуса чаще наблюдаются при ОРЭМ, в то время как перивентрикулярные очаги демиелинизации чаще встречаются при РС [1]. Для того чтобы отличить ОРЭМ от РС во время первого клинического эпизода, потенциально полезны три признака [5]:
1) два или более перивентрикулярных поражения;
2) наличие симптома «черных дыр»;
3) отсутствие двустороннего характера поражения ГМ.
При наличии двух из этих трех признаков вероятность РС выше, чем ОРЭМ. Тем не менее следует отметить, что эти критерии не являются диагностическими.
Исследование олигоклональных антител рекомендуется для проведения дифференциальной диагностики с РС, так как 2-й тип их синтеза часто встречается при РС и редко – при ОРЭМ. При РС, как правило, не определяются антитела к МОГ, тогда как при ОРЭМ в 40% случаев возможно их обнаружение [3].
При отрицательном анализе на антитела к МОГ и обнаружении в сыворотке крови антител к AQP-4 следует заподозрить ЗСОНМ. Также в пользу данного диагноза могут свидетельствовать синдром area postrema (эпизоды икоты или тошноты и рвоты, необъяснимой другими причинами), симптоматическая нарколепсия или острый клинический синдром поражения промежуточного мозга. Кроме того, расстройства из спектра оптиконевромиелита более характерны для пациентов женского пола, дебют заболевания отмечается во взрослом возрасте; поражение спинного мозга наблюдается чаще, чем зрительных нервов; оптический неврит в дебюте заболевания чаще односторонний [3].
В некоторых случаях возникают трудности в дифференциальной диагностике ОРЭМ со злокачественными новообразованиями ГМ. Тогда может проводиться исследование ликвора цитологическим методом и методом проточной цитометрии, редко возникает необходимость в биопсии ГМ [3].
Терапия ОРЭМ
В настоящее время не существует рандомизированных плацебо-контролируемых исследований, устанавливающих подходы к лечению ОРЭМ. Стандартом терапии является неспецифическая иммуносупрессивная терапия, включающая глюкокортикостероиды (ГКС), внутривенные иммуноглобулины (ВВИГ) и плазмаферез. Лечение 1-й линии состоит из внутривенного введения высоких доз ГКС с последующим переходом на пероральный прием с постепенным снижением дозы.
В большинстве случаев доза пероральных ГКС начинается с использования преднизолона в дозе 1–2 мг/кг в сутки, а затем постепенно снижается в течение 4–6 нед [2, 5]. Раннее прекращение приема ГКС (менее 3 нед) может увеличить риск рецидива заболевания [5, 8]. Механизмы действия ГКС в высоких дозах включают подавление продукции воспалительных цитокинов, ингибирование активации Т-клеток, уменьшение проникновения иммунных клеток в ЦНС и облегчение апоптоза активированных иммунных клеток [8].
Использование внутривенного Ig и плазмафереза считается терапией 2-й линии у пациентов с резистентностью к ГКС, а также у пациентов с противопоказаниями к применению ГКС и рецидивами ОРЭМ. Плазмаферез следует рассматривать на ранних стадиях молниеносного течения ОРЭМ [2]. Weinshenker и соавт. исследовали эффективность плазмафереза при лечении пациентов с тяжелыми демиелинизирующими заболеваниями ЦНС, не реагирующими на ГКС, в рандомизированном контролируемом исследовании по сравнению с плацебо. Исследование выявило улучшение неврологического статуса пациентов, которым проводился плазмаферез, по сравнению с другими участниками исследования. Плазмаферез обычно состоит из 3–6 сеансов с различным графиком проведения – от ежедневного использования до проведения через 1 день или в течение 10–14 дней. Некоторые клинические и рентгенологические характеристики заболевания могут быть полезны для принятия решения о выборе плазмафереза в пользу других методов терапии. Kozioelk и соавт. представили ретроспективное исследование, включающее 3 клинических случая ОРЭМ: у 2 пациентов развились двигательные симптомы, а у 1 пациента наблюдался рецидив ОРЭМ с невритом зрительного нерва. После лечения ГКС в высоких дозах и отсутствия клинического улучшения этим пациентам проведен плазмаферез с хорошим ответом на проводимую терапию. Показанием к плазмаферезу в данном случае являлись оценка по шкале EDSS≥6 или тяжелая потеря зрения (≤0,2) на одном глазу и отсутствие изменений симптомов по крайней мере после 5 дней применения ГКС в высоких дозах. Khurana и соавт. предложили использовать плазмаферез при наличии МРТ-признаков поражения глубокого серого вещества и ствола ГМ, которые могут быть связаны с отсутствием реакции на терапию ГКС [2].
Возможным фактором, свидетельствующим о неэффективности использования ГКС, является поражение ПНС. В таких случаях использование ВВИГ в дозировке 2 г/кг массы тела в течение 2–5 дней является терапевтическим вариантом [2, 5]. В качестве терапии 2-й линии ВВИГ могут назначаться в качестве монотерапии или в сочетании со вторым курсом ГКС, так как их совместное применение может оказывать синергетический эффект. Сообщалось о применении циклофосфамида у взрослых пациентов с ОРЭМ, которые не реагировали на стандартную терапию [2].
Прогноз
Прогноз при ОРЭМ сильно варьирует в зависимости от возраста пациента, показателей клинической картины и результатов МРТ-диагностики, а также наличия антител к МОГ. Наиболее тяжелые случаи ОРЭМ представляют собой острый геморрагический лейкоэнцефалит и острый некротизирующий лейкоэнцефалит, которые характеризуются кровоизлияниями в очагах демиелинизации. Предполагалось, что острый геморрагический лейкоэнцефалит является гиперострым вариантом ОРЭМ, но из-за различий в патофизиологии (увеличения количества нейтрофилов, разрушения мелких сосудов с отложением фибрина и кровоизлияний) он также рассматривался как отдельное заболевание [1, 11]. При монофазном течении ОРЭМ летальный исход может достигать 30% случаев. От 50 до 80% пациентов полностью выздоравливают при монофазном течении ОРЭМ. Около 25% госпитализированных детей нуждаются в интенсивной терапии, при этом смертность составляет от 1 до 3%. Взрослые чаще попадают в отделения интенсивной терапии, дольше находятся в стационаре, чаще наблюдаются летальные исходы [1].
Среди прогностических неблагоприятных факторов функционального восстановления после ОРЭМ у детей были выделены следующие: отсутствие продромальной головной боли, наличие миоклонуса в клинической картине заболевания и обнаружение очагового поражения мозжечка по данным МРТ ГМ [12]. Стоит отметить, что развитие миоклонуса как варианта двигательного расстройства у взрослых в дебюте ОРЭМ не является характерным и описано по данным литературы у пациентки с новой коронавирусной инфекцией (SARS-CoV-2) [13].
В большинстве случаев ОРЭМ протекает монофазно с возвращением к исходному неврологическому уровню в течение 3 мес после появления первых симптомов [2]. У 10–36% пациентов развивается повторный демиелинизирующий эпизод после перенесенного ОРЭМ [5].
Для оценки динамики демиелинизирующего процесса и последующего развития мультифазный ОРЭМ (МРЭМ) необходимо повторное проведение нейровизуализации (МРТ) не ранее чем через 3 мес после первого клинического эпизода, поскольку результаты радиологических исследований могут колебаться в течение этого периода времени [5].
Рецидивирующие формы ОРЭМ
Любые клинические симптомы и рентгенологические признаки ОРЭМ, проявляющиеся в течение следующих 3 мес с момента начала заболевания, считаются частью первоначального события. Когда второй эпизод ОРЭМ возникает по крайней мере через 3 мес после первого эпизода, он определяется как МРЭМ. Второй эпизод ОРЭМ может характеризоваться новыми или предшествующими неврологическими симптомами, признаками и поражениями по данным МРТ [2, 5].
МРЭМ у взрослых – это редкое заболевание с нетипичным течением, которое вызывает трудности диагностики. Asif и соавт. описал клинический случай
59-летнего мужчины, у которого было диагностировано два эпизода ОРЭМ, произошедших с временным интервалом в 26 лет, в отсутствие какой-либо недавней вирусной инфекции, вакцинации или других классических причин [14].
Три или более клинических эпизода позволяют пересмотреть диагноз ОРЭМ и рассмотреть другое хроническое заболевание, такое как РС, – заболевание, ассоциированное с антителами к МОГ, или ЗСОНМ. Иногда эти расстройства могут сливаться, как при ОРЭМ-оптическом неврите (ОРЭМ-ОН), который является подтипом рецидивирующего ОРЭМ, связанным с повторяющимися эпизодами неврита зрительного нерва без энцефалопатии [2, 5]. Частота эпизодов одностороннего воспаления зрительных нервов может достигать 9, иногда в сочетании с дальнейшими приступами, подобными ОРЭМ. Интересно, что у детей во время рецидива ОН редко обнаруживаются новые повреждения при МРТ [5].
W. Zang и соавт. провели ретроспективное исследование с целью анализа клинических, лабораторных, нейровизуализационных показателей 56 пациентов с ОРЭМ, из которых у 1/4 больных развился МРЭМ. Было отмечено, что некоторые исходные клинические характеристики могут быть использованы для различия монофазного и многофазного течения. Например, у пациентов с МРЭМ часто наблюдаются симптомы поражения зрительного нерва и вегетативной нервной системы. Кроме того, МРЭМ чаще встречается у женщин, пациентов с обнаружением ОКИ и пациентов с поражениями серого вещества коры ГМ, подкоркового белого вещества, а также с супратенториальными и инфратенториальными поражениями, выявленными по данным МРТ ГМ [9].
Выделяют и другие рецидивирующие формы ОРЭМ, такие как: ОРЭМ-РС и ОРЭМ-ЗСОНМ. ОРЭМ-РС характеризуется развитием нового клинического эпизода спустя 3 мес после перенесенного ОРЭМ с появлением очагов демиелинизации по данным МРТ, соответствующих критериям МакДональда для РС. Для ОРЭМ-ЗСОНМ характерно развитие ОН, миелита, поражения зоны area postrema с соблюдением диагностических критериев заболевания [5].
В связи с этим выявление сывороточных аутоантител, нацеленных на антигены ЦНС, может помочь исключить диагноз ОРЭМ и предсказать клинический исход, хотя их роль в патогенезе заболевания не ясна. Персистенция антител к МОГ была связана как с МРЭМ, так и с ОРЭМ-ОН. Однако антитела к МОГ не являются специфичными для ОРЭМ и были обнаружены у пациентов с ОН, поперечным миелитом и ЗСОНМ. Наличие сывороточных антител IgG к AQP-4 может помочь дифференцировать ОРЭМ от ЗСОНМ, поскольку они ассоциированы с ЗСОНМ, но не с ОРЭМ [2].
Прогностические факторы хронизации демиелинизирующего процесса после ОРЭМ
Понимание предикторов прогрессирования от первого демиелинизирующего события ко второму (и прежде всего диагноза РС) имеет важное клиническое значение.
L. Papetti и соавт. провели ретроспективное исследование, включающее 91 пациента ≤16 лет с острым демиелинизирующим эпизодом (ОДЭ) с целью выявления возможных прогностических факторов хронизации демиелинизирующего процесса и развития РС. Среди 33 пациентов с ОРЭМ у 7 пациентов в последующем диагностирован РС. Было установлено, что антитела класса IgG к вирусу Эпштейна–Барр были обнаружены у 100% пациентов с ОРЭМ, у которых развился РС, и только у 34,6% пациентов с монофазным ОРЭМ. Обнаружение ОКИ в ликворе у пациентов являлось важным предиктором развития РС (р<0,001), однако наличие ОКИ в ликворе не является патогномоничным признаком для РС, так как они выявляются у 8–15% детей с ОДЭ, у которых не развивается РС. Среди нейровизуализационных прогностических показателей развития РС после ОДЭ отмечены [15]:
1) наличие хотя бы одного перивентрикулярного очага демиелинизации;
2) наличие хотя бы одного очага демиелинизации в мозолистом теле;
3) хотя бы один гипоинтенсивный очаг на Т1-взвешенном изображении.
Прогностически неблагоприятными нейровизуализационными факторами у детей с ОРЭМ, по данным S. Arktout, являются: симметричные зоны поражения височных, теменных и затылочных долей по данным первой выполненной МРТ ГМ и наличие очагов демиелинизации в лобных или теменных долях на последующей МРТ ГМ [16].
У некоторых пациентов с рецидивирующими формами ОРЭМ были выявлены антитела к МОГ, для которых было характерно более частое развитие ОН и LETM [1, 2]. Как правило, обнаружение антител к МОГ в высоких титрах характерно для дебюта ОРЭМ с дальнейшим снижением их уровня до полного отсутствия после выздоровления [17]. Пациенты с антителами к МОГ, по-видимому, реагируют на стероидную терапию, демонстрируя монофазное течение заболевания и лучший исход, особенно при переходе в серонегативный статус [2]. У ряда пациентов наблюдается более двух приступов ОРЭМ в сочетании с обнаружением антител к МОГ [5]. Высокий титр (>1:1280) и персистенция антител к МОГ в крови пациентов считается одним из прогностических факторов развития РС, рецидивов ОН и неполного восстановления ОРЭМ [11, 17].
Второе демиелинизирующее событие обычно происходит в течение следующих 12 мес, но временной интервал и частота приступов значительно варьируются у разных пациентов и развитие повторного события может занять до 4 лет. У детей с ОРЭМ и последующими рецидивирующими демилиенизирующими эпизодами на фоне отсутствия антител к МОГ в сыворотке крови с большей вероятностью со временем будет поставлен альтернативный диагноз [5].
Доказательства патогенности и персистентности антител к МОГ у пациентов как с монофазной, так и с рецидивирующей формами ОРЭМ все еще находятся в стадии разработки. Роль антител к МОГ и серологический статус других антител должны быть рассмотрены в будущих диагностических критериях ОРЭМ [5].
Заключение
Классический подход к определению ОРЭМ как монофазного острого демиелинизирующего заболевания претерпел изменения на протяжении последних нескольких лет ввиду описания все большего количества случаев рецидивирующих форм ОРЭМ, включая МРЭМ, ОРЭМ-ЗСОНМ, ОРЭМ-ОН, ОРЭМ-РС. В ходе исследования возможных прогностических маркеров ОРЭМ была показана ассоциация между персистенцией антител к МОГ и высоким риском рецидива заболевания, что может послужить важным прогностическим маркером хронизации демиелинизирующего процесса. Необходимо дальнейшее исследование клинических, лабораторных, нейровизуализационных прогностических факторов рецидивирующих форм ОРЭМ для своевременной диагностики данных заболеваний и начала патогенетической терапии.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Данная статья выполнена при финансовой поддержке РНФ, грант №22-15-00284.
Financing. This article was funded by the Russian Science Foundation, grant №22-15-00284.
Информация об авторах
Information about the authors
Садекова Галина Игоревна – врач-невролог, ФГБУ ФЦМН.
E-mail: g.sadekova.neuro@gmail.com; ORCID: 0000-0002-4123-2313
Galina I. Sadekova – Neurologist, Federal Center of Brain Research and Neurotechnologies. E-mail: g.sadekova.neuro@gmail.com;
ORCID: 0000-0002-4123-2313
Омарова Мадина Алиевна – врач-невролог, ФГБУ ФЦМН.
E-mail: omarova.neurology@mail.ru; ORCID: 0000-0002-6744-2191
Madina A. Omarova – Neurologist, Federal Center of Brain Research and Neurotechnologies. E-mail: omarova.neurology@mail.ru; ORCID: 0000-0002-6744-2191
Бойко Алексей Николаевич – д-р мед. наук, проф. каф. неврологии, нейрохирургии, медицинской генетики, ФГАОУ ВО
«РНИМУ им. Н.И. Пирогова», врач-невролог, рук. отд. нейроиммунологии ФГБУ ФЦМН. E-mail: anboyko1377@gmail.com; ORCID: 0000-0002-2975-4151
Alexey N. Boyko – Dr. Sci. (Med.), Federal Center of Brain Research and Neurotechnologies, Pirogov Russian National Research Medical University. E-mail: anboyko1377@gmail.com; ORCID: 0000-0002-2975-4151
Поступила в редакцию: 14.11.2024
Поступила после рецензирования: 26.11.2024
Принята к публикации: 28.11.2024
Received: 14.11.2024
Revised: 26.11.2024
Accepted: 28.11.2024
Список исп. литературыСкрыть список1. Anilkumar AC, Foris LA, Tadi P. Acute Disseminated Encephalomyelitis. StatPearls [Internet]. 2024 Jan. Available from: https://www.ncbi.nlm.nih.gov/books/NBK430934/.
2. Massa S, Fracchiolla A, Neglia C et al. Update on Acute Disseminated Encephalomyelitis in Children and Adolescents. Children (Basel) 2021;8(4):280. DOI: 10.3390/children8040280
3. Авдеева В.Е., Котов А.С. Клинический полиморфизм острого рассеянного энцефаломиелита: диагностика, лечение, отдаленный прогноз. Лекция с описанием клинических случаев. Русский журнал детской неврологии. 2023;18(1):10-21. DOI: 10.17650/2073-8803-2023-18-1-10-21
Avdeeva V.E., Kotov A.S. Clinical polymorphism of acute multiple encephalomyelitis: diagnosis, treatment, long-term prognosis. A lecture describing clinical cases. Russian Journal of Pediatric Neurology. 2023;18(1):10-21. DOI: 10.17650/2073-8803-2023-18-1-10-21 (in Russian).
4. Бакулин И.С., Коржова Ю.Е., Козлова А.О. и др. Клинические особенности и диагностика острого рассеянного энцефаломиелита у взрослых. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2019;119(2-2):36-41. DOI: 10.17116/jnevro2019119 2236
Bakulin I.S., Korzhova Yu.E., Kozlova A.O. et al. Clinical features and diagnosis of acute multiple encephalomyelitis in adults. S.S. Korsakov Journal of Neurology and Psychiatry. Special issues. 2019;119(2-2):36-41. DOI: 10.17116/jnevro20191192236 (in Russian).
5. Paolilo RB, Deiva K, Neuteboom R et al. Acute Disseminated Encephalomyelitis: Current Perspectives. Children 2020;7(11):210. DOI: 10.3390/children7110210
6. Yang S, Liu Y, Wang S et al. Causal relationship between circulating inflammatory proteins and risk of different types of encephalitis: A two-sample Mendelian randomization study. Cytokine 2024;(184):156789. DOI: 10.1016/j.cyto.2024.156789
7. Li K, Li M, Wen L et al. Clinical Presentation and Outcomes of Acute Disseminated Encephalomyelitis in Adults Worldwide: Systematic Review and Meta-Analysis. Front Immunol 2022;(13):870867. DOI: 10.3389/fimmu.2022.870867
8. Wang CX. Assessment and Management of Acute Disseminated Encephalomyelitis (ADEM) in the Pediatric Patient. Paediatr Drugs 2021;23(3):213-21. DOI: 10.1007/s40272-021-00441-7
9. Zang WZ, Yang H, Li D et al. Clinical comparative analysis of monophasic and multiphasic acute disseminated encephalomyelitis in adults. Arch Med Sci 2020;19(3):687-93. DOI: 10.5114/aoms.2020.99801
10. Аверченков Д.М., Волик А.В., Фоминых В.В. и др. Острый рассеянный энцефаломиелит. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(11):119-28. DOI: 10.17116/jnevro2021121111119
Averchenkov D.M., Volik A.V., Fominykh V.V. et al. Acute disseminated encephalomyelitis. S.S. Korsakov Journal of Neurology and Psychiatry. 2021;121(11):119-28. DOI: 10.17116/jnevro2021121111119 (in Russian).
11. Otallah S. Acute disseminated encephalomyelitis in children and adults: A focused review emphasizing new developments. Mult Scler J 2021;27(8):1153-60. DOI: 10.1177/1352458520929627
12. Chen LW, Cheng JF, Chang TM et al. Prognostic factors for functional recovery in children with moderate to severe acute disseminated encephalomyelitis. Mult Scler Relat Disord 2022;(66):104056. DOI: 10.1016/j.msard.2022.104056
13. Ghosh R, Dubey S, Mandal A et al. Complex movement disorders in SARS-CoV-2 infection induced acute disseminated encephalomyelitis. J Neuroimmunol 2021;(358):577655. DOI: 10.1016/j.jneuroim.2021. 577655
14. Asif MH, Butt A, Riaz K et al. Multiphasic Acute Disseminated Encephalomyelitis with a Temporal Gap of 26 Years: A Case Report with Novel Presentation. Case Rep Neurol 2024;16(1):242-48. DOI: 10.1159/000540951
15. Papetti L, Fig‡ Talamanca L, Spalice A et al. Predictors of Evolution Into Multiple Sclerosis After a First Acute Demyelinating Syndrome in Children and Adolescents. Front Neurol 2019;(9):1156. DOI: 10.3389/fneur.2018.01156
16. Arktout S. Prognosis Factors in Children with ADEM: Clinical, Biological, and Radiological Features. Int J Radiol Imag Technol 2020;6(1):063. DOI: 10.23937/2572-3235.1510063
17. Almaghrabi N, Saab A. Adult onset acute disseminated encephalomyelitis: A case report. Radiol Case Rep 2021;16(9):2469-73. DOI: 10.1016/j.radcr.2021.05.052
24 февраля 2025
Количество просмотров: 9029

