Клинический разбор в общей медицине №2 2024
Клинический разбор в общей медицине №2 2024
Патогенетические аспекты рецидивирующей эндометриальной гиперплазии без атипии у женщин репродуктивного возраста
Номера страниц в выпуске:89-92
Аннотация
Цель. Установить наиболее информативные иммуногистохимические маркеры рецидивирующей эндометриальной гиперплазии без атипии у женщин репродуктивного возраста.
Материал и методы. Выполнен проспективный анализ результатов обследования 89 пациенток репродуктивного возраста на базе кафедры акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. В ходе исследования были сформированы две когорты пациенток в зависимости от течения эндометриальной гиперплазии: основная (n=45) – представлена пациентками с морфологически верифицированной рецидивирующей гиперплазией эндометрия без атипии (1 и более эпизодов рецидива в течение года), сравнения (n=44) – пациентки с впервые выявленной гиперплазией эндометрия без атипии. Средний возраст пациенток изучаемой когорты составил 44±3,0 года, группы сравнения – 42±2,0 года.
Результаты. В ходе исследования установлены иммуногистохимические маркеры рецидивирования: высокая экспрессия Ki-67 (p<0,05), низкая экспрессия Bcl-2 (p<0,05), увеличивающие пролиферативные и снижающие антипролиферативные процессы в эндометрии. У 40% пациенток, страдающих рецидивирующей гиперплазией эндометрия (у 18,2% в группе сравнения), установлены иммуногистохимические признаки хронического эндометрита (СD138+). Стоит также отметить наличие локальной гиперэстрогении на фоне высокой экспрессии эстрогена в эпителии желез и строме.
Дизайн: сравнительное проспективное исследование.
Заключение. Таким образом, экспрессия маркера Ki-67 и низкая экспрессия Bcl-2 способствуют рецидивирующему течению гиперплазии эндометрия без атипии. Также сочетание гиперплазии эндометрия с морфологически подтвержденным хроническим эндометритом служит дальнейшим предиктором рецидивирования пролиферативного процесса эндометрия. Имунногистохимия позволяет прогнозировать не только риски рецидивирования гиперплазии эндометрия, но и течение заболевания. Однако на данный момент нет универсального маркера, который позволил бы прогнозировать возможность как диагностики гиперплазии, так и ее рецидивирования.
Ключевые слова: гистероскопия, пролиферативные болезни эндометрия, рак эндометрия, гиперплазия эндометрия, иммуногистохимические маркеры.
Для цитирования: Оразов М.Р., Михалева Л.М., Хамошина М.Б., Муллина И.А., Артеменко Ю.С. Патогенетические аспекты рецидивирующей эндометриальной гиперплазии без атипии у женщин репродуктивного возраста. Клинический разбор в общей медицине. 2024; 5 (2): 89–92. DOI: 10.47407/kr2023.5.2.00393
Цель. Установить наиболее информативные иммуногистохимические маркеры рецидивирующей эндометриальной гиперплазии без атипии у женщин репродуктивного возраста.
Материал и методы. Выполнен проспективный анализ результатов обследования 89 пациенток репродуктивного возраста на базе кафедры акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. В ходе исследования были сформированы две когорты пациенток в зависимости от течения эндометриальной гиперплазии: основная (n=45) – представлена пациентками с морфологически верифицированной рецидивирующей гиперплазией эндометрия без атипии (1 и более эпизодов рецидива в течение года), сравнения (n=44) – пациентки с впервые выявленной гиперплазией эндометрия без атипии. Средний возраст пациенток изучаемой когорты составил 44±3,0 года, группы сравнения – 42±2,0 года.
Результаты. В ходе исследования установлены иммуногистохимические маркеры рецидивирования: высокая экспрессия Ki-67 (p<0,05), низкая экспрессия Bcl-2 (p<0,05), увеличивающие пролиферативные и снижающие антипролиферативные процессы в эндометрии. У 40% пациенток, страдающих рецидивирующей гиперплазией эндометрия (у 18,2% в группе сравнения), установлены иммуногистохимические признаки хронического эндометрита (СD138+). Стоит также отметить наличие локальной гиперэстрогении на фоне высокой экспрессии эстрогена в эпителии желез и строме.
Дизайн: сравнительное проспективное исследование.
Заключение. Таким образом, экспрессия маркера Ki-67 и низкая экспрессия Bcl-2 способствуют рецидивирующему течению гиперплазии эндометрия без атипии. Также сочетание гиперплазии эндометрия с морфологически подтвержденным хроническим эндометритом служит дальнейшим предиктором рецидивирования пролиферативного процесса эндометрия. Имунногистохимия позволяет прогнозировать не только риски рецидивирования гиперплазии эндометрия, но и течение заболевания. Однако на данный момент нет универсального маркера, который позволил бы прогнозировать возможность как диагностики гиперплазии, так и ее рецидивирования.
Ключевые слова: гистероскопия, пролиферативные болезни эндометрия, рак эндометрия, гиперплазия эндометрия, иммуногистохимические маркеры.
Для цитирования: Оразов М.Р., Михалева Л.М., Хамошина М.Б., Муллина И.А., Артеменко Ю.С. Патогенетические аспекты рецидивирующей эндометриальной гиперплазии без атипии у женщин репродуктивного возраста. Клинический разбор в общей медицине. 2024; 5 (2): 89–92. DOI: 10.47407/kr2023.5.2.00393
Original article
Yulia S. Artemenko1
1 Patrice Lumumba People’s Friendship University of Russi, Moscow, Russia;
2 Research Institute of Human Morphology named after Academician A.P. Avtsyna, Moscow, Russia
omekan@mail.ru
Abstract
Aim: to determine the most informative immunohistochemical markers of recurrent endometrial hyperplasia without atypia in women of childbearing age.
Methods. Prospective analysis of 89 patients of childbearing age was performed at the Department of Obstetrics and Gynecology with Perinatology, Medical Institute of the Peoples' Friendship University of Russia. During the study the patients were divided into two cohorts based on the EH course: the index group (n=45) was represented by patients with the morphologically verified recurrent endometrial hyperplasia without atypia (one or more episodes within a year), the control group (n=44) was represented by patients with the newly diagnosed endometrial hyperplasia without atypia. The average age of patients in the studied cohort was 44±3.0 years (comparison group – 42±2.0 years).
Results. Immunohistochemical markers of recurrence were identified during the study: high Ki-67 expression (p<0.05), low Bcl-2 expression (p<0.05) that enhanced proliferative and reduce antiproliferative processes in the endometrium. Immunohistochemical signs of chronic endometritis (СD138+) were found in 40% of patients suffering from recurrent endometrial hyperplasia (in 18.2% of controls). It should be also noted that there was local hyperestrogenism associated with high expression of estrogen in the glandular epithelium and stroma.
Conclusion. Thus, the Ki-67 marker expression and low Bcl-2 expression contribute to recurrence of endometrial hyperplasia without atypia. Furthermore, the combination of endometrial hyperplasia and morphologically verified chronic endometritis provides a further predictor of the endometrial proliferative process recurrence. Immunohistochemistry makes it possible to predict not only the risk of recurrent endometrial hyperplasia, but also the disease course. However, there is currently no universal marker allowing one to predict the chance of hyperplasia diagnosis and recurrence.
Design: a comparative prospective study.
Keywords: hysteroscopy, endometrial proliferative disease, endometrial cancer, endometrial hyperplasia, immunohistochemical markers.
For citation: Orazov M.R., Mihaleva L.M., Khamoshina M.B., Mullina I.A., Artemenko Yu.S. Pathogenetic aspects of recurrent endometrial hyperplasia without atypia in women of childbearing age. Clinical review for general practice. 2024; 5 (2): 89–92 (In Russ.). DOI: 10.47407/ kr2023.5.2.00393
Прогнозирование ГЭ является актуальной проблемой: ограниченное количество иммунногистохимических маркеров, отсутствие единого мнения, отсутствие профилактики рака эндометрия (скрининга). Большинство исследований были сосредоточены на изучении стероидных рецепторов, а именно изоморфов рецепторов эстрогена (ЭР) и прогестерона (ПР). Исследование, проведенное D.A. Gibson и соавт., показало увеличение экспрессии ЭРα при гиперпластических изменениях без атипии по сравнению с нормальным секреторным эндометрием [3]. Однако исследование E.T. Slettenn и соавт. не выявило связи между уровнем экспрессии эстрогена и рецидивом гиперпластических эндометриальных изменений [4].
Прогестерон – гормон, который снижает активность пролиферативного действия эстрогена [5]. Уровень экспрессии различных изоформ рецепторов прогестерона (ПР-А и ПР-В) в эндометриальных железах и строме, определенный при биопсии эндометрия до начала лечения гиперпластических изменений, имеет статистически значимую связь с возможностью рецидива гиперпластических процессов эндометрия. Женщины, у которых соотношение ПР-А : ПР-В ≤1 до начала лечения, имеют более высокий риск рецидива (71%), чем женщины с соотношением ПР-А : ПР-В >1 (19%) [6, 7]. Исследование E.T. Slettenn и соавт. также подтвердило связь между рецидивом гиперпластических изменений эндометрия без атипии, низким уровнем стромального ПР-А и высокой экспрессией железистого ПР-В [6].
В процессе циклической трансформации эндометрия, включая частичное отторжение и репарацию тканей во время менструации, запрограммированная гибель клеток (апоптоз) играет важную роль [1]. Регуляция апоптоза зависит от оптимального соотношения между антиапоптотическим белком Bcl-2 и инициирующим апоптоз геном х-белка, связанным с Bcl-2 (BAX) [8]. Экспрессия Bcl-2 значительно выше при неатипичных гиперплазиях по сравнению с атипическими морфотипами [7]. Однако для уточнения прогностической значимости Bcl-2 и BAX в рецидивах гиперпластических изменений эндометрия требуется дальнейшее исследование.
Также в контроле апоптоза и клеточной пролиферации принимает участие фосфатаза и гомолог тензина (PTEN), действуя как антагонист внутриклеточных сигнальных путей, индуцированных факторами роста. Мутации в гене PTEN признаны как важный фактор в развитии рака эндометрия [9]. Однако в отношении прогнозирования рецидива гиперпластических изменений эндометрия и экспрессии PTEN исследования E.T. Slettenn и соавт. не выявили связи [6]. Маркеры p53 и Ki67, хотя и малоизученные, согласно литературным данным, демонстрируют положительные результаты в прогнозировании гиперпластических изменений эндометрия, требуя дальнейшего исследования [10].
Цель исследования: установить наиболее информативные иммуногистохимические маркеры рецидивирующей эндометриальной гиперплазии без атипии у женщин репродуктивного возраста.
Результаты ИГХ-исследования представлены в таблице.
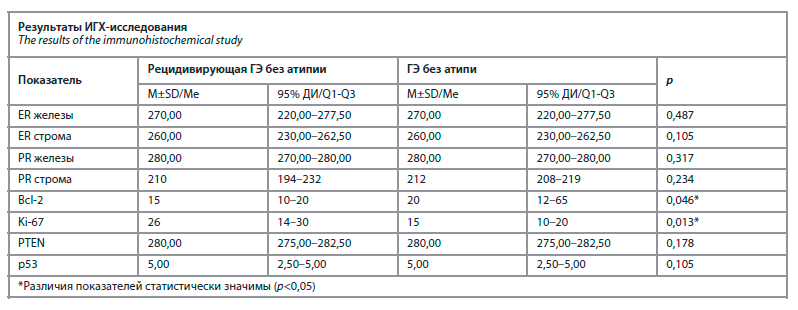
В ходе первичного обследования у 100% пациенток были верифицированы морфологические признаки неатипической ГЭ. С целью оценки ключевых маркеров пролиферации и апоптоза стандартное морфологическое исследование дополнено ИГХ-профилем экспрессии маркеров Ki-67, p53, Bcl2, PTEN. Результатами ИГХ установлена высокая экспрессия маркера Ki-67, что свидетельствовало о наличии повышенного пролиферативного потенциала в изучаемых локусах эндометриального паттерна. О наличии ИГХ-признаков дефектного апоптоза свидетельствовала низкая экспрессия маркера Bcl 2.
О наличии признаков локальной гиперэстрогении на фоне рецепторной дисфункции свидетельствовала положительная экспрессия к рецепторам эстрогена в эпителии желез и строме эндометрия, выявленная в ходе ИГХ-исследования.
У 40% пациенток, страдающих рецидивирующей ГЭ (у 18,2% в группе сравнения), установлены ИГХ-признаки хронического эндометрита (СD138+).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование не имело спонсорской поддержки.
Funding. The study had no sponsorship.
Благодарности. Публикация выполнена в рамках проекта № 030145-0-000.
Acknowledgments. The publication was performed under project number 030145-0-000.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia.
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Михалева Людмила Михайловна – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., директор ФГБНУ «НИИМЧ им. акад. А.П. Авцына». E-mail: mikhalevam@yandex.ru;
ORCID: 0000-0003-2052-914X; SPIN-код: 2086-7513
Liudmila M. Mikhaleva – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., director Research Institute of Human Morphology named after Academician A.P. Avtsyna. E-mail: mikhalevam@yandex.ru; ORCID: 0000-0003-2052-914X; SPIN-код: 2086-7513
Хамошина Марина Борисовна – заслуженный деятель науки РФ, д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: khamoshina@mail.ru; ORCID: 0000-0003-1940-4534
Marina B. Khamoshina – Honored Scientist of the Russian Federation, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia.
E-mail: khamoshina@mail.ru; ORCID: 0000-0003-1940-4534
Муллина Ирина Александровна – аспирант каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 211irina2111@rambler.ru;
ORCID: 0000-0002-5773-6399
Irina A. Mullina – Graduate Student, Patrice Lumumba People’s Friendship University of Russia.
E-mail: 211irina2111@rambler.ru;
ORCID: 0000-0002-5773-6399
Артеменко Юлия Сергеевна – аспирант каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. ORCID: 0000-0003-2116-1420
Yulia S. Artemenko – Graduate Student, Patrice Lumumba People’s Friendship University of Russia.
ORCID: 0000-0003-2116-1420
Поступила в редакцию: 12.03.2024
Поступила после рецензирования: 19.03.2024
Принята к публикации: 21.03.2024
Received: 12.03.2024
Revised: 19.03.2024
Accepted: 21.03.2024
Pathogenetic aspects of recurrent endometrial hyperplasia without atypia in women of childbearing age
Mekan R. Orazov1, Liudmila M. Mikhaleva2, Marina B. Khamoshina1, Irina A. Mullina1,Yulia S. Artemenko1
1 Patrice Lumumba People’s Friendship University of Russi, Moscow, Russia;
2 Research Institute of Human Morphology named after Academician A.P. Avtsyna, Moscow, Russia
omekan@mail.ru
Abstract
Aim: to determine the most informative immunohistochemical markers of recurrent endometrial hyperplasia without atypia in women of childbearing age.
Methods. Prospective analysis of 89 patients of childbearing age was performed at the Department of Obstetrics and Gynecology with Perinatology, Medical Institute of the Peoples' Friendship University of Russia. During the study the patients were divided into two cohorts based on the EH course: the index group (n=45) was represented by patients with the morphologically verified recurrent endometrial hyperplasia without atypia (one or more episodes within a year), the control group (n=44) was represented by patients with the newly diagnosed endometrial hyperplasia without atypia. The average age of patients in the studied cohort was 44±3.0 years (comparison group – 42±2.0 years).
Results. Immunohistochemical markers of recurrence were identified during the study: high Ki-67 expression (p<0.05), low Bcl-2 expression (p<0.05) that enhanced proliferative and reduce antiproliferative processes in the endometrium. Immunohistochemical signs of chronic endometritis (СD138+) were found in 40% of patients suffering from recurrent endometrial hyperplasia (in 18.2% of controls). It should be also noted that there was local hyperestrogenism associated with high expression of estrogen in the glandular epithelium and stroma.
Conclusion. Thus, the Ki-67 marker expression and low Bcl-2 expression contribute to recurrence of endometrial hyperplasia without atypia. Furthermore, the combination of endometrial hyperplasia and morphologically verified chronic endometritis provides a further predictor of the endometrial proliferative process recurrence. Immunohistochemistry makes it possible to predict not only the risk of recurrent endometrial hyperplasia, but also the disease course. However, there is currently no universal marker allowing one to predict the chance of hyperplasia diagnosis and recurrence.
Design: a comparative prospective study.
Keywords: hysteroscopy, endometrial proliferative disease, endometrial cancer, endometrial hyperplasia, immunohistochemical markers.
For citation: Orazov M.R., Mihaleva L.M., Khamoshina M.B., Mullina I.A., Artemenko Yu.S. Pathogenetic aspects of recurrent endometrial hyperplasia without atypia in women of childbearing age. Clinical review for general practice. 2024; 5 (2): 89–92 (In Russ.). DOI: 10.47407/ kr2023.5.2.00393
Актуальность проблемы
Гиперплазия эндометрия (ГЭ) является предшественником рака эндометрия, самого распространенного гинекологического злокачественного новообразования в странах с высоким уровнем дохода [1]. ГЭ представляет собой пролиферацию железистой ткани, классифицируемую либо как неатипическую гиперплазию эндометрия, либо, если цитологические признаки являются аномальными, как атипическую гиперплазию эндометрия. Клиническое значение ГЭ заключается в том, что пациенты сталкиваются как с высоким риском скрытого рака эндометрия, так и с высоким риском прогрессирования рака эндометрия при отсутствии лечения [2].Прогнозирование ГЭ является актуальной проблемой: ограниченное количество иммунногистохимических маркеров, отсутствие единого мнения, отсутствие профилактики рака эндометрия (скрининга). Большинство исследований были сосредоточены на изучении стероидных рецепторов, а именно изоморфов рецепторов эстрогена (ЭР) и прогестерона (ПР). Исследование, проведенное D.A. Gibson и соавт., показало увеличение экспрессии ЭРα при гиперпластических изменениях без атипии по сравнению с нормальным секреторным эндометрием [3]. Однако исследование E.T. Slettenn и соавт. не выявило связи между уровнем экспрессии эстрогена и рецидивом гиперпластических эндометриальных изменений [4].
Прогестерон – гормон, который снижает активность пролиферативного действия эстрогена [5]. Уровень экспрессии различных изоформ рецепторов прогестерона (ПР-А и ПР-В) в эндометриальных железах и строме, определенный при биопсии эндометрия до начала лечения гиперпластических изменений, имеет статистически значимую связь с возможностью рецидива гиперпластических процессов эндометрия. Женщины, у которых соотношение ПР-А : ПР-В ≤1 до начала лечения, имеют более высокий риск рецидива (71%), чем женщины с соотношением ПР-А : ПР-В >1 (19%) [6, 7]. Исследование E.T. Slettenn и соавт. также подтвердило связь между рецидивом гиперпластических изменений эндометрия без атипии, низким уровнем стромального ПР-А и высокой экспрессией железистого ПР-В [6].
В процессе циклической трансформации эндометрия, включая частичное отторжение и репарацию тканей во время менструации, запрограммированная гибель клеток (апоптоз) играет важную роль [1]. Регуляция апоптоза зависит от оптимального соотношения между антиапоптотическим белком Bcl-2 и инициирующим апоптоз геном х-белка, связанным с Bcl-2 (BAX) [8]. Экспрессия Bcl-2 значительно выше при неатипичных гиперплазиях по сравнению с атипическими морфотипами [7]. Однако для уточнения прогностической значимости Bcl-2 и BAX в рецидивах гиперпластических изменений эндометрия требуется дальнейшее исследование.
Также в контроле апоптоза и клеточной пролиферации принимает участие фосфатаза и гомолог тензина (PTEN), действуя как антагонист внутриклеточных сигнальных путей, индуцированных факторами роста. Мутации в гене PTEN признаны как важный фактор в развитии рака эндометрия [9]. Однако в отношении прогнозирования рецидива гиперпластических изменений эндометрия и экспрессии PTEN исследования E.T. Slettenn и соавт. не выявили связи [6]. Маркеры p53 и Ki67, хотя и малоизученные, согласно литературным данным, демонстрируют положительные результаты в прогнозировании гиперпластических изменений эндометрия, требуя дальнейшего исследования [10].
Цель исследования: установить наиболее информативные иммуногистохимические маркеры рецидивирующей эндометриальной гиперплазии без атипии у женщин репродуктивного возраста.
Материал и методы
Выполнен проспективный анализ результатов обследования 89 пациенток репродуктивного возраста на базе кафедры акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. В ходе исследования были сформированы две когорты пациенток в зависимости от течения ГЭ: основная (n=45) – представлена пациентками с морфологически верифицированной рецидивирующей ГЭ без атипии (1 и более эпизодов рецидива в течение года), сравнения (n=44) – пациентки с впервые выявленной ГЭ без атипии. Средний возраст пациенток изучаемой когорты составил 44±3,0 года (группы сравнения – 42±2,0 года). Проводилась морфологическая (гистологическая и иммуногистохимическая) оценка эндометрия, полученная с помощью прицельной биопсии под контролем гистероскопии. Гистологические образцы готовили по стандартным методикам. Для проведения иммуногисто-хмического (ИГХ) исследования подготовлены антитела (ER, PR, PTEN, Ki-67, Bcl-2, p53) для работы с парафиновыми срезами.Результаты
Средний возраст пациенток изучаемой когорты составил 44±3,0 года (группы сравнения – 42±2,0 года). Следует отметить, что частота рецидивов ГЭ без атипии с возрастом увеличивается. Статистически значимо чаще рецидив наблюдается у пациенток более позднего репродуктивного возраста (от 39 до 47 лет).Результаты ИГХ-исследования представлены в таблице.

В ходе первичного обследования у 100% пациенток были верифицированы морфологические признаки неатипической ГЭ. С целью оценки ключевых маркеров пролиферации и апоптоза стандартное морфологическое исследование дополнено ИГХ-профилем экспрессии маркеров Ki-67, p53, Bcl2, PTEN. Результатами ИГХ установлена высокая экспрессия маркера Ki-67, что свидетельствовало о наличии повышенного пролиферативного потенциала в изучаемых локусах эндометриального паттерна. О наличии ИГХ-признаков дефектного апоптоза свидетельствовала низкая экспрессия маркера Bcl 2.
О наличии признаков локальной гиперэстрогении на фоне рецепторной дисфункции свидетельствовала положительная экспрессия к рецепторам эстрогена в эпителии желез и строме эндометрия, выявленная в ходе ИГХ-исследования.
У 40% пациенток, страдающих рецидивирующей ГЭ (у 18,2% в группе сравнения), установлены ИГХ-признаки хронического эндометрита (СD138+).
Заключение
Таким образом, экспрессия маркера Ki-67 и низкая экспрессия Bcl-2 способствуют рецидивирующему течению ГЭ без атипии. Также сочетание ГЭ с морфологически подтвержденным хроническим эндометритом служит дальнейшим предиктором рецидивирования пролиферативного процесса эндометрия. ИГХ позволяет прогнозировать не только риски рецидивирования ГЭ, но и течение заболевания. Однако на данный момент нет универсального маркера, который позволил бы прогнозировать возможность как диагностики гиперплазии, так и ее рецидивирования.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование не имело спонсорской поддержки.
Funding. The study had no sponsorship.
Благодарности. Публикация выполнена в рамках проекта № 030145-0-000.
Acknowledgments. The publication was performed under project number 030145-0-000.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia.
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Михалева Людмила Михайловна – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., директор ФГБНУ «НИИМЧ им. акад. А.П. Авцына». E-mail: mikhalevam@yandex.ru;
ORCID: 0000-0003-2052-914X; SPIN-код: 2086-7513
Liudmila M. Mikhaleva – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., director Research Institute of Human Morphology named after Academician A.P. Avtsyna. E-mail: mikhalevam@yandex.ru; ORCID: 0000-0003-2052-914X; SPIN-код: 2086-7513
Хамошина Марина Борисовна – заслуженный деятель науки РФ, д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: khamoshina@mail.ru; ORCID: 0000-0003-1940-4534
Marina B. Khamoshina – Honored Scientist of the Russian Federation, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia.
E-mail: khamoshina@mail.ru; ORCID: 0000-0003-1940-4534
Муллина Ирина Александровна – аспирант каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 211irina2111@rambler.ru;
ORCID: 0000-0002-5773-6399
Irina A. Mullina – Graduate Student, Patrice Lumumba People’s Friendship University of Russia.
E-mail: 211irina2111@rambler.ru;
ORCID: 0000-0002-5773-6399
Артеменко Юлия Сергеевна – аспирант каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. ORCID: 0000-0003-2116-1420
Yulia S. Artemenko – Graduate Student, Patrice Lumumba People’s Friendship University of Russia.
ORCID: 0000-0003-2116-1420
Поступила в редакцию: 12.03.2024
Поступила после рецензирования: 19.03.2024
Принята к публикации: 21.03.2024
Received: 12.03.2024
Revised: 19.03.2024
Accepted: 21.03.2024
Список исп. литературыСкрыть список1. Henderson I, Black N, Khattak H; UKARCOG Working Group Authors; Gupta JK, Rimmer MP. Diagnosis and management of endometrial hyperplasia: A UK national audit of adherence to national guidance 2012–2020. PLoS Med. 2024;21(2):e1004346. DOI: 10.1371/journal.pmed. 1004346.
2. Ring KL, Mills AM, Modesitt SC. Endometrial Hyperplasia. Obstet Gynecol. 2022;140(6):1061-75. DOI: 10.1097/AOG.0000000000004989. PMID: 36357974.
3. Gibson DA, Saunders PT. Estrogen dependent signaling in reproductive tissues – a role for estrogen receptors and estrogen related receptors. Mol Cell Endocrinol. 2012;348(2):361-72. DOI: 10.1016/j.mce.2011. 09.026
4. Slettenn ET, Arnes M, Lysa LM et al. Prediction of relapse after therapy withdrawal in women with endometrial hyperplasia: a long-term follow-up study. Anticancer Res. 2017;37:2529-36.
5. MacLean JA II, Hayashi K: Progesterone Actions and Resistance in Gynecological Disorders. Cells. 2022;11:647. DOI: 10.3390/cells11040647
6. Sletten, ET, Arnes, M, Lyså, LM et al. Significance of progesterone receptors (PR-A and PR-B) expression as predictors for relapse after successful therapy of endometrial hyperplasia: a retrospective cohort study. BJOG. 2019;126:936-43.
7. Travaglino, A, Raffone, A, Saccone, G et al. Immunohistochemical predictive markers of response to conservative treatment of endometrial hyperplasia and early endometrial cancer: A systematic review. Acta Obstet Gynecol Scand. 2019;98:1086-99.
8. Sanderson PA, Critchley HO, Williams AR et al. New concepts for an old problem: the diagnosis of endometrial hyperplasia. Hum Reprod Update. 2017;23(2).
9. Dvorak O, Ndukwe M, Slavickova M et al DNA methylation of selected tumor suppressor genes in endometrial hyperplasia. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2024;168(1):68-73. DOI: 10.5507/bp.2022.053. PMID: 36628559.
10. Оразов М.Р., Хамошина М.Б., Муллина И.А., Артеменко Ю.С. Гиперплазия эндометрия – от патогенеза к эффективной терапии. Акушерство и гинекология: новости, мнения, обучение. 2021;9(3):21-8.
Orazov M.R., Khamoshina M.B., Mullina I.A., Artemenko Y.S. Endometrial hyperplasia – from pathogenesis to effective therapy. Obstetrics and gynecology: news, opinions, training. 2021;9(3):21-8 (in Russian).


