Клинический разбор в общей медицине №4 2024
Клинический разбор в общей медицине №4 2024
Тактика врача первичного звена при выявлении очаговых образований в легочной ткани
Номера страниц в выпуске:83-88
Аннотация
С целью своевременного и качественного оказания медицинской помощи населению в рамках улучшения материальной базы медицинских организаций многие лечебно-профилактические учреждения в последние три года были оснащены современным рентгеновским оборудованием. Большое количество пациентов были подвергнуты исследованию – компьютерной томографии органов грудной полости, что позволило выявить у ряда лиц бессимптомно протекающие образования в легочной ткани. С учетом необходимости своевременной дифференциальной диагностики таких образований и в первую очередь с целью исключения злокачественных легочных новообразований встает вопрос о том, какой тактики необходимо придерживаться врачу первичного звена в случае первичного выявления у пациента очагового образования в легких. В статье представлен клинический случай, демонстрирующий выявление легочного образования, требовавшего активной тактики ведения пациентки, представлены инструменты, использование которых придает врачу уверенности в своих действиях по ранней диагностике злокачественных новообразований легких.
Ключевые слова: очаговые образования, легочный фиброз, рак легкого, риск малигнизации, компьютерная томография, первичное звено.
Для цитирования: Усачева Е.В., Паленых А.В., Усачев Н.А., Ботвинко И.Ю. Тактика врача первичного звена при выявлении очаговых образований в легочной ткани. Клинический разбор в общей медицине. 2024; 5 (4): 83–88. DOI: 10.47407/kr2024.5.4.00423
С целью своевременного и качественного оказания медицинской помощи населению в рамках улучшения материальной базы медицинских организаций многие лечебно-профилактические учреждения в последние три года были оснащены современным рентгеновским оборудованием. Большое количество пациентов были подвергнуты исследованию – компьютерной томографии органов грудной полости, что позволило выявить у ряда лиц бессимптомно протекающие образования в легочной ткани. С учетом необходимости своевременной дифференциальной диагностики таких образований и в первую очередь с целью исключения злокачественных легочных новообразований встает вопрос о том, какой тактики необходимо придерживаться врачу первичного звена в случае первичного выявления у пациента очагового образования в легких. В статье представлен клинический случай, демонстрирующий выявление легочного образования, требовавшего активной тактики ведения пациентки, представлены инструменты, использование которых придает врачу уверенности в своих действиях по ранней диагностике злокачественных новообразований легких.
Ключевые слова: очаговые образования, легочный фиброз, рак легкого, риск малигнизации, компьютерная томография, первичное звено.
Для цитирования: Усачева Е.В., Паленых А.В., Усачев Н.А., Ботвинко И.Ю. Тактика врача первичного звена при выявлении очаговых образований в легочной ткани. Клинический разбор в общей медицине. 2024; 5 (4): 83–88. DOI: 10.47407/kr2024.5.4.00423
Clinical case
1 Omsk State Medical University, Omsk, Russia;
2 City Polyclinic No. 4, Omsk, Russia;
3 Clinical Medical and Sanitary Unit No. 7, Omsk, Russia
ElenaV.Usacheva@yandex.ru
Abstract
In order to provide timely and quality medical care to the population within the framework of improving the material base of medical organizations, many treatment and preventive care institutions have been equipped with modern X-ray equipment in the last three years. A large number of patients have been subjected to computed tomography of the chest organs, which has made it possible to detect asymptomatic pulmonary masses in a number of individuals. Taking into account the necessity of timely differential diagnostics of such masses and, first of all, in order to exclude malignant pulmonary neoplasms, the question arises what tactics should be followed by a primary care physician in case of detection of pulmonary neoplasms in a patient for the first time. The article presents a Clinical case demonstrating the detection of pulmonary neoplasm, which required active tactics of patient management, and presents tools, the use of which gives the doctor confidence in his actions for early diagnosis of malignant neoplasms.
Keywords: nodes, pulmonary fibrosis, lung cancer, risk of malignant neoplasms, computed tomography, outpatient care.
For citation: Usacheva E.V., Palenykh A.V., Usachev N.A., Botvinko I.Yu. The actions of the doctor in detecting a focal formation in the lung tissue. Clinical review for general practice. 2024; 5 (4): 83–88 (In Russ.). DOI: 10.47407/kr2024.5.4.00423
На обзорных рентгенограммах или флюорограммах выявить одиночный очаг размером менее 1 см затруднительно. Поэтому на сегодняшний день все большее значение в диагностике легочных образований приобретает компьютерная томография (КТ), позволяющая выявлять очаги в легочной ткани в 4 раза чаще за счет возможности визуализации более мелких образований [2]. Тем не менее КТ также не является абсолютным методом в диагностике злокачественных новообразований (ЗНО) в легких: при наличии высокой чувствительности КТ к выявлению очагов специфичность метода остается довольно низкой. Одной из причин низкой специфичности метода является то, что в настоящее время не существует достоверных КТ-признаков злокачественности или доброкачественности процесса [4, 5]. Поэтому для врача первичного звена при выявлении у пациента очагов в легочной ткани важным является определение дальнейшей диагностической тактики в каждом конкретном случае: активное вмешательство или динамическое наблюдение.
Нами представлен клинический случай ведения пациента с впервые выявленным образованием в легочной ткани в амбулаторной практике.
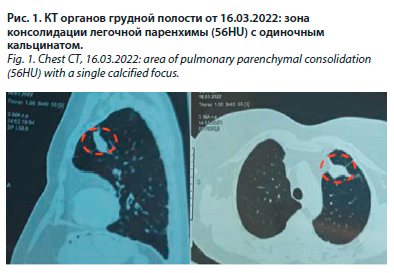 Пациентка Я. 80 лет 19 марта 2023 г. поступила в пульмонологическое отделение многопрофильного стационара с жалобами на выраженную инспираторную одышку, слабость и утомляемость.
Пациентка Я. 80 лет 19 марта 2023 г. поступила в пульмонологическое отделение многопрофильного стационара с жалобами на выраженную инспираторную одышку, слабость и утомляемость.
Из анамнеза известно, что в феврале 2022 г. перенесла коронавирусную инфекцию COVID-19 с развитием вирусной пневмонии и поражением легочной ткани в объеме 25%. В марте 2022 г. в исходе заболевания пациентке проведена контрольная КТ органов грудной полости, при которой был выявлен участок безвоздушной легочной ткани. Данный участок был описан врачом-рентгенологом как локализованная в переднем сегменте верхней доли левого легкого зона консолидации легочной паренхимы с одиночным кальцинатом (до 2 мм) неправильной формы. Более того, присутствовали признаки фиброателектаза (рис. 1).
Пациентка 16 марта 2022 г. была направлена на консультацию к врачу-онкологу, который выставил диагноз «поствоспалительный пневмофиброз в исходе пневмонии, вызванной коронавирусной инфекцией COVID-19» и рекомендовал повторить КТ через 3 мес.
В сентябре 2022 г. пациентка стала отмечать постепенно нарастающую одышку и быструю утомляемость при физических нагрузках, в связи с чем самостоятельно выполнила КТ органов грудной полости, по результатам которой были выявлены солидное образование переднего сегмента верхней доли левого легкого размерами 51×27×24 мм и признаки массивного экссудативного плеврита слева.
С результатами контрольного КТ органов грудной полости пациентка обратилась амбулаторно к врачу-пульмонологу. На приеме у врача-пульмонолога было выполнено ультразвуковое исследование (УЗИ) плевральных полостей, при котором подтверждено наличие большого количества жидкости в левой плевральной полости толщиной 120 мм. С учетом массивности плеврита, тахипноэ 32 в минуту и сатурации 90% пациентка была направлена на госпитализацию по неотложной помощи. В приемном покое стационара была проведена плевральная пункция с удалением 1,3 л красно-кирпичной жидкости. При исследовании плевральной жидкости атипичных клеток не обнаружено, пациентка выписана на амбулаторное лечение под наблюдение врача-терапевта с повторной консультацией врача-онколога. Начат диагностический поиск.
При видеотрахеобронхоскопии 13 декабря 2022 г. выявлена деформация левого нижнедолевого бронха с циркулярной рубцовой деформацией (до 2 мм), слизистая не изменена, биопсия не взята. В этот же день выполнено УЗИ плевральных полостей, выявлена осумкованная жидкость с множественными перегородками, проведена пункция с удалением 1,5 л красно-кирпичной жидкости, выполнено УЗИ шейных и подключичных лимфоузлов (структурных изменений не выявлено), УЗИ органов брюшной полости (диффузные изменения в печени и в поджелудочной железе). В декабре 2022 г. консилиумом врачей-онкологов выставлен диагноз: «ЗНО левого легкого, St3b, Т4Н2М0, клиническая группа 4, левосторонний плеврит, хроническая дыхательная недостаточность. Ишемическая болезнь сердца, атеросклеротическая болезнь сердца, гипертоническая болезнь III стадии, контролируемая артериальная гипертензия, риск 4 (очень высокий), хроническая сердечная недостаточность 2А, функциональный класс II. Сахарный диабет второго типа. Анемия легкой степени тяжести».
За последующие 3 мес диспансерного наблюдения у врача-терапевта участкового было проведено 2 плевральных пункции с удалением 1200 и 1500 мл красно-кирпичной жидкости, атипичных клеток в исследуемом материале обнаружено не было. С 10 марта 2023 г. пациентка отметила ухудшение самочувствия в виде прогрессирования клинической симптоматики, 16 марта 2023 г. была госпитализирована.
В анализе плевральной жидкости от 19 марта 2023 г. впервые были выявлены атипичные клетки, что подтвердило наличие ЗНО легкого: плевральная жидкость мутная, цвет коричнево-красный, проба Ривальта положительная, лейкоциты 10–12 в поле зрения, эритроциты в большом количестве в поле зрения, эозинофилы 2%, нейтрофилы 86%, лимфоциты 12%, кислотоустойчивые микобактерии не обнаружены, АК – выявлены клетки недифференцированной аденокарциномы.
С учетом стадии патологического процесса пациентке было рекомендовано симптоматическое лечение в территориальной медицинской организации. На фоне прогрессирования опухолевого процесса 2 октября 2023 г. пациентка умерла.
Алгоритм ведения пациентов с наличием очаговых образований в легочной ткани впервые был предложен обществом Флейшнера [17] в 2004 г. (Guidelines for management of small pulmonary nodules detected on CT scans: a statement from the Fleischner Society). В 2005 и 2013 гг. алгоритм был дополнен информацией в отношении солидных и субсолидных узлов соответственно, а в 2017 г. в связи с накоплением новых научных данных – полностью обновлен.
Изучением вопроса очаговых образований в легочной ткани занимается и Британское торакальное общество (British Thoracic Society), которое в 2015 г. предложило собственные рекомендации по ведению пациентов с образованиями в легких [18]. В России в настоящее время реализуется пилотный проект по проведению скрининга на выявление образований с помощью низкодозовой КТ органов грудной полости [19]. Данное исследование является методом скрининга рака легкого, проводится среди здоровых лиц с небольшим риском развития онкологического процесса в легких с целью выявления и своевременного лечения ранних бессимптомных форм заболевания.
Независимо от авторства цель всех рекомендаций одна – предотвращение инвазивных процедур у пациентов с доброкачественными узлами и быстрое оперативное лечение злокачественных узлов. Таким образом, на основании анализа литературных данных и рекомендаций научных обществ следует учитывать, что вероятность того, что впервые выявленное у пациента образование в легочной ткани окажется злокачественным, зависит от шести параметров образования: размера, типа, скорости роста, характера края, локализации и риска малигнизации (озлокачествления). Рассмотрим данные параметры.
Размер образования. Известно, что риск озлокачествления повышается в соответствии со следующей тенденцией: при размере образования менее 5 мм риск незначительный (менее 1%), от 5 до 9 мм – риск повышается до 6%, от 8 до 20 мм – риск озлокачествления существенно увеличивается и составляет 18%. Если размер образования 20 мм и более, то вероятность озлокачествления составляет уже 50% [20]. Важно отметить, что при размерах образования 30 мм и более всеми профессиональными врачебными сообществами рекомендуется выбирать инвазивную стратегию ведения пациента и резецировать образование, так как вероятность озлокачествления превосходит все риски, связанные с выполнением операции.
Тип образования в зависимости от плотности. Плотность образования в легочной ткани, определяемая при КТ, позволяет разделить все очаги на три группы: очаги по типу матового стекла, субсолидные очаги и очаги солидного типа. Очаги по типу матового стекла отличаются низкой плотностью, на их фоне видны стенки бронхов, контуры сосудов и элементы измененного легочного интерстиция. Очаги субсолидного типа характеризуются наличием более плотного участка в центре и зоны низкой плотности по типу матового стекла на периферии. Известно, что частично солидные узлы малигнизируются в 63%, узлы по типу матового стекла – в 18%, а солидные узлы – в 7% случаев [20].
Рост образования. Показателем роста является увеличение линейного размера образования более чем на 1,5 мм либо увеличение объема образования более чем на 2 мм3 (или более чем на 25% от первоначального размера). Анализ роста образования может быть проведен по любым изображениям – флюорограммам, рентгенограммам, компьютерным томограммам. Как правило, стабильный по размеру в течение 2 лет или более узел считают доброкачественным. Для количественной оценки темпов роста опухоли была предложена условная единица – время удвоения объема (ВУО). В случае удвоения объема образования в течение более 600 дней риск злокачественности оценивается в 0,8%, если удвоение объема произошло в течение 400–600 дней – 4%, менее 400 дней – риск злокачественности увеличивается до 9,9%. Было показано, что доброкачественными являются образования, имеющие ВУО более 465 сут, в то время как ВУО злокачественных узлов в большинстве случаев составляет от 20 до 400 дней [20–22].
Характер края образования. Риск злокачественности относительно невысок у образований с ровными краями (20%) и повышается при неровных краях: бугристые – 60%, спикулообразные – 90–95% [23].
Локализация образования. В исследовании A. McWilliams из 102 злокачественных узлов почти две трети располагалось в верхних долях, из 77 узлов с перифиссуральным расположением, установленным при КТ, ни один не являлся злокачественным [24]. Таким образом, локализация в верхних долях легких свидетельствует о более высоком риске того, что образование является злокачественным.
Риск малигнизации образования. Известны факторы риска, которые повышают вероятность малигнизации легочных образований: курение в анамнезе ≥20 пачка/лет, профессиональные вредности (асбестоз, бериллиоз, силикоз, работа с ураном или радоном), наличие хронической легочной патологии (эмфизема, легочный фиброз, хроническое интерстициальное заболевание легких), любое онкозаболевание в анамнезе самого пациента или рак легкого в семейном анамнезе, пожилой возраст, маргинальное существование пациента [25]. Для объективизации риска малигнизации легочных узлов предложен ряд калькуляторов, в том числе модель Brock (PanCan), которая представляет собой многомерную модель, оценивающую вероятность того, что описанный на КТ легочный узел будет диагностирован как рак в течение 2–4-летнего периода наблюдения [25].
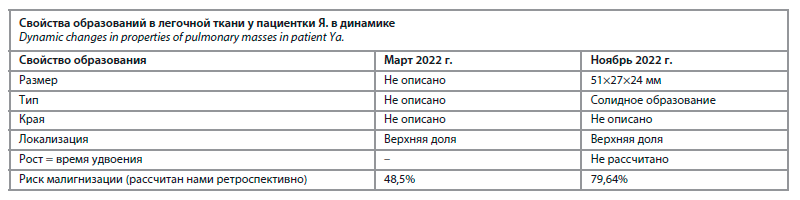
Приведенный нами клинический случай, когда от момента выявления образования в легочной ткани до момента установления диагноза «рак легкого» прошло 12 мес, формирует вопрос о том, мог ли диагноз ЗНО быть установлен на более ранней стадии, чем St3b, Т4Н2М0, параканкрозный экссудативный плеврит, клиническая группа 4. Для ответа на данный вопрос мы сравнили свойства образования, выявленного у пациентки, по данным КТ в марте 2022 г. и в ноябре 2022 г. (см. таблицу).
 При анализе данных установлено следующее:
При анализе данных установлено следующее:
1. Размер образования при первом обследовании описан не был, при повторном исследовании размер составил 51×27×24 мм. Известно, что узлы размером более 30 мм рекомендуют сразу резецировать, так как риск злокачественности превосходит все риски, связанные с выполнением операции.
2. Тип образования у пациентки был описан только при повторном исследовании как солидное образование (риск малигнизации около 7%).
3. Рост образования в исследовании от ноября 2022 г. описан как «увеличение образования», приведен размер образования при первом и втором исследованиях, однако не акцентировано внимание лечащего врача на том, что увеличение значимое: увеличение линейного размера на 1,5 мм и более, объема образования на 2 мм3 и более (25% и более от общего объема); не было рассчитано ВУО.
4. Ретроспективно нами проведен расчет ВУО. Для расчета был использован онлайн-калькулятор (https:// www.brit-thoracic.org.uk/quality-mprovement/guidelines/ pulmonary-nodules/pn-risk-calculator/). ВУО составило 141,43 дня, при этом известно, что ВУО менее 400 дней свидетельствует о риске малигнизации, равном 9%.
5. Локализация образования в легочной ткани у пациентки Я. соответствовала самому высокому риску злокачественности – верхняя доля. Известно, что в 60–70% случаев ЗНО легких локализуются в верхней доле, в 25–30% – в нижней доле, в 2–5% – в средней доле легкого [20].
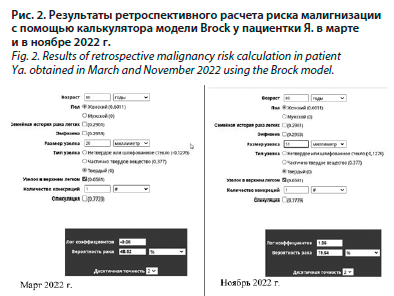
6. Риск малигнизации у пациентки Я. нами был рассчитан с помощью онлайн-калькулятора по модели Brock (Brock University Calculator, https://www.britthoracic.org.uk/qual-ity-improvement/guidelines/pulmonary-nodules/pn-risk-calculator..., рис. 2).
Онлайн-калькулятор предлагает автоматически формируемое заключение, которое в данном клиническом случае регламентирует применение инвазивной тактики ведения пациентки. Таким образом, по состоянию на март 2022 г. впервые выявленное у пациентки Я. объемное образование в верхней доле левого легкого с высоким риском вероятности было злокачественным, что требовало выбрать активную стратегию: направление на позитронно-эмиссионную томографию (ПЭТ), совмещенную с КТ, – ПЭТ/КТ, которая на сегодняшний день является современным неинвазивным методом диагностики рака легкого, специфичность и точность которого в разы превышает классическую рентгеновскую КТ. Этот метод диагностики позволяет более четко определить первичную опухоль, отличить опухолевую ткань от участков ателектаза и фиброзных изменений, расположенных рядом. Доказана высокая эффективность в оценке состояния лимфоузлов, а также в обнаружении отдаленных метастазов [26].
Отвечая на поставленный нами вопрос о том, мог ли диагноз ЗНО легкого быть установлен на более ранней стадии, чем St3b, Т4Н2М0, клиническая группа 4, считаем – да. Однако в данной ситуации, с учетом возраста пациентки, ее коморбидного фона и распространенности опухолевого процесса на момент обращения за медицинской помощью, проведение оперативного вмешательства, к сожалению, уже не представлялось возможным.
1) врачу-рентгенологу в протоколе КТ органов грудной полости описывать пять свойств образования: размер, тип, рост, характер края, локализация образования;
2) лечащему врачу при динамическом наблюдении за образованием рассчитывать ВУО с записью в первичной медицинской документации;
3) врачу-онкологу и врачу-терапевту участковому при впервые выявленном образовании в легочной ткани при первичном осмотре и далее в динамике ежегодно рассчитывать риск малигнизации, в том числе используя доступные онлайн-калькуляторы, при риске малигнизации более 10% в срочном порядке направлять пациентов на ПЭТ/КТ и/или выбирать инвазивную тактику – проведение биопсии/удаления образования.
Таким образом, использование современных простых объективизирующих методик позволяет выявлять онкологические заболевания на ранних стадиях и, стратифицируя пациентов в зависимости от риска, выбирать активную стратегию диагностики.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация о спонсорстве. Спонсор отсутствует.
Sponsorship information. There is no sponsor.
Информация об авторах
Information about the authors
Усачева Елена Владимировна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ. E-mail: elenav.usacheva@yandex.ru;
ORCID: 0000-0002-6134-1533
Elena V. Usacheva – Cand. Sci. (Med.), Associate Professor, Omsk State Medical University.
E-mail: elenav.usacheva@yandex.ru;
ORCID: 0000-0002-6134-1533
Паленых Алина Витальевна – студентка 4-го курса лечебного фак-та ФГБОУ ВО ОмГМУ. E-mail: palenyh@gmail.com;
ORCID: 0009-0009-3077-4895
Alina V. Palenykh – student, Omsk State Medical University. E-mail: palenyh@gmail.com;
ORCID: 0009-0009-3077-4895
Усачев Никита Андреевич – врач-терапевт БУЗОО ГП №4.
E-mail: usakrule@gmail.com; ORCID: 0000-0001-6051-1089
Nikita A. Usachev – therapist, City Polyclinic No. 4
E-mail: usakrule@gmail.com; ORCID: 0000-0001-6051-1089
Ботвинко Ирина Юрьевна – врач функциональной диагностики БУЗОО КМСЧ №7. E-mail: irinabotvinko@mail.ru
Irina Yu. Botvinko – doctor of functional diagnostics, Clinical Medical and Sanitary Unit No. 7.
E-mail: irinabotvinko@mail.ru
Поступила в редакцию: 04.03.2024
Поступила после рецензирования: 18.03.2024
Принята к публикации: 21.03.2024
Received: 04.03.2024
Revised: 18.03.2024
Accepted: 21.03.2024
The actions of the doctor in detecting a focal formation in the lung tissue
Elena V. Usacheva1, Alina V. Palenykh1, Nikita A. Usachev2, Irina Yu. Botvinko31 Omsk State Medical University, Omsk, Russia;
2 City Polyclinic No. 4, Omsk, Russia;
3 Clinical Medical and Sanitary Unit No. 7, Omsk, Russia
ElenaV.Usacheva@yandex.ru
Abstract
In order to provide timely and quality medical care to the population within the framework of improving the material base of medical organizations, many treatment and preventive care institutions have been equipped with modern X-ray equipment in the last three years. A large number of patients have been subjected to computed tomography of the chest organs, which has made it possible to detect asymptomatic pulmonary masses in a number of individuals. Taking into account the necessity of timely differential diagnostics of such masses and, first of all, in order to exclude malignant pulmonary neoplasms, the question arises what tactics should be followed by a primary care physician in case of detection of pulmonary neoplasms in a patient for the first time. The article presents a Clinical case demonstrating the detection of pulmonary neoplasm, which required active tactics of patient management, and presents tools, the use of which gives the doctor confidence in his actions for early diagnosis of malignant neoplasms.
Keywords: nodes, pulmonary fibrosis, lung cancer, risk of malignant neoplasms, computed tomography, outpatient care.
For citation: Usacheva E.V., Palenykh A.V., Usachev N.A., Botvinko I.Yu. The actions of the doctor in detecting a focal formation in the lung tissue. Clinical review for general practice. 2024; 5 (4): 83–88 (In Russ.). DOI: 10.47407/kr2024.5.4.00423
Введение
До настоящего времени методом первичного выявления очагов в легочной ткани остается традиционное рентгенологическое исследование [1]. Одиночные очаги выявляются в 0,2–1,0% случаев от всех рентгенологических исследований легких, при этом ряд авторов считает, что по меньшей мере 95% узелков являются доброкачественными [2, 3]. По мнению других авторов, половина из всех впервые выявленных в легких одиночных очагов являются злокачественными [4].На обзорных рентгенограммах или флюорограммах выявить одиночный очаг размером менее 1 см затруднительно. Поэтому на сегодняшний день все большее значение в диагностике легочных образований приобретает компьютерная томография (КТ), позволяющая выявлять очаги в легочной ткани в 4 раза чаще за счет возможности визуализации более мелких образований [2]. Тем не менее КТ также не является абсолютным методом в диагностике злокачественных новообразований (ЗНО) в легких: при наличии высокой чувствительности КТ к выявлению очагов специфичность метода остается довольно низкой. Одной из причин низкой специфичности метода является то, что в настоящее время не существует достоверных КТ-признаков злокачественности или доброкачественности процесса [4, 5]. Поэтому для врача первичного звена при выявлении у пациента очагов в легочной ткани важным является определение дальнейшей диагностической тактики в каждом конкретном случае: активное вмешательство или динамическое наблюдение.
Нами представлен клинический случай ведения пациента с впервые выявленным образованием в легочной ткани в амбулаторной практике.
Клинический случай
 Пациентка Я. 80 лет 19 марта 2023 г. поступила в пульмонологическое отделение многопрофильного стационара с жалобами на выраженную инспираторную одышку, слабость и утомляемость.
Пациентка Я. 80 лет 19 марта 2023 г. поступила в пульмонологическое отделение многопрофильного стационара с жалобами на выраженную инспираторную одышку, слабость и утомляемость.Из анамнеза известно, что в феврале 2022 г. перенесла коронавирусную инфекцию COVID-19 с развитием вирусной пневмонии и поражением легочной ткани в объеме 25%. В марте 2022 г. в исходе заболевания пациентке проведена контрольная КТ органов грудной полости, при которой был выявлен участок безвоздушной легочной ткани. Данный участок был описан врачом-рентгенологом как локализованная в переднем сегменте верхней доли левого легкого зона консолидации легочной паренхимы с одиночным кальцинатом (до 2 мм) неправильной формы. Более того, присутствовали признаки фиброателектаза (рис. 1).
Пациентка 16 марта 2022 г. была направлена на консультацию к врачу-онкологу, который выставил диагноз «поствоспалительный пневмофиброз в исходе пневмонии, вызванной коронавирусной инфекцией COVID-19» и рекомендовал повторить КТ через 3 мес.
В сентябре 2022 г. пациентка стала отмечать постепенно нарастающую одышку и быструю утомляемость при физических нагрузках, в связи с чем самостоятельно выполнила КТ органов грудной полости, по результатам которой были выявлены солидное образование переднего сегмента верхней доли левого легкого размерами 51×27×24 мм и признаки массивного экссудативного плеврита слева.
С результатами контрольного КТ органов грудной полости пациентка обратилась амбулаторно к врачу-пульмонологу. На приеме у врача-пульмонолога было выполнено ультразвуковое исследование (УЗИ) плевральных полостей, при котором подтверждено наличие большого количества жидкости в левой плевральной полости толщиной 120 мм. С учетом массивности плеврита, тахипноэ 32 в минуту и сатурации 90% пациентка была направлена на госпитализацию по неотложной помощи. В приемном покое стационара была проведена плевральная пункция с удалением 1,3 л красно-кирпичной жидкости. При исследовании плевральной жидкости атипичных клеток не обнаружено, пациентка выписана на амбулаторное лечение под наблюдение врача-терапевта с повторной консультацией врача-онколога. Начат диагностический поиск.
При видеотрахеобронхоскопии 13 декабря 2022 г. выявлена деформация левого нижнедолевого бронха с циркулярной рубцовой деформацией (до 2 мм), слизистая не изменена, биопсия не взята. В этот же день выполнено УЗИ плевральных полостей, выявлена осумкованная жидкость с множественными перегородками, проведена пункция с удалением 1,5 л красно-кирпичной жидкости, выполнено УЗИ шейных и подключичных лимфоузлов (структурных изменений не выявлено), УЗИ органов брюшной полости (диффузные изменения в печени и в поджелудочной железе). В декабре 2022 г. консилиумом врачей-онкологов выставлен диагноз: «ЗНО левого легкого, St3b, Т4Н2М0, клиническая группа 4, левосторонний плеврит, хроническая дыхательная недостаточность. Ишемическая болезнь сердца, атеросклеротическая болезнь сердца, гипертоническая болезнь III стадии, контролируемая артериальная гипертензия, риск 4 (очень высокий), хроническая сердечная недостаточность 2А, функциональный класс II. Сахарный диабет второго типа. Анемия легкой степени тяжести».
За последующие 3 мес диспансерного наблюдения у врача-терапевта участкового было проведено 2 плевральных пункции с удалением 1200 и 1500 мл красно-кирпичной жидкости, атипичных клеток в исследуемом материале обнаружено не было. С 10 марта 2023 г. пациентка отметила ухудшение самочувствия в виде прогрессирования клинической симптоматики, 16 марта 2023 г. была госпитализирована.
В анализе плевральной жидкости от 19 марта 2023 г. впервые были выявлены атипичные клетки, что подтвердило наличие ЗНО легкого: плевральная жидкость мутная, цвет коричнево-красный, проба Ривальта положительная, лейкоциты 10–12 в поле зрения, эритроциты в большом количестве в поле зрения, эозинофилы 2%, нейтрофилы 86%, лимфоциты 12%, кислотоустойчивые микобактерии не обнаружены, АК – выявлены клетки недифференцированной аденокарциномы.
С учетом стадии патологического процесса пациентке было рекомендовано симптоматическое лечение в территориальной медицинской организации. На фоне прогрессирования опухолевого процесса 2 октября 2023 г. пациентка умерла.
Обсуждение
История вопроса о возникновении очаговых образований легочной ткани волновала врачей-исследователей еще в XIX в., именно тогда, в 1894 г., была опубликована статья S. Gemmell и R. Buchanan «Случай сифилитического изъязвления трахеи и бронхов с уплотнением фиброзной ткани и казеозными (туберкулезными) узелками. Образования в базальных отделах легких, увеличение лимфатических желез и гуммы в печени» [6]. Шли годы, развивалась медицина, и уже ко второй половине XX в. было отмечено резкое возрастание числа исследований, касающихся образований в легочной паренхиме [7, 8]. В последние годы в связи с применением новых методов диагностики количество научных публикаций, посвященных вопросам впервые выявленных легочных образований, существенно увеличилось [9–16].Алгоритм ведения пациентов с наличием очаговых образований в легочной ткани впервые был предложен обществом Флейшнера [17] в 2004 г. (Guidelines for management of small pulmonary nodules detected on CT scans: a statement from the Fleischner Society). В 2005 и 2013 гг. алгоритм был дополнен информацией в отношении солидных и субсолидных узлов соответственно, а в 2017 г. в связи с накоплением новых научных данных – полностью обновлен.
Изучением вопроса очаговых образований в легочной ткани занимается и Британское торакальное общество (British Thoracic Society), которое в 2015 г. предложило собственные рекомендации по ведению пациентов с образованиями в легких [18]. В России в настоящее время реализуется пилотный проект по проведению скрининга на выявление образований с помощью низкодозовой КТ органов грудной полости [19]. Данное исследование является методом скрининга рака легкого, проводится среди здоровых лиц с небольшим риском развития онкологического процесса в легких с целью выявления и своевременного лечения ранних бессимптомных форм заболевания.
Независимо от авторства цель всех рекомендаций одна – предотвращение инвазивных процедур у пациентов с доброкачественными узлами и быстрое оперативное лечение злокачественных узлов. Таким образом, на основании анализа литературных данных и рекомендаций научных обществ следует учитывать, что вероятность того, что впервые выявленное у пациента образование в легочной ткани окажется злокачественным, зависит от шести параметров образования: размера, типа, скорости роста, характера края, локализации и риска малигнизации (озлокачествления). Рассмотрим данные параметры.
Размер образования. Известно, что риск озлокачествления повышается в соответствии со следующей тенденцией: при размере образования менее 5 мм риск незначительный (менее 1%), от 5 до 9 мм – риск повышается до 6%, от 8 до 20 мм – риск озлокачествления существенно увеличивается и составляет 18%. Если размер образования 20 мм и более, то вероятность озлокачествления составляет уже 50% [20]. Важно отметить, что при размерах образования 30 мм и более всеми профессиональными врачебными сообществами рекомендуется выбирать инвазивную стратегию ведения пациента и резецировать образование, так как вероятность озлокачествления превосходит все риски, связанные с выполнением операции.
Тип образования в зависимости от плотности. Плотность образования в легочной ткани, определяемая при КТ, позволяет разделить все очаги на три группы: очаги по типу матового стекла, субсолидные очаги и очаги солидного типа. Очаги по типу матового стекла отличаются низкой плотностью, на их фоне видны стенки бронхов, контуры сосудов и элементы измененного легочного интерстиция. Очаги субсолидного типа характеризуются наличием более плотного участка в центре и зоны низкой плотности по типу матового стекла на периферии. Известно, что частично солидные узлы малигнизируются в 63%, узлы по типу матового стекла – в 18%, а солидные узлы – в 7% случаев [20].
Рост образования. Показателем роста является увеличение линейного размера образования более чем на 1,5 мм либо увеличение объема образования более чем на 2 мм3 (или более чем на 25% от первоначального размера). Анализ роста образования может быть проведен по любым изображениям – флюорограммам, рентгенограммам, компьютерным томограммам. Как правило, стабильный по размеру в течение 2 лет или более узел считают доброкачественным. Для количественной оценки темпов роста опухоли была предложена условная единица – время удвоения объема (ВУО). В случае удвоения объема образования в течение более 600 дней риск злокачественности оценивается в 0,8%, если удвоение объема произошло в течение 400–600 дней – 4%, менее 400 дней – риск злокачественности увеличивается до 9,9%. Было показано, что доброкачественными являются образования, имеющие ВУО более 465 сут, в то время как ВУО злокачественных узлов в большинстве случаев составляет от 20 до 400 дней [20–22].
Характер края образования. Риск злокачественности относительно невысок у образований с ровными краями (20%) и повышается при неровных краях: бугристые – 60%, спикулообразные – 90–95% [23].
Локализация образования. В исследовании A. McWilliams из 102 злокачественных узлов почти две трети располагалось в верхних долях, из 77 узлов с перифиссуральным расположением, установленным при КТ, ни один не являлся злокачественным [24]. Таким образом, локализация в верхних долях легких свидетельствует о более высоком риске того, что образование является злокачественным.
Риск малигнизации образования. Известны факторы риска, которые повышают вероятность малигнизации легочных образований: курение в анамнезе ≥20 пачка/лет, профессиональные вредности (асбестоз, бериллиоз, силикоз, работа с ураном или радоном), наличие хронической легочной патологии (эмфизема, легочный фиброз, хроническое интерстициальное заболевание легких), любое онкозаболевание в анамнезе самого пациента или рак легкого в семейном анамнезе, пожилой возраст, маргинальное существование пациента [25]. Для объективизации риска малигнизации легочных узлов предложен ряд калькуляторов, в том числе модель Brock (PanCan), которая представляет собой многомерную модель, оценивающую вероятность того, что описанный на КТ легочный узел будет диагностирован как рак в течение 2–4-летнего периода наблюдения [25].
Приведенный нами клинический случай, когда от момента выявления образования в легочной ткани до момента установления диагноза «рак легкого» прошло 12 мес, формирует вопрос о том, мог ли диагноз ЗНО быть установлен на более ранней стадии, чем St3b, Т4Н2М0, параканкрозный экссудативный плеврит, клиническая группа 4. Для ответа на данный вопрос мы сравнили свойства образования, выявленного у пациентки, по данным КТ в марте 2022 г. и в ноябре 2022 г. (см. таблицу).

 При анализе данных установлено следующее:
При анализе данных установлено следующее:1. Размер образования при первом обследовании описан не был, при повторном исследовании размер составил 51×27×24 мм. Известно, что узлы размером более 30 мм рекомендуют сразу резецировать, так как риск злокачественности превосходит все риски, связанные с выполнением операции.
2. Тип образования у пациентки был описан только при повторном исследовании как солидное образование (риск малигнизации около 7%).
3. Рост образования в исследовании от ноября 2022 г. описан как «увеличение образования», приведен размер образования при первом и втором исследованиях, однако не акцентировано внимание лечащего врача на том, что увеличение значимое: увеличение линейного размера на 1,5 мм и более, объема образования на 2 мм3 и более (25% и более от общего объема); не было рассчитано ВУО.
4. Ретроспективно нами проведен расчет ВУО. Для расчета был использован онлайн-калькулятор (https:// www.brit-thoracic.org.uk/quality-mprovement/guidelines/ pulmonary-nodules/pn-risk-calculator/). ВУО составило 141,43 дня, при этом известно, что ВУО менее 400 дней свидетельствует о риске малигнизации, равном 9%.
5. Локализация образования в легочной ткани у пациентки Я. соответствовала самому высокому риску злокачественности – верхняя доля. Известно, что в 60–70% случаев ЗНО легких локализуются в верхней доле, в 25–30% – в нижней доле, в 2–5% – в средней доле легкого [20].
6. Риск малигнизации у пациентки Я. нами был рассчитан с помощью онлайн-калькулятора по модели Brock (Brock University Calculator, https://www.britthoracic.org.uk/qual-ity-improvement/guidelines/pulmonary-nodules/pn-risk-calculator..., рис. 2).
Онлайн-калькулятор предлагает автоматически формируемое заключение, которое в данном клиническом случае регламентирует применение инвазивной тактики ведения пациентки. Таким образом, по состоянию на март 2022 г. впервые выявленное у пациентки Я. объемное образование в верхней доле левого легкого с высоким риском вероятности было злокачественным, что требовало выбрать активную стратегию: направление на позитронно-эмиссионную томографию (ПЭТ), совмещенную с КТ, – ПЭТ/КТ, которая на сегодняшний день является современным неинвазивным методом диагностики рака легкого, специфичность и точность которого в разы превышает классическую рентгеновскую КТ. Этот метод диагностики позволяет более четко определить первичную опухоль, отличить опухолевую ткань от участков ателектаза и фиброзных изменений, расположенных рядом. Доказана высокая эффективность в оценке состояния лимфоузлов, а также в обнаружении отдаленных метастазов [26].
Отвечая на поставленный нами вопрос о том, мог ли диагноз ЗНО легкого быть установлен на более ранней стадии, чем St3b, Т4Н2М0, клиническая группа 4, считаем – да. Однако в данной ситуации, с учетом возраста пациентки, ее коморбидного фона и распространенности опухолевого процесса на момент обращения за медицинской помощью, проведение оперативного вмешательства, к сожалению, уже не представлялось возможным.
Заключение
Для улучшения качества медицинской помощи пациентам с впервые выявленными по данным КТ органов грудной полости образованиями в легочной ткани необходимо:1) врачу-рентгенологу в протоколе КТ органов грудной полости описывать пять свойств образования: размер, тип, рост, характер края, локализация образования;
2) лечащему врачу при динамическом наблюдении за образованием рассчитывать ВУО с записью в первичной медицинской документации;
3) врачу-онкологу и врачу-терапевту участковому при впервые выявленном образовании в легочной ткани при первичном осмотре и далее в динамике ежегодно рассчитывать риск малигнизации, в том числе используя доступные онлайн-калькуляторы, при риске малигнизации более 10% в срочном порядке направлять пациентов на ПЭТ/КТ и/или выбирать инвазивную тактику – проведение биопсии/удаления образования.
Таким образом, использование современных простых объективизирующих методик позволяет выявлять онкологические заболевания на ранних стадиях и, стратифицируя пациентов в зависимости от риска, выбирать активную стратегию диагностики.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация о спонсорстве. Спонсор отсутствует.
Sponsorship information. There is no sponsor.
Информация об авторах
Information about the authors
Усачева Елена Владимировна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ. E-mail: elenav.usacheva@yandex.ru;
ORCID: 0000-0002-6134-1533
Elena V. Usacheva – Cand. Sci. (Med.), Associate Professor, Omsk State Medical University.
E-mail: elenav.usacheva@yandex.ru;
ORCID: 0000-0002-6134-1533
Паленых Алина Витальевна – студентка 4-го курса лечебного фак-та ФГБОУ ВО ОмГМУ. E-mail: palenyh@gmail.com;
ORCID: 0009-0009-3077-4895
Alina V. Palenykh – student, Omsk State Medical University. E-mail: palenyh@gmail.com;
ORCID: 0009-0009-3077-4895
Усачев Никита Андреевич – врач-терапевт БУЗОО ГП №4.
E-mail: usakrule@gmail.com; ORCID: 0000-0001-6051-1089
Nikita A. Usachev – therapist, City Polyclinic No. 4
E-mail: usakrule@gmail.com; ORCID: 0000-0001-6051-1089
Ботвинко Ирина Юрьевна – врач функциональной диагностики БУЗОО КМСЧ №7. E-mail: irinabotvinko@mail.ru
Irina Yu. Botvinko – doctor of functional diagnostics, Clinical Medical and Sanitary Unit No. 7.
E-mail: irinabotvinko@mail.ru
Поступила в редакцию: 04.03.2024
Поступила после рецензирования: 18.03.2024
Принята к публикации: 21.03.2024
Received: 04.03.2024
Revised: 18.03.2024
Accepted: 21.03.2024
Список исп. литературыСкрыть список1. Лактионов К.К., Артамонова Е.В., Борисова Т.Н. и др. Злокачественное новообразование бронхов и легкого. Современная онкология. 2022;24(3):269-304.
Laktionov K.K., Artamonova E.V., Borisova T.N. et al. Malignant neoplasm of the bronchi and lung. Modern Oncology. 2022;24(3):269-304 (in Russian).
2. Тюрин И.Е. Дифференциальная диагностика одиночных очагов в легких. Поликлиника. 2014;(3-1):28-32.
Tyurin I.E. Differential diagnosis of single lesions in the lungs. Clinic. 2014;(3-1):28-32. (in Russian).
3. Mazzone PJ, Lam L. Evaluating the Patient With a Pulmonary Nodule: A Review. Journal of the American Medical Association Health Forum 2022;327(3):264-73.
4. Силантьева Н.К., Петросян А.П., Агабабян Т.А. и др. Динамическая и перфузионная компьютерная томография при одиночных очагах в легких. Онкология. Журнал им. П.А. Герцена. 2017;6(6):55-61.
Silantyeva N.K., Petrosyan A.P., Agababyan T.A. et al. Dynamic and perfusion computed tomography for single lesions in the lungs. Oncology. Journal named after P.A. Herzen. 2017;6(6):55-61 (in Russian).
5. Wu Z, Wang F, Cao W et al. Lung cancer risk prediction models based on pulmonary nodules: A systematic review. Thoracic Cancer 2022;13(5):664-77.
6. Zaevloshin MN. Syphilis of trachea and bronchi with stenosis of the trachea. Vestnik dermatologii i venerologii 1961;35:75-7.
7. Holin SM. Pulmonary nodules found in Cleveland survey. Journal of Community Medicine and Public Health Reports 1956;71(9):907-8.
8. Burrows FG. Pulmonary nodules in rheumatoid disease: a report of two cases. British Journal of Radiology 1967;40(472):256-61.
9. Cai J, Xu D, Liu S et al. The Added Value of Computer-aided Detection of Small Pulmonary Nodules and Missed Lung Cancers. Journal of Thoracic Imaging. 2018;33(6):390-5.
10. Alpert JB, Ko JP. Management of Incidental Lung Nodules: Current Strategy and Rationale. Radiologic Clinics of North America. 2018;56(3):339-51.
11. Schmid-Bindert G, Vogel-Claussen J, Gütz S et al. Incidental Pulmonary Nodules – What Do We Know in 2022. Respiration 2022;101(11):1024-34.
12. Farjah F, Monsell SE, Smith-Bindman R et al. Fleischner Society Guideline Recommendations for Incidentally Detected Pulmonary Nodules and the Probability of Lung Cancer. Journal of the American College of Radiology 2022;19(11):1226-35.
13. Patel P, Abbas H, Alghanim F et al. Incidental Pulmonary Nodules and Lung Cancer Screening. American Thoracic Society scholar 2023;4(2):243-5.
14. Horst C, Patel S, Nair A. Reporting and management of incidental lung findings on computed tomography: beyond lung nodules. British Journal of Radiology. 2023;96(1142):20220207.
15. Borg M, Kristensen K, Alstrup G et al. Consequences of Losing Incidental Pulmonary Nodules to Follow-Up: Unmonitored Nodules Progressing to Stage IV Lung Cancer. Respiration 2024;103(2):53-9.
16. Bagga B, Fansiwala K, Thomas S et al. Outcomes of Incidental Lung Nodules With Structured Recommendations and Electronic Tracking. Journal of the American College of Radiology 2022;19(3):407-14.
17. MacMahon H, Austin JH, Gamsu G et al. Guidelines for management of small pulmonary nodules detected on CT scans: a statement from the Fleischner Society. Radiology 2005;237(2):395-400.
18. Callister ME, Baldwin DR, Akram AR et al. British Thoracic Society guidelines for the investigation and management of pulmonary nodules. Thorax 2015;70(12):1188.
19. Морозов С.П., Гомболевский В.А., Владзимирский А.В. и др. Результаты первого года скрининга рака легкого с помощью низкодозной компьютерной томографии в Москве. Вопросы онкологии. 2019;(2).
Morozov S.P., Gombolevsky V.A., Vladzimirsky A.V. et al. Results of the first year of lung cancer screening using low-dose computed tomography in Moscow. Oncology issues. 2019;(2) (in Russian).
20. Mehta HJ, Ravenel JG, Shaftman SR et al. The utility of nodule volume in the context of malignancy prediction for small pulmonary nodules. Chest 2014;145(3):464-72.
21. Mendoza DP, Petranovic M, Som A et al. LUNG-RADS category 3 and 4 nodules on lung cancer screening in clinical practice. American Journal of Roentgenology 2022;219(1):55-65.
22. Li K, Yip R, Avila R et al. Size and Growth Assessment of Pulmonary Nodules: Consequences of the Rounding. Journal of Thoracic Oncology 2017;12(4):657-62.
23. Панина А.С., Жолдыбай Ж.Ж., Туркинбаев Е.К. и др. Характеристика узловых образований LUNG-RADS 4A и 4B категорий, обнаруженных при скрининге рака легкого с применением низкодозной компьютерной томографии. Онкология и радиология Казахстана. 2022;64(2):19-23.
Panina A.S., Zholdybai Zh.Zh., Turkinbaev E.K. et al. Characteristics of nodular formations of LUNG-RADS categories 4A and 4B detected during lung cancer screening using low-dose computed tomography. Oncology and radiology of Kazakhstan. 2022;64(2):19-23 (in Russian).
24. Порханов В.А., Шульженко Л.В., Поляков И.С. и др. Диагностика солитарных очаговых образований легких и стратегия диспансерного наблюдения за пациентами. Казанский медицинский журнал. 2016;(5).
Porkhanov V.A., Shulzhenko L.V., Polyakov I.S. et al. Diagnosis of solitary focal formations of the lungs and strategy for follow-up of patients. Kazan Medical Journal. 2016;(5) (in Russian).
25. Chung K, Mets OM, Gerke PK et al. Brock malignancy risk calculator for pulmonary nodules: validation outside a lung cancer screening population. Thorax 2018;73(9):857-63.
26. Hochhegger B, Alves GR, Irion KL et al. PET/CT imaging in lung cancer: indications and findings. Jornal brasileiro de pneumologia. 2015;41(3):264-74.


