Клинический разбор в общей медицине №7 2024
Аннотация
Согласно классификации Всемирной организации здравоохранения 2014 г., серомуцинозные опухоли яичников относятся к одному из шести видов эпителиальных опухолей яичников. Эти опухоли подразделяются на аденомы, атипично пролиферирующие (пограничные) опухоли и инвазивные карциномы. Частота встречаемости серомуцинозных опухолей яичников очень низкая: всего 1% составляют доброкачественные образования, 25% от всех атипично пролиферирующих опухолей – пограничные формы, а распространенность серомуцинозного рака все еще не изучена из-за его редкости. Именно по этой причине данная группа опухолей до сих пор не полностью изучена.
Ключевые слова: серомуцинозная пограничная опухоль яичников, эндометриоз, лечение, гистогенез.
Для цитирования: Оразов М.Р., Киселева М.В., Пернай В.М. Патогенез серомуцинозных пограничных опухолей яичников. Клинический разбор в общей медицине. 2024; 5 (7): 74–82. DOI: 10.47407/kr2024.5.7.00p425
Клинический разбор в общей медицине №7 2024
Патогенез серомуцинозных пограничных опухолей яичников
Аннотация
Согласно классификации Всемирной организации здравоохранения 2014 г., серомуцинозные опухоли яичников относятся к одному из шести видов эпителиальных опухолей яичников. Эти опухоли подразделяются на аденомы, атипично пролиферирующие (пограничные) опухоли и инвазивные карциномы. Частота встречаемости серомуцинозных опухолей яичников очень низкая: всего 1% составляют доброкачественные образования, 25% от всех атипично пролиферирующих опухолей – пограничные формы, а распространенность серомуцинозного рака все еще не изучена из-за его редкости. Именно по этой причине данная группа опухолей до сих пор не полностью изучена.
Ключевые слова: серомуцинозная пограничная опухоль яичников, эндометриоз, лечение, гистогенез.
Для цитирования: Оразов М.Р., Киселева М.В., Пернай В.М. Патогенез серомуцинозных пограничных опухолей яичников. Клинический разбор в общей медицине. 2024; 5 (7): 74–82. DOI: 10.47407/kr2024.5.7.00p425
Pathogenesis of ovarian seromucinous borderline tumors
Mekan R. Orazov1, Marina V. Kiseleva2, Vladlena M. Pernay1
1 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia;
2 Tsyb Medical Radiological Research Centre – branch of the National Medical Research Center of Radiology, Obninsk, Russia
omekan@mail.ru
Abstract
The 2014 World Health Organization classification identifies ovarian seromucinous tumors as one of the six categories of epithelial ovarian tumors. Ovarian seromucinous tumors encompass adenomas, atypical proliferating (borderline) tumors, and invasive carcinomas. These tumors are exceedingly rare, with benign instances accounting for a mere 1% and 25% of borderline cases among all atypical proliferating tumors. The rarity of seromucinous cancer means its prevalence has not been thoroughly investigated, which has resulted in this group of tumors remaining incompletely researched.
Keywords: ovarian seromucinous borderline tumors, endometriosis, treatment, histogenesis.
For citation: Orazov M.R., Kiseleva M.V., Pernay V.M. Pathogenesis of ovarian seromucinous borderline tumors. Clinical analysis in general medicine. 2024; 5 (7): 74–82. (In Russ.). DOI: 10.47407/kr2024.5.7.00p425
Эпителиальные карциномы яичников (epithelial ovarian carcinomas – EOCs) в основном подразделяются на серозный, муцинозный, светлоклеточный, эндометриоидный, переходный и плоскоклеточный рак [1]. Серомуцинозные опухоли яичников (СМОЯ) – это редкие новообразования, ранее классифицируемые как муцинозные опухоли мюллерова или эндоцервикального подтипа. В 2014 г. Всемирная организация здравоохранения (ВОЗ) впервые представила классификацию СМОЯ как отдельного патологического типа эпителиальных опухолей яичников (ЭОЯ) [2]. Признание этой особой группы является важным дополнением к классификации ЭОЯ. Известно, что в 1976 г. H. Fox и F. Langley ввели термин «серомуцинозная опухоль» для описания опухоли, состоящей из муцинозного эпителия эндоцервикального типа и клеток серозного типа [3]. Затем в 1988 г. J. Rutgers и R. Scully разделили похожие по внешнему виду пограничные опухоли на две категории: одна состояла из чистого эпителия эндоцервикального типа, а другая – из смеси муцинозных, серозных, эндометриоидных и индифферентных клеток эндоцервикального типа с обильной эозинофильной цитоплазмой [4, 5]. В 1993 г., Хендриксон и Кемпсон вернули термин «серомуцинозная опухоль» [6]. Предыдущие исследования почти полностью описывали серомуцинозные карциномы яичников (ovarian seromucinous carcinomas – OSMCs) с точки зрения патологии, и наше исследование в первую очередь сравнивает OSMC с другими EOCs, чтобы доказать, что OSMC отличается от ЕОС с клинической точки зрения.
OSMC, как разновидность злокачественной СМОЯ, в последние годы вызвала широкую полемику в области патологии. Некоторые патологи не считали, что OSMC может быть четко определенным гистологическим образованием, потому что его морфологический и иммунный фенотип перекрывался с другими типами опухолей яичников, особенно с эндометриоидной карциномой яичников (ovarian endometrioid carcinoma – OEC) и серозной карциномой низкой степени злокачественности с муцинозной дифференцировкой [7]. Таким образом, в 5-м издании Классификации опухолей женских половых органов ВОЗ, опубликованном в 2020 г., OSMC исключен как отдельный объект и теперь рассматривается как подтип OEC [8]. Но из-за его редкости нет клинической и патологической информации об OSMC, а также не сообщалось о клинических исследованиях для сравнения OSMC и других клинико-патологических особенностей, в основном EOCs. Термин «серомуцинозный» широко используется среди патологоанатомов уже более 40 лет для описания данной подгруппы ЭОЯ. Серомуцинозные опухоли до сих пор являются объектом дискуссии среди онкогинекологов, так как очень часто трактуется, что СМОЯ является смесью серозной и муцинозной опухолей, что совершенно неверно [2].
Серомуцинозные опухоли чаще всего представлены в виде пограничных опухолей, но могут быть как доброкачественными, так и злокачественными. Средний возраст пациенток с серомуцинозными пограничными опухолями составляет 34–44 года. До 40% случаев характеризуются двусторонним поражением, и 30–50% связаны с эндометриозом. Эти опухоли представляют собой одно- или многокамерные кистозные образования среднего диаметра 8–10 см. Содержимое кист может быть геморрагическим, серозным, муцинозным или слизисто-гнойным из-за инфильтрации нейтрофилов. Микроскопически они напоминают серозные пограничные опухоли яичников, имеющие ветвистые сосочки. Эти сосочки выстланы столбчатыми муцинозными клетками с ядрами в основании и апикальным муцином [9–11].
В изучении серомуцинозных пограничный опухолей яичников (СМПОЯ) была замечена их ассоциация с эндометриозом, в исследованиях была обнаружена связь между СМПОЯ и эндометриозом в 45–71% случаев.
J. Rutgers и R. Scully в своем исследовании выявили, что эндометриоз в 30% случаев является сопутствующим заболеванием при мюллеровской муцинозной папиллярной пограничной опухоли и в 53% – смешанно-эпителиальной папиллярной пограничной опухоли мюллеровского типа [12, 13]. В 2010 г. две группы исследователей практически одновременно сообщили о мутации гена ARID1A у 57% испытуемых [7, 14]. ARID1A – это ген-супрессор, расположенный на хромосоме 1p36.11 и кодирующий белок BAF250a [3]. BAF250a является членом семейства SWI/SNF, которое играет важную роль в ремоделировании хроматина. Эндометриоз-ассоциированная опухоль связана с изменениями в инактивирующих мутациях ARID1A [15]. Известно, что ARID1A кодирует белок BAF250A и участвует в ремоделировании хроматина. Исследования показали, что в 33% случаев происходит потеря экспрессии гена ARID1A при СМПОЯ [16]. Это соответствует частоте выявленных мутаций данного гена в опухолях, ассоциированных с эндометриозом, включая эндометриоидные и светлоклеточные опухоли. Эти данные подтверждают включение серозной пограничной опухоли яичников в категорию эндометриозассоциированных опухолей.
В 2020 г. R. Wu и соавт. провели исследование на 33 образцах СМПОЯ и выявили мутации в KRAS в 100%, PIK3CA – 60,7% и ARID1A в 14,3%. Активация онкогена PIK3CA характерна для эндометриозассоциированной опухоли, что еще раз показывает связь между СМПОЯ и эндометриозом [17].
Существует несколько теорий относительно гистогенеза ЭОЯ, и происхождение СМОЯ исследуется в этом контексте. Исторически первой теорией происхождения опухолей из покровного эпителия яичника была теория о происхождении опухолей из самого эпителия. Однако в последнее время большинство ученых отвергли данную теорию. Исследования раковых стволовых клеток, происходящих из покровного эпителия яичника, позволяют предположить, что эти клетки могут быть клетками-предшественниками опухоли. При канцерогенезе благодаря своим плюрипотентным свойствам эти клетки могут образовывать пеструю смесь различных клеток, что характерно для опухолей. Вероятно, раковые стволовые клетки, находящиеся в инклюзионных кистах, проникают глубоко в строму яичника, способствуя формированию толстой оболочки, что типично для СМОЯ. Это укрепляет предположение о возможном происхождении данного типа опухолей из раковых стволовых клеток [7, 18].
Теория возникновения ЭОЯ из вторичной мюллеровой системы действительно представляет собой важную веху в исследовании гистогенеза ЭОЯ, включая СМОЯ. Согласно этой теории, гетеротопии являются источником происхождения большинства опухолей яичников 1-го типа, включая СМОЯ. Генетические изменения в клетках вторичной мюллеровой системы в постнатальном онтогенезе приводят к появлению опухолевых клонов. Предполагается, что гетеротопии могут дифференцироваться в различные типы клеток мюллеровой системы, а их плюрипотентность определяет морфологию двух типов СМОЯ: мюллеровской муцинозной папиллярной пограничной опухоли или смешанно-эпителиальной папиллярной пограничной опухоли мюллеровского типа. Также эта теория подчеркивает этапность процесса канцерогенеза ЭОЯ, объясняющего совместное поражение яичника пограничными и инвазивными вариантами СМОЯ [5].
 Третья теория гистогенеза низкодифференцированных серозных карцином основана на в
Третья теория гистогенеза низкодифференцированных серозных карцином основана на в
торичном поражении яичников опухолевыми клетками, происходящими из эпителия фаллопиевых труб. Исследование, проведенное в 2019 г. G. Karpathiou и соавт., обнаружило, что патология маточных труб наблюдалась в 83,3% случаев серомуцинозных карцином, что подтверждает возможное участие эпителия фаллопиевых труб в процессе канцерогенеза СМОЯ [4]. Теория происхождения серомуцинозных карцином из атипичного эндометриоза представляет собой важную перспективу
в изучении гистогенеза данного типа опухолей яичников. Клинические и морфологические данные говорят о прямой связи СМПОЯ с эндометриозом, что подчеркивает интерес к этой теории. Однако молекулярно-генетический анализ серомуцинозных карцином ставит под сомнение их существование как отдельного вида опухолей яичников и отрицает этапность канцерогенеза этого типа опухолей. Вместе с тем уч
еные приходят к выводу о том, что генотип не окончательно определяет сущность и гистогенез новообразований, и поэтому морфологические и терминологические аспекты обязательно должны учитываться при типировании опухоли. В связи с этим предлагается считать истинными серокарциномами только те, которые возникли на фоне варианта СМПОЯ [6, 19]. Гипотеза о происхождении низкодифференцированных серомуцинозных карцином из резервных клеток эндоцервикса открывает новые возможности для понимания гистогенеза этого типа опухолей яичников. Ранее резервные клетки эндоцервикса ассоциировались с раком шейки матки. Однако обнаружение кубических эпителиоцитов, похожих по иммуногистохимическому профилю на резервные клетки при раке шейки матки, в СМПОЯ представляет убедительные аргументы в пользу этой гипотезы. Важно отметить, что эти же клетки были найдены в очагах эндометриоза, сосуществующих с СМПОЯ [20].
только те, которые возникли на фоне варианта СМПОЯ [6, 19]. Гипотеза о происхождении низкодифференцированных серомуцинозных карцином из резервных клеток эндоцервикса открывает новые возможности для понимания гистогенеза этого типа опухолей яичников. Ранее резервные клетки эндоцервикса ассоциировались с раком шейки матки. Однако обнаружение кубических эпителиоцитов, похожих по иммуногистохимическому профилю на резервные клетки при раке шейки матки, в СМПОЯ представляет убедительные аргументы в пользу этой гипотезы. Важно отметить, что эти же клетки были найдены в очагах эндометриоза, сосуществующих с СМПОЯ [20].
СМПОЯ, так же как и другие пограничные опухоли яичников, имеет благоприятный исход, высокие показатели выживаемости. Это заболевание чаще всего встречается у молодых женщин и часто диагностируется на ранней стадии, что позволяет провести органосохраняющую операцию для сохранения репродуктивной функции. На момент установления диагноза у 35% пациенток отмечается бесплодие. Для сохранения возможности забеременеть проводится односторонняя сальпингоовариоэктомия, резекция пораженного опухолью яичника или удаление кисты [9].
В исследование Yi Hu и соавт. были включены 12 пациенток с диагнозом OSMC, которым была сделана операция в больнице Сянъя с января 2010 по декабрь 2019 г. Были собраны клинико-патологические характеристики, такие как клинические симптомы, серологические показатели, хирургическая информация, послеоперационные данные, чувствительность к химиотерапии, информация о последующем наблюдении, изображения окрашивания HE и IHC и другие клинико-патологические характеристики. Патологический обзор проводился с использованием критериев ВОЗ 2014 г. Все патологические диагнозы проверялись двумя опытными патологоанатомами [23].
Средний возраст варьировал от 23 до 68 лет, средний возраст составил 46,8 года. Уровень CA125 в сыворотке крови был повышен у 10 пациенток, а соотношение CA125/CEA было менее 25 у 6 пациенток. Одиннадцати пациенткам была проведена радикальная операция по удалению рака яичников, и одной пациентке была проведена операция по сохранению фертильности. Выживаемость без прогрессирования (ВБП) и общая выживаемость (ОВ) при OSMC составляет 46,8 и 50,2 мес соответственно. Кривая выживаемости Каплана– Мейера показала, что прогноз OSMC и OEC достоверно различался (p=0,03). Прогноз OSMC и муцинозной карциномы яичников был схожим [23].
В итоге проведенного исследования авторы сделали вывод, что хотя OSMC и OEC схожи по патологической морфологии, их клинические особенности и прогноз существенно различаются. Признаки, сывороточный биомаркер и прогноз OSMC схожи с муцинозной карциномой яичников. Следовательно, OSMC не подходит для прямой классификации как OEC [23].
Представляет интерес, пожалуй, пока единственное исследование китайских коллег Yi Hu и соавт., результаты которого были опубликованы в «Journal of Ovarian Research» в 2023 г. (№18). Авторы проанализировали клиническую ситуацию у 106 пациенток с патологическим диагнозом различных EOCs, которые были прооперированы в больнице Сянъя с января 2010 по декабрь 2019 г. Среди этой когорты 12 случаев ОСМК были диагностированы двумя опытными патологами на основе классификации ВОЗ 2014 г. Двадцать четыре случая OEC, серозной карциномы яичников (OSC) и муцинозной карциномы яичников (OMC) и 22 случая светлоклеточной карциномы (OCCC), диагностированных с 2010 по 2019 г. в больнице Сянъя, были включены в это исследование в виде парной когорты. Клинико-патологические особенности, такие как клинические симптомы, серологические показатели, чувствительность к химиотерапии, микроскопические проявления и прогноз, были собраны с помощью электронных медицинских записей. Последующее наблюдение закончилось в декабре 2020 г. [23].
Гистопатологическая оценка и иммуногистохимический анализ были проведены во всех случаях двумя наблюдателями в соответствии с критериями ВОЗ 2014 г. [2]. При окрашивании IHC они наблюдали рецептор прогестерона (PR), рецептор эстрогена (ER), углеводный антиген 125 (CA125), цитокератиновый Pan (CK-Pan) и PAX-8 [23].
Возраст пациенток с OSMCs варьировал от 23 до 68 лет со средним возрастом 46,8. У двух (16,7%) пациенток были двусторонние образования в области таза и у пяти (41,7%) – односторонние образования в области таза. Асцит был обнаружен в 10 случаях, а раковые клетки были обнаружены при асците в 3 случаях. Восемь (66,7%) пациенток с OSMC обратились к врачам из-за новообразований в малом тазу. Десять случаев находятся на стадии
I–II и 2 случая – на стадии III в соответствии с классификацией Международной федерации акушеров и гинекологов (FIGO) 2018 г. У одной пациентки сохранилась репродуктивная функция, другим была проведена радикальная операция. Одиннадцать пациенток получили химиотерапию на основе платины [23].
Клинико-патологические особенности всех случаев EOCs приведены в табл. 3. OEC, OSC, OMC были сопоставлены в двукратном соотношении с OSMC в зависимости от возраста и стадии. С 2010 по 2019 г. в больнице Сянъя было диагностировано только 22 случая OSC, поэтому были включены все OSC. Не было выявлено существенной разницы в частоте эндометриоза, остаточных поражений и химиотерапии среди всех типов EOC. Есть существенная разница в соотношении CA125/CEA. При OSMC соотношение CA125/CEA составляет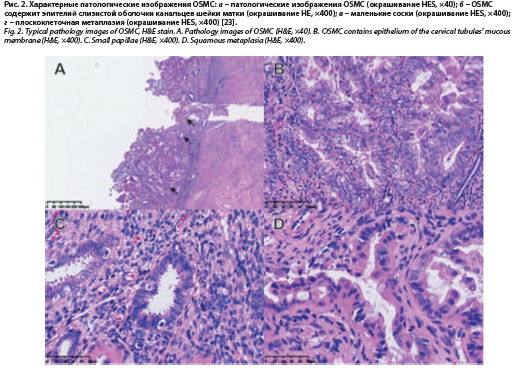 менее 25 в 6 случаях (50%), в то время как OEC составляет 9% (p<0,05) и OSC составляет 33,3%, но OMC составляет 58% [23].
менее 25 в 6 случаях (50%), в то время как OEC составляет 9% (p<0,05) и OSC составляет 33,3%, но OMC составляет 58% [23].
Был проведен прогностический анализ: к декабрю 2020 г. в парной когорте были доступны данные о выживаемости в 90 случаях, поскольку 16 пациенток были потеряны для последующего наблюдения. У пациенток, оставшихся без наблюдения, в 2 случаях был OSMC, в 5 случаях были как OEC, так и OMC, в 4 случаях был OCCC. ВБП и ОВ для различных видов карциномы яичников приведены в табл. 3 [23].
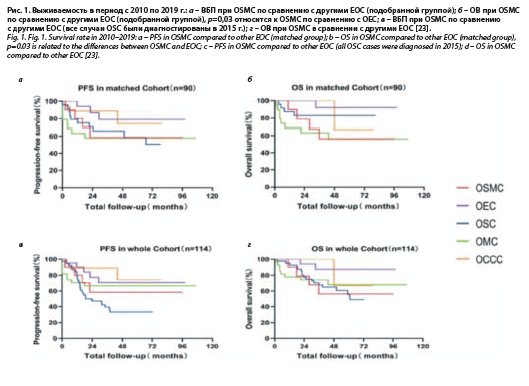
ОВ зависела от стадии заболевания (рис. 1, а, б).
К концу 2020 г. выживаемость пациенток с диагнозом
I стадии составила почти 85%, II стадии – 60%, III стадии – 55%. Аналогичные результаты были получены и для ВБП. Что касается гистологического подтипа, у пациенток с OSMC и OMC 5-летняя выживаемость составила менее 60%, у OEC 5-летняя выживаемость составила почти 90%, а у OSC 5-летняя выживаемость составила почти 80%. Разница в выживаемости была статистически значимой при OSMC и OEC (p=0,03). Результаты были аналогичными для ВБП [23].
Поскольку количество случаев OSMC относительно невелико, чтобы исключить ошибку, в этом исследовании сравнивали OSMC со всеми OEC, OMC и OCCC в период с января 2010 по декабрь 2019 г. и со всеми OSC
в 2015 г., были доступны данные о выживаемости в
114 случаях (рис. 1, в, г). У пациенток с OSMC, OSC, OMC и OCCC 5-летняя выживаемость составила менее 70%, в то время как у OEC 5-летняя выживаемость составила почти 90% [23].
Хотя нет существенной разницы в выживаемости между различными типами EOC, также можно видеть, что прогноз OEC лучше, чем у других EOC [23].
Кроме того, OSMC имеет свои уникальные патологические характеристики (рис. 2, а). Архитектура в большинстве случаев была папиллярной, характеризующейся крупными твердоотечными сосочками. В то же время на этой модели канала шейки матки при OSMC имеет слизистый эпителий (рис. 2, б) и показывает маленький сосок (рис. 2, в), в то время как в некоторых случаях может наблюдаться плоскоклеточная метаплазия (рис. 2, г) [23].
Иммуногистохимический анализ представлен на рис. 3. OSMC в основном экспрессировал маркеры мюллерова типа, такие как цитокератиновый Pan (CK-Pan), рецептор эстрогена (ER), рецептор прогестерона (PR) и антиген Pairing box gene 8 (PAX-8). ER и PR часто экспрессируются при раке яичников. CK-Pan используется для идентификации эпителиальных и неэпителиальных компонентов. Pax-8 – специфическая экспрессия при раке яичников. OSMC экспрессировал IHC-окрашивания для CK-Pan (рис. 3, а), ER (рис. 3, б), PAX8 (рис.
3, в), углеводный антиген 12 – CA125 (рис. 3, г), PR (рис. 3, д) и был отрицательным по опухолевому белку Вильмса – WT1 (рис. 3, е). WT1 обычно экспрессируется при раке яичников,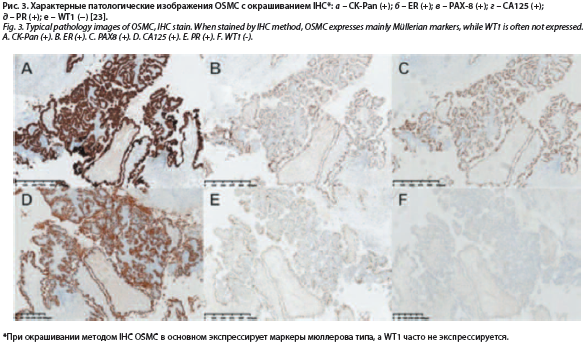 особенно при серозной карциноме высокой степени злокачественности. При OCCC и OEC WT1, как правило, отрицательный [23].
особенно при серозной карциноме высокой степени злокачественности. При OCCC и OEC WT1, как правило, отрицательный [23].
OSMC имеет сходные клинические характеристики с OMC. Большинство OSMC, как и OMC, выглядят как большие образования, поэтому большинство OSMC находятся на стадии I или II. В нашей серии прогноз OSMC коррелирует со стадиями. В целом у пациенток на более ранней стадии прогноз лучше, за исключением случая 7. ВБП этого случая в OSMC составляет
2,5 мес. Одной из возможных причин является то, что степень поражения равна трем. Это может быть причиной резистентности к химиотерапии. Пациентка проходила несколько курсов химиотерапии, но все равно умерла 26 декабря 2017 г. Что касается биомаркера, то в 50% случаев соотношение CA125 к CEA составляет менее 25, в то время как OEC составляет 9%, а OSC – 33,3%, но OMC составляет 58%. При раке яичников около 5–15% всех злокачественных новообразований яичников являются метастазами другого злокачественного образования. Большинство этих метастазов имеют желудочно-кишечное происхождение, но встречаются также метастазы из груди, кожи или другого гинекологического происхождения [21]. Соотношение CA125 и CEA лучше дифференцирует EOC и метастазы в яичники от новообразований желудочно-кишечного тракта, чем один из этих маркеров в отдельности [9]. Предыдущее исследование также показало чувствительность 73% и специфичность 63% при использовании порогового значения для отношения CA125/CEA 25 по сравнению с чувствительностью 78% и специфичностью 50% только для CA125 для различения EOC и новообразований желудочно-кишечного тракта, а пороговое значение 25 продемонстрировало высокую точность, и, таким образом, оно было использовано в клинической практике [18, 19]. OMC обычно отражает биологические характеристики новообразований желудочно-кишечного тракта, поэтому мы часто используем соотношение CA125 и CEA, чтобы отличить OMC от других EOC. В нашем исследовании более чем в 50% случаев соотношение CA125 к CEA составляет менее 25 как при OSMC, так и при OMC. Другой момент заключается в том, что OMC обычно представляют собой очень большие первичные опухоли, которые вызывают симптомы, пока заболевание все еще локализуется в яичнике [12]. И в
12 случаях OSMC около 66,7% случаев вызваны новообразованиями в области таза. Все это может свидетельствовать о том, что OSMC обладает некоторыми биологическими характеристиками OMC [23].
В сопоставимой когорте прогноз OSMC, вероятно, ближе к таковому при OMC и отличается при OEC (p=0,03). Прогноз при OEC лучше, чем при других EOCs. Потенциальным объяснением является то, что большинство OEC диагностируется на ранней стадии.
В сопоставимой когорте прогноз для OSC лучше, чем для OSMC, но при смене пациенток с OSC в 2015 г. прогноз для OSC ухудшается. Одна из возможных причин заключается в том, что большинство случаев OSC в сопоставимой когорте имеют раннюю стадию и более низкую степень злокачественности, но серозная карцинома высокой степени тяжести чаще диагностировалась на более высокой стадии в течение естественного года, и это действительно влияло на прогноз. Во всей когорте прогноз не был существенно связан с типом EOC [23].
Гистологически результаты показывают, что отечные фиброзные сосочковые выросты, плоскоклеточная метаплазия, слизистый эпителий в этой модели цервикального канала и маленькие соски являются уникальными патологическими характеристиками OSMC. Согласно предыдущим исследованиям, эндометриоз был обнаружен в 36% случаев, при этом в некоторых опухолях были видны эктопический эндометрий и переход в серозную карциному. Но в нашем исследовании эндометриоз не был обнаружен ни в одном из случаев, даже если мы сосредоточимся на прошлом анамнезе пациенток, мы не сможем обнаружить эндометриоз ни в одном случае.
Что касается иммунофенотипа OSMC, фенотип желудочно-кишечных и муцинозных опухолей сильно отличается от фенотипа OSMC [13]. Желудочно-кишечные и муцинозные опухоли часто экспрессируют маркеры желудочно-кишечной дифференцировки: CK20 и CDX2, в то время как OSMC экспрессирует маркеры мюллерова эпителия: ER, PR, CA125, мезотелин. Более того, PAX-8 был сильно экспрессирован в OSMC, который отличался от муцинозных опухолей, но был похож на серозные опухоли. В нашем исследовании OSMC также экспрессировал маркеры мюллерова эпителия, и PAX-8 был сильно экспрессирован.
В настоящее время существует мало исследований молекулярных характеристик OSMC. Сообщается, что ген ARID1A мутирует в половине случаев светлоклеточного рака яичников и в 30% случаев эндометриоидного рака [10, 22]. В исследовании 32 пациенток с OSC мутации включали KRAS, PIK3CA, PTEN и ARID1A [14].
И исследование, проведенное в 2020 г., продемонстрировало отчетливый мутационный ландшафт OSMC, в котором 1) неизменно мутирует KRAS; 2) часто мутирует PIK3CA; 3) отсутствуют мутации промотора TERT и дефекты репарации несоответствия ДНК [7].
Итак, с молекулярной точки зрения OSMC, вероятно, не относится к OEC, и его молекулярная сигнатура больше похожа на OSC. Из-за длительности наших случаев молекулярное тестирование не проводилось.
В итоге авторы пришли к пониманию, что хотя OSMC и OEC схожи по патологической морфологии, их клинические особенности и прогноз существенно различаются, а некоторые клинические особенности и прогноз у OSMC и OMC схожи. Необходимы дальнейшие крупномасштабные исследования, изучающие это в деталях.
Заключение
Серомуцинозные пограничные опухоли вызывают интерес у всего медицинского сообщества из-за их редкости и молекулярно-генетических особенностей. Несмотря на то, что уже более 50 лет назад введен термин «серомуцинозная пограничная опухоль», они до сих пор до конца не изучены. Связь между серомуцинозной пограничной опухолью и эндометриозом действительно вызывает интерес, и некоторые исследования указывают на возможную схожесть между этими заболеваниями. Однако необходимо продолжить дальнейшее исследование, чтобы лучше понять природу этой связи. Понимание молекулярных и генетических характеристик этих опухолей может способствовать разработке более эффективных методов диагностики, прогнозирования и лечения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – D. Sci. (Med.), Professor, Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Киселева Марина Викторовна – д-р мед. наук, зав. отд-нием новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии», проф. каф. акушерства и гинекологии ИПК ФМБА Минздрава России. E-mail: kismarvic@mail.ru
Marina V. Kiseleva – D. Sci. (Med.), Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Center of Radiology. E-mail: kismarvic@mail.ru
Пернай Владлена Мариановна – ординатор каф. акушерства
и гинекологии с курсом перинатологии Mедицинского института, ФГАОУ ВО РУДН. E-mail: vladlenapernai@inbox.ru
Vladlena M. Pernay – Medical Resident, Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: vladlenapernai@inbox.ru
Поступила в редакцию: 17.04.2024
Поступила после рецензирования: 23.04.2024
Принята к публикации: 25.04.2024
Received: 17.04.2024
Revised: 23.04.2024
Accepted: 25.04.2024
Mekan R. Orazov1, Marina V. Kiseleva2, Vladlena M. Pernay1
1 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia;
2 Tsyb Medical Radiological Research Centre – branch of the National Medical Research Center of Radiology, Obninsk, Russia
omekan@mail.ru
Abstract
The 2014 World Health Organization classification identifies ovarian seromucinous tumors as one of the six categories of epithelial ovarian tumors. Ovarian seromucinous tumors encompass adenomas, atypical proliferating (borderline) tumors, and invasive carcinomas. These tumors are exceedingly rare, with benign instances accounting for a mere 1% and 25% of borderline cases among all atypical proliferating tumors. The rarity of seromucinous cancer means its prevalence has not been thoroughly investigated, which has resulted in this group of tumors remaining incompletely researched.
Keywords: ovarian seromucinous borderline tumors, endometriosis, treatment, histogenesis.
For citation: Orazov M.R., Kiseleva M.V., Pernay V.M. Pathogenesis of ovarian seromucinous borderline tumors. Clinical analysis in general medicine. 2024; 5 (7): 74–82. (In Russ.). DOI: 10.47407/kr2024.5.7.00p425
Эпителиальные карциномы яичников (epithelial ovarian carcinomas – EOCs) в основном подразделяются на серозный, муцинозный, светлоклеточный, эндометриоидный, переходный и плоскоклеточный рак [1]. Серомуцинозные опухоли яичников (СМОЯ) – это редкие новообразования, ранее классифицируемые как муцинозные опухоли мюллерова или эндоцервикального подтипа. В 2014 г. Всемирная организация здравоохранения (ВОЗ) впервые представила классификацию СМОЯ как отдельного патологического типа эпителиальных опухолей яичников (ЭОЯ) [2]. Признание этой особой группы является важным дополнением к классификации ЭОЯ. Известно, что в 1976 г. H. Fox и F. Langley ввели термин «серомуцинозная опухоль» для описания опухоли, состоящей из муцинозного эпителия эндоцервикального типа и клеток серозного типа [3]. Затем в 1988 г. J. Rutgers и R. Scully разделили похожие по внешнему виду пограничные опухоли на две категории: одна состояла из чистого эпителия эндоцервикального типа, а другая – из смеси муцинозных, серозных, эндометриоидных и индифферентных клеток эндоцервикального типа с обильной эозинофильной цитоплазмой [4, 5]. В 1993 г., Хендриксон и Кемпсон вернули термин «серомуцинозная опухоль» [6]. Предыдущие исследования почти полностью описывали серомуцинозные карциномы яичников (ovarian seromucinous carcinomas – OSMCs) с точки зрения патологии, и наше исследование в первую очередь сравнивает OSMC с другими EOCs, чтобы доказать, что OSMC отличается от ЕОС с клинической точки зрения.
OSMC, как разновидность злокачественной СМОЯ, в последние годы вызвала широкую полемику в области патологии. Некоторые патологи не считали, что OSMC может быть четко определенным гистологическим образованием, потому что его морфологический и иммунный фенотип перекрывался с другими типами опухолей яичников, особенно с эндометриоидной карциномой яичников (ovarian endometrioid carcinoma – OEC) и серозной карциномой низкой степени злокачественности с муцинозной дифференцировкой [7]. Таким образом, в 5-м издании Классификации опухолей женских половых органов ВОЗ, опубликованном в 2020 г., OSMC исключен как отдельный объект и теперь рассматривается как подтип OEC [8]. Но из-за его редкости нет клинической и патологической информации об OSMC, а также не сообщалось о клинических исследованиях для сравнения OSMC и других клинико-патологических особенностей, в основном EOCs. Термин «серомуцинозный» широко используется среди патологоанатомов уже более 40 лет для описания данной подгруппы ЭОЯ. Серомуцинозные опухоли до сих пор являются объектом дискуссии среди онкогинекологов, так как очень часто трактуется, что СМОЯ является смесью серозной и муцинозной опухолей, что совершенно неверно [2].
Серомуцинозные опухоли чаще всего представлены в виде пограничных опухолей, но могут быть как доброкачественными, так и злокачественными. Средний возраст пациенток с серомуцинозными пограничными опухолями составляет 34–44 года. До 40% случаев характеризуются двусторонним поражением, и 30–50% связаны с эндометриозом. Эти опухоли представляют собой одно- или многокамерные кистозные образования среднего диаметра 8–10 см. Содержимое кист может быть геморрагическим, серозным, муцинозным или слизисто-гнойным из-за инфильтрации нейтрофилов. Микроскопически они напоминают серозные пограничные опухоли яичников, имеющие ветвистые сосочки. Эти сосочки выстланы столбчатыми муцинозными клетками с ядрами в основании и апикальным муцином [9–11].
В изучении серомуцинозных пограничный опухолей яичников (СМПОЯ) была замечена их ассоциация с эндометриозом, в исследованиях была обнаружена связь между СМПОЯ и эндометриозом в 45–71% случаев.
J. Rutgers и R. Scully в своем исследовании выявили, что эндометриоз в 30% случаев является сопутствующим заболеванием при мюллеровской муцинозной папиллярной пограничной опухоли и в 53% – смешанно-эпителиальной папиллярной пограничной опухоли мюллеровского типа [12, 13]. В 2010 г. две группы исследователей практически одновременно сообщили о мутации гена ARID1A у 57% испытуемых [7, 14]. ARID1A – это ген-супрессор, расположенный на хромосоме 1p36.11 и кодирующий белок BAF250a [3]. BAF250a является членом семейства SWI/SNF, которое играет важную роль в ремоделировании хроматина. Эндометриоз-ассоциированная опухоль связана с изменениями в инактивирующих мутациях ARID1A [15]. Известно, что ARID1A кодирует белок BAF250A и участвует в ремоделировании хроматина. Исследования показали, что в 33% случаев происходит потеря экспрессии гена ARID1A при СМПОЯ [16]. Это соответствует частоте выявленных мутаций данного гена в опухолях, ассоциированных с эндометриозом, включая эндометриоидные и светлоклеточные опухоли. Эти данные подтверждают включение серозной пограничной опухоли яичников в категорию эндометриозассоциированных опухолей.
В 2020 г. R. Wu и соавт. провели исследование на 33 образцах СМПОЯ и выявили мутации в KRAS в 100%, PIK3CA – 60,7% и ARID1A в 14,3%. Активация онкогена PIK3CA характерна для эндометриозассоциированной опухоли, что еще раз показывает связь между СМПОЯ и эндометриозом [17].
Существует несколько теорий относительно гистогенеза ЭОЯ, и происхождение СМОЯ исследуется в этом контексте. Исторически первой теорией происхождения опухолей из покровного эпителия яичника была теория о происхождении опухолей из самого эпителия. Однако в последнее время большинство ученых отвергли данную теорию. Исследования раковых стволовых клеток, происходящих из покровного эпителия яичника, позволяют предположить, что эти клетки могут быть клетками-предшественниками опухоли. При канцерогенезе благодаря своим плюрипотентным свойствам эти клетки могут образовывать пеструю смесь различных клеток, что характерно для опухолей. Вероятно, раковые стволовые клетки, находящиеся в инклюзионных кистах, проникают глубоко в строму яичника, способствуя формированию толстой оболочки, что типично для СМОЯ. Это укрепляет предположение о возможном происхождении данного типа опухолей из раковых стволовых клеток [7, 18].
Теория возникновения ЭОЯ из вторичной мюллеровой системы действительно представляет собой важную веху в исследовании гистогенеза ЭОЯ, включая СМОЯ. Согласно этой теории, гетеротопии являются источником происхождения большинства опухолей яичников 1-го типа, включая СМОЯ. Генетические изменения в клетках вторичной мюллеровой системы в постнатальном онтогенезе приводят к появлению опухолевых клонов. Предполагается, что гетеротопии могут дифференцироваться в различные типы клеток мюллеровой системы, а их плюрипотентность определяет морфологию двух типов СМОЯ: мюллеровской муцинозной папиллярной пограничной опухоли или смешанно-эпителиальной папиллярной пограничной опухоли мюллеровского типа. Также эта теория подчеркивает этапность процесса канцерогенеза ЭОЯ, объясняющего совместное поражение яичника пограничными и инвазивными вариантами СМОЯ [5].

 Третья теория гистогенеза низкодифференцированных серозных карцином основана на в
Третья теория гистогенеза низкодифференцированных серозных карцином основана на вторичном поражении яичников опухолевыми клетками, происходящими из эпителия фаллопиевых труб. Исследование, проведенное в 2019 г. G. Karpathiou и соавт., обнаружило, что патология маточных труб наблюдалась в 83,3% случаев серомуцинозных карцином, что подтверждает возможное участие эпителия фаллопиевых труб в процессе канцерогенеза СМОЯ [4]. Теория происхождения серомуцинозных карцином из атипичного эндометриоза представляет собой важную перспективу
в изучении гистогенеза данного типа опухолей яичников. Клинические и морфологические данные говорят о прямой связи СМПОЯ с эндометриозом, что подчеркивает интерес к этой теории. Однако молекулярно-генетический анализ серомуцинозных карцином ставит под сомнение их существование как отдельного вида опухолей яичников и отрицает этапность канцерогенеза этого типа опухолей. Вместе с тем уч
еные приходят к выводу о том, что генотип не окончательно определяет сущность и гистогенез новообразований, и поэтому морфологические и терминологические аспекты обязательно должны учитываться при типировании опухоли. В связи с этим предлагается считать истинными серокарциномами
 только те, которые возникли на фоне варианта СМПОЯ [6, 19]. Гипотеза о происхождении низкодифференцированных серомуцинозных карцином из резервных клеток эндоцервикса открывает новые возможности для понимания гистогенеза этого типа опухолей яичников. Ранее резервные клетки эндоцервикса ассоциировались с раком шейки матки. Однако обнаружение кубических эпителиоцитов, похожих по иммуногистохимическому профилю на резервные клетки при раке шейки матки, в СМПОЯ представляет убедительные аргументы в пользу этой гипотезы. Важно отметить, что эти же клетки были найдены в очагах эндометриоза, сосуществующих с СМПОЯ [20].
только те, которые возникли на фоне варианта СМПОЯ [6, 19]. Гипотеза о происхождении низкодифференцированных серомуцинозных карцином из резервных клеток эндоцервикса открывает новые возможности для понимания гистогенеза этого типа опухолей яичников. Ранее резервные клетки эндоцервикса ассоциировались с раком шейки матки. Однако обнаружение кубических эпителиоцитов, похожих по иммуногистохимическому профилю на резервные клетки при раке шейки матки, в СМПОЯ представляет убедительные аргументы в пользу этой гипотезы. Важно отметить, что эти же клетки были найдены в очагах эндометриоза, сосуществующих с СМПОЯ [20].СМПОЯ, так же как и другие пограничные опухоли яичников, имеет благоприятный исход, высокие показатели выживаемости. Это заболевание чаще всего встречается у молодых женщин и часто диагностируется на ранней стадии, что позволяет провести органосохраняющую операцию для сохранения репродуктивной функции. На момент установления диагноза у 35% пациенток отмечается бесплодие. Для сохранения возможности забеременеть проводится односторонняя сальпингоовариоэктомия, резекция пораженного опухолью яичника или удаление кисты [9].
В исследование Yi Hu и соавт. были включены 12 пациенток с диагнозом OSMC, которым была сделана операция в больнице Сянъя с января 2010 по декабрь 2019 г. Были собраны клинико-патологические характеристики, такие как клинические симптомы, серологические показатели, хирургическая информация, послеоперационные данные, чувствительность к химиотерапии, информация о последующем наблюдении, изображения окрашивания HE и IHC и другие клинико-патологические характеристики. Патологический обзор проводился с использованием критериев ВОЗ 2014 г. Все патологические диагнозы проверялись двумя опытными патологоанатомами [23].
Средний возраст варьировал от 23 до 68 лет, средний возраст составил 46,8 года. Уровень CA125 в сыворотке крови был повышен у 10 пациенток, а соотношение CA125/CEA было менее 25 у 6 пациенток. Одиннадцати пациенткам была проведена радикальная операция по удалению рака яичников, и одной пациентке была проведена операция по сохранению фертильности. Выживаемость без прогрессирования (ВБП) и общая выживаемость (ОВ) при OSMC составляет 46,8 и 50,2 мес соответственно. Кривая выживаемости Каплана– Мейера показала, что прогноз OSMC и OEC достоверно различался (p=0,03). Прогноз OSMC и муцинозной карциномы яичников был схожим [23].
В итоге проведенного исследования авторы сделали вывод, что хотя OSMC и OEC схожи по патологической морфологии, их клинические особенности и прогноз существенно различаются. Признаки, сывороточный биомаркер и прогноз OSMC схожи с муцинозной карциномой яичников. Следовательно, OSMC не подходит для прямой классификации как OEC [23].
Представляет интерес, пожалуй, пока единственное исследование китайских коллег Yi Hu и соавт., результаты которого были опубликованы в «Journal of Ovarian Research» в 2023 г. (№18). Авторы проанализировали клиническую ситуацию у 106 пациенток с патологическим диагнозом различных EOCs, которые были прооперированы в больнице Сянъя с января 2010 по декабрь 2019 г. Среди этой когорты 12 случаев ОСМК были диагностированы двумя опытными патологами на основе классификации ВОЗ 2014 г. Двадцать четыре случая OEC, серозной карциномы яичников (OSC) и муцинозной карциномы яичников (OMC) и 22 случая светлоклеточной карциномы (OCCC), диагностированных с 2010 по 2019 г. в больнице Сянъя, были включены в это исследование в виде парной когорты. Клинико-патологические особенности, такие как клинические симптомы, серологические показатели, чувствительность к химиотерапии, микроскопические проявления и прогноз, были собраны с помощью электронных медицинских записей. Последующее наблюдение закончилось в декабре 2020 г. [23].
Гистопатологическая оценка и иммуногистохимический анализ были проведены во всех случаях двумя наблюдателями в соответствии с критериями ВОЗ 2014 г. [2]. При окрашивании IHC они наблюдали рецептор прогестерона (PR), рецептор эстрогена (ER), углеводный антиген 125 (CA125), цитокератиновый Pan (CK-Pan) и PAX-8 [23].
Возраст пациенток с OSMCs варьировал от 23 до 68 лет со средним возрастом 46,8. У двух (16,7%) пациенток были двусторонние образования в области таза и у пяти (41,7%) – односторонние образования в области таза. Асцит был обнаружен в 10 случаях, а раковые клетки были обнаружены при асците в 3 случаях. Восемь (66,7%) пациенток с OSMC обратились к врачам из-за новообразований в малом тазу. Десять случаев находятся на стадии
I–II и 2 случая – на стадии III в соответствии с классификацией Международной федерации акушеров и гинекологов (FIGO) 2018 г. У одной пациентки сохранилась репродуктивная функция, другим была проведена радикальная операция. Одиннадцать пациенток получили химиотерапию на основе платины [23].
Клинико-патологические особенности всех случаев EOCs приведены в табл. 3. OEC, OSC, OMC были сопоставлены в двукратном соотношении с OSMC в зависимости от возраста и стадии. С 2010 по 2019 г. в больнице Сянъя было диагностировано только 22 случая OSC, поэтому были включены все OSC. Не было выявлено существенной разницы в частоте эндометриоза, остаточных поражений и химиотерапии среди всех типов EOC. Есть существенная разница в соотношении CA125/CEA. При OSMC соотношение CA125/CEA составляет
 менее 25 в 6 случаях (50%), в то время как OEC составляет 9% (p<0,05) и OSC составляет 33,3%, но OMC составляет 58% [23].
менее 25 в 6 случаях (50%), в то время как OEC составляет 9% (p<0,05) и OSC составляет 33,3%, но OMC составляет 58% [23].Был проведен прогностический анализ: к декабрю 2020 г. в парной когорте были доступны данные о выживаемости в 90 случаях, поскольку 16 пациенток были потеряны для последующего наблюдения. У пациенток, оставшихся без наблюдения, в 2 случаях был OSMC, в 5 случаях были как OEC, так и OMC, в 4 случаях был OCCC. ВБП и ОВ для различных видов карциномы яичников приведены в табл. 3 [23].
ОВ зависела от стадии заболевания (рис. 1, а, б).
К концу 2020 г. выживаемость пациенток с диагнозом
I стадии составила почти 85%, II стадии – 60%, III стадии – 55%. Аналогичные результаты были получены и для ВБП. Что касается гистологического подтипа, у пациенток с OSMC и OMC 5-летняя выживаемость составила менее 60%, у OEC 5-летняя выживаемость составила почти 90%, а у OSC 5-летняя выживаемость составила почти 80%. Разница в выживаемости была статистически значимой при OSMC и OEC (p=0,03). Результаты были аналогичными для ВБП [23].
Поскольку количество случаев OSMC относительно невелико, чтобы исключить ошибку, в этом исследовании сравнивали OSMC со всеми OEC, OMC и OCCC в период с января 2010 по декабрь 2019 г. и со всеми OSC
в 2015 г., были доступны данные о выживаемости в
114 случаях (рис. 1, в, г). У пациенток с OSMC, OSC, OMC и OCCC 5-летняя выживаемость составила менее 70%, в то время как у OEC 5-летняя выживаемость составила почти 90% [23].
Хотя нет существенной разницы в выживаемости между различными типами EOC, также можно видеть, что прогноз OEC лучше, чем у других EOC [23].
Кроме того, OSMC имеет свои уникальные патологические характеристики (рис. 2, а). Архитектура в большинстве случаев была папиллярной, характеризующейся крупными твердоотечными сосочками. В то же время на этой модели канала шейки матки при OSMC имеет слизистый эпителий (рис. 2, б) и показывает маленький сосок (рис. 2, в), в то время как в некоторых случаях может наблюдаться плоскоклеточная метаплазия (рис. 2, г) [23].
Иммуногистохимический анализ представлен на рис. 3. OSMC в основном экспрессировал маркеры мюллерова типа, такие как цитокератиновый Pan (CK-Pan), рецептор эстрогена (ER), рецептор прогестерона (PR) и антиген Pairing box gene 8 (PAX-8). ER и PR часто экспрессируются при раке яичников. CK-Pan используется для идентификации эпителиальных и неэпителиальных компонентов. Pax-8 – специфическая экспрессия при раке яичников. OSMC экспрессировал IHC-окрашивания для CK-Pan (рис. 3, а), ER (рис. 3, б), PAX8 (рис.
3, в), углеводный антиген 12 – CA125 (рис. 3, г), PR (рис. 3, д) и был отрицательным по опухолевому белку Вильмса – WT1 (рис. 3, е). WT1 обычно экспрессируется при раке яичников,
 особенно при серозной карциноме высокой степени злокачественности. При OCCC и OEC WT1, как правило, отрицательный [23].
особенно при серозной карциноме высокой степени злокачественности. При OCCC и OEC WT1, как правило, отрицательный [23].OSMC имеет сходные клинические характеристики с OMC. Большинство OSMC, как и OMC, выглядят как большие образования, поэтому большинство OSMC находятся на стадии I или II. В нашей серии прогноз OSMC коррелирует со стадиями. В целом у пациенток на более ранней стадии прогноз лучше, за исключением случая 7. ВБП этого случая в OSMC составляет
2,5 мес. Одной из возможных причин является то, что степень поражения равна трем. Это может быть причиной резистентности к химиотерапии. Пациентка проходила несколько курсов химиотерапии, но все равно умерла 26 декабря 2017 г. Что касается биомаркера, то в 50% случаев соотношение CA125 к CEA составляет менее 25, в то время как OEC составляет 9%, а OSC – 33,3%, но OMC составляет 58%. При раке яичников около 5–15% всех злокачественных новообразований яичников являются метастазами другого злокачественного образования. Большинство этих метастазов имеют желудочно-кишечное происхождение, но встречаются также метастазы из груди, кожи или другого гинекологического происхождения [21]. Соотношение CA125 и CEA лучше дифференцирует EOC и метастазы в яичники от новообразований желудочно-кишечного тракта, чем один из этих маркеров в отдельности [9]. Предыдущее исследование также показало чувствительность 73% и специфичность 63% при использовании порогового значения для отношения CA125/CEA 25 по сравнению с чувствительностью 78% и специфичностью 50% только для CA125 для различения EOC и новообразований желудочно-кишечного тракта, а пороговое значение 25 продемонстрировало высокую точность, и, таким образом, оно было использовано в клинической практике [18, 19]. OMC обычно отражает биологические характеристики новообразований желудочно-кишечного тракта, поэтому мы часто используем соотношение CA125 и CEA, чтобы отличить OMC от других EOC. В нашем исследовании более чем в 50% случаев соотношение CA125 к CEA составляет менее 25 как при OSMC, так и при OMC. Другой момент заключается в том, что OMC обычно представляют собой очень большие первичные опухоли, которые вызывают симптомы, пока заболевание все еще локализуется в яичнике [12]. И в
12 случаях OSMC около 66,7% случаев вызваны новообразованиями в области таза. Все это может свидетельствовать о том, что OSMC обладает некоторыми биологическими характеристиками OMC [23].
В сопоставимой когорте прогноз OSMC, вероятно, ближе к таковому при OMC и отличается при OEC (p=0,03). Прогноз при OEC лучше, чем при других EOCs. Потенциальным объяснением является то, что большинство OEC диагностируется на ранней стадии.
В сопоставимой когорте прогноз для OSC лучше, чем для OSMC, но при смене пациенток с OSC в 2015 г. прогноз для OSC ухудшается. Одна из возможных причин заключается в том, что большинство случаев OSC в сопоставимой когорте имеют раннюю стадию и более низкую степень злокачественности, но серозная карцинома высокой степени тяжести чаще диагностировалась на более высокой стадии в течение естественного года, и это действительно влияло на прогноз. Во всей когорте прогноз не был существенно связан с типом EOC [23].
Гистологически результаты показывают, что отечные фиброзные сосочковые выросты, плоскоклеточная метаплазия, слизистый эпителий в этой модели цервикального канала и маленькие соски являются уникальными патологическими характеристиками OSMC. Согласно предыдущим исследованиям, эндометриоз был обнаружен в 36% случаев, при этом в некоторых опухолях были видны эктопический эндометрий и переход в серозную карциному. Но в нашем исследовании эндометриоз не был обнаружен ни в одном из случаев, даже если мы сосредоточимся на прошлом анамнезе пациенток, мы не сможем обнаружить эндометриоз ни в одном случае.
Что касается иммунофенотипа OSMC, фенотип желудочно-кишечных и муцинозных опухолей сильно отличается от фенотипа OSMC [13]. Желудочно-кишечные и муцинозные опухоли часто экспрессируют маркеры желудочно-кишечной дифференцировки: CK20 и CDX2, в то время как OSMC экспрессирует маркеры мюллерова эпителия: ER, PR, CA125, мезотелин. Более того, PAX-8 был сильно экспрессирован в OSMC, который отличался от муцинозных опухолей, но был похож на серозные опухоли. В нашем исследовании OSMC также экспрессировал маркеры мюллерова эпителия, и PAX-8 был сильно экспрессирован.
В настоящее время существует мало исследований молекулярных характеристик OSMC. Сообщается, что ген ARID1A мутирует в половине случаев светлоклеточного рака яичников и в 30% случаев эндометриоидного рака [10, 22]. В исследовании 32 пациенток с OSC мутации включали KRAS, PIK3CA, PTEN и ARID1A [14].
И исследование, проведенное в 2020 г., продемонстрировало отчетливый мутационный ландшафт OSMC, в котором 1) неизменно мутирует KRAS; 2) часто мутирует PIK3CA; 3) отсутствуют мутации промотора TERT и дефекты репарации несоответствия ДНК [7].
Итак, с молекулярной точки зрения OSMC, вероятно, не относится к OEC, и его молекулярная сигнатура больше похожа на OSC. Из-за длительности наших случаев молекулярное тестирование не проводилось.
В итоге авторы пришли к пониманию, что хотя OSMC и OEC схожи по патологической морфологии, их клинические особенности и прогноз существенно различаются, а некоторые клинические особенности и прогноз у OSMC и OMC схожи. Необходимы дальнейшие крупномасштабные исследования, изучающие это в деталях.
Заключение
Серомуцинозные пограничные опухоли вызывают интерес у всего медицинского сообщества из-за их редкости и молекулярно-генетических особенностей. Несмотря на то, что уже более 50 лет назад введен термин «серомуцинозная пограничная опухоль», они до сих пор до конца не изучены. Связь между серомуцинозной пограничной опухолью и эндометриозом действительно вызывает интерес, и некоторые исследования указывают на возможную схожесть между этими заболеваниями. Однако необходимо продолжить дальнейшее исследование, чтобы лучше понять природу этой связи. Понимание молекулярных и генетических характеристик этих опухолей может способствовать разработке более эффективных методов диагностики, прогнозирования и лечения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – D. Sci. (Med.), Professor, Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Киселева Марина Викторовна – д-р мед. наук, зав. отд-нием новых медицинских технологий с группой лечения заболеваний молочной железы, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии», проф. каф. акушерства и гинекологии ИПК ФМБА Минздрава России. E-mail: kismarvic@mail.ru
Marina V. Kiseleva – D. Sci. (Med.), Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Center of Radiology. E-mail: kismarvic@mail.ru
Пернай Владлена Мариановна – ординатор каф. акушерства
и гинекологии с курсом перинатологии Mедицинского института, ФГАОУ ВО РУДН. E-mail: vladlenapernai@inbox.ru
Vladlena M. Pernay – Medical Resident, Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: vladlenapernai@inbox.ru
Поступила в редакцию: 17.04.2024
Поступила после рецензирования: 23.04.2024
Принята к публикации: 25.04.2024
Received: 17.04.2024
Revised: 23.04.2024
Accepted: 25.04.2024
Список исп. литературыСкрыть список1. Ершов В.А., Михайлов В.М., Чирский В.С. Резервные и базальные клетки эпителия шейки матки как источник цервикальных неоплазий, ассоциированных с вирусами папилломы человека. Гены и клетки. 2019;14(1):80-4.
Ershov V.A., Mikhailov V.M., Chirsky V.S. Reserve and basal cells of the cervical epithelium as a source of cervical neoplasia associated with human papillomaviruses. Genes and cells. 2019;14(1):80-4. (in Russian).
2. Guan B, Wang TL, Shih IeM. ARID1A, a factor that promotes formation of SWI/SNF-mediated chromatin remodeling, is a tumor suppressor in gynecologic cancers. Cancer Res 2012;72(12):3116
3. Fox H, Langley FA. Tumors of the ovary. William Heinemann/Year Book, 1976.
4. Karpathiou G, Chauleur C, Corsini T et al. Seromucinous ovarian tumor A comparison with the rest of ovarian epithelial tumors. Ann Diagn Pathol 2017;27:28-33.
5. Karpathiou G, Chauleur C, Venet M et al. Pathology of the fallopian tube: tubal involvement by ovarian tumors and incidental findings in the nontumoral setting. Pathobiology 20200;87(1):37-44.
6. Kurman RJ, Shih IeM. The dualistic model of ovarian carcinogenesis: revisited, revised, and expanded. Am J Pathol 2016.
7. Hada T, Miyamoto M, Ishibashi H et al. Ovarian Seromucinous Borderline Tumors Are Histologically Different from Mucinous Borderline. Tumors In Vivo 2020.
8. Jones S, Wang TL, Shih IeM et al. Frequent mutations of chromatin remodeling gene ARID1A in ovarian clear cell carcinoma. Science 2010.
9. Nagayoshi Y, Yamada K, Kiyokawa T et al. Clinical Features of Borderline Ovarian Seromucinous Tumor. Cancer Diagn Progn 2023.
10. Vroobel K, McCluggage M, Glenn W. Ovarian Clear Cell Tumors Associated With Seromucinous Borderline Tumor: A Case Series. Int J Gynecol Pathol 2022.
11. Wu B, Li J, Tao X et al. Clinicopathological Characteristics and Prognosis of 91 Patients with Seromucinous and Mucinous Borderline Ovarian Tumors: a Comparative Study. Reprod Sci 2023.
12. Rutgers JL, Scully RE. Ovarian mixed-epithelial papillary cystadenomas of borderline malignancy of mullerian type. A clinicopathologic analysis. Cancer 1988.
13. Rutgers JL, Scully RE. Ovarian mullerian mucinous papillary cystadenomas of borderline malignancy. A clinicopathologic analysis. Cancer 1988.
14. Wiegand KC, Shah SP, Al-Agha OM et al. ARID1A mutations in endometriosis-associated ovarian carcinomas. N Engl J Med 2010.
15. Wilsker D, Probst L, Wain HM et al. Nomenclature of the ARID family of DNA-binding proteins. Genomics 2005.
16. Wu CH, Mao TL, Vang R et al. Endocervical-type mucinous borderline tumors are related to endometrioid tumors based on mutation and loss of expression of ARID1A. Int J Gynecol Pathol 2012.
17. Wu RC, Chen SJ, Chen HC et al. Comprehensive genomic profiling reveals ubiquitous KRAS mutations and frequent PIK3CA mutations in ovarian seromucinous borderline tumor. Mod Pathol 2020.
18. Ng A, Barker N. Ovary and fimbrial stem cells: biology, niche and cancer origins. Nat Rev Mol Cell Biol 2015.
19. Rambau PF, McIntyre JB, Taylor J et al. Morphologic reproducibility, genotyping, and immunohistochemical profiling do not support a category of seromucinous carcinoma of the ovary. Am J Surg Pathol 2017.
20. Новиков Ф.В., Лунева И.С., Мишина Е.С., Мнихович М.В. Морфологические основы гистогенеза опухолей яичника. Опухоли женской репродуктивной системы. 2020.
Novikov F.V., Luneva I.S., Mishina E.S., Mnikhovich M.V. Morphological basis of the histogenesis of ovarian tumors. Tumors of the female reproductive system. 2020 (in Russian).
21. Nagamine M, Mikami Y. Ovarian seromucinous tumors: pathogenesis, morphologic spectrum, and clinical issues. Diagnostics (Basel) 2020; 10.
22. Tavassoli F, Devilee P. Pathology and genetics of tumours of the breast and female genital organs. IARC Press, Lyon, 2003.
23. Hu, Y, Fu K, Liu H et al. Ovarian seromucinous carcinoma: an independent epithelial ovarian cancer? J Ovarian Res 2023;16(1). DOI: 10.1186/s13048-023-01100-w
20 августа 2024
Количество просмотров: 21


