Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№02 2012
Заболеваемость раком среди больных шизофренией (обзор литературы) №02 2012
Номера страниц в выпуске:36-45
Проблема взаимосвязи шизофрении и злокачественных новообразований не утрачивает актуальности уже более ста лет. Впервые информация о гораздо более низкой заболеваемости раком среди больных шизофренией по сравнению с общей популяцией появилась в 1909 г. в докладе Комитета специальных уполномоченных по контролю за психическими расстройствами Англии и Уэльса (The Board of Control of the Commissioners in Lunacy).
The incidence of cancer among schizophrenic patients (review)
L.K.Myasnikova
Mental Health Research Center of the Russian Academy of Medical Sciences, Moscow
Проблема взаимосвязи шизофрении и злокачественных новообразований не утрачивает актуальности уже более ста лет. Впервые информация о гораздо более низкой заболеваемости раком среди больных шизофренией по сравнению с общей популяцией появилась в 1909 г. в докладе Комитета специальных уполномоченных по контролю за психическими расстройствами Англии и Уэльса (The Board of Control of the Commissioners in Lunacy). Однако несмотря на столь давнюю историю изучения эпидемиологического соотношения рака и шизофрении на сегодняшний день однозначного мнения не существует. Одни исследователи (Х.Н.Зильберштейн и соавт., 1959; М.Д.Пятов, 1965; Л.Я.Гусева, 1969; Fox и соавт., 1974; Baldwin, 1979) подтверждают первоначальные данные, другие выдвигают обратное представление, согласно которому злокачественные новообразования занимают одно из лидирующих мест среди естественных причин смерти больных шизофренией (Leucht и соавт., 2007; R.Hodgson и соавт., 2010), – второе место после сердечно-сосудистых заболеваний среди этого контингента (Л.Я.Гусева, 1969; C.Bouza и соавт., 2010). Подобные расхождения связывают с методикой проведения исследований: в значительной части работ выводы о распространенности строятся на данных об уровне смертности больных шизофренией от рака (M.Cohen и соавт., 2002).
Из 10 цитированных в табл. 1 работ в 7 зарегистрирован более низкий относительно среднепопуляционных значений показатель заболеваемости раком среди больных шизофренией.
Следует подчеркнуть, что доступные печатные работы (зарегистрированные в базах данных MEDLINE, PubMed и The Cochrane Collaboration), затрагивающие проблему соотношения обсуждаемых заболеваний, посвящены выявлению рака у больных шизофренией (как стационарных, так и амбулаторных), хотя, вероятно, для онкологов более актуальной была бы информация о заболеваемости шизофренией у больных раком. Такие исследования немногочисленны: выполненная в России многоцентровая программа СИНТЕЗ (А.Б.Смулевич и соавт., 2009) является фактически единственной работой, в которой изучена распространенность расстройств шизофренического спектра1 у онкологических пациентов, составившая 3,2% (17 из 516 онкологических больных)2. Отметим также, что к числу методических ограничений большинства работ относится заочная оценка (изучение медицинской документации и сопоставление онкологических и психиатрических архивов) данных.
Гипотеза канцеропротективного эффекта шизофрении
Одним из первых масштабных проспективных исследований заболеваемости раком среди больных шизофренией стала работа P.Mortensen (1989 г.), выполненная в Дании. Автор проследил судьбу 6168 больных шизофренией на протяжении 30 лет и пришел к выводу, что заболеваемость раком мужчин, больных шизофренией, достоверно ниже, чем в популяции, в то время как женщин – сопоставима с таковой. Спустя 5 лет автор (P.Mortensen, 1994) высказал предположение, что снижение показателя заболеваемости раком больных шизофренией мужчин может быть связано, во-первых, с запретом на курение в датских психиатрических больницах, а во-вторых, с неким протективным эффектом самого эндогенного процесса. В развитие гипотезы канцеропротективного эффекта шизофрении Goldacre и соавт. (2005 г.) и Catts и соавт. (2008 г.) предположили, что этот эффект связан с генетическими особенностями – гены или сцепление генов, ответственные за развитие этого заболевания, могут обеспечивать пациентам преимущества в плане выживаемости (R.Hodgson и соавт., 2010)3, несмотря на тот факт, что стиль жизни больных шизофренией способствует заболеваемости раком (учитывая такие канцерогенные факторы, как курение4, сниженная физическая активность и неправильное питание).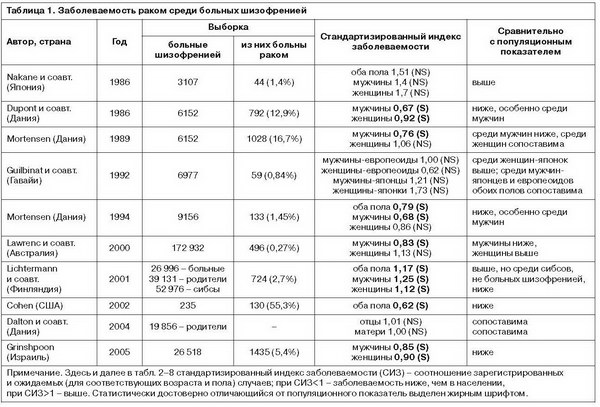 В качестве аргумента, подтверждающего это предположение, авторы используют как собственные данные, так и материалы других публикаций (D.Lichtermann и соавт., 2001), свидетельствующие о достоверно более низкой распространенности рака среди не страдающих психозами сибсов, больных шизофренией, и их родителей (в то время как среди самих больных шизофренией этот показатель сопоставим с распространенностью рака в населении).
В качестве аргумента, подтверждающего это предположение, авторы используют как собственные данные, так и материалы других публикаций (D.Lichtermann и соавт., 2001), свидетельствующие о достоверно более низкой распространенности рака среди не страдающих психозами сибсов, больных шизофренией, и их родителей (в то время как среди самих больных шизофренией этот показатель сопоставим с распространенностью рака в населении).
Обнаружено несколько генетических механизмов, претендующих на роль канцеропротективных факторов, связанных с шизофренией (Catts и соавт., 2000; Cui и соавт., 2005; Park и соавт., 2004; Yang и соавт., 2004; Waterland, Jirtle, 2004; Goldacre и соавт., 2005; Abel и соавт., 2006). Хотя это не является задачей настоящего обзора, кратко упомянем некоторые из них. В ряде работ обсуждается ген p53, участвующий в процессе апоптоза5, модификация которого обнаружена как у больных шизофренией, так и у их родственников (Catts и соавт., 2000; Cui и соавт., 2005; Park и соавт., 2004; Yang и соавт., 2004; K.Goulet, S.Grignon, 2008).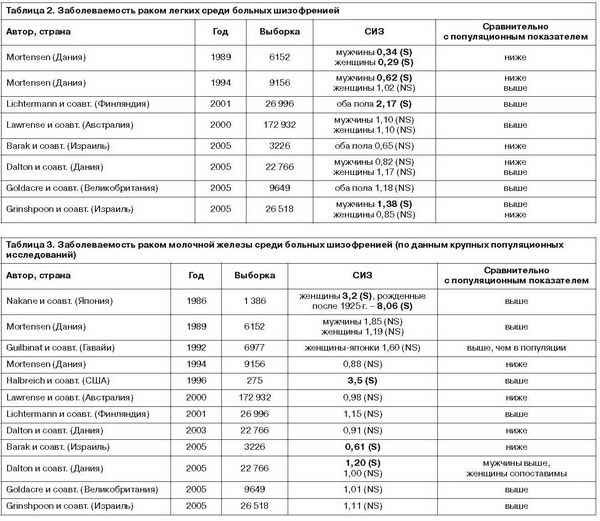
 Abel и соавт. (2006 г.) показали, что сниженная заболеваемость колоректальным раком среди больных шизофренией (Goldacre и соавт., 2005) может быть связана с аномальным импринтингом6 инсулиноподобного фактора роста 2 (ИФР-2), считающегося ведущим в патогенезе этого вида рака (Jirtle, 2004) и ассоциированного с риском развития шизофрении (Abel и соавт., 2004, 2006). Как показали Waterland, Jirtle (2004 г.), особенности питания матери пробанда во время беременности приводят к изменениям цитозиновой метиляции, к которой восприимчивы метилированные гены, такие как ген ИФР-2, что впоследствии, по мнению авторов, может влиять на развитие шизофрении.
Abel и соавт. (2006 г.) показали, что сниженная заболеваемость колоректальным раком среди больных шизофренией (Goldacre и соавт., 2005) может быть связана с аномальным импринтингом6 инсулиноподобного фактора роста 2 (ИФР-2), считающегося ведущим в патогенезе этого вида рака (Jirtle, 2004) и ассоциированного с риском развития шизофрении (Abel и соавт., 2004, 2006). Как показали Waterland, Jirtle (2004 г.), особенности питания матери пробанда во время беременности приводят к изменениям цитозиновой метиляции, к которой восприимчивы метилированные гены, такие как ген ИФР-2, что впоследствии, по мнению авторов, может влиять на развитие шизофрении.
Тем не менее, поскольку в ряде исследований (Guilbinat и соавт., 1992; Dalton и соавт., 2004) рассмотренная выше гипотеза не подтверждается, приведенные данные требуют уточнения в ходе дальнейших исследований.
Канцерогенные факторы, ассоциированные с шизофренией
В качестве факторов, повышающих риск канцерогенеза (курение, неправильное питание и др.), при шизофрении выделяют поведенческий фактор, обусловленный особенностями течения заболевания, влияющими на образ жизни больного. Неоспоримым фактором развития рака является курение, выявляемое среди больных шизофренией практически вдвое чаще, чем в популяции (Kelly, McCreadie, 1999; Punnoose и соавт., 2006).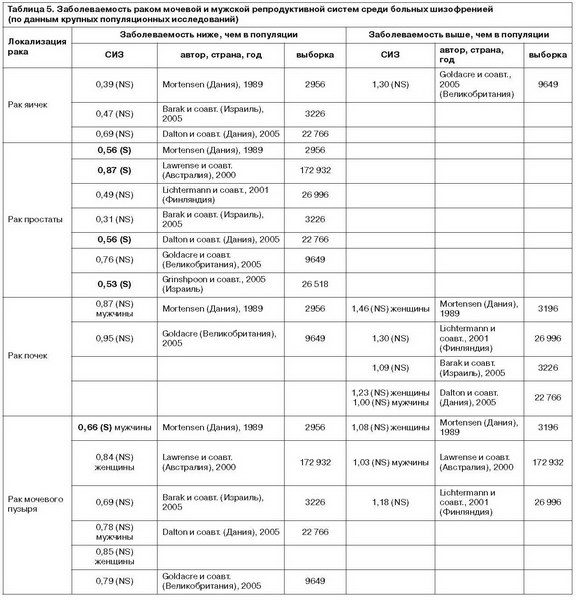
Было также показано, что стиль жизни больных шизофренией со снижением физической активности еще до назначения психотропных препаратов, с воздействием которых мог бы быть связан этот факт, может расцениваться в качестве еще одного фактора риска развития онкопатологии (Daumit и соавт., 2005; Smith и соавт., 2007). Кроме того, в качестве канцерогенного фактора при некоторых типах рака (они будут обсуждены ниже) приводят низкий вес плода при рождении, коррелирующий также и с повышенным риском развития шизофрении (R.Hodgson и соавт., 2010).
Среди гипотез подверженности раку больных шизофренией рассматривалась зависимость от региона рождения и проживания пациента. Так, Gulbinat и соавт. (1992 г.) при исследовании пациентов, проживающих в Дании, подтвердили данные, полученные P.Mortensen (1989 г.), но в Гонолулу и Нагасаки получили противоположные результаты. Grinshpoon и соавт. (2005 г.) изучали взаимосвязь между заболеваемостью раком и шизофренией на израильской популяции в зависимости от региона рождения (Азия–Африка, Европа–Америка и Израиль). Было показано, что в целом для пациентов из всех трех регионов рождения заболеваемость раком среди больных шизофренией достоверно ниже, чем в популяции: стандартизированный индекс заболеваемости раком (СИЗР) составил 0,86 и 0,91 для мужчин и женщин соответственно (p<0,05). При этом наиболее низким среди больных шизофренией СИЗР был для пациентов, родившихся в регионе Европы и Америки (0,85 и 0,86 для мужчин и женщин соответственно).
Наиболее обоснованным представляется предположение о разном распределении показателей распространенности шизофрении в зависимости от локализации и/или гистологического типа злокачественных новообразований. Такой подход представлен в работах R.Hodgson и соавт. (2010 г.). Обобщив противоречивые данные о заболеваемости раком среди больных шизофренией, авторы подытожили полученные результаты следующим образом. «Рак, как и шизофрения, это не просто заболевания – это комплексные биологические феномены. В природе существует более чем 100 анатомических разновидностей рака, многие из которых подразделяются на различные гистологические варианты, характеризуются разным прогнозом и ответом на лечение. Вероятно, только некоторые из них подвержены модификациям, ассоциированным с шизофренией».
Остановимся на распространенности отдельных типов раковых опухолей при шизофрении.
Заболеваемость больных шизофренией отдельными видами злокачественных новообразований
Рак легких открывает список причин смерти больных шизофренией мужчин от злокачественных новообразований (наряду с раком молочной железы больных шизофренией женщин): по данным Tran и соавт. (2009 г.) и Brown и соавт. (2010 г.), стандартизированный индекс смертности составляет 2,2 (95% доверительный интервал – ДИ 1,6–3,3), по данным Grinshpoon и соавт. (2005 г.), – 1,75 (для больных, родившихся в Азии и Африке). Lichtermann и соавт. (2001 г.), основываясь на анализе Финского ракового регистра, включив в исследование 446 653 истории болезни, обнаружили повышенную заболеваемость раком среди больных шизофренией, причем около половины всех случаев приходилось на рак легкого. J.Guo (2008 г.) также выявил повышенную заболеваемость раком дыхательных путей среди больных шизофренией. В то же время следует иметь в виду две работы, в которых было показано, что рак легких у больных шизофренией встречается достоверно реже (Mortensen, 1989, 1994; Hippisley-Cox и соавт., 2007).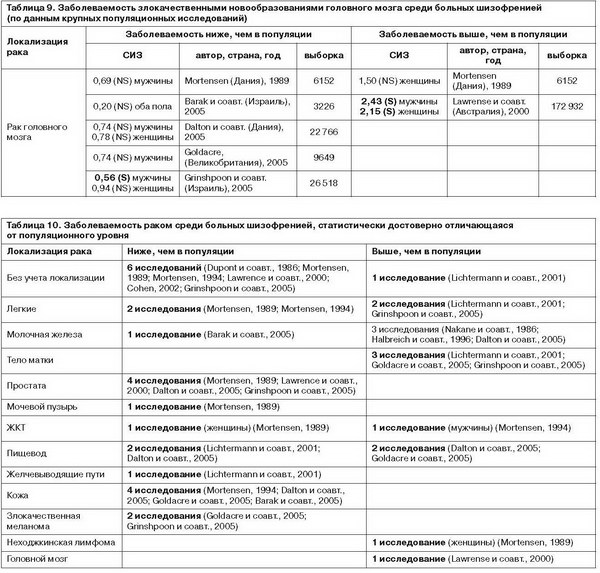
Одним из первых исследований, посвященных распространенности этого типа рака у больных шизофренией, является исследование A.Hussar, опубликованное еще в 1966 г., где указывалось, что распространенность рака легкого у больных шизофренией практически вдвое выше, чем в популяции.
Из работ отечественных авторов следует упомянуть исследование, выполненное В.П.Волковым (2009 г.), в котором изучалось место рака легких в структуре причин смертности больных, проходивших стационарное лечение и умерших в областной клинической психиатрической больнице №1 им. М.П.Литвинова (г. Тверь). На материале 850 протоколов вскрытия и историй болезни (случаи смерти с 1952 по 2007 г.) автор установил, что рак легкого является причиной смерти в 32% случаев от всех злокачественных новообразований у психически больных. Согласно полученным данным7 рак легкого как основная причина смерти встречается в 3,3% аутопсий при шизофрении, что достоверно (p<0,01) чаще, чем в общем секционном материале (0,9%) и чем среди умерших, страдавших другими психическими заболеваниями (0,4%). Стандартизированный индекс смертности среди больных шизофренией женщин от рака молочной железы составляет 2,8 (95% ДИ 1,6–4,9) (Tran и соавт., 2009; Brown и соавт., 2010) против 1,9 в общей популяции, причем значение этого показателя повышается с возрастом. По данным Office for National Statistics (2007 г.), более чем в 80% случаев этот тип онкопатологии манифестирует после 50 лет, что подтверждено в недавно проведенном эпидемиологическом исследовании – более 400 наблюдений (Bushe и соавт., 2009).
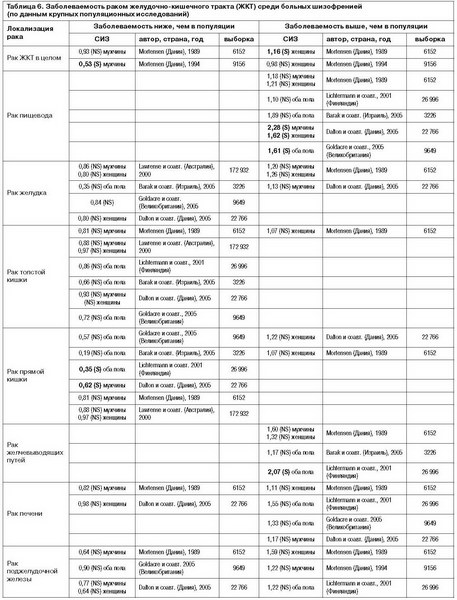
При более тщательном анализе исследований, посвященных эпидемиологии рака молочной железы у больных шизофренией, R.Hodgson и соавт. (2010 г.) отобрали работы, удовлетворяющие критерию надежности проспективных исследований – учет более чем 100 тыс. пациенто-лет (Baldwin и соавт., 1987). В итоге подтвердилась более высокая заболеваемость этим типом рака среди больных шизофренией, чем в населении. В трех наиболее крупных исследованиях – Grinshpoon и соавт. (2005 г.), Lichtermann и соавт. (2001 г.) и Dalton и соавт. (2005 г.) (см. табл. 3) СИЗ составил 1,11 (1,00–1,22), 1,20 (1,05–1,38) и 1,15 (0,98–1,34) соответственно. При этом у женщин, больных шизофренией, родившихся в Азии и Африке, этот показатель статистически значимо выше (p<0,05) и составляет 1,37.
Большинство авторов выделяют целый ряд факторов, ограничивающих достоверность подобных исследований, в том числе возраст, репродуктивный статус женщин, их семейное положение, применение контрацептивов, число беременностей, абортов и родов в анамнезе, а также курение и особенности их питания (Bushe и соавт., 2009). Также следует отметить, что в эпидемиологических исследованиях шизофрении при раке редко учитывают потенциально важный для оценки частотного распределения фактор – гистологический тип опухоли. Возможно, при шизофрении происходит накопление более агрессивных форм рака молочной железы, за счет чего в нескольких исследованиях были получены данные о заболеваемости, в несколько раз превышающей стандартизированный уровень (Halbreich и соавт., 1996; Dalton и соавт., 2005). Однако это лишь предположение: остается неясным, соответствует ли распространенность рака молочной железы у женщин с шизофренией показателю для общей популяции.
В качестве факторов риска развития рака молочной железы, связанных с шизофренией, рассматриваются и такие связанные с нежелательными эффектами длительного приема антипсихотиков факторы, как гиперпролактинемия, избыточная масса тела по типу центрипитального ожирения, а также неудовлетворительный гинекологический анамнез (отсутствие регулярной половой жизни, беременностей и родов, короткий период лактации или его отсутствие), связанные с особенностями психического заболевания (Bushe и соавт., 2009; Connolly и соавт., 2002). Существует мнение, что поддержание нормальной массы тела само по себе обладает достаточным протективным эффектом, но пониженный вес является бóльшим протективным фактором при раке молочной железы (Harvie и соавт., 2005; Parker, Folsom, 2003), а ожирение, напротив, способствует развитию рака молочной железы за счет влияния на метаболизм глюкозы и, что особенно значимо для рака молочной железы, – на гормональные процессы.
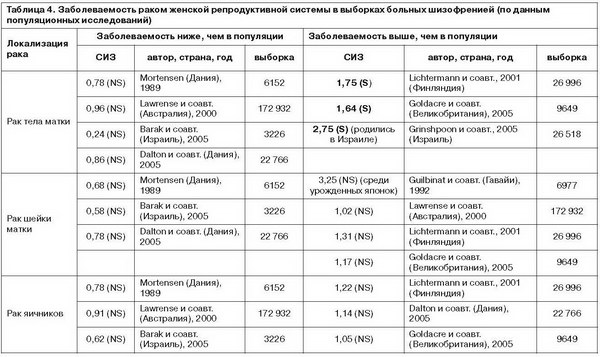
Исследования, посвященные изучению заболеваемости злокачественными новообразованиями других локализаций, приведены в табл. 4–9. Из 7 крупных популяционных исследований, посвященных изучению заболеваемости раком тела матки среди больных шизофренией, в 3 работах получены статистически достоверные результаты. Grinshpoon и соавт. (2005 г.) показали, что заболеваемость этим типом злокачественных новообразований у женщин, больных шизофренией, родившихся в Израиле, достоверно (p<0,05) выше, чем в населении этой страны: СИЗ – 2,75; по данным Lichtermann и соавт. (2001 г.), этот показатель составляет 1,75; Goldacre и соавт. (2005 г.) (Великобритания) сообщают о СИЗ, равном 1,64. Данные о заболеваемости раком шейки матки и яичников среди больных шизофренией противоречивы и статистически недостоверны (см. табл. 4).
При анализе заболеваемости раком мужской репродуктивной системы среди больных шизофренией (см. табл. 5) обращает внимание тот факт, что наиболее однозначные результаты оценки заболеваемости приводятся для рака простаты. Во всех крупных популяционных исследованиях зарегистрированы более низкие, чем в популяции, значения соответствующего показателя (Mortensen, 1989; Lawrense и соавт., 2001; Dalton и соавт., 2005; Grinshpoon и соавт., 2005). При этом в контексте риска упоминается проблема продолжительных госпитализаций, снижающих возможность вступления в сексуальные отношения (E.Torrey, 2006).
Показатели, касающиеся заболеваемости раком яичек, статистически недостоверны и противоречивы (см. табл. 5). В исследованиях, посвященных этому вопросу, высказывается гипотеза о зависимости риска развития различных заболеваний от очередности рождения пробанда: обнаружено, что у мужчин, родившихся первыми в семье, риск развития рака яичек выше (Cook и соавт., 2009). Известен и тот факт, что риск развития шизофрении у мужчин, родившихся в семье первыми, также выше (Kemppainen и соавт., 2001). Сопоставив эти два исследования, Goldacre и соавт. (2005 г.) выдвинули предположение о том, что больные шизофренией мужчины имеют больше шансов заболеть раком яичек, и даже получили данные, подтверждающие эту гипотезу, однако ограниченный объем изученной выборки не позволил прийти к окончательным выводам.
Все доступные исследования, посвященные распространенности рака почек, не выявили статистически достоверных отличий от популяционного уровня. Среди данных, касающихся заболеваемости раком мочевого пузыря у больных шизофренией, в единственной работе этот показатель статистически достоверно ниже, чем в популяции (Mortensen, 1989); результаты оставшихся 5 работ статистически недостоверны.
Второе по частоте место среди злокачественных новообразований у больных шизофренией занимает рак желудка (Ananth, Burnstein, 1977; В.П.Волков, 2009). Среди подверженных модификации факторов риска, специфичных для рака толстого кишечника, выделяют центрипетальное ожирение, связанное с длительным приемом антипсихотиков (Dai и соавт., 2007).
Резюмируя данные, представленные в табл. 7, выделим статистически значимые результаты крупных многоцентровых исследований, касающиеся эпидемиологии злокачественных новообразований ЖКТ у больных шизофренией:
• женщины, больные шизофренией, заболевают раком ЖКТ чаще (Mortensen, 1989);
• чаще, чем в популяции, вне зависимости от пола среди больных шизофренией встречается рак пищевода (Dalton и соавт., 2005; Goldacre и соавт., 2005) и желчевыводящих путей (Lichtermann и соавт., 2001);
• рак прямой кишки при шизофрении развивается достоверно реже (Lichtermann и соавт., 2001; Dalton и соавт., 2005).
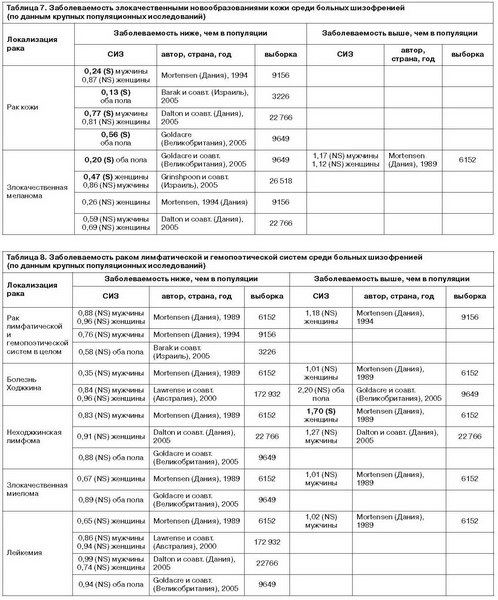
Данные о заболеваемости раком кожи и злокачественной меланомой в отличие от других типов рака достаточно однозначны (см. табл. 7): эти злокачественные новообразования при шизофрении встречаются достоверно реже, чем в населении (Mortensen, 1994; Barak и соавт., 2005; Dalton и соавт., 2005; Goldacre и соавт., 2005). Одним из возможных объяснений может быть предположение, выдвинутое Osterlind (1990 г.) о том, что больные шизофренией менее склонны находиться на солнце в связи с плохой переносимостью инсоляции – положительная корреляция с этим фактором обнаружена в ряде исследований (Mortensen, 1994; Grinshpoon, 2005; Goldacre и соавт., 2005). Данные, касающиеся заболеваемости злокачественными новообразованиями лимфопролиферативной и гемопоэтической систем, недостаточно информативны (табл. 8). Статистически достоверно чаще, чем в популяции, больные шизофренией заболевают лимфомой Ходжкина (Mortensen, 1989), все другие исследования достоверных отличий не выявили.
Злокачественные новообразования головного мозга у больных шизофренией встречаются достоверно чаще, чем в популяции, по данным Lawrense и соавт. (2000 г.), и достоверно реже (среди мужчин, больных шизофренией) – по данным Grinshpoon и соавт. (2005 г.). Среди факторов риска развития некоторых типов глиом и определенных типов детского рака головного мозга называют низкую массу тела при рождении (Spector и соавт., 2009), которая также коррелирует с высоким риском развития шизофрении (R.Hodgson и соавт., 2010).
Суммируя эпидемиологические данные о соотношении рака и шизофрении, можно сказать, что статистически достоверные отличия от популяционного уровня выглядят следующим образом (табл. 10).
Наиболее однозначны данные о заболеваемости неходжкинской лимфомой, раком тела матки и головного мозга (достоверно выше, чем в популяции), раком простаты и мочевого пузыря, желчевыводящих путей, кожи и злокачественной меланомой (достоверно ниже, чем в популяции). В отношении рака молочной железы, пищевода данные по заболеваемости раком ЖКТ в целом противоречивы – опубликованы исследования, результаты которых свидетельствуют как о достоверно более низкой, так и о достоверно более высокой заболеваемости среди больных шизофренией.
Учитывая противоречивость и разнородность приводимой информации, A.Lablensky, D.Lawrence (2001 г.) обозначили это явление как «эпидемиологическую головоломку» (epidemiologic puzzle), решить которую психиатрам и онкологам можно только сообща, используя современные подходы.
Сведения об авторе
Мясникова Любовь Константиновна – канд. мед. наук, мл. науч. сотр. отд-ния соматогенной психической патологии отд. по изучению пограничной психической патологии ФГБУ НЦПЗ РАМН. E-mail: pavl257@mail.ru
L.K.Myasnikova
Mental Health Research Center of the Russian Academy of Medical Sciences, Moscow
Проблема взаимосвязи шизофрении и злокачественных новообразований не утрачивает актуальности уже более ста лет. Впервые информация о гораздо более низкой заболеваемости раком среди больных шизофренией по сравнению с общей популяцией появилась в 1909 г. в докладе Комитета специальных уполномоченных по контролю за психическими расстройствами Англии и Уэльса (The Board of Control of the Commissioners in Lunacy). Однако несмотря на столь давнюю историю изучения эпидемиологического соотношения рака и шизофрении на сегодняшний день однозначного мнения не существует. Одни исследователи (Х.Н.Зильберштейн и соавт., 1959; М.Д.Пятов, 1965; Л.Я.Гусева, 1969; Fox и соавт., 1974; Baldwin, 1979) подтверждают первоначальные данные, другие выдвигают обратное представление, согласно которому злокачественные новообразования занимают одно из лидирующих мест среди естественных причин смерти больных шизофренией (Leucht и соавт., 2007; R.Hodgson и соавт., 2010), – второе место после сердечно-сосудистых заболеваний среди этого контингента (Л.Я.Гусева, 1969; C.Bouza и соавт., 2010). Подобные расхождения связывают с методикой проведения исследований: в значительной части работ выводы о распространенности строятся на данных об уровне смертности больных шизофренией от рака (M.Cohen и соавт., 2002).
Из 10 цитированных в табл. 1 работ в 7 зарегистрирован более низкий относительно среднепопуляционных значений показатель заболеваемости раком среди больных шизофренией.
Следует подчеркнуть, что доступные печатные работы (зарегистрированные в базах данных MEDLINE, PubMed и The Cochrane Collaboration), затрагивающие проблему соотношения обсуждаемых заболеваний, посвящены выявлению рака у больных шизофренией (как стационарных, так и амбулаторных), хотя, вероятно, для онкологов более актуальной была бы информация о заболеваемости шизофренией у больных раком. Такие исследования немногочисленны: выполненная в России многоцентровая программа СИНТЕЗ (А.Б.Смулевич и соавт., 2009) является фактически единственной работой, в которой изучена распространенность расстройств шизофренического спектра1 у онкологических пациентов, составившая 3,2% (17 из 516 онкологических больных)2. Отметим также, что к числу методических ограничений большинства работ относится заочная оценка (изучение медицинской документации и сопоставление онкологических и психиатрических архивов) данных.
Гипотеза канцеропротективного эффекта шизофрении
Одним из первых масштабных проспективных исследований заболеваемости раком среди больных шизофренией стала работа P.Mortensen (1989 г.), выполненная в Дании. Автор проследил судьбу 6168 больных шизофренией на протяжении 30 лет и пришел к выводу, что заболеваемость раком мужчин, больных шизофренией, достоверно ниже, чем в популяции, в то время как женщин – сопоставима с таковой. Спустя 5 лет автор (P.Mortensen, 1994) высказал предположение, что снижение показателя заболеваемости раком больных шизофренией мужчин может быть связано, во-первых, с запретом на курение в датских психиатрических больницах, а во-вторых, с неким протективным эффектом самого эндогенного процесса. В развитие гипотезы канцеропротективного эффекта шизофрении Goldacre и соавт. (2005 г.) и Catts и соавт. (2008 г.) предположили, что этот эффект связан с генетическими особенностями – гены или сцепление генов, ответственные за развитие этого заболевания, могут обеспечивать пациентам преимущества в плане выживаемости (R.Hodgson и соавт., 2010)3, несмотря на тот факт, что стиль жизни больных шизофренией способствует заболеваемости раком (учитывая такие канцерогенные факторы, как курение4, сниженная физическая активность и неправильное питание).
 В качестве аргумента, подтверждающего это предположение, авторы используют как собственные данные, так и материалы других публикаций (D.Lichtermann и соавт., 2001), свидетельствующие о достоверно более низкой распространенности рака среди не страдающих психозами сибсов, больных шизофренией, и их родителей (в то время как среди самих больных шизофренией этот показатель сопоставим с распространенностью рака в населении).
В качестве аргумента, подтверждающего это предположение, авторы используют как собственные данные, так и материалы других публикаций (D.Lichtermann и соавт., 2001), свидетельствующие о достоверно более низкой распространенности рака среди не страдающих психозами сибсов, больных шизофренией, и их родителей (в то время как среди самих больных шизофренией этот показатель сопоставим с распространенностью рака в населении).
Обнаружено несколько генетических механизмов, претендующих на роль канцеропротективных факторов, связанных с шизофренией (Catts и соавт., 2000; Cui и соавт., 2005; Park и соавт., 2004; Yang и соавт., 2004; Waterland, Jirtle, 2004; Goldacre и соавт., 2005; Abel и соавт., 2006). Хотя это не является задачей настоящего обзора, кратко упомянем некоторые из них. В ряде работ обсуждается ген p53, участвующий в процессе апоптоза5, модификация которого обнаружена как у больных шизофренией, так и у их родственников (Catts и соавт., 2000; Cui и соавт., 2005; Park и соавт., 2004; Yang и соавт., 2004; K.Goulet, S.Grignon, 2008).

 Abel и соавт. (2006 г.) показали, что сниженная заболеваемость колоректальным раком среди больных шизофренией (Goldacre и соавт., 2005) может быть связана с аномальным импринтингом6 инсулиноподобного фактора роста 2 (ИФР-2), считающегося ведущим в патогенезе этого вида рака (Jirtle, 2004) и ассоциированного с риском развития шизофрении (Abel и соавт., 2004, 2006). Как показали Waterland, Jirtle (2004 г.), особенности питания матери пробанда во время беременности приводят к изменениям цитозиновой метиляции, к которой восприимчивы метилированные гены, такие как ген ИФР-2, что впоследствии, по мнению авторов, может влиять на развитие шизофрении.
Abel и соавт. (2006 г.) показали, что сниженная заболеваемость колоректальным раком среди больных шизофренией (Goldacre и соавт., 2005) может быть связана с аномальным импринтингом6 инсулиноподобного фактора роста 2 (ИФР-2), считающегося ведущим в патогенезе этого вида рака (Jirtle, 2004) и ассоциированного с риском развития шизофрении (Abel и соавт., 2004, 2006). Как показали Waterland, Jirtle (2004 г.), особенности питания матери пробанда во время беременности приводят к изменениям цитозиновой метиляции, к которой восприимчивы метилированные гены, такие как ген ИФР-2, что впоследствии, по мнению авторов, может влиять на развитие шизофрении.
Тем не менее, поскольку в ряде исследований (Guilbinat и соавт., 1992; Dalton и соавт., 2004) рассмотренная выше гипотеза не подтверждается, приведенные данные требуют уточнения в ходе дальнейших исследований.
Канцерогенные факторы, ассоциированные с шизофренией
В качестве факторов, повышающих риск канцерогенеза (курение, неправильное питание и др.), при шизофрении выделяют поведенческий фактор, обусловленный особенностями течения заболевания, влияющими на образ жизни больного. Неоспоримым фактором развития рака является курение, выявляемое среди больных шизофренией практически вдвое чаще, чем в популяции (Kelly, McCreadie, 1999; Punnoose и соавт., 2006).



Было также показано, что стиль жизни больных шизофренией со снижением физической активности еще до назначения психотропных препаратов, с воздействием которых мог бы быть связан этот факт, может расцениваться в качестве еще одного фактора риска развития онкопатологии (Daumit и соавт., 2005; Smith и соавт., 2007). Кроме того, в качестве канцерогенного фактора при некоторых типах рака (они будут обсуждены ниже) приводят низкий вес плода при рождении, коррелирующий также и с повышенным риском развития шизофрении (R.Hodgson и соавт., 2010).
Среди гипотез подверженности раку больных шизофренией рассматривалась зависимость от региона рождения и проживания пациента. Так, Gulbinat и соавт. (1992 г.) при исследовании пациентов, проживающих в Дании, подтвердили данные, полученные P.Mortensen (1989 г.), но в Гонолулу и Нагасаки получили противоположные результаты. Grinshpoon и соавт. (2005 г.) изучали взаимосвязь между заболеваемостью раком и шизофренией на израильской популяции в зависимости от региона рождения (Азия–Африка, Европа–Америка и Израиль). Было показано, что в целом для пациентов из всех трех регионов рождения заболеваемость раком среди больных шизофренией достоверно ниже, чем в популяции: стандартизированный индекс заболеваемости раком (СИЗР) составил 0,86 и 0,91 для мужчин и женщин соответственно (p<0,05). При этом наиболее низким среди больных шизофренией СИЗР был для пациентов, родившихся в регионе Европы и Америки (0,85 и 0,86 для мужчин и женщин соответственно).
Наиболее обоснованным представляется предположение о разном распределении показателей распространенности шизофрении в зависимости от локализации и/или гистологического типа злокачественных новообразований. Такой подход представлен в работах R.Hodgson и соавт. (2010 г.). Обобщив противоречивые данные о заболеваемости раком среди больных шизофренией, авторы подытожили полученные результаты следующим образом. «Рак, как и шизофрения, это не просто заболевания – это комплексные биологические феномены. В природе существует более чем 100 анатомических разновидностей рака, многие из которых подразделяются на различные гистологические варианты, характеризуются разным прогнозом и ответом на лечение. Вероятно, только некоторые из них подвержены модификациям, ассоциированным с шизофренией».
Остановимся на распространенности отдельных типов раковых опухолей при шизофрении.
Заболеваемость больных шизофренией отдельными видами злокачественных новообразований
Рак легких открывает список причин смерти больных шизофренией мужчин от злокачественных новообразований (наряду с раком молочной железы больных шизофренией женщин): по данным Tran и соавт. (2009 г.) и Brown и соавт. (2010 г.), стандартизированный индекс смертности составляет 2,2 (95% доверительный интервал – ДИ 1,6–3,3), по данным Grinshpoon и соавт. (2005 г.), – 1,75 (для больных, родившихся в Азии и Африке). Lichtermann и соавт. (2001 г.), основываясь на анализе Финского ракового регистра, включив в исследование 446 653 истории болезни, обнаружили повышенную заболеваемость раком среди больных шизофренией, причем около половины всех случаев приходилось на рак легкого. J.Guo (2008 г.) также выявил повышенную заболеваемость раком дыхательных путей среди больных шизофренией. В то же время следует иметь в виду две работы, в которых было показано, что рак легких у больных шизофренией встречается достоверно реже (Mortensen, 1989, 1994; Hippisley-Cox и соавт., 2007).

Одним из первых исследований, посвященных распространенности этого типа рака у больных шизофренией, является исследование A.Hussar, опубликованное еще в 1966 г., где указывалось, что распространенность рака легкого у больных шизофренией практически вдвое выше, чем в популяции.
Из работ отечественных авторов следует упомянуть исследование, выполненное В.П.Волковым (2009 г.), в котором изучалось место рака легких в структуре причин смертности больных, проходивших стационарное лечение и умерших в областной клинической психиатрической больнице №1 им. М.П.Литвинова (г. Тверь). На материале 850 протоколов вскрытия и историй болезни (случаи смерти с 1952 по 2007 г.) автор установил, что рак легкого является причиной смерти в 32% случаев от всех злокачественных новообразований у психически больных. Согласно полученным данным7 рак легкого как основная причина смерти встречается в 3,3% аутопсий при шизофрении, что достоверно (p<0,01) чаще, чем в общем секционном материале (0,9%) и чем среди умерших, страдавших другими психическими заболеваниями (0,4%). Стандартизированный индекс смертности среди больных шизофренией женщин от рака молочной железы составляет 2,8 (95% ДИ 1,6–4,9) (Tran и соавт., 2009; Brown и соавт., 2010) против 1,9 в общей популяции, причем значение этого показателя повышается с возрастом. По данным Office for National Statistics (2007 г.), более чем в 80% случаев этот тип онкопатологии манифестирует после 50 лет, что подтверждено в недавно проведенном эпидемиологическом исследовании – более 400 наблюдений (Bushe и соавт., 2009).
При более тщательном анализе исследований, посвященных эпидемиологии рака молочной железы у больных шизофренией, R.Hodgson и соавт. (2010 г.) отобрали работы, удовлетворяющие критерию надежности проспективных исследований – учет более чем 100 тыс. пациенто-лет (Baldwin и соавт., 1987). В итоге подтвердилась более высокая заболеваемость этим типом рака среди больных шизофренией, чем в населении. В трех наиболее крупных исследованиях – Grinshpoon и соавт. (2005 г.), Lichtermann и соавт. (2001 г.) и Dalton и соавт. (2005 г.) (см. табл. 3) СИЗ составил 1,11 (1,00–1,22), 1,20 (1,05–1,38) и 1,15 (0,98–1,34) соответственно. При этом у женщин, больных шизофренией, родившихся в Азии и Африке, этот показатель статистически значимо выше (p<0,05) и составляет 1,37.
Большинство авторов выделяют целый ряд факторов, ограничивающих достоверность подобных исследований, в том числе возраст, репродуктивный статус женщин, их семейное положение, применение контрацептивов, число беременностей, абортов и родов в анамнезе, а также курение и особенности их питания (Bushe и соавт., 2009). Также следует отметить, что в эпидемиологических исследованиях шизофрении при раке редко учитывают потенциально важный для оценки частотного распределения фактор – гистологический тип опухоли. Возможно, при шизофрении происходит накопление более агрессивных форм рака молочной железы, за счет чего в нескольких исследованиях были получены данные о заболеваемости, в несколько раз превышающей стандартизированный уровень (Halbreich и соавт., 1996; Dalton и соавт., 2005). Однако это лишь предположение: остается неясным, соответствует ли распространенность рака молочной железы у женщин с шизофренией показателю для общей популяции.
В качестве факторов риска развития рака молочной железы, связанных с шизофренией, рассматриваются и такие связанные с нежелательными эффектами длительного приема антипсихотиков факторы, как гиперпролактинемия, избыточная масса тела по типу центрипитального ожирения, а также неудовлетворительный гинекологический анамнез (отсутствие регулярной половой жизни, беременностей и родов, короткий период лактации или его отсутствие), связанные с особенностями психического заболевания (Bushe и соавт., 2009; Connolly и соавт., 2002). Существует мнение, что поддержание нормальной массы тела само по себе обладает достаточным протективным эффектом, но пониженный вес является бóльшим протективным фактором при раке молочной железы (Harvie и соавт., 2005; Parker, Folsom, 2003), а ожирение, напротив, способствует развитию рака молочной железы за счет влияния на метаболизм глюкозы и, что особенно значимо для рака молочной железы, – на гормональные процессы.
Исследования, посвященные изучению заболеваемости злокачественными новообразованиями других локализаций, приведены в табл. 4–9. Из 7 крупных популяционных исследований, посвященных изучению заболеваемости раком тела матки среди больных шизофренией, в 3 работах получены статистически достоверные результаты. Grinshpoon и соавт. (2005 г.) показали, что заболеваемость этим типом злокачественных новообразований у женщин, больных шизофренией, родившихся в Израиле, достоверно (p<0,05) выше, чем в населении этой страны: СИЗ – 2,75; по данным Lichtermann и соавт. (2001 г.), этот показатель составляет 1,75; Goldacre и соавт. (2005 г.) (Великобритания) сообщают о СИЗ, равном 1,64. Данные о заболеваемости раком шейки матки и яичников среди больных шизофренией противоречивы и статистически недостоверны (см. табл. 4).
При анализе заболеваемости раком мужской репродуктивной системы среди больных шизофренией (см. табл. 5) обращает внимание тот факт, что наиболее однозначные результаты оценки заболеваемости приводятся для рака простаты. Во всех крупных популяционных исследованиях зарегистрированы более низкие, чем в популяции, значения соответствующего показателя (Mortensen, 1989; Lawrense и соавт., 2001; Dalton и соавт., 2005; Grinshpoon и соавт., 2005). При этом в контексте риска упоминается проблема продолжительных госпитализаций, снижающих возможность вступления в сексуальные отношения (E.Torrey, 2006).
Показатели, касающиеся заболеваемости раком яичек, статистически недостоверны и противоречивы (см. табл. 5). В исследованиях, посвященных этому вопросу, высказывается гипотеза о зависимости риска развития различных заболеваний от очередности рождения пробанда: обнаружено, что у мужчин, родившихся первыми в семье, риск развития рака яичек выше (Cook и соавт., 2009). Известен и тот факт, что риск развития шизофрении у мужчин, родившихся в семье первыми, также выше (Kemppainen и соавт., 2001). Сопоставив эти два исследования, Goldacre и соавт. (2005 г.) выдвинули предположение о том, что больные шизофренией мужчины имеют больше шансов заболеть раком яичек, и даже получили данные, подтверждающие эту гипотезу, однако ограниченный объем изученной выборки не позволил прийти к окончательным выводам.
Все доступные исследования, посвященные распространенности рака почек, не выявили статистически достоверных отличий от популяционного уровня. Среди данных, касающихся заболеваемости раком мочевого пузыря у больных шизофренией, в единственной работе этот показатель статистически достоверно ниже, чем в популяции (Mortensen, 1989); результаты оставшихся 5 работ статистически недостоверны.
Второе по частоте место среди злокачественных новообразований у больных шизофренией занимает рак желудка (Ananth, Burnstein, 1977; В.П.Волков, 2009). Среди подверженных модификации факторов риска, специфичных для рака толстого кишечника, выделяют центрипетальное ожирение, связанное с длительным приемом антипсихотиков (Dai и соавт., 2007).
Резюмируя данные, представленные в табл. 7, выделим статистически значимые результаты крупных многоцентровых исследований, касающиеся эпидемиологии злокачественных новообразований ЖКТ у больных шизофренией:
• женщины, больные шизофренией, заболевают раком ЖКТ чаще (Mortensen, 1989);
• чаще, чем в популяции, вне зависимости от пола среди больных шизофренией встречается рак пищевода (Dalton и соавт., 2005; Goldacre и соавт., 2005) и желчевыводящих путей (Lichtermann и соавт., 2001);
• рак прямой кишки при шизофрении развивается достоверно реже (Lichtermann и соавт., 2001; Dalton и соавт., 2005).
Данные о заболеваемости раком кожи и злокачественной меланомой в отличие от других типов рака достаточно однозначны (см. табл. 7): эти злокачественные новообразования при шизофрении встречаются достоверно реже, чем в населении (Mortensen, 1994; Barak и соавт., 2005; Dalton и соавт., 2005; Goldacre и соавт., 2005). Одним из возможных объяснений может быть предположение, выдвинутое Osterlind (1990 г.) о том, что больные шизофренией менее склонны находиться на солнце в связи с плохой переносимостью инсоляции – положительная корреляция с этим фактором обнаружена в ряде исследований (Mortensen, 1994; Grinshpoon, 2005; Goldacre и соавт., 2005). Данные, касающиеся заболеваемости злокачественными новообразованиями лимфопролиферативной и гемопоэтической систем, недостаточно информативны (табл. 8). Статистически достоверно чаще, чем в популяции, больные шизофренией заболевают лимфомой Ходжкина (Mortensen, 1989), все другие исследования достоверных отличий не выявили.
Злокачественные новообразования головного мозга у больных шизофренией встречаются достоверно чаще, чем в популяции, по данным Lawrense и соавт. (2000 г.), и достоверно реже (среди мужчин, больных шизофренией) – по данным Grinshpoon и соавт. (2005 г.). Среди факторов риска развития некоторых типов глиом и определенных типов детского рака головного мозга называют низкую массу тела при рождении (Spector и соавт., 2009), которая также коррелирует с высоким риском развития шизофрении (R.Hodgson и соавт., 2010).
Суммируя эпидемиологические данные о соотношении рака и шизофрении, можно сказать, что статистически достоверные отличия от популяционного уровня выглядят следующим образом (табл. 10).
Наиболее однозначны данные о заболеваемости неходжкинской лимфомой, раком тела матки и головного мозга (достоверно выше, чем в популяции), раком простаты и мочевого пузыря, желчевыводящих путей, кожи и злокачественной меланомой (достоверно ниже, чем в популяции). В отношении рака молочной железы, пищевода данные по заболеваемости раком ЖКТ в целом противоречивы – опубликованы исследования, результаты которых свидетельствуют как о достоверно более низкой, так и о достоверно более высокой заболеваемости среди больных шизофренией.
Учитывая противоречивость и разнородность приводимой информации, A.Lablensky, D.Lawrence (2001 г.) обозначили это явление как «эпидемиологическую головоломку» (epidemiologic puzzle), решить которую психиатрам и онкологам можно только сообща, используя современные подходы.
Сведения об авторе
Мясникова Любовь Константиновна – канд. мед. наук, мл. науч. сотр. отд-ния соматогенной психической патологии отд. по изучению пограничной психической патологии ФГБУ НЦПЗ РАМН. E-mail: pavl257@mail.ru
Список исп. литературыСкрыть список1. Волков В.П. Соматическая патология и причины смерти при шизофрении. Журн. неврол. и психиатр. им. С.С.Корсакова. 2009; 5: 14–9.
2. Гусева Л.Я. Смертность и причины смерти больных шизофренией. Дис. … канд. мед. наук. М., 1969.
3. Зильберштейн Х.Н., Гарбузенко Л.Л., Канторович В.И. Клинико-анатомическая характеристика шизофреника по материалам прозектуры УНИПНИ. В кн.: Тезисы и рефераты докладов 3-го съезда невропатологов и психиатров УССР. Харьков, 1959; с. 241–4.
4. Пятов М.Д. К вопросу о причинах смерти больных шизофренией. В кн.: Материалы к 13-й научной конференции аспирантов и клинических ординаторов 1-го ЛМИ им. И.П.Павлова. Л., 1965; с. 82–126.
5. Смулевич А.Б., Андрющенко А.В., Бескова Д.А. Психические расстройства в онкологии (результаты многоцентровой программы СИНТЕЗ). Психич. расстройства в общей медицине. 2009; 1: 4–11.
6. Abel KM, Allin MP, Jirtle AL. Schizophrenia, cancer and imprinting: early nutritional influences. Br J Psychiat 2006; 188: 394.
7. Ananth J, Burnstein M. Cancer: less common in psychiatric patients? Psychosomatics 1977; 18: 44–6.
8. Baldwin J. Schizophrenia and physical disease. Psychol Med 1979; 9: 611–8.
9. Baldwin J, Acheson ED, Graham WJ. Textbook of Medical Record Linkage Oxford: Oxford University Press 1987.
10. Bouza C, López-Cuadrado T, Amate JM. Physical disease in schizophrenia: a population-based analysis in Spain. BMC Public Health 2010; 10: 745.
11. Brown S, Kim M, Mitchell C, Inskip H. Twenty-five year mortality of a community cohort with schizophrenia. Br J Psychiat 2010; 196: 116–21.
12. Bushe C, Bradley A, Wildgust H, Hodgson R. Schizophrenia and breast cancer incidence. A systematic review of clinical studies. Schizophr Res 2009; 114: 6–16.
13. Catts VS, Catts SV. Apoptosis and schizophrenia: is the tumour suppressor gene, p53, a candidate susceptibility gene? Schizophr Res 2000; 41: 405–15.
14. Catts VS, Catts SV, O’Toole BI, Frost ADJ. Cancer incidence in patients with schizophrenia and their first-degree relatives – a meta-analysis. Acta Psychiat Scand 2008; 117: 323–36.
15. Cohen ME, Dembling B, Schorling JB. The association between schizophrenia and cancer: a population-based mortality study. Schizophr Res 2002; 57: 139–46.
16. Connolly BS, Barnett C, Vogt KN et al. A meta-analysis of published literature on waist-to-hip ratio and risk of breast cancer. Nutr Cancer 2002; 44: 127–38.
17. Cook MB, Akre O, Forman D et al. A systematic review and meta-analysis of perinatal variables in relation to the risk of testicular cancer – experiences of the mother. Int J Epidemiol 2009; 38: 1532–42.
18. Commissioners in Lunacy for England and Wales 1909. Ann Report London: HMSO (цит. по R.Hodgson и соавт., 2010).
19. Cui DH, Jiang KD, Jiang SD et al. The tumor suppressor adenomatous polyposis coli gene is associated with susceptibility to schizophrenia. Mol Psychiat 2005; 10: 669–77.
20. Dai Z, Xu YC, Niu L. Obesity and colorectal cancer risk: a meta-analysis of cohort studies. World J Gastroenterol 2007; 13: 4199–206.
21. Dalton SO, Laursen TM, Mellemkjær L et al. Risk for cancer in parents of patients with schizophrenia. Am J Psychiat 2004; 161: 903–8.
22. Dalton SO, Mellemkjaer L, Thomassen L et al. Risk for cancer in a cohort of patients hospitalized for schizophrenia in Denmark 1969–1993. Schizophr Res 2005; 75: 315–24.
23. Dupont A. Socio-psychiatric aspects of the young severely mentally retarded and the family. 19th Blake Marsh lecture delivered before the Royal College of Psychiatrists 1985. Br J Psychiat 1986; 148: 227–34. No abstr. available.
24. Fox BH, Howell MA. Cancer risk among psychiatric patients: a hypothesis. Int J Epidemiol 1974; 3: 207–8.
25. Goldacre MJ, Kurina LM, Wotton CJ et al. Schizophrenia and cancer: an epidemiological study. Br J Psychiat 2005; 187: 334–8.
26. Goulet K, Grignon S. Case report: clozapine given in the context of chemotherapy for lung cancer. Psychooncol 2008; 17 (5): 512–6.
27. Grinshpoon A, Barchana M, Ponizovsky A et al. Cancer in schizophrenia: is the risk higher or lower. Schizophr Res 2005; 73: 333–41.
28. Gulbinat W, Dupont A, Jablensky A et al. Cancer incidence of schizophrenic patients. Results of record linkage studies in three countries. Br J Psychiat 1992; 161 (Suppl. 18): 75–85.
29. Guo JJ. Schizophrenia associated with increased risk of colon cancer but reduced risk of respiratory cancer. Evid Based Ment Health 2008; 11 (3): 93.
30. Halbreich U, Palter S. Accelerated osteoporosis in psychiatric patients: possible pathophysiological processes. Schizophr Bull 1996; 22 (3): 447–54. Review.
31. Harvie M, Howell A, Vierkant RA et al. Association of gain and loss of weight before and after menopause with risk of postmenopausal breast cancer in the Iowa women’s health study. Cancer Epidemiol Biomark Prev 2005; 14: 656–61.
32. Hippisley-Cox J, Vinogradova Y, Coupland C, Parker C. Risk of malignancy in patients with schizophrenia or bipolar disorder: nested case-control study. Arch Gen Psychiat 2007; 64: 1368–76.
33. Hodgson R, Wildgust HJ, Bushe CJ. Cancer and schizophrenia: is there a paradox? J Psychopharmacol 2010; 24 (Suppl. 11): 51–60.
34. Hussar AE. Leading causes of death in institutionalized chronic schizophrenic patients: a study of 1275 autopsy protocols. J Nerv Ment Dis 1966; 142: 45–58.
35. Jablensky A, Lawrence D. Schizophrenia and cancer: is there a need to invoke a protective gene? Arch Gen Psychiat 2001; 58 (6): 579–80.
36. Jirtle RL. IGF2 loss of imprinting: a potential heritable risk factor for colorectal cancer. Gastroenterol 2004; 126: 1190–201.
37. Kampert JB, Blair SN, Barlow CE. Physical activity, physical fitness, and all-cause and cancer mortality: a prospective study of men and women. Ann Epidemiol 1996; 6: 452–7.
38. Kelly C, McCreadie RG. Smoking habits, current symptoms and premorbid characteristics of schizophrenic patients in Nithsdale, Scotland. Am J Psychiat 1999; 156: 1751–7.
39. Kemppainen L, Veijola J, Jokelainen J, Hartikainen A-L. Birth order and risk for schizophrenia: a 31-year follow-up of the Northern Finland 1966 Birth Cohort. Acta Psychiat Scand 2001; 104: 148–52.
40. Leucht S, Burkard T, Henderson J et al. Physical illness and schizophrenia: a review of the literature. Acta Psychiat Scand 2007; 116 (5): 317–33.
41. Lichtermann D, Ekelund J, Pukkala E et al. Incidence of cancer among persons with schizophrenia and their relatives. Arch Gen Psychiat 2001; 58: 573–8.
42. McCreadie RG, McDonald E, Blacklock C et al. Dietary intake of schizophrenic patients in Nithsdale, Scotland: case-control study. Br Med J 1998; 317: 784–5.
43. Mortensen PB. The incidence of cancer in schizophrenic patients. J Epidem Commun Health 1989; 43: 43–7.
44. Mortensen PB. The occurrence of cancer in first-admitted schizophrenic patients. Schizophr Res 1994; 12: 185–94.
45. Office for National Statistics Cancer Statistics Registrations: Registrations of Cancer Diagnosed in 2004, England. Series MB1 no. 35 London: Office for National Statistics 2007.
46. Osterlind A. Malignant melanoma in Denmark: occurrence and risk factors. Acta Oncol 1990; 29: 833–54.
47. Park JK, Lee HJ, Kim JW et al. Differences in p53 gene polymorphisms between Korean schizophrenia and lung cancer patients. Schizophr Res 2004; 67: 71–4.
48. Parker ED, Folsom AR. Intentional weight loss and incidence of obesity-related cancers: the Iowa Women’s Health Study. Int J Obes Relat Metab Disord 2003; 27: 1447–52.
49. Punnoose, Belgamwar MR. Nicotine for schizophrenia. Cochrane Database Syst Rev 2006; 1: CD004838.
50. Rosenthal D. The spectrum concept in schizophrenic and manic-depressive disorders. Res Publ Assoc Res Nerv Ment Dis 1975; 54: 19–25.
51. Seeman MV. Preventing breast cancer in women with schizophrenia. Acta Psychiat Scand 2011; 123 (2): 107–17.
52. Smith S, Yeomans D, Bushe CJ et al. A well-being programme in severe mental illness. Reducing risk for physical ill-health: a post-programme service evaluation at 2 years. Eur Psychiat 2007; 22: 413–8.
53. Spector LG, Puumala SE, Carozza SE, Chow EJ. Cancer risk among children with very low birth weights. Pediatrics 2009; 124: 96–104.
54. Tandon R, Keshavan MS, Nasrallah HA. Schizophrenia, «Just the facts». What we know in 2008. 2. Epidemiology and etiology. Schizoprenia research 2008; 102: 1–18.
55. Thakore JH. Metabolic disturbance in first-episode schizophrenia. Br J Psychiat 2004; 47: s76–9.
56. Torrey EF. Prostate cancer and schizophrenia. Urology 2006; 68 (6): 1280–3.
57. Tran E, Rouillon F, Loze JY et al. Cancer mortality in patients with schizophrenia: an 11-year prospective cohort study. Cancer 2009; 115: 3555–62.
58. Waterland RA, Jirtle RL. Early nutrition, epigenetic changes at transposons and imprinted genes, and enhanced susceptibility to adult chronic diseases. Nutrition 2004; 20 (1): 63–8.
59. Yang Y, Xiao Z, Chen W et al. Tumor suppressor gene TP53 is genetically associated with schizophrenia in the Chinese population. Neurosci Lett 2004; 369: 126–31.


