Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№03 2012
Вальдоксан (агомелатин) в терапии депрессивных расстройств у пациентов с онкологическими заболеваниями органов женской репродуктивной системы №03 2012
Номера страниц в выпуске:21-25
Проведена оценка антидепрессивного эффекта и переносимости препарата Вальдоксан в дозе 25–50 мг/сут у 30 пациентов с онкологическими заболеваниями органов женской репродуктивной системы, страдающих депрессивным эпизодом (по Международной классификации болезней 10-го пересмотра – МКБ-10: легкий – 26,6%, умеренный – 56,7% или тяжелый непсихотический без суицидальных тенденций – 16,7%).
Резюме. Проведена оценка антидепрессивного эффекта и переносимости препарата Вальдоксан в дозе 25–50 мг/сут у 30 пациентов с онкологическими заболеваниями органов женской репродуктивной системы, страдающих депрессивным эпизодом (по Международной классификации болезней 10-го пересмотра – МКБ-10: легкий – 26,6%, умеренный – 56,7% или тяжелый непсихотический без суицидальных тенденций – 16,7%). Результаты свидетельствуют о высокой эффективности Вальдоксана. Через 8 нед терапии доля респондеров (снижение суммарного балла MADRS на 50% и более) составила 63,3%, доля пациентов в ремиссии (суммарный балл MADRS<12) достигла 40%. Статистически значимое снижение стартового суммарного балла MADRS фиксировалось уже через 2 нед терапии, что говорит о быстром развитии антидепрессивного эффекта. Установлен благоприятный профиль переносимости и безопасности Вальдоксана: только 3 из 30 пациентов преждевременно выбыли из исследования из-за нежелательных явлений. Клинически значимых признаков неблагоприятных лекарственных взаимодействий Вальдоксана с препаратами химиотерапии и другими лекарственными средствами не зафиксировано. Полученные данные свидетельствуют о высокой эффективности Вальдоксана в сочетании с терапией депрессий у больных со злокачественными новообразованиями органов женской репродуктивной системы.
Ключевые слова: депрессия, Вальдоксан, рак молочной железы, рак органов женской репродуктивной системы.
Valdoxan (agomelatine) in anti-depressive therapy of the patients with malignancies of female reproductive system
M.A.Samushia1, L.K.Myasnikova2
1Sechenov First Moscow State Medical University
2Mental Health Research Center of the Russian Academy of Medical Sciences
Summary. The anti-depressive effectiveness and tolerability of Valdoxan (25–50 mg/day) have been studied in 30 patients with breast and gynecological cancer suffering from depressive episode (ICD-10: mild – 26,6%, moderate – 56,7% or severe non-psychotic without suicide tendencies – 16,7%). The results show a high level of Valdoxan effectiveness: 63,% of patients were responders (reduction of baseline MADRS total score ≥50%), 40% were remitters (MADRS total score <12). Valdoxan has provided early improvement with statistically significant changes of MADRS baseline scores after two weeks of treatment. Valdoxan demonstrated a good profile of tolerability and safety with only 3 from 30 patients discontinued from the study due to adverse events (headache) and no signs of drug interaction with chemotherapy and other medications. Valdoxan is effective and safe in treatment of depressions in cancer patients.
Key words: depression, Valdoxan, breast cancer, gynecological cancer.
Введение
Потребность в психофармакотерапии выявляется в среднем у 50–90% онкологических больных [8, 15]. Этот факт объясняется высокой распространенностью психической патологии, преимущественно тревожно-депрессивных расстройств, которые диагностируются у 60–80% больных, страдающих злокачественными новообразованиями [16, 28]. Актуальность эффективной терапии депрессии также определяется негативными последствиями депрессивных расстройств у пациентов, страдающих злокачественными новообразованиями, включая повышенный суицидальный риск, снижение качества жизни, сокращение сроков выживаемости, неудовлетворительную комплаентность терапии онкологических заболеваний и увеличение длительности пребывания в онкологическом стационаре [12, 19–21, 23]. Вальдоксан (агомелатин) является новейшим антидепрессантом с инновационным фармакологическим профилем. Вальдоксан действует как агонист мелатонинергических MT1- и MT2-рецепторов и антагонист серотонинергических 5HT2С-рецепторов, не обнаруживает значимого аффинитета к другим центральным рецепторам или переносчикам моноаминов и не влияет на внеклеточные уровни серотонина [10, 18, 24].
 В завершенных на сегодня исследованиях показана высокая антидепрессивная эффективность Вальдоксана в дозах 25–50 мг/сут при непсихотических депрессивных эпизодах легкой, умеренной и тяжелой степени [25]. Установлено, что по уровню стойкости и выраженности антидепрессивного эффекта Вальдоксан достоверно превосходит плацебо, а также сопоставим или превосходит по выраженности и срокам реализации тимоаналептического действия другие современные антидепрессанты, включая селективные ингибиторы обратного захвата серотонина – пароксетин, флуоксетин, эсциталопрам и сертралин, и ингибитор обратного захвата серотонина и норадреналина венлафаксин [11, 17]. В то же время благодаря уникальному фармакологическому профилю Вальдоксан не вызывает значимых побочных эффектов и значительно превосходит по переносимости и безо-пасности большинство современных антидепрессантов [15]. Благоприятный профиль переносимости Вальдоксана подтвержден в масштабных натуралистических исследованиях с участием пациентов с депрессиями, страдающих сопутствующими соматическими заболеваниями [4, 17, 22, 26], а также в специальном исследовании у больных с сердечно-сосудистыми заболеваниями [5] и в постинсультном периоде [1, 2]. Такое сочетание эффективности и безопасности определяет целесообразность изучения Вальдоксана как средства терапии депрессивных расстройств при онкологических заболеваниях.
В завершенных на сегодня исследованиях показана высокая антидепрессивная эффективность Вальдоксана в дозах 25–50 мг/сут при непсихотических депрессивных эпизодах легкой, умеренной и тяжелой степени [25]. Установлено, что по уровню стойкости и выраженности антидепрессивного эффекта Вальдоксан достоверно превосходит плацебо, а также сопоставим или превосходит по выраженности и срокам реализации тимоаналептического действия другие современные антидепрессанты, включая селективные ингибиторы обратного захвата серотонина – пароксетин, флуоксетин, эсциталопрам и сертралин, и ингибитор обратного захвата серотонина и норадреналина венлафаксин [11, 17]. В то же время благодаря уникальному фармакологическому профилю Вальдоксан не вызывает значимых побочных эффектов и значительно превосходит по переносимости и безо-пасности большинство современных антидепрессантов [15]. Благоприятный профиль переносимости Вальдоксана подтвержден в масштабных натуралистических исследованиях с участием пациентов с депрессиями, страдающих сопутствующими соматическими заболеваниями [4, 17, 22, 26], а также в специальном исследовании у больных с сердечно-сосудистыми заболеваниями [5] и в постинсультном периоде [1, 2]. Такое сочетание эффективности и безопасности определяет целесообразность изучения Вальдоксана как средства терапии депрессивных расстройств при онкологических заболеваниях.
Цель исследования – изучение эффективности и переносимости/безопасности Вальдоксана (агомелатина) в терапии депрессивных расстройств у онкологических больных с заболеваниями органов женской репродуктивной системы (злокачественные новообразования молочной железы, матки, яичников).
Материалы и методы
Открытое неконтролируемое исследование проводилось сотрудниками отделения соматогенной психической патологии (заведующий – д-р мед. наук С.В.Иванов) отдела по изучению пограничной психической патологии и психосоматических расстройств (руководитель – академик РАМН, профессор А.Б.Смулевич) НЦПЗ РАМН (директор – академик РАМН, профессор А.С.Тиганов). Выборка исследования формировалась из пациентов отделения гинекологии (заведующий – д-р мед. наук, профессор В.В.Кузнецов) и отделения химиотерапии (заведующий – член-корреспондент РАН, профессор М.Р.Личиницер) РОНЦ им. Н.Н.Блохина РАМН (директор – академик РАН и РАМН М.И.Давыдов).
Выборка исследования формировалась из пациентов отделения гинекологии (заведующий – д-р мед. наук, профессор В.В.Кузнецов) и отделения химиотерапии (заведующий – член-корреспондент РАН, профессор М.Р.Личиницер) РОНЦ им. Н.Н.Блохина РАМН (директор – академик РАН и РАМН М.И.Давыдов).
В исследование включались пациенты с верифицированным диагнозом онкологического заболевания органов женской репродуктивной системы, госпитализированных в РОНЦ им. Н.Н.Блохина, состояние которых соответствовало критериям депрессивного эпизода (МКБ-10), единичного или рекуррентного легкой, средней или тяжелой (без психотических симптомов) степени (F32.0, F32.1, F32.2, F33.0, F33.1, F33.2).
В исследование не включались больные с коморбидными депрессивному эпизоду расстройствами галлюцинаторно-бредового регистра, хроническим алкоголизмом, наркоманиями, органическими заболеваниями центральной нервной системы, а также больные с биполярным аффективным расстройством (F31), общим тяжелым соматическим состоянием в фазе декомпенсации, пациенты с непереносимостью (включая аллергические реакции) и/или неэффективностью Вальдоксана в анамнезе.
Для оценки состояния эффективности использовались следующие инструменты: шкала депрессии Монтгомери–Асберг (MADRS), госпитальная шкала тревоги и депрессии (HADS); шкала общего клинического впечатления (CGI) для оценки тяжести заболевания (CGI-S) и улучшения (CGI-I).
В целях оценки безопасности регистрировались жалобы пациентов на неблагоприятные изменения в самочувствии и изменения показателей физикального обследования, лабораторных и инструментальных методов исследования: частота сердечных сокращений, систолическое и диастолическое артериальное давление, ортостатическая проба (недели 0, 1, 2, 4, 6, 8) и другие исследования, которые назначались в соответствии со стандартами ведения пациентов, принятых в отделениях РОНЦ. Дополнительно предусматривалась оценка вероятных лекарственных взаимодействий между Вальдоксаном и средствами лечения онкологической патологии (признаки повышения токсических эффектов/ редукции терапевтического эффекта на фоне терапии Вальдоксаном).
При статистической обработке полученных данных использовались лицензионные комплекты программ Statistica 6.0 (Statsoft Inc, США), SPSS 18.0 и Microsoft Excel for Windows Russian. Применялись двусторонний
t-критерий Стьюдента (использовать этот критерий позволяют небольшие величины коэффициентов асимметрии и эксцентриситета), корреляционный анализ Spearman (достоверным считался уровень значимости p<0,05). Для уточнения некоторых показателей применялись методики описательной статистики.
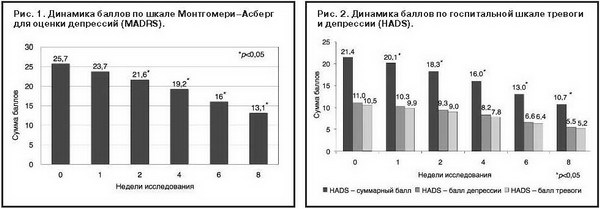 Схема терапии
Схема терапии
В рамках исследования Вальдоксан назначался курсами длительностью 56 дней (8 нед) в форме 1-кратного суточного приема (перед сном) в стартовой дозе 25 мг/сут. При отсутствии удовлетворительного эффекта в течение первых 2 нед терапии в соответствии с оценкой исследователя допускалось повышение дозы до 50 мг в сутки (2 таблетки одновременно перед сном), начиная с 15-го дня терапии. В случаях стойких инсомнических расстройств допускалось дополнительное назначение гипнотиков (кроме алпразолама) с длительностью ежедневного приема не более 7 дней.
Выборка исследования
В исследование включено 30 больных (средний возраст 45,33±8,57 года) с верифицированными злокачественными опухолями органов женской репродуктивной системы (средний интервал после выявления опухоли 3,2±1,97 года), состояние которых определялось депрессивным эпизодом, единичным (n=24) или рекуррентным (n=6). В 5 (16,7%) наблюдениях квалифицирован тяжелый непсихотический, в 17 (56,7%) – умеренный и в 8 (26,6%) – легкий депрессивный эпизод (МКБ-10). Методы лечения злокачественных новообразований включали хирургическое вмешательство на пораженных органах, химиотерапию и лучевую терапию; в ряде случаев использовались различные сочетания указанных методов (см. таблицу).
Пациенты проходили стационарное лечение в отделениях РОНЦ РАМН им. Н.А.Блохина в период с января по апрель 2011 г. Все больные подписали информированное согласие на участие в данном исследовании.
Результаты
У большинства (24 из 30) пациентов квалифицирована нозогенная тревожная депрессия, протекающая по типу депрессивного эпизода. На первый план в клинической картине депрессивных расстройств выступают явления стойкой гипотимии, представленные непреходящим чувством подавленности, чрезмерно пессимистической оценкой перспектив лечения, несмотря на относительно благоприятный клинический прогноз.
Динамика аффективной патологии обнаруживает тесную связь с нозогенными факторами – манифестация вслед за сообщением о диагнозе онкологического заболевания, эпизоды тоскливого настроения или дисфории в связи с негативной информацией о болезни.
В 6 наблюдениях диагностировано рекуррентное депрессивное расстройство в связи с выявленными отчетливыми депрессивными эпизодами в анамнезе (2–3 эпизода). В этих случаях речь идет о нозогенно провоцированной эндогенной депрессии, развивающейся по механизмам эндореактивной дистимии. Обнаруживая сходство с описанными выше нозогенными депрессиями на начальных этапах (манифестация в связи с сообщением о диагнозе онкологического заболевания, формирование отчетливого психогенного комплекса, сопряженного с обстоятельствами онкологической патологии), в дальнейшем (по истечении 2–3 мес) рассматриваемые депрессивные состояния постепенно видоизменяются. Отмечается расширение симптомов гипотимии за счет присоединения признаков эндогенного расстройства, включая отчетливые суточные колебания состояния с утяжелением аффективной симптоматики в первой половине, явления апатии, умеренно выраженную психомоторную заторможенность, стойкое снижение аппетита, отрывочные идеи самообвинения и мысли о смерти как избавлении от страдания (без значимых суицидальных тенденций).
 Сопутствующая гипотимии тревожная симптоматика представлена явлениями генерализованной тревоги с непреходящим ощущением напряжения, нервозности, а также танатофобией, опасениями беспомощности, утяжеления клиники заболевания и развития осложнений. В статусе пациентов выявляется выраженная лабильность эмоционального фона с отчетливыми
Сопутствующая гипотимии тревожная симптоматика представлена явлениями генерализованной тревоги с непреходящим ощущением напряжения, нервозности, а также танатофобией, опасениями беспомощности, утяжеления клиники заболевания и развития осложнений. В статусе пациентов выявляется выраженная лабильность эмоционального фона с отчетливыми
обострениями депрессивной и тревожной симптоматики в связи с любыми предстоящими лечебными (операция, химиотерапия и пр.) и диагностическими обследованиями (по типу «невроза ожидания» [3]).
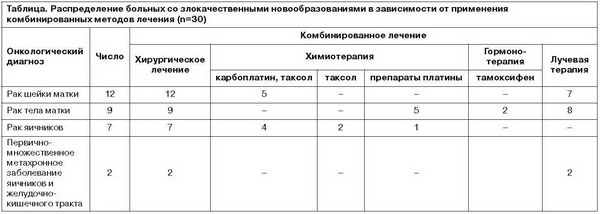
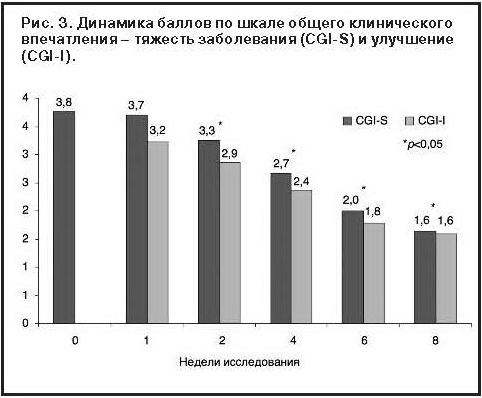
Результаты терапии в формализованной оценке по шкалам депрессии Монтгомери–Асберг, шкале общего клинического впечатления и госпитальной шкале тревоги и депрессии представлены в таблице и графически на рис. 1–3.
Достоверное клиническое улучшение, коррелирующее со снижением суммы баллов как по шкале Монтгомери–Асберг (см. рис. 1), так и по госпитальной шкале тревоги и депрессии (см. рис. 2), отмечалось уже спустя неделю от начала приема Вальдоксана (при сравнении по времени стартового и первого визитов, p<0,05) и продолжалось на протяжении всех 8 нед терапии (также статистически значимо). По завершении 8 нед терапии 19 из 30 (63,3%) пациентов соответствовали критериям респондеров (снижение стартового суммарного балла MADRS на 50% и более).
Ремиссии (суммарный балл MADRS<12) удалось достичь у 12 из 30 (40%) пациентов. Соответственно, 7 пациентов из числа респондеров не достигли ремиссии в течение предусмотренных протоколом 8 нед терапии. При анализе психопатологических особенностей этих пациентов обнаружено, что они отличались более высокими исходными суммарными баллами по госпитальной шкале тревоги и депрессии (4 относились к «тяжелому» уровню и 3 – к «среднему», но со значительным вкладом тревожной симптоматики, что является фактором риска неполной ремиссии при антидепрессивной терапии [13, 29]). Можно предположить, что и в этих случаях вероятность ремиссии остается высокой при условии более длительного применения Вальдоксана. Как видно из рис. 2, редукция депрессивной и тревожной симптоматики (отдельно эти показатели позволяет оценить анализ подшкал госпитальной шкалы тревоги и депрессии) происходила параллельно – расщепления синдрома при лечении Вальдоксаном не происходит, что согласуется с результатами наблюдательного многоцентрового исследования РИТМ [7], посвященного изучению терапии непсихотических депрессий Вальдоксаном.
Из рис. 3 видно улучшение клинического состояния пациентов, получающих Вальдоксан: баллы по шкале общего клинического впечатления о тяжести и динамике заболевания статистически достоверно (p<0,05) снижаются, начиная со второго визита. Повышение стартовой дозы 25 мг/сут до 50 мг/сут в связи с неудовлетворительным терапевтическим эффектом через 2 нед лечения потребовалось 8 пациентам.
В 8 случаях лечение было прекращено досрочно. У 2 пациентов отмечалось отсутствие эффекта к концу 4-й недели терапии (снижение баллов по шкале депрессии Монтгомери–Асберг менее чем на 25%). У 3 из 30 (10%) развились нежелательные явления (головная боль), ставшие причиной досрочного выбывания из исследования. Еще с 3 больными был утерян контакт. Выраженного утяжеления депрессии, ведущего к досрочному прекращению терапии, в изученной выборке не зафиксировано.
Препарат Вальдоксан отличается хорошей переносимостью: помимо упомянутых трех случаев головной боли, приведших к досрочному прекращению участия в исследовании, нежелательные явления дополнительно зарегистрированы только у 3 пациентов (во всех случаях необходимости в прекращении приема Вальдоксана не возникало): у 2 (6,7%) пациентов отмечались жалобы на головокружение (редуцировавшиеся без лечения) и у 1 (3,33%) больного отмечалось транзиторное усиление тревоги, потребовавшее назначения бензодиазепинов короткого действия (лоразепам) в низких дозах с продолжительностью ежедневного приема не более 7 дней.
Лекарственные взаимодействия
Клинически значимых признаков неблагоприятных лекарственных взаимодействий Вальдоксана с препаратами химиотерапии и другими лекарственными средствами, использовавшимися в лечении пациентов изученной выборки, не зафиксировано. Этот факт связан с особенностями фармакокинетики Вальдоксана и основных групп противоопухолевых препаратов, используемых при комбинированном лечении злокачественных новообразований у пациентов изучаемой выборки.
Метаболизм таксанов (таксол) – противоопухолевых препаратов растительного происхождения, антиэстрогенов (тамоксифен) и алкилирующих агентов (препараты платины) связан преимущественно с биотрансформацией при участии изоферментов CYP2C8 и CYP3A4 [6, 9]. Вальдоксан не угнетает биотрансформацию обозначенных выше лекарственных средств из-за отсутствия влияния на активность этих изоферментов печени, поскольку 90% действующего вещества препарата метаболизируется в печени при участии изоферментов CYP1А2 и 10% – при участии CYP2C9/19 [27], что доказывает безопасность применения антидепрессанта совместно с основными классами противоопухолевых препаратов, применяемых при лечении опухолей женской репродуктивной системы.
Заключение
Вальдоксан (агомелатин) является эффективным антидепрессантом в терапии тревожно-депрессивных расстройств у пациентов со злокачественными новообразованиями. Учитывая высокую распространенность депрессивных расстройств среди онкологических пациентов, рекомендовано применение Вальдоксана как эффективного средства психофармакотерапии в амбулаторной и госпитальной системе специализированной помощи пациентам с онкологическими заболеваниями. Важным преимуществом Вальдоксана является благоприятный профиль переносимости. При этом следует учитывать условия хронического стресса с непреходящим влиянием нозогенных (а также, по-видимому, и соматогенных) факторов, сопряженных с онкологической патологией, что не позволяет ожидать полного развертывания эффекта Вальдоксана у всех пациентов в пределах, установленных исследованием 8 нед терапии, и определяет целесообразность более длительного применения этого антидепрессанта при неполной редукции депрессивной симптоматики в указанные сроки.
Сведения об авторах
Самушия Марина Антиповна – доц. каф. психиатрии и психосоматики ФППОВ ГБОУ ВПО Первый МГМУ
им. И.М.Сеченова Минздрава РФ
Мясникова Любовь Константиновна – ст. науч. сотр. отд-ния соматогенной патологии отд. по изучению пограничной психической патологии и психосоматических расстройств НЦПЗ РАМН
Ключевые слова: депрессия, Вальдоксан, рак молочной железы, рак органов женской репродуктивной системы.
Valdoxan (agomelatine) in anti-depressive therapy of the patients with malignancies of female reproductive system
M.A.Samushia1, L.K.Myasnikova2
1Sechenov First Moscow State Medical University
2Mental Health Research Center of the Russian Academy of Medical Sciences
Summary. The anti-depressive effectiveness and tolerability of Valdoxan (25–50 mg/day) have been studied in 30 patients with breast and gynecological cancer suffering from depressive episode (ICD-10: mild – 26,6%, moderate – 56,7% or severe non-psychotic without suicide tendencies – 16,7%). The results show a high level of Valdoxan effectiveness: 63,% of patients were responders (reduction of baseline MADRS total score ≥50%), 40% were remitters (MADRS total score <12). Valdoxan has provided early improvement with statistically significant changes of MADRS baseline scores after two weeks of treatment. Valdoxan demonstrated a good profile of tolerability and safety with only 3 from 30 patients discontinued from the study due to adverse events (headache) and no signs of drug interaction with chemotherapy and other medications. Valdoxan is effective and safe in treatment of depressions in cancer patients.
Key words: depression, Valdoxan, breast cancer, gynecological cancer.
Введение
Потребность в психофармакотерапии выявляется в среднем у 50–90% онкологических больных [8, 15]. Этот факт объясняется высокой распространенностью психической патологии, преимущественно тревожно-депрессивных расстройств, которые диагностируются у 60–80% больных, страдающих злокачественными новообразованиями [16, 28]. Актуальность эффективной терапии депрессии также определяется негативными последствиями депрессивных расстройств у пациентов, страдающих злокачественными новообразованиями, включая повышенный суицидальный риск, снижение качества жизни, сокращение сроков выживаемости, неудовлетворительную комплаентность терапии онкологических заболеваний и увеличение длительности пребывания в онкологическом стационаре [12, 19–21, 23]. Вальдоксан (агомелатин) является новейшим антидепрессантом с инновационным фармакологическим профилем. Вальдоксан действует как агонист мелатонинергических MT1- и MT2-рецепторов и антагонист серотонинергических 5HT2С-рецепторов, не обнаруживает значимого аффинитета к другим центральным рецепторам или переносчикам моноаминов и не влияет на внеклеточные уровни серотонина [10, 18, 24].
 В завершенных на сегодня исследованиях показана высокая антидепрессивная эффективность Вальдоксана в дозах 25–50 мг/сут при непсихотических депрессивных эпизодах легкой, умеренной и тяжелой степени [25]. Установлено, что по уровню стойкости и выраженности антидепрессивного эффекта Вальдоксан достоверно превосходит плацебо, а также сопоставим или превосходит по выраженности и срокам реализации тимоаналептического действия другие современные антидепрессанты, включая селективные ингибиторы обратного захвата серотонина – пароксетин, флуоксетин, эсциталопрам и сертралин, и ингибитор обратного захвата серотонина и норадреналина венлафаксин [11, 17]. В то же время благодаря уникальному фармакологическому профилю Вальдоксан не вызывает значимых побочных эффектов и значительно превосходит по переносимости и безо-пасности большинство современных антидепрессантов [15]. Благоприятный профиль переносимости Вальдоксана подтвержден в масштабных натуралистических исследованиях с участием пациентов с депрессиями, страдающих сопутствующими соматическими заболеваниями [4, 17, 22, 26], а также в специальном исследовании у больных с сердечно-сосудистыми заболеваниями [5] и в постинсультном периоде [1, 2]. Такое сочетание эффективности и безопасности определяет целесообразность изучения Вальдоксана как средства терапии депрессивных расстройств при онкологических заболеваниях.
В завершенных на сегодня исследованиях показана высокая антидепрессивная эффективность Вальдоксана в дозах 25–50 мг/сут при непсихотических депрессивных эпизодах легкой, умеренной и тяжелой степени [25]. Установлено, что по уровню стойкости и выраженности антидепрессивного эффекта Вальдоксан достоверно превосходит плацебо, а также сопоставим или превосходит по выраженности и срокам реализации тимоаналептического действия другие современные антидепрессанты, включая селективные ингибиторы обратного захвата серотонина – пароксетин, флуоксетин, эсциталопрам и сертралин, и ингибитор обратного захвата серотонина и норадреналина венлафаксин [11, 17]. В то же время благодаря уникальному фармакологическому профилю Вальдоксан не вызывает значимых побочных эффектов и значительно превосходит по переносимости и безо-пасности большинство современных антидепрессантов [15]. Благоприятный профиль переносимости Вальдоксана подтвержден в масштабных натуралистических исследованиях с участием пациентов с депрессиями, страдающих сопутствующими соматическими заболеваниями [4, 17, 22, 26], а также в специальном исследовании у больных с сердечно-сосудистыми заболеваниями [5] и в постинсультном периоде [1, 2]. Такое сочетание эффективности и безопасности определяет целесообразность изучения Вальдоксана как средства терапии депрессивных расстройств при онкологических заболеваниях.
Цель исследования – изучение эффективности и переносимости/безопасности Вальдоксана (агомелатина) в терапии депрессивных расстройств у онкологических больных с заболеваниями органов женской репродуктивной системы (злокачественные новообразования молочной железы, матки, яичников).
Материалы и методы
Открытое неконтролируемое исследование проводилось сотрудниками отделения соматогенной психической патологии (заведующий – д-р мед. наук С.В.Иванов) отдела по изучению пограничной психической патологии и психосоматических расстройств (руководитель – академик РАМН, профессор А.Б.Смулевич) НЦПЗ РАМН (директор – академик РАМН, профессор А.С.Тиганов).
 Выборка исследования формировалась из пациентов отделения гинекологии (заведующий – д-р мед. наук, профессор В.В.Кузнецов) и отделения химиотерапии (заведующий – член-корреспондент РАН, профессор М.Р.Личиницер) РОНЦ им. Н.Н.Блохина РАМН (директор – академик РАН и РАМН М.И.Давыдов).
Выборка исследования формировалась из пациентов отделения гинекологии (заведующий – д-р мед. наук, профессор В.В.Кузнецов) и отделения химиотерапии (заведующий – член-корреспондент РАН, профессор М.Р.Личиницер) РОНЦ им. Н.Н.Блохина РАМН (директор – академик РАН и РАМН М.И.Давыдов).
В исследование включались пациенты с верифицированным диагнозом онкологического заболевания органов женской репродуктивной системы, госпитализированных в РОНЦ им. Н.Н.Блохина, состояние которых соответствовало критериям депрессивного эпизода (МКБ-10), единичного или рекуррентного легкой, средней или тяжелой (без психотических симптомов) степени (F32.0, F32.1, F32.2, F33.0, F33.1, F33.2).
В исследование не включались больные с коморбидными депрессивному эпизоду расстройствами галлюцинаторно-бредового регистра, хроническим алкоголизмом, наркоманиями, органическими заболеваниями центральной нервной системы, а также больные с биполярным аффективным расстройством (F31), общим тяжелым соматическим состоянием в фазе декомпенсации, пациенты с непереносимостью (включая аллергические реакции) и/или неэффективностью Вальдоксана в анамнезе.
Для оценки состояния эффективности использовались следующие инструменты: шкала депрессии Монтгомери–Асберг (MADRS), госпитальная шкала тревоги и депрессии (HADS); шкала общего клинического впечатления (CGI) для оценки тяжести заболевания (CGI-S) и улучшения (CGI-I).
В целях оценки безопасности регистрировались жалобы пациентов на неблагоприятные изменения в самочувствии и изменения показателей физикального обследования, лабораторных и инструментальных методов исследования: частота сердечных сокращений, систолическое и диастолическое артериальное давление, ортостатическая проба (недели 0, 1, 2, 4, 6, 8) и другие исследования, которые назначались в соответствии со стандартами ведения пациентов, принятых в отделениях РОНЦ. Дополнительно предусматривалась оценка вероятных лекарственных взаимодействий между Вальдоксаном и средствами лечения онкологической патологии (признаки повышения токсических эффектов/ редукции терапевтического эффекта на фоне терапии Вальдоксаном).
При статистической обработке полученных данных использовались лицензионные комплекты программ Statistica 6.0 (Statsoft Inc, США), SPSS 18.0 и Microsoft Excel for Windows Russian. Применялись двусторонний
t-критерий Стьюдента (использовать этот критерий позволяют небольшие величины коэффициентов асимметрии и эксцентриситета), корреляционный анализ Spearman (достоверным считался уровень значимости p<0,05). Для уточнения некоторых показателей применялись методики описательной статистики.
 Схема терапии
Схема терапии
В рамках исследования Вальдоксан назначался курсами длительностью 56 дней (8 нед) в форме 1-кратного суточного приема (перед сном) в стартовой дозе 25 мг/сут. При отсутствии удовлетворительного эффекта в течение первых 2 нед терапии в соответствии с оценкой исследователя допускалось повышение дозы до 50 мг в сутки (2 таблетки одновременно перед сном), начиная с 15-го дня терапии. В случаях стойких инсомнических расстройств допускалось дополнительное назначение гипнотиков (кроме алпразолама) с длительностью ежедневного приема не более 7 дней.
Выборка исследования
В исследование включено 30 больных (средний возраст 45,33±8,57 года) с верифицированными злокачественными опухолями органов женской репродуктивной системы (средний интервал после выявления опухоли 3,2±1,97 года), состояние которых определялось депрессивным эпизодом, единичным (n=24) или рекуррентным (n=6). В 5 (16,7%) наблюдениях квалифицирован тяжелый непсихотический, в 17 (56,7%) – умеренный и в 8 (26,6%) – легкий депрессивный эпизод (МКБ-10). Методы лечения злокачественных новообразований включали хирургическое вмешательство на пораженных органах, химиотерапию и лучевую терапию; в ряде случаев использовались различные сочетания указанных методов (см. таблицу).
Пациенты проходили стационарное лечение в отделениях РОНЦ РАМН им. Н.А.Блохина в период с января по апрель 2011 г. Все больные подписали информированное согласие на участие в данном исследовании.
Результаты
У большинства (24 из 30) пациентов квалифицирована нозогенная тревожная депрессия, протекающая по типу депрессивного эпизода. На первый план в клинической картине депрессивных расстройств выступают явления стойкой гипотимии, представленные непреходящим чувством подавленности, чрезмерно пессимистической оценкой перспектив лечения, несмотря на относительно благоприятный клинический прогноз.
Динамика аффективной патологии обнаруживает тесную связь с нозогенными факторами – манифестация вслед за сообщением о диагнозе онкологического заболевания, эпизоды тоскливого настроения или дисфории в связи с негативной информацией о болезни.
В 6 наблюдениях диагностировано рекуррентное депрессивное расстройство в связи с выявленными отчетливыми депрессивными эпизодами в анамнезе (2–3 эпизода). В этих случаях речь идет о нозогенно провоцированной эндогенной депрессии, развивающейся по механизмам эндореактивной дистимии. Обнаруживая сходство с описанными выше нозогенными депрессиями на начальных этапах (манифестация в связи с сообщением о диагнозе онкологического заболевания, формирование отчетливого психогенного комплекса, сопряженного с обстоятельствами онкологической патологии), в дальнейшем (по истечении 2–3 мес) рассматриваемые депрессивные состояния постепенно видоизменяются. Отмечается расширение симптомов гипотимии за счет присоединения признаков эндогенного расстройства, включая отчетливые суточные колебания состояния с утяжелением аффективной симптоматики в первой половине, явления апатии, умеренно выраженную психомоторную заторможенность, стойкое снижение аппетита, отрывочные идеи самообвинения и мысли о смерти как избавлении от страдания (без значимых суицидальных тенденций).
 Сопутствующая гипотимии тревожная симптоматика представлена явлениями генерализованной тревоги с непреходящим ощущением напряжения, нервозности, а также танатофобией, опасениями беспомощности, утяжеления клиники заболевания и развития осложнений. В статусе пациентов выявляется выраженная лабильность эмоционального фона с отчетливыми
Сопутствующая гипотимии тревожная симптоматика представлена явлениями генерализованной тревоги с непреходящим ощущением напряжения, нервозности, а также танатофобией, опасениями беспомощности, утяжеления клиники заболевания и развития осложнений. В статусе пациентов выявляется выраженная лабильность эмоционального фона с отчетливыми
обострениями депрессивной и тревожной симптоматики в связи с любыми предстоящими лечебными (операция, химиотерапия и пр.) и диагностическими обследованиями (по типу «невроза ожидания» [3]).
Результаты терапии в формализованной оценке по шкалам депрессии Монтгомери–Асберг, шкале общего клинического впечатления и госпитальной шкале тревоги и депрессии представлены в таблице и графически на рис. 1–3.
Достоверное клиническое улучшение, коррелирующее со снижением суммы баллов как по шкале Монтгомери–Асберг (см. рис. 1), так и по госпитальной шкале тревоги и депрессии (см. рис. 2), отмечалось уже спустя неделю от начала приема Вальдоксана (при сравнении по времени стартового и первого визитов, p<0,05) и продолжалось на протяжении всех 8 нед терапии (также статистически значимо). По завершении 8 нед терапии 19 из 30 (63,3%) пациентов соответствовали критериям респондеров (снижение стартового суммарного балла MADRS на 50% и более).
Ремиссии (суммарный балл MADRS<12) удалось достичь у 12 из 30 (40%) пациентов. Соответственно, 7 пациентов из числа респондеров не достигли ремиссии в течение предусмотренных протоколом 8 нед терапии. При анализе психопатологических особенностей этих пациентов обнаружено, что они отличались более высокими исходными суммарными баллами по госпитальной шкале тревоги и депрессии (4 относились к «тяжелому» уровню и 3 – к «среднему», но со значительным вкладом тревожной симптоматики, что является фактором риска неполной ремиссии при антидепрессивной терапии [13, 29]). Можно предположить, что и в этих случаях вероятность ремиссии остается высокой при условии более длительного применения Вальдоксана. Как видно из рис. 2, редукция депрессивной и тревожной симптоматики (отдельно эти показатели позволяет оценить анализ подшкал госпитальной шкалы тревоги и депрессии) происходила параллельно – расщепления синдрома при лечении Вальдоксаном не происходит, что согласуется с результатами наблюдательного многоцентрового исследования РИТМ [7], посвященного изучению терапии непсихотических депрессий Вальдоксаном.
Из рис. 3 видно улучшение клинического состояния пациентов, получающих Вальдоксан: баллы по шкале общего клинического впечатления о тяжести и динамике заболевания статистически достоверно (p<0,05) снижаются, начиная со второго визита. Повышение стартовой дозы 25 мг/сут до 50 мг/сут в связи с неудовлетворительным терапевтическим эффектом через 2 нед лечения потребовалось 8 пациентам.
В 8 случаях лечение было прекращено досрочно. У 2 пациентов отмечалось отсутствие эффекта к концу 4-й недели терапии (снижение баллов по шкале депрессии Монтгомери–Асберг менее чем на 25%). У 3 из 30 (10%) развились нежелательные явления (головная боль), ставшие причиной досрочного выбывания из исследования. Еще с 3 больными был утерян контакт. Выраженного утяжеления депрессии, ведущего к досрочному прекращению терапии, в изученной выборке не зафиксировано.
Препарат Вальдоксан отличается хорошей переносимостью: помимо упомянутых трех случаев головной боли, приведших к досрочному прекращению участия в исследовании, нежелательные явления дополнительно зарегистрированы только у 3 пациентов (во всех случаях необходимости в прекращении приема Вальдоксана не возникало): у 2 (6,7%) пациентов отмечались жалобы на головокружение (редуцировавшиеся без лечения) и у 1 (3,33%) больного отмечалось транзиторное усиление тревоги, потребовавшее назначения бензодиазепинов короткого действия (лоразепам) в низких дозах с продолжительностью ежедневного приема не более 7 дней.
Лекарственные взаимодействия
Клинически значимых признаков неблагоприятных лекарственных взаимодействий Вальдоксана с препаратами химиотерапии и другими лекарственными средствами, использовавшимися в лечении пациентов изученной выборки, не зафиксировано. Этот факт связан с особенностями фармакокинетики Вальдоксана и основных групп противоопухолевых препаратов, используемых при комбинированном лечении злокачественных новообразований у пациентов изучаемой выборки.
Метаболизм таксанов (таксол) – противоопухолевых препаратов растительного происхождения, антиэстрогенов (тамоксифен) и алкилирующих агентов (препараты платины) связан преимущественно с биотрансформацией при участии изоферментов CYP2C8 и CYP3A4 [6, 9]. Вальдоксан не угнетает биотрансформацию обозначенных выше лекарственных средств из-за отсутствия влияния на активность этих изоферментов печени, поскольку 90% действующего вещества препарата метаболизируется в печени при участии изоферментов CYP1А2 и 10% – при участии CYP2C9/19 [27], что доказывает безопасность применения антидепрессанта совместно с основными классами противоопухолевых препаратов, применяемых при лечении опухолей женской репродуктивной системы.
Заключение
Вальдоксан (агомелатин) является эффективным антидепрессантом в терапии тревожно-депрессивных расстройств у пациентов со злокачественными новообразованиями. Учитывая высокую распространенность депрессивных расстройств среди онкологических пациентов, рекомендовано применение Вальдоксана как эффективного средства психофармакотерапии в амбулаторной и госпитальной системе специализированной помощи пациентам с онкологическими заболеваниями. Важным преимуществом Вальдоксана является благоприятный профиль переносимости. При этом следует учитывать условия хронического стресса с непреходящим влиянием нозогенных (а также, по-видимому, и соматогенных) факторов, сопряженных с онкологической патологией, что не позволяет ожидать полного развертывания эффекта Вальдоксана у всех пациентов в пределах, установленных исследованием 8 нед терапии, и определяет целесообразность более длительного применения этого антидепрессанта при неполной редукции депрессивной симптоматики в указанные сроки.
Сведения об авторах
Самушия Марина Антиповна – доц. каф. психиатрии и психосоматики ФППОВ ГБОУ ВПО Первый МГМУ
им. И.М.Сеченова Минздрава РФ
Мясникова Любовь Константиновна – ст. науч. сотр. отд-ния соматогенной патологии отд. по изучению пограничной психической патологии и психосоматических расстройств НЦПЗ РАМН
Список исп. литературыСкрыть список1. Артемов А.Н., Василенко И.В., Триф Ю.В., Маркина В.А. Опыт применения Вальдоксана при лечении тревожно-депрессивных расстройств у постинсультных больных в раннем восстановительном периоде. Психич. расстройства в общей медицине. 2011; 1: 42–5.
2. Боголепова А.Н., Чуканова Е.И., Смирнова М.Ю. и др. Опыт применения Вальдоксана в терапии постинсультной депрессии. Журн. неврол. и психиатр. им. С.С.Корсакова. 2011; 111 (4): 42–6.
3. Иванов С.В. Соматоформные расстройства (органные неврозы): эпидемиология, коморбидные психосоматические соотношения, терапия. Автореф. дис. … д-ра мед. наук. М., 2002.
4. Иванов С.В. Вальдоксан (агомелатин) при терапии умеренных и тяжелых депрессий непсихотического уровня в амбулаторной и госпитальной практике (результаты российского многоцентрового исследования ХРОНОС). Психиатр. и психофармакотер. 2009; 6: 14–7.
5. Медведев В.Э. Перспективы использования мелатонинергических препаратов в терапии депрессий у пациентов с сердечно-сосудистыми заболеваниями. Психиатр. и психофармакотер. 2010; 3.
6. Переводчикова Н.И. Химиотерапия опухолевых заболеваний. М., 2000.
7. Смулевич А.Б., Андрющенко А.В., Бескова Д.А. Терапия непсихотических депрессий антидепрессантом агомелатином (Вальдоксан): результаты наблюдательного многоцентрового исследования РИТМ. Психиатр. и психофармакотер. 2010; 4: 4–11.
8. Смулевич А.Б., Андрющенко А.В., Бескова Д.А. Психические расстройства в онкологии (результаты многоцентровой программы СИНТЕЗ). Психич. расстройства в общей медицине. 2009; 1: 4–11.
9. Справочник Видаль. Лекарственные препараты в России. М.: АстраФармСервис, 2006.
10. Audinot V, Mailliet F, Lahaye-Brasseur C et al. New selective ligands of human cloned melatonin MT1- and MT2-receptors. Naunyn Schmiedebergs Arch Pharmacol 2003; 367: 553–61.
11. Corruble E, Belaidi C, Goodwin GM. Agomelatine versus escitalopram in major depressive disorders : a randomized double-blind, long term study focusing on sleep satisfaction and emotional blunting. Eur Psychiat 2011; 26: 2–24.
12. Endicott J. Measurement of depression in patients with cancer. Cancer 1984; 53: 2243–8.
13. Fava M, Rush AJ, Alpert JE et al. Difference in treatment outcome in outpatients with anxious vs nonaxious depression: a STAR*D report. Am J Psychiat 2008; 165: 342–51.
14. Gil Nuno P, Albuquerque E, Vilao O. Use of psychotropic drugs in palliative cancer care: a retrospective study. Abstracts of the 8th world congress of psycho-oncology 2006; 15 (2): 154.
15. Goodwin GM, Rouillon F, Emsley R. Long-term treatment with agomelatine: prevention of relapse in patients with major depressive disorder over 10 months [abstr.]. In: 21st European College of Neuropsychopharmacology Congress. Barcelona, Spain. Eur Neuropsychopharmacol 2008; 18: s338–9.
16. Grassi L, Sabato S, Rossi E et al. Depressive and anxiety disorders among cancer patients: screening methods by using the distress thermometer compared to the ICD-10. Abstracts of the 8th world congress of psycho-oncology 2006; 15 (2): s169.
17. Kennedy SH. Agomelatine. Efficacy at each phase of antidepressant treatment. CNS Drugs 2009; 23 (Suppl. 2): 41–7.
18. Lader M. Pharmacotherapy of mood disorders and treatment discontinuation. Drugs 2007; 67: 1657–63.
19. Lloyd-Williams M, Shiels C, Taylor F, Dennis M. Depression – an independent predictor of early death in patients with advanced cancer. J Affect Disord 2009; 113: 127–32.
20. Lloyd-Williams M, Dennis M, Taylor F. A prospective study to determine the association between physical symptoms and depression in patients with advanced cancer. Palliative Med 2004; 18: 558–63.
21. Lloyd-Williams M. Difficulties in diagnosing and treating depression in the terminally ill cancer patient. Postgrad Med J 2000; 76: 555–8.
22. Loo H, Hale A, D\'haenen H. Determination of the dose of agomelatine, a melatoninergic agonist and selective 5HT(2C) antagonist, in the treatment of major depressive disorder: a placebo-controlled dose range study. Int Clin Psychopharmacol 2002; 17: 239–47.
23. Maguire P. Barriers to psychological care of the dying. BMJ 1985; 291: 1711–3.
24. Millan MJ, Gobert A, Lejeune F et al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydro-xytryptamine 2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. J Pharmacol Exp Ther 2003; 306: 954–64.
25. Montgomery SA, Kasper S. Severe depression and antidepressants: focus on a pooled analysis of placebo-controlled studies on agomelatine. Int Clin Psychopharmacol 2007; 22: 283–91.
26. Goodwin GM, Rouillon F, Emsley R. Munich, Germany. Int J Neuropsychopharmacol 2008; 11 (Suppl. 1): 193. Long-term treatment with agomelatine: prevention of relapse in patients with major depressive disorder over 10 months [abstr.]. In: 21st European College of Neuropsychopharmacology Congress; Barcelona, Spain. Eur Neuropsychopharmacol 2008; 18: 338–9.
27. Owen RT. Agomelatine: a novel pharmacological approach to treating depression. Drugs Today (Barc) 2009; 45 (8): 599–608.
28. Pramod DS, Salgokar RN, Nirmalkumar AR, Vaishali PS. Psychological assessment in patients with oncopathology: need to break psychological barriers. Abstracts of the 8th world congress of psycho-oncology 2006; 15 (2): s145.
29. Thase ME. Pharmacotherapeutic treatment strategies for antidepressant nonresponse. J Clin Psychiat 2009; 70: 42.


