Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№03 2012
Применение Алпразолама в терапии тревожных расстройств №03 2012
Номера страниц в выпуске:38-43
В статье представлен обзор литературы по вопросу использования Алпразолама при лечении тревожных расстройств. Приводятся сведения о механизме действия, фармакологических свойствах препарата и особенностях его клинического применения. Отдельное внимание уделяется освещению вопросов безопасности, в том числе при курсовом применении, а также дифференцированным показаниям к его назначению, включая использование врачами общей практики.
Резюме. В статье представлен обзор литературы по вопросу использования Алпразолама при лечении тревожных расстройств. Приводятся сведения о механизме действия, фармакологических свойствах препарата и особенностях его клинического применения. Отдельное внимание уделяется освещению вопросов безопасности, в том числе при курсовом применении, а также дифференцированным показаниям к его назначению, включая использование врачами общей практики.
Ключевые слова: Алпразолам, тревожные расстройства, терапия.
Alprazolam in treatment of anxiety disorders: review
D.V.Yastrebov
V.P.Serbsky Social and Forensic Psychiatry Research Centre
Summary. The article introduces literature review covering Alprazolam use for treatment of anxiety disorders. The detailed description of the mode of action, pharmacological properties and clinical use patterns. Special attention has focused on long-term use safety and differentiated indications including the use in general practice.
Key words: Alprazolam, anxiety disorders, therapy.
Прогресс в понимании тревожных расстройств в последние годы сопровождается освоением целого ряда направлений – психологических, фармакологических, нейробиологических. Современные авторы отмечают, что клиническая практика находится «на рубеже»: ожидается появление лекарственных средств нового поколения, позволяющих разработать инновационные подходы к лечению тревоги. J.Nash и D.Nutt [28] указывают, что «основной массив клинических и фармакологических данных, накопленных к настоящему времени, может потерять актуальность в течение ближайших нескольких лет».
Однако оптимистичность этих прогнозов пока не оправдалась: терапия тревожных расстройств до сих пор опирается на алгоритмы, разработанные и проверенные клинически в течение десятилетий, прошедших со времени создания средств этого класса. Существенное место в арсенале таких средств, занявших прочное место не только в специализированной психиатрической, но и в общемедицинской практике, по-прежнему занимают бензодиазепиновые транквилизаторы.
Алпразолам – транквилизатор триазолобензодиазепиновой структуры, по своему строению относится к 1,4-триазолобензодиазепинам, структура которых отличается от классических 1,4-бензодиазепинов (например, диазепама) наличием триазольного кольца. В отличие от других транквилизаторов Алпразолам, появившийся в продаже с 1991 г., уверенно удерживает свои позиции, по-прежнему являясь самым назначаемым психофармакологическим препаратом.
Фармакокинетика Алпразолама
Исследования показали, что время достижения пиковой концентрации препарата (Tmax) составляет 1–2 ч, период полувыведения (T1/2) – 9–16 ч. После перорального приема примерно 90% препарата всасывается и связывается с белками плазмы. Равновесная концентрация препарата в крови наступает через 2–3 дня, вне зависимости от режима приема. Алпразолам метаболизируется печенью с участием изофермента CYP3A4. Необходимо учитывать, что совместное назначение Алпразолама с препаратами группы селективных ингибиторов обратного захвата серотонина (СИОЗС), ингибирующими CYP3A4, приводит к заметному (на 20–30%) замедлению его выведения. В наибольшей степени этим свойством обладает метаболит флуоксетина норфлуоксетин. Другие препараты, способные замедлять выведение Алпразолама при совместном назначении, – венлафаксин, флувоксамин, карбамазепин и оральные контрацептивы [7, 15, 17]. В процессе биотрансформации, происходящей в печени, Алпразолам преобразуется помимо прочих в два основных метаболита, обладающих значительно меньшей сравнительно с исходным препаратом фармакологической активностью. Трансформация в 4-гидроксиалпразолам составляет основную часть клиренса Алпразолама, остальное приходится на a-гидроксиалпразолам и другие метаболиты.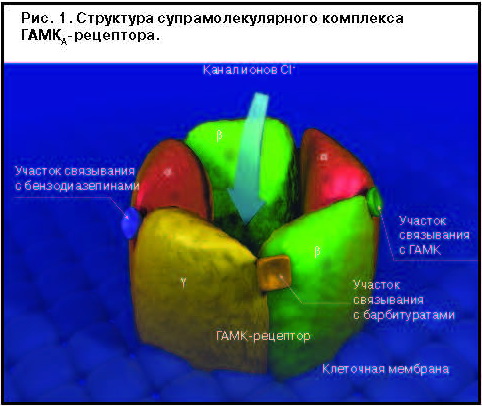 Их фармакологическая активность в сравнении с исходным соединением невелика, вследствие чего считается, что они не принимают участия в клинических эффектах Алпразолама. Метаболиты Алпразолама не склонны к кумуляции. От 25 до 75% исходной дозы препарата выводится в неизмененном виде почками и через кишечник [12, 18].
Их фармакологическая активность в сравнении с исходным соединением невелика, вследствие чего считается, что они не принимают участия в клинических эффектах Алпразолама. Метаболиты Алпразолама не склонны к кумуляции. От 25 до 75% исходной дозы препарата выводится в неизмененном виде почками и через кишечник [12, 18].
При назначении в виде монотерапии длительность клинического эффекта стандартной таблетированной формы составляет 6–11 ч, что обычно подразумевает необходимость 2-кратного приема [14, 27]. Более чем
2-кратное снижение концентрации препарата в междозовом интервале может приводить к снижению клинического эффекта, что проявляется в виде так называемой междозовой симптоматики (англ. interdose symptoms) или симптомов прорыва (англ. breakthrouh symptoms) и в числе прочего является одним из факторов, снижающих лекарственный комплаенс.
Выраженность нарастающих по мере падения концентрации препарата в крови симптомов тревоги ограничивается субклиническим уровнем. Тем не менее испытывающие их пациенты могут прибегнуть к самостоятельному сокращению временно́го интервала между последовательными приемами препарата. Этой проблемы обычно не возникает при комплексной терапии (комбинация транквилизаторов с антидепрессантами). Тимоаналептики, с одной стороны, замедляют метаболизм транквилизаторов, а с другой – оказывают отдельное терапевтическое воздействие на анксиозную симптоматику [8, 40].
Механизм действия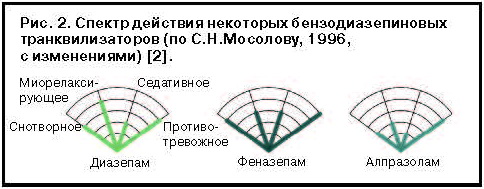
Основным механизмом действия Алпразолама является воздействие на процесс ГАМКергической передачи. Подобно другим бензодиазепинам, Алпразолам связывается с ГАМК-хлорным комплексом.
ГАМК-рецепторы типа А (ГАМКА/GABAA), ответственные за такие эффекты, как противотревожный, седативный, снотворный, миорелаксирующий и др., относятся к ионотропным рецепторам – межсинаптическая передача в них осуществляется посредством ионов Cl-, проходящих через соответствующий канал ГАМК-рецептора (хлорный канал). Этот канал открывается после активации рецептора нейромедиатором, который взаимодействует с рецептором через ГАМК-центр связывания.
Структурно ГАМКА-рецептор представляет собой супрамолекулярный комплекс, состоящий из пяти субъ-единиц, каждая из которых может быть отнесена к одному из типов: a, b, g и некоторым другим; обнаружено несколько вариантов каждого из этих типов, например a1, a2, a3, a4, a5, a6. Центр связывания с ГАМК расположен на стыке a- и b-субъединиц.
Кроме центра связывания с нейромедиатором, в ГАМК-рецепторе существует ряд структур, отвечающих за процесс модуляции, т.е. опосредованного воздействия на интенсивность нейротрансмиссии. Эти структуры получили название по имени класса препаратов, которые, взаимодействуя с ними, оказывают модулирующее действие: участок связывания с бензодиазепинами [прежние названия: w(омега)-рецепторы, или бензодиазепиновые рецепторы]. Предполагается, что в организме существует ряд соединений полипептидной структуры (так называемых эндозепинов), способных связываться с этими центрами. Аналогичным образом в комплексе ГАМК-рецептора существует центр связывания с барбитуратами, локализованный на g-субъединице. Модулирующее действие ГАМКергических препаратов заключается в том, что в результате их связывания с ГАМК-рецептором возрастает поток ионов хлора, проходящих через рецептор. Это достигается повышением частоты циклов «открытия–закрытия» хлорного канала в случае бензодиазепинов или увеличением времени его открытия в случае барбитуратов. Такое различие в механизме действия 2 групп препаратов обусловливает возможность потенцирования эффекта при совместном приеме.
В зависимости от варианта входящей в состав ГАМК-рецептора a-субъединицы, на которой расположен центр связывания с бензодиазепинами, определено 2 основных типа ГАМК-рецепторов: a1/a5, ответственных за седативный и снотворный эффекты, и a2/a3, ответственных за противотревожное действие. Большинство препаратов группы бензодиазепинов способны взаимодействовать с обоими типами ГАМК-рецепторов, в то время как более избирательно действующие препараты – только с одним: Z-гипнотики с a1/a5-типом, препараты с преимущественно анксиолитическим действием – с a2/a3-типом [11, 13, 36, 38] (рис. 1).
Предполагается, что потенцируемое Алпразоламом опосредованное влияние на серотонинергическую и норадренергическую системы в лимбической и стволовых структурах также обеспечивает его клинические эффекты. Высокая степень сродства к комплексу ГАМК-рецептора позволяет отнести Алпразолам к высокопотентным транквилизаторам. Его диазепамовый эквивалент оценивается как 0,25–0,5 [40].
Клиническое действие Алпразолама и особенности практического применения
Производные бензодиазепина в отличие от других транквилизаторов являются препаратами избирательного рецепторного действия, характеризуются высоким терапевтическим эффектом в широком диапазоне доз и практически нетоксичны. Помимо снотворного, бензодиазепины обладают седативным, анксиолитическим (противотревожным), центральным миорелаксантным и противосудорожным действием, которое у отдельных представителей этого класса выражено в разной степени. Так, сравнение эффектов Алпразолама с другими транквилизаторами показывает, что этому препарату в меньшей степени свойственны седативный, снотворный и миорелаксирующий эффекты при сохранении высокого анксиолитического/антифобического потенциала, что обусловливает его популярность в качестве средства терапии панического расстройства (рис. 2).
Сочетание высоких показателей распространенности панического расстройства (на уровне 2,5–5% популяции) и выраженного нарушения функционирования определяет особое внимание к вопросам терапии таких состояний [20, 22, 39]. Паническое расстройство имеет достаточно типичный стереотип становления и развития симптоматики: возникновение первых панических атак четко фиксируется пациентом, быстро приводя к появлению тревоги «ожидания» (предвосхищения) приступа, в большинстве случаев определяющей состояние и способствующей ретенции пароксизмальной тревоги, а также формированию фобического избегания [25].
Помимо собственно тревожных проявлений, в клинической картине отчетливо выступают сопутствующие вегетативные (усиленное и учащенное сердцебиение, повышенное потоотделение, ощущение мышечного напряжения или слабости) и соматоформные (конверсионные, алгические) нарушения. Сходство последних с проявлениями соматических заболеваний определяет медицинское поведение больных (необоснованные обращения к специалистам разного профиля, не всегда оправданным диагностическим исследованиям); характерно появление ипохондрической симптоматики, способствующей утяжелению и хронификации состояния [35].
Также надо отметить, что детальное изучение вариантов ответа на терапию показывает, что число неэффективных курсов при назначении антидепрессантов оказывается выше (для пароксетина порядка 30–50%), в то время как Алпразолам даже в дозах 1,5–2 мг/сут позволяет достичь улучшения той или иной степени у 85% пациентов с паническим расстройством [9, 26]. В этой связи целесообразно предположение, что зарегистрированный рядом авторов недостаточный терапевтический эффект Алпразолама может быть объяснен жестким режимом дозирования в рамках клинического исследования, не позволяющим менять дозу препарата в соответствии с текущим состоянием. Отсюда следует важность индивидуального подбора дозы транквилизатора при паническом расстройстве с последующим гибким ее изменением [23].
До настоящего времени остается дискуссионным вопрос о том, насколько действие тех или иных препаратов при терапии панического расстройства в частности, и тревожных расстройств в целом может быть определено как «симптоматическое» или, напротив, как «патогенетическое»?
На наш взгляд, при ответе на этот вопрос необходимо учитывать тот факт, что заключение о симптоматическом действии Алпразолама преимущественно основывается на скорости наступления клинического эффекта непосредственно после начала терапии. Однако в связи с тем, что после отмены препарата (как правило, через 4–6–8 нед монотерапии) определяющая состояние тревожная симптоматика может рецидивировать, многие авторы приходят к заключению о неэффективности монотерапии в плане долгосрочного прогноза. По нашему мнению, такой подход не предусматривает возможность упущения, связанного с тем, что катамнестическая оценка состояния по завершении сравнительных курсов терапии транквилизаторами и антидепрессантами проводится в одно и то же время (обычно через 7–14 дней после завершения терапии, реже в течение месяца).
В результате именно скорость становления прямых эффектов, а также рецидива симптоматики по завершении курса терапии определяется как ключевая характеристика для вывода о целесообразности курсового применения (в особенности длительного) того или иного класса лекарственных средств.
В этой связи отметим, что феномен рецидива симптомов тревоги при отмене бензодиазепинов отличают две характерные особенности: а) динамика такого рода рецидива напрямую коррелирует с падением концентрации препарата; б) выраженность и острота регистрируемого рецидива может быть усугублена вследствие феномена «лекарственного рикошета», клинические проявления которого (в отличие от серотонинергических антидепрессантов) по своему профилю совпадают с определяющей клиническую картину симптоматикой, по поводу которой терапия была назначена [6].
В противоположность Алпразоламу терапевтический эффект после назначения серотонинергических антидепрессантов возникает отсроченно и не настолько определяется регулярностью приема и дозой препарата, как в случае с бензодиазепиновыми транквилизаторами. Аналогичным образом, если после отмены антидепрессанта наступает рецидив, то его динамика также носит протрагированный характер и в меньшей степени зависит от немедленного возобновления приема препарата в случае, если такое решение будет принято (рис. 3) [5].
Как уже упоминалось, назначение Алпразолама при паническом расстройстве в большинстве случаев приводит к быстрой и заметной редукции симптоматики. Этот эффект регистрируется при использовании как субъективных методов оценки (самоопросники), так и объективных (рейтинговые шкалы). Сравнение этих методик показывает, что их показатели в определенной степени разнородны: субъективная оценка результатов терапии заметно превосходит объективную (рис. 4). Высокая положительная субъективная оценка терапевтического эффекта Алпразолама связана с выраженным действием на такие показатели, как интенсивность антиципационной тревоги и приступов паники, в то время как собственно продолжительность панических приступов может редуцироваться в меньшей степени [26].
Очевидно, что такой профиль действия определяет формирование высокой степени приверженности пациента терапии транквилизаторами и большую субъективную значимость регулярного приема препарата. Соответственно, отмечается, что пациенты, принимающие транквилизаторы длительное время, под разными предлогами отказываются от предлагаемого изменения схемы терапии с заменой бензодиазепинов на средства других классов [32]. Логично предположить, что отмена транквилизатора у пациента с высоким уровнем антиципационной тревоги является событием – предиктором ухудшения состояния, что в зависимости от позиции эксперта может быть расценено либо как проявление лекарственной зависимости, либо как спровоцированный отменой препарата рецидив. В случае если на основании заключения о формировании лекарственной зависимости будет принято решение об отмене транквилизатора, повторно встает вопрос о том, смогут ли фармакологические и психотерапевтические альтернативы сравниться с эталонным препаратом в способности купировать симптомы тревоги.
Применение дифференцированного подхода позволяет очертить круг состояний, при которых выраженность анксиолитического действия оказывается решающим фактором: наиболее предпочтительно использование высокого анксиолитического потенциала Алпразолама в случае определяющих клиническую картину проявлений тревоги непсихотического уровня (например, паническое расстройство). Затяжные состояния, при которых тревога носит ситуационно обусловленный или генерализованный характер и не достигает полной психопатологической завершенности, требуют иного подхода. Сравнение эффектов монотерапии генерализованного тревожного расстройства бензодиазепинами и антидепрессантами показывает, что целевая симптоматика по-разному реагирует на применение препаратов разных классов: если применение эталонных антидепрессантов приводит к преимущественному снижению проявлений психической тревоги, то назначение Алпразолама в основном влияет на соматическую составляющую симптомокомплекса.
В ряде работ показано, что суммарный эффект монотерапии бензодиазепинами при генерализованном тревожном расстройстве и при аффективных нарушениях ниже, чем при назначении как селективных, так и эталонных трициклических антидепрессантов [19]. В то же время эффект комбинированной терапии (антидепрессант + транквилизатор) оказывается выше не только благодаря быстрой редукции проявлений психической тревоги, но и за счет свойственного транквилизаторам положительного воздействия на сопутствующие соматические симптомы (кардиоваскулярные, респираторные, соматосенсорные, мышечные и др.), отсутствующего у большинства антидепрессантов [16, 24]. Эта последняя особенность расценивается как ключевое свойство всего класса бензодиазепиновых производных [34].
При обсуждении соматических симптомов тревоги отдельного упоминания заслуживают случаи атипичного панического расстройства, определяемого некоторыми авторами в качестве отдельной его формы: паническое расстройство без фобических проявлений (non-fearful panic disorder).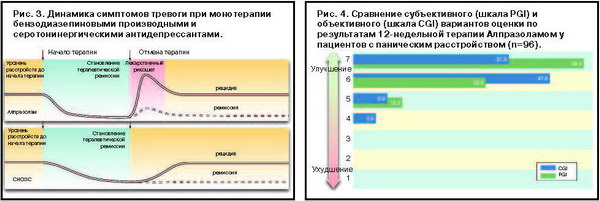 Особенностью такого рода нарушений является преобладание выраженных соматических проявлений при минимальной представленности в структуре состояния явлений психической тревоги, что позволяет квалифицировать эти случаи как «маскированное» паническое расстройство. При этом соматические симптомы в большинстве своем подчиняются общему стереотипу и носят пароксизмальный характер, осциллируя от минимально представленных до выраженных в степени, определяющей необходимость госпитализации в стационары соматического профиля. Речь идет о приступах болей в эпигастральной области, в области грудной клетки и др., сопровождающихся парестезиями и широким кругом так называемых автономных симптомов (см. таблицу). Указанный вариант панического расстройства перекрывается с нарушениями ипохондрического круга [29]. Большинство пациентов успешно отвечают на комбинированную терапию антидепрессантами и высокопотентными транквилизаторами (Алпразолам), в то время как назначение соматотропной терапии (например, ингибиторов протонной помпы) или даже «классических» бензодиазепинов (диазепам) не приводит к столь заметному улучшению состояния [33, 37].
Особенностью такого рода нарушений является преобладание выраженных соматических проявлений при минимальной представленности в структуре состояния явлений психической тревоги, что позволяет квалифицировать эти случаи как «маскированное» паническое расстройство. При этом соматические симптомы в большинстве своем подчиняются общему стереотипу и носят пароксизмальный характер, осциллируя от минимально представленных до выраженных в степени, определяющей необходимость госпитализации в стационары соматического профиля. Речь идет о приступах болей в эпигастральной области, в области грудной клетки и др., сопровождающихся парестезиями и широким кругом так называемых автономных симптомов (см. таблицу). Указанный вариант панического расстройства перекрывается с нарушениями ипохондрического круга [29]. Большинство пациентов успешно отвечают на комбинированную терапию антидепрессантами и высокопотентными транквилизаторами (Алпразолам), в то время как назначение соматотропной терапии (например, ингибиторов протонной помпы) или даже «классических» бензодиазепинов (диазепам) не приводит к столь заметному улучшению состояния [33, 37].
Влияние модели лекарственного приема
Результаты фармакоэпидемиологических исследований свидетельствуют о том, что несмотря на ограничения и, как следствие, снижение числа назначений, до настоящего времени бензодиазепины остаются одним из самых используемых классов психотропных средств. Примерно 10% взрослого населения принимали средства этого класса в течение последнего года хотя бы эпизодически, а 10–25% – регулярно, что соотносится с показателями распространенности основных/коморбидных тревожно-фобических расстройств в населении [1].
Из характерных для последнего времени изменений в назначениях бензодиазепинов стоит отметить сдвиг в отношении преимущественного использования препаратов короткого действия. Кроме того, регистрируется более частое назначение бензодиазепинов интермиттирующими курсами, в связи с чем, на наш взгляд, стоит упомянуть об имевшей место дискуссии. Основной из обсуждавшихся при этом проблем являлся вопрос о том, какие именно курсы терапии более безопасны с точки зрения «поведенческой токсичности» – постоянные или интермиттирующие [21].
Как уже отмечалось, фармакоэпидемиологические показатели свидетельствуют о существовании разрыва между принятыми стандартами лечения и клинической реальностью. Назначения врачей существенно расходятся с ограничительными рекомендациями. Достаточно неожиданным и даже парадоксальным можно назвать тот факт, что, в частности, Алпразолам до настоящего времени остается самым назначаемым препаратом психофармакологического действия. Длительность курсов лечения бензодиазепиновыми транквилизаторами у пациентов с тревожными расстройствами также обычно превышает рекомендуемые сроки [1].
Одной из причин этого может быть недостаточная эффективность препаратов, предлагаемых официальными стандартами для терапии тревожных расстройств, в сравнении с бензодиазепинами – эталоном быстроты и выраженности анксиолитического эффекта. Немаловажную роль играют и индивидуальные предпочтения врача [3].
Другая причина состоит в том, что в отличие от других препаратов, требующих строгого курсового применения, бензодиазепины чрезвычайно удобны для приема «по необходимости». Такой вариант приема делает достаточно неопределенным само понятие лекарственного режима, который в этом случае бывает трудно сопоставить с формализованными схемами, приводимыми в практических рекомендациях и руководствах.
Дифференцированная оценка возможного развития толерантности к различным клиническим эффектам транквилизаторов показывает, что те из них, которые оцениваются как побочные (мышечная слабость, повышенная седация, изменение психофизиологических показателей), в большинстве редуцируются, и в ходе регулярного приема препаратов выявляется исключительно анксиолитическое действие [40]. Соответственно, исследования, предлагающие построение моделей приема бензодиазепинов, показывают, что у большинства пациентов не отмечается изменения толерантности к терапевтическому действию, ведущего к необходимости повышения доз. Более того, лишь незначительная (10–13%) часть больных обнаруживают тенденцию к самотерапевтическому приему бензодиазепинов и стремление к коррекции своего состояния с отклонением от рекомендованных дозировок. Такие пациенты, в клинической̆ картине которых существенную роль играют характерологические расстройства и стойкая ипохондрическая фиксация, могут проявлять стремление к интенсификации и продлению курсов терапии [4].
В целом, существующие к настоящему времени данные позволяют предположить, что длительность курса терапии бензодиазепинами не является решающим фактором, определяющим развитие психопатологических расстройств их приема – злоупотребления и лекарственной зависимости. Имеются указания, что эти нарушения чаще развиваются у отдельных групп пациентов, характеризующихся определенными сочетаниями преморбидных личностных девиаций, ведущей психопатологической симптоматики и социодемографических показателей. Определение этих групп сделает возможным выявление клинических предикторов развития аддикции и злоупотребления бензодиазепинами, что позволит более дифференцированно оценивать показания к назначению средств этого класса при тревожных расстройствах.
Сведения об авторе
Д.В.Ястребов – ст. науч. сотр. отд-ния новых средств и методов терапии ГНЦ ССП им. В.П.Сербского.
E-mail: dvyastrebov@gmail.com
Ключевые слова: Алпразолам, тревожные расстройства, терапия.
Alprazolam in treatment of anxiety disorders: review
D.V.Yastrebov
V.P.Serbsky Social and Forensic Psychiatry Research Centre
Summary. The article introduces literature review covering Alprazolam use for treatment of anxiety disorders. The detailed description of the mode of action, pharmacological properties and clinical use patterns. Special attention has focused on long-term use safety and differentiated indications including the use in general practice.
Key words: Alprazolam, anxiety disorders, therapy.
Прогресс в понимании тревожных расстройств в последние годы сопровождается освоением целого ряда направлений – психологических, фармакологических, нейробиологических. Современные авторы отмечают, что клиническая практика находится «на рубеже»: ожидается появление лекарственных средств нового поколения, позволяющих разработать инновационные подходы к лечению тревоги. J.Nash и D.Nutt [28] указывают, что «основной массив клинических и фармакологических данных, накопленных к настоящему времени, может потерять актуальность в течение ближайших нескольких лет».
Однако оптимистичность этих прогнозов пока не оправдалась: терапия тревожных расстройств до сих пор опирается на алгоритмы, разработанные и проверенные клинически в течение десятилетий, прошедших со времени создания средств этого класса. Существенное место в арсенале таких средств, занявших прочное место не только в специализированной психиатрической, но и в общемедицинской практике, по-прежнему занимают бензодиазепиновые транквилизаторы.
Алпразолам – транквилизатор триазолобензодиазепиновой структуры, по своему строению относится к 1,4-триазолобензодиазепинам, структура которых отличается от классических 1,4-бензодиазепинов (например, диазепама) наличием триазольного кольца. В отличие от других транквилизаторов Алпразолам, появившийся в продаже с 1991 г., уверенно удерживает свои позиции, по-прежнему являясь самым назначаемым психофармакологическим препаратом.
Фармакокинетика Алпразолама
Исследования показали, что время достижения пиковой концентрации препарата (Tmax) составляет 1–2 ч, период полувыведения (T1/2) – 9–16 ч. После перорального приема примерно 90% препарата всасывается и связывается с белками плазмы. Равновесная концентрация препарата в крови наступает через 2–3 дня, вне зависимости от режима приема. Алпразолам метаболизируется печенью с участием изофермента CYP3A4. Необходимо учитывать, что совместное назначение Алпразолама с препаратами группы селективных ингибиторов обратного захвата серотонина (СИОЗС), ингибирующими CYP3A4, приводит к заметному (на 20–30%) замедлению его выведения. В наибольшей степени этим свойством обладает метаболит флуоксетина норфлуоксетин. Другие препараты, способные замедлять выведение Алпразолама при совместном назначении, – венлафаксин, флувоксамин, карбамазепин и оральные контрацептивы [7, 15, 17]. В процессе биотрансформации, происходящей в печени, Алпразолам преобразуется помимо прочих в два основных метаболита, обладающих значительно меньшей сравнительно с исходным препаратом фармакологической активностью. Трансформация в 4-гидроксиалпразолам составляет основную часть клиренса Алпразолама, остальное приходится на a-гидроксиалпразолам и другие метаболиты.
 Их фармакологическая активность в сравнении с исходным соединением невелика, вследствие чего считается, что они не принимают участия в клинических эффектах Алпразолама. Метаболиты Алпразолама не склонны к кумуляции. От 25 до 75% исходной дозы препарата выводится в неизмененном виде почками и через кишечник [12, 18].
Их фармакологическая активность в сравнении с исходным соединением невелика, вследствие чего считается, что они не принимают участия в клинических эффектах Алпразолама. Метаболиты Алпразолама не склонны к кумуляции. От 25 до 75% исходной дозы препарата выводится в неизмененном виде почками и через кишечник [12, 18].
При назначении в виде монотерапии длительность клинического эффекта стандартной таблетированной формы составляет 6–11 ч, что обычно подразумевает необходимость 2-кратного приема [14, 27]. Более чем
2-кратное снижение концентрации препарата в междозовом интервале может приводить к снижению клинического эффекта, что проявляется в виде так называемой междозовой симптоматики (англ. interdose symptoms) или симптомов прорыва (англ. breakthrouh symptoms) и в числе прочего является одним из факторов, снижающих лекарственный комплаенс.
Выраженность нарастающих по мере падения концентрации препарата в крови симптомов тревоги ограничивается субклиническим уровнем. Тем не менее испытывающие их пациенты могут прибегнуть к самостоятельному сокращению временно́го интервала между последовательными приемами препарата. Этой проблемы обычно не возникает при комплексной терапии (комбинация транквилизаторов с антидепрессантами). Тимоаналептики, с одной стороны, замедляют метаболизм транквилизаторов, а с другой – оказывают отдельное терапевтическое воздействие на анксиозную симптоматику [8, 40].
Механизм действия

Основным механизмом действия Алпразолама является воздействие на процесс ГАМКергической передачи. Подобно другим бензодиазепинам, Алпразолам связывается с ГАМК-хлорным комплексом.
ГАМК-рецепторы типа А (ГАМКА/GABAA), ответственные за такие эффекты, как противотревожный, седативный, снотворный, миорелаксирующий и др., относятся к ионотропным рецепторам – межсинаптическая передача в них осуществляется посредством ионов Cl-, проходящих через соответствующий канал ГАМК-рецептора (хлорный канал). Этот канал открывается после активации рецептора нейромедиатором, который взаимодействует с рецептором через ГАМК-центр связывания.
Структурно ГАМКА-рецептор представляет собой супрамолекулярный комплекс, состоящий из пяти субъ-единиц, каждая из которых может быть отнесена к одному из типов: a, b, g и некоторым другим; обнаружено несколько вариантов каждого из этих типов, например a1, a2, a3, a4, a5, a6. Центр связывания с ГАМК расположен на стыке a- и b-субъединиц.
Кроме центра связывания с нейромедиатором, в ГАМК-рецепторе существует ряд структур, отвечающих за процесс модуляции, т.е. опосредованного воздействия на интенсивность нейротрансмиссии. Эти структуры получили название по имени класса препаратов, которые, взаимодействуя с ними, оказывают модулирующее действие: участок связывания с бензодиазепинами [прежние названия: w(омега)-рецепторы, или бензодиазепиновые рецепторы]. Предполагается, что в организме существует ряд соединений полипептидной структуры (так называемых эндозепинов), способных связываться с этими центрами. Аналогичным образом в комплексе ГАМК-рецептора существует центр связывания с барбитуратами, локализованный на g-субъединице. Модулирующее действие ГАМКергических препаратов заключается в том, что в результате их связывания с ГАМК-рецептором возрастает поток ионов хлора, проходящих через рецептор. Это достигается повышением частоты циклов «открытия–закрытия» хлорного канала в случае бензодиазепинов или увеличением времени его открытия в случае барбитуратов. Такое различие в механизме действия 2 групп препаратов обусловливает возможность потенцирования эффекта при совместном приеме.

В зависимости от варианта входящей в состав ГАМК-рецептора a-субъединицы, на которой расположен центр связывания с бензодиазепинами, определено 2 основных типа ГАМК-рецепторов: a1/a5, ответственных за седативный и снотворный эффекты, и a2/a3, ответственных за противотревожное действие. Большинство препаратов группы бензодиазепинов способны взаимодействовать с обоими типами ГАМК-рецепторов, в то время как более избирательно действующие препараты – только с одним: Z-гипнотики с a1/a5-типом, препараты с преимущественно анксиолитическим действием – с a2/a3-типом [11, 13, 36, 38] (рис. 1).
Предполагается, что потенцируемое Алпразоламом опосредованное влияние на серотонинергическую и норадренергическую системы в лимбической и стволовых структурах также обеспечивает его клинические эффекты. Высокая степень сродства к комплексу ГАМК-рецептора позволяет отнести Алпразолам к высокопотентным транквилизаторам. Его диазепамовый эквивалент оценивается как 0,25–0,5 [40].
Клиническое действие Алпразолама и особенности практического применения
Производные бензодиазепина в отличие от других транквилизаторов являются препаратами избирательного рецепторного действия, характеризуются высоким терапевтическим эффектом в широком диапазоне доз и практически нетоксичны. Помимо снотворного, бензодиазепины обладают седативным, анксиолитическим (противотревожным), центральным миорелаксантным и противосудорожным действием, которое у отдельных представителей этого класса выражено в разной степени. Так, сравнение эффектов Алпразолама с другими транквилизаторами показывает, что этому препарату в меньшей степени свойственны седативный, снотворный и миорелаксирующий эффекты при сохранении высокого анксиолитического/антифобического потенциала, что обусловливает его популярность в качестве средства терапии панического расстройства (рис. 2).
Сочетание высоких показателей распространенности панического расстройства (на уровне 2,5–5% популяции) и выраженного нарушения функционирования определяет особое внимание к вопросам терапии таких состояний [20, 22, 39]. Паническое расстройство имеет достаточно типичный стереотип становления и развития симптоматики: возникновение первых панических атак четко фиксируется пациентом, быстро приводя к появлению тревоги «ожидания» (предвосхищения) приступа, в большинстве случаев определяющей состояние и способствующей ретенции пароксизмальной тревоги, а также формированию фобического избегания [25].
Помимо собственно тревожных проявлений, в клинической картине отчетливо выступают сопутствующие вегетативные (усиленное и учащенное сердцебиение, повышенное потоотделение, ощущение мышечного напряжения или слабости) и соматоформные (конверсионные, алгические) нарушения. Сходство последних с проявлениями соматических заболеваний определяет медицинское поведение больных (необоснованные обращения к специалистам разного профиля, не всегда оправданным диагностическим исследованиям); характерно появление ипохондрической симптоматики, способствующей утяжелению и хронификации состояния [35].
Также надо отметить, что детальное изучение вариантов ответа на терапию показывает, что число неэффективных курсов при назначении антидепрессантов оказывается выше (для пароксетина порядка 30–50%), в то время как Алпразолам даже в дозах 1,5–2 мг/сут позволяет достичь улучшения той или иной степени у 85% пациентов с паническим расстройством [9, 26]. В этой связи целесообразно предположение, что зарегистрированный рядом авторов недостаточный терапевтический эффект Алпразолама может быть объяснен жестким режимом дозирования в рамках клинического исследования, не позволяющим менять дозу препарата в соответствии с текущим состоянием. Отсюда следует важность индивидуального подбора дозы транквилизатора при паническом расстройстве с последующим гибким ее изменением [23].
До настоящего времени остается дискуссионным вопрос о том, насколько действие тех или иных препаратов при терапии панического расстройства в частности, и тревожных расстройств в целом может быть определено как «симптоматическое» или, напротив, как «патогенетическое»?
На наш взгляд, при ответе на этот вопрос необходимо учитывать тот факт, что заключение о симптоматическом действии Алпразолама преимущественно основывается на скорости наступления клинического эффекта непосредственно после начала терапии. Однако в связи с тем, что после отмены препарата (как правило, через 4–6–8 нед монотерапии) определяющая состояние тревожная симптоматика может рецидивировать, многие авторы приходят к заключению о неэффективности монотерапии в плане долгосрочного прогноза. По нашему мнению, такой подход не предусматривает возможность упущения, связанного с тем, что катамнестическая оценка состояния по завершении сравнительных курсов терапии транквилизаторами и антидепрессантами проводится в одно и то же время (обычно через 7–14 дней после завершения терапии, реже в течение месяца).
В результате именно скорость становления прямых эффектов, а также рецидива симптоматики по завершении курса терапии определяется как ключевая характеристика для вывода о целесообразности курсового применения (в особенности длительного) того или иного класса лекарственных средств.
В этой связи отметим, что феномен рецидива симптомов тревоги при отмене бензодиазепинов отличают две характерные особенности: а) динамика такого рода рецидива напрямую коррелирует с падением концентрации препарата; б) выраженность и острота регистрируемого рецидива может быть усугублена вследствие феномена «лекарственного рикошета», клинические проявления которого (в отличие от серотонинергических антидепрессантов) по своему профилю совпадают с определяющей клиническую картину симптоматикой, по поводу которой терапия была назначена [6].
В противоположность Алпразоламу терапевтический эффект после назначения серотонинергических антидепрессантов возникает отсроченно и не настолько определяется регулярностью приема и дозой препарата, как в случае с бензодиазепиновыми транквилизаторами. Аналогичным образом, если после отмены антидепрессанта наступает рецидив, то его динамика также носит протрагированный характер и в меньшей степени зависит от немедленного возобновления приема препарата в случае, если такое решение будет принято (рис. 3) [5].
Как уже упоминалось, назначение Алпразолама при паническом расстройстве в большинстве случаев приводит к быстрой и заметной редукции симптоматики. Этот эффект регистрируется при использовании как субъективных методов оценки (самоопросники), так и объективных (рейтинговые шкалы). Сравнение этих методик показывает, что их показатели в определенной степени разнородны: субъективная оценка результатов терапии заметно превосходит объективную (рис. 4). Высокая положительная субъективная оценка терапевтического эффекта Алпразолама связана с выраженным действием на такие показатели, как интенсивность антиципационной тревоги и приступов паники, в то время как собственно продолжительность панических приступов может редуцироваться в меньшей степени [26].
Очевидно, что такой профиль действия определяет формирование высокой степени приверженности пациента терапии транквилизаторами и большую субъективную значимость регулярного приема препарата. Соответственно, отмечается, что пациенты, принимающие транквилизаторы длительное время, под разными предлогами отказываются от предлагаемого изменения схемы терапии с заменой бензодиазепинов на средства других классов [32]. Логично предположить, что отмена транквилизатора у пациента с высоким уровнем антиципационной тревоги является событием – предиктором ухудшения состояния, что в зависимости от позиции эксперта может быть расценено либо как проявление лекарственной зависимости, либо как спровоцированный отменой препарата рецидив. В случае если на основании заключения о формировании лекарственной зависимости будет принято решение об отмене транквилизатора, повторно встает вопрос о том, смогут ли фармакологические и психотерапевтические альтернативы сравниться с эталонным препаратом в способности купировать симптомы тревоги.
Применение дифференцированного подхода позволяет очертить круг состояний, при которых выраженность анксиолитического действия оказывается решающим фактором: наиболее предпочтительно использование высокого анксиолитического потенциала Алпразолама в случае определяющих клиническую картину проявлений тревоги непсихотического уровня (например, паническое расстройство). Затяжные состояния, при которых тревога носит ситуационно обусловленный или генерализованный характер и не достигает полной психопатологической завершенности, требуют иного подхода. Сравнение эффектов монотерапии генерализованного тревожного расстройства бензодиазепинами и антидепрессантами показывает, что целевая симптоматика по-разному реагирует на применение препаратов разных классов: если применение эталонных антидепрессантов приводит к преимущественному снижению проявлений психической тревоги, то назначение Алпразолама в основном влияет на соматическую составляющую симптомокомплекса.
В ряде работ показано, что суммарный эффект монотерапии бензодиазепинами при генерализованном тревожном расстройстве и при аффективных нарушениях ниже, чем при назначении как селективных, так и эталонных трициклических антидепрессантов [19]. В то же время эффект комбинированной терапии (антидепрессант + транквилизатор) оказывается выше не только благодаря быстрой редукции проявлений психической тревоги, но и за счет свойственного транквилизаторам положительного воздействия на сопутствующие соматические симптомы (кардиоваскулярные, респираторные, соматосенсорные, мышечные и др.), отсутствующего у большинства антидепрессантов [16, 24]. Эта последняя особенность расценивается как ключевое свойство всего класса бензодиазепиновых производных [34].
При обсуждении соматических симптомов тревоги отдельного упоминания заслуживают случаи атипичного панического расстройства, определяемого некоторыми авторами в качестве отдельной его формы: паническое расстройство без фобических проявлений (non-fearful panic disorder).
 Особенностью такого рода нарушений является преобладание выраженных соматических проявлений при минимальной представленности в структуре состояния явлений психической тревоги, что позволяет квалифицировать эти случаи как «маскированное» паническое расстройство. При этом соматические симптомы в большинстве своем подчиняются общему стереотипу и носят пароксизмальный характер, осциллируя от минимально представленных до выраженных в степени, определяющей необходимость госпитализации в стационары соматического профиля. Речь идет о приступах болей в эпигастральной области, в области грудной клетки и др., сопровождающихся парестезиями и широким кругом так называемых автономных симптомов (см. таблицу). Указанный вариант панического расстройства перекрывается с нарушениями ипохондрического круга [29]. Большинство пациентов успешно отвечают на комбинированную терапию антидепрессантами и высокопотентными транквилизаторами (Алпразолам), в то время как назначение соматотропной терапии (например, ингибиторов протонной помпы) или даже «классических» бензодиазепинов (диазепам) не приводит к столь заметному улучшению состояния [33, 37].
Особенностью такого рода нарушений является преобладание выраженных соматических проявлений при минимальной представленности в структуре состояния явлений психической тревоги, что позволяет квалифицировать эти случаи как «маскированное» паническое расстройство. При этом соматические симптомы в большинстве своем подчиняются общему стереотипу и носят пароксизмальный характер, осциллируя от минимально представленных до выраженных в степени, определяющей необходимость госпитализации в стационары соматического профиля. Речь идет о приступах болей в эпигастральной области, в области грудной клетки и др., сопровождающихся парестезиями и широким кругом так называемых автономных симптомов (см. таблицу). Указанный вариант панического расстройства перекрывается с нарушениями ипохондрического круга [29]. Большинство пациентов успешно отвечают на комбинированную терапию антидепрессантами и высокопотентными транквилизаторами (Алпразолам), в то время как назначение соматотропной терапии (например, ингибиторов протонной помпы) или даже «классических» бензодиазепинов (диазепам) не приводит к столь заметному улучшению состояния [33, 37].
Влияние модели лекарственного приема
Результаты фармакоэпидемиологических исследований свидетельствуют о том, что несмотря на ограничения и, как следствие, снижение числа назначений, до настоящего времени бензодиазепины остаются одним из самых используемых классов психотропных средств. Примерно 10% взрослого населения принимали средства этого класса в течение последнего года хотя бы эпизодически, а 10–25% – регулярно, что соотносится с показателями распространенности основных/коморбидных тревожно-фобических расстройств в населении [1].
Из характерных для последнего времени изменений в назначениях бензодиазепинов стоит отметить сдвиг в отношении преимущественного использования препаратов короткого действия. Кроме того, регистрируется более частое назначение бензодиазепинов интермиттирующими курсами, в связи с чем, на наш взгляд, стоит упомянуть об имевшей место дискуссии. Основной из обсуждавшихся при этом проблем являлся вопрос о том, какие именно курсы терапии более безопасны с точки зрения «поведенческой токсичности» – постоянные или интермиттирующие [21].
Как уже отмечалось, фармакоэпидемиологические показатели свидетельствуют о существовании разрыва между принятыми стандартами лечения и клинической реальностью. Назначения врачей существенно расходятся с ограничительными рекомендациями. Достаточно неожиданным и даже парадоксальным можно назвать тот факт, что, в частности, Алпразолам до настоящего времени остается самым назначаемым препаратом психофармакологического действия. Длительность курсов лечения бензодиазепиновыми транквилизаторами у пациентов с тревожными расстройствами также обычно превышает рекомендуемые сроки [1].
Одной из причин этого может быть недостаточная эффективность препаратов, предлагаемых официальными стандартами для терапии тревожных расстройств, в сравнении с бензодиазепинами – эталоном быстроты и выраженности анксиолитического эффекта. Немаловажную роль играют и индивидуальные предпочтения врача [3].
Другая причина состоит в том, что в отличие от других препаратов, требующих строгого курсового применения, бензодиазепины чрезвычайно удобны для приема «по необходимости». Такой вариант приема делает достаточно неопределенным само понятие лекарственного режима, который в этом случае бывает трудно сопоставить с формализованными схемами, приводимыми в практических рекомендациях и руководствах.

Дифференцированная оценка возможного развития толерантности к различным клиническим эффектам транквилизаторов показывает, что те из них, которые оцениваются как побочные (мышечная слабость, повышенная седация, изменение психофизиологических показателей), в большинстве редуцируются, и в ходе регулярного приема препаратов выявляется исключительно анксиолитическое действие [40]. Соответственно, исследования, предлагающие построение моделей приема бензодиазепинов, показывают, что у большинства пациентов не отмечается изменения толерантности к терапевтическому действию, ведущего к необходимости повышения доз. Более того, лишь незначительная (10–13%) часть больных обнаруживают тенденцию к самотерапевтическому приему бензодиазепинов и стремление к коррекции своего состояния с отклонением от рекомендованных дозировок. Такие пациенты, в клинической̆ картине которых существенную роль играют характерологические расстройства и стойкая ипохондрическая фиксация, могут проявлять стремление к интенсификации и продлению курсов терапии [4].
В целом, существующие к настоящему времени данные позволяют предположить, что длительность курса терапии бензодиазепинами не является решающим фактором, определяющим развитие психопатологических расстройств их приема – злоупотребления и лекарственной зависимости. Имеются указания, что эти нарушения чаще развиваются у отдельных групп пациентов, характеризующихся определенными сочетаниями преморбидных личностных девиаций, ведущей психопатологической симптоматики и социодемографических показателей. Определение этих групп сделает возможным выявление клинических предикторов развития аддикции и злоупотребления бензодиазепинами, что позволит более дифференцированно оценивать показания к назначению средств этого класса при тревожных расстройствах.
Сведения об авторе
Д.В.Ястребов – ст. науч. сотр. отд-ния новых средств и методов терапии ГНЦ ССП им. В.П.Сербского.
E-mail: dvyastrebov@gmail.com
Список исп. литературыСкрыть список1. Мосолов С.Н. Основы психофармакотерапии. М., 1996.
2. Смулевич А.В, Дробижев М.Ю., Иванов С.В. Транквилизаторы – производные бензодиазепина в психиатрии и общей медицине. М., 1999.
3. Чеберда О.А. Клинические особенности больных, длительно принимающих бензодиазепиновые транквилизаторы. Рос. психиатр. журн. 2006; 1: 70–5.
4. Ястребов Д.В. Симптоматика, ассоциированная с прекращением приема антидепрессантов. Механизмы развития, способы предотвращения и коррекции. Психиатр. и психофармакотер. 2011; 36: 14–20.
5. Ястребов Д.В. Алпразолам сегодня: 30 лет дискуссии об индивидуальных показаниях и безопасности. Психиатр. и психофармакотер. 2012; 1: 62–8.
6. Achmin J, Zarycranski W, Taylor KP et al. Effects of venlafaxine on the pharmacokinetics of alprazolam. Psychopharmacol Bull 1998; 34: 211–9.
7. Alexander PE. The need for extended-release medications. Curr Ther Res 1995; 56: 940–6.
8. Ballenger JC, Wheadon DE, Steiner M. Double-blind, fixed-dose, placebo-controlled study of paroxetine in the treatment of panic disorder. Am J Psychiat 1998; 155: 36–42.
9. Beitman BD, Basha I, Flaker G et al. Non-fearful panic disorder: panic attacks without fear. Behav Res Ther 1987; 25: 487–92.
10. Dämgen K, Lüddens H. Zaleplon displays a selectivity to recombinant GABAA receptors different from zolpidem, zopiclone and benzodiazepines. Neurosci Res Commun 1999; 25: 139–48.
11. Dehlin O, Kullingsjö H, Lidén A et al. Pharmacokinetics of alprazolam in geriatric patients with neurotic depression. Pharmacol Toxicol 1991; 68: 121–4.
12. Doble A. New insights into the mechanisms of action hypnotics. J Psychopharmacol 1999; 13 (Suppl. 4): s11–20.
13. Fawcett JA, Kravitz HM. Alprazolam: pharmacokinetics, clinical efficacy, and mechanism of action. Pharmacother 1982; 2: 243–54.
14. Fleishaker JC, Hulst LK. A pharmacokinetic and pharmacodynamic evaluation of the combined administration of alprazolam and fluvoxamine. Eur J Clin Pharmacol 1994; 46: 35–9.
15. Furukawa TA, Streiner DL, Young LT. Is antidepressant-benzodiazepine combination therapy clinically more useful? A meta-analytic study. J Affect Disord 2001; 65 (2): 173–7.
16. Furukori H, Otani K, Yasui N et al. Effect of carbamazepine on the single oral dose pharmacokinetics of alprazolam. Neuropsychopharmacol 1998; 18: 364–9.
17. Greenblatt DJ, Wright E. Clinical pharmacokinetics of alprazolam. Therapeutic implications. Clin Pharmacokinet 1993; 24: 453–71.
18. Hoehn-Saric R, McLeod DR, Zimmerli WD. Differential effects of alprazolam and imipramine in generalized anxiety disorder: somatic vs psychic symptoms. J Clin Psychiat 1988; 49: 293–301.
19. Hollifield M, Katon W, Skipper B et al. Panic disorder and quality of life: variables predictive of functional impairment. Am J Psychiat 1997; 154: 766–72.
20. Kassam A, Patten SB. Hypnotic use in a population-based sample of over thirty-five thousand interviewed Canadians. Popul Health Metr 2006; 24 (4): 15.
21. Kessler RC, Chiu WT, Jin R et al. The epidemiology of panic attacks, panic disorder, and agoraphobia in the Na-tional Comorbidity Survey Replication. Arch Gen Psychiat 2006; 63: 415–24.
22. Lesser IM, Lydiard RB, Antal E et al. Alprazolam plasma concentrations and treatment response in panic disorder and agoraphobia. Am J Psychiat 1992; 149: 1556–62.
23. Lydiard RB, Rickels K, Herman B, Feltner E. Pregabalin for psychic and somatic symptoms of GAD. Intern J Neuropsychopharmacol 2010; 13: 229–41.
24. Marks I. The classification of phobic disorders. British J Psy 1970; 116: 377–86.
25. Márquez M, Arenoso H, Caruso N. Efficacy of alprazolam sublingual tablets in the treatment of the acute phase of panic disorders. Actas Esp Psiquiat 2011; 39 (2): 88–94.
26. von Moltke L, Greenblatt DJ, Cotreau-Bibbo MM et al. Inhibitors of alprazolam metabolism in vitro: effect of serotonin-reuptake-inhibitor antidepressants, ketoconazole and quinidine. Br J Clin Pharmac 1994; 38: 23–31.
27. Nash JR, Nutt DJ. Pharmacotherapy of anxiety. Hand Exp Pharmacol 2005; 169: 469–501.
28. Noyes R, Reich J, Clancy J, O\'Gorman TW. Reduction in hypochondriasis with treatment of panic disorder. Br J Psychiat 1986; 149: 631–5.
29. Noyes R, Du Pont RL, Pecknold JC et al. Alprazolam in panic disorder and agoraphobia: Patient acceptance, side effects, and safety. Arch Gen Psychiat 1988; 45: 423–8.
30. Pecknold JC, Swinson RP, Kuch K, Lewis CP. Alprazolam in panic disorder and agoraphobia: discontinuation effects. Arch Gen Psychiat 1988; 45: 429–36.
31. Petursson H, Lader M. Dependence on tranquilizers. Oxford University Press 1984.
32. Porcelli P, De Carne M. Non-fearful panic disorder in gastroenterology. Psychosomatics 2008; 49: 543–5.
33. Rickels K, Downing R, Schweizer E et al. Antidepressants for the treatment of generalized anxiety disorder: a placebo-controlled comparison of imipramine, trazodone, and diazepam. Arch Gen Psychiat 1993; 50: 884–95.
34. Rief W, Martin A, Klaiberg A et al. Specific effects of depression, panic, and somatic symptoms on illness behavior. Psychosom Med 2005; 67: 596–601.
35. Rudolph U, Crestani F, Möhler H. GABA-A-receptor subtypes: dissecting their pharmacological functions. Trends Pharmacol Sci 2001; 22: 188–94.
36. Russell JL, Kushner MG, Beitman BD, Bartels KM. Nonfearful panic disorder in neurology patients validated by lactate challenge. Am J Psychiat 1991; 148 (3): 361–4.
37. Sanger DJ, Benavides J, Perrault G et al. Recent developments in the behavioral pharmacology of benzodiazepine (o)-receptors: Evidence for the functional significance of receptor subtypes. Neurosci Biobehav Rev 1994; 18: 355–72.
38. Stein MB, Roy Byrne PP, Craske MG et al. Functional impact and health utility of anxiety disorders in primary care outpatients. Med Care 2005; 43: 1164–70.
39. Verster JC, Volkerts ER. Clinical pharmacology, clinical efficacy, and behavioral toxicity of Alprazolam: a review of the literature. CNS Drug Rev 2004; 10 (1): 45–76.


