Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№01 2009
Терапия нозогенных реакций у больных раком желудка №01 2009
Номера страниц в выпуске:38-45
Необходимость психофармакотерапии психических расстройств у больных со злокачественными новообразованиями, в первую очередь нозогенных реакций, определяется как высокой распространенностью рассматриваемых состояний, так и негативными последствиями (медицинскими, социальными) для исхода онкологических заболеваний (S.Davis-Ali и соавт., 1993; L.Dahlquist и соавт., 1993; D.Razavi, F.Stiefel, 1994; K.Nordin, B.Glimelius, 1999). Согласно данным современных исследований в назначении психофармакотерапии нуждаются в среднем 50–90% онкологических больных
Введение
Необходимость психофармакотерапии психических расстройств у больных со злокачественными новообразованиями, в первую очередь нозогенных реакций, определяется как высокой распространенностью рассматриваемых состояний, так и негативными последствиями (медицинскими, социальными) для исхода онкологических заболеваний (S.Davis-Ali и соавт., 1993; L.Dahlquist и соавт., 1993; D.Razavi, F.Stiefel, 1994; K.Nordin, B.Glimelius, 1999).
Согласно данным современных исследований в назначении психофармакотерапии нуждаются в среднем 50–90% онкологических больных (табл. 1).

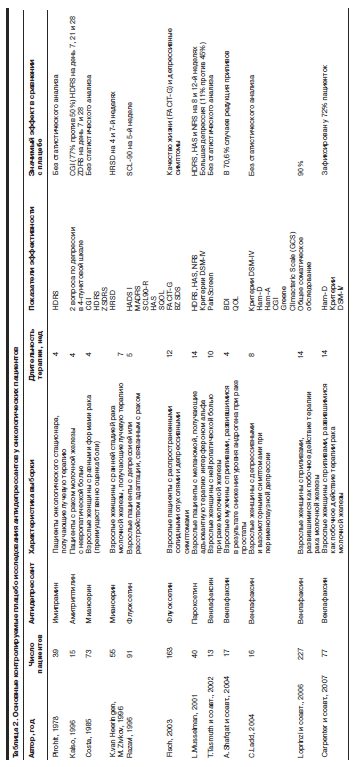
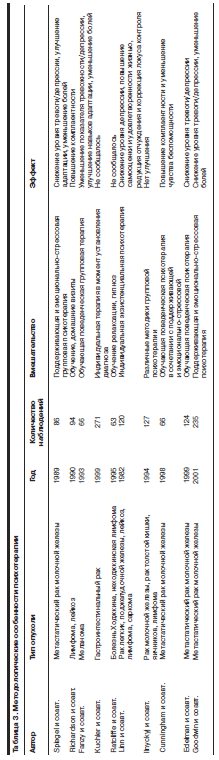
В современной медицине отмечается отчетливая тенденция к развитию системы психиатрической и психологической помощи онкологическим пациентам, о чем свидетельствует неуклонно возрастающее число исследований эффективности разных методов психофармако- и психотерапии в онкологической практике (Е.Ф.Бажин, А.В.Гнездилов, 1983; А.В.Асеев и соавт., 1995; А.В.Алясова и соавт., 2002; А.В.Гнездилов, 2002; И.Г.Терентьев и соавт., 2004; N.Biglia и соавт., 2005; A.van Gool и соавт., 2005; D.Carroll и соавт., 2006). В табл. 2 приведены основные характеристики контролируемых плацебо исследований антидепрессантов, применявшихся в терапии пациентов с онкологической патологией.
Хотя в цитированных работах показания к назначению антидепрессантов не ограничивались собственно психическими расстройствами (депрессивными, тревожно-депрессивными) и в ряде исследований главной целью назначения тимоаналептиков было купирование соматовегетативной симптоматики, включая нейропатическую боль или приливы (как осложнение гормональной терапии опухолей), их авторами предусматривалась оценка динамики депрессивной и тревожной симптоматики (в качестве основного или дополнительного показателя эффективности) по стандартным шкалам: шкала депрессии Гамильтона (HAM-D), шкала тревоги Гамильтона (HAM-A), шкала депрессии Монтгомери–Асберг (HAM-D), госпитальная шкала тревоги и депрессии (HADS), шкала общего клинического впечатления (CGI) и др.
Полученные в этих исследованиях данные подтверждают широкий спектр клинической эффективности антидепрессантов разных классов, включая трициклические антидепрессанты (ТЦА – амитриптилин, имипрамин), селективные ингибиторы обратного захвата серотонина (СИОЗС – пароксетин, флуоксетин), норадренергические селективные серотонинергические антидепрессанты (НАССА – миансерин) и так называемые препараты двойного действия – ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН – венлафаксин). В первую очередь следует отметить высокие доли респондеров по показателям редукции симптомов гипотимии в рамках аффективных расстройств (дистимия, депрессивный эпизод), превышающие 60%. Однако, как можно видеть, применение антидепрессантов, способных воздействовать на 2 нейротрансмиттерные системы и более (ТЦА, ИОЗСН), позволяет успешно сочетать собственно тимоаналептическое действие с благоприятными соматотропными эффектами, что реализуется в высоких показателях эффективности воздействия на болевые синдромы и соматовегетативные расстройства в форме приливов, развивающихся в качестве побочных эффектов терапии раковых опухолей как у женщин при раке молочной железы (S.Loibl и соавт., 2005; J.Carpenter, A.Storniolo и соавт., 2007; C.Loprinzi и соавт., 2006; D.Barton и соавт., 2002; C.Ladd и соавт., 2005), так и мужчин при раке предстательной железы (A.Shafqat и соавт., 2004; S.Quella и соавт., 1999). Также следует отметить и ряд других работ, свидетельствующих об успешном применении современных антидепрессантов класса ИОЗСН (венлафаксин) для коррекции неврологических осложнений химиотерапии, включая нейропатическую боль (T.Tasmuth и соавт., 2002; D.Grothe и соавт., 2004), нейросенсорную токсичность (J.Durand и соавт., 2002, 2003), постмастэктомический болевой синдром (S.Reuben, 2004) и стойкую нейропатию (J.Durand и соавт., 2005).
В контексте переносимости и безопасности предпочтение отдается антидепрессантам новых поколений (СИОЗС, ИОЗСН), значительно превосходящих по этим показателям препараты первого поколения (ТЦА) (Б.А.Волель, Д.В.Романов, 2007; M.Fisch 2004; F.Ashbury и соавт., 2003; J.Williams Jr. и соавт., 2000; M.Fisch и соавт., 1999; Center for Drug Evaluation and Research, 2004; S.Passik, 2002; G.Emslie и соавт., 1997; G.Emslie и соавт., 2002; M.Keller и соавт., 2001; K.Wagner и соавт., 2003; Medicines and Healthcare Products Regulatory Agency, 2003).
Широкое применение в оказании психологической помощи онкологическим пациентам находит психотерапия. На сегодня опубликовано большое число работ, свидетельствующих об эффективности психотерапевтического воздействия на всех этапах онкологического заболевания, начиная с ситуации первого сообщения пациенту о подозрении или наличии злокачественного новообразования, затем в условиях госпитального обследования и лечения и далее вплоть до терминальных стадий, включая службы хосписа (И.Г.Малкина-Пых, 2003; W.Redd, 1993). При этом круг задач, решаемых методами психотерапии, весьма широк и включает индивидуальные и групповые методы работы с пациентами и опекающими их родственниками, направленные на купирование тревожной и депрессивной симптоматики, коррекцию дезадаптивных форм поведения (в том числе нарушения комплаентности к терапии основного заболевания), формирование адекватного образа болезни и выработку навыков по преодолению проблем, связанных с ситуацией онкологической патологии, например помощь в совладании с болевыми и другими тягостными соматическими симптомами заболевания, изменения в социальной роли и пр. (Spiegel и соавт., 1989; Goodwin и соавт., 2001).
В целом в подавляющем большинстве публикаций сообщается о высоких результатах применения психотерапии в контексте улучшения самочувствия, поведения и адаптации больных (Fanzy и соавт., 1993; Kuchler и соавт., 1995; Ratcliffe и соавт., 1999). По мнению ряда авторов, успешное психотерапевтическое воздействие в конечном итоге может способствовать повышению выживаемости пациентов с злокачественными новообразованиями (Edelman и соавт., 1999; Cunningham и соавт., 1998; Linn и соавт., 1999), что соотносится, в частности, с данными о негативном влиянии коморбидной психической патологии на продолжительность жизни онкологических пациентов (F.Sirois, 1993; D.Razavi, F.Stiefel, 1994; W.Breitbart, 1995).
Таким образом, можно констатировать, что накопленный на сегодня клинический опыт свидетельствует о высокой потребности и значительной эффективности применения психофармако- и психотерапии как при коррекции отдельных (психопатологических, психологических и социальных) нарушений, сопряженных с онкологической патологией, так и в отношении отдаленного прогноза раковых заболеваний в показателях продолжительности жизни пациентов. В то же время доступные данные не позволяют выработать какие-либо конкретные рекомендации в отношении показаний, выбора методик, доз препаратов/частоты сеансов психотерапии, что обусловлено не только и не столько недостаточным количеством клинических фактов и/или существенными методологическими различиями выполненных исследований, сколько разобщенностью двух основных – психофармакологического и психотерапевтического – подходов к решению проблемы лечения психических расстройств, коморбидных онкологической патологии. Соответственно сохраняется актуальность разработки интегративных подходов, обеспечивающих возможность дифференцированного применения разных методов психофармако- и психотерапии с учетом клинических особенностей психических и соматических расстройств в рамках каждой из нозологических категорий онкологической патологии, особенно в свете данных современных исследований о значительной гетерогенности злокачественных новообразований в плане распределения различных форм психической патологии (M.Massie, 2004). В качестве наиболее адекватного базисного принципа для разработки интегративного терапевтического подхода к лечению онкологических пациентов с нозогенными реакциями может рассматриваться психопатологическая составляющая на уровне симптомов-мишеней – принцип, нашедший широкое применение в клинической психиатрии (F.Feyhan, 1971).
Цель настоящего исследования – изучение эффективности и безопасности дифференцированного клинического подхода к назначению психофармакотерапии и психотерапии при нозогенных реакциях у больных со злокачественными новообразованиями в области желудка.
Материалы и методы
Исследование проведено сотрудниками отделения соматогенной психической патологии (зав. – д-р мед. наук С.В.Иванов) отдела по изучению пограничной психической патологии и психосоматических расстройств (руководитель – акад. РАМН А.Б.Смулевич) Научного центра психического здоровья РАМН (директор – акад. РАМН А.С. Тиганов) на базе Российского онкологического научного центра им. Н.Н. Блохина (директор – акад. РАН и РАМН М.И.Давыдов) РАМН.
В исследование включали пациентов с верифицированным диагнозом злокачественного новообразования в области желудка, психическое состояние которых определялось тревожно-депрессивными и тревожно-диссоциативными нозогенными реакциями, из числа больных, госпитализированных в отделения РОНЦ им. Н.Н.Блохина.
Исключали больных, состояние которых не позволяло выполнить психопатологическое и психологическое обследование в необходимом для оценки объеме: тяжелое соматическое заболевание, умственная отсталость (F71– F79 по МКБ-10), грубое органическое поражение ЦНС (F00–F09), прогредиентная шизофрения с выраженными изменениями личности (F20–F29), злоупотребление психоактивными веществами (F10–F19).
Длительность заболевания от даты выявления злокачественного новообразования желудка варьировала от 0,5 до 4,5 года (в среднем 1,6 года). Распределение пациентов по стадиям опухолевого процесса было примерно равным с некоторым преобладанием больных с III и IV стадиями: I – 14,6%; II – 23,3%; III – 34,5%; IV – 27,6%.
Большинство пациентов были подвергнуты оперативному лечению – 71 (73,19%) больной, другая часть получала полихимиотерапию (ПХТ) – 21 (21,64%) больной, у остальных 5 (5,17%) больных применяли комбинированное лечение – ПХТ + оперативное вмешательство.
Терапия. Лечение нозогенных реакций проводилось с применением методов психофармакологической и психотерапевтической коррекции. Психотерапию осуществляли сотрудники отдела по изучению пограничной психической патологии и психосоматических расстройств НЦПЗ РАМН О.А.Сиранчиева и Д.А.Бескова.
Стартовый метод терапии выбирали эмпирически с учетом клинической типологии нозогенных реакций при раке желудка (А.Б.Смулевич и соавт., 2007) в соответствии с показаниями по следующей схеме: 1) умеренные и тяжелые диссоциативные реакции – психотерапия (1 группа, n=62); 2) легкие тревожно-диссоциативные реакции – анксиолитик (2 группа, n=15); 3) тревожно-депрессивные реакции – антидепрессант (3-я группа, n=20). В случаях назначения психотерапии предусматривали возможность изменения стартовой схемы терапии в зависимости от динамики состояния пациента с последующим присоединением психофармакотерапии в рамках комбинированного воздействия или замены на лекарственную терапию при наличии соответствующих показаний.
Клиническим обоснованием выбора метода лечебного воздействия служили клинические и экспериментально-психологические характеристики каждого из выделенных типов нозогенных реакций при раке желудка.
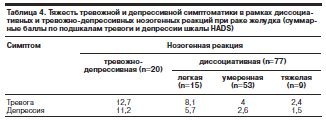
Умеренные и тяжелые диссоциативные реакции (1 группа, n=62) сопряжены с выраженным снижением уровня комплаентности, с отказом от определенных диагностических процедур и методов лечения вплоть до полного прекращения наблюдения и лечения (в случаях тяжелых диссоциативных реакций). При этом проявления латентной тревоги минимальны или вовсе отсутствуют (табл. 4). Соответственно главной задачей становится формирование максимально адаптивных (в рамках ресурсов личности) способов реагирования на болезнь, не сопровождающихся отрицанием реальности болезни, отказом от лечения и другими нарушениями комплаентности с помощью психотерапии, тогда как собственно фармакологические симптомы-мишени на момент начала лечения не выявляются.
Клиническая картина легкой диссоциативной реакции (группа 2, n=15) определяется минимальными признаками отчуждения (при адекватном уровне комплаентности) с отчетливыми признаками стойкой латентной тревоги, реализующимися в первую очередь лабильностью аффекта с эпизодическими (1–3 дня) нарушениями сна (преимущественно ранняя и средняя инсомния) и снижением аппетита. Для купирования подобных психопатологических расстройств представляется адекватным назначение анксиолитика с целью купирования тревожных расстройств.
При тревожно-депрессивных реакциях (группа 3, n=20) на первый план в клинической картине выступают явления генерализованной тревоги с танатофобией, опасениями беспомощности, утяжеления клиники заболевания и развития осложнений. Во всех случаях указанные тревожные расстройства дополняются явлениями стойкой гипотимии (подавленность, эпизоды тоскливости или дисфории в связи с негативной информацией о болезни, чрезмерно пессимистическая оценка перспектив лечения), которые, однако, не достигают уровня завершенного депрессивного синдрома, а сохраняют в определенной степени подчиненное положение по отношению к явлениям патологической тревоги и обнаруживают отчетливый параллелизм динамики с тревожной патологией. Также выявляются полиморфные соматоформные расстройства с мигрирующими и изменчивыми по интенсивности алгическими симптомами и функциональными нарушениями разной топической проекции (нарушения кожной чувствительности, тахикардия и экстрасистолия, учащенное мочеиспускание и пр.). Соответственно, учитывая синдромальную завершенность и полиморфизм психопатологической симптоматики, тревожно-депрессивные реакции, определяют показания к психофармакотерапии антидепрессантами.
Психотерапию (визуально-кинестетическая диссоциация, нейролингвистическое программирование, рефрейминг) назначали 2-недельными курсами по 6 сеансов, продолжительность каждого сеанса составила 1–1,5 ч.
Психофармакотерапию проводили с применением одного из 4 антидепрессантов (эсциталопрам, флувоксамин, сертралин, венлафаксин) или небензодиазепинового анксиолитика афобазола в соответствии с приведенным выше подходом к выбору метода лечения. Средства фармакотерапии назначали в следующих стартовых дозах: эсциталопрам 10 мг (1 раз в сутки), флувоксамин 25 мг (1 раз в сутки), сертралин 50 мг (1 раз в сутки), венлафаксин 75 мг (2 раза в сутки), феварин 75 мг (1 раз в сутки), афобазол 30 мг (3 раза в сутки). Лечение каждым препаратом проводилось в течение 6 нед. Начиная с 10-го дня терапии при неудовлетворительном терапевтическом эффекте допускали повышение стартовой суточной дозы, но не выше стандартной максимальной дозы (эсциталопрам – 20 мг/сут, флувоксамин – 300 мг/сут, сертралин – 200 мг/сут, венлафаксин – 375 мг/сут, афобазол – 60 мг/сут) в зависимости от эффективности и переносимости. В случаях стойких инсомнических расстройств назначали гипнотики (производные бензодиазепина короткого действия) с длительностью регулярного ежедневного приема не более 7 дней.
Досрочную отмену психофармакотерапии предусматривали в следующих случаях: отсутствие эффекта по завершении 4-й недели терапии; клинически значимое утяжеление тревожно-депрессивных расстройств; выраженные нежелательные явления; отказ пациента от лечения/утраты контакта с пациентом.
Для оценки эффективности лечения использовали следующие инструменты: госпитальная шкала тревоги и депрессии (HADS); шкала тревоги Гамильтона (HAM-D); шкала общего клинического впечатления (CGI) для оценки тяжести заболевания (CGI-тяжесть) и улучшения (CGI-улучшение).
Учитывая значительную клиническую гетерогенность нозогенных реакций и различия в методах терапевтического воздействия, в качестве основного критерия эффективности был избран наиболее универсальный для клинической оценки показатель – балл шкалы CGI-I (улучшение) 1,7 (интервал между 1 – «очень выраженное улучшение» и 2 – «выраженное улучшение»). Пациентов с указанными баллами CGI-I на момент завершения считали респондерами.
Статистический анализ проводили с помощью программных пакетов «Statistica 6.0 for Windows». Поскольку объемы выборок не позволили обеспечить достоверно не смещенные параметры распределения (в частности, среднее и дисперсию распределения), то для проверки гипотез о значимости различий использовали непараметрический U-тест Манна–Уитни (в качестве достоверного рассматривали уровень вероятности p<0,05).
Результаты
Получены данные, подтверждающие эффективность дифференцированного подхода к назначению средств психофармакотерапии и методов психотерапии в зависимости от клинической типологии нозогенных реакций, о чем свидетельствуют высокие доли пациентов во всех трех терапевтических группах, у которых достигнуты главные цели терапии – формирование адекватной комплаентности с помощью психотерапии, купирование тревожной и депрессивной симптоматики средствами психофармакотерапии. При этом следует отметить, что в изученной выборке не зафиксировано ни одного случая полной и стойкой ремиссии. Этот факт объясняется в первую очередь непрерывным и сравнительно сильным стрессовым фактором – собственно онкологическим заболеванием и связанными с ним обстоятельствами (диагностические процедуры, лечение, симптоматические осложнения, побочные эффекты лечения и пр.). Соответственно, полная редукция тревожной симптоматики в подобных условиях представляется маловероятной, а адекватная цель психофармакологического воздействия определяется как достижение максимально возможной и стойкой редукции психопатологической симптоматики.
В группе умеренной/тяжелой диссоциативной нозогенной реакции (n=62) предпринятое психотерапевтическое вмешательство обеспечивало достижение главной цели – коррекцию аномального отрицания онкологического заболевания с формированием адекватной комплаентности в подавляющем числе случаев (60 из 62 пациентов). Исключение составили 2 пациента с тяжелой диссоциацией, у которых отмечены лишь минимальные изменения в поведении, что в конечном итоге сопровождалось отказом от рекомендованного дальнейшего онкологического наблюдения после выписки из стационара1.
В остальных 60 наблюдениях психотерапия способствовала формированию более адекватного отношения к ситуации болезни и в среднем через 3–4 сеанса (2–3 нед лечения) с коррекцией комплаентности и выполнением всех или (как минимум) витально необходимых диагностических и лечебных назначений. Однако в ходе психотерапии у большинства пациентов с успешной коррекцией диссоциативных расстройств – 47 (78,3%) из 60 пациентов – отмечена трансформация клинической картины с формированием тревожно-депрессивного состояния – 39 (65%) из 60 пациентов, или редукцией умеренной/тяжелой диссоциативной реакции до уровня легкой диссоциативной нозогении – 8 (13,3%) из 60 пациентов. Соответственно, респондеры на психотерапевтическое воздействие составили лишь 21% (13 из 62 больных в 1-й группе) – пациенты с восстановлением удовлетворительного уровня комплаентности без манифестации клинически выраженной тревожной или депрессивной симптоматики.
В указанных 47 случаях при видоизменении диссоциативных расстройств с формированием патологических реакций иного типа проводили замену психотерапии на фармакологическое лечение: 39 пациентам с манифестацией тревожно-депрессивного расстройства переведены на терапию антидепрессантом, в 8 случаях редукции до уровня легкой диссоциативной нозогении назначен анксиолитик афобазол. Эти пациенты включены в анализ эффективности фармакотерапии (тимоаналептиками или анксиолитиками соответственно), представленный ниже.
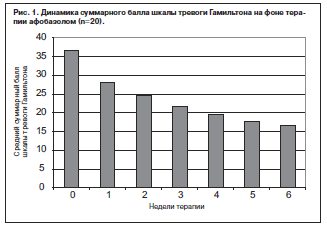
В группе легкой диссоциативной реакции (n=15, в том числе 8 пациентов, переведенных из группы 1) редукция симптомов тревоги в той или иной степени отмечена у всех пациентов, что подтверждается динамикой стартового суммарного балла шкалы тревоги Гамильтона (рис. 1).
Высокая общая эффективность лечения находит отражение также и в результатах оценки по шкалам общего клинического впечатления – CGI-тяжесть и CGI-улучшение. Стартовый средний суммарный балл CGI-тяжесть, составивший 4,3 (интервал между 4 – «умеренно болен» и 5 – «явно болен»), снизился через 6 нед терапии до 2,2 (интервал между 2 – «пограничное состояние» и 3 – «в легкой степени болен»). Средний суммарный балл шкалы CGI-улучшение на финальном визите (6-я неделя) составил 1,7 (интервал между 1 – «очень выраженное улучшение» и 2 – «выраженное улучшение»).
По завершении терапии респондеры (пациенты с редукцией исходного суммарного балла по шкале оценки тревоги Гамильтона более 50%) составили 67% от общего числа пациентов.
Эффект афобазола был клинически значимым у большинства – 16 (80%) из 20 пациентов, получавших данный анксиолитик (легкая диссоциативная реакция с минимальными клиническими признаками патологической тревоги), характеризовался отчетливой редукцией уровня тревоги и тревожных опасений без признаков седации в дневное время. Во всех случаях неудовлетворительного эффекта терапии (4 наблюдения) выявлена полиморфная тревожная симптоматика (множественные фобии, соматизированные расстройства) и стойкая инсомния.
Афобазол хорошо переносился пациентами. Побочные эффекты зафиксированы в 8 случаях (тошнота – 4, дневная сонливость – 4), были преимущественно легкой степени и редуцировались без изменения схемы терапии. Токсических эффектов и клинически значимых изменений лабораторных и инструментальных показателей, связанных с приемом афобазола, не зафиксировано, каких-либо признаков взаимодействия с препаратами химиотерапии не отмечено.
В группе тревожно-депрессивных нозогенных реакций (n=59, включая пациентов, переведенных из группы 1) установлена высокая эффективность фармакотерапии современными антидепрессантами, о чем свидетельствуют установленные доли респондеров: 79% больных с более чем 50% редукцией стартовых баллов HADS (рис. 2, 3).
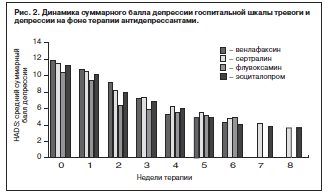
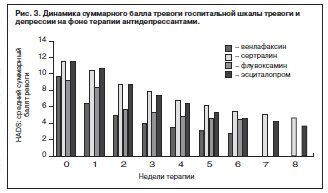
Высокая общая эффективность лечения находит отражение также и в результатах оценки по шкалам общего клинического впечатления – CGI-тяжесть и CGI-улучшение. Стартовый средний суммарный балл CGI-тяжесть, составивший 4,7 (интервал между 4 – «умеренно болен» и 5 – «явно болен»), снизился через 6 нед терапии до 2,2 (интервал между 2 – «пограничное состояние» и 3 – «в легкой степени болен»). Средний суммарный балл шкалы CGI-улучшение на финальном визите (6-я неделя) составил 1,8 (интервал между 1 – «очень выраженное улучшение» и 2 – «выраженное улучшение»).
Также следует отметить достаточно быструю реализацию антидепрессивного и анксиолитического эффекта с достоверной (р<0,05) редукцией стартовых суммарных баллов тревоги и депрессии по HADS через 5 и 7 дней соответственно у большинства (65%) респондеров.
В то же время полная и стойкая ремиссия с длительностью минимум 4 нед отмечена лишь у 3 пациентов с начальными стадиями рака желудка (I–II) после успешной радикальной хирургической операции, которым не требовалась дополнительная консервативная терапия раковой опухоли.
Наряду с высоким уровнем эффективности обращает на себя внимание низкий уровень средних доз, на которых был получен значимый терапевтический эффект: эсциталопрам 10 мг/сут; флувоксамин 41,4 мг/сут; сертралин 72,3 мг/сут; венлафаксин 88,8 мг/сут. По сути указанные дозы соответствуют минимальным рекомендуемым терапевтическим дозам приведенных антидепрессантов. В соответствии с идентичными по дизайну протоколами исследований каждый из антидепрессантов назначен в минимальной терапевтической дозе с ее последующей коррекцией по принципу достаточного минимума, который определяли двумя критериями – достижение значимого клинического эффекта и переносимость препарата. По результатам лечения основным фактором, ограничивающим эскалацию стартовой дозы каждого препарата, является значимый терапевтический эффект, тогда как побочные эффекты влияли на процесс титрации дозы лишь в единичных (4 из 59 пациентов) наблюдениях.
Как отмечено выше, длительность курсов терапии рассматриваемыми антидепрессантами была относительно небольшой – 6–8 нед. Однако по истечении предусмотренного протоколом срока лечения пациенты оставались под наблюдением, что способствовало отдаленной оценке результатов терапии. Во всех случаях терапевтического эффекта попытки отмены препаратов приводили к возобновлению тревожной и депрессивной симптоматики и диссоциативных расстройств в среднем через 2–4 дня после приема последней дозы. При этом симптомы отмены не зафиксированы, на основании чего можно сделать вывод о том, что в пределах указанного срока регулярный прием антидепрессанта обеспечивает лишь лекарственную ремиссию. Подобные результаты объясняются природой нозогенных реакций у изученных пациентов – речь идет о психопатологических расстройствах, непосредственно связанных с хроническим и неразрешимым полностью (как минимум на период проведения исследования) онкологическим заболеванием. В пользу такого объяснения свидетельствуют и данные о единичных случаях полной ремиссии, сопряженных с наиболее благоприятным течением и высокими результатами терапии основного заболевания.
Переносимость тимоаналептической терапии была хорошей. Побочные эффекты развивались сравнительно редко и зафиксированы у 8 (13,5%) из 59 пациентов. В большинстве наблюдений побочные эффекты были представлены единичными и легкими по своим проявлениям симптомами, которые развивались в течение первых 10 дней фармакотерапии и спонтанно редуцировались без каких-либо изменений в схеме приема препаратов. Как отмечено, только у 4 больных в связи с выраженностью побочных эффектов потребовалось вмешательство в схему терапии: 2 случая снижения дозы и 2 случая отмены препарата из-за непереносимости побочных эффектов. Во всех 4 наблюдениях главной причиной снижения дозы или отмены была тошнота. Следует отметить, что данный побочный эффект, свойственный большинству современных антидепрессантов с серотонинергическим механизмом действия, приобретает особое значение в онкологической клинике, поскольку относится к числу наиболее субъективно тягостных и стойких побочных эффектов химиотерапии. Онкологические пациенты, как правило, подробно информированные о нежелательных явлениях, связанных с химиотерапией, особенно настороженно относятся к подобным ощущениям. Соответственно, при первых признаках тошноты во время приема антидепрессанта негативная реакция больных со злокачественными образованиями представлена наиболее отчетливо и реализуется категорическим отказом от дальнейшего приема данного препарата независимо от медицинского заключения о более вероятной причинной связи тошноты с другими факторами.
В ходе исследования не зафиксировано ни одного случая неблагоприятных лекарственных взаимодействий между психотропными средствами и препаратами, использующимися для химиотерапии рака желудка. Учитывая данные по метаболизму цитостатиков, использовавшихся в терапии больных изученной выборки, риск взаимодействия антидепрессантов с этими лекарственными средствами можно считать минимальным (табл. 5).

Заключение
Полученные в проведенном исследовании данные представляются значимыми в прикладном аспекте и в первую очередь в плане оптимизации психиатрической и психологической помощи больным раком желудка, страдающим нозогенными реакциями. Хотя объем выборки нельзя признать достаточным для окончательного суждения, полученные данные позволяют сделать ряд важных с клинической точки зрения выводов, которые могут в значительной степени способствовать оптимизации психиатрической и психологической помощи онкологическим пациентам на лечебно-диагностическом этапе в условиях онкологического стационара.
Очевидно, что столь выраженная и распространенная диссоциативная симптоматика, значительно затрудняющая терапию, требует особого подхода с комбинированным применением методов психофармакологической и психотерапевтической коррекции. Особенно возрастает значение психотерапии, направленной на коррекцию неадекватного отношения к болезни и повышение уровня комплаентности с формированием осознания необходимости психофармакотерапии для купирования тревожной и диссоциативной симптоматики. При этом следует отметить, что в пределах данного исследования применение психотерапии ограничивалось задачей формирования адекватного уровня комплаентности, что, несомненно, представляет собой лишь малую часть широкого спектра возможностей для использования современных методов психотерапевтической коррекции у пациентов с онкологическими заболеваниями.
В случаях легких диссоциативных нозогенных реакций достигнут достаточно высокий эффект при использовании атипичного анксиолитика афобазола. Учитывая сравнительно умеренный противотревожный эффект этого препарата в сравнении с классическими бензодиазепиновыми препаратами (А.С.Аведисова и соавт., 2006; Г.Г.Незнамов и соавт., 2006; А.В.Васильева и соавт., 2006), можно предполагать, что в таких случаях могут быть эффективными и другие психофармакологические средства, обладающие анксиолитическими свойствами в сочетании с благоприятными профилями переносимости и безопасности. На основе полученных данных можно также высказать предположение, что легкие диссоциативные реакции могут успешно купироваться психотерапевтическими методиками, направленными в первую очередь на коррекцию латентной тревоги у таких пациентов.
Результаты оценки эффективности антидепрессантов согласуются с данными других исследователей о высокой эффективности препаратов этого класса в купировании тревожной и депрессивной симптоматики у пациентов с тревожно-депрессивными расстройствами. В то же время следует подчеркнуть отчетливую особенность представленных в данной публикации наблюдений, а именно: адекватность терапевтического ответа при минимальных терапевтических или даже субтерапевтических дозах медикаментов относительно стандартных рекомендаций для лечения тревожных и депрессивных состояний у психиатрических пациентов. По всей видимости, это объясняется преимущественно психогенной (нозогенной) природой изученных состояний, связанной с более высокой чувствительностью к терапевтическим эффектам тимоаналептиков (в первую очередь собственно антидепрессивному и противотревожному) в сравнении с больными, страдающими синдромально завершенными формами аффективной и тревожной патологии. Также следует указать на минимальный риск лекарственных взаимодействий, объясняющийся особенностями метаболизма применяемых в исследовании антидепрессантов и препаратов химиотерапии основного заболевания, использующихся в лечении рака желудка, в первую очередь отсутствие «перекреста» на уровне основных изоферментов печени, отвечающих за биотрансформацию указанных медикаментов. Данное обстоятельство можно считать дополнительным обоснованием более широкого применения современных тимоаналептиков для лечения тревожных и депрессивных расстройств у онкологических пациентов.
Таким образом, в ходе проведенного исследования получены предварительные данные о целесообразности дифференцированного, основанного на клинической типологии рассматриваемых психопатологических расстройств выбора методов психофармако- и психотерапии в купировании нозогенных реакций у больных раком желудка. В случаях умеренных/тяжелых диссоциативных реакций показана 2-этапная терапия: назначение психотерапевтических методик, способствующих коррекции аномального отрицания болезни и формированию удовлетворительного уровня комплаенса с последующим применением анксиолитиков или антидепрессантов при появлении соответствующих показаний. В случаях легких диссоциативных реакций целесообразно наиболее щадящее воздействие, направленное на купирование нетяжелой тревожно-ипохондрической симптоматики (в рамках латентной тревоги), которое может осуществляться с помощью анксиолитиков и, вероятно, соответствующих методик психотерапии. У пациентов с тревожно-депрессивными нозогенными реакциями целесообразно назначение современных селективных серотонин- и норадренергических антидепрессантов, обладающих благоприятными профилями переносимости и безопасности (включая минимальный риск лекарственных взаимодействий) с выбором минимальных или даже субминимальных терапевтических доз с учетом сравнительно высокого уровня лечебного эффекта, установленного в ходе представленного исследования.
Необходимость психофармакотерапии психических расстройств у больных со злокачественными новообразованиями, в первую очередь нозогенных реакций, определяется как высокой распространенностью рассматриваемых состояний, так и негативными последствиями (медицинскими, социальными) для исхода онкологических заболеваний (S.Davis-Ali и соавт., 1993; L.Dahlquist и соавт., 1993; D.Razavi, F.Stiefel, 1994; K.Nordin, B.Glimelius, 1999).
Согласно данным современных исследований в назначении психофармакотерапии нуждаются в среднем 50–90% онкологических больных (табл. 1).

В современной медицине отмечается отчетливая тенденция к развитию системы психиатрической и психологической помощи онкологическим пациентам, о чем свидетельствует неуклонно возрастающее число исследований эффективности разных методов психофармако- и психотерапии в онкологической практике (Е.Ф.Бажин, А.В.Гнездилов, 1983; А.В.Асеев и соавт., 1995; А.В.Алясова и соавт., 2002; А.В.Гнездилов, 2002; И.Г.Терентьев и соавт., 2004; N.Biglia и соавт., 2005; A.van Gool и соавт., 2005; D.Carroll и соавт., 2006). В табл. 2 приведены основные характеристики контролируемых плацебо исследований антидепрессантов, применявшихся в терапии пациентов с онкологической патологией.

Хотя в цитированных работах показания к назначению антидепрессантов не ограничивались собственно психическими расстройствами (депрессивными, тревожно-депрессивными) и в ряде исследований главной целью назначения тимоаналептиков было купирование соматовегетативной симптоматики, включая нейропатическую боль или приливы (как осложнение гормональной терапии опухолей), их авторами предусматривалась оценка динамики депрессивной и тревожной симптоматики (в качестве основного или дополнительного показателя эффективности) по стандартным шкалам: шкала депрессии Гамильтона (HAM-D), шкала тревоги Гамильтона (HAM-A), шкала депрессии Монтгомери–Асберг (HAM-D), госпитальная шкала тревоги и депрессии (HADS), шкала общего клинического впечатления (CGI) и др.
Полученные в этих исследованиях данные подтверждают широкий спектр клинической эффективности антидепрессантов разных классов, включая трициклические антидепрессанты (ТЦА – амитриптилин, имипрамин), селективные ингибиторы обратного захвата серотонина (СИОЗС – пароксетин, флуоксетин), норадренергические селективные серотонинергические антидепрессанты (НАССА – миансерин) и так называемые препараты двойного действия – ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН – венлафаксин). В первую очередь следует отметить высокие доли респондеров по показателям редукции симптомов гипотимии в рамках аффективных расстройств (дистимия, депрессивный эпизод), превышающие 60%. Однако, как можно видеть, применение антидепрессантов, способных воздействовать на 2 нейротрансмиттерные системы и более (ТЦА, ИОЗСН), позволяет успешно сочетать собственно тимоаналептическое действие с благоприятными соматотропными эффектами, что реализуется в высоких показателях эффективности воздействия на болевые синдромы и соматовегетативные расстройства в форме приливов, развивающихся в качестве побочных эффектов терапии раковых опухолей как у женщин при раке молочной железы (S.Loibl и соавт., 2005; J.Carpenter, A.Storniolo и соавт., 2007; C.Loprinzi и соавт., 2006; D.Barton и соавт., 2002; C.Ladd и соавт., 2005), так и мужчин при раке предстательной железы (A.Shafqat и соавт., 2004; S.Quella и соавт., 1999). Также следует отметить и ряд других работ, свидетельствующих об успешном применении современных антидепрессантов класса ИОЗСН (венлафаксин) для коррекции неврологических осложнений химиотерапии, включая нейропатическую боль (T.Tasmuth и соавт., 2002; D.Grothe и соавт., 2004), нейросенсорную токсичность (J.Durand и соавт., 2002, 2003), постмастэктомический болевой синдром (S.Reuben, 2004) и стойкую нейропатию (J.Durand и соавт., 2005).
В контексте переносимости и безопасности предпочтение отдается антидепрессантам новых поколений (СИОЗС, ИОЗСН), значительно превосходящих по этим показателям препараты первого поколения (ТЦА) (Б.А.Волель, Д.В.Романов, 2007; M.Fisch 2004; F.Ashbury и соавт., 2003; J.Williams Jr. и соавт., 2000; M.Fisch и соавт., 1999; Center for Drug Evaluation and Research, 2004; S.Passik, 2002; G.Emslie и соавт., 1997; G.Emslie и соавт., 2002; M.Keller и соавт., 2001; K.Wagner и соавт., 2003; Medicines and Healthcare Products Regulatory Agency, 2003).
Широкое применение в оказании психологической помощи онкологическим пациентам находит психотерапия. На сегодня опубликовано большое число работ, свидетельствующих об эффективности психотерапевтического воздействия на всех этапах онкологического заболевания, начиная с ситуации первого сообщения пациенту о подозрении или наличии злокачественного новообразования, затем в условиях госпитального обследования и лечения и далее вплоть до терминальных стадий, включая службы хосписа (И.Г.Малкина-Пых, 2003; W.Redd, 1993). При этом круг задач, решаемых методами психотерапии, весьма широк и включает индивидуальные и групповые методы работы с пациентами и опекающими их родственниками, направленные на купирование тревожной и депрессивной симптоматики, коррекцию дезадаптивных форм поведения (в том числе нарушения комплаентности к терапии основного заболевания), формирование адекватного образа болезни и выработку навыков по преодолению проблем, связанных с ситуацией онкологической патологии, например помощь в совладании с болевыми и другими тягостными соматическими симптомами заболевания, изменения в социальной роли и пр. (Spiegel и соавт., 1989; Goodwin и соавт., 2001).
В целом в подавляющем большинстве публикаций сообщается о высоких результатах применения психотерапии в контексте улучшения самочувствия, поведения и адаптации больных (Fanzy и соавт., 1993; Kuchler и соавт., 1995; Ratcliffe и соавт., 1999). По мнению ряда авторов, успешное психотерапевтическое воздействие в конечном итоге может способствовать повышению выживаемости пациентов с злокачественными новообразованиями (Edelman и соавт., 1999; Cunningham и соавт., 1998; Linn и соавт., 1999), что соотносится, в частности, с данными о негативном влиянии коморбидной психической патологии на продолжительность жизни онкологических пациентов (F.Sirois, 1993; D.Razavi, F.Stiefel, 1994; W.Breitbart, 1995).

Таким образом, можно констатировать, что накопленный на сегодня клинический опыт свидетельствует о высокой потребности и значительной эффективности применения психофармако- и психотерапии как при коррекции отдельных (психопатологических, психологических и социальных) нарушений, сопряженных с онкологической патологией, так и в отношении отдаленного прогноза раковых заболеваний в показателях продолжительности жизни пациентов. В то же время доступные данные не позволяют выработать какие-либо конкретные рекомендации в отношении показаний, выбора методик, доз препаратов/частоты сеансов психотерапии, что обусловлено не только и не столько недостаточным количеством клинических фактов и/или существенными методологическими различиями выполненных исследований, сколько разобщенностью двух основных – психофармакологического и психотерапевтического – подходов к решению проблемы лечения психических расстройств, коморбидных онкологической патологии. Соответственно сохраняется актуальность разработки интегративных подходов, обеспечивающих возможность дифференцированного применения разных методов психофармако- и психотерапии с учетом клинических особенностей психических и соматических расстройств в рамках каждой из нозологических категорий онкологической патологии, особенно в свете данных современных исследований о значительной гетерогенности злокачественных новообразований в плане распределения различных форм психической патологии (M.Massie, 2004). В качестве наиболее адекватного базисного принципа для разработки интегративного терапевтического подхода к лечению онкологических пациентов с нозогенными реакциями может рассматриваться психопатологическая составляющая на уровне симптомов-мишеней – принцип, нашедший широкое применение в клинической психиатрии (F.Feyhan, 1971).
Цель настоящего исследования – изучение эффективности и безопасности дифференцированного клинического подхода к назначению психофармакотерапии и психотерапии при нозогенных реакциях у больных со злокачественными новообразованиями в области желудка.
Материалы и методы
Исследование проведено сотрудниками отделения соматогенной психической патологии (зав. – д-р мед. наук С.В.Иванов) отдела по изучению пограничной психической патологии и психосоматических расстройств (руководитель – акад. РАМН А.Б.Смулевич) Научного центра психического здоровья РАМН (директор – акад. РАМН А.С. Тиганов) на базе Российского онкологического научного центра им. Н.Н. Блохина (директор – акад. РАН и РАМН М.И.Давыдов) РАМН.
В исследование включали пациентов с верифицированным диагнозом злокачественного новообразования в области желудка, психическое состояние которых определялось тревожно-депрессивными и тревожно-диссоциативными нозогенными реакциями, из числа больных, госпитализированных в отделения РОНЦ им. Н.Н.Блохина.
Исключали больных, состояние которых не позволяло выполнить психопатологическое и психологическое обследование в необходимом для оценки объеме: тяжелое соматическое заболевание, умственная отсталость (F71– F79 по МКБ-10), грубое органическое поражение ЦНС (F00–F09), прогредиентная шизофрения с выраженными изменениями личности (F20–F29), злоупотребление психоактивными веществами (F10–F19).
Длительность заболевания от даты выявления злокачественного новообразования желудка варьировала от 0,5 до 4,5 года (в среднем 1,6 года). Распределение пациентов по стадиям опухолевого процесса было примерно равным с некоторым преобладанием больных с III и IV стадиями: I – 14,6%; II – 23,3%; III – 34,5%; IV – 27,6%.
Большинство пациентов были подвергнуты оперативному лечению – 71 (73,19%) больной, другая часть получала полихимиотерапию (ПХТ) – 21 (21,64%) больной, у остальных 5 (5,17%) больных применяли комбинированное лечение – ПХТ + оперативное вмешательство.
Терапия. Лечение нозогенных реакций проводилось с применением методов психофармакологической и психотерапевтической коррекции. Психотерапию осуществляли сотрудники отдела по изучению пограничной психической патологии и психосоматических расстройств НЦПЗ РАМН О.А.Сиранчиева и Д.А.Бескова.
Стартовый метод терапии выбирали эмпирически с учетом клинической типологии нозогенных реакций при раке желудка (А.Б.Смулевич и соавт., 2007) в соответствии с показаниями по следующей схеме: 1) умеренные и тяжелые диссоциативные реакции – психотерапия (1 группа, n=62); 2) легкие тревожно-диссоциативные реакции – анксиолитик (2 группа, n=15); 3) тревожно-депрессивные реакции – антидепрессант (3-я группа, n=20). В случаях назначения психотерапии предусматривали возможность изменения стартовой схемы терапии в зависимости от динамики состояния пациента с последующим присоединением психофармакотерапии в рамках комбинированного воздействия или замены на лекарственную терапию при наличии соответствующих показаний.
Клиническим обоснованием выбора метода лечебного воздействия служили клинические и экспериментально-психологические характеристики каждого из выделенных типов нозогенных реакций при раке желудка.
Умеренные и тяжелые диссоциативные реакции (1 группа, n=62) сопряжены с выраженным снижением уровня комплаентности, с отказом от определенных диагностических процедур и методов лечения вплоть до полного прекращения наблюдения и лечения (в случаях тяжелых диссоциативных реакций). При этом проявления латентной тревоги минимальны или вовсе отсутствуют (табл. 4). Соответственно главной задачей становится формирование максимально адаптивных (в рамках ресурсов личности) способов реагирования на болезнь, не сопровождающихся отрицанием реальности болезни, отказом от лечения и другими нарушениями комплаентности с помощью психотерапии, тогда как собственно фармакологические симптомы-мишени на момент начала лечения не выявляются.

Клиническая картина легкой диссоциативной реакции (группа 2, n=15) определяется минимальными признаками отчуждения (при адекватном уровне комплаентности) с отчетливыми признаками стойкой латентной тревоги, реализующимися в первую очередь лабильностью аффекта с эпизодическими (1–3 дня) нарушениями сна (преимущественно ранняя и средняя инсомния) и снижением аппетита. Для купирования подобных психопатологических расстройств представляется адекватным назначение анксиолитика с целью купирования тревожных расстройств.
При тревожно-депрессивных реакциях (группа 3, n=20) на первый план в клинической картине выступают явления генерализованной тревоги с танатофобией, опасениями беспомощности, утяжеления клиники заболевания и развития осложнений. Во всех случаях указанные тревожные расстройства дополняются явлениями стойкой гипотимии (подавленность, эпизоды тоскливости или дисфории в связи с негативной информацией о болезни, чрезмерно пессимистическая оценка перспектив лечения), которые, однако, не достигают уровня завершенного депрессивного синдрома, а сохраняют в определенной степени подчиненное положение по отношению к явлениям патологической тревоги и обнаруживают отчетливый параллелизм динамики с тревожной патологией. Также выявляются полиморфные соматоформные расстройства с мигрирующими и изменчивыми по интенсивности алгическими симптомами и функциональными нарушениями разной топической проекции (нарушения кожной чувствительности, тахикардия и экстрасистолия, учащенное мочеиспускание и пр.). Соответственно, учитывая синдромальную завершенность и полиморфизм психопатологической симптоматики, тревожно-депрессивные реакции, определяют показания к психофармакотерапии антидепрессантами.
Психотерапию (визуально-кинестетическая диссоциация, нейролингвистическое программирование, рефрейминг) назначали 2-недельными курсами по 6 сеансов, продолжительность каждого сеанса составила 1–1,5 ч.
Психофармакотерапию проводили с применением одного из 4 антидепрессантов (эсциталопрам, флувоксамин, сертралин, венлафаксин) или небензодиазепинового анксиолитика афобазола в соответствии с приведенным выше подходом к выбору метода лечения. Средства фармакотерапии назначали в следующих стартовых дозах: эсциталопрам 10 мг (1 раз в сутки), флувоксамин 25 мг (1 раз в сутки), сертралин 50 мг (1 раз в сутки), венлафаксин 75 мг (2 раза в сутки), феварин 75 мг (1 раз в сутки), афобазол 30 мг (3 раза в сутки). Лечение каждым препаратом проводилось в течение 6 нед. Начиная с 10-го дня терапии при неудовлетворительном терапевтическом эффекте допускали повышение стартовой суточной дозы, но не выше стандартной максимальной дозы (эсциталопрам – 20 мг/сут, флувоксамин – 300 мг/сут, сертралин – 200 мг/сут, венлафаксин – 375 мг/сут, афобазол – 60 мг/сут) в зависимости от эффективности и переносимости. В случаях стойких инсомнических расстройств назначали гипнотики (производные бензодиазепина короткого действия) с длительностью регулярного ежедневного приема не более 7 дней.
Досрочную отмену психофармакотерапии предусматривали в следующих случаях: отсутствие эффекта по завершении 4-й недели терапии; клинически значимое утяжеление тревожно-депрессивных расстройств; выраженные нежелательные явления; отказ пациента от лечения/утраты контакта с пациентом.
Для оценки эффективности лечения использовали следующие инструменты: госпитальная шкала тревоги и депрессии (HADS); шкала тревоги Гамильтона (HAM-D); шкала общего клинического впечатления (CGI) для оценки тяжести заболевания (CGI-тяжесть) и улучшения (CGI-улучшение).
Учитывая значительную клиническую гетерогенность нозогенных реакций и различия в методах терапевтического воздействия, в качестве основного критерия эффективности был избран наиболее универсальный для клинической оценки показатель – балл шкалы CGI-I (улучшение) 1,7 (интервал между 1 – «очень выраженное улучшение» и 2 – «выраженное улучшение»). Пациентов с указанными баллами CGI-I на момент завершения считали респондерами.
Статистический анализ проводили с помощью программных пакетов «Statistica 6.0 for Windows». Поскольку объемы выборок не позволили обеспечить достоверно не смещенные параметры распределения (в частности, среднее и дисперсию распределения), то для проверки гипотез о значимости различий использовали непараметрический U-тест Манна–Уитни (в качестве достоверного рассматривали уровень вероятности p<0,05).
Результаты
Получены данные, подтверждающие эффективность дифференцированного подхода к назначению средств психофармакотерапии и методов психотерапии в зависимости от клинической типологии нозогенных реакций, о чем свидетельствуют высокие доли пациентов во всех трех терапевтических группах, у которых достигнуты главные цели терапии – формирование адекватной комплаентности с помощью психотерапии, купирование тревожной и депрессивной симптоматики средствами психофармакотерапии. При этом следует отметить, что в изученной выборке не зафиксировано ни одного случая полной и стойкой ремиссии. Этот факт объясняется в первую очередь непрерывным и сравнительно сильным стрессовым фактором – собственно онкологическим заболеванием и связанными с ним обстоятельствами (диагностические процедуры, лечение, симптоматические осложнения, побочные эффекты лечения и пр.). Соответственно, полная редукция тревожной симптоматики в подобных условиях представляется маловероятной, а адекватная цель психофармакологического воздействия определяется как достижение максимально возможной и стойкой редукции психопатологической симптоматики.
В группе умеренной/тяжелой диссоциативной нозогенной реакции (n=62) предпринятое психотерапевтическое вмешательство обеспечивало достижение главной цели – коррекцию аномального отрицания онкологического заболевания с формированием адекватной комплаентности в подавляющем числе случаев (60 из 62 пациентов). Исключение составили 2 пациента с тяжелой диссоциацией, у которых отмечены лишь минимальные изменения в поведении, что в конечном итоге сопровождалось отказом от рекомендованного дальнейшего онкологического наблюдения после выписки из стационара1.
В остальных 60 наблюдениях психотерапия способствовала формированию более адекватного отношения к ситуации болезни и в среднем через 3–4 сеанса (2–3 нед лечения) с коррекцией комплаентности и выполнением всех или (как минимум) витально необходимых диагностических и лечебных назначений. Однако в ходе психотерапии у большинства пациентов с успешной коррекцией диссоциативных расстройств – 47 (78,3%) из 60 пациентов – отмечена трансформация клинической картины с формированием тревожно-депрессивного состояния – 39 (65%) из 60 пациентов, или редукцией умеренной/тяжелой диссоциативной реакции до уровня легкой диссоциативной нозогении – 8 (13,3%) из 60 пациентов. Соответственно, респондеры на психотерапевтическое воздействие составили лишь 21% (13 из 62 больных в 1-й группе) – пациенты с восстановлением удовлетворительного уровня комплаентности без манифестации клинически выраженной тревожной или депрессивной симптоматики.
В указанных 47 случаях при видоизменении диссоциативных расстройств с формированием патологических реакций иного типа проводили замену психотерапии на фармакологическое лечение: 39 пациентам с манифестацией тревожно-депрессивного расстройства переведены на терапию антидепрессантом, в 8 случаях редукции до уровня легкой диссоциативной нозогении назначен анксиолитик афобазол. Эти пациенты включены в анализ эффективности фармакотерапии (тимоаналептиками или анксиолитиками соответственно), представленный ниже.
В группе легкой диссоциативной реакции (n=15, в том числе 8 пациентов, переведенных из группы 1) редукция симптомов тревоги в той или иной степени отмечена у всех пациентов, что подтверждается динамикой стартового суммарного балла шкалы тревоги Гамильтона (рис. 1).

Высокая общая эффективность лечения находит отражение также и в результатах оценки по шкалам общего клинического впечатления – CGI-тяжесть и CGI-улучшение. Стартовый средний суммарный балл CGI-тяжесть, составивший 4,3 (интервал между 4 – «умеренно болен» и 5 – «явно болен»), снизился через 6 нед терапии до 2,2 (интервал между 2 – «пограничное состояние» и 3 – «в легкой степени болен»). Средний суммарный балл шкалы CGI-улучшение на финальном визите (6-я неделя) составил 1,7 (интервал между 1 – «очень выраженное улучшение» и 2 – «выраженное улучшение»).
По завершении терапии респондеры (пациенты с редукцией исходного суммарного балла по шкале оценки тревоги Гамильтона более 50%) составили 67% от общего числа пациентов.
Эффект афобазола был клинически значимым у большинства – 16 (80%) из 20 пациентов, получавших данный анксиолитик (легкая диссоциативная реакция с минимальными клиническими признаками патологической тревоги), характеризовался отчетливой редукцией уровня тревоги и тревожных опасений без признаков седации в дневное время. Во всех случаях неудовлетворительного эффекта терапии (4 наблюдения) выявлена полиморфная тревожная симптоматика (множественные фобии, соматизированные расстройства) и стойкая инсомния.
Афобазол хорошо переносился пациентами. Побочные эффекты зафиксированы в 8 случаях (тошнота – 4, дневная сонливость – 4), были преимущественно легкой степени и редуцировались без изменения схемы терапии. Токсических эффектов и клинически значимых изменений лабораторных и инструментальных показателей, связанных с приемом афобазола, не зафиксировано, каких-либо признаков взаимодействия с препаратами химиотерапии не отмечено.
В группе тревожно-депрессивных нозогенных реакций (n=59, включая пациентов, переведенных из группы 1) установлена высокая эффективность фармакотерапии современными антидепрессантами, о чем свидетельствуют установленные доли респондеров: 79% больных с более чем 50% редукцией стартовых баллов HADS (рис. 2, 3).


Высокая общая эффективность лечения находит отражение также и в результатах оценки по шкалам общего клинического впечатления – CGI-тяжесть и CGI-улучшение. Стартовый средний суммарный балл CGI-тяжесть, составивший 4,7 (интервал между 4 – «умеренно болен» и 5 – «явно болен»), снизился через 6 нед терапии до 2,2 (интервал между 2 – «пограничное состояние» и 3 – «в легкой степени болен»). Средний суммарный балл шкалы CGI-улучшение на финальном визите (6-я неделя) составил 1,8 (интервал между 1 – «очень выраженное улучшение» и 2 – «выраженное улучшение»).
Также следует отметить достаточно быструю реализацию антидепрессивного и анксиолитического эффекта с достоверной (р<0,05) редукцией стартовых суммарных баллов тревоги и депрессии по HADS через 5 и 7 дней соответственно у большинства (65%) респондеров.
В то же время полная и стойкая ремиссия с длительностью минимум 4 нед отмечена лишь у 3 пациентов с начальными стадиями рака желудка (I–II) после успешной радикальной хирургической операции, которым не требовалась дополнительная консервативная терапия раковой опухоли.
Наряду с высоким уровнем эффективности обращает на себя внимание низкий уровень средних доз, на которых был получен значимый терапевтический эффект: эсциталопрам 10 мг/сут; флувоксамин 41,4 мг/сут; сертралин 72,3 мг/сут; венлафаксин 88,8 мг/сут. По сути указанные дозы соответствуют минимальным рекомендуемым терапевтическим дозам приведенных антидепрессантов. В соответствии с идентичными по дизайну протоколами исследований каждый из антидепрессантов назначен в минимальной терапевтической дозе с ее последующей коррекцией по принципу достаточного минимума, который определяли двумя критериями – достижение значимого клинического эффекта и переносимость препарата. По результатам лечения основным фактором, ограничивающим эскалацию стартовой дозы каждого препарата, является значимый терапевтический эффект, тогда как побочные эффекты влияли на процесс титрации дозы лишь в единичных (4 из 59 пациентов) наблюдениях.
Как отмечено выше, длительность курсов терапии рассматриваемыми антидепрессантами была относительно небольшой – 6–8 нед. Однако по истечении предусмотренного протоколом срока лечения пациенты оставались под наблюдением, что способствовало отдаленной оценке результатов терапии. Во всех случаях терапевтического эффекта попытки отмены препаратов приводили к возобновлению тревожной и депрессивной симптоматики и диссоциативных расстройств в среднем через 2–4 дня после приема последней дозы. При этом симптомы отмены не зафиксированы, на основании чего можно сделать вывод о том, что в пределах указанного срока регулярный прием антидепрессанта обеспечивает лишь лекарственную ремиссию. Подобные результаты объясняются природой нозогенных реакций у изученных пациентов – речь идет о психопатологических расстройствах, непосредственно связанных с хроническим и неразрешимым полностью (как минимум на период проведения исследования) онкологическим заболеванием. В пользу такого объяснения свидетельствуют и данные о единичных случаях полной ремиссии, сопряженных с наиболее благоприятным течением и высокими результатами терапии основного заболевания.
Переносимость тимоаналептической терапии была хорошей. Побочные эффекты развивались сравнительно редко и зафиксированы у 8 (13,5%) из 59 пациентов. В большинстве наблюдений побочные эффекты были представлены единичными и легкими по своим проявлениям симптомами, которые развивались в течение первых 10 дней фармакотерапии и спонтанно редуцировались без каких-либо изменений в схеме приема препаратов. Как отмечено, только у 4 больных в связи с выраженностью побочных эффектов потребовалось вмешательство в схему терапии: 2 случая снижения дозы и 2 случая отмены препарата из-за непереносимости побочных эффектов. Во всех 4 наблюдениях главной причиной снижения дозы или отмены была тошнота. Следует отметить, что данный побочный эффект, свойственный большинству современных антидепрессантов с серотонинергическим механизмом действия, приобретает особое значение в онкологической клинике, поскольку относится к числу наиболее субъективно тягостных и стойких побочных эффектов химиотерапии. Онкологические пациенты, как правило, подробно информированные о нежелательных явлениях, связанных с химиотерапией, особенно настороженно относятся к подобным ощущениям. Соответственно, при первых признаках тошноты во время приема антидепрессанта негативная реакция больных со злокачественными образованиями представлена наиболее отчетливо и реализуется категорическим отказом от дальнейшего приема данного препарата независимо от медицинского заключения о более вероятной причинной связи тошноты с другими факторами.
В ходе исследования не зафиксировано ни одного случая неблагоприятных лекарственных взаимодействий между психотропными средствами и препаратами, использующимися для химиотерапии рака желудка. Учитывая данные по метаболизму цитостатиков, использовавшихся в терапии больных изученной выборки, риск взаимодействия антидепрессантов с этими лекарственными средствами можно считать минимальным (табл. 5).

Заключение
Полученные в проведенном исследовании данные представляются значимыми в прикладном аспекте и в первую очередь в плане оптимизации психиатрической и психологической помощи больным раком желудка, страдающим нозогенными реакциями. Хотя объем выборки нельзя признать достаточным для окончательного суждения, полученные данные позволяют сделать ряд важных с клинической точки зрения выводов, которые могут в значительной степени способствовать оптимизации психиатрической и психологической помощи онкологическим пациентам на лечебно-диагностическом этапе в условиях онкологического стационара.
Очевидно, что столь выраженная и распространенная диссоциативная симптоматика, значительно затрудняющая терапию, требует особого подхода с комбинированным применением методов психофармакологической и психотерапевтической коррекции. Особенно возрастает значение психотерапии, направленной на коррекцию неадекватного отношения к болезни и повышение уровня комплаентности с формированием осознания необходимости психофармакотерапии для купирования тревожной и диссоциативной симптоматики. При этом следует отметить, что в пределах данного исследования применение психотерапии ограничивалось задачей формирования адекватного уровня комплаентности, что, несомненно, представляет собой лишь малую часть широкого спектра возможностей для использования современных методов психотерапевтической коррекции у пациентов с онкологическими заболеваниями.
В случаях легких диссоциативных нозогенных реакций достигнут достаточно высокий эффект при использовании атипичного анксиолитика афобазола. Учитывая сравнительно умеренный противотревожный эффект этого препарата в сравнении с классическими бензодиазепиновыми препаратами (А.С.Аведисова и соавт., 2006; Г.Г.Незнамов и соавт., 2006; А.В.Васильева и соавт., 2006), можно предполагать, что в таких случаях могут быть эффективными и другие психофармакологические средства, обладающие анксиолитическими свойствами в сочетании с благоприятными профилями переносимости и безопасности. На основе полученных данных можно также высказать предположение, что легкие диссоциативные реакции могут успешно купироваться психотерапевтическими методиками, направленными в первую очередь на коррекцию латентной тревоги у таких пациентов.
Результаты оценки эффективности антидепрессантов согласуются с данными других исследователей о высокой эффективности препаратов этого класса в купировании тревожной и депрессивной симптоматики у пациентов с тревожно-депрессивными расстройствами. В то же время следует подчеркнуть отчетливую особенность представленных в данной публикации наблюдений, а именно: адекватность терапевтического ответа при минимальных терапевтических или даже субтерапевтических дозах медикаментов относительно стандартных рекомендаций для лечения тревожных и депрессивных состояний у психиатрических пациентов. По всей видимости, это объясняется преимущественно психогенной (нозогенной) природой изученных состояний, связанной с более высокой чувствительностью к терапевтическим эффектам тимоаналептиков (в первую очередь собственно антидепрессивному и противотревожному) в сравнении с больными, страдающими синдромально завершенными формами аффективной и тревожной патологии. Также следует указать на минимальный риск лекарственных взаимодействий, объясняющийся особенностями метаболизма применяемых в исследовании антидепрессантов и препаратов химиотерапии основного заболевания, использующихся в лечении рака желудка, в первую очередь отсутствие «перекреста» на уровне основных изоферментов печени, отвечающих за биотрансформацию указанных медикаментов. Данное обстоятельство можно считать дополнительным обоснованием более широкого применения современных тимоаналептиков для лечения тревожных и депрессивных расстройств у онкологических пациентов.
Таким образом, в ходе проведенного исследования получены предварительные данные о целесообразности дифференцированного, основанного на клинической типологии рассматриваемых психопатологических расстройств выбора методов психофармако- и психотерапии в купировании нозогенных реакций у больных раком желудка. В случаях умеренных/тяжелых диссоциативных реакций показана 2-этапная терапия: назначение психотерапевтических методик, способствующих коррекции аномального отрицания болезни и формированию удовлетворительного уровня комплаенса с последующим применением анксиолитиков или антидепрессантов при появлении соответствующих показаний. В случаях легких диссоциативных реакций целесообразно наиболее щадящее воздействие, направленное на купирование нетяжелой тревожно-ипохондрической симптоматики (в рамках латентной тревоги), которое может осуществляться с помощью анксиолитиков и, вероятно, соответствующих методик психотерапии. У пациентов с тревожно-депрессивными нозогенными реакциями целесообразно назначение современных селективных серотонин- и норадренергических антидепрессантов, обладающих благоприятными профилями переносимости и безопасности (включая минимальный риск лекарственных взаимодействий) с выбором минимальных или даже субминимальных терапевтических доз с учетом сравнительно высокого уровня лечебного эффекта, установленного в ходе представленного исследования.


