Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№04 2009
Проблема хронического аутоиммунного тиреоидита у мужчин (психоиммуноэндокринологическое исследование) №04 2009
Номера страниц в выпуске:20-26
На основе изучения психических и эндокринных факторов у лиц мужского пола с хроническим аутоиммунным тиреоидитом (АИТ) в фазе эутиреоза показано их влияние на характер и течение иммунного процесса, а также дана оценка вовлечения цитокинов в механизм формирования структуры психопатологических нарушений непсихотического уровня, что свидетельствует о тесной интеграции трех регулирующих гомеостаз систем. Подчеркивается целесообразность комплексного обследования мужчин с АИТ для правильного выбора патогенетически обоснованных методов терапии выявленных нарушений и совершенствования лечебной тактики с использованием комплексной схемы лечения иммунотропными и психотропными препаратами, воздействующими на все составляющие болезненного процесса.
Резюме. На основе изучения психических и эндокринных факторов у лиц мужского пола с хроническим аутоиммунным тиреоидитом (АИТ) в фазе эутиреоза показано их влияние на характер и течение иммунного процесса, а также дана оценка вовлечения цитокинов в механизм формирования структуры психопатологических нарушений непсихотического уровня, что свидетельствует о тесной интеграции трех регулирующих гомеостаз систем. Подчеркивается целесообразность комплексного обследования мужчин с АИТ для правильного выбора патогенетически обоснованных методов терапии выявленных нарушений и совершенствования лечебной тактики с использованием комплексной схемы лечения иммунотропными и психотропными препаратами, воздействующими на все составляющие болезненного процесса.
Ключевые слова: аутоиммунный тиреоидит, половой диморфизм, психопатология, гормоны.
Chronic Autoimmune Thyroiditis in Men
(A Psychoimmunoendocrinological Study)
G.P.Ivanova, L.N.Gorobets
Moscow Research Psychiatric Institute of the Ministy of Health of the Russian Federation
Summary. In this study we showed the influence of psychic and endocrine factors in men with chronic autoimmune thyroiditis in the euthyroid phase on the character and the course of the immune process; we also evaluated the cytokine involvement in the pathogenetic mechanism shaping the clinical structure of the psychopathological disorders of the non-psychotic scale, illustrating the close integration of all the three homeostasis-regulating systems. The emphasis is laid upon the advisability of the integrated evaluation of AIT men for choosing the correct and pathogenetically grounded therapeutic methods of the diagnosed impairments, as well as the enhancement of treatment tactics with the integrated treatment regimen of immunotropic and psychotropic drugs affecting all of the elements of the pathological process.
Key words: autoimmune thyroiditis, sex dimorphism, psychopathology, hormones.
Благодаря стремительному развитию нейроиммуноэндокринологии все большую значимость приобретает изучение психической сферы как составляющей общей системы адаптации при анализе заболеваний, имеющих аутоиммунные механизмы развития [1].
Изучение механизмов взаимодействия иммунных и психических процессов позволит уточнить этиопатогенетические механизмы развития иммунных процессов, а также оптимизировать методы терапии, используя принцип комплексного подхода.
Однако в спектре этих проблем остается недостаточно освещенным вопрос гендерных различий и их роли в течении и прогнозе заболеваний иммунной природы. Отмеченное в ряде работ соотношение частоты женщины: мужчины при аутоиммунных заболеваниях с преимущественной представленностью среди них лиц женского пола дало основание сместить акцент исследования этой проблемы в сторону изучения указанной патологии у женщин, оставляя открытыми вопросы, касающиеся мужского пола [2, 3]. Тем не менее в отдельных исследованиях приводятся данные о существовании определенной специфики нейроэндокринной организации мужского организма при иммунном дисбалансе [4].
Следует отметить, что до сих пор в недостаточной степени освещены темы, связанные с оценкой факторов, участвующих в реализации иммунного ответа, психических механизмов, ответственных за взаимодействие систем, регулирующих гомеостатический баланс, при аутоиммунных процессах с учетом фактора полового диморфизма.
Одной из удобных моделей для рассмотрения этих взаимодействий является такая форма аутоиммунной патологии, как хронический аутоиммунный тиреоидит (АИТ). Среди заболеваний с аутоиммунным механизмом развития АИТ (зоб Хашимото) занимает одно из основных мест. Интерес к АИТ продиктован высокой его частотой в структуре патологии щитовидной железы (46%), а также причастностью к развитию первичного гипотиреоза [5].
АИТ – хроническое заболевание с постепенным началом, неспецифичностью ранних признаков и очень медленным, но неуклонным прогрессированием, в основе которого лежит определенная тенденция к постепенному нарастанию деструктивных процессов в щитовидной железе с последующим развитием гипотиреоза, что определяет высокую социальную значимость проблемы [6–9]. Эпидемиологические исследования 40-х годов прошлого века убедительно продемонстрировали преобладание женщин среди больных АИТ, что позднее подтвердилось благодаря разработке специфических серологических методов диагностики [10]. Согласно эпидемиологическим данным АИТ, дебютирующий преимущественно в возрасте 40–60 лет, у женщин встречается в 40 раз чаще, чем у лиц мужского пола.
Можно предположить, что при изучении этой патологии важным является также целенаправленное изучение периода, соответствующего эутиреоидной фазе АИТ, так как именно на этой стадии закладываются основные особенности структурной и функциональной составляющей трех систем: психической, эндокринной и иммунной в рамках общей системы адаптации. Важность такого комплексного анализа подчеркивают R.Ader и соавт. [11]. Эти системы в соответствии с иммунной реактивностью организма будут реагировать по своему (индивидуальному) сценарию, определяющему течение и прогноз аутоиммунного процесса.
Цель настоящего исследования – выявление структурных особенностей психопатологической симптоматики у лиц мужского пола с АИТ и уточнение взаимосвязи психопатологических явлений и биологических параметров (иммунных и гормональных) на этапе, предшествующем периоду дисгормональных нарушений в щитовидной железе.
Материал и методы
Объектом изучения послужили 77 мужчин с гипертрофической формой АИТ – зобом Хашимото в фазе эутиреоза. Средний возраст 33,2±0,8 года; предполагаемая длительность заболевания от 5 до 8 лет. Диффузная форма структуры железы выявлена у 32 (41,6%) пациентов – группа 1; диффузно-узловая – у 45 (58,4%) – группа 2.
Обе группы были сопоставимы по основным клинико-демографическим показателям. Все пациенты дали информированное согласие на участие в исследовании.
Критерии исключения: наличие сопутствующих аллергических, других аутоиммунных, тяжелых соматических заболеваний, органического поражения ЦНС, психотических расстройств, острых и хронических воспалительных процессов, влияющих на иммунологический статус. Применение психотропной терапии в течение 2 мес до начала исследования; иммунотерапии или иммунопрофилактики в течение 3 мес до начала исследования.
В исследовании использованы следующие методы:
При клинико-психопатологическом анализе изученного состояния выявлен характерный спектр непсихотических психических расстройств, представленный двумя основными синдромами – астеническим и аффективным.
Астенические проявления в соответствии с МКБ-10 квалифицированы в диагностической рубрике «Другие невротические расстройства» (F48).
К особенностям астенической симптоматики у обследованных больных отнесены: полиморфизм болезненных проявлений, перманентность и волнообразность течения, невозможность быстрой и полной коррекции под влиянием благоприятно изменившихся условий (снижение умственных и физических нагрузок).
При оценке распределения больных по типам астенических нарушений (использована традиционная дихотомическая систематика А.Г.Иванова-Смоленского [12], подразделяющая астенические расстройства на гиперстеническую и гипостеническую формы) оказалось, что у больных, отнесенных к группе 1, гиперстеническая форма выявлена в 58,3% случаев, гипостеническая – в 41,7%; в группе 2 – в 62,4 и 37,6% соответственно. (Распределение астенических состояний в этой группе соответствует расчетам А.Г.Иванова-Смоленского, наблюдавшего гиперстеническую форму у 69,7%, а гипостеническую у 30,3% больных.)
Гиперстенический вариант в изученных случаях характеризовался явлениями гиперестезии в отношении воздействия внешних факторов. Астеническая симптоматика сочеталась с тревогой и признаками вегетативной лабильности. Наряду с повышенной возбудимостью, чувством напряженности с неспособностью расслабиться, внутренним беспокойством, утратой самообладания, несобранностью, рассеянностью чувствительностью к нейтральным в норме внешним раздражителям, выявлялись элементы раздражительной слабости (сочетание повышенной раздражительности, возбудимости с утомляемостью, истощаемостью, плаксивостью) с чертами истерического поведения. При этом выявлялось противоречие между жалобами на усталость и активной деятельностью, проявлявшейся как в работе, так и в быту.
Клиническая картина гипостенического варианта астении определена неврастенической симптоматикой (общая физическая и психическая слабость, вялость, пассивность, истощение активной работоспособности), взаимосвязанной с субдепрессивными феноменами (чувство грусти, подавленность) и склонностью к ипохондрической фиксации на соматических ощущениях. При этом аффективные проявления не достигали степени клинически оформленных состояний и оценены как «эмоциональная составляющая» в структуре астенического синдрома. Астеническому симптомокомплексу была свойственна тенденция к волнообразности с колебаниями выраженности проявлений (периоды «наплывов»).
Дифференцированная оценка астенических проявлений по пяти субшкалам шкалы MFI-20 приведена в табл.1.
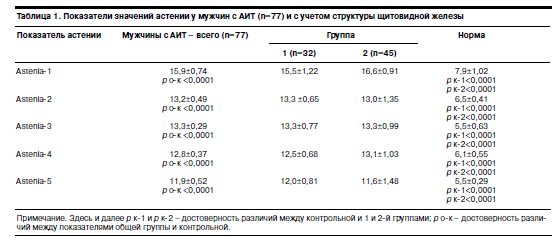
Как видно из представленных в табл. 1 данных, значения средних показателей по субшкалам «общая астения», «физическая астения», «снижение активности» и «психическая астения» соответствовали степени легкой астении (А1 – 15,9±0,74; А2 – 13,2±0,49; А3 – 13,3±0,29; А4 – 12,8±0,37 балла), по субшкале «снижение мотивации» астении не зафиксировано (А5 – 11,9±0,52 балла).
Сравнительное исследование астении с учетом морфологических трансформаций в структуре щитовидной железы обнаружило различия между выделенными группами. При этом межгрупповые различия по параметрам «общая астения» и «снижение мотивации» не достигали статистической значимости. У пациентов группы 1 астенические проявления выявлялись по всем субшкалам и имели значения, соответствующие легкой степени выраженности (А1 – 15,5±1,22; А2 – 13,3±0,65; А3 – 13,3±0,77; А4 – 12,5±0,68; А5 – 12,0±0,81 балла). В группе 2 астенические нарушения зарегистрированы по всем субшкалам, кроме параметра «снижение мотивации», где астенические проявления не регистрировались (А1 – 16,6±0,91; А2 – 13,0±1,35; А3 – 13,3±0,99; А4 – 13,1±1,03; А5 – 11,6±1,48 балла). Астения по субшкале «общая астения» в отличие от группы 1 носила умеренный характер. По субшкалам «физическая астения», «снижение активности» и «психическая астения» – легкие астенические расстройства.
Аффективные расстройства в структуре астенических состояний у 40 (51,9%) пациентов отнесены по МКБ-10 к категории «Другой депрессивный эпизод» (F32.8).
При анализе спектра депрессивных проявлений у обследованных группы 1 (43,4%) выявлено незначительное угнетение витальных функций (позднее засыпание, снижение аппетита), идеаторной сферы при слабой выраженности собственно аффективной симптоматики. Среди жалоб депрессивного спектра отмечены: «изменение обычного жизнеощущения», «хандра», «ленивость», «скука», «спад», «общее недомогание».
В структуре депрессивного расстройства доминирующее положение занимала тревога (субъективное переживание внутреннего волнения, напряжения), носившая сквозной характер с волнообразным течением. Моторный компонент тревожного аффекта проявлялся субъективным ощущением мышечной скованности, имеющей периодичность возникновения без четкой суточной зависимости.
Следует отметить, что анксиозные проявления, несмотря на их выраженность, не эволюционировали до генерализации аффекта с формированием панических состояний. В 1/3 случаев тревогу, не связанную с конкретной ситуацией, носившую неопределенный, беспредметный характер, расценивали как «свободноплавающую» (флотирующая). В остальных наблюдениях тревожный аффект приобретал «фабульный» характер с конкретными опасениями, касающимися собственного здоровья, и развивался вне зависимости от того, были ли тревожные реакции свойственны субъекту в преморбидном периоде. Содержание тревожных опасений отражало осознание соматического неблагополучия, основанное на ощущениях «кома в горле», «затруднений при глотании». Последние могут относиться как к разряду соматических, обусловленных увеличением объема щитовидной железы при АИТ, так и психических расстройств (общие симптомы). Тенденция к ипохондрической переработке этих ощущений отмечена лишь в 6% случаев и соответствовала степени субъективной обеспокоенности пациента болезнью. Тревожные опасения, связанные с вероятностью разрастания узловых образований и перспективой их малигнизации, сопровождались формированием фобической симптоматики, характеризующейся конкретным содержанием и вегетативными проявлениями, которые также становились объектом для болезненной фиксации на состоянии здоровья.
В группе 2 у 26 (57,1%) пациентов наблюдали усложнение депрессивной симптоматики с доминированием «соматической тревоги» (неясный телесный дискомфорт, внутренняя скованность, сменяющаяся чувством общей физической слабости, различной степени выраженности ощущения напряжения в скелетной мускулатуре, вегетовисцеральные симптомы). Углубление депрессии сопровождалось трансформацией «соматической» тревоги в «психическую» и выявлением жалоб на снижение социальной активности, утраты интереса к повседневной деятельности и угнетение физиологических функций (снижениt аппетита, пресомнические расстройства, средняя инсомния).
Результаты обследования по Мюнхенскому личностному тесту показали, что для 41 (53,2%) пациента типичными были такие преморбидные характеристики, как невротизм, низкая устойчивость к фрустрации, ригидность, стремление к изоляции, приверженность социальным нормам. В этой части случаев по шкале ТАС выявлена алекситимия2. В другой части наблюдений (25–32,5%) у пациентов определены такие преморбидные личностные черты, как экстраверсия, устойчивость к стрессу, мотивационная направленность. Смешанный вариант составили 11 (14,3%) наблюдений.
Оценки параметров по шкалам Гамильтона (НАМА), Спилбергера (STAI), SCL-90, Мюнхенского личностного теста (МРТ), ТАS у больных изученной выборки с учетом морфологической структуры щитовидной железы, приведены в табл. 2.
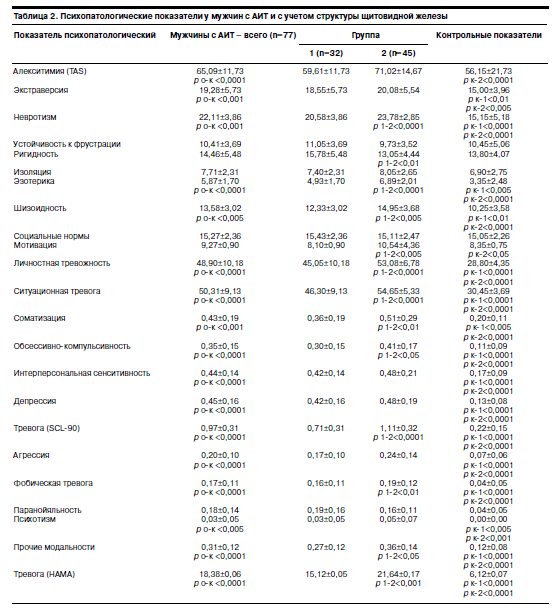
Как это показано в табл. 2, средний балл тревоги (18,4) у всех обследованных соответствовал «симптомам тревоги»; в группе 1 значение этого показателя отражало умеренную выраженность анксиозных расстройств – 15,7 балла, в группе 2 зафиксирован более высокий уровень тревоги – 21,1 балла (р<0,001).
При сопоставлении данных, полученных при тестировании по психометрической шкале SCL-90, со средними нормативными показателями выявлено статистически достоверное превышение среднего балла по всем подшкалам (по профилю значений SCL-90 группы 1 и 2 значимо различались между собой). При этом в группе 2 обнаружена тенденция к усилению выраженности проявлений по следующим кластерам: соматизация (соматоформные расстройства) – р<0,01, обсессивно-компульсивные расстройства – р<0,05, тревога – р<0,0001, фобическая тревога – р<0,01, прочие модальности – р<0,05. Очевидно, высокий удельный вес аффекта тревоги, широко представленный среди мужчин с АИТ, объясняется комплексом причин, среди которых в качестве основной может быть выделен ответ ЦНС на влияние хронического иммунного стресса со снижением порога стрессоустойчивости [1]. Изменения изучаемых показателей гормонального профиля в сравниваемых группах по структуре щитовидной железы, приведены в табл. 3.
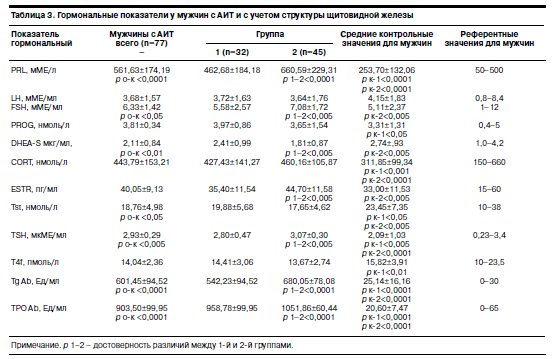
Анализ средних значений показателей гормонального профиля в изученной выборке выявил статистически значимые отклонения по отношению к контрольным показателям по пролактину (PRL) – р<0,0001, фолликулостимулирующему гормону (FSH) – р<0,05, дегидроэпиандростерон-сульфату (DHЕА-S) – р<0,05, тестостерону (Tst) – р<0,05, тиреотропному гормону (ТSH) – р<0,005, антителам к тиреоглобулину (Tg Ab) – р<0,0001 и тиреопироксидазе (TPO Ab) – р<0,0001.
Известно, что гиперпролактинемия (ГПРЛ) выявляется в основном у гипотиреоидных больных с АИТ, что отражает влияние недостатка тиреоидных гормонов на секрецию пролактина [14]. В изученной выборке ГПРЛ зафиксирована в фазе эутиреоза в 31,4% случаев. Кроме того, выявлены достоверные различия по уровню пролактина как между выделенными группами (р<0,0001), так и для каждой из них в отдельности сравнительно с контрольной (р<0,0001). Обнаружены ассоциации между уровнем пролактинемии и показателями гуморального иммунитета: Tg Ab (r=0,34, p<0,0001) и TPO Ab (r=0,26, p<0,0001). Выявлена положительная корреляция между уровнем пролактина и показателями клеточного иммунитета: CD3 (r=0,21, p<0,0001), CD4 T-хелперами (r=0,14, p<0,01), CD95 (r=0,14, р<0,01); провоспалительными цитокинами ИЛ-1 (r=0,46, p<0,0001), ИЛ-2 (r=0,27, p<0,0001), a-TNF (r=0,51, p<0,0001), a-INF (r=0,43, p<0,0001) и отрицательная с ИЛ-6 (r=0,31, p<0,05), что указывает на взаимосвязь секреции пролактина с аутоиммунным процессом. Как показано в большом цикле работ [15–17], ГПРЛ является частым спутником аутоиммунных заболеваний, а его основная биологическая роль при стрессе связана с участием гормона в предотвращении негативного действия других стрессреализующих факторов [18].
Концентрация антител (Tg Ab и TPO Ab) у изученных пациентов существенно превышала диагностические пороги (р<0,0001), отражая тем самым активность процессов органоспецифической аутоагрессии.
По результатам исследования уровней DHЕА-S установлено, что достоверные отклонения его средних значений от контрольных показателей выявляются как у всех пациентов с АИТ (р<0,01), так и у больных группы 2 (р<0,005), причем у 15,2% пациентов этой группы индивидуальные значения определяемого показателя были меньше нижней границы нормы. Регистрировали также различия по содержанию в крови DHЕА-S между группами 1 и 2 с более низкими средними значениями гормона в группе 2, не выходящими за нижнюю границу нормативного диапазона (р<0,005). Выявлены устойчивые отрицательные корреляции DHЕА-S как с Tg Ab (r=-0,50, p<0,0001) и TPO Ab (r=-0,41, p<0,005), так и ИЛ-2 (r=-0,31, p<0,01), ИЛ-6 (r=-0,26, p<0,05). Согласно данным литературы снижение дегидроэпиандростерона, выполняющего роль иммуномодулятора, свидетельствует об истощении анаболических возможностей организма по мере нарастания иммунологической реактивности и значительном напряжении адаптационной системы [19].
Поскольку андрогены могут модулировать активность аутоиммунных процессов [20], в настоящем исследовании проанализированы концентрации тестостерона (Tst) в крови. Выявлена тенденция к снижению значений Tst как у пациентов в целом (р<0,05), так и у обследованных 1-й (р<0,05) и 2-й (р<0,005) групп по сравнению с контрольными без отклонения от границ референтных значений. Обнаружена отрицательная взаимосвязь уровня Tst с a-INF (r=-0,43, p<0,0001) и Tg Ab (r=-0,45, p<0,0001), которую можно расценивать как вклад в прогрессирование процессов иммунологической реактивности в отношении щитовидной железы при АИТ.
Для определения взаимосвязи клинических характеристик в формализованной оценке и биологических параметров методом корреляционного анализа сопоставлены уровни астении (шкала MFI-20), тревоги [шкалы НАМА, STAI (SA, PA), SCL-90], депрессии (шкала SCL-90) и показатели цитокинов и гормонального профиля. Результаты, полученные при таком сопоставлении, представлены в табл. 4 (включены только значимые корреляции).
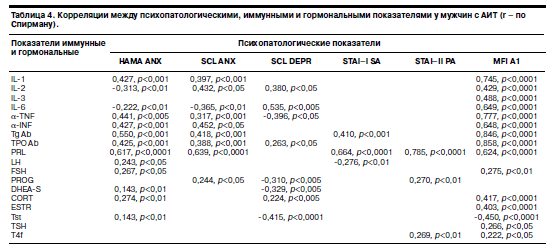
Как видно из данных, приведенных в табл. 4, для астенических состояний при АИТ показана большая заинтересованность как иммунной, так и эндокринной систем. Выявлена положительная корреляционная связь между степенью астенизации и иммунными параметрами: ИЛ-1, ИЛ-2, ИЛ-3,ИЛ-6, a-TNF, a-INF, а также показателями антител Tg Ab и TPO Ab, что позволяет высказать следующее предположение. Иммунный дисбаланс является, по-видимому, одним из звеньев патогенеза астенических расстройств при АИТ. Анализ корреляционных взаимодействий выявил значимые ассоциативные связи астенических состояний с гормональными показателями, часть из которых обладает иммуномодулирующими свойствами (в частности, прямая зависимость существует с уровнем PRL, CORT, ESTR, но обратная – с Tst). Обнаружена также положительная взаимосвязь степени выраженности тревожного аффекта по шкале НАМА и уровня ИЛ-1, a-TNF, a-INF. Те же соотношения выявлены при тестировании по шкале SCL-90 (кластер SCL-ANX), использующей иной способ оценки выраженности психопатологических нарушений – установлена достоверная положительная корреляция между уровнем тревоги и значениями ИЛ-2 и a-INF. При сопоставлении данных подшкалы SCL-DEPR и исследуемых цитокинов обнаружена устойчивая положительная взаимосвязь формализованных характеристик депрессии и уровня ИЛ-6.
Получены результаты, свидетельствующие о возможной причастности гормональной системы к формированию психопатологической симптоматики в эутиреоидную фазу АИТ: установлена прямая зависимость между выраженностью тревожного аффекта (по всем указанным выше шкалам) и уровнем PRL, проявления депрессивной симптоматики соотносятся со снижением уровня тестостерона (Tst).
В заключение подчеркнем, что вся совокупность полученных в ходе настоящего исследования данных, может быть положена в обоснование целесообразности комплексного обследования мужчин с АИТ, позволяющего определить адекватные подходы к выбору патогенетически обоснованной терапии и совершенствования лечебной тактики с использованием комплексной терапии иммунотропными и психотропными препаратами, воздействующими на все составляющие болезненного процесса.
Ключевые слова: аутоиммунный тиреоидит, половой диморфизм, психопатология, гормоны.
Chronic Autoimmune Thyroiditis in Men
(A Psychoimmunoendocrinological Study)
G.P.Ivanova, L.N.Gorobets
Moscow Research Psychiatric Institute of the Ministy of Health of the Russian Federation
Summary. In this study we showed the influence of psychic and endocrine factors in men with chronic autoimmune thyroiditis in the euthyroid phase on the character and the course of the immune process; we also evaluated the cytokine involvement in the pathogenetic mechanism shaping the clinical structure of the psychopathological disorders of the non-psychotic scale, illustrating the close integration of all the three homeostasis-regulating systems. The emphasis is laid upon the advisability of the integrated evaluation of AIT men for choosing the correct and pathogenetically grounded therapeutic methods of the diagnosed impairments, as well as the enhancement of treatment tactics with the integrated treatment regimen of immunotropic and psychotropic drugs affecting all of the elements of the pathological process.
Key words: autoimmune thyroiditis, sex dimorphism, psychopathology, hormones.
Благодаря стремительному развитию нейроиммуноэндокринологии все большую значимость приобретает изучение психической сферы как составляющей общей системы адаптации при анализе заболеваний, имеющих аутоиммунные механизмы развития [1].
Изучение механизмов взаимодействия иммунных и психических процессов позволит уточнить этиопатогенетические механизмы развития иммунных процессов, а также оптимизировать методы терапии, используя принцип комплексного подхода.
Однако в спектре этих проблем остается недостаточно освещенным вопрос гендерных различий и их роли в течении и прогнозе заболеваний иммунной природы. Отмеченное в ряде работ соотношение частоты женщины: мужчины при аутоиммунных заболеваниях с преимущественной представленностью среди них лиц женского пола дало основание сместить акцент исследования этой проблемы в сторону изучения указанной патологии у женщин, оставляя открытыми вопросы, касающиеся мужского пола [2, 3]. Тем не менее в отдельных исследованиях приводятся данные о существовании определенной специфики нейроэндокринной организации мужского организма при иммунном дисбалансе [4].
Следует отметить, что до сих пор в недостаточной степени освещены темы, связанные с оценкой факторов, участвующих в реализации иммунного ответа, психических механизмов, ответственных за взаимодействие систем, регулирующих гомеостатический баланс, при аутоиммунных процессах с учетом фактора полового диморфизма.
Одной из удобных моделей для рассмотрения этих взаимодействий является такая форма аутоиммунной патологии, как хронический аутоиммунный тиреоидит (АИТ). Среди заболеваний с аутоиммунным механизмом развития АИТ (зоб Хашимото) занимает одно из основных мест. Интерес к АИТ продиктован высокой его частотой в структуре патологии щитовидной железы (46%), а также причастностью к развитию первичного гипотиреоза [5].
АИТ – хроническое заболевание с постепенным началом, неспецифичностью ранних признаков и очень медленным, но неуклонным прогрессированием, в основе которого лежит определенная тенденция к постепенному нарастанию деструктивных процессов в щитовидной железе с последующим развитием гипотиреоза, что определяет высокую социальную значимость проблемы [6–9]. Эпидемиологические исследования 40-х годов прошлого века убедительно продемонстрировали преобладание женщин среди больных АИТ, что позднее подтвердилось благодаря разработке специфических серологических методов диагностики [10]. Согласно эпидемиологическим данным АИТ, дебютирующий преимущественно в возрасте 40–60 лет, у женщин встречается в 40 раз чаще, чем у лиц мужского пола.
Можно предположить, что при изучении этой патологии важным является также целенаправленное изучение периода, соответствующего эутиреоидной фазе АИТ, так как именно на этой стадии закладываются основные особенности структурной и функциональной составляющей трех систем: психической, эндокринной и иммунной в рамках общей системы адаптации. Важность такого комплексного анализа подчеркивают R.Ader и соавт. [11]. Эти системы в соответствии с иммунной реактивностью организма будут реагировать по своему (индивидуальному) сценарию, определяющему течение и прогноз аутоиммунного процесса.
Цель настоящего исследования – выявление структурных особенностей психопатологической симптоматики у лиц мужского пола с АИТ и уточнение взаимосвязи психопатологических явлений и биологических параметров (иммунных и гормональных) на этапе, предшествующем периоду дисгормональных нарушений в щитовидной железе.
Материал и методы
Объектом изучения послужили 77 мужчин с гипертрофической формой АИТ – зобом Хашимото в фазе эутиреоза. Средний возраст 33,2±0,8 года; предполагаемая длительность заболевания от 5 до 8 лет. Диффузная форма структуры железы выявлена у 32 (41,6%) пациентов – группа 1; диффузно-узловая – у 45 (58,4%) – группа 2.
Обе группы были сопоставимы по основным клинико-демографическим показателям. Все пациенты дали информированное согласие на участие в исследовании.
Критерии исключения: наличие сопутствующих аллергических, других аутоиммунных, тяжелых соматических заболеваний, органического поражения ЦНС, психотических расстройств, острых и хронических воспалительных процессов, влияющих на иммунологический статус. Применение психотропной терапии в течение 2 мес до начала исследования; иммунотерапии или иммунопрофилактики в течение 3 мес до начала исследования.
В исследовании использованы следующие методы:
• клинико-анамнестический с применением стандартизованного опросника – интервью, модифицированного для эндокринологических больных. Ретроспективно оценивали преморбидные особенности личности с акцентом на изучение эмоционально-волевой и поведенческой сфер;
• клинико-психопатологический: психометрическая оценка степени выраженности психических расстройств с помощью диагностических шкал:
1. Клиническая шкала самоотчета, разработанная L.Derogatis и соавт. (1974 г.) – SCL-90 для исследования субъективной оценки больными своего психического состояния.
2. Toronto Alexithimia Scale (ТАS) для выявления неалекситимического, невыраженного и алекситимического типов личности.
3. Staite-Trait Anxiety Inventory (STAI) для выявления высокого уровня реактивной тревоги (STAI-I) и личностной тревожности (STAI-II).
4. Шкала оценки тревожных расстройств Гамильтона (НАМА).
5. Мюнхенский личностный тест (МРТ) von Zerssen (1988 г.) для многовекторной оценки личности в преморбидном периоде.
6. Субъективная шкала оценки астении (MFI-20)1.
7. Биохимические методы: иммунологический, характеризующий состояние основных звеньев иммунной системы; иммуноферментный анализ гормонального профиля.
8. Клинико-эндокринологический.
9. Ультразвуковое исследование щитовидной железы.
10. Статистический анализ с использованием программы: STATISTICA 6,0, Basic statistic и Nonparametric Statistic [Spearman].
При клинико-психопатологическом анализе изученного состояния выявлен характерный спектр непсихотических психических расстройств, представленный двумя основными синдромами – астеническим и аффективным.
Астенические проявления в соответствии с МКБ-10 квалифицированы в диагностической рубрике «Другие невротические расстройства» (F48).
К особенностям астенической симптоматики у обследованных больных отнесены: полиморфизм болезненных проявлений, перманентность и волнообразность течения, невозможность быстрой и полной коррекции под влиянием благоприятно изменившихся условий (снижение умственных и физических нагрузок).
При оценке распределения больных по типам астенических нарушений (использована традиционная дихотомическая систематика А.Г.Иванова-Смоленского [12], подразделяющая астенические расстройства на гиперстеническую и гипостеническую формы) оказалось, что у больных, отнесенных к группе 1, гиперстеническая форма выявлена в 58,3% случаев, гипостеническая – в 41,7%; в группе 2 – в 62,4 и 37,6% соответственно. (Распределение астенических состояний в этой группе соответствует расчетам А.Г.Иванова-Смоленского, наблюдавшего гиперстеническую форму у 69,7%, а гипостеническую у 30,3% больных.)
Гиперстенический вариант в изученных случаях характеризовался явлениями гиперестезии в отношении воздействия внешних факторов. Астеническая симптоматика сочеталась с тревогой и признаками вегетативной лабильности. Наряду с повышенной возбудимостью, чувством напряженности с неспособностью расслабиться, внутренним беспокойством, утратой самообладания, несобранностью, рассеянностью чувствительностью к нейтральным в норме внешним раздражителям, выявлялись элементы раздражительной слабости (сочетание повышенной раздражительности, возбудимости с утомляемостью, истощаемостью, плаксивостью) с чертами истерического поведения. При этом выявлялось противоречие между жалобами на усталость и активной деятельностью, проявлявшейся как в работе, так и в быту.
Клиническая картина гипостенического варианта астении определена неврастенической симптоматикой (общая физическая и психическая слабость, вялость, пассивность, истощение активной работоспособности), взаимосвязанной с субдепрессивными феноменами (чувство грусти, подавленность) и склонностью к ипохондрической фиксации на соматических ощущениях. При этом аффективные проявления не достигали степени клинически оформленных состояний и оценены как «эмоциональная составляющая» в структуре астенического синдрома. Астеническому симптомокомплексу была свойственна тенденция к волнообразности с колебаниями выраженности проявлений (периоды «наплывов»).
Дифференцированная оценка астенических проявлений по пяти субшкалам шкалы MFI-20 приведена в табл.1.

Как видно из представленных в табл. 1 данных, значения средних показателей по субшкалам «общая астения», «физическая астения», «снижение активности» и «психическая астения» соответствовали степени легкой астении (А1 – 15,9±0,74; А2 – 13,2±0,49; А3 – 13,3±0,29; А4 – 12,8±0,37 балла), по субшкале «снижение мотивации» астении не зафиксировано (А5 – 11,9±0,52 балла).
Сравнительное исследование астении с учетом морфологических трансформаций в структуре щитовидной железы обнаружило различия между выделенными группами. При этом межгрупповые различия по параметрам «общая астения» и «снижение мотивации» не достигали статистической значимости. У пациентов группы 1 астенические проявления выявлялись по всем субшкалам и имели значения, соответствующие легкой степени выраженности (А1 – 15,5±1,22; А2 – 13,3±0,65; А3 – 13,3±0,77; А4 – 12,5±0,68; А5 – 12,0±0,81 балла). В группе 2 астенические нарушения зарегистрированы по всем субшкалам, кроме параметра «снижение мотивации», где астенические проявления не регистрировались (А1 – 16,6±0,91; А2 – 13,0±1,35; А3 – 13,3±0,99; А4 – 13,1±1,03; А5 – 11,6±1,48 балла). Астения по субшкале «общая астения» в отличие от группы 1 носила умеренный характер. По субшкалам «физическая астения», «снижение активности» и «психическая астения» – легкие астенические расстройства.
Аффективные расстройства в структуре астенических состояний у 40 (51,9%) пациентов отнесены по МКБ-10 к категории «Другой депрессивный эпизод» (F32.8).
При анализе спектра депрессивных проявлений у обследованных группы 1 (43,4%) выявлено незначительное угнетение витальных функций (позднее засыпание, снижение аппетита), идеаторной сферы при слабой выраженности собственно аффективной симптоматики. Среди жалоб депрессивного спектра отмечены: «изменение обычного жизнеощущения», «хандра», «ленивость», «скука», «спад», «общее недомогание».
В структуре депрессивного расстройства доминирующее положение занимала тревога (субъективное переживание внутреннего волнения, напряжения), носившая сквозной характер с волнообразным течением. Моторный компонент тревожного аффекта проявлялся субъективным ощущением мышечной скованности, имеющей периодичность возникновения без четкой суточной зависимости.
Следует отметить, что анксиозные проявления, несмотря на их выраженность, не эволюционировали до генерализации аффекта с формированием панических состояний. В 1/3 случаев тревогу, не связанную с конкретной ситуацией, носившую неопределенный, беспредметный характер, расценивали как «свободноплавающую» (флотирующая). В остальных наблюдениях тревожный аффект приобретал «фабульный» характер с конкретными опасениями, касающимися собственного здоровья, и развивался вне зависимости от того, были ли тревожные реакции свойственны субъекту в преморбидном периоде. Содержание тревожных опасений отражало осознание соматического неблагополучия, основанное на ощущениях «кома в горле», «затруднений при глотании». Последние могут относиться как к разряду соматических, обусловленных увеличением объема щитовидной железы при АИТ, так и психических расстройств (общие симптомы). Тенденция к ипохондрической переработке этих ощущений отмечена лишь в 6% случаев и соответствовала степени субъективной обеспокоенности пациента болезнью. Тревожные опасения, связанные с вероятностью разрастания узловых образований и перспективой их малигнизации, сопровождались формированием фобической симптоматики, характеризующейся конкретным содержанием и вегетативными проявлениями, которые также становились объектом для болезненной фиксации на состоянии здоровья.
В группе 2 у 26 (57,1%) пациентов наблюдали усложнение депрессивной симптоматики с доминированием «соматической тревоги» (неясный телесный дискомфорт, внутренняя скованность, сменяющаяся чувством общей физической слабости, различной степени выраженности ощущения напряжения в скелетной мускулатуре, вегетовисцеральные симптомы). Углубление депрессии сопровождалось трансформацией «соматической» тревоги в «психическую» и выявлением жалоб на снижение социальной активности, утраты интереса к повседневной деятельности и угнетение физиологических функций (снижениt аппетита, пресомнические расстройства, средняя инсомния).
Результаты обследования по Мюнхенскому личностному тесту показали, что для 41 (53,2%) пациента типичными были такие преморбидные характеристики, как невротизм, низкая устойчивость к фрустрации, ригидность, стремление к изоляции, приверженность социальным нормам. В этой части случаев по шкале ТАС выявлена алекситимия2. В другой части наблюдений (25–32,5%) у пациентов определены такие преморбидные личностные черты, как экстраверсия, устойчивость к стрессу, мотивационная направленность. Смешанный вариант составили 11 (14,3%) наблюдений.
Оценки параметров по шкалам Гамильтона (НАМА), Спилбергера (STAI), SCL-90, Мюнхенского личностного теста (МРТ), ТАS у больных изученной выборки с учетом морфологической структуры щитовидной железы, приведены в табл. 2.

Как это показано в табл. 2, средний балл тревоги (18,4) у всех обследованных соответствовал «симптомам тревоги»; в группе 1 значение этого показателя отражало умеренную выраженность анксиозных расстройств – 15,7 балла, в группе 2 зафиксирован более высокий уровень тревоги – 21,1 балла (р<0,001).
При сопоставлении данных, полученных при тестировании по психометрической шкале SCL-90, со средними нормативными показателями выявлено статистически достоверное превышение среднего балла по всем подшкалам (по профилю значений SCL-90 группы 1 и 2 значимо различались между собой). При этом в группе 2 обнаружена тенденция к усилению выраженности проявлений по следующим кластерам: соматизация (соматоформные расстройства) – р<0,01, обсессивно-компульсивные расстройства – р<0,05, тревога – р<0,0001, фобическая тревога – р<0,01, прочие модальности – р<0,05. Очевидно, высокий удельный вес аффекта тревоги, широко представленный среди мужчин с АИТ, объясняется комплексом причин, среди которых в качестве основной может быть выделен ответ ЦНС на влияние хронического иммунного стресса со снижением порога стрессоустойчивости [1]. Изменения изучаемых показателей гормонального профиля в сравниваемых группах по структуре щитовидной железы, приведены в табл. 3.

Анализ средних значений показателей гормонального профиля в изученной выборке выявил статистически значимые отклонения по отношению к контрольным показателям по пролактину (PRL) – р<0,0001, фолликулостимулирующему гормону (FSH) – р<0,05, дегидроэпиандростерон-сульфату (DHЕА-S) – р<0,05, тестостерону (Tst) – р<0,05, тиреотропному гормону (ТSH) – р<0,005, антителам к тиреоглобулину (Tg Ab) – р<0,0001 и тиреопироксидазе (TPO Ab) – р<0,0001.
Известно, что гиперпролактинемия (ГПРЛ) выявляется в основном у гипотиреоидных больных с АИТ, что отражает влияние недостатка тиреоидных гормонов на секрецию пролактина [14]. В изученной выборке ГПРЛ зафиксирована в фазе эутиреоза в 31,4% случаев. Кроме того, выявлены достоверные различия по уровню пролактина как между выделенными группами (р<0,0001), так и для каждой из них в отдельности сравнительно с контрольной (р<0,0001). Обнаружены ассоциации между уровнем пролактинемии и показателями гуморального иммунитета: Tg Ab (r=0,34, p<0,0001) и TPO Ab (r=0,26, p<0,0001). Выявлена положительная корреляция между уровнем пролактина и показателями клеточного иммунитета: CD3 (r=0,21, p<0,0001), CD4 T-хелперами (r=0,14, p<0,01), CD95 (r=0,14, р<0,01); провоспалительными цитокинами ИЛ-1 (r=0,46, p<0,0001), ИЛ-2 (r=0,27, p<0,0001), a-TNF (r=0,51, p<0,0001), a-INF (r=0,43, p<0,0001) и отрицательная с ИЛ-6 (r=0,31, p<0,05), что указывает на взаимосвязь секреции пролактина с аутоиммунным процессом. Как показано в большом цикле работ [15–17], ГПРЛ является частым спутником аутоиммунных заболеваний, а его основная биологическая роль при стрессе связана с участием гормона в предотвращении негативного действия других стрессреализующих факторов [18].
Концентрация антител (Tg Ab и TPO Ab) у изученных пациентов существенно превышала диагностические пороги (р<0,0001), отражая тем самым активность процессов органоспецифической аутоагрессии.
По результатам исследования уровней DHЕА-S установлено, что достоверные отклонения его средних значений от контрольных показателей выявляются как у всех пациентов с АИТ (р<0,01), так и у больных группы 2 (р<0,005), причем у 15,2% пациентов этой группы индивидуальные значения определяемого показателя были меньше нижней границы нормы. Регистрировали также различия по содержанию в крови DHЕА-S между группами 1 и 2 с более низкими средними значениями гормона в группе 2, не выходящими за нижнюю границу нормативного диапазона (р<0,005). Выявлены устойчивые отрицательные корреляции DHЕА-S как с Tg Ab (r=-0,50, p<0,0001) и TPO Ab (r=-0,41, p<0,005), так и ИЛ-2 (r=-0,31, p<0,01), ИЛ-6 (r=-0,26, p<0,05). Согласно данным литературы снижение дегидроэпиандростерона, выполняющего роль иммуномодулятора, свидетельствует об истощении анаболических возможностей организма по мере нарастания иммунологической реактивности и значительном напряжении адаптационной системы [19].
Поскольку андрогены могут модулировать активность аутоиммунных процессов [20], в настоящем исследовании проанализированы концентрации тестостерона (Tst) в крови. Выявлена тенденция к снижению значений Tst как у пациентов в целом (р<0,05), так и у обследованных 1-й (р<0,05) и 2-й (р<0,005) групп по сравнению с контрольными без отклонения от границ референтных значений. Обнаружена отрицательная взаимосвязь уровня Tst с a-INF (r=-0,43, p<0,0001) и Tg Ab (r=-0,45, p<0,0001), которую можно расценивать как вклад в прогрессирование процессов иммунологической реактивности в отношении щитовидной железы при АИТ.
Для определения взаимосвязи клинических характеристик в формализованной оценке и биологических параметров методом корреляционного анализа сопоставлены уровни астении (шкала MFI-20), тревоги [шкалы НАМА, STAI (SA, PA), SCL-90], депрессии (шкала SCL-90) и показатели цитокинов и гормонального профиля. Результаты, полученные при таком сопоставлении, представлены в табл. 4 (включены только значимые корреляции).

Как видно из данных, приведенных в табл. 4, для астенических состояний при АИТ показана большая заинтересованность как иммунной, так и эндокринной систем. Выявлена положительная корреляционная связь между степенью астенизации и иммунными параметрами: ИЛ-1, ИЛ-2, ИЛ-3,ИЛ-6, a-TNF, a-INF, а также показателями антител Tg Ab и TPO Ab, что позволяет высказать следующее предположение. Иммунный дисбаланс является, по-видимому, одним из звеньев патогенеза астенических расстройств при АИТ. Анализ корреляционных взаимодействий выявил значимые ассоциативные связи астенических состояний с гормональными показателями, часть из которых обладает иммуномодулирующими свойствами (в частности, прямая зависимость существует с уровнем PRL, CORT, ESTR, но обратная – с Tst). Обнаружена также положительная взаимосвязь степени выраженности тревожного аффекта по шкале НАМА и уровня ИЛ-1, a-TNF, a-INF. Те же соотношения выявлены при тестировании по шкале SCL-90 (кластер SCL-ANX), использующей иной способ оценки выраженности психопатологических нарушений – установлена достоверная положительная корреляция между уровнем тревоги и значениями ИЛ-2 и a-INF. При сопоставлении данных подшкалы SCL-DEPR и исследуемых цитокинов обнаружена устойчивая положительная взаимосвязь формализованных характеристик депрессии и уровня ИЛ-6.
Получены результаты, свидетельствующие о возможной причастности гормональной системы к формированию психопатологической симптоматики в эутиреоидную фазу АИТ: установлена прямая зависимость между выраженностью тревожного аффекта (по всем указанным выше шкалам) и уровнем PRL, проявления депрессивной симптоматики соотносятся со снижением уровня тестостерона (Tst).
В заключение подчеркнем, что вся совокупность полученных в ходе настоящего исследования данных, может быть положена в обоснование целесообразности комплексного обследования мужчин с АИТ, позволяющего определить адекватные подходы к выбору патогенетически обоснованной терапии и совершенствования лечебной тактики с использованием комплексной терапии иммунотропными и психотропными препаратами, воздействующими на все составляющие болезненного процесса.
Список исп. литературыСкрыть список1. Ветлугина Т.П., Семке В.Я. Клиническая психонейроиммунология на современном этапе. Сибир. вестн. психиат. и наркол. 2001; 3: 34–6.
2. Anderson DJ. Immunologic aspects of menopause. J Immunol Tokyo 2000; p. 353–6.
3. Druckmann X. Review: Female sex hormones, autoimmune diseases and immune response. Gynecol Endocrinol 2001; 15 (Suppl. 6): 69–76.
4. Клюквина Н.Г., Ильина А.Е. Рос. мед. журн. 2005; 13 (8): 513–7.
5. Балаболкин М.И. Состояние и перспективы изучения проблемы физиологии и патологии щитовидной железы. Тер. арх. 1997; 10: 5–11.
6. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечению аутоиммунного тиреоидита у взрослых. Пробл. эндокринол. 2003; 6: 50–4.
7. Рафибеков Д.С., Калинин А.П. Аутоиммунный тиреоидит. Бишкек: КГМА, 1996; с. 158.
8. Савина Л.В., Белоножкин С.Л., Кадыгроб Г.В. и др. Роль экологических факторов в формировании заболеваемости аутоиммунным тиреоидитом. Пробл. эндокринол. 1999; 5: 26–9.
9. Volpe R. Immunoregulation in autoimmune thyroid disease. N Engl J 1994; 4: 373–7.
10. Grossman ChJ, Me Cruden AB, Stimson WH. Bilateral communication between the endocrine and immune systems. Springer-Verlag 1994; p. 36–43.
11. Ader R, Cohen N, Felden D. Psychoneuroimmunology: interactions between the nervous system and the immune system. Lancet 1995; 345 (8942): 99–103.
12. Иванов-Смоленский А.Г. Очерки патофизиологии высшей нервной деятельности. М., 1952; с. 70–4.
13. Иванова Г.П., Горобец Л.Н., Калинин В.В. Феномен алекситимии у больных аутоиммунным тиреоидитом. Сибир. вестн. психиат. и наркол. 2009; с. 59–63.
14. Lahat N, Miller A, Shriller R et al. Differential effects of prolactin upon activation and differentiation of human В lymphocytes. J Neuroimmunol 1993; 47: 35–40.
15. Дедов И.И., Мельниченко Г.А., Романцева Т.И. Синдром гиперпролактинемии. М.: Тверь, 2004; с. 70–4.
16. Субхангулов З.М., Давлетшин Р.А., Давлетшина Г.К., Сафина А.З. Пролактин и его взаимоотношение с цитокинами при аутоиммунном тиреоидите. Иммунол. и клин. иммунол. 2007; 28 (5): 300–3.
17. De Bellis A, Bizzarro A, Pivonello R et al. Prolactin and autoimmunity. Pituitary. J Clin Endocrinol Metab 2005; 8 (1): 25–30.
18. Freeman ME, Kanyicska В, Lerant A, Nagy G. Prolactin: Structure, function and regulation of secretion. Physiol Rev 2000; 80 (4): 1523–631.
19. Shanks N, Windle RJ, Perks PA. Early-life exposure to endotoxin alters hypothalamic-pituitary-adrenal function and prediposition to inflammation. Proc Natl Acad Sci USA 2000; 97: 5645–50.
20. Ueshiba H, Matoba H, Segava M et al. 80 years of Hashimoto Disease. Excerpta Medica 1993; p. 187–9.
30 ноября 2009
Количество просмотров: 2089


