Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№04 2009
Антидепрессант двойного действия венлафаксин (обзор зарубежной литературы) №04 2009
Номера страниц в выпуске:34-43
По данным одного из последних масштабных эпидемиологических исследований, депрессией («большой» и «биполярной» без учета других форм) страдают 7,8% взрослых жителей Евросоюза. Это значит, что 20,8 млн европейцев работоспособного возраста относятся не только к числу пораженных аффективной патологией, но и образуют группу высокого риска рецидива или хронификации депрессии.
По данным одного из последних масштабных эпидемиологических исследований, депрессией («большой» и «биполярной» без учета других форм) страдают 7,8% взрослых жителей Евросоюза [121]. Это значит, что 20,8 млн европейцев работоспособного возраста относятся не только к числу пораженных аффективной патологией, но и образуют группу высокого риска рецидива или хронификации депрессии. Известно также, что вероятность заболеть депрессией в течение жизни возрастает более чем вдвое и достигает 14,4–17,3% [50, 53, 60, 121]. При этом оказывается, что выздоровление или наступление стойкой ремиссии отмечается лишь у 33% больных, в то время как у 55% депрессия рецидивирует, а еще у 12% продолжается годами и даже десятилетиями. Такой вывод следует из катамнестических данных. Они приводятся, в частности, M.Keller и соавт. [58], изучившими репрезентативную выборку больных с депрессивными расстройствами (431 наблюдение; длительность катамнеза – 5–15 лет). Пятая часть жизни этих пациентов и их семей проходит под бременем депрессивной болезни, чреватой суицидами [74]. Депрессивные расстройства в развитых странах занимают второе место среди причин нетрудоспособности [77]. При этом, несмотря на успехи, достигнутые благодаря «второй психофармакологической революции», ознаменовавшейся синтезом селективных ингибиторов обратного захвата серотонина (СИОЗС), существенная доля больных остаются резистентными к лечению тимоаналептиками [5]. Такое положение определяет актуальность поиска новых антидепрессантов.
Опыт изучения тимоаналептиков, избирательно блокирующих обратный захват серотонина (СИОЗС), подтвердил, что их действие практически лишено свойственных трициклическим антидепрессантам (ТЦА) побочных эффектов (холинолитические, адренолитические, кардиотоксические), являющихся основной причиной нарушений комплаентности вплоть до отказа от продолжения терапии. Установлено, что при назначении препаратов этой группы частота преждевременной отмены терапии достоверно ниже, чем при лечении ТЦА [4]. Тем не менее, несмотря на такое превосходство современных антидепрессантов над традиционными, они не более эффективны [5, 32, 40, 46]. По мере накопления опыта применения СИОЗС оказалось, что их клиническая активность не обеспечивает более существенной редукции проявлений депрессии, чем ТЦА, обладающие «двойным действием» [1, 27, 91]. Основанием к представлению о том, что не менее значимая роль в патогенезе депрессии принадлежит норадренергической передаче, послужили полученные с учетом требований доказательной медицины данные о том, что СИОЗС уступают ТЦА при купировании тяжелых депрессий, их клиническая активность реализуется позже, а способность контролировать симптомы депрессии и снижать частоту рецидивов меньше, чем у ТЦА [1, 5, 25, 26, 124, 128, 131].
Было выдвинуто предположение о том, что селективные антидепрессанты двойного действия могут превзойти СИОЗС по эффективности [52, 78, 100].
Эта гипотеза послужила отправным пунктом к созданию II поколения антидепрессантов двойного действия – селективных ингибиторов обратного захвата серотонина и норадреналина, первым из которых является венлафаксин [54].
Фармакологические свойства венлафаксина1. По химической структуре венлафаксин относится к бициклическим соединениям, представляя собой рацемическую смесь двух активных энантиомеров. Венлафаксин (и его основной метаболит О-десметилвенлафаксин), обладающий, как и ТЦА, ингибирующим воздействием на обратный захват серотонина и норадреналина2, практически не связывается с мускариновыми, холинергическими, гистаминовыми и a1-адренергическими рецепторами. Кроме того, препарат не оказывает существенного влияния на активность моноаминоксидазы, не обладает сродством к опиатным, бензодиазепиновым, фенциклидиновым рецепторам, а также к рецепторам N-метил-D-аспарагиновой кислоты (NMDA). Как и другие современные тимоаналептики двойного действия, венлафаксин избирательно ингибирует обратный захват норадреналина и серотонина приблизительно в одном диапазоне концентраций и не оказывает существенного влияния на другие нейротрансмиттерные системы [6, 65, 124, 129, 130]. Так, согласно экспериментальным данным, полученным F.Bymaster и соавт. [16, 17], соотношение констант связывания с белками-транспортерами норадреналина и серотонина для венлафаксина составляет 30,3, что в 6 раз больше, чем тот же показатель для имипрамина, и почти в 5 раз меньше, чем для флуоксетина, следовательно, венлафаксин занимает по балансу связывания с указанными моноаминовыми рецепторами промежуточное положение между ТЦА и СИОЗС. Препарат хорошо всасывается из желудочно-кишечного тракта, его максимальная концентрация в плазме крови достигает 33–172 нг/мл в течение приблизительно 2,4 ч; периоды полувыведения венлафаксина и его основного метаболита составляют 5 и 11 ч соответственно; равновесные концентрации достигаются в течение 72 ч. Показатель связывания с белками крови составляет 25% против 80–95% для СИОЗС, т.е. при одинаковой концентрации препаратов в плазме уровень свободной активной фракции венлафаксина значительно выше, чем у СИОЗС. Подвергаясь интенсивному метаболизму при первом прохождении через печень, венлафаксин оказывает минимальное (даже сравнительно с СИОЗС) воздействие на изоэнзимы цитохрома Р-450, что позволяет заведомо прогнозировать низкий риск лекарственных взаимодействий [109]. Венлафаксин и его метаболиты выделяются почками.
Спектр клинической активности венлафаксина. Обращаясь к анализу данных литературы об эффективности венлафаксина, сразу же подчеркнем, что еще на этапе доклинических испытаний препарата в открытых исследованиях [43, 96] появились обнадеживающие сведения о его способности купировать проявления депрессии (табл. 1).
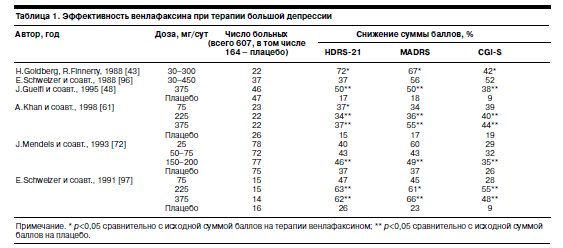
Так, в двух одновременно проведенных открытых исследованиях [43, 96], насчитывающих в совокупности 59 наблюдений, показано снижение суммы баллов по всем использованным психометрическим шкалам, причем в первом из них такое снижение было статистически достоверным сравнительно с исходными показателями. В более поздних плацебо-контролируемых исследованиях (всего 548 наблюдений, из них 384 пациента, получавших венлафаксин в широком диапазоне доз – от 25 до 374 мг/сут) это предварительное представление получило подтверждение на статистической основе [48, 61, 72, 97].
Если обобщить результаты открытых исследований, то выясняется, что, во-первых, доли больных, у которых регистрируется положительный ответ на терапию вполне сопоставимы, во-вторых, что такой эффект отличается стойкостью и, в-третьих, что частота преждевременного прекращения терапии не превышает 15–25%.
Одна из этих работ выполнена в Канаде C. de Montigny и соавт. [75] в рамках многоцентрового 8-недельного открытого изучения эффективности и переносимости венлафаксина у больных большой депрессией (159 госпитализированных/амбулаторных больных в возрасте от 18 до 70 лет; HDRS-21≥18 баллов). Венлафаксин применяли в стартовой дозе 37,5 мг/сут с последующей титрацией до максимальной – 375 мг/сут, проведенной с учетом переносимости и ответа на лечение (средняя доза 260 мг/сут). Полностью завершили исследование 152 (95,6%) пациента. Положительный ответ (редукция исходного балла 52% по HDRS-21 и 50% по MADRS), зарегистрирован к моменту завершения исследования у 52% больных, а ремиссия (улучшение на 75% и более по шкале HDRS-21) – у 28%; у 88% больных выявлено также улучшение по шкале общего клинического впечатления (CGI). Целью другого канадского открытого исследования [56] было изучение эффективности и переносимости венлафаксина в реальной клинической практике. В работе над этим натуралистическим исследованием участвовали 211 практических врачей, в их числе – 149 семейных и 62 психиатра; каждый мог включить не более 5 пациентов. Терапия венлафаксином оказалась эффективной у 62% от общего числа амбулаторных больных депрессией (880 наблюдений) и не сопровождалась тяжелыми побочными эффектами.
Полученные данные совпадают с результатами пенсильванских авторов [35], согласно которым частота положительного ответа на кратковременную терапию венлафаксином составила 60–70%, а преждевременного прекращения лечения – 15–25%. Объединенные результаты еще двух открытых исследований (опубликованы в виде тезисов) с участием 327 больных подтвердили, что антидепрессивный эффект венлафаксина в средней дозе 143–186 мг/сут сохраняет стойкость в течение 12 мес [54].
В ходе сравнительных клинических исследований (в доступной литературе обнаружено 10 таких работ [9, 10, 42, 66, 70, 93, 98, 102, 106, 108]) была показана сопоставимая с ТЦА эффективность венлафаксина. Если такая сопоставимость нуждалась в подтверждении на статистически доказательной базе, то безусловным преимуществом венлафаксана оказалась относительная редкость клинически значимых нежелательных явлений, в том числе холинергических [93]. Проиллюстрируем сказанное несколькими примерами.
В двойном слепом сравнительном исследовании венлафаксина (до 150 мг/сут) и амитриптилина в идентичных дозах (до 150 мг/сут) у амбулаторных больных с большой депрессией установлено, что оба препарата обнаруживают сопоставимую эффективность. При этом нежелательные явления значимо чаще регистрируются на фоне терапии амитриптилином [9]. В рандомизированном исследовании R.Shrivastava и соавт. [102], выполненном в одном из медицинских центров Нью-Йорка, представлено сравнение венлафаксина и имипрамина (381 пациент; средний возраст 43 года; 54% женщин), подтвердившее статистически достоверно более высокую эффективность венлафаксина в дозах 75–225 мг/сут (в среднем 165 мг/сут) сравнительно с имипрамином и плацебо. Эти значимые различия выявлялись в течение 8-недельного курса терапии и сохранялись на 6 и 12-м месяцах лечения. Терапия венлафаксином сопровождалась статистически достоверно более низким числом нонреспондеров и нежелательных явлений.
Результаты этих исследований, начиная с первых публикаций [117] и кончая последними [118, 122], датированными 1997 и 2000 гг. соответственно, свидетельствуют о сопоставимой эффективности венлафаксина и препаратов сравнения. Приводимую при этом информацию следует рассматривать с учетом того обстоятельства, что венлафаксин, являясь (как и традиционные тимоаналептики) препаратом двойного действия, подобно СИОЗС, уступает ТЦА при купировании тяжелых депрессий. По-видимому, неслучайно материалом клинических исследований эффективности венлафаксина (как и других современных антидепрессантов) даже в случае большой депрессии является амбулаторный контингент.
Коллектив авторов, работавших в рамках специальной программы [136], представил обзор 293 публикаций, посвященных эффективности и безопасности антидепрессантов современных генераций (включая венлафаксин). Из них 187 соответствовали требованиям доказательной медицины, причем 126 финансировались фармацевтическими компаниями и лишь 17 – государственными учреждениями или независимыми фондами. Метаанализ показал, что шансы положительного терапевтического ответа для венлафаксина значимо выше, чем для СИОЗС (флуоксетин). Отмечено также важное преимущество венлафаксина: при лечении резистентных депрессий этот препарат более эффективен, чем СИОЗС (циталопрам, флуоксетин, сертралин) и другой антидепрессант двойного действия – миртазапин, причем терапия венлафаксином сопровождается минимальным (сравнительно с миртазапином) увеличением массы тела. Кроме того, при сравнении с СИОЗС более высокая частота преждевременного отказа от продолжения терапии из-за побочных эффектов (11,5% против 8,5%) компенсируется более редкой отменой из-за недостаточной эффективности (3,5% против 4,4%).
К числу наиболее методологически безупречных обобщающих работ, выполненных в последние годы в форме метаанализа, позволяющего объективно оценить различные аспекты клинической активности венлафаксина сравнительно с СИОЗС, относится обзорная публикация D. Smith и соавт. [110]. На предварительном этапе авторами, подчеркивающими необходимость проведения исследований в соответствии с современными требованиям доказательной медицины3, из 2349 работ отобрано 32 рандомизированных двойных слепых сравнительных исследования эффективности венлафаксина [1, 7, 10, 21–23, 41, 42, 49, 66, 67, 70, 71, 85, 89, 90, 92, 93, 95, 98, 102, 103, 106, 108, 117, 118, 122], удовлетворяющих таким требованиям. Результаты этих исследований (из них на сопоставление с ТЦА амитриптилином, кломипрамином, дезипрамином приходится 7 работ) подтверждают статистически значимо более высокую, чем СИОЗС, эффективность воздействия венлафаксина на симптомы большой депрессии, диагностированной по DSM-IV4, однако в сравнении с ТЦА такого превосходства не обнаружено.
В контексте оценки тимоаналептических свойств венлафаксина уместно остановиться на дозозависимой эффективности препарата, выявленной в части уже цитированных выше исследований [48, 61, 72, 96, 97]. Так, J.Mendels и соавт. [72] применяли венлафаксин/плацебо у 312 амбулаторных больных в течение 6 нед. Суточные дозы венлафаксина составляли 25, 50–75 и 150–200 мг/сут, а дозозавимый эффект проявлялся уже в течение 1-й недели лечения5. В другом 6-недельном двойном слепом исследовании [54] рандомизированы 323 больных, которым назначали плацебо или венлафаксин в дозах 75, 225 или 375 мг/сут; в двух последних группах дозу титровали в течение 7 дней. Эффективность оценивали с помощью шкал HDRS, MADRS и CGI. Улучшение во всех группах венлафаксина (Велафакс) значимо превосходило эффект плацебо; при этом эффективность 375 мг препарата оказалась выше, чем при назначении в более низких дозах.
Следует также отметить, что дозозависимый эффект венлафаксина (Велафакса) проявляется и при воздействии на болевые синдромы. Первоначально такой эффект был выявлен N.Kunz и соавт. [64] при диабетической нейропатии; оказалось, что если в дозе 75 мг/сут антиноцицептивное действие не проявлялось (по этому признаку венлафаксин не отличался от СИОЗС и плацебо), то в дозах 150–225 мг/сут терапия сопровождалась значимой редукцией болей. Эти данные позволили J.Markowitz и K. Patrick [67] предположить, что препарат окажется эффективным и при других алгопатиях. Высказанная гипотеза в дальнейшем подтвердилась в ряде исследований, показавших эффективность венлафаксина при терапии мигрени и головных болей напряжения [1], фибромиалгий [31, 94], хронического болевого [39, 47] и других соматоформных расстройств [63], в том числе и коморбидных депрессии [8, 12].
Не менее значимым клиническим эффектом венлафаксина является его способность купировать тревогу. Предваряя обсуждение результатов изучения венлафаксина в этом аспекте, подчеркнем следующее.
Вклад анксиозных расстройств в структуру аффективной патологии, по мнению некоторых исследователей, настолько важен, что требует построения новых таксономических единиц. В частности, в ходе дискуссии, связанной с подготовкой очередного пересмотра американской классификации психических расстройств – DSM-V, D.Watson предлагает рассматривать гипотимические состояния и генерализованную тревогу в пределах общей категории – «Эмоциональные расстройства с преобладанием дистресса». Эта позиция согласуется с представлениями H.van Praag [119], предполагающего, что «гордиев узел» депрессия – тревога может быть распутан следующим образом: за такие проявления, как тревога, агрессия, склонность к суицидальному поведению, «ответственны» нарушения метаболизма серотонина, а «сбой» норадренергической трансмиссии влечет за собой иные проявления – собственно меланхолию, ангедонию, снижение побуждений.
Анксиолитический эффект венлафаксина продемонстрирован в представленном R.Rudolph [88] в метаанализе 6 исследований препарата, применявшегося у больных тревожной депрессией. При ретроспективной оценке оказалось, что наряду со статистически достоверным (p≤0,001) сравнительно с плацебо снижением выраженности собственно гипотимической составляющей депрессивного синдрома, терапия венлафаксином сопровождается значимым улучшением по фактору «тревога» шкалы HDRS уже через 1 нед и по факторам «тревога»/«соматизация» через 3 нед лечения. При этом достигнутый эффект достаточно стоек и сохранялся через 6 и 12 нед лечения. К сходным выводам приходят и авторы более поздних исследований [45, 57, 80], причем A.De Nayer и соавт. [80] отметили, что на момент последнего визита состояние 59,4% больных, получавших венлафаксин, квалифицировалось как ремиссия против 40,3% на фоне терапии препаратом сравнения (флуоксетин).
Появляются публикации, посвященные эффективности венлафаксина при депрессиях, коморбидных алкогольной зависимости. В открытом многоцентровом 24-недельном проспективном исследовании 90 амбулаторных пациентов (средний возраст 44,9±9,7 года; 73,4% мужчин) с диагнозом «алкогольная зависимость» и коморбидной большой депрессией [134] венлафаксин показал свою эффективность. Выраженность депрессии (средние значения по шкале Гамильтона) значимо снижалась при оценке на каждом следующем визите по сравнению с предыдущим (p<0,0005). Наряду с редукцией депрессии и признаками стабилизации психического состояния также нормализовалось соматическое состояние, снижалась тяга к употреблению алкоголя, восстанавливались семейные и социальные взаимоотношения. Зарегистрирован также благоприятный профиль переносимости и безопасности препарата у 76,7% пациентов. Полученные авторами данные согласуются с результатами предшествующих немногочисленных исследований [132, 133].
В этой работе выдвинут принципиально важный для клинической практики вопрос об оценке эффективности терапии в терминах «ответ» (степень улучшения в процентах от исходного базового уровня, позволяющая дифференцировать респондеров от нонреспондеров) – «ремиссия» (полная/частичная редукция симптоматики со снижением тяжести симптомов до нижних пороговых значений). Соответственно ремиссия – более строгий стандарт, «поднимающий планку» оценки эффективности терапии в соответствии с критерием достижения длительной и стойкой стабилизации состояния.
Эту позицию отстаивает, в частности, S.Stahl в полемической статье, озаглавленной «Причиняет ли депрессия боль?» [107]. Автор считает ошибочным ограничение целей терапии 50% редукцией депрессивных проявлений; такой целью может являться только достижение ремиссии. Вероятность становления ремиссии при использовании антидепрессантов двойного действия, включая венлафаксин, повышается. При этом S. Stahl опирается на данные, полученные в серии работ, выполненных пенсильванскими (Филадельфия) учеными M.Thase и соавт. [113] и основанных на результатах 8 сравнительных исследований венлафаксина и СИОЗС. Метаанализ показал, что положительный эффект к 8-й неделе терапии венлафаксином достигает 40–55% против 31–37% для СИОЗС (различия статистически достоверны, p≥0,05) и выявляется на более ранних сроках. A.Entsuah и соавт. [35] при пересмотре тех же данных подтвердили, что эти различия статистически значимы и не зависят от гендерных и возрастных факторов.
Исходя из результатов 4 рандомизированных двойных слепых плацебо-контролируемых клинических исследований, R.Golden и L.Nicholas [44] представили анализ частоты рецидивов у амбулаторных больных большой депрессией (304 пациента: 184 получали венлафаксин и 119 – плацебо) – респондеров к венлафаксину. Положительный ответ на терапию был зафиксирован после 4-недельного курса лечения, продолженного до 12 мес. Длительную терапию завершили 38% от общего числа больных, получавших венлафаксин, и 26% – из группы плацебо. Через 6 мес частота рецидивов составила 11 и 23% соответственно. По мнению авторов, эти результаты являются свидетельством эффективности использования длительной противорецидивной терапии венлафаксином, снижающей риск рецидивов большой депрессии.
Не менее важным аспектом проблемы терапии депрессий, которым в последние годы уделяется особое внимание, являются вопросы, связанные с преодолением резистентности, чреватой высокой потребностью в специализированной помощи (а следовательно, в использовании ресурсов здравоохранения) и снижением трудоспособности [112, 113, 135].
В обзоре M.Thase и соавт. [112] обобщаются данные об эффективности венлафаксина при терапевтически резистентных депрессиях (отсутствие ответа на терапию тремя различными антидепрессантами двух разных классов или к электросудорожной терапии в сочетании с двумя антидепрессантами). Анализ публикаций позволил авторам придти к выводу о том, что на 8-недельную терапию венлафаксином (Велафаксом) в дозах 150–375 мг/сут отвечают 40–55% больных депрессией, ранее резистентной к лечению, причем достигнутый результат остается устойчивым при продолжении лечения в течение 12 мес.
В цитированном выше исследовании C. de Montigny [75] также оценивался ответ на терапию венлафаксином у рефрактерных к предшествующему тимоаналептическому лечению пациентов, получавших до включения в изученную выборку от 1 до 8 антидепрессантов (45% – не менее 3), назначавшихся в адекватных дозах. Было показано, что венлафаксин оптимизирует в подобных случаях ответ на терапию – доля пациентов с явлениями терапевтической резистентности сокращается в среднем на 1/3. К тому же выводу приходят и авторы других работ [73, 79, 104, 113]. Так, в двухэтапном открытом исследовании, проводившемся в 40 медицинских центрах Австралии [73], получены следующие результаты. Больным депрессией (312 пациентов) с признаками резистентности – «абсолютной» (отсутствие ответа на 4-недельную терапию стандартными антидепрессантами в максимальных терапевтических дозах) или «относительной» (без признаков улучшения при назначении минимальных доз тимоаналептиков) проведен 8-недельный курс лечения венлафаксином в суточных дозах до 300 мг. Доля респондеров (улучшение по шкале MADRS на 50%) составила 52,6% и только 15,7% отнесены к числу «абсолютно» резистентных. При этом положительный ответ на терапию обнаруживал следующую зависимость: если в течение первых 2 нед лечения регистрировали улучшение по крайней мере на 20%, то можно было прогнозировать вероятность преодоления резистентности. Этот прогноз подтвердился во второй фазе исследования, продолженного E.Schweitzer и соавт. [99]. Авторы приводят данные, позволяющие оценить результаты длительной (10 мес после завершения 8-недельной фазы) терапии венлафаксином (149 больных с резистентной депрессией). Частота положительного ответа через 8 нед от начала обсуждаемой фазы, т.е. через 16 нед от фактического начала курса лечения, и на момент его окончания составила 69 и 73% соответственно. У больных, продолживших лечение венлафаксином в течение 10 мес, отмечено не только сохранение первоначального ответа на 8-недельную терапию, но и признаки дальнейшего улучшения состояния.
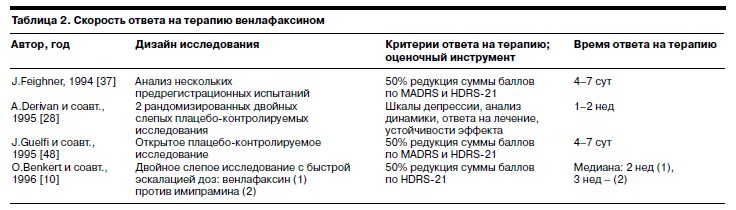
К концу столетия эти данные были подтверждены в ряде исследований [34, 61], а в начале нового века P.Silverstone и соавт. [105] сформулировали положение о том, что оценка эффективности, определение ремиссии и времени ответа на терапию должны проводиться дифференцированно. Необходимо учитывать динамику показателей по двум имеющим принципиальное значение параметрам шкалы HDRS-21; речь идет о пунктах «депрессивное настроение» и «психическая тревога». При такой оценке сопоставление эффективности венлафаксина и СИОЗС позволило установить, что время ответа на терапию обоими препаратами составляет 2 нед, хотя эффективность венлафаксина выше.
Переходя к обсуждению переносимости, безопасности и нежелательных эффектов венлафаксина, необходимо подчеркнуть следующее.
Согласно определению ВОЗ под нежелательным действием лекарственного препарата (НДЛП) понимается любая непредусмотренная патологическая реакция, возникающая при его применении в дозах, обычно используемых для профилактики или лечения. Аргументом, доказывающим «виновность» лекарственного препарата в нежелательном действии, может стать повторное развитие наблюдаемого ранее НДЛП при возобновлении его приема («позитивная реэкспозиция» по G.Laux и соавт. [65]). При том что усредненная частота побочных эффектов составляет для ТЦА 1,5%, для СИОЗС 1,7% [65]6, по данным созданной в Германии Рабочей группы по контролю за лекарственными препаратами в психиатрии, на фоне терапии этими антидепрессатами в течение 12 лет (1989–2001 гг.) НДЛП зарегистрированы у 52% пациентов, из них в 2% случаев они расценены как угрожающие жизни (делирий, судорожные припадки, паралитическая кишечная непроходимость, токсический гепатит, холестаз, угнетение дыхания); требующие изменения терапии – 21,5%, отмены препарата – 8%. При сопоставлении последнего показателя с адаптированными по материалам J.Rakesh [91] данными P.Tran и соавт. [115] – 21% для кломипрамина и 33% для имипрамина – становится очевидным, что доля пациентов, преждевременно прекращающих терапию (и среди них тех, кто совершает «выбор в пользу рецидива»), может оказаться значительно более высокой. В то же время при лечении венлафаксином показатель преждевременной отмены терапии составляет 11–19%, а по данным C. de Montigny и соавт. [75], только 8% больных отказываются от продолжения терапии в связи с побочными эффектами (головная боль, бессонница, тошнота, запоры, потливость, ксеростомия).
В обзорной публикации R.Rudolph и A.Derivan [87], посвященной анализу переносимости и безопасности венлафаксина у 3082 пациентов, из которых у 455 лечение продолжалось в течение года, также отмечена низкая частота прекращения лечения из-за нежелательных явлений7. Напротив, авторы подчеркивают, что нежелательные реакции, сопровождающие прием венлафаксина (тошнота, бессонница, головокружение, сонливость, запоры, потливость), хотя и встречаются чаще, чем у пациентов, получавших плацебо, носят транзиторный характер, не требуют дополнительной коррекции и при продолжении терапии полностью редуцируются. В первую очередь это касается тошноты, наблюдавшейся в начале лечения и оказавшейся полностью обратимой у подавляющего большинства пациентов. Этот вывод согласуется с данными метаанализа 19 исследований, включающих 2181 наблюдение [24], в котором среди побочных эффектов, в совокупности лишь несколько превышающих 10%, наиболее распространенным является тошнота, приводящая в 6% случаев к отмене препарата. Вместе с тем этот нежелательный эффект снижается на 50% уже после 1-й недели терапии и минимизируется в течение дальнейшего курса лечения. При этом, как подчеркивается в обзоре R.Rudolph и A.Derivan [87], изучение больших выборок показало, переносимость и безопасность венлафаксина у пожилых пациентов (65 лет и старше) достоверно не отличаются от соответствующих показателей, полученных у пациентов более молодого возраста.
При оценке нежелательных явлений, сопряженных с приемом антидепрессантов современных поколений, большое значение придается сексуальным дисфункциям (нарушения либидо, эрекции, эякуляции, аноргазмия, импотенция), развитие которых может поддерживать негативную самооценку, а также идеи несостоятельности в содержании депрессии.
Анализ данных, приведенных в специально посвященных этому аспекту действия венлафаксина публикациях [20, 59, 114], выполненных в последние 7 лет, позволяет утверждать следующее. При сопоставлении частоты и характера сексуальных дисфункций на 8–14-й неделе терапии обратными ингибиторами моноаминоксидазы – ОИМАО (моклобемид), СИОЗС (сертралин) и венлафаксином (107 пациентов с большой депрессией) с помощью специального опросника (Sexual Functioning Questionnaire) было установлено, что у мужчин на терапии всеми применявшимися антидепрессантами значимо больше, чем у женщин (p<0,05), нарушается сексуальное влечение (либидо, потенция), тогда как по признаку аноргазмии различий не выявляется. Частота сексуальных дисфункций у женщин зарегистрирована реже (26–32% против 38–50% у мужчин). Венлафаксин по показателю сексуальной дисфункции обнаруживал тенденцию к промежуточному рейтингу между СИОЗС и ОИМАО-А [59]. При сравнении риска возникновения сексуальных дисфункций на фоне терапии бупропионом, нефазодоном8, СИОЗС (флуоксетин, пароксетин, сертралин, циталопрам) и препаратами двойного действия (миртазапин, венлафаксин) [20] у амбулаторных больных с депрессиями (4534 женщины и 1763 мужчины) оказалось, что эти расстройства выявляются при использовании первых двух препаратов с минимальной частотой (22–28%), а для всех остальных антидепрессантов значения этого показателя колеблются в диапазоне 36–43%. В двойном слепом сравнительном многоцентровом исследовании сексуального функционирования, антидепрессивной эффективности и переносимости бупропиона (300–450 мг/сут) и венлафаксина (150–225 мг/сут) M.Thase и соавт. [114] показали, что на фоне курсовой (12 нед) терапии 348 пациентов репродуктивного возраста сексуальное функционирование (в субъективной оценке) обнаруживает статистически значимые различия. Если применение бупропиона у пациентов без признаков сексуальных дисфункций до начала лечения не оказывало нежелательного воздействия на в эту сферу, то на фоне терапии венлафаксином такие нарушения выявлялись начиная со 2-й недели.
При этом подчеркивается необходимость проведения дальнейших исследований на основе единой методологии с использованием валидных оценочных инструментов.
Тяжелые НДЛП (синдром отмены, серотониновый синдром, кардиотоксический эффект9, включая влияние на сердечную проводимость и активности печеночных ферментов, судороги) у больных, получавших венлафаксин, встречались редко [86]10. Так, показатели артериального давления даже при сочетании депрессии с коморбидной соматической патологией (артериальная гипертензия, ИБС, фибрилляция предсердий, сердечная недостаточность, состояние после инфаркта/инсульта, транзиторные ишемические атаки, атеросклеротическая энцефалопатия, черепно-мозговая травма, сахарный диабет), как это показано в сравнительном исследовании B.Zimmer и соавт. [123], при применении венлафаксина существенно не менялись. В 88% случаев терапия не сопровождалась ни развитием артериальной гипертензии, ни клинически значимыми различиями уровней систолического артериального давления (АД). Лишь у пациентов престарелого возраста зарегистрировано статистически незначимое повышение диастолического АД на 4,7 мм рт. ст. Некоторые авторы [13, 14] устанавливают нижнюю границу частоты повышения АД в 2% и указывают, что этот показатель может достигать максимума – 13%. При этом отмечено, что повышение диастолического АД относится к числу дозозависимых эффектов венлафаксина, как и другие серотонинергические НДЛП (тошнота, инсомния, сексуальные дисфункции). Результат метаанализа [111] исследований, обобщающих около 4 тыс. наблюдений, показал, что повышение диастолического АД в среднем на 2 мм рт. ст. в покое, сравнимое с эффектом плацебо, регистрируется на суточных дозах венлафаксина менее 200 мг. В то же время при повышении дозы у 5% больных отмечено клинически значимое повышение диастолического АД.
Доля летальных исходов вследствие передозировки антидепрессантов с суицидальной целью составляет 4–7% от общего числа суицидов; причем в 1/3 случаев такие исходы регистрируются при комбинации тимоаналептиков с алкоголем и другими лекарствами. О благоприятном профиле переносимости и безопасности венлафаксина свидетельствуют данные как ранних, так и современных исследований. Обобщая результаты работ, выполненных до 1996 г., R.Rudolph и A.Derivan [87] сообщают о 14 случаях преднамеренной передозировки венлафаксина в дозах, в 10 раз или более превышавших рекомендуемые (концентрация препарата в плазме крови в 30 раз превосходила терапевтическую). Ни в одном из этих случаев каких-либо серьезных последствий не зарегистрировано.
Однако одновременно стали появляться и отдельные сообщения, указывающие не только на возможность нейротоксических осложнений при передозировке венлафаксина [36, 120] и в их числе повторных судорожных припадков [11, 82], но и на летальный исход вследствие приема 3500–7500 мг венлафаксина (2 наблюдения A.Parsons и соавт. [83] из судебно-медицинской лаборатории Сакраменто; оба пациента престарелого возраста с длительным анамнезом депрессивной болезни, активными суицидальными мыслями; в 1 случае депрессия сочеталась с тяжелой кардиоваскулярной патологией).
На сегодняшний день риск фатального исхода при передозировке венлафаксина и других лекарств рассчитывается на основе современных критериев (отношение числа смертей к числу назначений препарата) [29]. По этому признаку в табл. 3 приведено сравнение венлафаксина с другими тимоаналептиками – СИОЗС и ТЦА.

Немаловажным фактором, определяющим уровень безопасности психотропных средств в целом и антидепрессантов в частности, является риск повреждающего воздействия «по вертикали»11, т.е. влияние препарата, поступающего из организма матери, получающей препарат в период беременности или кормления, на плод или новорожденного. С учетом такого риска антидепрессанты беременным назначают при крайней необходимости по строгим клиническим показаниям (психотические депрессии; депрессии с суицидальными идеями, тоскливые/тревожные депрессии, протекающие с выраженными расстройствами сна и аппетита, усугубляющими соматическое состояние женщины). Необходимость оценки потенциальной опасности применяемых средств в плане тератогенных или других негативных эффектов возникает также при незапланированной беременности, когда будущая мать продолжает принимать антидепрессанты. Соответственно, целью исследования, проведенного S.Shaikir [101], являлся ответ на вопрос: повышает ли венлафаксин риск мальформаций (врожденные уродства), составляющий в населении 1–3%. Изученная автором выборка сформирована из числа женщин, обращавшихся к специалистам службы здоровья беременных и кормящих за информацией о безопасности приема венлафаксина в I триместре беременности. Из их числа 125 разрешились живым плодом, у 18 зарегистрированы самопроизвольные аборты, еще у 7 беременность была прервана по медицинским показаниям. Врожденные уродства плода (гипоспадия, дефект нервной трубки с косолапостью) выявлены на фоне принимаемой матерью терапии венлафаксином в 2 случаях против 3 (дефект межпредсердной перегородки, пилоростеноз, отсутствие мозолистого тела) в группе сравнения (женщины, принимавшие СИОЗС). По данным другого многоцентрового проспективного конролируемого исследования [33], из 39 женщин, принимавших во время беременности венлафаксин, гестация завершилась 13 абортами (7 спонтанных, 6 медицинских) и 26 срочными родами без признаков патологии плода. Описано также [51] 2 случая грудного вскармливания (до 6 мес) матерями, получавшими венлафаксин в дозах 75–150 мг/сут, без негативных последствий для младенцев (последние получали 7,6% материнской дозы препарата).
В качестве принципиального требования к новым психотропным средствам (в частности, к антидепрессантам) рассматривается минимальное влияние на поведенческие и психомоторные функции («поведенческая токсичность»), а следовательно – на качество жизни пациентов. В этом плане особую субъективную значимость имеет неотъемлемый атрибут современного общества – возможность водить автомобиль. Венлафаксин (хотя полученные данные не могут считаться окончательными) не обладает поведенческой токсичностью и не нарушает навыков вождения. Если ТЦА оказывают негативное влияние на способность водить автомобиль (при разборе 20 000 дорожно-транспортных происшествий выявлено, что при приеме ТЦА риск попадания в аварию возрастает в 2,2 и даже в 5,5 раза (доза амитриптилина 125 мг/сут), а исследования, проведенные на здоровых добровольцах показали, что результаты психомоторных тестов ухудшаются уже после однократного приема классических тимоаналептиков [65], то венлафаксин, по данным J.O’Hanlon и соавт. [81], не влияет на реакцию при вождении. Этот вывод вытекает из результатов проведенного авторами двойного слепого плацебо-контролируемого сравнительного анализа венлафаксина (75–150 мг/сут) и миансерина (30–60 мг/сут). Выборку получавших венлафаксин составили 37 волонтеров, из которых 22 полностью завершили исследование.
Таким образом, Велафакс (венлафаксин) является эффективным антидепрессантом для эмпирической терапии депрессивных расстройств любой степени тяжести, в т.ч. с выраженным тревожным компонентом, что согласуются с результатами, полученными другими авторами [(137, 138, 139, 140)].
Наряду с доказанной клинической эффективностью Велафаксу свойственен благоприятный профиль переносимости и высокий уровень безопасности, что, учитывая высокую распространенность аффективной патологии, в т.ч. сочетанной с проявлениями тревоги, обуславливает целесообразность применения Велафакса как в госпитальной, так и при продолжительной амбулаторной терапии указанных расстройств.
В заключение необходимо подчеркнуть, что расширение арсенала антидепрессантов с внедрением в клиническую практику венлафаксина намечает перспективы дальнейших исследований не только в области патогенеза и клиники депрессий, но изучения механизмов действия тимоаналептиков. Такие исследования, проводимые на базе принципов доказательной медицины, обеспечат решение важных задач современной клинической психофармакологии, направленных на создание оптимально действующих антидепрессантов.
Опыт изучения тимоаналептиков, избирательно блокирующих обратный захват серотонина (СИОЗС), подтвердил, что их действие практически лишено свойственных трициклическим антидепрессантам (ТЦА) побочных эффектов (холинолитические, адренолитические, кардиотоксические), являющихся основной причиной нарушений комплаентности вплоть до отказа от продолжения терапии. Установлено, что при назначении препаратов этой группы частота преждевременной отмены терапии достоверно ниже, чем при лечении ТЦА [4]. Тем не менее, несмотря на такое превосходство современных антидепрессантов над традиционными, они не более эффективны [5, 32, 40, 46]. По мере накопления опыта применения СИОЗС оказалось, что их клиническая активность не обеспечивает более существенной редукции проявлений депрессии, чем ТЦА, обладающие «двойным действием» [1, 27, 91]. Основанием к представлению о том, что не менее значимая роль в патогенезе депрессии принадлежит норадренергической передаче, послужили полученные с учетом требований доказательной медицины данные о том, что СИОЗС уступают ТЦА при купировании тяжелых депрессий, их клиническая активность реализуется позже, а способность контролировать симптомы депрессии и снижать частоту рецидивов меньше, чем у ТЦА [1, 5, 25, 26, 124, 128, 131].
Было выдвинуто предположение о том, что селективные антидепрессанты двойного действия могут превзойти СИОЗС по эффективности [52, 78, 100].
Эта гипотеза послужила отправным пунктом к созданию II поколения антидепрессантов двойного действия – селективных ингибиторов обратного захвата серотонина и норадреналина, первым из которых является венлафаксин [54].
Фармакологические свойства венлафаксина1. По химической структуре венлафаксин относится к бициклическим соединениям, представляя собой рацемическую смесь двух активных энантиомеров. Венлафаксин (и его основной метаболит О-десметилвенлафаксин), обладающий, как и ТЦА, ингибирующим воздействием на обратный захват серотонина и норадреналина2, практически не связывается с мускариновыми, холинергическими, гистаминовыми и a1-адренергическими рецепторами. Кроме того, препарат не оказывает существенного влияния на активность моноаминоксидазы, не обладает сродством к опиатным, бензодиазепиновым, фенциклидиновым рецепторам, а также к рецепторам N-метил-D-аспарагиновой кислоты (NMDA). Как и другие современные тимоаналептики двойного действия, венлафаксин избирательно ингибирует обратный захват норадреналина и серотонина приблизительно в одном диапазоне концентраций и не оказывает существенного влияния на другие нейротрансмиттерные системы [6, 65, 124, 129, 130]. Так, согласно экспериментальным данным, полученным F.Bymaster и соавт. [16, 17], соотношение констант связывания с белками-транспортерами норадреналина и серотонина для венлафаксина составляет 30,3, что в 6 раз больше, чем тот же показатель для имипрамина, и почти в 5 раз меньше, чем для флуоксетина, следовательно, венлафаксин занимает по балансу связывания с указанными моноаминовыми рецепторами промежуточное положение между ТЦА и СИОЗС. Препарат хорошо всасывается из желудочно-кишечного тракта, его максимальная концентрация в плазме крови достигает 33–172 нг/мл в течение приблизительно 2,4 ч; периоды полувыведения венлафаксина и его основного метаболита составляют 5 и 11 ч соответственно; равновесные концентрации достигаются в течение 72 ч. Показатель связывания с белками крови составляет 25% против 80–95% для СИОЗС, т.е. при одинаковой концентрации препаратов в плазме уровень свободной активной фракции венлафаксина значительно выше, чем у СИОЗС. Подвергаясь интенсивному метаболизму при первом прохождении через печень, венлафаксин оказывает минимальное (даже сравнительно с СИОЗС) воздействие на изоэнзимы цитохрома Р-450, что позволяет заведомо прогнозировать низкий риск лекарственных взаимодействий [109]. Венлафаксин и его метаболиты выделяются почками.
Спектр клинической активности венлафаксина. Обращаясь к анализу данных литературы об эффективности венлафаксина, сразу же подчеркнем, что еще на этапе доклинических испытаний препарата в открытых исследованиях [43, 96] появились обнадеживающие сведения о его способности купировать проявления депрессии (табл. 1).

Так, в двух одновременно проведенных открытых исследованиях [43, 96], насчитывающих в совокупности 59 наблюдений, показано снижение суммы баллов по всем использованным психометрическим шкалам, причем в первом из них такое снижение было статистически достоверным сравнительно с исходными показателями. В более поздних плацебо-контролируемых исследованиях (всего 548 наблюдений, из них 384 пациента, получавших венлафаксин в широком диапазоне доз – от 25 до 374 мг/сут) это предварительное представление получило подтверждение на статистической основе [48, 61, 72, 97].
Если обобщить результаты открытых исследований, то выясняется, что, во-первых, доли больных, у которых регистрируется положительный ответ на терапию вполне сопоставимы, во-вторых, что такой эффект отличается стойкостью и, в-третьих, что частота преждевременного прекращения терапии не превышает 15–25%.
Одна из этих работ выполнена в Канаде C. de Montigny и соавт. [75] в рамках многоцентрового 8-недельного открытого изучения эффективности и переносимости венлафаксина у больных большой депрессией (159 госпитализированных/амбулаторных больных в возрасте от 18 до 70 лет; HDRS-21≥18 баллов). Венлафаксин применяли в стартовой дозе 37,5 мг/сут с последующей титрацией до максимальной – 375 мг/сут, проведенной с учетом переносимости и ответа на лечение (средняя доза 260 мг/сут). Полностью завершили исследование 152 (95,6%) пациента. Положительный ответ (редукция исходного балла 52% по HDRS-21 и 50% по MADRS), зарегистрирован к моменту завершения исследования у 52% больных, а ремиссия (улучшение на 75% и более по шкале HDRS-21) – у 28%; у 88% больных выявлено также улучшение по шкале общего клинического впечатления (CGI). Целью другого канадского открытого исследования [56] было изучение эффективности и переносимости венлафаксина в реальной клинической практике. В работе над этим натуралистическим исследованием участвовали 211 практических врачей, в их числе – 149 семейных и 62 психиатра; каждый мог включить не более 5 пациентов. Терапия венлафаксином оказалась эффективной у 62% от общего числа амбулаторных больных депрессией (880 наблюдений) и не сопровождалась тяжелыми побочными эффектами.
Полученные данные совпадают с результатами пенсильванских авторов [35], согласно которым частота положительного ответа на кратковременную терапию венлафаксином составила 60–70%, а преждевременного прекращения лечения – 15–25%. Объединенные результаты еще двух открытых исследований (опубликованы в виде тезисов) с участием 327 больных подтвердили, что антидепрессивный эффект венлафаксина в средней дозе 143–186 мг/сут сохраняет стойкость в течение 12 мес [54].
В ходе сравнительных клинических исследований (в доступной литературе обнаружено 10 таких работ [9, 10, 42, 66, 70, 93, 98, 102, 106, 108]) была показана сопоставимая с ТЦА эффективность венлафаксина. Если такая сопоставимость нуждалась в подтверждении на статистически доказательной базе, то безусловным преимуществом венлафаксана оказалась относительная редкость клинически значимых нежелательных явлений, в том числе холинергических [93]. Проиллюстрируем сказанное несколькими примерами.
В двойном слепом сравнительном исследовании венлафаксина (до 150 мг/сут) и амитриптилина в идентичных дозах (до 150 мг/сут) у амбулаторных больных с большой депрессией установлено, что оба препарата обнаруживают сопоставимую эффективность. При этом нежелательные явления значимо чаще регистрируются на фоне терапии амитриптилином [9]. В рандомизированном исследовании R.Shrivastava и соавт. [102], выполненном в одном из медицинских центров Нью-Йорка, представлено сравнение венлафаксина и имипрамина (381 пациент; средний возраст 43 года; 54% женщин), подтвердившее статистически достоверно более высокую эффективность венлафаксина в дозах 75–225 мг/сут (в среднем 165 мг/сут) сравнительно с имипрамином и плацебо. Эти значимые различия выявлялись в течение 8-недельного курса терапии и сохранялись на 6 и 12-м месяцах лечения. Терапия венлафаксином сопровождалась статистически достоверно более низким числом нонреспондеров и нежелательных явлений.
Результаты этих исследований, начиная с первых публикаций [117] и кончая последними [118, 122], датированными 1997 и 2000 гг. соответственно, свидетельствуют о сопоставимой эффективности венлафаксина и препаратов сравнения. Приводимую при этом информацию следует рассматривать с учетом того обстоятельства, что венлафаксин, являясь (как и традиционные тимоаналептики) препаратом двойного действия, подобно СИОЗС, уступает ТЦА при купировании тяжелых депрессий. По-видимому, неслучайно материалом клинических исследований эффективности венлафаксина (как и других современных антидепрессантов) даже в случае большой депрессии является амбулаторный контингент.
Коллектив авторов, работавших в рамках специальной программы [136], представил обзор 293 публикаций, посвященных эффективности и безопасности антидепрессантов современных генераций (включая венлафаксин). Из них 187 соответствовали требованиям доказательной медицины, причем 126 финансировались фармацевтическими компаниями и лишь 17 – государственными учреждениями или независимыми фондами. Метаанализ показал, что шансы положительного терапевтического ответа для венлафаксина значимо выше, чем для СИОЗС (флуоксетин). Отмечено также важное преимущество венлафаксина: при лечении резистентных депрессий этот препарат более эффективен, чем СИОЗС (циталопрам, флуоксетин, сертралин) и другой антидепрессант двойного действия – миртазапин, причем терапия венлафаксином сопровождается минимальным (сравнительно с миртазапином) увеличением массы тела. Кроме того, при сравнении с СИОЗС более высокая частота преждевременного отказа от продолжения терапии из-за побочных эффектов (11,5% против 8,5%) компенсируется более редкой отменой из-за недостаточной эффективности (3,5% против 4,4%).
К числу наиболее методологически безупречных обобщающих работ, выполненных в последние годы в форме метаанализа, позволяющего объективно оценить различные аспекты клинической активности венлафаксина сравнительно с СИОЗС, относится обзорная публикация D. Smith и соавт. [110]. На предварительном этапе авторами, подчеркивающими необходимость проведения исследований в соответствии с современными требованиям доказательной медицины3, из 2349 работ отобрано 32 рандомизированных двойных слепых сравнительных исследования эффективности венлафаксина [1, 7, 10, 21–23, 41, 42, 49, 66, 67, 70, 71, 85, 89, 90, 92, 93, 95, 98, 102, 103, 106, 108, 117, 118, 122], удовлетворяющих таким требованиям. Результаты этих исследований (из них на сопоставление с ТЦА амитриптилином, кломипрамином, дезипрамином приходится 7 работ) подтверждают статистически значимо более высокую, чем СИОЗС, эффективность воздействия венлафаксина на симптомы большой депрессии, диагностированной по DSM-IV4, однако в сравнении с ТЦА такого превосходства не обнаружено.
В контексте оценки тимоаналептических свойств венлафаксина уместно остановиться на дозозависимой эффективности препарата, выявленной в части уже цитированных выше исследований [48, 61, 72, 96, 97]. Так, J.Mendels и соавт. [72] применяли венлафаксин/плацебо у 312 амбулаторных больных в течение 6 нед. Суточные дозы венлафаксина составляли 25, 50–75 и 150–200 мг/сут, а дозозавимый эффект проявлялся уже в течение 1-й недели лечения5. В другом 6-недельном двойном слепом исследовании [54] рандомизированы 323 больных, которым назначали плацебо или венлафаксин в дозах 75, 225 или 375 мг/сут; в двух последних группах дозу титровали в течение 7 дней. Эффективность оценивали с помощью шкал HDRS, MADRS и CGI. Улучшение во всех группах венлафаксина (Велафакс) значимо превосходило эффект плацебо; при этом эффективность 375 мг препарата оказалась выше, чем при назначении в более низких дозах.
Следует также отметить, что дозозависимый эффект венлафаксина (Велафакса) проявляется и при воздействии на болевые синдромы. Первоначально такой эффект был выявлен N.Kunz и соавт. [64] при диабетической нейропатии; оказалось, что если в дозе 75 мг/сут антиноцицептивное действие не проявлялось (по этому признаку венлафаксин не отличался от СИОЗС и плацебо), то в дозах 150–225 мг/сут терапия сопровождалась значимой редукцией болей. Эти данные позволили J.Markowitz и K. Patrick [67] предположить, что препарат окажется эффективным и при других алгопатиях. Высказанная гипотеза в дальнейшем подтвердилась в ряде исследований, показавших эффективность венлафаксина при терапии мигрени и головных болей напряжения [1], фибромиалгий [31, 94], хронического болевого [39, 47] и других соматоформных расстройств [63], в том числе и коморбидных депрессии [8, 12].
Не менее значимым клиническим эффектом венлафаксина является его способность купировать тревогу. Предваряя обсуждение результатов изучения венлафаксина в этом аспекте, подчеркнем следующее.
Вклад анксиозных расстройств в структуру аффективной патологии, по мнению некоторых исследователей, настолько важен, что требует построения новых таксономических единиц. В частности, в ходе дискуссии, связанной с подготовкой очередного пересмотра американской классификации психических расстройств – DSM-V, D.Watson предлагает рассматривать гипотимические состояния и генерализованную тревогу в пределах общей категории – «Эмоциональные расстройства с преобладанием дистресса». Эта позиция согласуется с представлениями H.van Praag [119], предполагающего, что «гордиев узел» депрессия – тревога может быть распутан следующим образом: за такие проявления, как тревога, агрессия, склонность к суицидальному поведению, «ответственны» нарушения метаболизма серотонина, а «сбой» норадренергической трансмиссии влечет за собой иные проявления – собственно меланхолию, ангедонию, снижение побуждений.
Анксиолитический эффект венлафаксина продемонстрирован в представленном R.Rudolph [88] в метаанализе 6 исследований препарата, применявшегося у больных тревожной депрессией. При ретроспективной оценке оказалось, что наряду со статистически достоверным (p≤0,001) сравнительно с плацебо снижением выраженности собственно гипотимической составляющей депрессивного синдрома, терапия венлафаксином сопровождается значимым улучшением по фактору «тревога» шкалы HDRS уже через 1 нед и по факторам «тревога»/«соматизация» через 3 нед лечения. При этом достигнутый эффект достаточно стоек и сохранялся через 6 и 12 нед лечения. К сходным выводам приходят и авторы более поздних исследований [45, 57, 80], причем A.De Nayer и соавт. [80] отметили, что на момент последнего визита состояние 59,4% больных, получавших венлафаксин, квалифицировалось как ремиссия против 40,3% на фоне терапии препаратом сравнения (флуоксетин).
Появляются публикации, посвященные эффективности венлафаксина при депрессиях, коморбидных алкогольной зависимости. В открытом многоцентровом 24-недельном проспективном исследовании 90 амбулаторных пациентов (средний возраст 44,9±9,7 года; 73,4% мужчин) с диагнозом «алкогольная зависимость» и коморбидной большой депрессией [134] венлафаксин показал свою эффективность. Выраженность депрессии (средние значения по шкале Гамильтона) значимо снижалась при оценке на каждом следующем визите по сравнению с предыдущим (p<0,0005). Наряду с редукцией депрессии и признаками стабилизации психического состояния также нормализовалось соматическое состояние, снижалась тяга к употреблению алкоголя, восстанавливались семейные и социальные взаимоотношения. Зарегистрирован также благоприятный профиль переносимости и безопасности препарата у 76,7% пациентов. Полученные авторами данные согласуются с результатами предшествующих немногочисленных исследований [132, 133].
В этой работе выдвинут принципиально важный для клинической практики вопрос об оценке эффективности терапии в терминах «ответ» (степень улучшения в процентах от исходного базового уровня, позволяющая дифференцировать респондеров от нонреспондеров) – «ремиссия» (полная/частичная редукция симптоматики со снижением тяжести симптомов до нижних пороговых значений). Соответственно ремиссия – более строгий стандарт, «поднимающий планку» оценки эффективности терапии в соответствии с критерием достижения длительной и стойкой стабилизации состояния.
Эту позицию отстаивает, в частности, S.Stahl в полемической статье, озаглавленной «Причиняет ли депрессия боль?» [107]. Автор считает ошибочным ограничение целей терапии 50% редукцией депрессивных проявлений; такой целью может являться только достижение ремиссии. Вероятность становления ремиссии при использовании антидепрессантов двойного действия, включая венлафаксин, повышается. При этом S. Stahl опирается на данные, полученные в серии работ, выполненных пенсильванскими (Филадельфия) учеными M.Thase и соавт. [113] и основанных на результатах 8 сравнительных исследований венлафаксина и СИОЗС. Метаанализ показал, что положительный эффект к 8-й неделе терапии венлафаксином достигает 40–55% против 31–37% для СИОЗС (различия статистически достоверны, p≥0,05) и выявляется на более ранних сроках. A.Entsuah и соавт. [35] при пересмотре тех же данных подтвердили, что эти различия статистически значимы и не зависят от гендерных и возрастных факторов.
Исходя из результатов 4 рандомизированных двойных слепых плацебо-контролируемых клинических исследований, R.Golden и L.Nicholas [44] представили анализ частоты рецидивов у амбулаторных больных большой депрессией (304 пациента: 184 получали венлафаксин и 119 – плацебо) – респондеров к венлафаксину. Положительный ответ на терапию был зафиксирован после 4-недельного курса лечения, продолженного до 12 мес. Длительную терапию завершили 38% от общего числа больных, получавших венлафаксин, и 26% – из группы плацебо. Через 6 мес частота рецидивов составила 11 и 23% соответственно. По мнению авторов, эти результаты являются свидетельством эффективности использования длительной противорецидивной терапии венлафаксином, снижающей риск рецидивов большой депрессии.
Не менее важным аспектом проблемы терапии депрессий, которым в последние годы уделяется особое внимание, являются вопросы, связанные с преодолением резистентности, чреватой высокой потребностью в специализированной помощи (а следовательно, в использовании ресурсов здравоохранения) и снижением трудоспособности [112, 113, 135].
В обзоре M.Thase и соавт. [112] обобщаются данные об эффективности венлафаксина при терапевтически резистентных депрессиях (отсутствие ответа на терапию тремя различными антидепрессантами двух разных классов или к электросудорожной терапии в сочетании с двумя антидепрессантами). Анализ публикаций позволил авторам придти к выводу о том, что на 8-недельную терапию венлафаксином (Велафаксом) в дозах 150–375 мг/сут отвечают 40–55% больных депрессией, ранее резистентной к лечению, причем достигнутый результат остается устойчивым при продолжении лечения в течение 12 мес.
В цитированном выше исследовании C. de Montigny [75] также оценивался ответ на терапию венлафаксином у рефрактерных к предшествующему тимоаналептическому лечению пациентов, получавших до включения в изученную выборку от 1 до 8 антидепрессантов (45% – не менее 3), назначавшихся в адекватных дозах. Было показано, что венлафаксин оптимизирует в подобных случаях ответ на терапию – доля пациентов с явлениями терапевтической резистентности сокращается в среднем на 1/3. К тому же выводу приходят и авторы других работ [73, 79, 104, 113]. Так, в двухэтапном открытом исследовании, проводившемся в 40 медицинских центрах Австралии [73], получены следующие результаты. Больным депрессией (312 пациентов) с признаками резистентности – «абсолютной» (отсутствие ответа на 4-недельную терапию стандартными антидепрессантами в максимальных терапевтических дозах) или «относительной» (без признаков улучшения при назначении минимальных доз тимоаналептиков) проведен 8-недельный курс лечения венлафаксином в суточных дозах до 300 мг. Доля респондеров (улучшение по шкале MADRS на 50%) составила 52,6% и только 15,7% отнесены к числу «абсолютно» резистентных. При этом положительный ответ на терапию обнаруживал следующую зависимость: если в течение первых 2 нед лечения регистрировали улучшение по крайней мере на 20%, то можно было прогнозировать вероятность преодоления резистентности. Этот прогноз подтвердился во второй фазе исследования, продолженного E.Schweitzer и соавт. [99]. Авторы приводят данные, позволяющие оценить результаты длительной (10 мес после завершения 8-недельной фазы) терапии венлафаксином (149 больных с резистентной депрессией). Частота положительного ответа через 8 нед от начала обсуждаемой фазы, т.е. через 16 нед от фактического начала курса лечения, и на момент его окончания составила 69 и 73% соответственно. У больных, продолживших лечение венлафаксином в течение 10 мес, отмечено не только сохранение первоначального ответа на 8-недельную терапию, но и признаки дальнейшего улучшения состояния.

К концу столетия эти данные были подтверждены в ряде исследований [34, 61], а в начале нового века P.Silverstone и соавт. [105] сформулировали положение о том, что оценка эффективности, определение ремиссии и времени ответа на терапию должны проводиться дифференцированно. Необходимо учитывать динамику показателей по двум имеющим принципиальное значение параметрам шкалы HDRS-21; речь идет о пунктах «депрессивное настроение» и «психическая тревога». При такой оценке сопоставление эффективности венлафаксина и СИОЗС позволило установить, что время ответа на терапию обоими препаратами составляет 2 нед, хотя эффективность венлафаксина выше.
Переходя к обсуждению переносимости, безопасности и нежелательных эффектов венлафаксина, необходимо подчеркнуть следующее.
Согласно определению ВОЗ под нежелательным действием лекарственного препарата (НДЛП) понимается любая непредусмотренная патологическая реакция, возникающая при его применении в дозах, обычно используемых для профилактики или лечения. Аргументом, доказывающим «виновность» лекарственного препарата в нежелательном действии, может стать повторное развитие наблюдаемого ранее НДЛП при возобновлении его приема («позитивная реэкспозиция» по G.Laux и соавт. [65]). При том что усредненная частота побочных эффектов составляет для ТЦА 1,5%, для СИОЗС 1,7% [65]6, по данным созданной в Германии Рабочей группы по контролю за лекарственными препаратами в психиатрии, на фоне терапии этими антидепрессатами в течение 12 лет (1989–2001 гг.) НДЛП зарегистрированы у 52% пациентов, из них в 2% случаев они расценены как угрожающие жизни (делирий, судорожные припадки, паралитическая кишечная непроходимость, токсический гепатит, холестаз, угнетение дыхания); требующие изменения терапии – 21,5%, отмены препарата – 8%. При сопоставлении последнего показателя с адаптированными по материалам J.Rakesh [91] данными P.Tran и соавт. [115] – 21% для кломипрамина и 33% для имипрамина – становится очевидным, что доля пациентов, преждевременно прекращающих терапию (и среди них тех, кто совершает «выбор в пользу рецидива»), может оказаться значительно более высокой. В то же время при лечении венлафаксином показатель преждевременной отмены терапии составляет 11–19%, а по данным C. de Montigny и соавт. [75], только 8% больных отказываются от продолжения терапии в связи с побочными эффектами (головная боль, бессонница, тошнота, запоры, потливость, ксеростомия).
В обзорной публикации R.Rudolph и A.Derivan [87], посвященной анализу переносимости и безопасности венлафаксина у 3082 пациентов, из которых у 455 лечение продолжалось в течение года, также отмечена низкая частота прекращения лечения из-за нежелательных явлений7. Напротив, авторы подчеркивают, что нежелательные реакции, сопровождающие прием венлафаксина (тошнота, бессонница, головокружение, сонливость, запоры, потливость), хотя и встречаются чаще, чем у пациентов, получавших плацебо, носят транзиторный характер, не требуют дополнительной коррекции и при продолжении терапии полностью редуцируются. В первую очередь это касается тошноты, наблюдавшейся в начале лечения и оказавшейся полностью обратимой у подавляющего большинства пациентов. Этот вывод согласуется с данными метаанализа 19 исследований, включающих 2181 наблюдение [24], в котором среди побочных эффектов, в совокупности лишь несколько превышающих 10%, наиболее распространенным является тошнота, приводящая в 6% случаев к отмене препарата. Вместе с тем этот нежелательный эффект снижается на 50% уже после 1-й недели терапии и минимизируется в течение дальнейшего курса лечения. При этом, как подчеркивается в обзоре R.Rudolph и A.Derivan [87], изучение больших выборок показало, переносимость и безопасность венлафаксина у пожилых пациентов (65 лет и старше) достоверно не отличаются от соответствующих показателей, полученных у пациентов более молодого возраста.
При оценке нежелательных явлений, сопряженных с приемом антидепрессантов современных поколений, большое значение придается сексуальным дисфункциям (нарушения либидо, эрекции, эякуляции, аноргазмия, импотенция), развитие которых может поддерживать негативную самооценку, а также идеи несостоятельности в содержании депрессии.
Анализ данных, приведенных в специально посвященных этому аспекту действия венлафаксина публикациях [20, 59, 114], выполненных в последние 7 лет, позволяет утверждать следующее. При сопоставлении частоты и характера сексуальных дисфункций на 8–14-й неделе терапии обратными ингибиторами моноаминоксидазы – ОИМАО (моклобемид), СИОЗС (сертралин) и венлафаксином (107 пациентов с большой депрессией) с помощью специального опросника (Sexual Functioning Questionnaire) было установлено, что у мужчин на терапии всеми применявшимися антидепрессантами значимо больше, чем у женщин (p<0,05), нарушается сексуальное влечение (либидо, потенция), тогда как по признаку аноргазмии различий не выявляется. Частота сексуальных дисфункций у женщин зарегистрирована реже (26–32% против 38–50% у мужчин). Венлафаксин по показателю сексуальной дисфункции обнаруживал тенденцию к промежуточному рейтингу между СИОЗС и ОИМАО-А [59]. При сравнении риска возникновения сексуальных дисфункций на фоне терапии бупропионом, нефазодоном8, СИОЗС (флуоксетин, пароксетин, сертралин, циталопрам) и препаратами двойного действия (миртазапин, венлафаксин) [20] у амбулаторных больных с депрессиями (4534 женщины и 1763 мужчины) оказалось, что эти расстройства выявляются при использовании первых двух препаратов с минимальной частотой (22–28%), а для всех остальных антидепрессантов значения этого показателя колеблются в диапазоне 36–43%. В двойном слепом сравнительном многоцентровом исследовании сексуального функционирования, антидепрессивной эффективности и переносимости бупропиона (300–450 мг/сут) и венлафаксина (150–225 мг/сут) M.Thase и соавт. [114] показали, что на фоне курсовой (12 нед) терапии 348 пациентов репродуктивного возраста сексуальное функционирование (в субъективной оценке) обнаруживает статистически значимые различия. Если применение бупропиона у пациентов без признаков сексуальных дисфункций до начала лечения не оказывало нежелательного воздействия на в эту сферу, то на фоне терапии венлафаксином такие нарушения выявлялись начиная со 2-й недели.
При этом подчеркивается необходимость проведения дальнейших исследований на основе единой методологии с использованием валидных оценочных инструментов.
Тяжелые НДЛП (синдром отмены, серотониновый синдром, кардиотоксический эффект9, включая влияние на сердечную проводимость и активности печеночных ферментов, судороги) у больных, получавших венлафаксин, встречались редко [86]10. Так, показатели артериального давления даже при сочетании депрессии с коморбидной соматической патологией (артериальная гипертензия, ИБС, фибрилляция предсердий, сердечная недостаточность, состояние после инфаркта/инсульта, транзиторные ишемические атаки, атеросклеротическая энцефалопатия, черепно-мозговая травма, сахарный диабет), как это показано в сравнительном исследовании B.Zimmer и соавт. [123], при применении венлафаксина существенно не менялись. В 88% случаев терапия не сопровождалась ни развитием артериальной гипертензии, ни клинически значимыми различиями уровней систолического артериального давления (АД). Лишь у пациентов престарелого возраста зарегистрировано статистически незначимое повышение диастолического АД на 4,7 мм рт. ст. Некоторые авторы [13, 14] устанавливают нижнюю границу частоты повышения АД в 2% и указывают, что этот показатель может достигать максимума – 13%. При этом отмечено, что повышение диастолического АД относится к числу дозозависимых эффектов венлафаксина, как и другие серотонинергические НДЛП (тошнота, инсомния, сексуальные дисфункции). Результат метаанализа [111] исследований, обобщающих около 4 тыс. наблюдений, показал, что повышение диастолического АД в среднем на 2 мм рт. ст. в покое, сравнимое с эффектом плацебо, регистрируется на суточных дозах венлафаксина менее 200 мг. В то же время при повышении дозы у 5% больных отмечено клинически значимое повышение диастолического АД.
Доля летальных исходов вследствие передозировки антидепрессантов с суицидальной целью составляет 4–7% от общего числа суицидов; причем в 1/3 случаев такие исходы регистрируются при комбинации тимоаналептиков с алкоголем и другими лекарствами. О благоприятном профиле переносимости и безопасности венлафаксина свидетельствуют данные как ранних, так и современных исследований. Обобщая результаты работ, выполненных до 1996 г., R.Rudolph и A.Derivan [87] сообщают о 14 случаях преднамеренной передозировки венлафаксина в дозах, в 10 раз или более превышавших рекомендуемые (концентрация препарата в плазме крови в 30 раз превосходила терапевтическую). Ни в одном из этих случаев каких-либо серьезных последствий не зарегистрировано.
Однако одновременно стали появляться и отдельные сообщения, указывающие не только на возможность нейротоксических осложнений при передозировке венлафаксина [36, 120] и в их числе повторных судорожных припадков [11, 82], но и на летальный исход вследствие приема 3500–7500 мг венлафаксина (2 наблюдения A.Parsons и соавт. [83] из судебно-медицинской лаборатории Сакраменто; оба пациента престарелого возраста с длительным анамнезом депрессивной болезни, активными суицидальными мыслями; в 1 случае депрессия сочеталась с тяжелой кардиоваскулярной патологией).
На сегодняшний день риск фатального исхода при передозировке венлафаксина и других лекарств рассчитывается на основе современных критериев (отношение числа смертей к числу назначений препарата) [29]. По этому признаку в табл. 3 приведено сравнение венлафаксина с другими тимоаналептиками – СИОЗС и ТЦА.

Немаловажным фактором, определяющим уровень безопасности психотропных средств в целом и антидепрессантов в частности, является риск повреждающего воздействия «по вертикали»11, т.е. влияние препарата, поступающего из организма матери, получающей препарат в период беременности или кормления, на плод или новорожденного. С учетом такого риска антидепрессанты беременным назначают при крайней необходимости по строгим клиническим показаниям (психотические депрессии; депрессии с суицидальными идеями, тоскливые/тревожные депрессии, протекающие с выраженными расстройствами сна и аппетита, усугубляющими соматическое состояние женщины). Необходимость оценки потенциальной опасности применяемых средств в плане тератогенных или других негативных эффектов возникает также при незапланированной беременности, когда будущая мать продолжает принимать антидепрессанты. Соответственно, целью исследования, проведенного S.Shaikir [101], являлся ответ на вопрос: повышает ли венлафаксин риск мальформаций (врожденные уродства), составляющий в населении 1–3%. Изученная автором выборка сформирована из числа женщин, обращавшихся к специалистам службы здоровья беременных и кормящих за информацией о безопасности приема венлафаксина в I триместре беременности. Из их числа 125 разрешились живым плодом, у 18 зарегистрированы самопроизвольные аборты, еще у 7 беременность была прервана по медицинским показаниям. Врожденные уродства плода (гипоспадия, дефект нервной трубки с косолапостью) выявлены на фоне принимаемой матерью терапии венлафаксином в 2 случаях против 3 (дефект межпредсердной перегородки, пилоростеноз, отсутствие мозолистого тела) в группе сравнения (женщины, принимавшие СИОЗС). По данным другого многоцентрового проспективного конролируемого исследования [33], из 39 женщин, принимавших во время беременности венлафаксин, гестация завершилась 13 абортами (7 спонтанных, 6 медицинских) и 26 срочными родами без признаков патологии плода. Описано также [51] 2 случая грудного вскармливания (до 6 мес) матерями, получавшими венлафаксин в дозах 75–150 мг/сут, без негативных последствий для младенцев (последние получали 7,6% материнской дозы препарата).
В качестве принципиального требования к новым психотропным средствам (в частности, к антидепрессантам) рассматривается минимальное влияние на поведенческие и психомоторные функции («поведенческая токсичность»), а следовательно – на качество жизни пациентов. В этом плане особую субъективную значимость имеет неотъемлемый атрибут современного общества – возможность водить автомобиль. Венлафаксин (хотя полученные данные не могут считаться окончательными) не обладает поведенческой токсичностью и не нарушает навыков вождения. Если ТЦА оказывают негативное влияние на способность водить автомобиль (при разборе 20 000 дорожно-транспортных происшествий выявлено, что при приеме ТЦА риск попадания в аварию возрастает в 2,2 и даже в 5,5 раза (доза амитриптилина 125 мг/сут), а исследования, проведенные на здоровых добровольцах показали, что результаты психомоторных тестов ухудшаются уже после однократного приема классических тимоаналептиков [65], то венлафаксин, по данным J.O’Hanlon и соавт. [81], не влияет на реакцию при вождении. Этот вывод вытекает из результатов проведенного авторами двойного слепого плацебо-контролируемого сравнительного анализа венлафаксина (75–150 мг/сут) и миансерина (30–60 мг/сут). Выборку получавших венлафаксин составили 37 волонтеров, из которых 22 полностью завершили исследование.
Таким образом, Велафакс (венлафаксин) является эффективным антидепрессантом для эмпирической терапии депрессивных расстройств любой степени тяжести, в т.ч. с выраженным тревожным компонентом, что согласуются с результатами, полученными другими авторами [(137, 138, 139, 140)].
Наряду с доказанной клинической эффективностью Велафаксу свойственен благоприятный профиль переносимости и высокий уровень безопасности, что, учитывая высокую распространенность аффективной патологии, в т.ч. сочетанной с проявлениями тревоги, обуславливает целесообразность применения Велафакса как в госпитальной, так и при продолжительной амбулаторной терапии указанных расстройств.
В заключение необходимо подчеркнуть, что расширение арсенала антидепрессантов с внедрением в клиническую практику венлафаксина намечает перспективы дальнейших исследований не только в области патогенеза и клиники депрессий, но изучения механизмов действия тимоаналептиков. Такие исследования, проводимые на базе принципов доказательной медицины, обеспечат решение важных задач современной клинической психофармакологии, направленных на создание оптимально действующих антидепрессантов.
Список исп. литературыСкрыть список1. Adelman LC, Adelman JU, von Seggern R, Mannix LK. Venlafaxine extended release (XR) for the prophylaxis of migraine and tension-type headache: A retrospective study in a clinical setting. Headache 2000; 40 (7): 572–80.
2. Alves C, Cachola I, Brandao J. Efficacy and tolerability of venlafaxine and fluoxetine in outpatients with major depression. Prim Care Psychiat 1999; 5: 57–63.
3. Anderson IM, Tomenson BM. The efficacy of selective serotonin re-uptake inhibitors in depression: a metaanalysis of studies against tricyclic antidepressants. J Psychopharmacol 1994; 8: 238–49.
4. Anderson IM, Tomenson BM. Treatment discontinuation with SSRI compared with TCA: a metaanalysis. Brit Med J 1995; 310: 1433–8.
5. Anderson IM. SSRIs versus tricyclic antidepressants in depressed inpatients: a metaanalysis of efficacy and tolerability. Depression Anxiety 1998; 7 (Suppl. 1): 11–7.
6. Arana JW, Rosenbaum JF. Handbook of psychiatric drug therapy. Philadelphia, 2001.
7. Ballus C, Quiros G, de-Flores T et al. The efficacy and tolerability of venlafaxine and paroxetine in outpatients with depressive disorder of dysthymia. Internat Clin Psychopharmacol 2000; 15: 43–8.
8. Barkin RL, Barkin S. The role of venlafaxine and duloxetine in the treatment of depression with decremental changes in somatic symptoms of pain, chronic pain, and the pharmacokinetics and clinical considerations of duloxetine pharmacotherapy. Am J Ther 2005; 12 (5): 431–8.
9. Benedictis E. Double–blind comparison of venlafaxine and amitriptyline in outpatients with major depression with or without melancholia. J Psychopharmacol 2000; 14: 61–6.
10. Benkert O, Gruender G, Wetzel H et al. A randomised, double-blind comparison of a rapidly escalating dose of venlafaxine and imipramine in inpatients with major depression and melancholia. J Psychiat Res 1996; 30: 441–51.
11. Blythe D, Hackett LP. Cardiovascular and neurological toxicity of Venlafaxine. Human & Experimental Toxicology 1999; 18: 309–13.
12. Bradley RH, Barkin RL, Jerome J et al. Efficacy of venlafaxine for the long term treatment of chronic pain with associated major depressive disorder. Am J Ther 2003; 10 (5): 318–23.
13. Buckley NA, McManus PR. Fatal toxicity of serotonergic and other antidepressant drugs: analysis of UK mortality data. BMJ 2002; 325: 1332–3.
14. Burnett F, Dinan T. Venlafaxine. Pharmacology and Therapeutic Potential in the Treatment of Depression. Human Psychopharmacol 1998; 13: 153–62.
15. Blier P. Possible neurobiological mechanisms underlying faster onset of antidepressant action. J Clin Psychiat 2001; 62 (suppl 4): 7–11.
16. Bymaster FP, Dreshfield-Ahmad LJ, Threlkeld PG et al. Comparative affinity of duloxetine and venlafaxine for serotonin and norepinephrine transporters in vitro and in vivo, human serotonin receptor subtypes and other neuronal receptors. Neuropsychopharmacology 2001; 25: 871–80.
17. Bymaster FP, Katner JS, Nelson DL et al. Atomoxetine increases extracellular levels of norepinephrine and dopamine in prefrontal cortex of rat: a potential mechanism for efficacy in attention deficit/hyperactivity disorder. Neuropsychopharmacology 2002; 27: 699–711.
18. Cardona X, Avila A, Castellanos P. Venlafaxine-Associated Hepatitis 2000; Ann Intern Med 132 (5): 417; Horsmans Y, De Clercq M, Sempoux C. Venlafaxine-associated hepatitis [Letter]. Ann Intern Med 1999; 130: 944.
19. Cheeta S, Schifano F, Oyefeso A et al. Antidepressant-related deaths and antidepressant prescriptions in England and Wales, 1998–2000. Br J Psychiat 2004; 184: 41–7.
20. Clayton AH, Pradko JF, Croft HA et al. Prevalence of sexual dysfunction among newer antidepressants. J Clin Psychiat 2002; 63 (4): 357–66.
21. Clerc GE, Ruimy P, Verdeau PJ. A double-blind comparison of venlafaxine and fluoxetine in patients hospitalised for major depression and melancholia, international. Clin Psychopharmacol 1994; 9: 139–43.
22. Costa, e. Silva J. Randomised, double-blind comparison of venlafaxine and fluoxetine in outpatients with major depression. J Clin Psychiat 1998; 59: 352–7.
23. Cunningham L, Borison R, Carman J et al. A comparison of venlafaxine, trazodone and placebo in major depression. J Clin Psychopharmacol 1994; 14: 99–106.
24. Danjou P, Hackett D. Safety and tolerance profile of venlafaxine. Internat Clin Psychopharmacol 1995; 10: 15–20.
25. Danish University Antidepressant Group. Citalopram: clinical effect profile in comparison with clomipramine. A controlled multicenter study. Psychopharmacology 1986; 90: 131–8.
26. Danish University Antidepressant Group. Paroxetine: a selective serotonin reuptake inhibitor showing better tolerance, but weaker antidepressant effect than clomipramine in a controlled multicenter study. J Affective Disorders 1990; 18: 289–99.
27. Delgado PL, Charney DS, Price LH et al. Serotonin function and the mechanism of antidepressant action: reversal of antidepressant-induced remission by rapid depletion of plasma tryptophan. Arch Gen Psychiat 1990; 47: 411–8.
28. Derivan A, Entsuah AR, Kikta D. Venlafaxine: measuring the onset of antidepressant action. Psychopharm Bull 1995; 31 (2): 439–47.
29. Deshauer D. Venlafaxine (Effexor): concerns about increased risk of fatal outcomes in overdose. J Canad Med Assoc 2007; 176 (1): 39–40.
30. Dierick M, Ravizza L, Realini R, Martin A. A double-blind comparison of venlafaxine and fluoxetine for treatment of major depression in outpatients. Prog Neuropsychopharmacol Biol Psychiat 1996; 20 (1): 57–71.
31. Dwight MM., Arnold LM, O\'Brien H et al. An Open Clinical Trial of Venlafaxine Treatment of Fibromyalgia. Psychosomatics 1998; 39: 14–7.
32. Edwards G. Selective serotonin reuptake inhibitors: a modest though welcome advance in the treatment of depression. BMJ 1992; 304: 1644–5.
33. Einarson A, Fatoye RNB, Sarkar M et al. Pregnancy Outcome Following Gestational Exposure to Venlafaxine: A Multicenter Prospective Controlled Study Am J Psychiat 2001; 158: 1728–30.
34. Entsuah R, Derivan A, Kikta D. Early onset of antidepressant action of venlafaxine: pattern analysis in intent-to-treat patients. Clin Ther 1998; 20 (3): 517–26.
35. Entsuah AR, Rudolph RL, Hackett D, Miska S. Efficacy of venlafaxine and placebo during long-term treatment of depression: a pooled analysis of relapse rates. Int Clin Psychopharmacol 1996; 11 (2): 137–45.
36. Fantaskey A, Burkhart KK. A case report of venlafaxine toxicity. J Toxicol Clin Toxicol 1995; 33: 359–61.
37. Feighner JP. The role of venlafaxine in rational antidepressant therapy. J Clin Psychiat 1994; 55 (Suppl. A): 62–8; discussion 69–70, 98 100. Rev.
38. Fleisch MC, Blauer F, Gubler JGH, Kuhn M. Eosinophilic pneumonia and respiratory failure associated with venlafaxine treatment. Eur Respire J 2000; 15: 205–8.
39. Galvez R, Caballero J, Atero M et al. Venlafaxine extended release for the treatment of chronic pain. A series of 50 cases. Actas Esp Psiquiat 2004; 32 (2): 92–7.
40. Geddes JR, Freemantle N, Mason J et al. SSRIs versus alternative antidepressants for depressive disorders. Cochrane Library, issue I. Oxford: Update Software. 2001.
41. Geerts S, Lacante P, Migon A. Venlafaxine versus fluoxetine in the treatment of depressed patients with concomitant anxiety. J Eur Coll Neuropsychopharmacol 1999; 9 (suppl. 5): S224.
42. GentiI V, Kerr-Correa F, Moreno R et al. Double-blind comparison of venlafaxine and amitriptyline in outpatients with major depression with or without melancholia. J Psychopharmacol 2000; 14: 61–6.
43. Goldberg HL, Finnerty R. An open-label, variable-dose study of WY-45,030 (venlafexine) in depressed outpatients. Psychopharmacol Bull 1988; 24 (1): 198–9.
44. Golden RN, Nicholas L. Antidepressant efficacy of venlafaxine. Depress Anxiety 2000; 12 (Suppl. 1): 45–9. Rev.
45. Gorman J, Laszlo A. Efficacy of Fenlafaxine in mixed Depression-Anxiety States. Depres Anxiety 2000; 12 (1): 77–80.
46. Gross G, Huber G. How far are newer antidepressants an advance compared with classical antidepressants? Neurol Psychiat Brain Res 1999; 7: 79–86.
47. Grothe DR, Scheckner B, Albano D. Treatment of pain syndromes with venlafaxine. Pharmacother 2004; 24 (5): 621–9.
48. Guelfi JD, White C, Hackett C et al. Effectiveness of venlafaxine in patients hospitalized for major depression and melancholia. J Clin Psych 1995; 56 (10): 450–8.
49. Guelfi JD. Efficacy and Tolerability of Mirtazapine versus Venlafaxine in Hospitalised, Severely Depressed Patients with Melancholia [Abstract]. London: Association of Clinical Neuropsychopharmacology. 1999
50. Haro JM. Definind the scope of the problem: the prevalence of psychiatric disorders in Europe. Poster presented at the 15th ECNP Congress, October 2002, Barcelona, Spain.
51. Hendrick V, Altshuler L, Wertheimer A et al. Venlafaxine and Breast-Feeding. Am J Psychiat 2001; 158: 12.
52. Heninger G, Delgado P, Charney D. The revised monoamine theory of depression: a modulatory role of monoamines, based on new findings from monomaine depletion experiments in humans. Pharmacopsychiatry 1996; 29: 2–11.
53. Hirschfeld R. WPA teaching bulletin on depression 2000; 4 (19): 7–10.
54. Hollyday SM, Benfield P. Venlafaxine. A review of its pharmacology and therapeutic potential in depression. Drugs 1995; 49 (2): 281–94.
55. Hyman SE, Nestler EJ. Initiation and adaptation: a paradigm for understanding psychotropic drug action. Am J Psych 1996; 153: 151–62.
56. Joffe RT, Marshall AM, Lee DK. A large open-label study of venlafaxine in depressed outpatients by community-based physicians. J Clin Psychiat 1998; 59 (10): 515–20.
57. Judge R, Wagner B. Once-daily venlafaxine XR compared with fluoxetine in outpatient with depression and anxiety. J Clin Psychiat 1999; 60: 795–6.
58. Keller MB, Lavori PM, Mueller TI et al. Time to recovery, chronicity and levels of psychopathology in major depression: a 5-year prospective follow-up of 431 sujects. Arch Gen Psychiat 1992; 49: 809–16.
59. Kennedy SH, Eisfeld BS, Dickens SE et al. Antidepressant-induced sexual dysfunction during treatment with moclobemide, paroxetine, sertraline, and venlafaxine. J Clin Psychiat 2000; 61 (4): 276–81.
60. Kessler RC, Berglund P, Demler O et al. The epidemiology of major depressive disorder: results from the National Comorbidity Survey replication (NCS-R). JAMA 2003; 289: 3095–105.
61. Khan A, Upton GV, Rudolph RL et al. The use of venlafaxine in the treatment of major depression and major depression associated with anxiety: a dose-response study. Venlafaxine Investigator Study Group. J Clin Psychopharmacol 1998; 18 (1): 19–25.
62. Koski A, Vuori E, Ojanpera I. Newer antidepressants: evaluation of fatal toxicity index and interaction with alcohol based on Finnish. Int J Legal Med Nov 2005; 119 (6): 344–8.
63. Kroenke K, Messina N 3rd, Benattia I et al. Venlafaxine extended release in the short-term treatment of depressed and anxious primary care patients with multisomatoform disorder. J Clin Psychiat 2006; 67 (1): 72–80.
64. Kunz NR, Goli V, Entsuah R et al. Diabetic neuropathic pain management with venlafaxine extended release. Eur Neuropsychopharmacol 2000; 10 (3): 389.
65. Laux G, Dietmaier O, KЪnig W. Pharmakopsychiatrie. MЪnchen, 2001.
66. Lecrubier Y, Boutin M, Moon CAL et al. Efficacy of venlafaxine in depressive illness in general practice. Acta Psychiat Scandinavica 1997; 95: 485–93.
67. Markowitz JS, Patrick KS. Venlafaxine–tramadol similarities. Med Hypotheses 1998; 51 (2): 167–8.
68. McCue RE, Joseph M. Venlafaxine- and Trazodone-Induced Serotonin Syndrome. Am J Psychiat 2001; 158 (12): 2088–9.
69. McPartlin GM, Reynolds A, Anderson C et al. A comparison of once-daily venlafaxine XR and paroxetine in depressed outpatients treated in general practice. Primary Care Psychiat 1998; 693: 127– 32.
70. Mahapatra SN, Hackett D. A randomised, double-blind, parallel-group comparison of venlafaxine and dothiepin in geriatric patients with major depression. Internat J Clin Pract 1997; 51: 209-13.
71. Mehtonen O, Sogaard J, Roponen P et al. Randomised, double-blind comparison of venlafaxine and sertraline in outpatients with major depressive disorder. J Clin Psychiat 2000; 61: 95-100.
72. Mendels J, Johnston R, Mattes J, Riesenberg R. Efficacy and safety of b.i.d. doses of venlafaxine in a dose response study. Psychopharmacol Bull 1993; 29: 169-74.
73. Mitchell PB, Schweitzer I, Burrows G. Efficacy of venlafaxine and predictors of response in a prospective open-label study of patients with treatment-resistant major depression. J Clin Psychopharmacol 2000; 20 (4): 483-7.
74. Montgomery S. Why do we need new and better antidepressants? Medicographia 2005; 27 (3): 213-6.
75. Montigny C. de, Silverstrone PH et al. Venlafaxine in Treatment-Resistant Major Depression: A Canadian Multicenter, Open-Label Trial. J Clin Psychopharmacol 1999; 19: 401-6.
76. Morgan O, Griffiths C, Baker A et al. Fatal toxicity of antidepressants in England and Wales, 1993-2002. Health Stat Q 2004; 23: 18-24.
77. Murray C, Lopez A. Global mortality, disability, and the contribution of risk factors: global burden of disease study. Lancet 1997; 349: 1436-42.
78. Nelson J, Mazure C, Bowers M et al. A preliminary, open study of the combination of fluoxetine and desipramine for rapid treatment of major depression. Arch Gen Psychiat 1991; 48: 303-7.
79. Nierenberg A, Feigner JP, Rudolph R. Venlafaxine for treatment resistant unipolar depression. J Clin Psychopharmacol 1994; 14: 419-23.
80. Nayer A De, Geerts S, Ruelens L et al. Venlafaxine compared with fluoxetine in outpatients with depression and concomitant anxiety. Int J Neuropsychopharmacol 2002; 5 (2): 115-20.
81. O\'Hanlon JF, Robbe HWJ, Vesmeeren A et al. Venlafaxine\'s Effects on Healthy Volunteers\' Driving, Psychomotor, and Vigilance Performance During 15-Day Fixed and Incremental Dosing Regimens. J Clin Psychopharm 1998; 18 (3): 212-9.
82. Oliver JJ, Kelly C, Jarvie D et al. Venlafaxine poisoning complicated by a late rise in creatine kinase: two case reports. Hum Experim Toxicol 2002; 21: 463-6.
83. Parsons AT, Anthony RM, Meeker JE. Two fatal case of venlafaxine poisoning. J Analit Toxicol 1996; 20: 266-8.
84. Perry NK. Venlafaxine-induced serotonin syndrome with relapse following amitriptyline. Postgrad Med J 2000; 76: 254-6.
85. Poirier MF, Boyer P. Venlafaxine and paroxetine in treatment-resistant depression. Double-blind, randomised comparison. Brit J Psychiat 1999; 175: 12-6.
86. Preskorn SH. Applied Clinical Psychopharmacology. J Pract Psych Behav Health 1999; 7: 224-8.
87. Rudolph RL, Derivan AT. The safety and tolerability of venlafaxine hydrochloride: analysis of the clinical trials database. J Clin Psychopharm 1996; 16 (3): 54-61.
88. Rudolph RL. Meta-Analysis of the Effects of Venlafaxine on anxiety associated With Depression. MD. J Clin Psychopharmacol 1998; 18: 212-21.
89. Rudolph R, Fabre L, Feighner J et al. A randomised, placebo-controlled, dose-response trial of venlafaxine hydrochloride in the treatment of major depression. Clin Psychiat 1998; 59: 116-22.
90. Rudolph R, Feiger A. A double-blind, randomised, placebo-controlled trial of once-daily venlafaxine extended release (XR) and fluoxetine for the treatment of depression. J Affect Disord 1998; 56: 171-81.
91. Rakesh J. Single-Action Versus Dual-Action Antidepressants Prim Care Companion. J Clin Psychiat 2004; 6 (suppl. 1): 7-11.
92. Salinas E. Once-daily venlafaxine XR versus paroxetine outpatients with major depression, biological. Psychiatry 1997; 42 (suppl. I): 297S.
93. Samuelian JC, Hackett D. A randomised, double-blind, parallel-group comparison of venlafaxine and clomipramine in outpatients with major depression. J Psychopharmacol 1998; 12: 273–8.
94. Sayar K, Aksu G, Ak I, Tosun M. Venlafaxine Treatment of Fibromyalgia. Ann Pharmacother 2003; 37 (11): 1561–5.
95. Schatzberg A, Cantillon M. Antidepressant early response and remission with venlafaxine or fluoxetine in depressed geriatric patients. Internat J Neuropsychopharmacol 2000; 3 (suppl. I), SI9I.
96. Schweizer E, Clary C, Weise C, Rickels K. An open-label, dose-finding study of WY-45,030, a novel bicyclic antidepressant. Psychopharmacol Bull, Jan 1988; 24 (1): 195–7.
97. Schweizer E, Weise C, Clary C et al. Placebo-controlled trial of venlafaxine for the treatment of major depression. J Clin Psychopharmacol 1991; 11 (4): 233–6.
98. Schweizer E, Feighner J, Mandos LA et al. Comparison of venlafaxine and imipramine in the acute treatment of major depression in outpatients. J Clin Psychiat 1994; 55: 104–8.
99. Schweitzer I, Burrows G, Tuckwell V et al. Sustained response to open-label venlafaxine in drug-resistant major depression. J Clin Psychopharmacol 2001; 21 (2): 185–9.
100. Seth R, Jennings AL, Bindman J et al. Combination treatment of noradrenalin and serotonin reuptake inhibitors in resistant depression. Brit J Psychiat 1992; 161: 562–5.
101. Shaikir S. Data. Southampton, UK, Drug Safety Research Unit, 1999.
102. Shrivastava RK, Cohn C, Crowder J et al. Long-term safety and clinical acceptability of venlafaxine and imipramine in outpatients with major depression. J Clin Psychopharmacol 1994; 14: 322–9.
103. Silverstone PH, Ravindran A. Once daily venlafaxine extended release (XR) compared with fluoxetine in outpatients with depression and anxiety Venlafaxine XR 360 Study Group. J Clin Psychiat 1999; 60: 22–8.
104. Silverstrone PH et al. Venlafaxine in Treatment-Resistant Major Depression: A Canadian Multicenter, Open-Label Trial. J Clin Psychopharmacol 1999; 19: 401–6.
105. Silverstone P, Entsuah R, Hackett D. Two items on the Hamilton Depressive Rating Scale are effective predictors of remission: comparison of SSRI with SNRI venlafaxin. Internat Clin Psychopharmacol 2002; 17: 273–80.
106. Smeraldi E, Rizzo F, Crespi G. Double blind, randomised study of venlafaxine, clomipramine and trazodone in geriatric patients with major depression. Primary Care Psychiat 1998; 4: 189–95.
107. Stahl SM. Does depression hurt? J Clin Psychiat 2002; 63 (4): 273–4.
108. Stanley N, Kimber S, Fairweather D et al. Venlafaxine and dothiepin in depressed patients: a comparison of efficacy and effect on cognition and subjective sleep [Abstract PI044]. Ilth European Congress of Neuropsychopharmacology Paris, France.
109. Sellers EM, Ball SE, Cheung SW et al. Inhibition by venlafaxine (VF) and other 5HT reuptake inhibitors of the polymorphic enzyme CYP2D6 [abstract]. 22nd Annual Meeting of the American College of Neuropsychopharmacology, Honolulu 1993 Dec. 13–17; 163.
110. Smith D, Dempser C, Glanville J et al. Efficacy and tolerability of venlafaxine compared with selective serotonin reaptake inhibitors and other antidepressants: a metaanalysis. Br J Psychiat 2002; 180: 396–404.
111. Thase ME. Effects of venlafaxine on blood pressure: a meta–analysis of original data from 3744 depressed patients. J Clin Psychiat 1998; 59: 502–8.
112. Thase ME, Friedman ES, Howland RH. Venlafaxine and treatment-resistant depression. Depress Anxiety 2000; 12 (Suppl. 1): 55–62.
113. Thase ME, Entsuah AR, Rudolph RL. Remission rates during treatment with venlafaxine or selective serotonin reuptake inhibitors. Br J Psychiatr 2001; 178: 234–41.
114. Thase ME, Clayton AH, Haight BR et al. A double-blind comparison between bupropion XL and venlafaxine XR: sexual functioning, antidepressant efficacy, and tolerability. J Clin Psychopharmacol 2006; 26 (5): 482–8.
115. Tran P, Bymaster FP, McNamara RK et al. Dual monoamine modulation for improved treatment of major depressive disorder. J Clin Psychopharmacol 2003; 23: 78–86.
116. Troy SM, Turner MB. Pharmacokinetic and Pharmacodinamic Evaluation of the potential Drug interaction between Venlafaxine and Ethanol.
117. Tylee A, Beaumont G, Bowden MW et al. A double-blind, randomised, 12-week comparison study of the safety and efficacy of venlafaxine and fluoxetine in moderate to severe depression in general practice. Primary Care Psychiat 1997; 3: 51–8.
118. Tzanakaki M, Guazzelli M, Nimatoudis I et al. Increased remission rates with venlafaxine compared with fluoxetine in hospitalised patients with major depression and melancholia. Internat Clin Psychopharmacol 2000; 15: 29–34.
119. van Praag HM. Monoamines and abnormal behavior. A multiaminergic perspective. Brit J Psychiat 1990; 157 (11): 723–34.
120. White CM, Gailey RA, Levin GM, Smith T. Seizure resulting from a venlafaxine overdose. Ann Pharmacother 1997; 31: 178–80.
121. Wittchen H-U, Jacobi F. Size and burden of mental disorders in Europe-a critical review and appraisal of 27 studies. Eur Neuropsychopharmacol 2005; 15 (4): 357–76.
122. Zanardi R, Franchini L, Serretti A et al. Venlafaxine versus fluvoxamine in the treatment of delusional depression: a pilot double-blind controlled study. J Clin Psychiat 2000; 61: 26–9.
123. Zimmer B, Kant R, Zeiller D et al. Antidepressant efficacy and cardiovascular safety of venlafaxine in young vs. old patients with comorbid medical disorders. Int J Psychiat Med 1997; 27 (4): 353–64.
124. Андрусенко М.П. Антидепрессанты: соотношение особенностей нейрохимического действия и клинических эффектов при лечении депрессий. Псих. и психофарм. 2005; 5: 273–9.
125. Волель Б.А., Романов Д.В. Опыт применения венлафаксина (велафакса) у пациентов с депрессией в амбулаторной и клинической практике.
126. Козырев В.Н., Зеленина Е.В., Лебедева О.И. Эффективность и переносимость препарата Эфевелона (Венлафаксин) при терапии депрессивных расстройств. Псих. и психофарм. 2007; 9 (2).
127. Медведев В.Э., Добровольский А.В. Лечение депрессий у больных сердечно-сосудистыми заболеваниями (опыт применения велаксина). Псих. растр. общ. мед. 2007; 4 (в печати).
128. Мосолов С.Н. Клиническое применение современных антидепрессантов. СПБ., 1995.
129. Мосолов С.Н. Современный этап развития психофармакотерапии. В кн.: Новые достижения в терапии психических заболеваний. М., 2002; 21-37.
130. Раевский К.С. Антидепрессанты: нейрохимические аспекты механизма действия. Псих. и психофарм. 2001; 5: 162-6.
131. Смулевич А.Б. Депрессии в общей медицине. М., 2001.
132. Upadhyaya HP, Brady KT, Sethuraman G et al. Venlafaxine treatment of patients with comorbid alcohol/cocaine abuse and attention-deficit/hyperactivity disorder: a pilot study. J Clin Psychopharmacol 2001; 21 (1): 116–8.
133. Bobes J, Gonzalez MP, Saiz PA, Bousono M. Venlafaxine in the treatment of depression in alcoholic patients. Comunicacion Poster presentada en el 21 Congress of the CINP (Abstract PW 16008). Glasgow, 1997.
134. Garcia-Portilla MP, Bascaran MT, Saiz PA et al. Effectiveness of venlafaxine in the treatment of alcohol dependence with comorbid depression. Actas Esp Psiquiat 2005; 33 (1): 41–5.
135. Tierney JG. II. Treatment-Resistant Depression: Managed Care Considerations. J Manag Care Pharm 2007; 13 (6) (suppl. S-a): S2–S7.
136. Gartlehner G, Hansen RA, Thieda P et al. Comparative Effectiveness of Second-Generation Antidepressants in the Pharmacologic Treatment of Adult Depression. Comparative Effectiveness Review No. 7. Rockville, MD: Agency for Healthcare Research and Quality. 2007.
137. Gorman J, Laszlo A. Efficacy of Fenlafaxine in mixed Depression-Anxiety States. Depression and Anxiety, 2000; 12 (1): 77-80.
138. Judge R, Wagner B. Once-daily venlafaxine XR compared with fluoxetine in outpatientwith depression and anxiety. J Clin Psychiatry 1999; 60: 795-6.
139. Rudolph RL, Entsuah R, Chitra R. A meta-analysis of the effects of venlafaxine on anxiety associated with depression. J Clin Psychopharmacol. Apr;18(2):136-44. 1998.
140. Silverstone PH, Ravindran A. Once-daily venlafaxine extended release (XR) compared with fluoxetine in outpatients with depression and anxiety. Venlafaxine XR 360 Study Group. J Clin Psychiat 1999; 60: 22–8.
30 ноября 2009
Количество просмотров: 3832


