Психиатрия Психические расстройства в общей медицине
№03 2008
К проблеме увеличения массы тела у больных шизофренией и шизоаффективным расстройством при купирующей антипсихотической терапии №03 2008
Введение
Метаболические побочные эффекты нейролептической терапии (метаболический синдром – МС) включают три основных относительно независимых симптомокомплекса, к которым относятся: увеличение массы тела, нередко сопровождающееся нарушениями пищевого поведения; нарушения толерантности к глюкозе (гипергликемия, сахарный диабет типа 2) и дислипидемия.
Сходство проявлений МС при различных заболеваниях (соматические, эндокринологические и психические) является предметом активного обсуждения в современных научных исследованиях [1, 2]. В работах последних лет все чаще указывается на наличие причинно-следственных взаимосвязей применения атипичных антипсихотиков и МС. По мнению R.Tandon и соавт. (2003 г.), а также ряда других исследователей, значительное увеличение массы тела является наиболее распространенным побочным эффектом антипсихотиков новой генерации, а профиль увеличения массы тела, характерный для каждого из атипичных антипсихотиков, является общепризнанным фактором, требующим учета при назначении и проведении антипсихотической терапии [1, 2–9, 31].
Изменения массы тела у больных шизофренией были хорошо известны еще до внедрения в клиническую практику традиционных нейролептиков [10–18]. Однако с появлением этих препаратов прибавка массы тела, которой сопровождается антипсихотическая терапия, приобрела статус серьезной проблемы [9, 19–22]. В соответствии с данными, опубликованными в США в Приложении к Национальному отчету по вопросам состояния здоровья населения (National Health Interview Survey–NHIS) в 1989 г., показатели индекса массы тела (ИМТ) у больных шизофренией сопоставимы или превосходят значения аналогичных показателей, рассчитанных для населения [23].
Доля лиц с избыточной массой тела среди больных шизофренией, находящихся на терапии типичными антипсихотиками, варьирует от 6,7 до 62%, причем наиболее высокий процент установлен у женщин [4, 5, 24, 25]. Отмечается, что терапия хлорпромазином приводит к увеличению массы тела в 15,9% случаев, клопентиксолом – в 6,7%, перфеназином – в 8% в течение первых 5 лет их применения, тогда как D.Johnson [26] описывал прибавку массы тела на фоне терапии пролонгированными формами антипсихотиков (флюпентиксола деканоат, флуфеназина деканоат) в 55% случаев.
Данные исследований, проведенных в течение последнего десятилетия, показали, что увеличение массы тела более чем на 20% у больных шизофренией на фоне приема атипичных антипсихотиков наблюдается в 40–94% случаев [1, 2, 7–9, 27].
Проблема комплексного изучения и оценки влияния нейролептической терапии на изменения массы тела у больных шизофренией и шизоаффективным расстройством остается крайне актуальной. Это обусловлено не только повышением частоты среди таких больных лиц с избыточной массой тела, но и преимущественно абдоминального (андроидный) типа жировых отложений у указанной категории пациентов, что довольно часто приводит к различным соматическим осложнениям [1, 24].
Вместе с тем многие аспекты этой проблемы, а именно роль в развитии нейролептического ожирения нарушений пищевого поведения, гендерного и других факторов, требуют своего разрешения.
В настоящей публикации приведены результаты сравнительного исследования влияния купирующей антипсихотической терапии рисперидоном, оланзапином, клозапином, кветиапином, амисульпридом и галоперидолом на изменения массы тела и нарушения пищевого поведения у больных шизофренией и шизоаффективным расстройством.
Материал и методы
Материалом исследования послужили данные обследования 291 больного. Пациенты проходили стационарное лечение в клиниках Московского НИИ психиатрии Росздрава и отделениях ГПБ № 4 им. П.Б.Ганнушкина в 2000–2006 гг., из них 102 (35%) мужчины и 189 (65%) женщин в возрасте от 18 до 55 лет. Средний возраст составил 33,64±0,49 года, из них: до 30 лет – 111 (38%), 30–39 лет – 93 (32%), 40–49 лет – 64 (22%) и старше 50 лет – 23 (8%). В соответствии с критериями МКБ-10 у 254 (87%) пациентов была диагностирована параноидная шизофрения (F20.0) и 37 (13%) пациентов – шизоаффективное расстройство (F31.0). Средняя длительность заболевания составила 6,5±1,2 года и варьировала от 1 года до 16 лет: 157 (54%) пациентов с длительностью заболевания до 5 лет и 134 (46%) больных – более 5 лет.
В процессе исследования были сформированы 6 групп больных (группирующий признак – препарат): I группу составили больные, находящиеся на терапии рисперидоном (83 человека), II – оланзапином (56 человек), III – клозапином (37 человек), IV – кветиапином (37 человек), V – амисульпридом (23 человека), VI – галоперидолом (55 человек – группа сравнения).
При отборе больных мы руководствовались следующими критериями: возраст от 18 до 55 лет; отсутствие органических заболеваний ЦНС; отсутствие эндокринных заболеваний; отсутствие тяжелых форм соматических и гинекологических заболеваний; отсутствие беременности и лактации; монотерапия нейролептическим препаратом; “отмывочный” период 7–10 дней перед назначением одного из исследуемых препаратов в тех случаях, когда больные до начала исследования получали антипсихотическую терапию; наличие информированного согласия больного для участия в исследовании.
Исследование проведено с использованием клинико-психопатологического, клинико-эндокринологического, антропометрического и клинико-статистического методов.
Оценку состояния пациентов проводили с использованием клинико-психопатологического метода. С целью оценки нейроэндокринного статуса использовали карту обследования больного психоэндокринологического профиля, разработанную в отделении психиатрической эндокринологии МНИИП Росздрава.
С целью изучения влияния терапии на изменение массы тела у больных мы использовали 4 основных антропометрических параметра: масса тела (кг), прирост массы тела (кг), ИМТ (кг/м2) и соотношение окружности талии и бедер (СТБ). Применение указанного подхода позволяет оценить фармакогенную прибавку массы тела, определить наличие или отсутствие избыточной массы тела (по ранжированной шкале ИМТ), а также характер жировых отложений и тип ожирения (по СТБ).
Параллельно с изучением перечисленных показателей были исследованы изменения пищевого поведения. Изучение данных показателей проводили на определенных этапах терапевтического процесса: фон (до назначения препарата), 3–4-я и 6–8-я недели купирующей антипсихотической терапии.
Статистическую обработку результатов осуществляли с использованием компьютерной программы Statistica-6 (для Windows, StatSoft, Inc., USA).
Сравнительные данные о влиянии изучаемых препаратов на отдельные параметры, характеризующие метаболические нарушения у больных шизофренией и шизоаффективным расстройством, представлены на рис. 1–4 и в табл. 1–3.

На рис. 1 можно видеть, что к 3–4-й неделе терапии оланзапином и клозапином повышение массы тела наблюдали у подавляющего большинства больных (78 и 92% соответственно); при терапии рисперидоном, кветиапином и галоперидолом прибавка массы тела отмечена примерно у половины больных и лишь у 9% пациентов – при терапии амисульпридом. Достоверные (p<0,01) различия отмечены между II и III группами по сравнению с I, IV, V и VI. К 6–8-й неделе при терапии рисперидоном и клозапином доля пациентов с прибавкой массы тела достоверно снижалась (p=0,04 и p=0,031 соответственно). В IV и V группах больные с увеличением массы тела отсутствовали, причем в группе амисульприда у 2 больных отмечено ее снижение. На фоне лечения оланзапином и галоперидолом доли пациентов с прибавкой массы тела оставались на том же уровне, что и в середине терапевтического курса (3–4 нед терапии).
На рис. 2 изображена сравнительная динамика прироста массы тела больных в процессе терапии исследуемыми препаратами.
Как видно из данных, наибольшую интенсивность увеличения массы тела у больных наблюдали в течение 1-го месяца лечения.
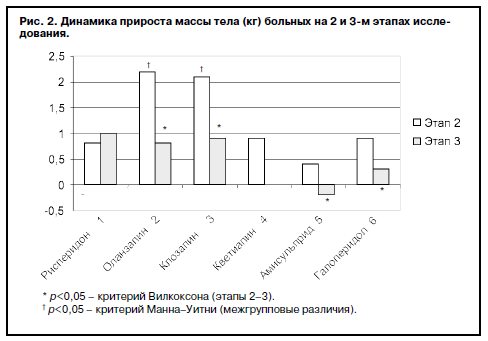
Наибольшая прибавка массы тела отмечена у больных, находящихся на терапии оланзапином и клозапином. Статистически значимые различия на 3–4-й неделе обнаружены между I и II группами (p=0,017), I и III группами (p=0,02), IV и II группами (p=0,047), IV и III группами (p=0,38), V и II группами (p=0,0015), V и III группами (p=0,002), VI и II группами (p=0,04); VI и III группами (p=0,039).
К 6–8-й неделе при терапии рисперидоном, оланзапином и клозапином прирост массы тела происходил с одинаковой интенсивностью (0,8±0,1 кг), при этом если у больных в I группе интенсивность прибавления практически не менялась, то во II и III группах прирост массы тела был достоверно ниже по сравнению с 1-м месяцем терапии (p=0,034; p=0,041 соответственно). Динамика прироста при терапии галоперидолом была сходна с таковой при терапии оланзапином и клозапином – к 6–8-й неделе терапии он достоверно (p=0,019) снижался. При терапии кветиапином прирост массы тела больных к 6–8-й неделе терапии отсутствовал, а при терапии амисульпридом отмечены отрицательные величины этого показателя, т.е. масса тела уменьшилась.
Таким образом, анализ влияния терапии как атипичными антипсихотиками, так и галоперидолом на изменения массы тела у больных шизофренией и шизоаффективным расстройством позволил выявить признаки как сходства, так и различия.
Так, основные изменения массы тела у больных происходили в течение 1-го месяца купирующей антипсихотической терапии всеми препаратами, однако наблюдались с различной частотой и интенсивностью.
Достоверно чаще и с большей интенсивностью прибавку массы тела в течение 3–4 нед наблюдали у больных при терапии оланзапином и клозапином по сравнению с другими изучаемыми препаратами, тем не менее купирующая терапия лишь в единичных случаях приводила к фармакогенной (≥5%) прибавке, что согласуется с данными литературы [8, 28–30].
Прибавка массы тела при терапии рисперидоном, кветиапином и галоперидолом в 1-й месяц терапии не превышала 0,9 кг и наблюдалась у больных этих групп с равной частотой (в пределах 50% случаев). При терапии амисульпридом прибавка была наименьшей (0,4 кг) и встречалась лишь у 9% больных.
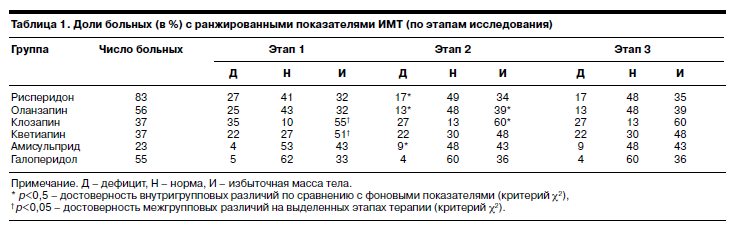
Для сравнительной оценки динамики массы тела (наличия или отсутствия ожирения) у больных мы использовали ранжированные показатели ИМТ (см. табл. 1).
Как видно, до включения в исследование в III и IV группах (клозапин и кветиапин) преобладали больные с избыточной массой тела. В процессе терапии рисперидоном на 3–4-й неделе происходило достоверное (p<0,01) снижение доли пациентов с дефицитом массы тела, что свидетельствует о том, что ее увеличение происходило у лиц с изначально недостаточной массой тела.
В группах оланзапина и клозапина прибавка массы тела у больных происходила независимо от различия фоновых показателей, т.е. как у больных с дефицитом, так и у больных с нормальной и избыточной массой тела. При этом достоверно (p<0,01) увеличивалось число пациентов с избыточной массой тела. При терапии кветиапином и галоперидолом прибавка массы тела была менее выраженной по сравнению со II и III группами, что не приводило к изменению долей пациентов с ранжированными показателями ИМТ: они были практически одинаковыми как до включения в исследование, так и в процессе 6–8-недельной терапии.
При терапии амисульпридом (V группа) обращает на себя внимание тот факт, что к 6–8-й неделе терапии достоверно (p<0,01) увеличивалась доля пациентов с дефицитом массы тела, что объясняется отрицательными показателями прироста массы тела после 1 мес терапии указанным препаратом.
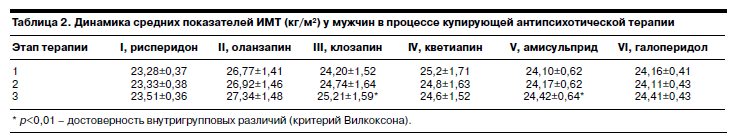
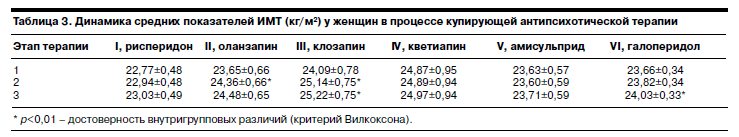
С целью сравнительной оценки массы тела у мужчин и женщин, а также проверки гипотезы об участии гендерного фактора в развитии нейролептического ожирения, был проведен анализ динамики средних показателей ИМТ внутри групп с учетом половой принадлежности пациентов (см. табл. 2, 3).
Проведенный анализ динамики изменения средних значений ИМТ в каждой группе отдельно у мужчин и женщин позволил выявить определенные зависимости, которые заключаются в следующем.
Фоновые показатели ИМТ у мужчин во всех группах, исключая II и IV, соответствовали нормативному диапазону, тогда как в указанных группах (оланзапин и кветиапин) ИМТ соответствовал 1-й степени избыточной массы тела (25,2 и 26,7 кг/м2 соответственно). Сходство динамики показателей ИМТ обнаружено при терапии рисперидоном, оланзапином и галоперидолом: средние показатели ИМТ в этих группах не изменялись на всем протяжении исследования, причем в I и в V группах они соответствовали нормальной массе тела, а в группе оланзапина – 1-й степени избыточной массы тела. При терапии клозапином и амисульпридом ИМТ достоверно (p<0,01) повышался к 6–8-й неделе терапии, а у больных на терапии кветиапином имел тенденцию к снижению. При этом ИМТ у пациентов IV и V групп (кветиапин и амисульприд) оставался в нормативном диапазоне, тогда как в группе клозапина соответствовал 1-й степени избыточной массы тела.
В отличие от мужчин средние фоновые показатели ИМТ у женщин во всех группах соответствовали норме, в то же время динамика показателей имела как сходство, так и различия. При терапии рисперидоном, кветиапином и амисульпридом ИМТ оставался стабильным в отличие от терапии оланзапином, клозапином и галоперидолом, при которой наблюдали повышение показателей ИМТ: во II группе – к 3–4-й неделе; в VI группе – к 6–8-й неделе; в III группе – на каждом этапе исследования.
При этом ИМТ у больных при терапии оланзапином и галоперидолом соответствовал норме, а при терапии клозапином уже к 3–4-й неделе соответствовал 1-й степени избыточной массы тела.
При анализе характера распределения жировых отложений с использованием показателя СТБ установлено, что при терапии рисперидоном, кветиапином, амисульпридом и галоперидолом оно соответствовало гиноидному (глютеофеморальному), а при терапии оланзапином и клозапином – андроидному (абдоминальному) типам.
Важную роль в повышении массы тела больных, связанном с психофармакотерапией, по мнению большинства авторов, играет увеличение поступления энергии в организм, т.е. повышение аппетита [1, 5, 24].
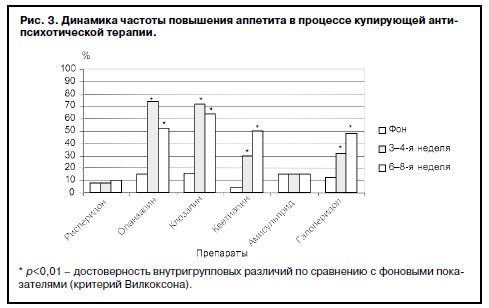
Данные о влиянии антипсихотиков на изменение пищевого поведения приведены на рис. 3, 4. Как видно из представленных данных, фоновая частота пациентов с повышенным аппетитом в группе кветиапина была достоверно (p<0,01) ниже по сравнению с остальными группами. Терапия рисперидоном и амисульпридом практически не оказывала влияния на аппетит больных: доли пациентов как в начале, так и в конце терапии не превышали 10–15%, причем у этих пациентов отмечено легкое (не превышающее 0,5 балла) повышение аппетита. Динамика частоты, а также выраженности указанной симптоматики на фоне терапии оланзапином и клозапином имела сходные тенденции: к 3–4-й неделе терапии происходило достоверное (p<0,01) увеличение долей пациентов с повышенным аппетитом, причем выраженность повышения аппетита была максимальной (2–3 балла), достоверно (p≤0,01) выше по сравнению с другими группами и имела положительные корреляционные связи с прибавкой массы тела именно в 1-й месяц терапии. К 6–8-й неделе доля больных с повышенным аппетитом незначительно снижалась, однако степень выраженности этого симптома оставалась прежней.
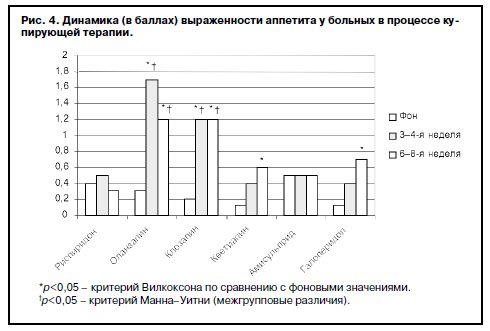
Доли больных с повышением аппетита при терапии кветиапином и галоперидолом постепенно возрастали от этапа к этапу (30–50%), однако у больных этих групп показатели выраженности этого признака не превышали 1 балла, что соответствует легкой и в ряде случаев умеренной степени повышения аппетита. Тем не менее обнаружены положительные корреляционные связи между повышением аппетита и увеличением массы тела на 3–4-й неделе терапии кветиапином (r=0,63; p=0,0008), 3–4-й и 6–8-й неделях терапии галоперидолом (r=0,57; p=0,002; r=0,78; p=0,00003 соответственно).
Заключение
Таким образом, в результате проведенного исследования уточнены особенности влияния купирующей терапии каждым из атипичных антипсихотиков (рисперидон, оланзапин, клозапин, кветиапин, амисульприд) в сравнении с типичным нейролептиком галоперидолом на массу тела и пищевое поведение больных шизофренией и шизоаффективным расстройством. Показана определенная роль пола как фактора повышения аппетита у женщин и недостаточной массы тела больных до лечения при развитии нейролептического ожирения.
Список исп. литературыСкрыть список1. Горобец Л.Н. Нейроэндокринные дисфункции и нейролептическая терапия. М.: ИД “Медпрактика-М”, 2007.
2. Wirshing DA, Wirshing WC, Kysar L et al. Novel antipsychotics: comparison of weight gain liabilities. J Clin Psychiat 1999; 60: 358–63.
3. Ванина Е., Подольская А., Седки К. и др. Изменения веса тела, связанные с психофармакотерапией. Метаболические побочные эффекты и осложнения психофармакотерапии (Прил. к журн. “Соц. и клин. психиат.”). М., 2003; 2–8.
4. Горобец Л.Н., Ермолаева Л.Г., Жмурина М.В. Проблемы увеличения веса и развития сахарного диабета при нейролептической терапии шизофрении. В сб.: “Метаболические побочные эффекты и осложнения при писхофармакотерапии” под ред. И.Я.Гуровича и А.Б.Шмуклера. (Прил. к журн. “Соц. и клин. психиатрия”). 2003; 22–28.
5. Мосолов С.Н., Кабанов С.О. Метаболические нарушения при антипсихотической терапии. Соц. и клин. психиат. 2003; 13 (Вып. 2): 162–72.
6. Allison DB, Mentor JM, Heo M et al. Antipsychotic-induced weight gain: a comprehensive research synthesis. Am J Psychiat 1999; 156 (11): 1686–96.
7. Bernstein JG. Induction of obesity by psychotropic drugs. Ann NY Acad Sci 1987; 499: 203–15.
8. Green JK, Goisman RM et al. Weight Gain From Novel Antypsychotic Drugs: Need For Action. General Hospital Psychiatry 2000; 22: 224–35.
9. Masand PS, Blackburn CL, Ganguli R et al. Weight gain associated with the use of antipsychotic medications. J Clin Psychiat 1999; Audiograph Series: 2.
10. Белкин А.И. Патология диэнцефально-гипофизарной области и эндокринный психосиндром. Глубокие структуры головного мозга и проблемы психиатрии. М., 1966; 49–53.
11. Жислин С.Г. К вопросу о роли эндокринного фактора в клинике шизофрении и психозов позднего возраста. Пробл. психиат. 1962; 2: 3–19.
12. Краснушкин Е.К. Ближайшие перспективы исследования душевнобольных в связи с учением о железах внутренней секреции. Клин. мед. 1920; 1: 34–8.
13. Орловская Д.Д. Клинические особенности эндокринных нарушений, развивающихся в течение шизофрении. Журн. невропатол. и психиат. им. Корсакова. 1968; 68 (5): 735–42.
14. Попов Е.А. Современное состояние вопроса о роли внутренней секреции при психических расстройствах. Уч. зап. Укр. ин-та эксперимент. эндокринол. 1949; 14: 21–30.
15. Протопопов В.П. Обмен веществ при маниакально-депрессивном психозе, терапия и профилактика этого психоза. Сб. трудов ин-та физиол. АН УССР. Высшая нервная деятельность и кортико-висцеральные взаимоотношения. Киев, 1955.
16. Руденко Г.М. Клинические особенности шизофрении с присоединившимися эндокринными расстройствами (ожирение, гирсутизм). Дис. … канд. мед наук М., 1969.
17. Туркевич О.М., Гершанович З.С. О некоторых гормональных нарушениях при шизофрении. Сов. психоневрол. 1936; 6: 80–91.
18. Post F. Body-weight changes in psychiatric illness: a critical survey of the literature. J Psychosom 1956; 1: 219–26.
19. Авруцкий Г.Я., Гурович И.Я., Громова В.В. Фармакотерапия психических заболеваний. М.: Медицина, 1974.
20. Гурович И.Я. Побочные эффекты и осложнения при нейролептической терапии больных шизофренией. Дис. ... д-ра мед. наук. М., 1971.
21. Таллер М.Б. Психофармакотерапия и морфоконституциональная предиспозиция в генезе эндокринных расстройств больных шизофренией. Дис. … канд. мед. наук. М., 1986.
22. Silverstone T, Smith G, Coodall E. Prevalence of obesity in patients receiving depot antipsychotics. Br J Psychol 1988; 153: 214–7.
23. U.S. Department of Health and Human Services: 1989 National Health Interview Survey. CD-ROM Series, 1993: 10 (3).
24. Крылов В.И. Метаболические эффекты атипичных нейролептиков. Рос. психиат. журн. 2004; 3: 47–51.
25. Stanton JM. Weight gain associated with neuroleptic medication: a review. Schizoph Bull 1995; 21: 463–72.
26. Jonson G. Endocrine disfunction in depression. Handbook of psychiatry and endocrinology. Amsterdam 1982; 237–66.
27. Beasley CM, Tollefson GD, Tran PV. Safety of olanzapine. J Clin Psychiat 1997; 58 (suppl. 10): 13–7.
28. Калинин В.В. Применение препарата зипрекса (оланзапин) для лечения шизофрении. Соц. и клин. психиат. 1998; 1: 126–35.
29. Bai YM, Lin CC, Chen JY et al. Weight gain among patients on clozapine. Psychiatr Serv 1999; 50: 704–5.
30. Bustillo JR, Buchanan RW, Irish D, Breier A. Differential effect of clozapine on weight: a controlled study. Am J Psychiat 1996; 153: 817–9.


